Comparison in the Structure and Physicochemical Properties of Soybean Dregs Insoluble Dietary Fiber from Different Sources
-
摘要: 本研究旨在以传统豆制品加工产生的豆渣为原料制备不溶性膳食纤维(TBP-IDF),并对比其与以分离蛋白加工副产物豆渣为原料制备的不溶性膳食纤维(SPI-IDF)在结构和理化性质方面的差异。采用单因素实验和响应面试验对传统豆制品豆渣的脱脂工艺参数进行优化;通过复合酶法制备TBP-IDF,并对其基础成分和组分进行测定;利用离子色谱仪、扫描电子显微镜、X-射线衍射仪及傅里叶变换红外光谱仪对TBP-IDF和SPI-IDF的结构差异进行对比;通过测定吸水性、膨胀性、持油性及葡萄糖和胆固醇吸附能力,对TBP-IDF和SPI-IDF的理化性质差异进行分析。结果表明,传统豆制品豆渣最佳脱脂工艺参数如下:液料比为22:1、处理温度59 ℃、处理时间70 min,在此条件下,豆渣的脱脂率达90.13%;TBP-IDF含量可达83.23%,其中纤维素含量为29.3%,半纤维素含量为53.5%,木质素含量为17.2%;与SPI-IDF相比,TBP-IDF单糖组成存在显著差异,葡萄糖含量显著增加(P<0.05),但高级结构类似;TBP-IDF的持水性(9.53 g/g)和膨胀性(5.20 mL/g)显著高于SPI-IDF(7.73 g/g,4.30 mL/g)(P<0.05),持油性(6.22 g/g)显著低于SPI-IDF(7.95 g/g)(P<0.05);二者对葡萄糖和胆固醇的吸附能力均随底物浓度的增加而升高,且无显著差异(P>0.05)。本研究证明了TBP-IDF与SPI-IDF具有类似的潜在生理活性,有可能被用作辅助糖脂代谢类功能性食品原料,同时扩大了大豆不溶性膳食纤维的制备来源和途径。Abstract: This study aimed to prepare soybean dregs insoluble dietary fiber generated from the processing of traditional soybean products (TBP-IDF) and to compare the differences in structure and physicochemical properties between it and insoluble dietary fiber prepared from soybean protein isolate processing by-products (SPI-IDF). The optimal degreasing process of soybean dregs was optimized by single-factor experiments and response surface methodology. TBP-IDF was prepared by a complex enzymatic method and its basic components and fractions were determined. The structural differences between TBP-IDF and SPI-IDF were compared using ion chromatography, scanning electron microscopy, X-ray diffraction, and Fourier transform infrared spectroscopy. Differences in the physicochemical properties of TBP-IDF and SPI-IDF were analyzed by determining water-holding capacity, swelling capacity, oil-holding capacity, glucose-absorption capacity, and cholesterol-adsorption capacity. The results showed that the optimal defatting process parameters for traditional soybean dregs were as follows: liquid-to-feed ratio of 22:1, treatment temperature of 59 ℃, and treatment time of 70 min, under which the defatting rate of soybean dregs reached 90.13%. The content of TBP-IDF was up to 83.23%, with 29.3% cellulose, 53.5% hemicellulose, and 17.2% lignin. Compared with SPI-IDF, there were significant differences in the composition of the monosaccharides of TBP-IDF, with significantly increased glucose content (P<0.05), but the advanced structure was similar. The water-holding capacity (9.53 g/g) and swelling capacity (5.20 mL/g) of TBP-IDF were significantly higher than SPI-IDF (7.73 g/g, 4.30 mL/g) (P<0.05), while the oil-holding capacity (6.22 g/g) was significantly lower than SPI-IDF (7.95 g/g) (P<0.05). The adsorption capacity of both for glucose and cholesterol increased with the increase of substrate concentration, and there was no significant difference (P>0.05). This study demonstrated that TBP-IDF had similar potential physiological activities with SPI-IDF, which could potentially be used as a functional food ingredient for assisting glycolipid metabolism, and expanded the sources and ways of preparing soybean insoluble dietary fiber.
-
随着时代的进步与发展,人们的生活水平逐步提高,饮食结构也随之改变。低膳食纤维(Dietary fiber,DF)饮食易造成营养失衡,导致机体患肥胖症、心血管疾病、糖尿病等代谢疾病的风险升高[1]。人们越来越意识到均衡饮食对预防疾病的重要性。世界卫生组织,粮食及农业组织(WHO/FAO)和欧洲食品安全局(EFSA)推荐膳食纤维摄入量为25 g/d。然而,大多数国家的DF摄入量远低于推荐量[2]。因此,开发富含DF的功能性食品成为食品行业中的热点。
豆渣是豆腐、豆浆等传统豆制品加工及大豆分离蛋白工业化生产过程中产生的主要副产物,年产量达2000万吨[3]。豆渣的高水分含量导致其易腐败变质、难以储存运输、利用率较低,造成了严重的资源浪费和环境污染问题。豆渣中含有丰富营养物质,如DF、蛋白质及异黄酮和大豆苷元等其他生物活性物质[4−7]。尤其是被誉为“第七营养素”的DF,可占豆渣干物质的50%~60%,其中不溶性膳食纤维(Insoluble dietary fiber,IDF)占DF总量的90%以上[8]。豆渣来源丰富且价格低廉,可作为IDF的良好来源。因此,提高豆渣中IDF的综合利用率是实现豆渣资源高值化利用的关键途径。
课题组前期从大豆分离蛋白工业化生产的副产物豆渣中利用复合酶法制备不溶性膳食纤维(SPI-IDF),并对SPI-IDF进行了系统研究,包括结构表征、理化性质分析和功能特性探究[9]。与大豆分离蛋白工业化生产不同的是,传统豆制品加工过程中并未对原料大豆进行脱皮、脱脂处理,且加工工艺与分离蛋白生产存在较大差异。故本研究基于前期基础,优化传统豆制品豆渣的脱脂工艺参数,并利用复合酶法制备不溶性膳食纤维(TBP-IDF),对比其与SPI-IDF在结构特性和理化特性等方面的差异,旨在证明TBP-IDF与SPI-IDF具有类似的潜在功能性,同样可以作为辅助糖脂代谢类功能性食品的原料,扩大大豆不溶性膳食纤维获取来源和途径的同时,提高传统豆制品加工副产物的综合利用率和附加值。
1. 材料与方法
1.1 材料与仪器
传统豆制品豆渣制备方法参考传统豆浆工艺制备后获得,简述如下:提前一晚将大豆浸泡在5倍质量的纯净水中,次日取出加入5倍质量水磨浆,120目纱布滤出豆浆,即得传统豆制品豆渣,65~80 ℃烘干后备用;大豆分离蛋白豆渣膳食纤维(SPI-IDF)按照课题组方法[10]进行制备;正己烷、冰醋酸、氢氧化钠 均为分析纯,北京化工厂有限责任公司;中性蛋白酶(60000 U/g)、高峰α-淀粉酶(40000 U/g)、淀粉葡萄糖苷酶(100000 U/g)、木糖标准品、半乳糖标准品、鼠李糖标准品、岩藻糖标准品、葡萄糖标准品、甘露糖标准品、阿拉伯糖标准品、半乳糖醛酸标准品、葡萄糖醛酸标准品、胆固醇标准品、胆酸钠标准品 北京索莱宝科技有限公司。
GDE酶标仪 意大利VELP公司;ME54E/204E分析天平、DELTA 320数显pH计 梅特勒-托利多仪器(上海)有限公司;Sigma 3K15高速冷冻离心机 美国Sigma公司;SHB-III循环水式多用真空泵 郑州长城科工贸有限公司;DHG-9036A立式电热恒温鼓风干燥箱 精宏实验室设备(上海)有限公司;KDN-08B凯氏定氮仪 华睿仪器有限公司;SU8020扫描电子显微镜 日本Hitachi公司;Smart Lab X-射线衍射仪 日本Rigaku公司;IRTracer-100傅里叶变换红外光谱仪 日本Shimadzu公司;ICS 5000离子色谱仪 美国Thermo Fisher公司。
1.2 实验方法
1.2.1 传统豆制品豆渣脱脂工艺单因素实验
1.2.1.1 液料比对豆渣脱脂率的影响
精确称取10.00 g豆渣5份,分别以液料比10:1、15:1、20:1、25:1、30:1加入正己烷,脱脂温度设置为50 ℃,在90 r/min条件下振荡70 min后取出,抽滤,干燥后,测定不同液料比对豆渣脱脂率的影响。
1.2.1.2 脱脂温度对豆渣脱脂率的影响
精确称取10.00 g豆渣5份,均以液料比20:1加入正己烷,脱脂温度分别设置为30、40、50、60、70℃,在90 r/min条件下振荡70 min后取出,抽滤,干燥后,测定不同脱脂温度对豆渣脱脂率的影响。
1.2.1.3 脱脂时间对豆渣脱脂率的影响
精确称取10.00 g豆渣5份,均以液料比20:1加入正己烷,脱脂时间分别设置为50、60、70、80、90 min,脱脂温度设置为50 ℃,在90 r/min条件下振荡后取出,抽滤,干燥后,测定不同脱脂时间对豆渣脱脂率的影响。
1.2.2 响应面试验设计
根据单因素实验结果,确定影响豆渣脱脂率的3个因素的最佳取值范围,利用Design-Expert.V13软件,设计响应面试验,以豆渣脱脂率为响应值,以液料比、脱脂温度、脱脂时间三项因素为考察因子(表1),探究各变量对脱脂率影响的显著性以及最佳脱脂条件。
表 1 响应面试验因素和水平Table 1. Factor and level of response surface test水平 A液料比 B脱脂温度(℃) C脱脂时间(min) −1 15:1 50 60 0 20:1 60 70 1 25:1 70 80 1.2.3 传统豆渣不溶性膳食纤维的制备
根据课题组方法进行制备[10]。取5 g豆渣置于1000 mL锥形瓶中,向瓶中加入250 mL蒸馏水搅拌均匀,再加入500 μL热稳定α-淀粉酶液(500 U/g),缓慢搅拌,瓶口盖上铝箔,置于95~100 ℃恒温振荡水浴箱中持续振摇,当水浴温度达到95 ℃开始计时,反应时间为35 min。然后将锥形瓶取出,冷却至60 ℃,打开铝箔盖,用刮勺轻轻将附着于锥形瓶内壁的胶状物刮下,用少量水进行冲洗瓶壁。将α-淀粉酶酶解后的样品液置于60 ℃水浴中,向锥形瓶中加入1.5 mL蛋白酶溶解液(300 U/g),瓶口盖上铝箔,开始计时,持续振摇30 min。反应完成后打开铝箔盖,一边搅拌一边加入50 mL、3 mol/mL乙酸溶液,控制瓶内样品的温度保持在60 ℃,用6 mol/L NaOH或6 mol/L HCl溶液调节试样液pH至4.50±0.02。边搅拌边加入2 mL淀粉葡糖苷酶酶解液(200 U/g),盖上铝箔,继续于60 ℃水浴中持续振摇,反应30 min。酶解完成后,加入预热好的70 ℃的蒸馏水,静置1.5~2.0 h,待溶液澄清,3500 r/min离心10 min。然后进行醇沉,抽滤,挥发乙醇,干燥备用,获得传统豆渣不溶性膳食纤维(TBP-IDF)。
1.2.4 基础成分测定
样品中蛋白质含量按照GB 5009.5-2016 《食品安全国家标准 食品中蛋白质的测定》中的方法测定;脂肪含量按照GB 5009.6-2016《食品安全国家标准 食品中脂肪的测定》中的方法测定;灰分含量按照GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》中的方法测定;水分含量按照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》中的方法测定;膳食纤维含量按照GB 5009.88-2023《食品安全国家标准 食品中膳食纤维的测定》中的方法测定。
1.2.5 组分测定
按照Teramoto等[11]的方法稍做修改,对纤维素、半纤维素和木质素含量进行测定,具体测定方法如下。
1.2.5.1 全纤维素含量的测定
精确称量0.25 g TBP-IDF和SPI-IDF分别置于50 mL离心管中,称取0.2 g NaClO加入管中,再加入6%醋酸溶液15 mL,封口,在75 ℃恒温振荡水浴锅中反应60 min。取1 mL丙酮将反应后的样品洗涤三次,再用1 mL超纯水洗涤三次。洗涤后的残渣80 ℃烘干,称重即为全纤维素的含量。
1.2.5.2 纤维素含量的测定
称取烘干后的全纤维素0.1 g置于50 mL离心管中,加入17.5% NaOH溶液10 mL,在20 ℃恒温振荡水浴锅中100 r/min振荡反应40 min。反应后加入2.5 mL超纯水,静置5 min,过滤。用4 mL 10%醋酸溶液洗涤残渣,再用100 mL的沸水洗涤多次。洗涤后的残渣80 ℃烘干,称重即为纤维素的含量。半纤维含量为全纤维素含量减去纤维素含量。
1.2.5.3 木质素含量的测定
称取0.1 g的TBP-IDF和SPI-IDF分别置于锥形瓶中,加入72% H2SO4溶液1.5 mL,在20 ℃恒温振荡水浴锅中反应4 h,加入56 mL超纯水继续振荡反应4 h,过滤。残渣用沸水洗涤多次,再用冷水洗涤。洗涤后的残渣80 ℃烘干并称重。
1.2.6 不溶性膳食纤维结构表征
1.2.6.1 单糖组成分析
使用精密天平准确称量5 mg的TBP-IDF和SPI-IDF,将样品放于安瓿瓶中。向瓶中加入2 mL TFA(3 mol/L),然后在120 ℃条件下水解3 h。吸取水解后的样液至管中,并用氮气吹干。再向管中加入5 mL水,混匀,然后吸取管中样液50 μL,向样液中加入去离子水950 µL,离心(12000 r/min,5 min)。取上清进离子色谱仪分析。
色谱柱:Dionex CarbopacTM PA20(3×150 mm);流动相:A:H2O;B:15 mmol/L NaOHC(15 mmol/L NaOH和100 mmol/L NaOAc);流速:0.3 mL/min;进样量:5 µL;柱温:30 ºC。
1.2.6.2 扫描电子显微镜分析
取1 mg样品固定在样品台,对样品进行镀金,利用SU8020扫描电镜在5 kV工作电压条件下对TBP-IDF与SPI-IDF颗粒形貌进行观察(1000×)。
1.2.6.3 X-射线衍射分析
参考Ma等[12]的方法,适当修改。通过Rigaku Smart Lab型X-射线衍射仪使用Cu-Kα射线(λ=0.154 nm)并在管压40 kV和入射电流30 mA条件下对TBP-IDF和SPI-IDF进行晶体结构分析。测量角度2θ为5°~70°,步长0.05°,扫描速度4°/min。结晶度计算公式如下:
(1) 式中:Dc:结晶度(%);Ac:结晶区;Aa:非结晶区。
1.2.6.4 傅里叶变换红外光谱分析
精确称量1 mg TBP-IDF和SPI-IDF,与200 mg KBr充分混匀,研磨,压片,利用IRTracer-100型傅里叶红外光谱仪在光谱扫描波数范围为4000~400 cm−1扫描64次,光谱分辨率为4 cm−1。
1.2.7 理化性质测定
1.2.7.1 持水性
参考Dong等[13]方法,适当修改,测定TBP-IDF和SPI-IDF的持水性。取两支50 mL离心管分别放入0.5 g的TBP-IDF和SPI-IDF,再分别加入25 mL的蒸馏水,混匀,室温条件下静置24 h后离心(4000 r/min,15 min),弃上清。计算公式如下:
(2) 式中:WHC:持水性(g/g);W1:离心前样品质量(g);W2:离心后剩余样品质量(g)。
1.2.7.2 持油性
参考Qiao等[14]的方法,适当修改,测定TBP-IDF与SPI-IDF的持油性。取两支50 mL离心管分别放入0.5 g的TBP-IDF和SPI-IDF,再分别加入25 mL的大豆油,搅匀,室温条件下静置24 h后离心(4000 r/min,15 min),弃上清。计算公式如下:
(3) 式中:OHC:持油性(g/g);W1:样品质量(g);W2:离心后剩余样品质量(g)。
1.2.7.3 膨胀性
参考Gouw等[15]的方法,适当修改,测定TBP-IDF和SPI-IDF的膨胀性。取0.5 g的TBP-IDF和SPI-IDF分别放入25 mL比色管中,读取此时样品体积V1,加入20 mL蒸馏水。搅拌均匀,室温条件下静置24 h。然后记录此时样品溶胀后的体积。计算公式如下:
(4) 式中:SW:膨胀性(mL/g);V1:样品体积(mL);V2:样品溶胀后体积(mL);W:样品质量(g)。
1.2.7.4 葡萄糖吸附能力
参考Chau等[16]的方法,适当修改。取1 g的TBP-IDF和SPI-IDF分别加入50、100、150、200、250 mmol/L的葡萄糖溶液10 mL,37 ℃水浴6 h,4500 r/min离心10 min。取上清液根据葡萄糖试剂盒进行测定,计算公式如下:
(5) 式中:GAC:葡萄糖吸附能力(mmol/g);C1:吸附前葡萄糖浓度(mmol/L);C2:吸附后葡萄糖浓度(mmol/L);V:上清液体积(L);M:样品的质量(g)。
1.2.7.5 胆固醇吸附能力
参考Yang等[17]的方法,适当修改,准确称量蛋黄的体积后按照1:9的比例加入蒸馏水,搅拌均匀。准确称取1 g的TBP-IDF和SPI-IDF各放入两个锥形瓶中,分别加入25 g的上述蛋黄液混匀,调节pH为2.0和7.0,在37 ℃的条件下水浴2 h后离心(4000 r/min,20 min)。吸取上清液0.02 mL,分别加入0.38 mL冰乙酸、1.5 mL邻苯二甲醛、1.0 mL浓硫酸,在波长550 nm条件下测定吸光度。
胆固醇标准曲线方程为:Y=1.9287X+0.0115(R2=0.9975)。
胆固醇吸附能力计算公式如下:
(6) 式中:CAC:胆固醇吸附能力(mg/g);M1:吸附前蛋黄乳液胆固醇的质量(mg);M2:吸附后上清液中胆固醇的质量(mg);M:样品的质量(g)。
1.2.7.6 胆酸钠吸附能力
参考Qiao等[18]的方法并稍作修改。准确称取0.2 g的TBP-IDF和SPI-IDF各放入两个锥形瓶中,将浓度为2 mg/mL和3 mg/mL的胆酸钠溶液(pH7.0)分别向锥形瓶中加入100 mL,搅拌均匀。将锥形瓶放到37 ℃恒温水浴振荡器中恒温振荡2 h后离心(4000 r/min,20 min),取上清液1 mL于试管中,向试管中加入45%的浓硫酸6 mL,再加入0.3%的糠醛1 mL,混匀。在65 ℃的条件下水浴30 min,冷却到室温。在波长620 nm条件下测定其吸光度。
胆酸钠标准曲线方程为:Y=1.6142X−0.0245(R2=0.9983)。
胆酸钠吸附能力计算公式如下:
(7) 式中:SAC:胆酸钠吸附能力(mg/g);M1:吸附前溶液中胆酸钠的质量(mg);M2:吸附后上清液中胆酸钠的质量(mg);M:样品的质量(g)。
1.3 数据处理
所有实验均重复三次,结果均以平均值±标准差(Means±SD)表示,采用SPSS 19.0进行分析数据,平均数之间的差异通过单因素方差分析,P<0.05为显著性差异,采用OriginPro 2017 C64Bit进行处理和作图。
2. 结果与分析
2.1 单因素实验结果分析
2.1.1 液料比对脱脂率的影响
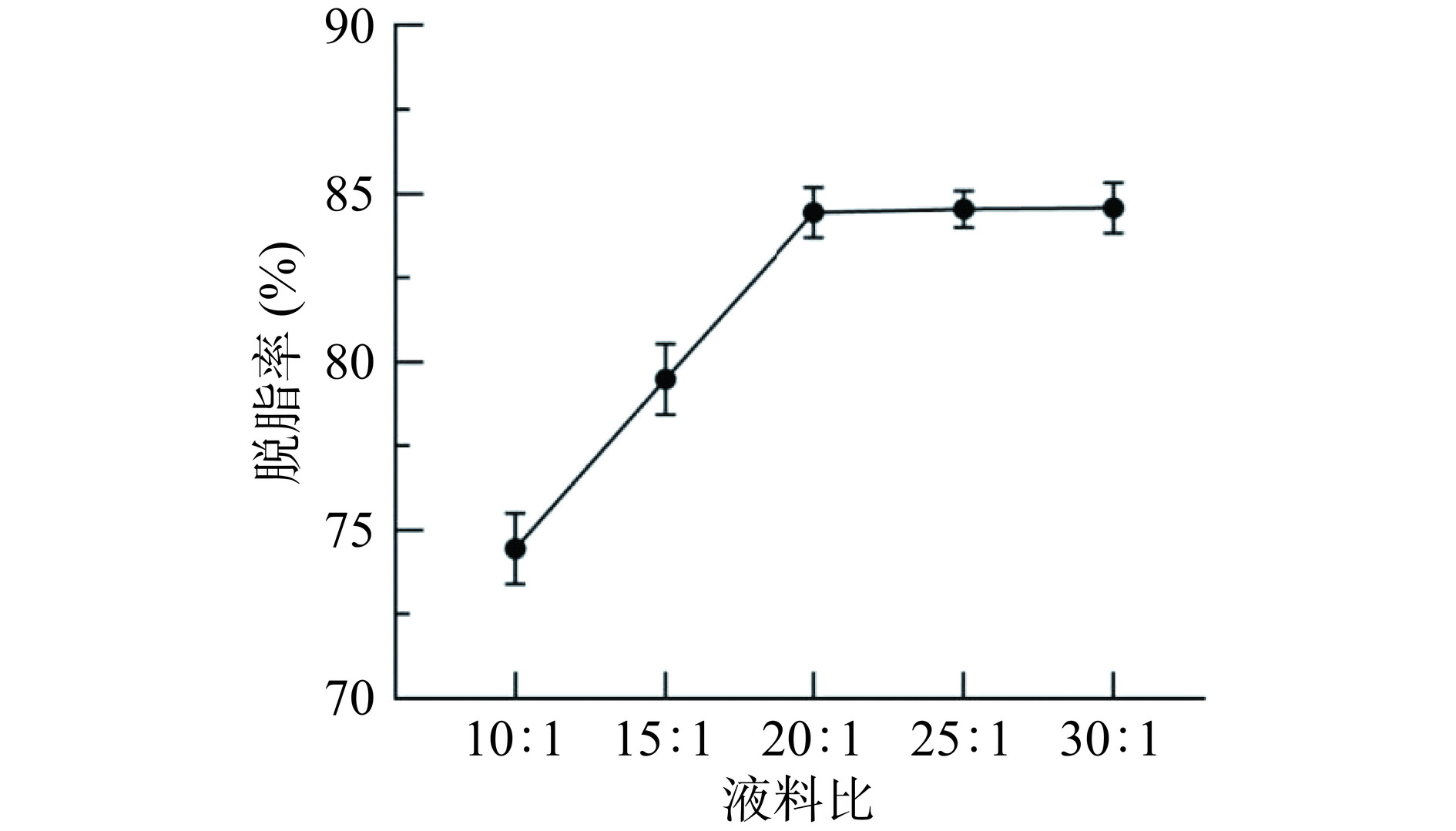
如图1所示,随着液料比的升高,反应体系中溶剂用量不断增加,脱脂溶剂溶解并分离油脂[19],脱脂率呈现上升的趋势,当液料比为20:1时,豆渣脱脂率到达顶点,此后趋势呈平缓状态,此时豆渣的脱脂率为84.43%。考虑到液料比对溶剂消耗的影响,选择液料比20:1作为响应面优化中心点较为合理。
2.1.2 脱脂温度对脱脂率的影响
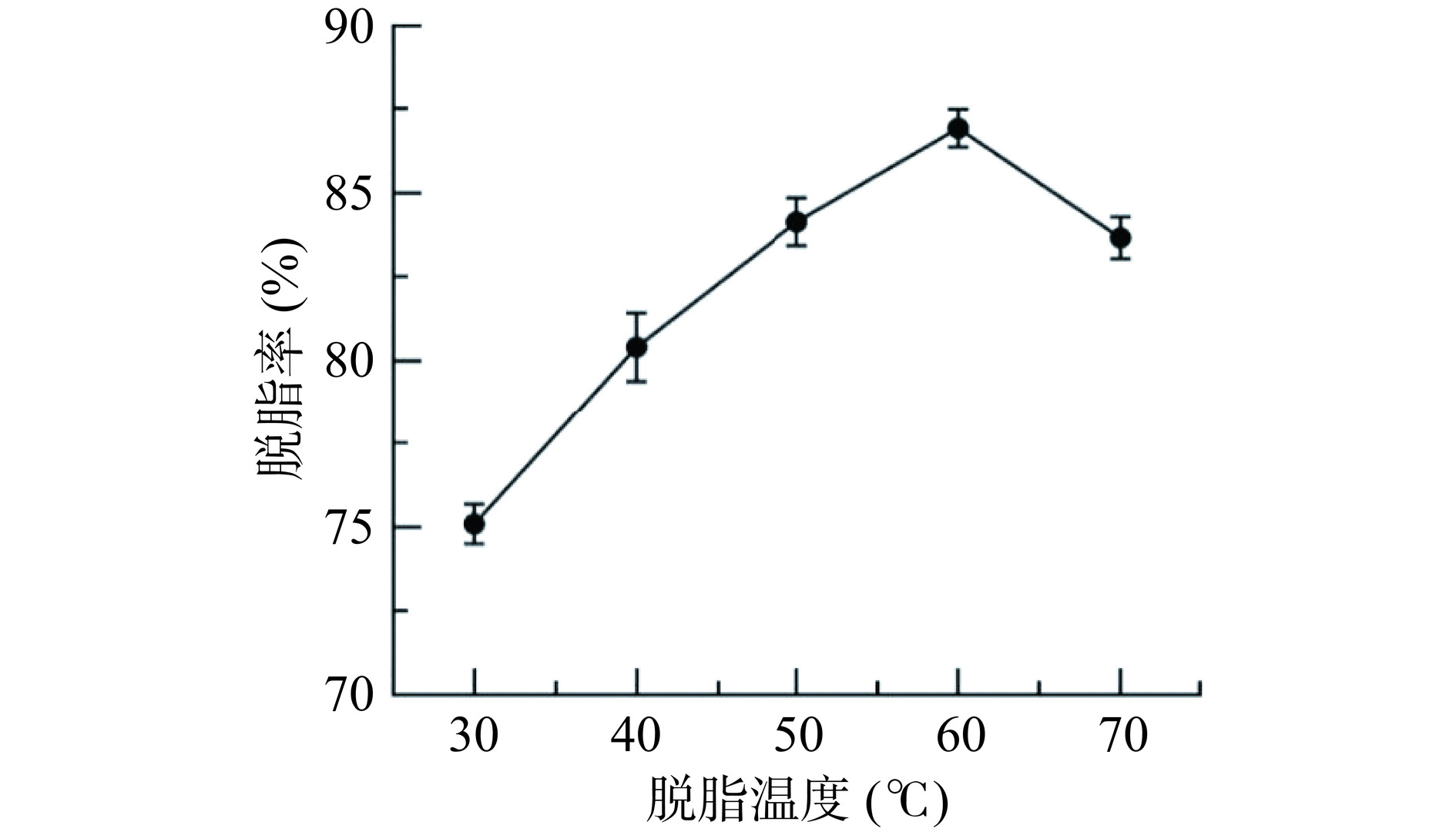
如图2所示,随着脱脂温度的增加,传质阻力减小,有利于油脂浸出[20],豆渣的脱脂率呈现先上升后下降的趋势。脱脂温度为60 ℃时,豆渣的脱脂率最高,为86.91%。因此,选择脱脂温度60 ℃作为响应面优化中心点较为合理。
2.1.3 脱脂时间对脱脂率的影响
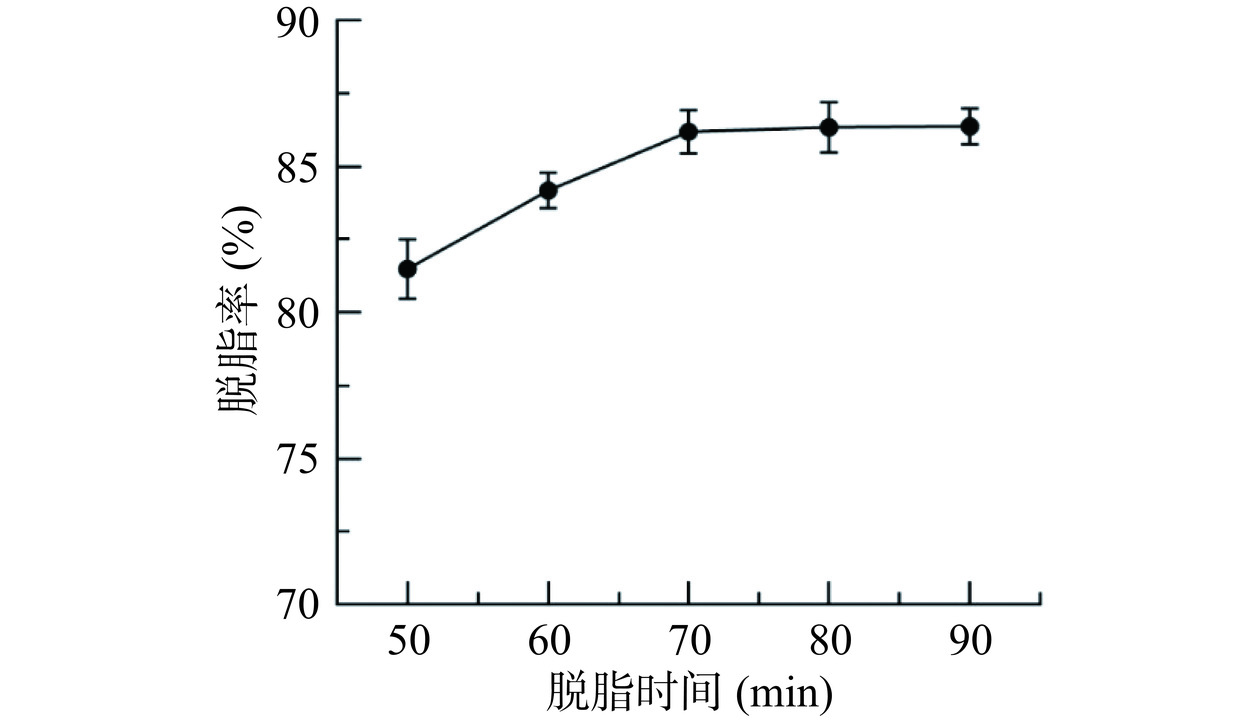
如图3所示,豆渣脱脂率随着脱脂时间的增加先呈现上升趋势,当脱脂时间为70 min时,豆渣的脱脂率到达顶点,此时豆渣的脱脂率为86.17%,此后趋势呈平缓状态。这可能是由于随着脱脂时间的延长,油脂的浸出增加,一段时间后,油脂的浸出趋于饱和,进而脱脂率趋于平缓。因此,选择脱脂时间70 min作为响应面优化中心点较为合理。
2.2 响应面试验结果分析
利用Design-Expert.V13软件对响应面试验因素水平进行处理,得到试验方案,以豆渣脱脂率为响应值,液料比、脱脂温度、脱脂时间三项因素为考察因子,按照试验方案所给出条件进行试验,共17组,每组均重复操作3次,响应面试验设计及结果和回归模型的方差分析结果如表2和表3所示。
表 2 响应面试验方案及结果Table 2. Design and results of response surface test试验号 A液料比 B脱脂温度(℃) C脱脂时间(min) 脱脂率(%) 1 15:1 50 70 78.82 2 25:1 50 70 85.12 3 15:1 70 70 75.35 4 25:1 70 70 83.35 5 15:1 60 60 81.03 6 25:1 60 60 87.89 7 15:1 60 80 82.15 8 25:1 60 80 90.15 9 20:1 50 60 84.28 10 20:1 70 60 83.05 11 20:1 50 80 86.63 12 20:1 70 80 83.24 13 20:1 60 70 90.94 14 20:1 60 70 90.68 15 20:1 60 70 90.03 16 20:1 60 70 89.96 17 20:1 60 70 90.42 表 3 回归模型的方差分析Table 3. Analysis of variance of regression model方差来源 平方和 自由度 均方 F值 P值 显著性 模型 344.98 9 38.33 306.24 <0.0001 ** A 106.29 1 106.29 849.17 <0.0001 ** B 12.15 1 12.15 97.09 <0.0001 ** C 4.38 1 4.38 35.00 0.0006 ** AB 0.7225 1 0.7225 5.77 0.0473 * AC 0.3249 1 0.3249 2.60 0.1512 BC 1.17 1 1.17 9.32 0.0185 * A2 80.43 1 80.43 642.55 <0.0001 ** B2 121.67 1 121.67 972.04 <0.0001 ** C2 2.25 1 2.25 17.95 0.0039 ** 残差 0.8762 7 0.1252 失拟项 0.1754 3 0.0585 0.3338 0.8029 注:*代表显著(P<0.05);**代表极显著(P<0.01)。 通过Design-Expert软件,对表2的实验结果进行拟合分析,获得了吸附后豆渣脱脂率(Y)对液料比(A)、脱脂温度(B)、脱脂时间(C)的三元二次回归方程:
Y=90.41+3.65A−1.23B+0.74C+0.425AB+0.285AC−0.54BC−4.37A2−5.38B2−0.7305C2
由方差分析可知:响应面回归模型,呈极显著性,失拟项P=0.8029>0.0001,不显著,说明试验建模成立,且R2值为0.9975,说明此模型能够解释99.75%的响应值变化,因而模型的拟合度较好,用于分析试验结果具有一定的可信度,具有统计学意义。
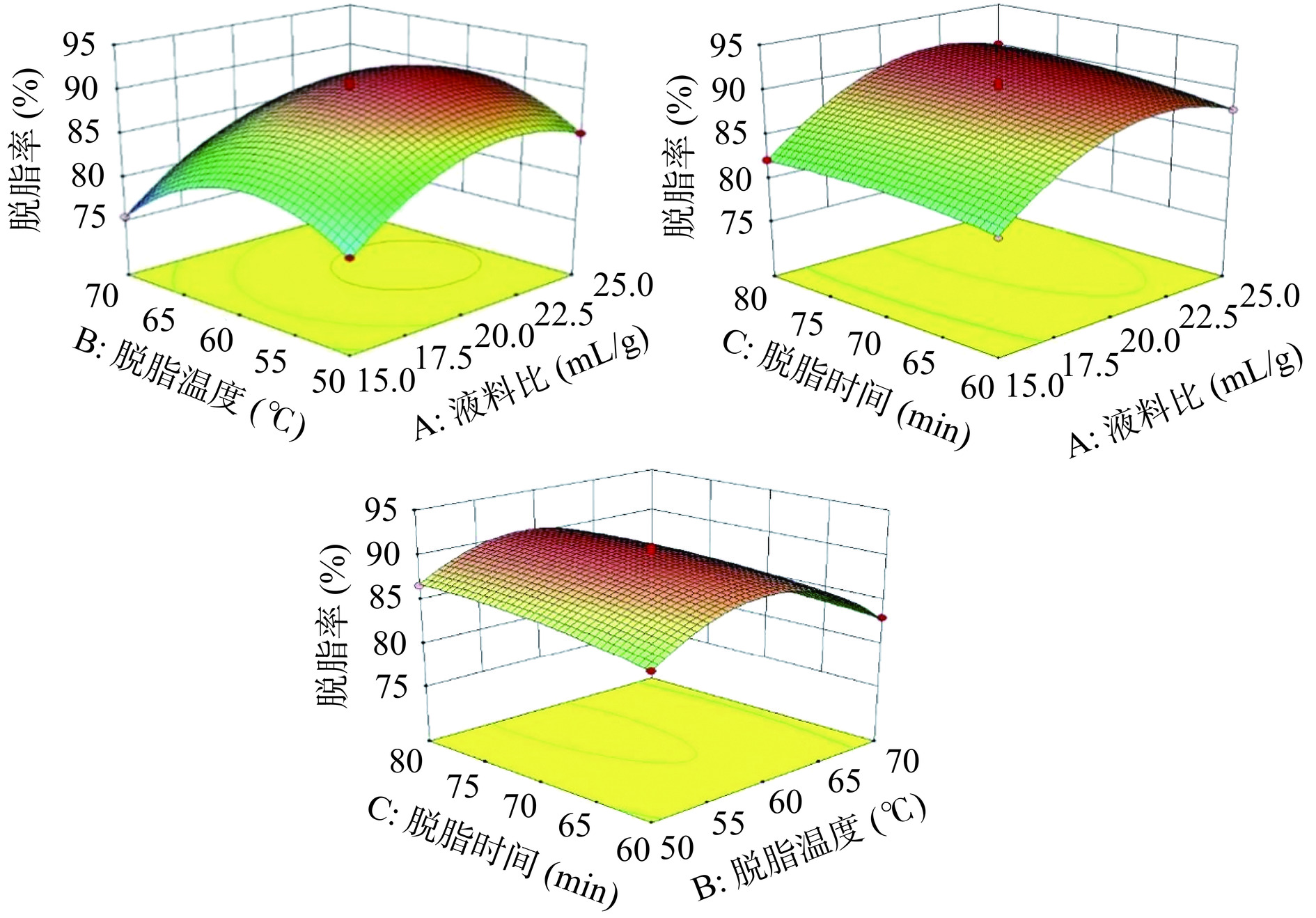
图4为影响3个因素交互作用的响应面3D图,可以明显看出,液料比和脱脂温度、脱脂温度和脱脂时间交互作用显著。
2.3 验证实验
根据响应面试验回归模型预测得到最佳脱脂条件:液料比为22.01:1、脱脂温度为59.60 ℃,脱脂时间为70.61 min,在此条件下传统豆制品豆渣理论脱脂率达到91.25%。根据实验实际条件,条件修正为液料比为22:1、脱脂温度为59 ℃、脱脂时间为70 min,在此最优条件下进行3次平行实验,得到传统豆制品豆渣的脱脂率为90.13%±1.13%,与传统豆制品豆渣的理论脱脂率相差在5%范围内,证实了理论值和实验值之间的良好相关性。
2.4 基础成分分析
传统豆制品豆渣和TBP-IDF的成分分析如表4所示,传统豆制品豆渣中IDF含量为67.69%。据报道,橙子果渣中IDF含量为46%~56%[21],柠檬果渣中则为41.88%[22],故传统豆制品豆渣可作为制备IDF的优质来源。在此基础上,本研究通过复合酶法制备TBP-IDF,IDF含量显著提升(P<0.05),高达83.23%。Chen等[23]采用复合酶法分别从小麦和藜麦中提取IDF,其纯度分别为80.69%和74.08%。由此可见,本研究制备的TBP-IDF含量较高,这有利于进一步对其结构、理化性质及功能特性等进行深入研究。
表 4 豆渣和TBP-IDF的基础成分Table 4. Basic ingredients of okara and TBP-IDF2.5 膳食纤维组分分析
TBP-IDF和SPI-IDF的组分如表5所示,TBP-IDF的纤维素含量显著高于SPI-IDF(P<0.05),而半纤维素含量显著低于SPI-IDF(P<0.05),这是由于传统豆制品加工过程中所用的大豆原料未经脱皮处理,所以其纤维素含量较高。
表 5 TBP-IDF和SPI-IDF的组分Table 5. Components of TBP-IDF and SPI-IDF样品 纤维素(%) 半纤维素(%) 木质素(%) TBP-IDF 29.3±0.76b 53.5±0.81a 17.2±0.85a SPI-IDF 13.4±0.79a 70.2±0.87b 16.4±0.72a 2.6 结构表征分析
2.6.1 单糖组成分析
通过表6的结果可知,TBP-IDF水解单糖成分中,半乳糖含量最高(38.53%±0.75%),其次为阿拉伯糖(21.71%±0.86%)、葡萄糖(15.12%±0.73%)、木糖(7.92%±0.92%)等。与SPI-IDF相比,TBP-IDF表现出不同的单糖组成,其主要特点为葡萄糖含量的显著升高(P<0.05)。研究表明,葡萄糖主要来自植物细胞壁中纤维素的水解[24]。本研究中,传统豆制品在加工过程中几乎不进行脱皮操作,而分离蛋白的生产则需要脱皮,致使大豆种皮中的纤维素成分保留在了TBP-IDF中,进而表现为葡萄糖含量的增加。这一初级结构的差异有可能会导致二者高级结构及理化特性间的差异。此外,Qi等[25]报道半乳糖、阿拉伯糖和木糖都属于半纤维素成分,这说明半纤维素和纤维素是TBP-IDF的主要成分,与基本组分测定实验结果一致。
表 6 TBP-IDF和SPI-IDF单糖组成Table 6. Monosaccharide composition of TBP-IDF and SPI-IDF样品 半乳糖(%) 阿拉伯糖(%) 葡萄糖(%) 木糖(%) 鼠李糖(%) 甘露糖(%) 岩藻糖(%) 半乳糖醛酸(%) 葡萄糖醛酸(%) TBP-IDF 38.53±0.75a 21.71±0.86a 15.12±0.73b 7.92±0.92b 2.88±0.88a 1.32±0.72a 2.71±0.65b 8.17±0.75a 1.64±0.88b SPI-IDF 47.00±0.69b 22.40±0.82a 2.30±0.77a 6.40±0.81a 3.20±0.93a 1.00±0.68a 1.50±0.85a 15.80±0.79b 0.40±0.93a 2.6.2 扫描电镜分析
TBP-IDF与SPI-IDF的扫描电镜结果如图5所示,从图中可以看出,TBP-IDF和SPI-IDF都呈现出多面立体形状,这是由于在制备IDF的过程中,豆渣中的一些大分子物质被酶解,造成内部基团暴露,比表面积增大[26]。二者微观结构虽整体差异较小,但某些细节结构上TBP-IDF显得更致密,曲折度更低,其可能由于较高的纤维素含量可以为TBP-IDF提供更致密的刚性结构。
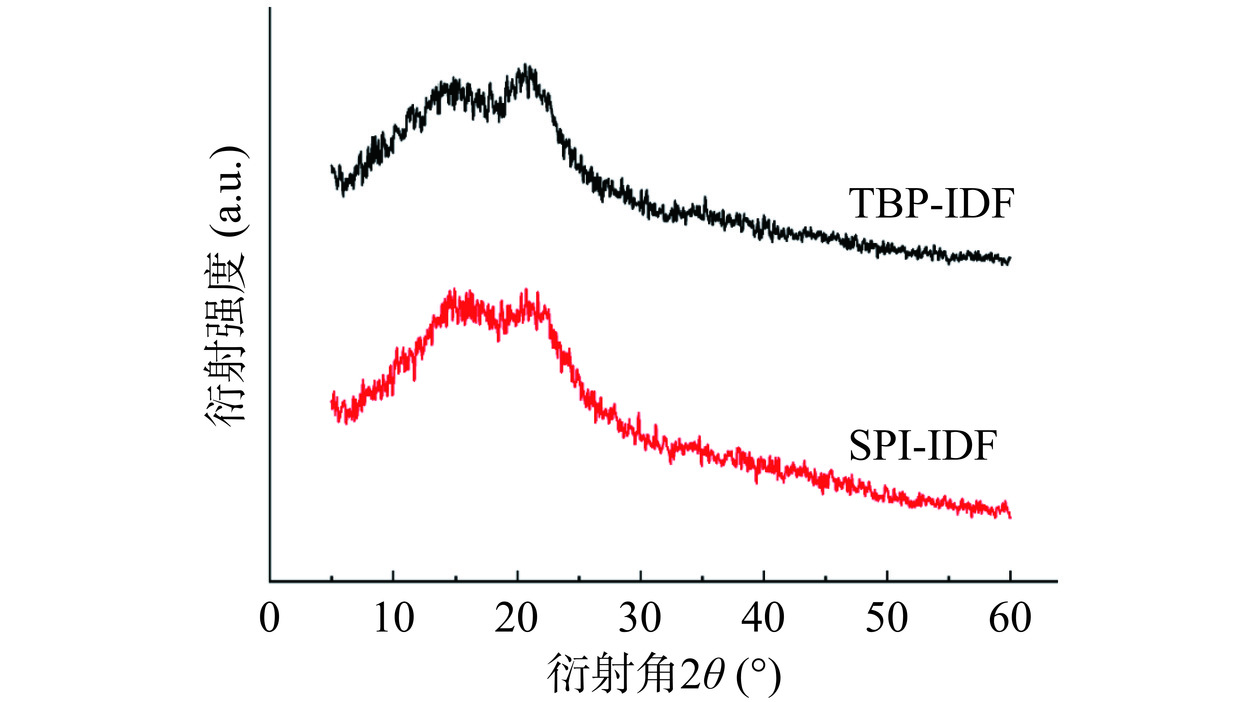
2.6.3 X-射线衍射分析
TBP-IDF与SPI-IDF的X-衍射图谱结果如图6所示,衍射角(2θ angle)为15.12°和20.64°时出现不同的衍射峰,属于纤维素Ⅱ型结构[27−28],这可能是由于酶解处理过程使晶体结构发生了改变。TBP-IDF和SPI-IDF的衍射峰位置没有明显改变,TBP-IDF衍射强度高于SPI-IDF,其结晶度也高于SPI-IDF。经计算,TBP-IDF的结晶度为35.86%,高于SPI-IDF的31.21%。Ye等[29]报道结晶度是判断食品原料机械性和热特性的一个重要因素,结晶度与其成正相关。本研究中TBP-IDF具有较高的结晶度,说明其热特性较为稳定,同样有可能由于TBP-IDF比SPI-IDF拥有更多的纤维素结构,其稳定性高于半纤维素和木质素等成分所致。
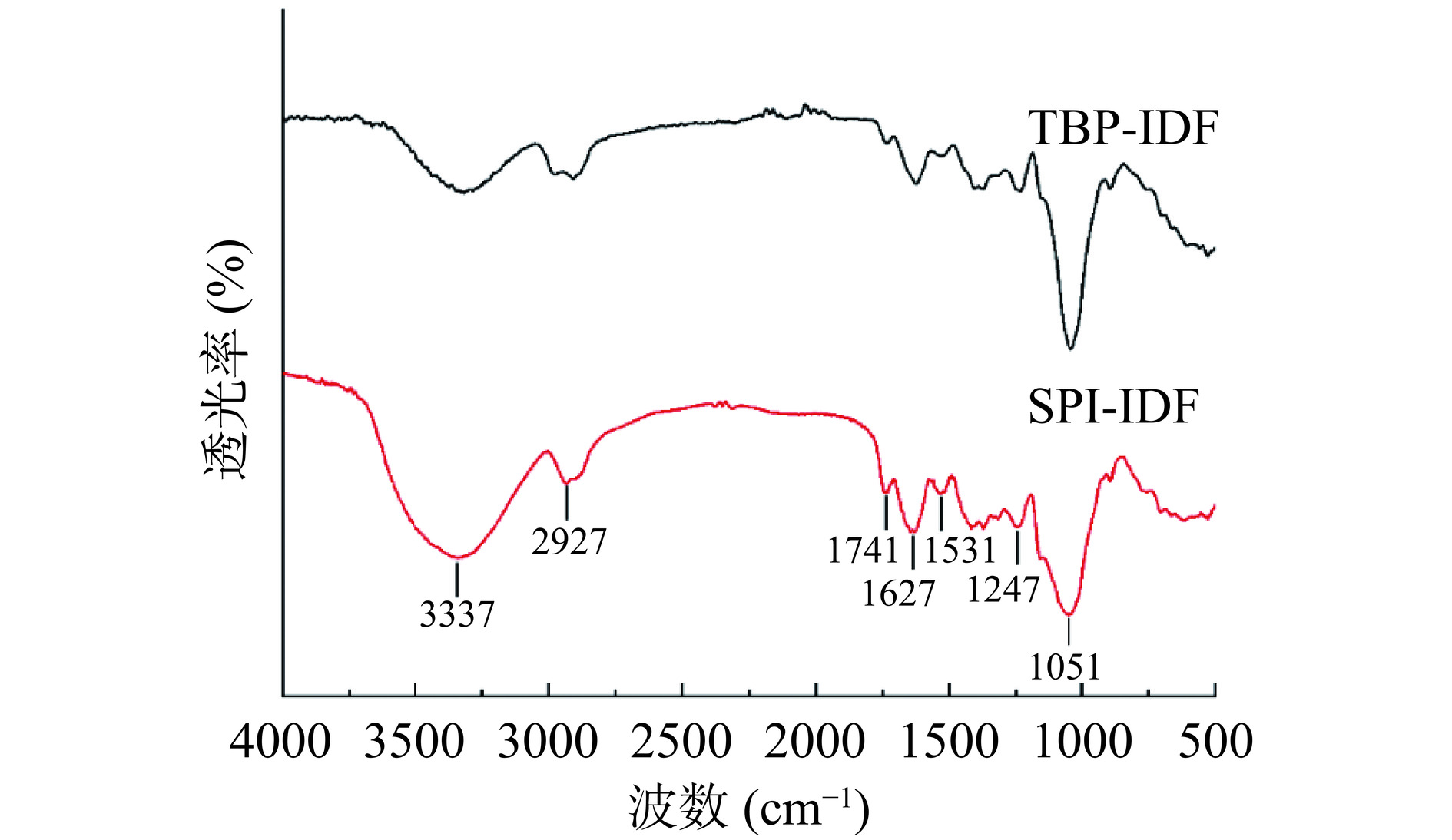
2.6.4 傅里叶变换红外光谱分析
TBP-IDF与SPI-IDF傅里叶红外光谱结果如图7所示,在3337 cm−1处的吸收峰是由于纤维素和半纤维素的O-H拉伸振动[30]。2927 cm−1处的吸收峰是由于多糖分子甲基及亚甲基上C-H的伸缩振动,代表多糖化合物的典型结构[31];1741 cm−1处的吸收峰是半纤维素的乙酰基或酯羰基C=O拉伸的结果[32],表明TBP-IDF和SPI-IDF中含有醛基或羧基。1627 cm−1吸收峰归因于半乳糖醛酸的酯化和离子化的羧基。1531 cm−1处的吸收峰是木质素的脂肪族或芳香族C-H基团振动的结果[33]。1247 cm−1是木质素组分拉伸振动的结果,1051 cm−1处的吸收峰是半纤维素中醚键(C-O-C)的特征峰[34]。TBP-IDF与SPI-IDF峰型位置无明显变化且都具有多糖特征吸收峰。
2.7 理化性质分析
2.7.1 持水性、持油性和膨胀性分析
TBP-IDF,SPI-IDF的持水性、持油性和膨胀性如表7所示。TBP-IDF的持水性和膨胀性显著高于SPI-IDF(P<0.05),而持油性显著低于SPI-IDF(P<0.05)。Lopez等[35]报道影响膳食纤维的持水性和膨胀性的主要因素与膳食纤维的比表面积有关。这与微观结构观察结果一致,TBP-IDF的高持水性与膨胀性是由于TBP-IDF比表面积较大,增加了水分子的表面张力,或结构中暴露的羟基多,氢键缔合程度增加。此外,TBP-IDF中蛋白质含量高于SPI-IDF,导致其吸水能力增加。持油性的降低则可能由于纤维素比例的增加导致的羟基(-OH,纤维素特征官能团)等基团比例的增加,乙酰基(-COCH3,半纤维素特征官能团)和甲氧基(-OCH3,木质素特征官能团)等基团比例降低导致的[36]。
表 7 TBP-IDF和SPI-IDF的持水性、持油性及膨胀性Table 7. Water-holding, oil-holding, and swelling capacity of TBP-IDF and SPI-IDF样品 持水性(g/g) 持油性(g/g) 膨胀性(mL/g) TBP-IDF 9.53±0.19b 6.22±0.10a 5.20±0.08b SPI-IDF 7.73±0.22a 7.95±0.16b 4.30±0.09a 2.7.2 葡萄糖吸附能力分析
如图8所示,TBP-IDF和SPI-IDF都具有较强的葡萄糖吸附能力,在测定范围内,二者吸附性都随着葡萄糖浓度升高而增加,几乎呈线性关系,且各浓度下二者几乎不存在显著差异(P>0.05)。这与Benitez等[37]报道的洋葱副产物IDF的葡萄糖吸附能力结果一致,表明TBP-IDF的摄入与SPI-IDF类似,可以吸附消化道中存在的葡萄糖,防止机体对过度摄入的葡萄糖进行吸收,这表明TBP-IDF在控制血糖方面可能具有应用价值,未来还需要通过体内试验进一步探究。
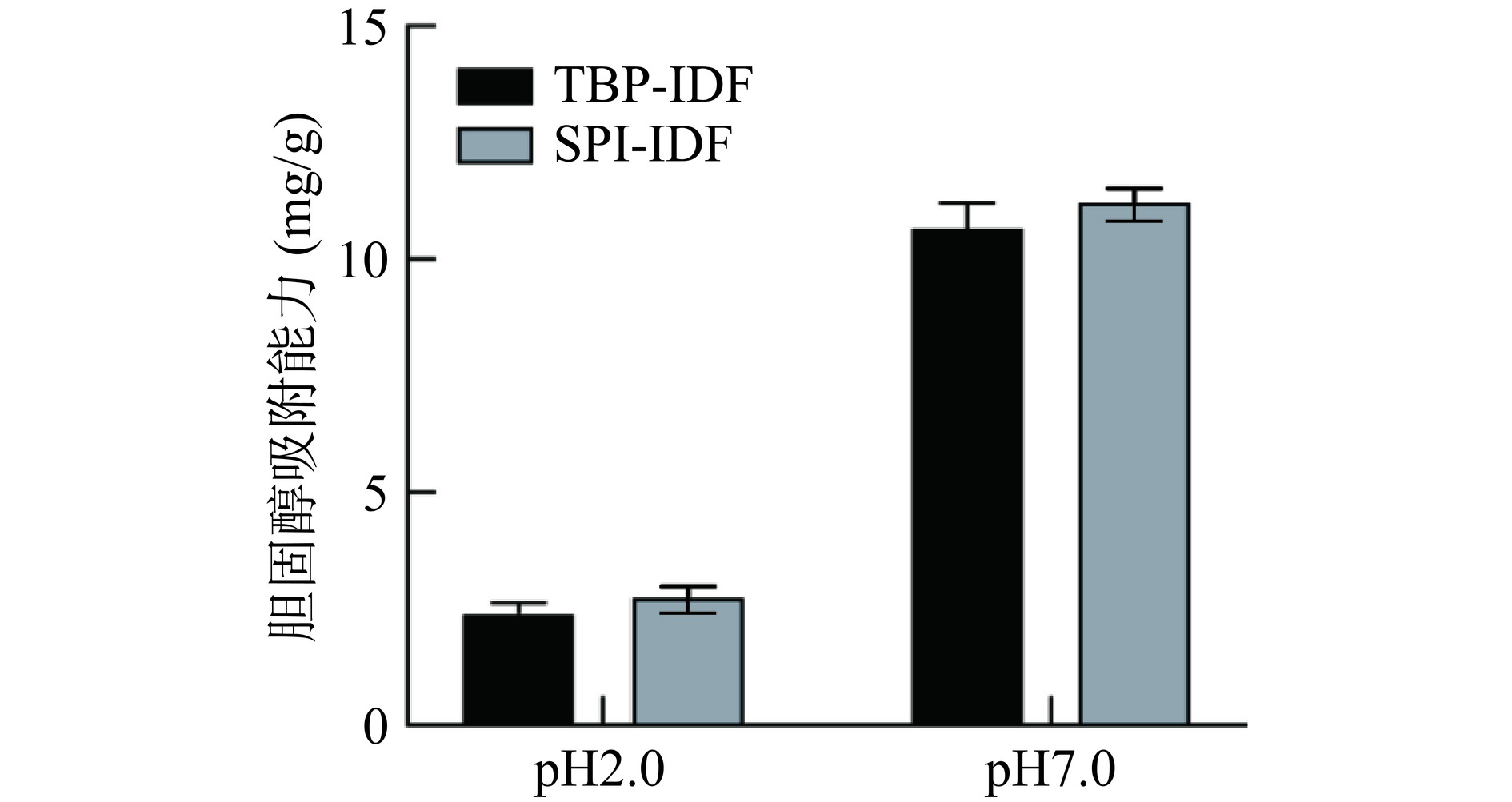
2.7.3 胆固醇吸附能力分析
TBP-IDF与SPI-IDF的胆固醇吸附能力测定结果如图9所示。当pH为2.0时(模拟胃环境),TBP-IDF的胆固醇吸附能力为2.38 mg/g,略低于SPI-IDF(2.76 mg/g),但不存在显著性差异(P>0.05)。pH为7.0时(模拟肠道环境),TBP-IDF与SPI-IDF对胆固醇的吸附能力无显著差异(P>0.05),但均高于pH为2.0时,且优于麦麸和大豆籽壳IDF的胆固醇吸附能力[38],说明TBP-IDF和SPI-IDF在肠道环境下对胆固醇的吸附效果优于胃环境,且由于机体对脂质的吸收主要集中于肠道,故二者的摄入均可以防止脂质在机体中被过度吸收;辅以DF本身具备的润滑性和增加肠道蠕动的能力,使其表现出潜在的辅助降脂能力。
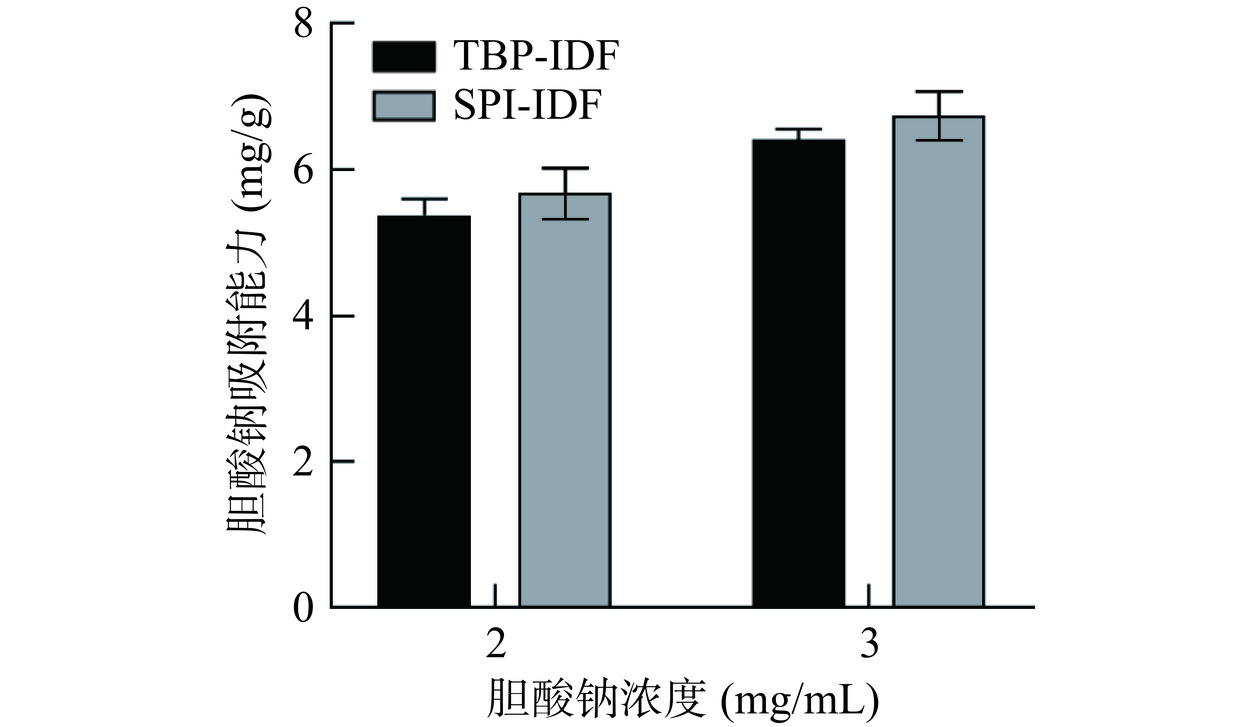
2.7.4 胆酸钠吸附能力分析
TBP-IDF和SPI-IDF的胆酸钠吸附能力如图10所示。TBP-IDF和SPI-IDF对胆酸钠的吸附能力无显著差异(P>0.05),当胆酸钠浓度升高时,TBP-IDF和SPI-IDF的胆酸钠吸附能力也随之增加。胆酸钠是一种胆汁酸和钠离子结合生成的胆汁盐,其在消化道中可能会损伤消化道黏膜并诱导细胞死亡,哺乳动物肠道内的细菌可以通过多种生理过程来调节耐受胆盐的抗性[39]。TBP-IDF和SPI-IDF的胆酸钠吸附能力与胆酸钠的浓度呈正相关,二者结合胆汁酸盐的能力越强,意味着肝脏中胆固醇转化为胆汁酸的速度越快,降胆固醇效果越好,表明降血脂活性更强[40],再次表现出了潜在的辅助降脂能力。
3. 结论
本研究通过单因素实验结合响应面试验优化了传统豆制品豆渣脱脂工艺参数,脱脂率高达90.13%。在此基础上,通过复合酶法制备的TBP-IDF含量为83.23%,其组分以半纤维素为主,其次是纤维素和木质素。TBP-IDF的单糖组成与SPI-IDF存在较大差异,但均具有光滑的表面结构且成多面立体形状,并具有大分子多糖的特征吸收峰;TBP-IDF的结晶度高于SPI-IDF。此外,与SPI-IDF相比,TBP-IDF具有较好的持水性和膨胀性;二者均对葡萄糖、胆固醇和胆酸钠均具有较好的吸附能力。综上所述,本研究阐明了TBP-IDF的结构特征、理化性质及潜在的功能特性,并扩大了不溶性膳食纤维的获取来源和途径,这对提高传统豆制品加工副产物的综合利用率及附加值具有重要意义。未来,将进一步通过体内实验验证TBP-IDF摄入对机体糖脂代谢的影响,并探究其调控机制与SPI-IDF是否存在差异。
-
表 1 响应面试验因素和水平
Table 1 Factor and level of response surface test
水平 A液料比 B脱脂温度(℃) C脱脂时间(min) −1 15:1 50 60 0 20:1 60 70 1 25:1 70 80 表 2 响应面试验方案及结果
Table 2 Design and results of response surface test
试验号 A液料比 B脱脂温度(℃) C脱脂时间(min) 脱脂率(%) 1 15:1 50 70 78.82 2 25:1 50 70 85.12 3 15:1 70 70 75.35 4 25:1 70 70 83.35 5 15:1 60 60 81.03 6 25:1 60 60 87.89 7 15:1 60 80 82.15 8 25:1 60 80 90.15 9 20:1 50 60 84.28 10 20:1 70 60 83.05 11 20:1 50 80 86.63 12 20:1 70 80 83.24 13 20:1 60 70 90.94 14 20:1 60 70 90.68 15 20:1 60 70 90.03 16 20:1 60 70 89.96 17 20:1 60 70 90.42 表 3 回归模型的方差分析
Table 3 Analysis of variance of regression model
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 344.98 9 38.33 306.24 <0.0001 ** A 106.29 1 106.29 849.17 <0.0001 ** B 12.15 1 12.15 97.09 <0.0001 ** C 4.38 1 4.38 35.00 0.0006 ** AB 0.7225 1 0.7225 5.77 0.0473 * AC 0.3249 1 0.3249 2.60 0.1512 BC 1.17 1 1.17 9.32 0.0185 * A2 80.43 1 80.43 642.55 <0.0001 ** B2 121.67 1 121.67 972.04 <0.0001 ** C2 2.25 1 2.25 17.95 0.0039 ** 残差 0.8762 7 0.1252 失拟项 0.1754 3 0.0585 0.3338 0.8029 注:*代表显著(P<0.05);**代表极显著(P<0.01)。 表 4 豆渣和TBP-IDF的基础成分
Table 4 Basic ingredients of okara and TBP-IDF
表 5 TBP-IDF和SPI-IDF的组分
Table 5 Components of TBP-IDF and SPI-IDF
样品 纤维素(%) 半纤维素(%) 木质素(%) TBP-IDF 29.3±0.76b 53.5±0.81a 17.2±0.85a SPI-IDF 13.4±0.79a 70.2±0.87b 16.4±0.72a 表 6 TBP-IDF和SPI-IDF单糖组成
Table 6 Monosaccharide composition of TBP-IDF and SPI-IDF
样品 半乳糖(%) 阿拉伯糖(%) 葡萄糖(%) 木糖(%) 鼠李糖(%) 甘露糖(%) 岩藻糖(%) 半乳糖醛酸(%) 葡萄糖醛酸(%) TBP-IDF 38.53±0.75a 21.71±0.86a 15.12±0.73b 7.92±0.92b 2.88±0.88a 1.32±0.72a 2.71±0.65b 8.17±0.75a 1.64±0.88b SPI-IDF 47.00±0.69b 22.40±0.82a 2.30±0.77a 6.40±0.81a 3.20±0.93a 1.00±0.68a 1.50±0.85a 15.80±0.79b 0.40±0.93a 表 7 TBP-IDF和SPI-IDF的持水性、持油性及膨胀性
Table 7 Water-holding, oil-holding, and swelling capacity of TBP-IDF and SPI-IDF
样品 持水性(g/g) 持油性(g/g) 膨胀性(mL/g) TBP-IDF 9.53±0.19b 6.22±0.10a 5.20±0.08b SPI-IDF 7.73±0.22a 7.95±0.16b 4.30±0.09a -
[1] QIN W, SUN L, MIAO M, et al. Plant-sourced intrinsic dietary fiber:Physical structure and health function[J]. Trends in Food Science & Technology,2021,118:341−355.
[2] YE S, SHAH B R, LI J, et al. A critical review on interplay between dietary fibers and gut microbiota[J]. Trends in Food Science & Technology,2022,124:237−249.
[3] SANTOS D C, OLIVEIRA FILHO J G, SILVA J D, et al. Okara flour:Its physicochemical, microscopical and functional properties[J]. Nutrition Food Science,2019,49(6):1252−1264. doi: 10.1108/NFS-11-2018-0317
[4] 张蒙冉, 李淑英, 高雅鑫, 等. 不同真菌发酵豆渣营养品质与功能特性研究[J]. 中国食品学报,2022,22(8):334−342. [ZHANG M R, LI S Y, GAO Y X, et al. Studies on nutritional quality and functional characteristics of soybean dregs fermented by different fungus[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(8):334−342.] ZHANG M R, LI S Y, GAO Y X, et al. Studies on nutritional quality and functional characteristics of soybean dregs fermented by different fungus[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(8): 334−342.
[5] SINGH A, MEENA M, KUMAR D, et al. Structural and functional analysis of various globulin proteins from soy seed[J]. Critical Reviews in Food Science and Nutrition,2015,55(11):1491−1502. doi: 10.1080/10408398.2012.700340
[6] MATEOS-APARICIO I, REDONDO-CUENCA A, VILLANUEVA-SUAREZ M J, et al. Pea pod, broad bean pod and okara, potential sources of functional compounds[J]. LWT-Food Science and Technology,2010,43(9):1467−1470. doi: 10.1016/j.lwt.2010.05.008
[7] AMBAWAT S, KHETARPAUL N. Comparative assessment of antioxidant, nutritional and functional properties of soybean and its by-product okara[J]. Annals of Phytomedicine-An International Journal,2018,7(1):112−118.
[8] ULLAH I, KHODER R M, YIN T, et al. Gelation properties of tofu induced by different coagulants:Effects of molecular interactions between nano-sized okara dietary fiber and soybean proteins[J]. Food Chemistry,2023,403:134056. doi: 10.1016/j.foodchem.2022.134056
[9] WANG S, SUN W, SWALLAH M S, et al. Preparation and characterization of soybean insoluble dietary fiber and its prebiotic effect on dyslipidemia and hepatic steatosis in high fat-fed C57BL/6J mice[J]. Food Function,2021,12(18):8760−8773. doi: 10.1039/D1FO01050F
[10] LYU B, WANG H, SWALLAH M S, et al. Structure, properties and potential bioactivities of high-purity insoluble fibre from soybean dregs (Okara)[J]. Food Chemistry,2021,364:130402. doi: 10.1016/j.foodchem.2021.130402
[11] TERAMOTO Y, LEE S, ENDO T. Pretreatment of woody and herbaceous biomass for enzymatic saccharification using sulfuric acid-free ethanol cooking[J]. Bioresource Technology,2008,99:8856−8863. doi: 10.1016/j.biortech.2008.04.049
[12] MA M, MU T. Effects of extraction methods and particle size distribution on the structural, physicochemical, and functional properties of dietary fiber from deoiled cumin[J]. Food Chemistry,2016,194:237−246. doi: 10.1016/j.foodchem.2015.07.095
[13] DONG W, WANG D, HU R, et al. Chemical composition, structural and functional properties of soluble dietary fiber obtained from coffee peel using different extraction methods[J]. Food Research International,2020,136:109497. doi: 10.1016/j.foodres.2020.109497
[14] QIAO C C, ZENG F K, WU N N, et al. Functional, physicochemical and structural properties of soluble dietary fiber from rice bran with extrusion cooking treatment[J]. Food Hydrocolloids,2021,121:107057. doi: 10.1016/j.foodhyd.2021.107057
[15] GOUW V P, JUNG J, ZHAO Y. Functional properties, bioactive compounds, and in vitro gastrointestinal digestion study of dried fruit pomace powders as functional food ingredients[J]. LWT-Food Science and Technology,2017,80:136−144. doi: 10.1016/j.lwt.2017.02.015
[16] CHAU C F, WANG Y T, WEN Y L. Different micronization methods significantly improve the functionality of carrot insoluble fibre[J]. Food Chemistry,2007,100(4):1402−1408. doi: 10.1016/j.foodchem.2005.11.034
[17] YANG T, YAN H L, TANG C H. Wet media planetary ball milling remarkably improves functional and cholesterol-binding properties of okara[J]. Food Hydrocolloids,2021,111:106386. doi: 10.1016/j.foodhyd.2020.106386
[18] QIAO H, SHAO H, ZHENG X, et al. Modification of sweet potato (Ipomoea batatas Lam.) residues soluble dietary fiber following twin-screw extrusion[J]. Food Chemistry,2021,335:127522. doi: 10.1016/j.foodchem.2020.127522
[19] 胡巍, 杨帆, 熊子奕, 等. 不同脱脂方法对高脂肪型复杂食物基质中牛乳过敏原检测的影响[J]. 食品科学技术学报,2023,41(6):115−126. [HU W, YANG F, XIONG Z Y, et al. Effects of different degreasing methods on cow’s milk allergens detection in high-fat complex food matrix[J]. Journal of Food Science and Technology,2023,41(6):115−126.] HU W, YANG F, XIONG Z Y, et al. Effects of different degreasing methods on cow’s milk allergens detection in high-fat complex food matrix[J]. Journal of Food Science and Technology, 2023, 41(6): 115−126.
[20] 宁伟伟, 陶宁萍, 荣旭, 等. 响应面法优化奇亚籽饼脱脂工艺研究[J]. 中国油脂,2016,41(7):20−23. [NING W W, TAO N P, RONG X, et al. Optimization of defatting of chia (Salvia hispanica) seed cake by response surface methodology[J]. China Oils and Fats,2016,41(7):20−23.] doi: 10.3969/j.issn.1003-7969.2016.07.005 NING W W, TAO N P, RONG X, et al. Optimization of defatting of chia (Salvia hispanica) seed cake by response surface methodology[J]. China Oils and Fats, 2016, 41(7): 20−23. doi: 10.3969/j.issn.1003-7969.2016.07.005
[21] KARAMAN E, YILMAZ E, TUNCEL N B. Physicochemical, microstructural and functional characterization of dietary fibers extracted from lemon, orange and grapefruit seeds press meals[J]. Bioactive Carbohydrates and Dietary Fibre,2017,11:9−17. doi: 10.1016/j.bcdf.2017.06.001
[22] ELLEUCH M, BEDIGIAN D, ROISEUX O, et al. Dietary fibre and fibre-rich by-products of food processing:Characterisation, technological functionality and commercial applications:A review[J]. Food Chemistry,2010,124(2):411−421.
[23] CHEN H, XIONG M, BAI T, et al. Comparative study on the structure, physicochemical, and functional properties of dietary fiber extracts from quinoa and wheat[J]. LWT-Food Science and Technology,2021,149:111816. doi: 10.1016/j.lwt.2021.111816
[24] WU W, HU J, GAO H, et al. The potential cholesterol-lowering and prebiotic effects of bamboo shoot dietary fibers and their structural characteristics[J]. Food Chemistry,2020,332:127372. doi: 10.1016/j.foodchem.2020.127372
[25] QI J, YOKOYAMA W, MAJEED H, et al. Structural and physicochemical properties of insoluble rice bran fiber:Effect of acid-base induced modifications[J]. RSC Advances,2015,5:79915−79923. doi: 10.1039/C5RA15408A
[26] SCHMITT C, SANCHEZ C, DESOBRY-BANON S, et al. Structure and technofunctional properties of protein-polysaccharide complexes:A review[J]. Critical Reviews in Food Technology,1998,38(8):689−753. doi: 10.1080/10408699891274354
[27] ULLAH I, YIN T, XIONG S, et al. Effects of thermal pre-treatment on physicochemical properties of nano-sized okara (soybean residue) insoluble dietary fiber prepared by wet media milling[J]. Journal of Food Engineering,2018,237:18−26. doi: 10.1016/j.jfoodeng.2018.05.017
[28] YU C, TAN H. Study on crystal structures of enzyme-hydrolyzed cellulosic materials by X-ray diffraction[J]. Enzyme & Microbial Technology,2005,36(2-3):314−317.
[29] YE F, TAO B, LIU J, et al. Effect of micronization on the physicochemical properties of insoluble dietary fiber from citrus (Citrus junos Sieb. ex Tanaka) pomace[J]. Food Science and Technology International,2016,22(3):246−255. doi: 10.1177/1082013215593394
[30] CHEN H, ZHAO C, JIE L, et al. Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of lotus root[J]. LWT-Food Science and Technology,2018,93:203−211.
[31] YAN X, YE R, CHEN Y. Blasting extrusion processing:The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J]. Food Chemistry,2015,180:106−115. doi: 10.1016/j.foodchem.2015.01.127
[32] KAUSHIK A, SINGH M. Isolation and characterization of cellulose nanofibrils from wheat straw using steam explosion coupled with high shear homogenization[J]. Carbohydrate Research,2011,346(1):76−85. doi: 10.1016/j.carres.2010.10.020
[33] ALBA K, MACNAUGHTAN W, LAWS A P, et al. Fractionation and characterisation of dietary fibre from blackcurrant pomace[J]. Food Hydrocolloids,2018,81:398−408. doi: 10.1016/j.foodhyd.2018.03.023
[34] OUYANG H, GUO B, HU Y, et al. Effect of ultra-high pressure treatment on structural and functional properties of dietary fiber from pomelo fruitlets[J]. Food Bioscience,2023,52:102436. doi: 10.1016/j.fbio.2023.102436
[35] LOPEZ G, ROS G, RINCON F, et al. Relationship between physical and hydration properties of soluble and insoluble fiber of artichoke[J]. Journal of Agricultural & Food Chemistry,1996,44(9):2773−2778.
[36] PEERAJIT P, CHIEWCHAN N, DEVAHASTIN S. Effects of pretreatment methods on health-related functional properties of high dietary fibre powder from lime residues[J]. Food Chemistry,2012,132(4):1891−1898. doi: 10.1016/j.foodchem.2011.12.022
[37] BENITEZ V, MOLLA E, MARTIN-CABREJAS M A, et al. Physicochemical properties and in vitro antidiabetic potential of fibre concentrates from onion by-products[J]. Journal of Functional Foods,2017,36:34−42. doi: 10.1016/j.jff.2017.06.045
[38] ZHANG N, HUANG C, OU S. In vitro binding capacities of three dietary fibers and their mixture for four toxic elements, cholesterol, and bile acid[J]. Journal of Hazardous Materials,2011,186(1):236−239. doi: 10.1016/j.jhazmat.2010.10.120
[39] PALLAGI-KUNSTAR É, FARKAS K, MALETH J, et al. Bile acids inhibit Na+/H+ exchanger and Cl−/HCO3− exchanger activities via cellular energy breakdown and Ca2+ overload in human colonic crypts[J]. Pflügers Archiv-European Journal of Physiology,2015,467:1277−1290.
[40] MAEKYNEN K, JITSAARDKUL S, TACHASAMRAN P, et al. Cultivar variations in antioxidant and antihyperlipidemic properties of pomelo pulp (Citrus grandis L. Osbeck) in Thailand[J]. Food Chemistry,2013,139(1-4):735−743. doi: 10.1016/j.foodchem.2013.02.017





 下载:
下载:


 下载:
下载:
