Research Progress on Plant Polyphenols Regulating the Structure, Function, and Biological Characteristics of Dietary Proteins
-
摘要: 蛋白质是人体必需的营养素,植物多酚具有抗炎、抗氧化功效和改善蛋白质品质等特性,不同植物多酚由于其组成、结构不同导致其和蛋白质相互作用的机制和效果也不同。本文综述了近年来多酚对食源蛋白结构、功能、生物特性的影响规律。研究发现多酚与蛋白质之间的非共价相互作用力主要包括氢键、疏水作用力和静电相互作用力等,共价结合方式主要包括加热、碱性条件、酶促反应等。多酚与蛋白质相互作用多会破坏蛋白质二级结构,使α-螺旋结构含量减少、β-转角结构含量增加,引起蛋白三级结构解折叠,暴露出更多的蛋白质内部的疏水基团。多酚与蛋白质相互作用一方面容易引起蛋白部分亚基聚集,另一方面也会因为结合于特定的蛋白质亚基上形成小分子聚合物。多酚与蛋白质相互作用可以改善蛋白质的乳化性和起泡性,提高抗氧化性和消化性,降低致敏性等。本文同时对植物多酚调控蛋白质的研究中存在的问题、未来发展的方向进行了展望,旨在为研究植物多酚改善蛋白质品质提供参考。Abstract: Proteins are essential nutrients, while plant polyphenols exhibit beneficial properties such as anti-inflammatory, antioxidant, and protein quality-enhancing effects. The interaction between polyphenols and proteins varies based on the distinct compositions and structures of different polyphenols. This paper reviews recent studies on how polyphenols effect the structure, function, and biological properties of food proteins. Studies indicate that polyphenols interact with proteins through both non-covalent and covalent bonds. Non-covalent interactions primarily involve hydrogen bonding, hydrophobic forces, and electrostatic interactions. Covalent binding generally occurs under conditions such as heat, alkaline environments, or enzymatic reactions. These interactions typically disrupt the secondary structure of proteins, reducing the α-helical content while increasing β-sheet structures. This leads to the unfolding of the protein’s tertiary structure and the exposure of hydrophobic groups. As a result of these interactions, proteins can undergo both aggregation and polymerization. Polyphenols may cause certain protein subunits to aggregate, while also forming small molecular polymers by binding to specific subunits. These changes can improve the emulsification and foaming properties of proteins, enhance their antioxidant and digestive functions, and reduce their allergenicity. The paper concludes by discussing challenges and future directions for research on polyphenol-protein interactions, aiming to provide valuable insights into how plant polyphenols can be used to enhance protein quality.
-
Keywords:
- plant polyphenols /
- proteins /
- structure /
- functional characteristics /
- biological characteristics
-
近年来,由于社会的持续发展以及人们生活水平普遍提高,人们越来越关注饮食的健康,因此有益于人体健康的动植物蛋白产品在众多食品中脱颖而出。蛋白质广泛存在于奶制品、肉类、蛋类、谷物、豆类和油籽中,是由20种不同氨基酸相互连接而成的一种结构高度复杂的多聚体,具有多种重要功能特性,是人体六大营养素之一[1]。植物多酚作为次生代谢物,广泛分布于水果、蔬菜和草药的根、皮、叶、果实以及种子等组织中,是一种植物体内具有多个羟基的芳香族化合物,具有多种生物活性[2]。多酚与蛋白质可通过共价或非共价相互作用,使蛋白质二级结构、三级结构以及四级结构发生变化,从而影响蛋白质的功能特性,调节某些植物蛋白的消化吸收问题,降低蛋白质的致敏性,增强蛋白的抗氧化活性,从而延长食品的保质期,提高其营养价值。
由于植物多酚与蛋白质相互作用,可以改善蛋白质的功能特性和生物学特性,所以植物多酚和蛋白质相互作用的影响受到越来越多的学者关注[3]。例如绿原酸可与乳蛋白发生非共价相互作用,改善蛋白质溶解度、起泡能力和稳定性[4];表没食子儿茶素没食子酸酯通过疏水相互作用导致蛋白质原纤维的构象转变,从而增强大豆蛋白的稳定性、粘度和抗氧化活性[5];绿原酸、表没食子儿茶素没食子酸酯和阿魏酸通过非共价相互作用与麦胚蛋白结合,导致蛋白质的去折叠,氨基酸序列也变得无序,从而导致麦胚蛋白的发泡性和乳化性增强[6]。
本文基于近十年来有关植物多酚调控蛋白质功能特性及生物特性的研究,对不同种类植物多酚对蛋白质的影响进行了归纳总结,并对植物多酚与蛋白质相互作用对蛋白质的结构、功能特性以及生物特性的影响进行分析,旨在为研究植物多酚改善蛋白质品质提供参考。
1. 多酚对蛋白质结构的影响
近年来越来越多的学者研究多酚与蛋白质的相互作用,研究发现,多酚与蛋白质相互作用,能够引起蛋白质结构的改变[7]。且不同多酚对蛋白结构的作用效果及作用机制也存在显著差异。
1.1 多酚对蛋白质二级结构的影响
多酚与蛋白质的相互作用可能会破坏蛋白质有序二级结构,导致α-螺旋的解开或β-折叠的重组[8],这种结构上的变化会对蛋白质功能和生物学特性造成一定影响。Sui等[9]研究发现,花青素的添加会使大豆蛋白的β-折叠结构含量降低,并提高β-转角和无规卷曲结构含量,从而使大豆蛋白的乳化性及起泡性得到了改善。Shi等[10]研究发现,儿茶素与米糠分离蛋白作用后米糠蛋白的无规卷曲和β-反平行结构显著增加,α-螺旋结构略有增加,说明儿茶素的加入使米糠蛋白发生了解折叠和聚集。Dai等[11]研究发现,随着儿茶素浓度的增加,大豆蛋白的α-螺旋和β-折叠含量均显著降低,β-转角和无规卷曲均显著增加,这表明儿茶素的加入使大豆蛋白的内部结构松散,导致蛋白质发生解折叠,从而使蛋白质溶解性提高。Hao等[12]研究发现,豌豆蛋白与多酚(如:表没食子儿茶素没食子酸酯、绿原酸、白藜芦醇)反应后α-螺旋结构的含量降低,但是复合物中β-折叠结构和无规卷曲结构的含量增加,β-转角的含量变化不规律。这表明,豌豆蛋白和多酚之间的相互作用导致蛋白质二级结构展开,从而使蛋白质乳化性得到改善。Hasni等[7]发现牛奶中的α-和β-酪蛋白与茶多酚共价结合,会使蛋白质的α-螺旋和β-折叠结构含量明显降低,同时无规卷曲和β-转角含量增加,从而使蛋白质稳定性提升。Wang等[13]研究发现紫苏籽粕蛋白与原儿茶酸、没食子酸、咖啡酸、芹菜素、木犀草素的共价结合物中,除紫苏籽蛋白-原儿茶酸复合物外,其他的共价结合物的α-螺旋含量均降低,这可能是由于紫苏籽蛋白结构在碱性条件下长期偏离其等电点且发生不可逆地改变所致,同时发现紫苏籽蛋白与多酚的共价结合物的无规卷曲含量增加,这说明紫苏籽蛋白结构已经展开,蛋白质乳化性也得到了改善。
综上可知,多酚与蛋白质相互作用会改变蛋白质的二级结构,通常表现为α-螺旋含量降低,这可能是因为多酚与蛋白质相互作用,破坏了蛋白质分子表面的疏水性及氢键网络结构[14],然而,还有研究表明,多酚与蛋白质相互作用也可能会使α-螺旋结构含量增加,这可能是由于:一方面,多酚的浓度以及与蛋白质结合方式的不同引起的[15];另一方面,多酚与蛋白质可通过静电和疏水相互作用力结合引起的[16]。部分研究发现的由于多酚与蛋白质导致的β-转角含量增加,这可能是由于在蛋白质与多酚化合物反应过程中,氨基酸侧链与极性基团或带电基团结合,从而促进了β-转角的形成[17]。
1.2 多酚对蛋白质三级结构影响
蛋白质的三级结构是指其整体的三维构象,包括各个二级结构单元之间的空间排列和相互作用。多酚与蛋白质的结合可能导致蛋白质整体构象的改变,如折叠、伸展或扭曲等。这种构象变化不仅影响蛋白质的稳定性,还可能改变其与其他分子的结合能力,从而影响其生物学功能。Liu等[6]发现,麦胚蛋白在加入绿原酸、表没食子儿茶素没食子酸酯、阿魏酸等多酚后色氨酸和酪氨酸逐渐暴露在水中,而且随着多酚浓度的增加,麦胚蛋白的解折叠程度越强。还有研究发现通过荧光光谱分析,米糠蛋白-儿茶素复合物的荧光强度增加,这表明儿茶素诱导的蛋白质解折叠,暴露了米糠蛋白隐藏在分子内部的色氨酸/酪氨酸残基,致其溶解性增加[18]。Wang等[13]通过内源荧光光谱研究得出,紫苏籽蛋白与多酚相互作用,紫苏籽蛋白发生解折叠,蛋白质内部的色氨酸残基暴露到溶液中,酪氨酸是疏水氨基酸,所以在一定程度上降低了紫苏籽蛋白-多酚共价复合物的疏水性,提高了其溶解性。Xu等[19]和Xie等[20]通过荧光光谱分析发现,单宁酸、表儿茶素没食子酸酯、表没食子儿茶素没食子酸酯、没食子酸与猪肉肌原纤维蛋白相互作用,可以产生更亲水的色氨酸残基的微环境;而槲皮素、槲皮苷与猪肉肌原纤维蛋白相互作用,产生的微环境更为疏水,这主要是由于槲皮素和槲皮苷通过解折叠,暴露蛋白质内部的疏水氨基酸,并增加α-螺旋含量,在猪肉肌原纤维蛋白中产生更多的疏水位点,使其表面疏水性增加,溶解性降低。综上所述,多酚通常会引起蛋白三级结构解折叠,荧光强度增加,说明蛋白质内部的疏水基团暴露。
1.3 多酚对蛋白质四级结构的影响
蛋白质的四级结构描述的是由多条各自具有一、二、三级结构的肽链通过非共价键相互结合形成的复合蛋白质结构,这些非共价键主要包括疏水作用、氢键和离子键,其中疏水作用在维持四级结构中起着主要的作用。Dai等[11]研究发现,大豆蛋白与儿茶素之间会发生疏水相互作用,但是儿茶素的浓度对疏水相互作用基本没有影响,这是由于高浓度的儿茶素使大豆蛋白发生了聚集反应,抑制了儿茶素与大豆蛋白内部疏水基团之间的相互作用,使其表面疏水性降低,溶解性增加。Wang等[13]研究发现,紫苏籽蛋白与多酚相互作用导致小分子量的亚基含量增加,这可能是因为加入酚类物质导致蛋白质结构展开,使其溶解性增加。He等[21]研究发现花生蛋白-表没食子儿茶素没食子酸酯和花生蛋白-绿原酸缀合物中70、40和22 kDa处的蛋白条带略微上移,这表明花生蛋白与绿原酸、表没食子儿茶素没食子酸酯的共价结合提高了PPE的分子量,而且70、40和22 kDa处的条带变得更薄和更浅,花生蛋白-表没食子儿茶素没食子酸酯和花生蛋白-绿原酸结合物中的33 kDa和95 kDa条带消失,出现了两个新的大于130 kDa的大分子量条带,表明花生蛋白与表没食子儿茶素没食子酸酯和绿原酸的共价结合使花生蛋白发生交联反应。总体上看,多酚会从两个方面对蛋白四级结构产生影响,一方面容易引起蛋白部分亚基聚集,另一方面也会因为结合于特定的蛋白质亚基上,形成小分子聚合物。
2. 多酚与蛋白相互作用研究
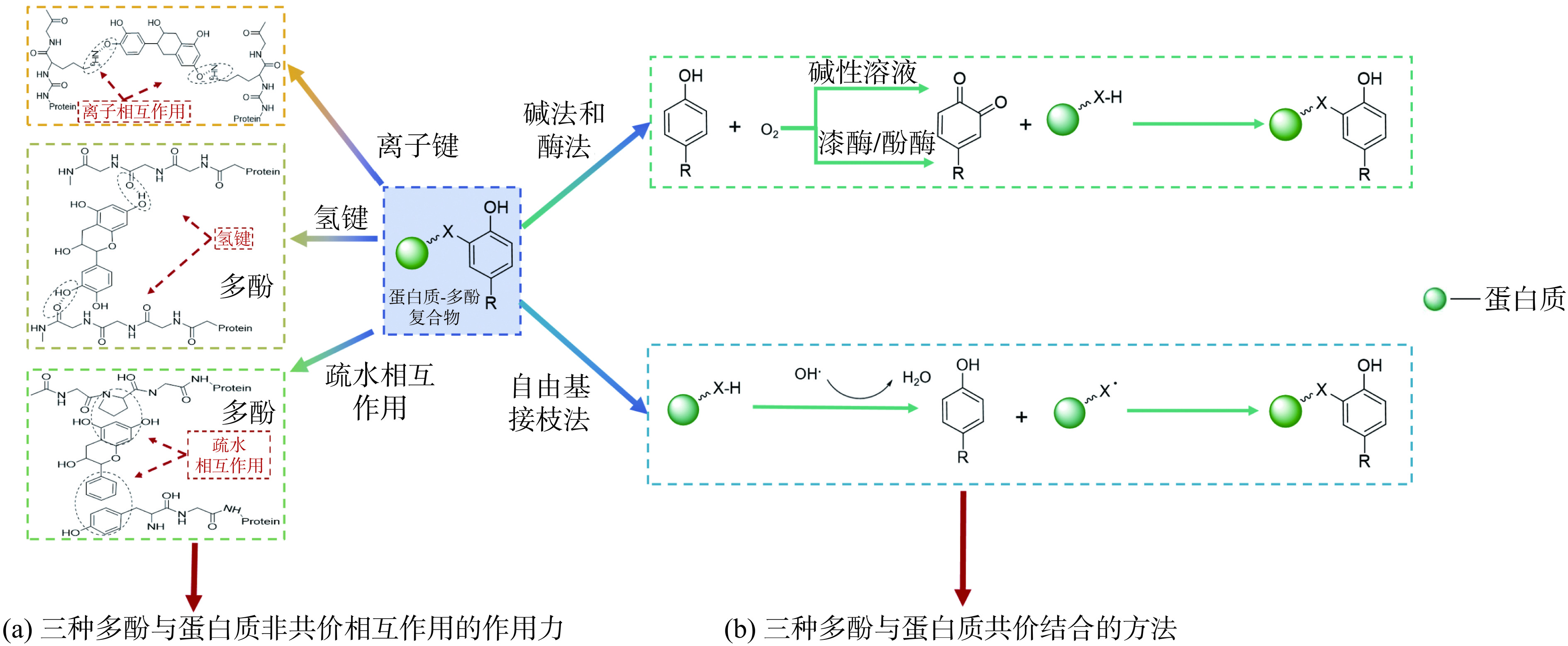
由于蛋白质和多酚的不同,多酚与蛋白质的相互作用存在差异,可按作用种类分为非共价作用和共价作用,通常非共价相互作用是多酚与蛋白质之间的主要作用力。图1是多酚与蛋白质非共价及共价作用的作用机制图。
2.1 非共价相互作用
多酚与植物蛋白的非共价相互作用是十分常见的,主要包括氢键、疏水作用和静电相互作用[22−24],其中以疏水作用力和氢键为主要作用力[25]。疏水相互作用发生在蛋白质疏水位点与多酚的非极性芳香环之间(如:脯氨酸残基的吡咯环和亮氨酸、赖氨酸或脯氨酸等氨基酸的非极性侧链)[23]。氢键是由酚类物质中酚羟基与蛋白质侧链中的C=O、羟基、氨基等基团发生作用而形成的,在蛋白质-多酚复合物中起稳定结构的作用[26],如阿魏酸中酚羟基与牛血清白蛋白多肽链中的C、H、NH发生作用生成作用较强的氢键[27];表没食子儿茶素没食子酸酯与大豆分离蛋白主要通过疏水相互作用和氢键相互作用,多酚充当聚合蛋白质分子的“桥梁”,使蛋白质发生交联[22,28]。绿原酸与脱色青稞总蛋白中的疏水性氨基酸通过疏水相互作用力发生了结合,使溶解性增加[14]。还有研究表明,槲皮素和芒果苷与肌球蛋白相互作用时产生了范德华力,范德华力可同时协助氢键改善蛋白质构象及凝胶特性等生理特性[29−30]。多酚化合物的羟基和苯环结构与蛋白质发生非共价相互作用,从而改变了蛋白质的相关特性。
2.2 共价相互作用
加热、碱性条件、酶促反应等均能诱导蛋白质与酚类物质发生共价结合,而且共价结合不可逆且比非共价结合更稳定[31]。多酚的双酚基活性较高,可经由酶促及分子氧氧化反应生成邻醌或半醌,并进一步与多肽的氨基或巯基侧链反应形成共价化合物[32]。
蛋白质-多酚的共价结合的方法主要有3种,分别是:碱法、自由基接枝法和酶催化法。其中碱性反应是指酚类物质在碱性且有氧的条件下,酚类物质极易被氧化成半醌或醌,而与蛋白质侧链中的色氨酸、半胱氨酸、蛋氨酸和赖氨酸等亲核氨基酸残基反应生成C-N或C-S等化学键,发生共价交联[31]。自由基接枝法通常是利用过氧化氢或抗坏血酸诱导酚类物质氧化成醌,再与蛋白质发生相互作用,该方法操作简单,是制备多酚-蛋白质复合物的有效方法[33],如:卵清蛋白与儿茶素、表没食子酸儿茶酸、表没食子儿茶素没食子酸酯等通过自由基接枝法共价相互作用,从而改善了蛋白质的抗氧化活性[34]。酶催化法的条件温和,特异性高,但步骤繁琐,价格昂贵,其主要是利用酚酶将酚类物质氧化为邻二酚,再使用多酚氧化酶、漆酶或酪氨酸酶等酶制剂将邻二酚氧化为邻醌,与蛋白质的亲核残基发生共价结合[35],如花生蛋白与茶多酚在酪氨酸酶和漆酶作用下形成共价复合物,从而改善了蛋白质的溶解性和消化性[36]。
3. 多酚对蛋白质功能特性的影响
蛋白质与酚类物质相互作用可引起蛋白质乳化性和乳化稳定性、凝胶性、溶解性、起泡性和泡沫稳定性等功能特性的变化,表1总结了代表性多酚与蛋白质相互作用对蛋白质功能特性的影响。
表 1 多酚对蛋白质功能特性的影响Table 1. Effects of polyphenols on protein functional characteristics多酚 蛋白质 功能特性变化 作用机制 参考文献 花青素 大米蛋白 溶解性增强 天然蛋白质的内部基团部分解折叠,为蛋白质颗粒提供暴露面积 [46] 乳化性提高 内部基团部分解折叠,增大了暴露面积,稳定泡沫 起泡性增强 界面膜的结构改变和稳定性增强 大豆分离蛋白 乳化性提高 蛋白质与花青素相互作用后界面膜的结构改变和稳定性增强 [9] 起泡性增强 与大豆分离蛋白的相互作用改变了蛋白质膜的界面性质,并导致在气液表面形成具有增强弹性的稳定界面膜,从而使起泡性增强 乳铁蛋白 起泡性增强 花青素与乳铁蛋白的结合导致α-螺旋减少,而β-折叠和无规卷曲含量增加,导致起泡性改善 [45] 儿茶素 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对油水界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 花生蛋白 乳化性提高 三级结构稳定性降低,表面疏水性和分子柔性增加 [21] 大豆蛋白 乳化性提高 降低了豌豆蛋白的疏水性,使多肽链膨胀,豌豆蛋白结构松散 [27] 紫苏籽粕蛋白 乳化性提高 在一定程度上增加了蛋白质液滴之间的空间位阻和静电排斥作用,从而降低了油水界面的界面张力,防止了液滴聚集 [13] 溶解性提高 可能是由于多酚对用于结合的疏水氨基酸进行了修饰,从而降低了表面疏水性,提高了溶解性 猪肉肌原纤维蛋白 凝胶性下降 儿茶素促进蛋白交联能力过强,导致凝胶结构与品质易受到不同程度的损害 [43] 绿原酸 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对水油界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 花生蛋白 乳化性提高 三级结构稳定性降低,表面疏水性和分子柔性增加 [21] 小麦胚芽蛋白 溶解性提高 多酚与小麦胚芽蛋白结合,降低了小麦胚芽蛋白表面的疏水性,从而改善了蛋白质的溶解性 [6] 原儿茶酸 紫苏籽粕蛋白 乳化性提高 无规卷曲含量增多,而且降低了油水界面的界面张力,防止了液滴聚集 [13] 白藜芦醇 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对油水界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 芦丁 豌豆蛋白 乳化性提高 芦丁与豌豆蛋白相互作用,导致豌豆蛋白多肽链膨胀,结构松散,而且豌豆蛋白的亲水性和亲脂性的平衡使乳液体系更稳定 [12] 单宁酸 鱼肉肌原纤维蛋白 凝胶性增强 蛋白之间交联聚集程度增加 [47] 猪肉肌原纤维蛋白 凝胶性增强 尚不明确 [19] 槲皮苷 猪原纤维蛋白 凝胶性降低 槲皮苷-猪原纤维蛋白具有螺旋结构含量高,猪原纤维蛋白活性中心较少 溶解性降低 α-螺旋含量增加,导致肌原纤维蛋白表面疏水性增强,导致溶解性降低 [21] 3.1 乳化性和乳化稳定性
蛋白质的乳化活性取决于其在油滴周围形成吸附膜和降低油-水界面张力的能力。研究发现,多酚与蛋白质相互作用可使芳香残基增加,使蛋白质对油-水界面的亲和力更高,并降低了界面张力,提高其乳化性[37]。Hao等[12]研究发现,豌豆分离蛋白与多酚的复合物,其中包括豌豆蛋白-表没食子儿茶素没食子酸酯、豌豆蛋白-绿原酸和豌豆蛋白-白藜芦醇复合物的乳化性均高于单独豌豆分离蛋白,乳化稳定性也有所增加,这说明豌豆蛋白-表没食子儿茶素没食子酸酯、豌豆蛋白-绿原酸和豌豆分离蛋白-白藜芦醇复合物的乳化活性和乳化稳定性高于单独豌豆分离蛋白;Chen等[38]通过研究芦丁、儿茶素与大豆蛋白相互作用,发现其改善了大豆蛋白的乳化特性;Tian等[27]和Fu等[34]研究发现,黄酮类化合物的加入,降低了豌豆蛋白的疏水性,这主要是由于多酚与豌豆蛋白相互作用,使豌豆蛋白结构变得松散,从而提高了蛋白质乳液的稳定性。
另有研究发现,蛋白-多酚复合乳液表面蛋白质的吸水性增强,油滴在水相中分布更加稳定,不易聚集成大颗粒,从而增强了乳液的稳定性。Chen等[39]研究发现,卵白蛋白-单宁酸复合物的乳化性有所降低,但是其乳化稳定性显著增强。部分研究发现,紫苏籽蛋白-多酚复合物的乳化性和乳化稳定性均显著高于紫苏籽粕蛋白,这可能是因为多酚的加入改变了蛋白质之间的相互作用,在一定程度上增加了蛋白质液滴之间的空间位阻和静电排斥作用,从而降低了油水界面的界面张力,防止了液滴聚集,而且紫苏籽蛋白-原儿茶酸无规卷曲含量增多,乳化性和乳化稳定性也增强[13]。He等[21]研究发现花生蛋白与绿原酸、表没食子儿茶素没食子酸酯存在较强的相互作用,其复合物的乳化性和乳化稳定性均有改善,这是因为花生蛋白与绿原酸和表没食子儿茶素没食子酸酯相互作用后的三级结构稳定性降低,表面疏水性和分子柔性增加。综上可知,多酚与蛋白质相互作用通常会导致蛋白质分子内部结构部分展开,使蛋白质分子内部的疏水性残基暴露在蛋白质表面,从而使蛋白质分子迅速吸附至界面、降低界面张力,形成稳定且弹性强的界面膜,最终改善了蛋白质的乳化性[14]。
3.2 凝胶性
多酚对蛋白质凝胶性的影响主要体现在凝胶形成时间、凝胶强度、凝胶硬度和凝胶水分保持能力等方面,这种影响不仅与多酚的种类有关,还与多酚的浓度以及蛋白质的性质密切相关。研究发现,多酚与蛋白质相互作用,通常会发生交联聚集,从而改善了蛋白质的凝胶性。Xu等[19]、Li等[40]和Zhao等[41]研究发现用单宁酸、没食子酸和表儿茶素没食子酸酯处理的肌原纤维蛋白凝胶样品表现出硬度、弹性、胶粘性和持水性增加;单宁酸、没食子酸和表儿茶素没食子酸酯可以改善肌原纤维蛋白凝胶性质,很可能是因为酚类化合物可以诱导更多未折叠的肌原纤维蛋白结构,这暴露了更多有助于凝胶形成的活性位点。氧化的没食子酸可以通过促进巯基向二硫键的转化和多肽链之间的连接,增强肌原纤维蛋白的凝胶性质。Nie等[42]在鱼肉肌原纤维蛋白中添加了单宁类物质(单宁酸与原花青素),发现蛋白之间的交联聚集程度增加,因此可用来制得高强度、低透性的凝胶可食用膜。但部分研究也发现,多酚可能会对蛋白凝胶特性产生不利的影响,例如Jia等[43]发现在有氧条件下,添加儿茶素会导致猪肉肌原纤维蛋白发生聚集,使得蛋白凝胶的强度、流变特性和保水性均下降,而且在儿茶素用量超过50 μmol/g时,蛋白会失去形成凝胶的能力。
3.3 溶解性
蛋白质的溶解性是蛋白质在食品中发挥功能特性的重要影响因素,酚类化合物与蛋白质的相互作用可以使蛋白质发生交联,这些相互作用会改变蛋白质分子的净电荷,进而影响蛋白质的溶解度。Liu等[6]研究发现,绿原酸的添加使麦胚蛋白的溶解度显著增加,在25~150 μmol/g蛋白质范围内,随着多酚浓度的增加,麦胚蛋白的溶解度也得到显著改善,这是因为多酚与麦胚蛋白结合降低了蛋白质表面的疏水性,从而改善了蛋白质的溶解性。Wang等[13]研究发现紫苏籽蛋白与多酚共价结合,其共价缀合物的溶解性提高,这可能是由于多酚对用于结合的疏水氨基酸进行了修饰,从而降低了表面疏水性,提高了溶解性。He等[21]也有相同的研究结果,花生蛋白和表没食子儿茶素没食子酸酯、绿原酸形成的复合物溶解度略有增加。通常多酚可以改善蛋白质的溶解性,但是有些研究表明,多酚也可能会降低蛋白质 溶解性,Xu等[19]研究发现槲皮素和槲皮苷与猪肉肌原纤维蛋白相互作用使其α-螺旋含量增加,而且发现α-螺旋含量与肌原纤维蛋白的表面疏水性成正比,说明槲皮素和槲皮苷可以使猪肉肌原纤维蛋白表面疏水性增强,导致溶解性降低。
3.4 起泡性和起泡稳定性
蛋白质的起泡性和起泡稳定性对面包、蛋糕等食品的加工影响较大,这与其自身结构密切相关,同时也会收到外部因素的影响(如:温度、pH、蛋白质的分子量和其他组分等)。多酚与蛋白质相互作用会改变蛋白质二级结构,从而改善蛋白质起泡特性。还有研究证明,蛋白质-多酚复合物可以增加空气/水表面的弹性,从而增加气泡在融合、收缩或膨胀时的稳定性[44]。Hao等[12]发现,多酚-豌豆蛋白复合物的起泡性和泡沫稳定性高于单独的豌豆蛋白。这可能是因为多酚类物质与蛋白质相互作用,使β-折叠及无规卷曲含量增加,导致蛋白质表面弹性增加,从而改善了蛋白质的起泡性。Li等[45]研究发现,花青素与乳铁蛋白的结合导致α-螺旋减少,而β-折叠和无规卷曲含量增加,使蛋白质气-液界面弹性增加,从而增加了气泡合并、收缩或膨胀的稳定性进而改善了该蛋白质起泡特性。
4. 多酚对蛋白质生物学特性的影响
4.1 抗氧化性
多酚作为一种强效的抗氧化剂,可以有效地清除自由基、抑制氧化应激反应,保护植物蛋白免受氧化损伤,从而延长食品的保质期和提高其营养价值[48]。通常,与具有较少羟基的酚类相比,具有高含量活性羟基的多酚,如表没食子儿茶素没食子酸酯与蛋白质互作能够产生具有更高抗氧化活性的蛋白质复合物和缀合物[49]。例如He等[21]研究证明,花生蛋白与绿原酸和表没食子儿茶素没食子酸酯的偶联增强了花生蛋白的抗氧化活性。王晨雨等[50]研究发现,游离原儿茶酸、卵白蛋白和原儿茶酸-卵白蛋白复合物均呈现出ABTS+自由基清除活性,且清除能力随浓度增加而增强;在相同浓度下,原儿茶酸-卵白蛋白复合物的抗氧化活性明显增强。Wang等[13]通过DPPH自由基清除实验研究发现,紫苏籽蛋白与多酚反应可以增强其抗氧化能力,其中原因是醌类化合物可以通过与自由基的加成或反加成反应生成半醌和醌自由基,由于不成对电子的存在,半醌和醌自由基阻碍自由基,然后与苯环共轭产生空间位阻,从而起到清除自由基的作用。还有学者证明多酚类物质的羟基具有优异的转移氢原子和电子的能力,可以清除自由基,从而抑制羰基和二酪氨酸的形成,以防止肌原纤维蛋白氧化[19]。
4.2 消化性
有研究表明,植物蛋白的消化率(75%~80%)通常低于动物蛋白的消化率(90%~95%),主要是由于植物中存在某些抗营养因子、不易消化的细胞壁,而且植物蛋白质结构特殊,与动物蛋白质结构有一定的差异[51]。研究表明,多酚与植物蛋白的结合可能改善蛋白的消化性,这主要是由于多酚与蛋白质结合后,蛋白质结构发生解折叠。Hao等[12]研究发现,豌豆蛋白与表没食子儿茶素没食子酸酯、绿原酸和白芦藜醇结合后,促进了蛋白质的水解,有利于蛋白质的消化。Zhao等[23]通过体外消化模拟实验研究发现,单宁酸与酪蛋白相互作用,降低了蛋白质的水解度,从而推断出单宁酸-酪蛋白复合物的形成抑制了消化酶对蛋白质的水解作用,导致蛋白质消化率下降。Rawel等[52]研究发现,绿原酸与牛血清蛋白结合,破坏了牛血清蛋白中必需氨基酸的结构,抑制了胰蛋白酶和胃蛋白酶的活性,从而使蛋白质消化率下降。相反,有研究表明,多酚与蛋白质相互作用可以使蛋白质消化率提升,如:绿原酸、花青素、儿茶素、可使大豆蛋白、酪蛋白、花生蛋白的消化率提高,这可能是由于多酚类物质与蛋白质相互作用,可使蛋白质结构展开,溶解性提高,从而导致与蛋白酶的结合位点增多[53−56]。
4.3 降低致敏性
蛋白质过敏是指人体免疫系统对某些蛋白质成分产生异常反应。常见的易致敏的蛋白质有花生蛋白、大豆蛋白、酪蛋白、乳清蛋白、核桃蛋白、β-乳球蛋白等[57]。近年来有较多的学者研究证明多酚可以降低蛋白质的致敏性,He等[21]通过体外和体内实验研究证明,花生蛋白与表没食子儿茶素没食子酸酯、绿原酸相互作用显著降低了花生过敏原的致敏性,但是目前尚不清楚多酚影响花生蛋白的致敏性的机制,还有待研究。Ma等[58]通过动物实验研究发现表没食子儿茶素没食子酸酯、槲皮素、阿魏酸和白藜芦醇与核桃蛋白的共价结合可能通过促进细胞因子Th 1/Th 2和Treg/Th 17平衡,减轻过敏性屏障损伤,从而减轻核桃蛋白的致敏性。韩玥颖等[59]研究发现,马尾藻多酚与虾原肌球蛋白相互作用可改变蛋白质的三级结构,并通过体外研究发现,其结合位点可能位于抗原表位,从而降低了虾原肌球蛋白的致敏性。
5. 结论与展望
目前,人们已经对多酚与蛋白质的作用机制以及对多酚调控蛋白质功能特性、生物学特性进行了较为深入的研究。其中关于酚酸类以及黄酮类多酚与蛋白质相互作用的研究更为广泛,芪类多酚及木酚素调控蛋白的研究较少。多酚调控蛋白质的品质特性主要是通过改变蛋白质的高级结构,从而改变蛋白质的功能特性及生物学特性。在食品领域中,多酚作为一种天然的营养物质,研究其与蛋白质的相互作用有助于提高蛋白质的营养价值及利用率。
然而,目前更多的研究集中于天然多酚对蛋白质的调控作用,但是对于多酚影响蛋白质营养功能的研究较少,可以利用分子对接、体内及体外模拟方法研究多酚对蛋白质营养功能的影响,从而可以提高其在食品、医学及生物等领域的应用。而且多酚与蛋白质相互作用涉及到多个学科及领域,每个学科和领域研究的研究重点不同,未来需要加强不同学科之间的交叉融合,更深入的研究多酚与蛋白质的相互作用机制,共同推进多酚与蛋白质研究的发展。
-
表 1 多酚对蛋白质功能特性的影响
Table 1 Effects of polyphenols on protein functional characteristics
多酚 蛋白质 功能特性变化 作用机制 参考文献 花青素 大米蛋白 溶解性增强 天然蛋白质的内部基团部分解折叠,为蛋白质颗粒提供暴露面积 [46] 乳化性提高 内部基团部分解折叠,增大了暴露面积,稳定泡沫 起泡性增强 界面膜的结构改变和稳定性增强 大豆分离蛋白 乳化性提高 蛋白质与花青素相互作用后界面膜的结构改变和稳定性增强 [9] 起泡性增强 与大豆分离蛋白的相互作用改变了蛋白质膜的界面性质,并导致在气液表面形成具有增强弹性的稳定界面膜,从而使起泡性增强 乳铁蛋白 起泡性增强 花青素与乳铁蛋白的结合导致α-螺旋减少,而β-折叠和无规卷曲含量增加,导致起泡性改善 [45] 儿茶素 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对油水界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 花生蛋白 乳化性提高 三级结构稳定性降低,表面疏水性和分子柔性增加 [21] 大豆蛋白 乳化性提高 降低了豌豆蛋白的疏水性,使多肽链膨胀,豌豆蛋白结构松散 [27] 紫苏籽粕蛋白 乳化性提高 在一定程度上增加了蛋白质液滴之间的空间位阻和静电排斥作用,从而降低了油水界面的界面张力,防止了液滴聚集 [13] 溶解性提高 可能是由于多酚对用于结合的疏水氨基酸进行了修饰,从而降低了表面疏水性,提高了溶解性 猪肉肌原纤维蛋白 凝胶性下降 儿茶素促进蛋白交联能力过强,导致凝胶结构与品质易受到不同程度的损害 [43] 绿原酸 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对水油界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 花生蛋白 乳化性提高 三级结构稳定性降低,表面疏水性和分子柔性增加 [21] 小麦胚芽蛋白 溶解性提高 多酚与小麦胚芽蛋白结合,降低了小麦胚芽蛋白表面的疏水性,从而改善了蛋白质的溶解性 [6] 原儿茶酸 紫苏籽粕蛋白 乳化性提高 无规卷曲含量增多,而且降低了油水界面的界面张力,防止了液滴聚集 [13] 白藜芦醇 豌豆分离蛋白 乳化性提高 芳香族氨基酸残基暴露,造成蛋白质对油水界面的亲和力更高,并降低了界面张力 [12] 起泡性增强 蛋白质的部分解折叠可以改善其发泡性能 [9,12] 芦丁 豌豆蛋白 乳化性提高 芦丁与豌豆蛋白相互作用,导致豌豆蛋白多肽链膨胀,结构松散,而且豌豆蛋白的亲水性和亲脂性的平衡使乳液体系更稳定 [12] 单宁酸 鱼肉肌原纤维蛋白 凝胶性增强 蛋白之间交联聚集程度增加 [47] 猪肉肌原纤维蛋白 凝胶性增强 尚不明确 [19] 槲皮苷 猪原纤维蛋白 凝胶性降低 槲皮苷-猪原纤维蛋白具有螺旋结构含量高,猪原纤维蛋白活性中心较少 溶解性降低 α-螺旋含量增加,导致肌原纤维蛋白表面疏水性增强,导致溶解性降低 [21] -
[1] OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International,2013,51(2):954−970. doi: 10.1016/j.foodres.2013.02.009
[2] 郝霄鹏. 植物多酚的提取工艺、生物学功能及其在动物生产中应用的研究进展[J]. 饲料研究,2021,44(23):153−156. [HAO X P. Research progress on extraction process, biological function and application of plant polyphenols in animal production[J]. Feed Research,2021,44(23):153−156.] HAO X P. Research progress on extraction process, biological function and application of plant polyphenols in animal production[J]. Feed Research, 2021, 44(23): 153−156.
[3] CHENG J R, ZHU M J, LIU X M. Insight into the conformational and functional properties of myofibrillar protein modified by mulberry polyphenols[J]. Food Chemistry,2020,308:125592. doi: 10.1016/j.foodchem.2019.125592
[4] JIANG J, ZHANG Z P, ZHAO J, et al. The effect of non-covalent interaction of chlorogenic acid with whey protein and casein on physicochemical and radical-scavenging activity of in vitro protein digests[J]. Food Chemistry,2018,268:334−341. doi: 10.1016/j.foodchem.2018.06.015
[5] TONG X H, CAO J, TIAN T, et al. Changes in structure , rheological property and antioxidant activity of soy protein isolate fibrils by ultrasound pretreatment and EGCG[J]. Food Hydrocolloids, 2022, 122:107084.
[6] LIU J, ZHANG Y M, LIU J Y, et al. Effect of non-covalently bound polyphenols on the structural and functional properties of wheat germ protein[J]. Food Hydrocolloids,2024,149:109534. doi: 10.1016/j.foodhyd.2023.109534
[7] HASNI I, BOURASSA P, HAMDANI S, et al. Interaction of milk α- and β-caseins with tea polyphenols[J]. Food Chemistry,2011,126(2):630−639. doi: 10.1016/j.foodchem.2010.11.087
[8] 王远利, 康心蕊, 陶亮, 等. 蛋白质与多酚的互作机制及其应用[J]. 中国食品学报,2024,24(2):357−372. [WANG Y L, KANG X R, TAO L, et al. The interaction mechanism between protein and polyphenol and its application[J]. Journal of Chinese Institute of Food Science and Technology,2024,24(2):357−372.] WANG Y L, KANG X R, TAO L, et al. The interaction mechanism between protein and polyphenol and its application[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(2): 357−372.
[9] SUI X N, SUN H B, QI B K, et al. Functional and conformational changes to soy proteins accompanying anthocyanins:Focus on covalent and non-covalent interactions[J]. Food Chemistry,2018,245:871−878. doi: 10.1016/j.foodchem.2017.11.090
[10] SHI M, HUANG L Y, NIE N, et al. Binding of tea catechins to rice bran protein isolate :Interaction and protective effect during in vitro digestion[J]. Food Research International, 2017, 93:1-7.
[11] DAI S C, LIAN Z T, QI W J, et al. Non-covalent interaction of soy protein isolate and catechin:Mechanism and effects on protein conformation[J]. Food Chemistry,2022,384:132507. doi: 10.1016/j.foodchem.2022.132507
[12] HAO L L, SUN J W, PEI M Q, et al. Impact of non-covalent bound polyphenols on conformational, functional properties and in vitro digestibility of pea protein[J]. Food Chemistry,2022,383:132623. doi: 10.1016/j.foodchem.2022.132623
[13] WANG D, LI H, HOU T Y, et al. Effects of conjugated interactions between Perilla seed meal proteins and different polyphenols on the structural and functional properties of proteins[J]. Food Chemistry,2024,433:137345. doi: 10.1016/j.foodchem.2023.137345
[14] 杜艳. 青稞蛋白-多酚相互作用机制及复合物应用研究[D]. 无锡:江南大学, 2023. [DU Y. The interaction mechanism of highland barley proteins-polyphenols and the application of its complexes[D]. Wuxi:Jiangnan University, 2023.] DU Y. The interaction mechanism of highland barley proteins-polyphenols and the application of its complexes[D]. Wuxi: Jiangnan University, 2023.
[15] KANAKIS C D, HASNI I, BOURASSA P, et al. Milk β-lactoglobulin complexes with tea polyphenols[J]. Food Chemistry,2011,127(3):1046−1055. doi: 10.1016/j.foodchem.2011.01.079
[16] SHEN H, ZHAO M M, SUN W Z. Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J]. Food Chemistry,2019,287:93−99. doi: 10.1016/j.foodchem.2019.02.060
[17] YANG C, WANG B Y, WANG J M, et al. Effect of pyrogallic acid (1, 2, 3-benzenetriol) polyphenol-protein covalent conjugation reaction degree on structure and antioxidant properties of pumpkin (Cucurbita sp.) seed protein isolate[J]. Food Science and Technology,2019,109:443−449.
[18] LIU H T, HAN G, ZHANG H, et al. Improving the physical and oxidative stability of emulsions based on the interfacial electrostatic effects between porcine bone protein hydrolysates and porcine bone protein hydrolysate-rutin conjugates[J]. Food Hydrocolloids,2019,94:418−427. doi: 10.1016/j.foodhyd.2019.03.037
[19] XU Q D, YU Z L, ZENG W C. Structural and functional modifications of myofibrillar protein by natural phenolic compounds and their application in pork meatball[J]. Food Research International,2021,148:110593. doi: 10.1016/j.foodres.2021.110593
[20] XIE W L, HUANG Y, XIANG Y Z, et al. Insights into the binding mechanism of polyphenols and fish myofibrillar proteins explored using multi-spectroscopic methods[J]. Food and Bioprocess Technology,2020,13(5):797−806. doi: 10.1007/s11947-020-02439-4
[21] HE W Y, HE K, LIU X Y, et al. Modulating the allergenicity and functional properties of peanut protein by covalent conjugation with polyphenols[J]. Food Chemistry,2023,415:135733. doi: 10.1016/j.foodchem.2023.135733
[22] ZHOU S D, LIN Y F, XU X, et al. Effect of non-covalent and covalent complexation of (-)- epigallocatechin gallate with soybean protein isolate on protein structure and in vitro digestion characteristics[J]. Food Chemistry,2020,309:125718. doi: 10.1016/j.foodchem.2019.125718
[23] ZHAO Q, YU X J, ZHOU C S, et al. Effects of collagen and casein with phenolic compounds interactions on protein in vitro digestion and antioxidation[J]. Food Science and Technology,2020,124:109192.
[24] SUN X, SARTESHNIZI R A, UDENIGWE C C. Recent advances in protein-polyphenol interactions focusing on structural properties related to antioxidant activities[J]. Current Opinion in Food Science,2022,45:109192.
[25] LIN D R, XIAO L J, WEN Y, et al. Comparison of apple polyphenol-gelatin binary complex and apple polyphenol-gelatin-pectin ternary complex:Antioxidant and structural characterization[J]. Food Science and Technology,2021,148:111740.
[26] YE J P, DENG L P, WANG Y R, et al. Impact of rutin on the foaming properties of soybean protein:Formation and characterization of flavonoid-protein complexes[J]. Food Chemistry,2021,362:130238. doi: 10.1016/j.foodchem.2021.130238
[27] TIAN L, YANG K J, ZHANG S L, et al. Impact of tea polyphenols on the stability of oil-in-water emulsions coated by whey proteins[J]. Food Chemistry,2021,343:128448. doi: 10.1016/j.foodchem.2020.128448
[28] JAKOBEK L. Interactions of polyphenols with carbohydrates, lipids and proteins[J]. Food Chemistry,2015,175:556−567. doi: 10.1016/j.foodchem.2014.12.013
[29] LÜ Y F, LIANG Q Q, LI Y, et al. Study on the interactions between the screened polyphenols and Penaeus vannamei myosin after freezing treatment[J]. International Journal of Biological Macromolecules,2022,217:701−713. doi: 10.1016/j.ijbiomac.2022.07.088
[30] CHARLTON A J, BAXTER N J, KHAN M L, et al. Polyphenol/peptide binding and precipitation[J]. Journal of Agricultural and Food Chemistry,2002,50(6):1593−1601. doi: 10.1021/jf010897z
[31] QUAN T H, BENJAKUL S, SAE-LEAW T, et al. Protein-polyphenol conjugates:Antioxidant property, functionalities and their applications[J]. Trends in Food Science & Technology, 2019, 91:507-517.
[32] 陈晓玲, 管维良, 施佩影, 等. 谷物醇溶蛋白与植物多酚的互作机理及应用研究进展[J]. 食品科学,2022,43(17):353−361. [CHEN X L, GUAN W L, SHI P Y, et al. Review on recent progress in the mechanism and application of interaction between prolamins and polyphenols[J]. Food Science,2022,43(17):353−361.] doi: 10.7506/spkx1002-6630-20210506-037 CHEN X L, GUAN W L, SHI P Y, et al. Review on recent progress in the mechanism and application of interaction between prolamins and polyphenols[J]. Food Science, 2022, 43(17): 353−361. doi: 10.7506/spkx1002-6630-20210506-037
[33] 孟甘露, 楚玉南, 吴仪, 等. 自由基法多酚共价结合对大豆蛋白基乳液凝胶特性的影响[J]. 食品科学,2024,45(1):23−31. [MENG G L, CHU Y N, WU Y, et al. Effect of covalent conjugation with polyphenols by free radical method on gel properties of soybean protein-stabilized emulsion[J]. Food Science,2024,45(1):23−31.] doi: 10.7506/spkx1002-6630-20230327-252 MENG G L, CHU Y N, WU Y, et al. Effect of covalent conjugation with polyphenols by free radical method on gel properties of soybean protein-stabilized emulsion[J]. Food Science, 2024, 45(1): 23−31. doi: 10.7506/spkx1002-6630-20230327-252
[34] FU M, GENG Q, CHEN J, et al. Pea protein-quercetin glycoside complexes:Interaction, foaming and emulsifying properties[J]. Journal of Molecular Liquids,2023,386:122487. doi: 10.1016/j.molliq.2023.122487
[35] 赵钜阳, 袁惠萍, 孙昕萌. 蛋白质-多酚复合物的形成机制及其功能性变化研究进展[J]. 食品工业科技,2022,43(8):416−425. [ZHAO J Y, YUAN H P, SUN X M. A systematic review for the formation mechanism, functional properties of protein-polyphenol compounds[J]. Science and Technology of Food Industry,2022,43(8):416−425.] ZHAO J Y, YUAN H P, SUN X M. A systematic review for the formation mechanism, functional properties of protein-polyphenol compounds[J]. Science and Technology of Food Industry, 2022, 43(8): 416−425.
[36] VELICKOVIC T D C, STANIC-VUCINIC D J. The role of dietary phenolic compounds in protein digestion and processing technologies to improve their antinutritive properties[J]. Comprehensive Reviews in Food Science and Food Safety,2018,17(1):82−103. doi: 10.1111/1541-4337.12320
[37] JIA Z B, ZHENG M, TAO F, et al. Effect of covalent modification by (-)- epigallocatechin-3-gallate on physicochemical and functional properties of whey protein isolate[J]. Food Science and Technology,2016,66:305−310.
[38] CHEN G, WANG S T, FENG B, et al. Interaction between soybean protein and tea polyphenols under high pressure[J]. Food Chemistry,2019,277:632−638. doi: 10.1016/j.foodchem.2018.11.024
[39] CHEN Y, HU J, YI X Z, et al. Interactions and emulsifying properties of ovalbumin with tannic acid[J]. Food Science and Technology,2018,95:282−288.
[40] LI J L, MUNIR S, YU X Y, et al. Double-crosslinked effect of TGase and EGCG on myofibrillar proteins gel based on physicochemical properties and molecular docking[J]. Food Chemistry,2021,345:128655. doi: 10.1016/j.foodchem.2020.128655
[41] ZHAO X, XU X, ZHOU G. Covalent chemical modification of myofibrillar proteins to improve their gelation properties:A systematic review[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(1):924−959. doi: 10.1111/1541-4337.12684
[42] NIE X H, ZHAO L M, WANG N N, et al. Phenolics-protein interaction involved in silver carp myofibrilliar protein films with hydrolysable and condensed tannins[J]. Food Science and Technology,2017,81:258−264.
[43] JIA N, LIN S W, ZHANG F X, et al. Improved effect of flaxseed gum on the weakened gelling properties of myofibrillar protein induced by catechin[J]. Food Chemistry,2022,372:131136. doi: 10.1016/j.foodchem.2021.131136
[44] WU W, CLIFFORD M, HOWELL N K. The effect of instant green tea on the foaming and rheological properties of egg albumen proteins[J]. Journal of the Science of Food and Agriculture,2007,87(10):1810−1819. doi: 10.1002/jsfa.2809
[45] LI C H, DAI T T, CHEN J, et al. Protein-polyphenol functional ingredients:The foaming properties of lactoferrin are enhanced by forming complexes with procyanidin[J]. Food Chemistry,2021,339:128145. doi: 10.1016/j.foodchem.2020.128145
[46] LI T, WANG L, CHEN Z X, et al. Functional properties and structural changes of rice proteins with anthocyanins complexation[J]. Food Chemistry,2020,331:127336. doi: 10.1016/j.foodchem.2020.127336
[47] GUO X, HU L, WANG Z, et al. Effect of rutin on the physicochemical and gel characteristics of myofibrillar protein under oxidative stress[J]. Journal of Food Biochemistry, 2021, 45(10).
[48] YAN X H, ZHANG G H, ZHAO J X, et al. Influence of phenolic compounds on the structural characteristics, functional properties and antioxidant activities of Alcalase-hydrolyzed protein isolate from Cinnamomum camphora seed kernel[J]. Food Science and Technology,2021,148:111799.
[49] DE MORAIS F P R, PESSATO T B, RODRIGUES E, et al. Whey protein and phenolic compound complexation:Effects on antioxidant capacity before and after in vitro digestion[J]. Food Research International,2020,133:109104. doi: 10.1016/j.foodres.2020.109104
[50] 王晨雨, 付子航, 陈成诚, 等. 原儿茶酸与卵白蛋白的相互作用[J]. 食品研究与开发,2023,44(24):16−22. [WANG C Y, FU Z H, CHEN C C, et al. Interaction between protocatechuic acid and ovalbumin[J]. Food Research and Development,2023,44(24):16−22.] doi: 10.12161/j.issn.1005-6521.2023.24.003 WANG C Y, FU Z H, CHEN C C, et al. Interaction between protocatechuic acid and ovalbumin[J]. Food Research and Development, 2023, 44(24): 16−22. doi: 10.12161/j.issn.1005-6521.2023.24.003
[51] 袁钦杰, 桑森鑫, 吴峰华, 等. 植物蛋白肉产品、生产方法及消化率的研究现状[J]. 粮食与油脂,2023,36(12):13−16. [YUAN Q J, SANG S X, WU F H, et al. Research status of vegetable protein meat products, production methods and digestibility[J]. Cereals & Oils,2023,36(12):13−16.] YUAN Q J, SANG S X, WU F H, et al. Research status of vegetable protein meat products, production methods and digestibility[J]. Cereals & Oils, 2023, 36(12): 13−16.
[52] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry,2002,78(4):443−455. doi: 10.1016/S0308-8146(02)00155-3
[53] SECZYK L, SWIECA M, GAWLIK-DZIKI U. Soymilk enriched with green coffee phenolics-Antioxidant and nutritional properties in the light of phenolics-food matrix interactions[J]. Food Chemistry,2017,223:1−7. doi: 10.1016/j.foodchem.2016.12.020
[54] JIAN L Z, LIU Y J, LI L, et al. Covalent conjugates of anthocyanins to soy protein:Unravelling their structure features and in vitro gastrointestinal digestion fate[J]. Food Research International,2019,120:603−609. doi: 10.1016/j.foodres.2018.11.011
[55] LIN L Z, JIAO M, ZHAO M M, et al. In vitro gastrointestinal digest of catechin-modified α-conglycinin oxidized by lipoxygenase-catalyzed linoleic acid peroxidation[J]. Food Chemistry,2019,280:154−163. doi: 10.1016/j.foodchem.2018.12.067
[56] MA M, DONG S, HUSSAIN M, et al. Effects of addition of condensed tannin on the structure and properties of silk fibroin film[J]. Polymer International,2017,66(1):151−159. doi: 10.1002/pi.5272
[57] 宋天园, 王甜, 肖兰, 等. 植物蛋白过敏原的研究进展[J]. 饲料博览,2022(5):29−37. [SONG T Y, WANG T, XIAO L, et al. Research progress on plant protein allergens[J]. Feed Review,2022(5):29−37.] SONG T Y, WANG T, XIAO L, et al. Research progress on plant protein allergens[J]. Feed Review, 2022(5): 29−37.
[58] MA J, TONG P Y, CHEN Q W, et al. Covalent conjugation with polyphenol reduced the sensitization of walnut and ameliorated allergy by enhancing intestinal epithelial barrier in mice[J]. Food Chemistry,2024,439:138191. doi: 10.1016/j.foodchem.2023.138191
[59] 韩玥颖, 张自业, 李自豪, 等. 马尾藻多酚的提取纯化工艺优化及其对虾原肌球蛋白致敏性的消减作用研究[J]. 食品安全质量检测学报,2024,15(7):93−102. [HAN Y Y, ZHANG Z Y, LI Z H, et al. Optimization of extraction and purification of polyphenol from Sargassum carpophyllum and its attenuating effects on the allergenicity of shrimp tropomyosin[J]. Journal of Food Safety and Quality,2024,15(7):93−102.] HAN Y Y, ZHANG Z Y, LI Z H, et al. Optimization of extraction and purification of polyphenol from Sargassum carpophyllum and its attenuating effects on the allergenicity of shrimp tropomyosin[J]. Journal of Food Safety and Quality, 2024, 15(7): 93−102.





 下载:
下载:
 下载:
下载:
