Inhibitory Effect of Different Biopreservatives on Repeated Freeze-thaw Oxidation in Tibetan Sheep
-
摘要: 为探究壳聚糖(Chitosan,CHI)、溶菌酶(Lysozyme,LYS)、乳酸菌(Lactic acid bacteria,LAB)对藏羊肉反复冻融过程中脂质氧化和肌原纤维蛋白(Myofibrillar protein,MP)氧化的抑制作用,对藏羊背最长肌肉喷淋生物保鲜剂后进行五次冻融循环,测定分析冻融过程中样品的过氧化值、硫代巴比妥酸值、羰基含量、巯基含量、表面疏水性、浊度、溶解度等指标。结果显示,三种生物保鲜剂能有效延缓藏羊肉在冻融过程中脂肪氧化及肌原纤维蛋白氧化的程度。其中,乳酸菌效果最佳。五次冻融循环后,乳酸菌处理组的过氧化值及硫代巴比妥酸值比对照组低2.111 mmol/kg、0.0315 mg/100 g,羰基含量、表面疏水性、浊度比对照组低2.720 nmol/mg蛋白、12.404 μg、0.025,巯基含量及溶解度比对照组高0.025 nmol/g、14.25%。综上所述,乳酸菌有效延缓了藏羊肉冻融循环过程中的脂质及肌原纤维蛋白氧化。Abstract: The objective of this study was to investigate the inhibitory effects of chitosan (CHI), lysozyme (LYS), and lactic acid bacteria (LAB) on lipid and myofibrillar protein (MP) oxidation during the repeated freeze-thaw process of Tibetan sheep meat. Five freeze-thaw cycles were conducted after spraying biopreservatives on the longest muscle of Tibetan sheep, and then the indicators of peroxide value, thiobarbituric acid value, carbonyl content, sulfhydryl content, surface hydrophobicity, turbidity, solubility, and other sample characteristics during the freeze-thaw process were measured and analyzed. The results showed that the above three biopreservatives had good effects to reduce the degree of lipid and MP oxidation in Tibetan sheep during the freeze-thaw process. Among them, lactic acid bacteria had the best effect. Following the fifth freeze-thaw cycle, compared with the control group, the peroxide and thiobarbituric acid values of the lactic acid bacteria treated group were 2.111 mmol/kg and 0.0315 mg/100 g lower than the control group, respectively. The carbonyl content, surface hydrophobicity, and turbidity were 2.720 nmol/mg prot, 12.404 μg, and 0.025 lower than the control group, respectively. The sulfhydryl content and solubility were 0.025 nmol/g and 14.25% higher than the control group, respectively. In conclusion, lactic acid bacteria effectively delayed the oxidation of lipids and MP during the freeze-thaw cycle of Tibetan sheep.
-
Keywords:
- Tibetan sheep /
- lactic acid bacteria /
- chitosan /
- lysozyme /
- freeze-thaw cycle /
- fat oxidation /
- myofibrillar protein oxidation /
- correlation
-
藏羊肉味道鲜美、肉质细嫩,具有高蛋白、低胆固醇、低脂肪的特性[1]。然而,藏羊肉在食用及加工之前要经过冷冻、运输、贮藏、解冻的过程,导致其出现蒸煮损失率及总渗透流失率增加、剪切力降低[2]、肌原纤维断裂程度增加及总胶原蛋白浓度降低[3]等现象。反复冻融会使得羊肉质地变差、微观结构恶化[4]、肌原纤维的保水能力降低、表面疏水性增加[5]、脂质氧化加剧[6]、肌红蛋白含量上升[7]、水分和蛋白质含量下降、蛋白质发生氧化、羰基和硫代巴比妥酸含量增加[8],并且随着冻融时间的延长,恶化加剧。因此,在冻融过程中采取措施抑制藏羊肉的氧化显得尤为必要。
生物保鲜剂通常来源于植物、动物、微生物,其具有天然、无毒的特性,一般通过喷淋、浸渍等方式作用于食品,进而保持食品品质[9]。生物保鲜剂在肉的贮藏过程中可以降低肉的pH、菌落总数、挥发性盐基氮及硫代巴比妥酸活性物质含量[10]。壳聚糖被认为是仅次于纤维素的第二普遍存在的多糖,其有助于延长食品保质期,对食品的感官特性产生积极影响[11]。溶菌酶具有良好的抗菌性能,可以更好地保持肉品风味[12]。乳酸菌可以调节肉制品蛋白质降解和氧化[13],抑制李斯特菌及梭状芽胞杆菌等腐败微生物[14]。生物保鲜剂应用于肉制品中,可以保持肉制品的品质并且延长货架期。
目前,关于不同生物保鲜剂对肉类反复冻融过程中氧化的抑制作用的报道较少,且生物保鲜剂在肉类保鲜中的应用效果还需要进一步研究。因此,本实验将生物保鲜剂(壳聚糖、溶菌酶、乳酸菌)喷淋于藏羊肉,藏羊肉经过5次冻融循环,测定分析冻融过程中样品的过氧化值、硫代巴比妥酸值、羰基含量、巯基含量、表面疏水性、浊度、溶解度等指标,并对指标进行相关性分析,研究不同生物保鲜剂对藏羊肉反复冻融过程中氧化的抑制作用,以期为藏羊肉品质保障提供理论依据,对冻融循环中抑制脂肪氧化及肌原纤维蛋白氧化具有一定意义。
1. 材料与方法
1.1 材料与仪器
藏羊肉 青海省海北州海晏县青海库库诺尔食品有限公司;壳聚糖、溶菌酶(2万U/mg) 食品级,南宁庞博生物工程有限公司;总巯基含量检测试剂盒 索莱宝生物科技有限公司;蛋白质羰基试剂盒 南京建成生物工程研究所;三(羟甲基)氨基甲烷盐酸盐(Tris-HCl) 试剂级,阿拉丁试剂(上海)有限公司;2-硫代巴比妥酸(生化试剂)、碘化钾(分析纯) 上海展云化工有限公司;氯化钾、乙二胺四乙酸二钠(EDTA) 分析纯,天津市河东区红岩试剂厂;可溶性淀粉 分析纯,天津市致远化学试剂有限公司。
UN-2600型紫外可见分光光度计 岛津企业管理有限公司;BD/BC-201KEMS型转换型冷藏冷冻箱 合肥美的电冰箱有限公司;HH-6型电热恒温水浴锅 上海比朗仪器有限公司;H/T16MN型台式高速离心机 湖南赫西仪器装备有限公司;Xw-80A型涡旋振荡器 海门市其林贝尔仪器制造有限公司;MULTISKAN Sky型全波长酶标仪 北京平利洋经贸有限公司。
1.2 实验方法
1.2.1 样品采集及前处理
藏羊在青海省海北州海晏县青海库库诺尔食品有限公司屠宰后,取藏羊肉背最长肌分割成3 cm×3 cm×3 cm的肉块,将背最长肌肉置于4 ℃冰箱中排酸8 h。然后每个肉块喷淋1%生物保鲜剂(溶菌酶、壳聚糖、乳酸菌),保鲜剂涂抹均匀后用七层共挤包装袋(PA/TIE/PA/TIE/PE/PE/PE)进行真空包装,以肉块喷淋蒸馏水作为对照组。
冻融循环处理参考楼丹露等[15]的方法并稍作修改,取经过前处理的藏羊背最长肌肉放入−40 ℃冰箱中冷冻贮藏36 h,然后于4 ℃冰箱中解冻至中心温度为4 ℃,作为1次冻融,再放回−40 ℃下进行冷冻贮藏,重复上述步骤,共冻融5次,每次冻融循环结束后测定指标。
肉糜制备方法:将解冻后的藏羊肉剔除筋膜及脂肪后切块放入绞肉机中绞制为肉糜状态。将其装入自封袋,于4 ℃冷藏保存。
1.2.2 脂质氧化指标测定
过氧化值(Peroxide value,POV)的测定:参照GB 5009.227-2016标准中的滴定法测定。在250 mL碘量瓶中称取3 g肉糜,加入三氯甲烷-冰乙酸混合液(2:3)30 mL,加入1 mL饱和碘化钾溶液,摇晃均匀后避光放置3 min,此时溶液变为深色,取出碘量瓶加入100 mL蒸馏水和1 mL 1%淀粉溶液,然后用0.01 mol/L硫代硫酸钠滴定至溶液蓝色消失。
式中,V1:试样消耗的硫代硫酸钠标准溶液体积,单位为毫升(mL);V2:空白试验消耗的硫代硫酸钠标准溶液体积,单位为毫升(mL);C:硫代硫酸钠标准溶液的浓度,单位为摩尔每升(mol/L);m:试样质量,单位为克(g)。
硫代巴比妥酸值(Thiobarbituric acid reactive substances,TBARS)的测定:参照GB/T 5009.181-2016标准中的分光光度法来测定[16]。在锥形瓶中称取10 g肉糜,加入7.5%的三氯乙酸(含体积分数为0.1% EDTA)50 mL,将锥形瓶固定在振荡器中振荡30 min后用双层滤纸过滤,取5 mL上清液,在上清液中加入5 mL 0.02 mo/L硫代巴比妥酸溶液,然后在沸水浴条件下放置40 min后取出冷却,加入5 mL氯仿,静置分层后取上清液分别在532 nm和600 nm处测定吸光度,记为A532和A600。
1.2.3 肌原纤维蛋白氧化指标测定
肌原纤维蛋白的提取:参照LIU等[17]的方法,略作修改。将藏羊背最长肌肉用绞肉机制作成肉糜,称取5 g肉糜加入20 mL 20 mmol/L Tris-HCl缓冲液(0.1 mol/L KCl溶液调节pH至7.0)混合,置于均质机均质3 min,用20目滤网过滤后于4 ℃条件下设置8000 r/min离心10 min。弃去上清液,重复操作三次,得到高质量MP。
肌原纤维蛋白巯基含量的测定:采用Solarbbio总巯基含量试剂盒测定。
肌原纤维蛋白羰基含量的测定:采用蛋白质羰基含量测试盒测定。
表面疏水性的测定:参照CHELH等[18]的方法测定。取5 mL MP溶液(5 mg/mL),将1 mL溴酚蓝溶液(1 mg/mL)加入MP溶液中,对照组样品取5 mL 蒸馏水,将1 mL溴酚蓝溶液(1 mg/mL)加入蒸馏水中混合均匀,在高速离心机设置转速5000 r/min、设置时间10 min。离心结束后对上清液稀释10倍,在595 nm处测定吸光度。
浊度的测定:参照JIANG等[19]的方法。将MP溶液(1 mg/mL)置于比色皿中,在600 nm条件下测定的吸光值即为浊度。
溶解度的测定:参照TAN等[20]的方法,略作修改。将5 mL MP溶液(1 mg/mL)在5000 r/min条件下离心10 min。取上清液采用考马斯亮蓝法测定蛋白含量。
1.3 数据处理
样品经同一操作处理后,3组平行试验数据以平均值±标准差的形式表示,数据加工、统计分析及视图绘制,依托Excel 2019、IBM SPSS Statistics 26(P<0.05)及Origin 2018软件实施。
2. 结果与分析
2.1 不同生物保鲜剂在冻融循环中对过氧化值升高的抑制作用
过氧化值(POV)通常用来判断食品变质和氧化的程度。不同生物保鲜剂在冻融循环中对过氧化值的影响如图1所示,新鲜肉(0次冻融)的过氧化值为1.22±0.255 mmol/kg,随着冻融次数的增加,过氧化值随之增高,此结果与PAN等[21]研究结果相似。与对照组相比,加入生物保鲜剂的三个组(壳聚糖处理组、溶菌酶处理组、乳酸菌处理组)在相同冻融次数下过氧化值低于对照组,这说明添加生物保鲜剂可以有效抑制冻融过程中过氧化值的上升,并且在冻融循环中,乳酸菌处理过的藏羊肉过氧化值始终处于较低水平,第5次冻融后,乳酸菌处理组与壳聚糖处理组过氧化值低于其它组,对照组过氧化值为6.278±0.8552 mmol/kg,乳酸菌处理组过氧化值为4.167±0.167 mmol/kg,可能是由于在喷淋乳酸菌后,降低了水分含量、水分活度和pH,从而增强了乳酸菌的抗氧化能力,改善了藏羊肉在冻融过程中的感官特性和安全性[22]。壳聚糖处理组过氧化值为4.333±0.667 mmol/kg,由于涂抹壳聚糖会在肉表面形成薄膜有效延缓与氧气的接触,以此降低周围氧气的浓度和活性氧来保护游离脂肪酸免受氧化损伤[23]。
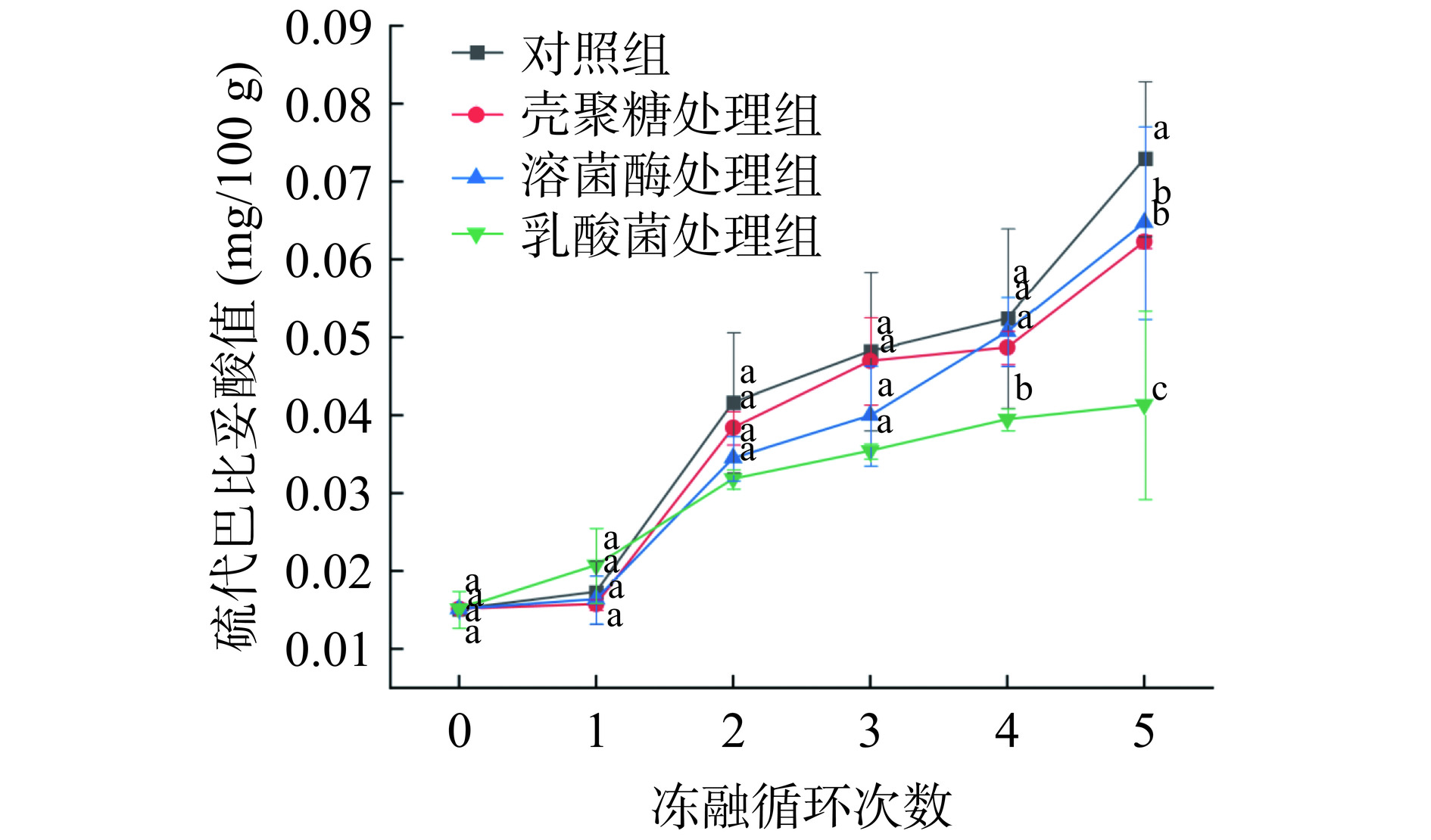
2.2 不同生物保鲜剂在冻融循环中对硫代巴比妥酸值升高的抑制作用
硫代巴比妥酸值(TBARS)是评价肉类脂肪氧化的重要指标[24],肉中多不饱和脂肪酸降解产生的次级脂质氧化产物含量常用TBARS表示[25]。不同生物保鲜剂在冻融循环中对硫代巴比妥酸值的影响如图2所示,新鲜肉(0次冻融)的TBARS值为0.015±0.002 mg/100 g,随着冻融次数的增加,TBARS值逐渐升高,这与WANG等[26]的研究结果相似。第5次冻融循环后对照组TBARS值为0.073±0.009 mg/100 g,显著高于生物保鲜剂组(P<0.05),这与POV结果一致,说明喷淋生物保鲜剂可以有效抑制在冻融循环过程中藏羊肉的脂肪氧化。在冻融1次、2次、3次时各组间差异不显著,在冻融4次、5次时乳酸菌处理组的TBARS值显著低于其他组别(P<0.05),具有较好的抗氧化能力。乳酸菌加入到藏羊肉中,可以延缓藏羊肉的腐败及致病菌的生长,使得TBARS处于较低水平,提高藏羊肉安全性和保质期[27]。
2.3 不同生物保鲜剂在冻融循环中对羰基含量升高的抑制作用
肉在冻融贮藏期间的劣变主要是由于蛋白质氧化造成的[28],羰基含量是衡量蛋白质氧化变质的重要指标。不同生物保鲜剂在冻融循环中对羰基含量的影响如图3所示,新鲜肉(0次冻融)的羰基含量为1.699±0.328 nmol/mg蛋白,随着冻融次数的增加,羰基含量逐渐增加,这与WANG等[29]的研究结果相似。在冻融循环过程中对照组的羰基含量始终显著高于壳聚糖处理组与乳酸菌处理组(P<0.05),此结果说明壳聚糖与乳酸菌有效保护蛋白质在冻融循环过程中不被氧化。第5次冻融循环结束后,对照组的羰基含量为6.459±0.744 nmol/mg蛋白,溶菌酶处理组、壳聚糖处理组、乳酸菌处理组的羰基含量分别为4.978±0.256 nmol/mg蛋白、4.273±0.168 nmol/mg蛋白、3.739±0.692 nmol/mg蛋白。在冻融循环过程中,乳酸菌处理组在相同冻融次数下的羰基含量低于其它组,这种抑制羰基含量上升的作用随着冻融循环次数的增加愈加显著,乳酸菌能产生包括有机酸和抗菌肽(细菌素)、抗菌真菌在内的抗微生物化合物,从而有效阻止蛋白质被氧化[30],使得蛋白质中特定氨基酸(如精氨酸、赖氨酸和脯氨酸)的侧链不容易被氧化成羰基残基[31],进而延缓羰基含量增加。
2.4 不同生物保鲜剂在冻融循环中对巯基含量下降的抑制作用
在藏羊肉冻融贮藏过程中,半胱氨酸中的硫羟基易受ROS作用生成二硫键,导致巯基含量逐渐降低,二硫键含量增加[32]。不同生物保鲜剂在冻融循环中对巯基含量的影响如图4所示,新鲜肉(0次冻融)的巯基含量为0.204±0.032 nmol/g,随着冻融次数的增加,肌原纤维蛋白巯基含量呈现下降趋势,这与CHEN等[33]的研究结果相似,可能是由于在冻融过程中半胱氨酸的硫羟基受到ROS作用,生成的二硫键增加,使得巯基含量下降。在冻融1次、2次、3次时各组间巯基含量差异不显著(P>0.05),但在冻融4次、5次时,乳酸菌处理组巯基含量下降趋势显著低于对照组(P<0.05),第5次冻融循环后对照组巯基含量为0.0282±0.006 nmol/g,乳酸菌处理组的巯基含量为0.052±0.017 nmol/g,是由于添加乳酸菌可以更好地保护巯基不被氧化成二硫键,有效保护蛋白质的三级和四级结构不被破坏[34]。
2.5 不同生物保鲜剂在冻融循环中对表面疏水性升高的抑制作用
表面疏水性可以反映出位于内部的疏水氨基酸残基暴露在蛋白质表面的程度,而蛋白质变性的程度可以通过结合溴酚蓝的量来反映[35],不同生物保鲜剂在冻融循环中对表面疏水性的影响如图5所示,新鲜肉(0次冻融)的表面疏水性为17.775±5.526 μg,随着冻融次数的增加,表面疏水性随之增加,这与ZHANG等[5]的研究结果相似。是由于冻融过程中形成的大冰晶会改变肌原纤维蛋白的三级结构,使蛋白质结构发生变化,暴露出更多的内部疏水残基与溴酚蓝结合[36]。在冻融1次、2次、3次时相同冻融次数下各实验组(壳聚糖处理组、溶菌酶处理组、乳酸菌处理组)差异不显著(P>0.05),冻融次数为4次、5次时对照组的表面疏水性高于壳聚糖处理组、溶菌酶处理组与乳酸菌处理组。随着冻融次数的增多,三种生物保鲜剂可以延缓蛋白质变性。第5次冻融循环后对照组表面疏水性为47.114±4.967 μg,壳聚糖处理组、溶菌酶处理组、乳酸菌处理组的表面疏水性分别为36.171±5.721 μg、36.448±6.068 μg、34.710±4.469 μg,乳酸菌处理组可以在冻融循环过程有效延缓肌原纤维蛋白氧化及蛋白质结构的构象变化[37]。是由于乳酸菌处理过的样品疏水性残基暴露程度比较低[38],维持蛋白质空间构象的作用力较强,从而减缓了蛋白质的变性程度[39],所以在冻融循环过程中表面疏水性处于较低水平。
2.6 不同生物保鲜剂在冻融循环中对浊度升高的抑制作用
浊度可以显示蛋白质溶液的均匀性及由MP之间的相互作用引起的蛋白质聚集程度[40]。不同生物保鲜剂在冻融循环中对浊度的影响如图6所示,新鲜肉(0次冻融)的浊度为0.123±0.006,随着冻融次数的增加,浊度随之上升,这可能是由于冻融过程中疏水氨基酸暴露、疏水相互作用增强,为蛋白质聚集提供有利条件[40]。在冻融循环次数为1次、2次、3次、4次时各实验组(壳聚糖处理组、溶菌酶处理组、乳酸菌处理组)浊度差异不显著(P>0.05),第5次冻融循环结束后,对照组的浊度为0.186±0.002,壳聚糖处理组、溶菌酶处理组、乳酸菌处理组的浊度分别为0.1794±0.002、0.181±0.006、0.160±0.001。在三种生物保鲜剂(壳聚糖、溶菌酶、乳酸菌)中,乳酸菌表现出对肌原纤维蛋白良好的保护作用,可能是由于随着冻融次数的增加乳酸菌处理组较其它组蛋白质氧化变性程度减缓,蛋白质与水的结合作用被其他作用取代程度较低,所以相互聚集程度较小[41]。
2.7 不同生物保鲜剂在冻融循环中对溶解度下降的抑制作用
溶解度反映蛋白质的变性和聚集程度[42]。不同生物保鲜剂在冻融循环中对溶解度的影响如图7所示,新鲜肉(0次冻融)的溶解度为99.001%±0.771%,随着冻融次数的增加,溶解度逐渐下降,可能是由于暴露的疏水基团相关的蛋白质数量增加[43]。冻融循环次数为1次、2次时,三种生物保鲜剂(壳聚糖、溶菌酶、乳酸菌)对蛋白质变性和聚集的抑制作用差异不显著(P>0.05),在冻融次数为4次、5次时,生物保鲜剂组(壳聚糖处理组、溶菌酶处理组、乳酸菌处理组)的溶解度显著高于对照组(P<0.05)。随着冻融次数的增加,各实验组对蛋白质变性和聚集的抑制能力依次是乳酸菌处理组>壳聚糖处理组>溶菌酶处理组>对照组。第5次冻融循环结束后,对照组的溶解度为75.941%±2.972%,壳聚糖处理组、溶菌酶处理组、乳酸菌处理组的溶解度分别为85.312%±0.531%、83.385%±0.899%、90.191%±1.546%。乳酸菌处理组的溶解度高于其他组,可能是因为乳酸菌处理过的样品会使得蛋白分子间二硫键及疏水相互作用减弱,蛋白发生变性程度延缓[44]。
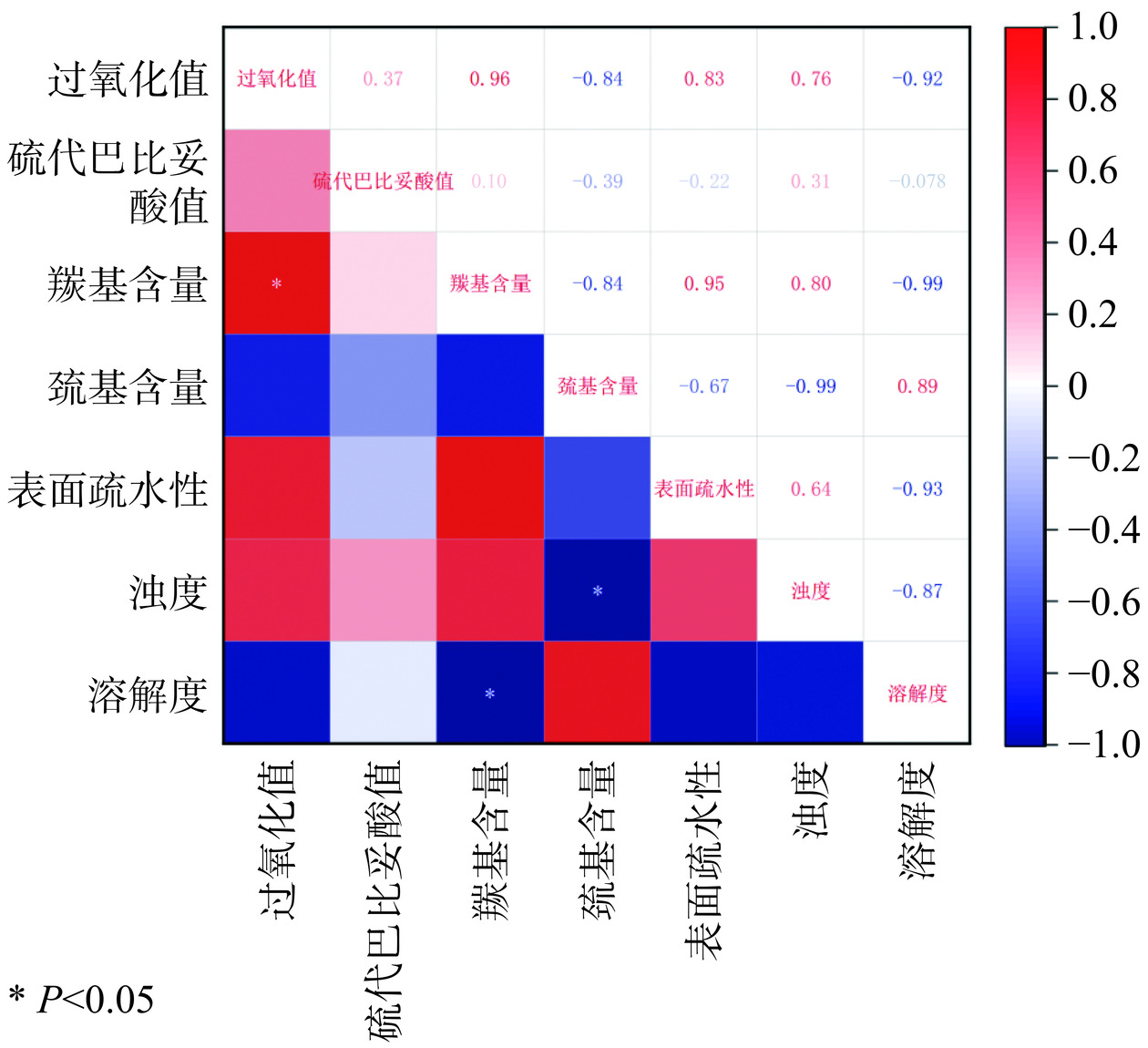
2.8 不同生物保鲜剂在冻融循环中各指标的相关性分析
相关性分析作为一种探索不同变量之间的线性关系的统计方法,揭示变量之间的潜在联系,从而为形成新的科学假设和确定研究方向提供依据[45]。在本研究中,对藏羊肉第五次冻融循环的过氧化值、硫代巴比妥酸值、羰基含量、巯基含量、表面疏水性、浊度及溶解度进行相关性分析(图8)。从脂质氧化指标之间的相关性来看:过氧化值与硫代巴比妥酸值之间具有正相关性;从肌原纤维蛋白氧化指标之间的相关性来看:羰基含量与浊度、羰基含量与表面疏水性、巯基含量与溶解度、表面疏水性与浊度之间具有正相关性,羰基含量与溶解度、羰基含量与巯基含量、巯基含量与浊度、巯基含量与表面疏水性、表面疏水性与溶解度、浊度与溶解度之间负相关。从脂质氧化和肌原纤维蛋白氧化之间的相关性来看:过氧化值与浊度、过氧化值与表面疏水性、过氧化值与羰基含量、硫代巴比妥酸值与浊度、硫代巴比妥酸值与羰基含量呈现正相关性,过氧化值与溶解度、过氧化值与巯基含量、硫代巴比妥酸值与溶解度、硫代巴比妥酸值与表面疏水性、硫代巴比妥酸值与巯基含量呈现负相关性。并且过氧化值与羰基含量之间高度正相关,相关系数为0.96(P<0.05),羰基含量与溶解度、巯基含量与浊度之间高度负相关,相关系数均为−0.99(P<0.05)。
3. 结论
通过探究不同生物保鲜剂(壳聚糖、溶菌酶、乳酸菌)对藏羊肉反复冻融过程中脂质氧化和蛋白氧化的抑制作用,研究发现,与对照组相比,添加壳聚糖、溶菌酶、乳酸菌的藏羊肉在冻融循环过程中脂肪氧化及肌原纤维蛋白氧化程度较低。五次冻融循环后,相较于其它组,乳酸菌处理组的过氧化值及硫代巴比妥酸值比对照组低2.111 mmol/kg、0.0315 mg/100 g,羰基含量、表面疏水性、浊度比对照组低2.720 nmol/mg蛋白、12.404 μg、0.025,巯基含量及溶解度比对照组高0.025 nmol/g、14.25%。总之,生物保鲜剂对藏羊肉反复冻融过程中氧化具有一定的抑制作用。本文能够为提升藏羊肉在冻融循环过程中品质变化提供理论依据。对于生物保鲜剂对藏羊肉品质的变化在本文未探究,后续还需进一步研究生物保鲜剂在冻融过程中对藏羊肉食用品质及营养品质的影响,并结合代谢组学进一步探究其作用机理。
-
-
[1] 张攀高, 师希雄, 田铸, 等. 宰后N-硝基-L-精氨酸甲酯盐酸盐处理对藏羊肉品质的影响[J]. 食品科学,2021,42(19):43−48. [ZHANG P G, SHI X X, TIAN Z, et al. Effect of post-slaughter N-nitro-L-arginine methyl ester hydrochloride treatment on the quality of Tibetan sheep meat[J]. Food Science,2021,42(19):43−48.] doi: 10.7506/spkx1002-6630-20201028-290 ZHANG P G, SHI X X, TIAN Z, et al. Effect of post-slaughter N-nitro-L-arginine methyl ester hydrochloride treatment on the quality of Tibetan sheep meat[J]. Food Science, 2021, 42(19): 43−48. doi: 10.7506/spkx1002-6630-20201028-290
[2] AROEIRA C N, TORRES FILHO R A, FONTES P R, et al. Freezing, thawing and aging effects on beef tenderness from Bos indicus and Bos taurus cattle[J]. Meat Science,2016,116:118−125. doi: 10.1016/j.meatsci.2016.02.006
[3] GIAMPIETRO-GANECO A, OWENS C M, MELLO J L M, et al. Physical and chemical characteristics of meat from broilers raised in 4 different rearing systems, stored under freezing for up to 12 months[J]. Poultry Science,2017,96(10):3796−3804. doi: 10.3382/ps/pex183
[4] DELGADO-PANDO G, ÁLVAREZ C, MORÁN L. From farm to fork:New strategies for quality evaluation of fresh meat and processed meat products[J]. Journal of Food Quality,2019,2019:1−2.
[5] ZHANG Y, PUOLANNE E, ERTBJERG P. Mimicking myofibrillar protein denaturation in frozen-thawed meat:Effect of pH at high ionic strength[J]. Food Chemistry,2021,338:128017. doi: 10.1016/j.foodchem.2020.128017
[6] WU G, YANG C, BRUCE H L, et al. Effects of alternating electric field during freezing and thawing on beef quality[J]. Food Chemistry,2023,419:135987. doi: 10.1016/j.foodchem.2023.135987
[7] JEONG J Y, KIM G D, YANG H S, et al. Effect of freeze-thaw cycles on physicochemical properties and color stability of beef semimembranosus muscle[J]. Food Research International,2011,44(10):3222−3228. doi: 10.1016/j.foodres.2011.08.023
[8] BAI X, LI Y, LIANG W. Formation of advanced glycation end products of chicken breast meat induced by freeze-thaw cycles and subsequent cooking[J]. International Journal of Biological Macromolecules,2023,244:125387. doi: 10.1016/j.ijbiomac.2023.125387
[9] 杨焕彬, 曾庆培, 林光明, 等. 生物保鲜剂在禽肉保鲜中的应用研究进展[J]. 轻工学报,2021,36(6):38−46. [YANG H B, ZENG Q P, LIN G M, et al. Progress in the application of biopreservatives in poultry meat preservation[J]. Journal of Light Industry,2021,36(6):38−46.] doi: 10.12187/2021.06.005 YANG H B, ZENG Q P, LIN G M, et al. Progress in the application of biopreservatives in poultry meat preservation[J]. Journal of Light Industry, 2021, 36(6): 38−46. doi: 10.12187/2021.06.005
[10] WANG Z, HAN L, TIAN X, et al. The combined impact of food antistaling agents and super-chilling on chicken breast meat by physicochemical and dynamic rheological properties[J]. CyTA-Journal of Food,2021,19(1):782−792. doi: 10.1080/19476337.2021.1989493
[11] FERNANDO S S, JO C, MUDANNAYAKE D C, et al. An overview of the potential application of chitosan in meat and meat products[J]. Carbohydrate Polymers, 2023:121477.
[12] CEGIELSKA-RADZIEJEWSKA R, SZABLEWSKI T, RADZIEJEWSKA-KUBZDELA E, et al. The effect of modified lysozyme treatment on the microflora, physicochemical and sensory characteristics of pork packaged in preservative gas atmospheres[J]. Coatings,2021,11(5):488. doi: 10.3390/coatings11050488
[13] WANG D, CHENG F, WANG Y, et al. The changes occurring in proteins during processing and storage of fermented meat products and their regulation by lactic acid bacteria[J]. Foods,2022,11(16):2427. doi: 10.3390/foods11162427
[14] ABDELHAMID A G, EL-DOUGDOUG N K. Controlling foodborne pathogens with natural antimicrobials by biological control and antivirulence strategies[J]. Heliyon,2020,6(9):e5020.
[15] 楼丹露, 王清政, 邹祖全, 等. 冻融循环对熟制鲣鱼暗色肉脂质变化的影响[J]. 食品科学,2022,43(13):177−183. [LOU D L, WANG Q Z, ZOU Z Q, et al. Effect of freeze-thaw cycle on lipid changes in dark meat of cooked fish[J]. Food Science,2022,43(13):177−183.] doi: 10.7506/spkx1002-6630-20210629-331 LOU D L, WANG Q Z, ZOU Z Q, et al. Effect of freeze-thaw cycle on lipid changes in dark meat of cooked fish[J]. Food Science, 2022, 43(13): 177−183. doi: 10.7506/spkx1002-6630-20210629-331
[16] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品中丙二醛的测定[S]. 2016. [National Health and Family Planning Commission of the People's Republic of China. National standard for food safety Determination of malondialdehyde in food[S]. 2016.] National Health and Family Planning Commission of the People's Republic of China. National standard for food safety Determination of malondialdehyde in food[S]. 2016.
[17] LIU C K, LI W X, ZHOU M Y, et al. Effect of oxidation modification induced by peroxyl radicals on the physicochemical and gel characteristics of grass carp myofibrillar protein[J]. Journal of Food Measurement and Characterization,2021,15(6):5572−5583. doi: 10.1007/s11694-021-01123-1
[18] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V, et al. Technical note:A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science,2006,74(4):681−683. doi: 10.1016/j.meatsci.2006.05.019
[19] JIANG S S, DING J Z, ANDRADE J, et al. Modifying the physicochemical properties of pea protein by pH-shifting and ultrasound combined treatments[J]. Ultrasonics Sonochemistry,2017,38:835−842. doi: 10.1016/j.ultsonch.2017.03.046
[20] TAN M T, DING Z Y, XIE J. Freezing-induced myofibrillar protein denaturation:Contributions of freeze-concentration and role of cellobiose[J]. Journal of Food Engineering,2022,329:11076.
[21] PAN N, DONG C H, DU X, et al. Effect of freeze-thaw cycles on the quality of quick-frozen pork patty with different fat content by consumer assessment and instrument-based detection[J]. Meat Science,2021,172:108313. doi: 10.1016/j.meatsci.2020.108313
[22] ZHANG Y, HU P, LOU L, et al. Antioxidant activities of lactic acid bacteria for quality improvement of fermented sausage[J]. Journal of Food Science,2017,82(12):2960−2967. doi: 10.1111/1750-3841.13975
[23] HABIBIE A, YAZDANI N, SABA M K, et al. Ascorbic acid incorporated with walnut green husk extract for preserving the postharvest quality of cold storage fresh walnut kernels[J]. Scientia Horticulturae,2019,245:193−199. doi: 10.1016/j.scienta.2018.10.022
[24] SINGH T P, CHAUHAN G, MENDIRATTA S K, et al. In vitro antioxidant and antimicrobial activities of clove extract and its effectiveness in bio-composite film on storage stability of goat meat balls[J]. Journal of Food Science,2022,87(5):2083−2095. doi: 10.1111/1750-3841.16135
[25] CAI L, WAN J, LI X, et al. Effects of different thawing methods on physicochemical properties and structure of largemouth bass (Micropterus salmoides)[J]. Journal of Food Science,2020,85(3):582−591. doi: 10.1111/1750-3841.15029
[26] WANG Z, HE Z, ZHANG D, et al. Effect of multiple freeze‐thaw cycles on protein and lipid oxidation in rabbit meat[J]. International Journal of Food Science & Technology,2021,56(6):3004−3015.
[27] RATHOD N B, PHADKE G G, TABANELLI G, et al. Recent advances in bio-preservatives impacts of lactic acid bacteria and their metabolites on aquatic food products[J]. Food Bioscience,2021,44:101440. doi: 10.1016/j.fbio.2021.101440
[28] CHEN Q, XIE Y, XI J, et al. Characterization of lipid oxidation process of beef during repeated freeze-thaw by electron spin resonance technology and Raman spectroscopy[J]. Food Chemistry,2018,243:58−64. doi: 10.1016/j.foodchem.2017.09.115
[29] WANG Z, HE Z, LI H. The effect of repeated freeze-thaw cycles on the meat quality of rabbit[J]. World Rabbit Science,2018,26(2):165−177. doi: 10.4995/wrs.2018.8616
[30] PARLINDUNGAN E, LUGLI G A, VENTURA M, et al. Lactic acid bacteria diversity and characterization of probiotic candidates in fermented meats[J]. Foods,2021,10(7):1519. doi: 10.3390/foods10071519
[31] LUND M N, HEINONEN M, BARON C P, et al. Protein oxidation in muscle foods:A review[J]. Molecular Nutrition & Food Research,2011,55(1):83−95.
[32] RAMIAREZ J A, MARTIAN-POLO M O, BANDMAN E. Fish myosin aggregation as affected by freezing and initial physical state[J]. Journal of Food Science,2000,65(4):556−560. doi: 10.1111/j.1365-2621.2000.tb16047.x
[33] CHEN X, LI X, YANG F, et al. Effects and mechanism of antifreeze peptides from silver carp scales on the freeze-thaw stability of frozen surimi[J]. Food Chemistry,2022,396:133717. doi: 10.1016/j.foodchem.2022.133717
[34] ZHANG Y, DONG M, ZHANG X, et al. Effects of inulin on the gel properties and molecular structure of porcine myosin:A underlying mechanisms study[J]. Food Hydrocolloids,2020,108:105974. doi: 10.1016/j.foodhyd.2020.105974
[35] CAO Y, XIONG Y L. Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J]. Food Chemistry,2015,180:235−243. doi: 10.1016/j.foodchem.2015.02.036
[36] LIN J, HONG H, ZHANG L, et al. Antioxidant and cryoprotective effects of hydrolysate from gill protein of bighead carp (Hypophthalmichthys nobilis) in preventing denaturation of frozen surimi[J]. Food Chemistry,2019,298:124868. doi: 10.1016/j.foodchem.2019.05.142
[37] LIU J, FANG C, LUO Y, et al. Effects of konjac oligo-glucomannan on the physicochemical properties of frozen surimi from red gurnard (Aspitrigla cuculus)[J]. Food Hydrocolloids,2019,89:668−673. doi: 10.1016/j.foodhyd.2018.10.056
[38] LIU P, LI Y, GAO L, et al. Effect of different carbohydrates on the functional properties of black rice glutelin (BRG) modified by the Maillard reaction[J]. Journal of Cereal Science,2020,93:102979. doi: 10.1016/j.jcs.2020.102979
[39] 张洪超, 薛张芝, 徐晓蓉, 等. 羟基自由基氧化对乌贼蛋白分子间作用力及结构的影响[J]. 核农学报,2020,34(1):131−138. [ZHANG H C, XUE Z Z, XU X R, et al. Effects of hydroxyl radical oxidation on the intermolecular force and structure of the squid protein[J]. Journal of Nuclear Agriculture,2020,34(1):131−138.] doi: 10.11869/j.issn.100-8551.2020.01.0131 ZHANG H C, XUE Z Z, XU X R, et al. Effects of hydroxyl radical oxidation on the intermolecular force and structure of the squid protein[J]. Journal of Nuclear Agriculture, 2020, 34(1): 131−138. doi: 10.11869/j.issn.100-8551.2020.01.0131
[40] FENG J, BAI X, LI Y, et al. Improvement on gel properties of myofibrillar protein from chicken patty with potato dietary fiber:Based on the change in myofibrillar protein structure and water state[J]. International Journal of Biological Macromolecules,2023,230:123228. doi: 10.1016/j.ijbiomac.2023.123228
[41] ALI S, ZHANG W, RAJPUT N, et al. Effect of multiple freeze-thaw cycles on the quality of chicken breast meat[J]. Food Chemistry,2015,173:808−814. doi: 10.1016/j.foodchem.2014.09.095
[42] DONG M, XU Y, ZHANG Y, et al. Physicochemical and structural properties of myofibrillar proteins isolated from pale, soft, exudative (PSE)-like chicken breast meat:Effects of pulsed electric field (PEF)[J]. Innovative Food Science & Emerging Technologies, 2020, 59.
[43] YANG Z, DE CAMPO L, GILBERT E P, et al. Effect of NaCl and CaCl2 concentration on the rheological and structural characteristics of thermally-induced quinoa protein gels[J]. Food Hydrocolloids,2022,124:107350. doi: 10.1016/j.foodhyd.2021.107350
[44] 刁小琴, 关文婷, 关海宁, 等. 冻结与解冻处理对猪肉肌原纤维蛋白凝胶特性及分子间作用力的影响[J]. 山西农业科学,2019,47(11):1890−1894. [DIAO X Q, GUAN W T, GUAN H N, et al. Effect of freezing and thawing treatment on myofibrillin gel properties and intermolecular forces of pork[J]. Shanxi Agricultural Science,2019,47(11):1890−1894.] doi: 10.3969/j.issn.1002-2481.2019.11.07 DIAO X Q, GUAN W T, GUAN H N, et al. Effect of freezing and thawing treatment on myofibrillin gel properties and intermolecular forces of pork[J]. Shanxi Agricultural Science, 2019, 47(11): 1890−1894. doi: 10.3969/j.issn.1002-2481.2019.11.07
[45] WANG W, LE T, WANG W, et al. Effects of key components on the antioxidant activity of black tea[J]. Foods,2023,12(16):3134. doi: 10.3390/foods12163134






 下载:
下载:





 下载:
下载:
