Changes in Volatile Components during the Refining Process of Crude Fish Oil from Snakehead Fish Viscera by Using GC-IMS and Chemometric Analysis
-
摘要: 探究黑鱼内脏粗鱼油精制阶段的单因素最佳条件及挥发性物质变化。本文以黑鱼内脏为原料提取粗鱼油,随后以酸价和过氧化值为指标,单因素优化脱胶、脱酸和脱色精制条件,采用气相色谱-离子迁移光谱(Gas chromatography-ion mobility spectroscopy,GC-IMS)检测粗鱼油精制不同阶段的挥发性物质,结合化学计量学法、正交偏最小二乘法判别分析(Orthogonal partial least squares discriminant analysis,OPLS-DA)和相对气味活度值(Relative odor activity value,ROAV)筛选黑鱼粗鱼油单因素最佳精制条件下关键挥发性物质。结果显示,黑鱼粗鱼油单因素最佳精制条件为0.6%磷酸脱胶,0.7%超量碱(NaOH,4 mol/L)脱酸,5%活性白土脱色,鱼油酸价和过氧化值最低,分别为0.59 mg KOH/g和2.62 mmol/kg。黑鱼粗鱼油精制阶段GC-IMS共检测出58种挥发性物质,其中以醛类最为丰富(25种),其次为醇类(11种)和酮类(8种)。脱胶油挥发性物质含量最高,后续随着精制进行,挥发性物质种类和浓度逐渐降低。黑鱼内脏粗鱼油经过脱酸和脱臭阶段,挥发性物质种类和浓度降低最为显著(P<0.05)。GC-IMS结合OPLS-DA和预测变量重要性投影(Variable importance in projection,VIP)分析筛选出10种关键性挥发性物质,分别为香茅醛、(Z)-4-庚烯醛、丁醛、3-甲硫基丙醛、1-辛烯-3-醇、正丁醇、(Z)-2-戊烯-1-醇、1-戊烯-3-酮、(E)-2-己烯和吡啶。ROAV显示,(E)-2-壬烯醛是黑鱼油风味的主要贡献者,与1-辛烯-3-醇、(E,E)-2,4-庚二烯醛、香茅醛、正辛醛、(Z)-4-庚烯醛、己醛、3-甲基丁醛、丙醛、庚醛、3-甲硫基丙醛、2-己酮、戊酸乙酯、2-正戊基呋喃和2-己烯17种关键性风味物质共同构成了黑鱼油的独特香气。综上,脱酸和脱臭精炼显著减少黑鱼粗鱼油中关键性挥发性物质含量,提升鱼油品质。研究可为后期低腥味鱼油研发制备等提供理论依据。Abstract: The optimum conditions and the changes of volatile flavor compounds were studied in each stage of the refining process for the crude fish oil from Snakehead fish viscera. In this study, crude fish oil was extracted from Snakehead fish viscera, and then the degumming, deacidification, and decolorization conditions were optimized by a single factor with acid value and peroxide value as response values. Gas chromatography-ion mobility spectroscopy (GC-IMS) was used to detect the volatiles at different stages of refining fish oil, and the differences in volatiles at the stage of best refining fish oil were investigated by using chemometrics and orthogonal partial least squares discriminant analysis (OPLS-DA) combined with relative odor activity value (ROAV). The results showed that the best refining conditions of Snakehead fish oil were 0.6% phosphoric acid degum, 0.7% excess alkali (NaOH, 4 mol/L) deacidification, 5% active clay decolorization, and the acid value and peroxide value of fish oil were lowest, which were 0.59 mg KOH/g and 2.62 mmol/kg, respectively. A total of 58 volatile flavor compounds were detected by GC-IMS during the refining stage of Snakehead fish oil, among which aldehydes (25) were the most abundant, followed by alcohols (11) and ketones (8). The volatile flavor compound content of degumming oil was the highest, and the volatile flavor compound content gradually decreased with refining. After the deacidification and deodorization stage, the volatile flavor compounds decreased significantly (P<0.05). GC-IMS combined with OPLS-DA and variable importance in projection (VIP) analysis screened out 10 key volatile flavor compounds, as follows: citronellal, (Z)-4-heptenal, butanal, 3-methylthiopropanal, 1-octen-3-ol, n-butanol-M, cis-2-penten-1-ol, 1-penten-3-one, (E)-2-hexene and pyridine. ROAV results showed that (E)-2-nonenal was the major contributor to the flavor of Snakehead fish oil, along with 1-octen-3-ol, (E,E)-2,4-heptadienal, citronellal, n-octanal, (Z)-4-heptenal, hexanal, 3-methylbutanal, propanal, heptanal, 3-methylthio-propanal, 2-hexanone, ethyl pentanoate, 2-pentylfuran and 2-hexenal, which together contributed to the distinctive aroma of Snakehead fish oil. The results showed that refining significantly reduced the content of key volatile compounds in the Snakehead fish oil, and improved the quality of Snakehead fish oil. The results can provide a theoretical basis for preparing low-fishy fish oil in the future.
-
Keywords:
- Snakehead fish oil /
- refining /
- volatile organic compounds /
- GC-IMS /
- chemometric analysis
-
黑鱼(Channa Striata)又称乌鱼,是鲈形目鳢属的一种肉食性的鱼类,广泛分布于我国长江流域至黑龙江一带,具有较高的经济价值[1]。黑鱼肌肉富含丰富的营养成分,如蛋白质(17.63%~20.03%)和脂肪(0.10%~1.24%)[2]。黑鱼加工主要集中在鱼肉,产生包括内脏在内的40%~55%副产物。内脏随之丢弃不仅会造成资源的浪费,还会污染环境[3]。鱼油是鱼类副产物内脏开发的主要途径之一,黑鱼内脏鱼油含有二十碳五烯酸(Eicosapentaenoic acid,EPA)和二十二碳六烯酸(Docosahexaenoic acid,DHA)等大量多不饱和脂肪酸。长期食用鱼油可以起到预防心血管疾病、抗氧化、预防癌症和精神疾病的作用[4]。然而粗鱼油含有水分、磷脂、游离脂肪酸、色素等杂质[5]和部分源于蛋白质、微生物腐败自氧化而产生的醛酮类挥发性物质[6],极大地降低鱼油的稳定性和质量,需要经过脱胶、脱酸、脱色和脱臭得到精制鱼油以延长鱼油保质期,提升鱼油品质。
挥发性物质直接影响精制鱼油品质。气相色谱-离子迁移光谱(Gas chromatography-ion mobility spectroscopy,GC-IMS)作为检测挥发性物质方法之一,因其检测下限低、选择稳定性好、分析能力强和灵敏度高等优点,在检测食品中挥发性物质得到广泛应用[6]。相比传统的挥发性有机物分析技术气相色谱-质谱(Gas chromatography-Mass spectrometer,GC-MS),GC-IMS可以快速追踪挥发性特征,强调独特挥发性物质的细微差别[7]。GC-IMS软件得出的可视化图谱,可直观呈现出样品中挥发性物质的差异及变化情况[8]。前期研究发现,黑鱼粗鱼油在精制不同阶段的挥发性物质相对含量存在一定差异[5]。然而,黑鱼粗鱼油的最佳精制条件和精制阶段中挥发性物质的动态变化尚不清楚。
本研究以黑鱼内脏为原料提取粗鱼油,通过单因素实验得到单因素最佳的精制条件,并利用GC-IMS结合化学计量学方法对最佳条件下制备的鱼油进行挥发性物质分析,旨在比较黑鱼内脏粗鱼油精制过程的挥发性物质动态变化及其特征物质,以期为鱼油油脂行业有效控制鱼油风味品质提供依据。
1. 材料与方法
1.1 材料与仪器
新鲜黑鱼内脏 江西东坡实业有限公司;磷酸、乙醇、氢氧化钾、氢氧化钠、无水硫酸钠、碘化钾、乙醚、环己烷、异丙醇、二氯甲烷 西陇科学股份有限公司;三氯甲烷 成都科隆化学品有限公司;正己烷 天津大茂化学试剂厂;均为分析纯;2-丁酮、2-戊酮、2-己酮、2-庚酮、2-辛酮和2-壬酮 阿拉丁公司(均为分析纯)。
MXT-WAX毛细管色谱柱(30 m×0.53 mm,1.0 μm) 美国Restek公司;Eppendorf 5430/5430R高速冷冻离心机 德国Eppendorf公司;N-2000型紫外检测仪 上海嘉鹏科技有限公司;FlavourSpec® 气相离子迁移谱 G.A.S.公司(德国,Dortmund);CTC-PAL 3静态顶空自动进样装置 CTC Analytics AG 公司(瑞士,Zwingen)。
1.2 实验方法
1.2.1 黑鱼粗鱼油的制备
黑鱼内脏解冻后去除胆汁,料理机搅碎后加入正己烷1:4(g/mL),在45 ℃下超声30 min后离心(5000 r/min)10 min,取上层油液旋蒸后为黑鱼粗鱼油(Crude fish oil,CFO),置于−20 ℃密封保存待用。
1.2.2 粗鱼油的精制工艺
1.2.2.1 磷酸脱胶
参照Crexi[9]等方法并做部分修改。称取50 g粗鱼油,80 ℃水浴加热10 min并搅拌均匀,分别加入体积质量分数0.2%、0.4%、0.6%、0.8%、1.0%、1.2%、1.4%(V/m:V,磷酸体积;m,鱼油质量)的磷酸(85%),搅拌均匀,80 ℃下加热30 min,再以7800 r/min趁热离心10 min,取上层油样为脱胶鱼油(Degummed fish oil,D-GFO)。
1.2.2.2 超量碱脱酸
参照Crexi[9]方法并做部分修改。脱胶最佳条件下,30 g D-GFO中根据酸价加入理论碱量(7.13×10−4×油质量×酸价)和质量分数0.4%、0.5%、0.6%、0.7%、0.8%、0.9%、1.0%的超量碱(NaOH溶液,4 mol/L)。均匀搅拌后加热至45 ℃,保温30 min,静置分层,7800 r/min离心10 min,取上层。上层液加入等体积95 ℃去离子水,涡旋1.0 min后静置,去除水层,多次水洗至中性,此为脱酸鱼油(Deacidified fish oil,D-AFO)。
1.2.2.3 活性白土脱色
参照Chew[10]等方法并做部分修改。脱酸最佳条件下,30 g D-AFO加热至60 ℃,分别加入占鱼油质量3%、4%、5%、6%、7%的中性活性白土,600 r/min搅拌30 min,7800 r/min离心10 min,吸出上层油样为脱色鱼油(Decolorized fish oil,D-CFO)。
1.2.2.4 真空脱臭
参照Chew[10]等方法并做部分修改。将30 g D-CFO置于旋转蒸发仪中,真空度-0.1 MPa,温度70 ℃,转速35 r/min,旋转蒸发1.0 h,以除去挥发性物质和水分得到脱臭鱼油(Deodorized fish oil,D-OFO)。
1.2.3 黑鱼油基本理化指标测定
酸价测定:参照GB 5009.229-2016《食品安全国家标准 食品中酸价的测定》中的冷溶剂指示剂滴定法[11]。过氧化值测定:参照GB 5009.227-2023《食品安全国家标准 食品中过氧化值的测定》中的滴定法[12]。脱色率测定:取1.000 g鱼油与正己烷均匀混合后在448 nm处[13]测定吸收波长,并按(1)式计算脱色率。
(1) 式中:T为脱色率;A0为鱼油处理前吸光度;A1为鱼油处理后吸光度。
1.2.4 GC-IMS测定
参照Capitain等[14]方法,稍作修改,具体如下。
1.2.4.1 样品前处理
准确称取鱼油样品1.5 g置于20 mL顶空瓶中,80 ℃孵化20 min后进样。
1.2.4.2 进样条件
孵化温度:80 ℃;孵化时间:20 min;进样体积:500 µL;不分流进样;孵化转速:500 rpm/min;进样针温度:85 ℃。GC条件:色谱柱温度:60 ℃;载气:高纯氮(纯度≥99.999%);程序升压:初始流量2.00 mL/min保持2 min,在8 min内线性增至10.00 mL/min,在10 min内线性增至100.00 mL/min,保持10 min。色谱运行时间:30 min;进样口温度:80 ℃。IMS条件:电离源:氚源(3H);迁移管长度:53 mm;电场强度:500 V/cm;迁移管温度:45 ℃;漂移气:氮气(纯度≥99.999%);流速:150 mL/min;正离子模式。
1.2.4.3 挥发性成分鉴定与分析
检测6种正构酮的混标,建立保留时间和保留指数(Retention index,RI)的校准曲线,随后通过目标物的保留时间计算出该物质的保留指数,使用VOCal软件内置的GC保留指数数据库(NIST 2020)和IMS迁移时间数据库检索和比对,对目标物进行定性分析。利用VOCal数据处理软件中的Reporter、Gallery Plot和Dynamic PCA等插件分别生成挥发性成分的三维谱图、二维谱图、差异谱图、指纹图谱和PCA图谱,用于样品间挥发性物质的对比。RI计算公式如下所示:
(2) 式中:RI为保留指数;n为挥发性物质的碳原子数;t'(i)为待测组分的调整保留时间,min;t'(n)为具有n个碳原子正构烷烃的调整保留时间,min;t'(n+1)为具有n+1个碳原子的正构烷烃的调整保留时间,min。
1.2.5 关键风味物质评价方法
采用刘登勇等[15]提出的相对气味活度值(ROAV)法对黑鱼油精制过程中的关键风味物质进行分析。ROAV计算公式如下:
(3) 式中:C表示某挥发性成分的相对百分含量(%),T表示某挥发性成分对应的感觉值(mg/kg);Cmax表示对样品气味贡献程度最大的挥发性成分的相对百分含量(%),Tmax表示对样品气味贡献程度最大的挥发性成分对应的感觉阈值(mg/kg)。
所有挥发性成分ROAV≤100,并且挥发性成分的ROAV越大表明对样品气味的贡献程度就越大。ROAV≥1.0的挥发性成分是样品气味的关键香气成分。
1.3 数据处理
所有试验均做3次平行,结果以mean±sd表示。实验数据使用VOCal 0.4.03数据处理软件G.A.S公司(德国,Dortmund)处理,Origin 2021绘图。SIMCA 14.1进行OPLS-DA绘图计算VIP值,SPSS 16.0统计软件对数据进行单因素方差分析(ANOVA)。显著性差异分析采用Duncan检验,P<0.05表示差异显著。
2. 结果与分析
2.1 黑鱼油精制阶段单因素优化结果
2.1.1 磷酸添加量
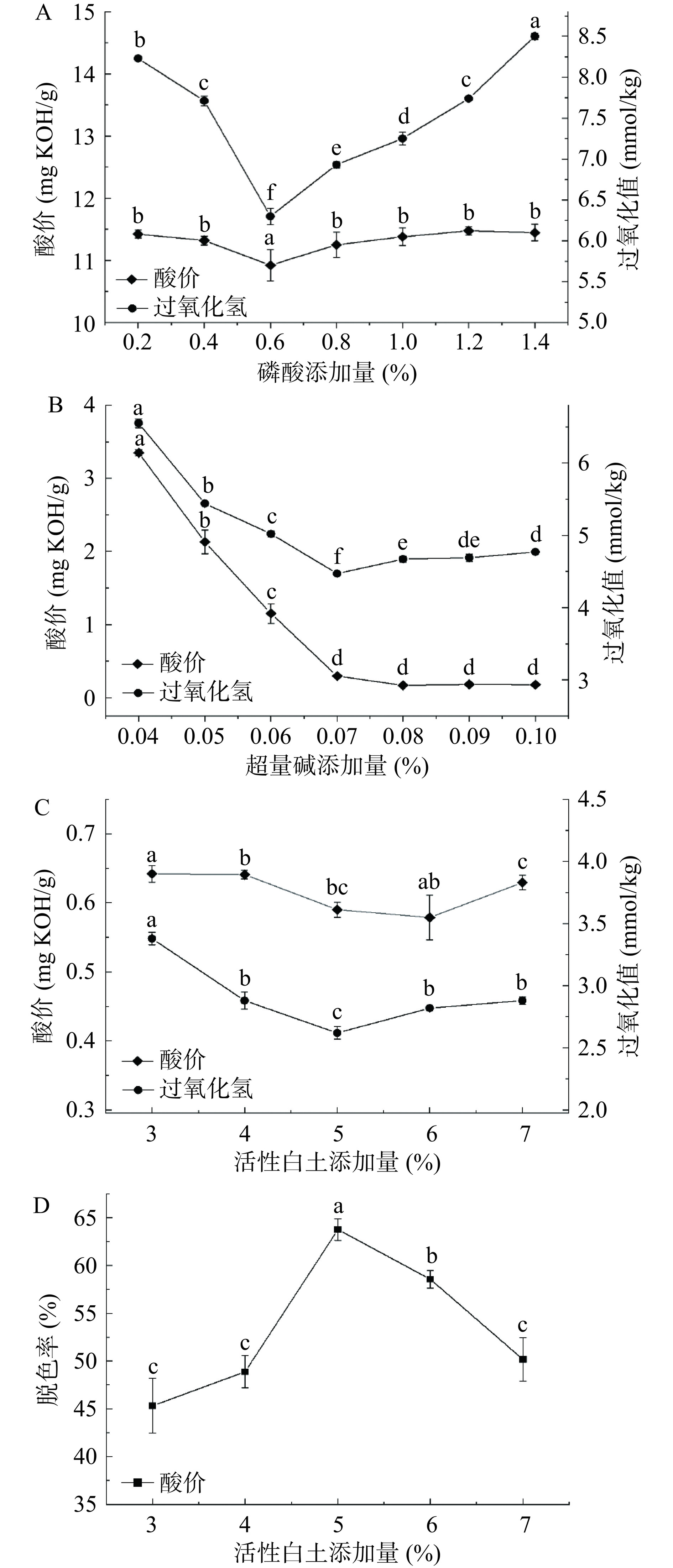
磷脂具备较强的亲水性,影响油脂的品质以及储存稳定性,从而影响油脂的品质和后续精深加工[16]。磷脂分子上含有磷酸,磷酸质量百分数与鱼油的酸价和氧化程度密切相关[17]。粗鱼油中加入如磷酸等弱酸可以使鱼油中的非水化磷脂转化为水化磷脂,增强磷脂和水的结合程度,磷脂吸水膨胀和油中重金属等物质凝聚、结合、沉降去除,从而提高鱼油品质。由图1A可知,当磷酸添加量达到0.6%时,鱼油酸价最低,为10.923 mg KOH/g,对比0.2%磷酸添加量组,鱼油酸价降低了4.59%。此时,鱼油过氧化值达到最低值,为6.30 mmol/kg,对比磷酸添加量为0.2%组差异显著(P<0.05),过氧化值降低30.63%。当磷酸添加量过高时,鱼油的氧化导致酸性增大,酸价和过氧化值上升。相似结果在李冲冲等[13]研究中发现。因此,后续试验选择0.6%磷酸添加量脱胶。
2.1.2 超量碱添加量
脱酸是通过酸碱中和的原理,让碱液与游离脂肪酸反应生成皂脚,吸附出油脂中原有的色素、蛋白质等物质[18]。由图1B可知,随着超量碱的添加,D-GFO的酸价和过氧化值均大幅下降。当超量碱的添加量从0.2%增加到0.7%时,鱼油酸价从3.40 mg KOH/g下降至0.30 mg KOH/g,过氧化值由6.55 mmol/kg降低至4.51 mmol/kg,且鱼油的酸价与过氧化值均达到国家一级精制鱼油的标准(酸价≤1.0 mg KOH/g,过氧化值≤5.0 mmol/kg)[19]。综上,后续试验选择0.7%超量碱作为最优脱酸工艺。
2.1.3 活性白土添加量
油脂的主要成分为甘油三酯,纯净的甘油三酯在凝聚状态下呈白色,流动状态下则无色[20]。由图1C可知,D-AFO的酸价和过氧化值随着活性白土添加量的增加呈现出先下降后上升的趋势。当活性白土添加量为5%时,D-CFO酸价达到0.59 mg KOH/g,过氧化值下降至2.62 mmol/kg。60 ℃高温下脱色,鱼油可能因为脂肪酸氧化导致脱酸油酸价上升,但仍符合国家一级精制鱼油标准。鱼油脱色率在活性白土添加量为5%时达到最高,为63.75%。当活性白土添加量继续增加,鱼油脱色率呈下降的趋势(图1D)。可能是因为添加5%的活性白土已经吸附油样中大部分色素,继续添加的活性白土会附着在底物表面,抑制吸附脱色效果[21]。故而活性白土添加量5%较为合适。
综上,黑鱼粗鱼油精制阶段最佳的条件为0.6%磷酸脱胶,0.7%超量碱量脱酸,5%活性白土脱色。
2.2 黑鱼内脏粗鱼油精制不同阶段GC-IMS谱图差异对比分析
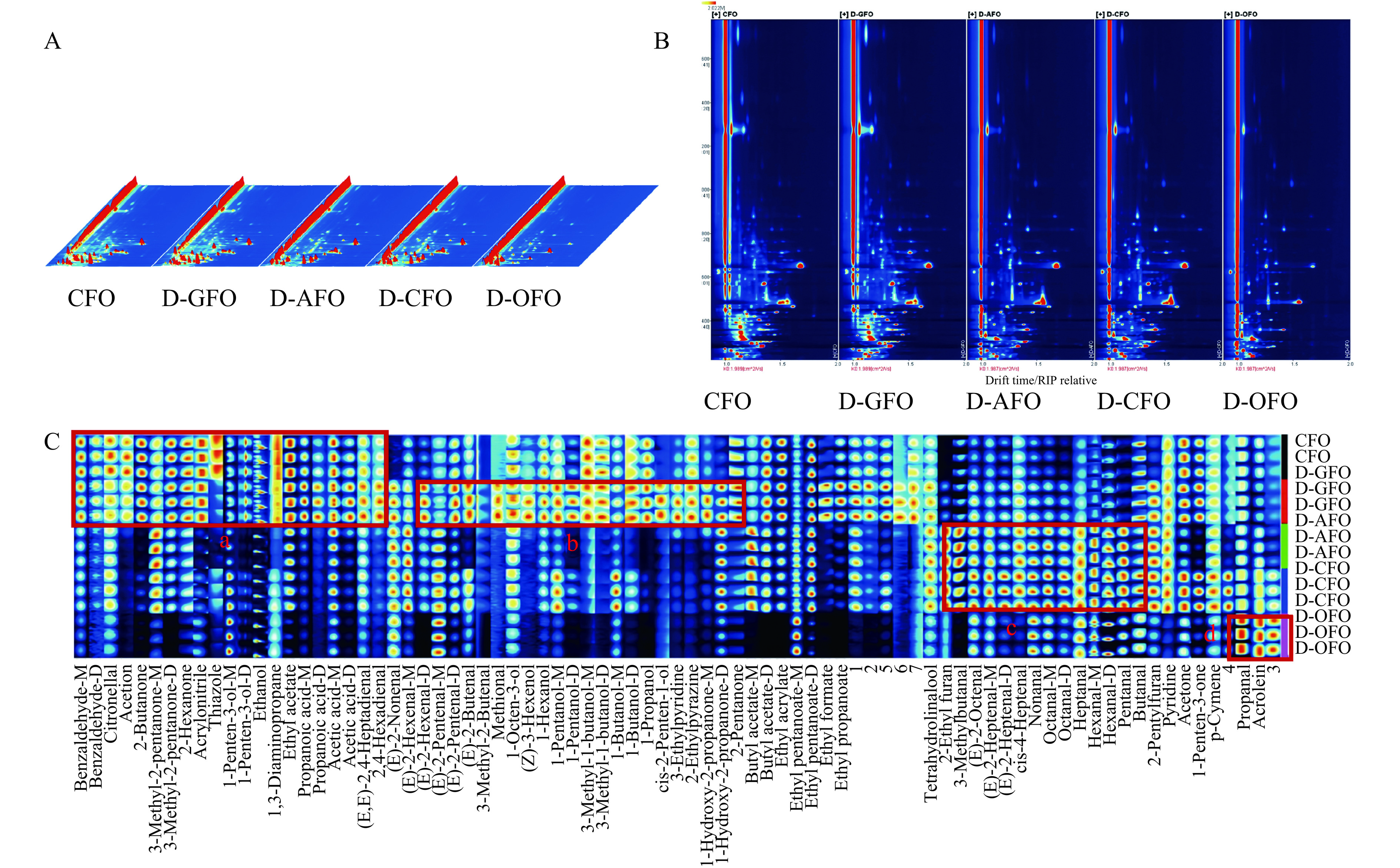
GC-IMS利用缓冲液中的离子迁移率不同,可以有效地分离和鉴定芳香化合物[22]。CFO、D-GFO、D-AFO、D-CFO、D-OFO的GC-IMS结果如图2所示。图2A显示了在不同精制阶段下的鱼油中挥发性物质的3D图谱。不同精制阶段鱼油中的挥发性物质具有相似性,但其信号强度略有不同。
利用CFO的参比光谱,通过维度消减法得到精炼不同阶段的鱼油挥发性2D图谱。颜色代表物质的峰强度,从蓝色到红色,颜色越深表示峰强度越大。如图2B所示,随着精制步骤的进行,蓝色化合物面积的比例逐渐增加。对比CFO,D-GFO中挥发性物质种类和浓度最高;D-AFO和D-CFO中挥发性物质种类相似,整体下降较为显著;D-OFO挥发性物质种类和浓度最低,下降最为显著。结果表明,CFO随着精制程度进行,鱼油中原有的挥发性物质的数量不断减少且浓度也呈减弱的趋势。这一发现与Zhang等[23]关于大黄鱼内脏粗鱼油的精制研究结果一致。
对挥发性物质处理后得到鱼油精炼各阶段指纹图谱,可以准确表示不同精制优化步骤导致鱼油挥发性物质含量的变化。CFO精制不同阶段GC-IMS指纹图谱如图2C所示,在精制不断处理后的鱼油样品中挥发性物质含量降低。在CFO和D-GFO中,a区中的挥发性成分浓度无显著性差别,包括香茅醛、乙偶姻和2-丁醛等。在D-GFO样品中,b区域的挥发性物质含量最高,包括E-2-己烯(D)、E-2-丁烯醛、1-戊醇(D)和2-戊酮等19种挥发性物质组成。同时,在D-AFO和D-CFO样品中,c区主要由2-乙基呋喃、异戊醇、正辛醇(D)和庚醛等14种挥发性物质组成。d区含有3种挥发性物质,其中D-OFO样本中挥发性物质含量最高,有丙烯醛和丙醛等。精制不同阶段的黑鱼内脏鱼油样品的挥发性成分差异显著(P<0.05),脱胶能形成粗鱼油新的挥发性物质(b区),对鱼油整体风味增强,可能与高温脱胶导致脂肪酸氧化有关。脱酸去除脱胶油中大部分挥发性物质,鱼油整体风味显著降低,同时生成新的挥发性物质(c区),可能与游离脂肪酸的去除有关。脱色对脱酸油挥发性物质影响不大,同时形成少量新的挥发性物质,可能与高温脱色导致脂肪酸氧化有关。脱臭去除了脱色油中大部分挥发性物质,鱼油整体风味大幅度降低,同时形成少量新的挥发性物质(d区),可能与高温脱臭后余热温度导致脂肪酸氧化未被脱去有关。综上,黑鱼粗鱼油在精制过程中引入的新的挥发性物质会伴随着COF原有的挥发性物质在脱酸和脱臭阶段中脱除。
2.3 黑鱼内脏粗鱼油精制不同阶段挥发性物质多元统计学分析
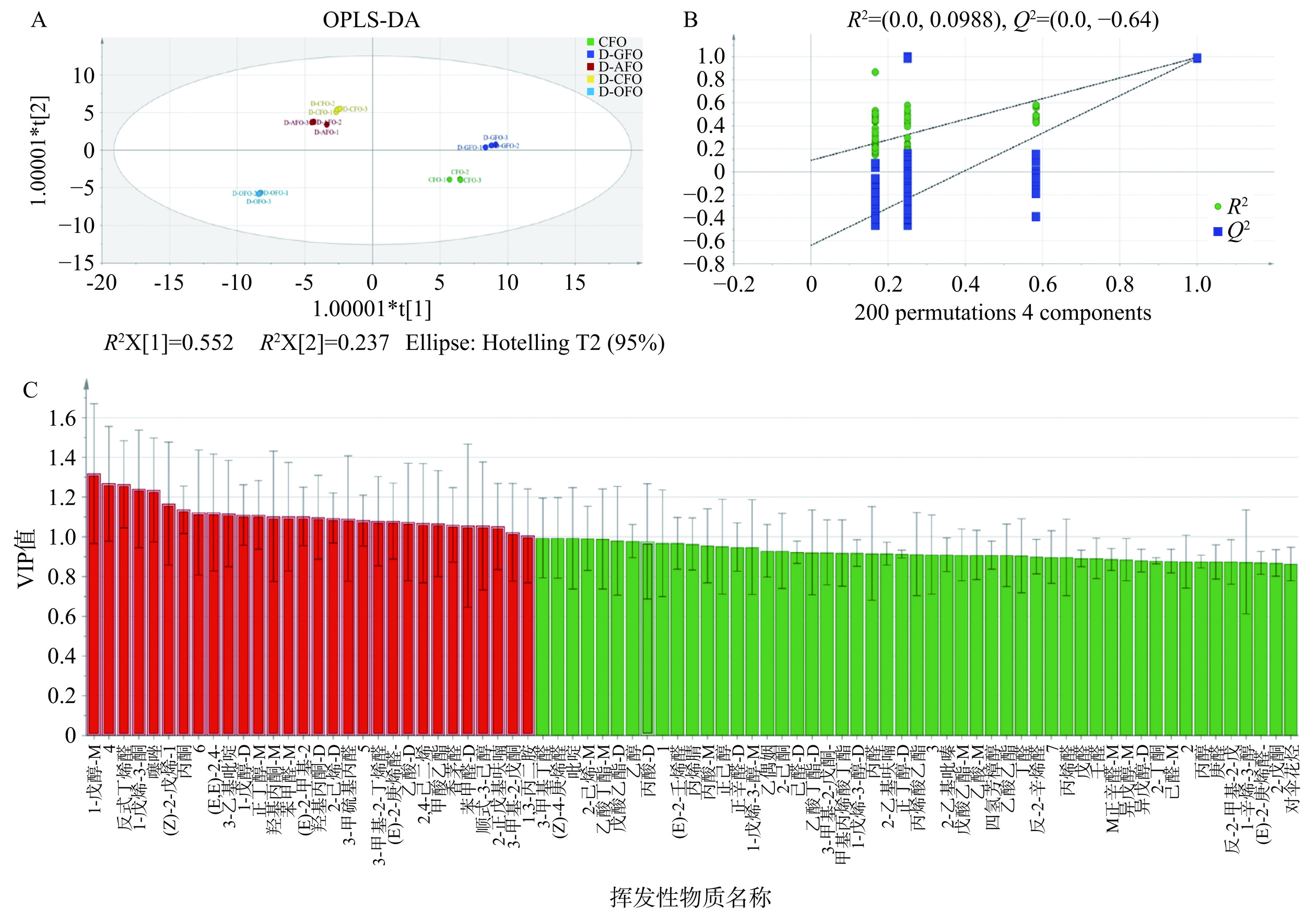
利用鱼油的GC-IMS数据构建出OPLS-DA模型中R2y=0.994,Q2=0.988,接近1.0,说明该模型拥有良好的解释率和预测性。五个鱼油样本总体分布分散,D-CFO和D-AFO分布在第二象限,表明挥发性物质比较相似。D-GFO仅分布在第一象限,D-OFO仅分布在第三象限、CFO完全分布在第四象限,说明黑鱼粗鱼油精制不同阶段在挥发性物质相似性上存在较大差异(图3A)。置换检验用于模型的进一步验证,置换检验中成功的模型才可用于数据可视化和随后的VIP计算。经过200次置换试验后,R2=0.0988,Q2=−0.64,R2均高于Q2值,且Q2与y轴相交于负半轴(图3B),说明该模型不存在过拟合的现象[25],实现了不同精制阶段中鱼油的快速区分。
预测变量重要性(VIP)描述了每个变量对模型的总体贡献,可作为评估个体变量在分类和区分方面的强度和解释能力的手段[25]。VIP>1.0的挥发性物质在图3C中以红色突出显示,并且根据P<0.05且VIP>1.0的标准对鱼油样品分类结果筛选出有显著贡献的12种物质,差异贡献度从大到小依次为香茅醛、3-乙基吡啶、M-羟基丙酮、(Z)-4-庚烯醛、D-2-己烯、M-乙酸丁酯、(Z)-3-丁烯醛、3-甲基丁醛、甲酸乙酯、丁醛、D-正辛醛,此类挥发性有机化合物含量的变化导致在精制不同阶段鱼油的挥发性风味发生显著变化(P<0.05)。结果表明,GC-IMS结合VIP值可以准确地识别鱼油精制各阶段的差异挥发性物质。
2.4 黑鱼内脏粗鱼油精制不同阶段挥发性物质的变化
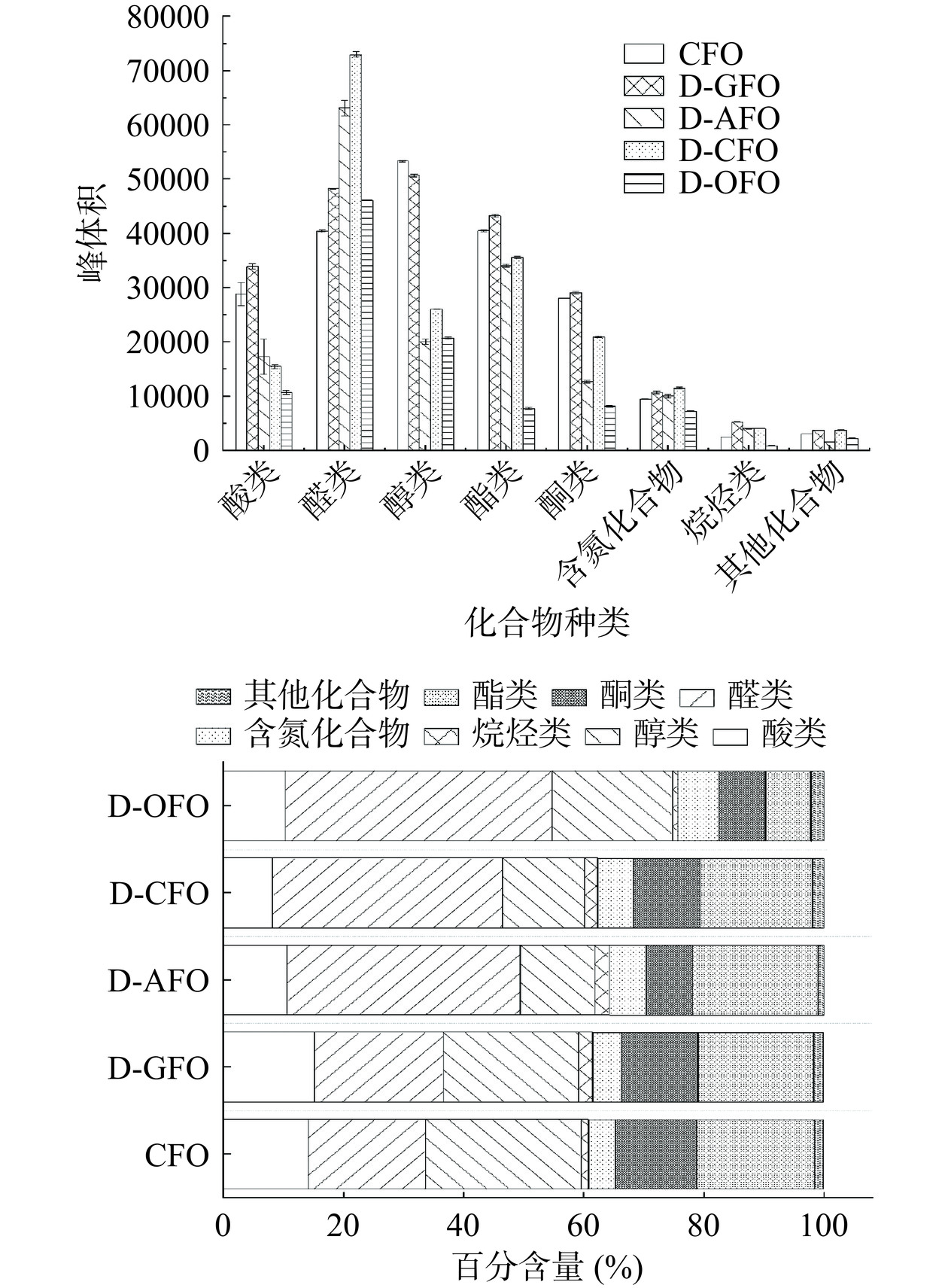
黑鱼内脏粗鱼油精制不同阶段样品GC-IMS共检测出81个色谱信号峰,其中74个信号峰为明确的挥发性物质。筛除单倍体和二聚体重复出现的物质,黑鱼粗鱼油精炼不同阶段样品中共鉴定出58种芳香化合物,包括22种醛类、11种醇类、8种酮类、7种含氮类化合物、6种酯类、2种烷烃和2种醇类。
鱼油中挥发性物质对整体风味的贡献大小由相对含量和感官阈值共同决定[27]。因此,采用相对香气活度值对鱼油精制过程中挥发性风味物质进行分析,确定关键性风味化合物。如表1所示。ROAV越高,被认为对样品整体风味的贡献越大,以ROAV≥1.0作为评价关键挥发性物质的标准,共鉴定出了17种关键性风味物质,分别为1-辛烯-3-醇、(E,E)-2,4-庚二烯醛、香茅醛、(E)-2-辛烯醛、正辛醛、(Z)-4-庚烯醛、己醛、3-甲基丁醛、丙醛、庚醛、(E)-2-壬烯醛、3-甲硫基丙醛、2-己酮、戊酸乙酯、2-正戊基呋喃和2-己烯。粗鱼油精制后,关键性风味物质ROAV均降低。精制不同阶段鱼油中(Z)-4-庚烯醛ROAV均最高,为黑鱼油风味的主要贡献者。
表 1 精制过程中黑鱼油关键性风味物质变化Table 1. Changes in key flavor components of snakehead fish oil during refining化合物名称 感官阈值(μg/kg)[26] ROAV 气味特征描述 CFO D-GFO D-AFO D-CFO D-OFO 1-辛烯-3-醇 1.00 8.67 2.62 2.67 3.00 2.35 蘑菇香、土腥味、油脂味 (E,E)-2,4-庚二烯醛 10.00 3.13 1.17 0.83 0.88 0.64 油脂味、鱼腥味、青草香 香茅醛 3.50 3.24 0.82 0.81 0.91 0.71 柠檬味、柑橘味 (E)-2-辛烯醛 3.00 4.89 2.70 2.89 3.40 2.98 油脂味、肉类、黄瓜 壬醛 1.00 20.67 10.71 14.17 15.00 16.12 腊香、清香、玫瑰花香 辛醛 0.70 35.24 23.13 34.52 40.00 28.07 醛香、腊香、脂香 (Z)-4-庚烯醛 1.00 16.00 6.43 7.00 7.80 1.88 油脂味、青草味、奶油味 己醛 5.00 74.93 29.10 52.60 55.48 32.56 油脂味、汗味、青草味 3-甲基丁醛 10.8 6.79 2.05 6.08 5.19 0.33 可可味、发酵香、水果味 丙醛 68.00 2.08 0.68 0.62 0.81 1.16 霉味、酵母味、坚果味 庚醛 3.00 3.78 1.51 2.67 2.87 2.90 油脂味、清香、醛香 (E)-2-壬烯醛 0.10 100.00 100.00 100.00 100.00 100.00 油脂味、清香、醛香 3-甲硫基丙醛 0.05 66.67 57.14 23.33 32.00 32.94 醛香、腊香、脂香 2-己酮 90.00 1.97 0.63 0.44 0.47 0.16 肉汤味、黄油味 戊酸乙酯 94.00 5.33 1.82 1.77 1.84 0.36 果香、杏仁味 2-正戊基呋喃 6.00 1.44 1.63 1.69 1.77 0.90 金属味、土腥味、蜡香 2-己烯 17.00 3.88 2.90 2.17 2.24 0.42 脂肪味、果香 注:气味描述来源于http://www.perflavory.com/index.html。 黑鱼粗鱼油精制不同阶段的挥发性物质种类及含量如图4所示。随着鱼油精制的进行,CFO阶段至D-CFO阶段中鱼油中醛类含量呈现增加趋势,鱼油在脱酸和脱色过程中加热会导致脂质氧化及脂肪酸裂解,从而导致醛类含量增加。D-OFO样品在真空旋转蒸发仪的作用下醛类物质种类有所下降,但百分含量上升。醛主要来源于脂肪酸降解,因醛基团中的碳原子带正电荷,容易受到亲核分子的攻击,使得醛相对活跃[28],容易被还原为醇或被氧化为酸[29]。醛的味觉阈值相对较低,低浓度下表现为令人愉悦的青草香。3-甲基丁醛为脂肪酶催化反应和多不饱和脂肪酸的氧化分解产生的一种支链醛,是亮氨酸与还原糖在高温下进行Strecker降解的重要中间体,有着强烈的挥发性风味,表现为发酵香、坚果香、咖啡香风味[30]。辛醛类饱和醛来自于亚油酸和油酸的自氧化,而(Z)-3-丁烯醛主要由亚油酸的氧化降解生成[31]。醇类主要来源为不饱和脂肪酸的氧化以及氨基酸的衍生作用,如1-辛烯-3醇,兼具蘑菇、干草香、清香带甜气味[32]。脂肪氧合酶在有氧情况下可将亚油酸生成氢过氧化物,并在氢过氧化物裂解酶的酶切下得到1-辛烯-3-醇。部分氨基酸降解后可以生成醇类物质,如伴有果香、薄荷味的3-甲基-1-丁醇为亮氨酸的典型降解物[33]。醇类挥发性物质种类和百分含量在黑鱼粗鱼油精制过程中呈现下降趋势。酮通常由氨基酸的分解和多不饱和脂肪酸的热氧化降解而产生。1-戊烯-3-酮被认为是鱼油和富含鱼油的食品中鱼腥味的主要来源之一,在鱼腥味形成的过程当中,(Z)-4-庚烯醛和(E,E)-2,4-庚二烯醛具有补偿作用,而(E,Z)-2,6-壬二烯醛和(Z)-4-庚烯醛具有协同作用[34]。此三种物质在单独存在时并不会出现鱼腥味,组合时可加强油脂中的鱼腥味[35]。醇类挥发性物质种类和百分含量在黑鱼粗鱼油精制过程脱色阶段略有增加,但整体呈现下降趋势。如图4所示,在前期精制阶段中,酯类物质占鱼油挥发性物质含量并无显著变化(P>0.05),由于其性质的不稳定,加热后脱臭的鱼油中酯类占D-OFO中挥发性物质百分含量显著减少(P<0.05)。酯类物质有着独特的水果香气[34],油脂的气味更加丰富。乙酸乙酯(葡萄味、白兰地气味)作为鱼油精制步骤中的关键性风味化合物,带来水果气味时增加酒香味,气味更为丰富[33]。酸类挥发性物质多来源于脂类的氧化分解,常呈现为令人难以接受的汗味、刺激性气味,具有较高的气味阈值[36]。磷酸脱胶使酸类种类和百分含量在D-GFO中最高,但对鱼油风味产生较小影响。含氮杂环风味化合物在D-CFO中种类最多但百分含量下降。以呋喃类化合物为例,2-乙基呋喃的形成一般由EPA或DHA的自氧化生成,鱼油精制过程中涉及到高温脱胶、脱酸后水洗等步骤会破坏EPA或DHA中的二烯键,分子断裂后环化形成过氧化物,经过β断裂转化为4-羟基-α,β-不饱和醛,进而形成呋喃结构[37]。油脂氧化程度越高则呋喃类化合物含量也会越高。在大量的Omega-3补充剂中,包括鱼油、鱼肝油、磷虾油和微藻油,(E,Z/E,E)-2,4-庚二烯醛含量最高,其次是1-戊烯-3-醇、(E)-2-己烯醛和2-乙基呋喃,表明此类物质可能参与了鱼腥味的形成[38]。鱼油中精制过程中辛醛与(Z)-4-庚烯醛ROAV变化趋势相同,经脱胶后ROAV明显降低,脱酸后升高,但脱色和脱臭后下降,说明精制过程中脱胶、脱色和脱臭能有效去除腥味物质,ROAV显著降低,而脱酸过程中可能热水水洗导致风味成分发生变化从而ROAV升高。精制过后17种关键性风味化合物均降低,表明精制有效去除了鱼油中一些带有不良风味的挥发性物质。Guo[39]等研究表明,己醛、3-甲基丁醛、异丁醛、戊醛、1-辛烯-3-醇、2-甲基丁酸甲酯、庚醛、己醛、丙醛、丁醛和苯乙醛是鲥鱼粗鱼油中的关键性风味物质,经精制后庚醛、己醛、丙醛、丁醛和苯乙醛外,其他物质的ROAV均不同程度降低,与本文结果类似。
3. 结论
本研究以黑鱼内脏为原料提取粗鱼油,将粗鱼油进行精制阶段单因素优化,利用GC-IMS对最佳精制阶段鱼油的挥发性物质进行测定。黑鱼粗鱼油精制单因素下最佳条件为0.6%磷酸脱胶,0.7%超量碱脱酸和5%活性白土脱色,鱼油酸价和过氧化值整体最低。黑鱼粗鱼油精制阶段共检测出58种挥发性物质,结合VIP>1.0和P>0.05,鉴定出10种关键性物质,分别为香茅醛、(Z)-4-庚烯醛、丁醛、3-甲硫基丙醛、1-辛烯-3-醇、正丁醇-M、(Z)-2-戊烯-1-醇、1-戊烯-3-酮、(E)-2-己烯-D和吡啶。根据GC-IMS的结果,鱼油从粗鱼油阶段到脱臭的优化阶段的挥发性物质含量呈降低的趋势。据OPLS-DA的结果,得出精制鱼油的挥发性物质在脱胶阶段和脱色阶段时相似,粗鱼油、脱酸阶段和脱臭阶段的挥发性物质有着显著区别。根据ROAV结果,鉴定出17种关键性风味化合物,分别为(E)-2-壬烯醛、1-辛烯-3-醇、(E,E)-2,4-庚二烯醛、香茅醛、正辛醛、(Z)-4-庚烯醛、己醛、3-甲基丁醛、丙醛、庚醛、(E)-2-壬烯醛、3-甲硫基丙醛、2-己酮、戊酸乙酯、2-正戊基呋喃和2-己烯。结果显示黑鱼内脏粗鱼油挥发性物质主要在脱酸和脱臭精炼阶段进行有效去除。研究建立了黑鱼鱼油精制步骤导致的挥发性物质的指纹谱库,同时GC-IMS结合化学计量法可以准确地识别鱼油精制阶段的差异挥发性物质,ROAV可计算出黑鱼油精炼过程中的关键性挥发性物质。
-
表 1 精制过程中黑鱼油关键性风味物质变化
Table 1 Changes in key flavor components of snakehead fish oil during refining
化合物名称 感官阈值(μg/kg)[26] ROAV 气味特征描述 CFO D-GFO D-AFO D-CFO D-OFO 1-辛烯-3-醇 1.00 8.67 2.62 2.67 3.00 2.35 蘑菇香、土腥味、油脂味 (E,E)-2,4-庚二烯醛 10.00 3.13 1.17 0.83 0.88 0.64 油脂味、鱼腥味、青草香 香茅醛 3.50 3.24 0.82 0.81 0.91 0.71 柠檬味、柑橘味 (E)-2-辛烯醛 3.00 4.89 2.70 2.89 3.40 2.98 油脂味、肉类、黄瓜 壬醛 1.00 20.67 10.71 14.17 15.00 16.12 腊香、清香、玫瑰花香 辛醛 0.70 35.24 23.13 34.52 40.00 28.07 醛香、腊香、脂香 (Z)-4-庚烯醛 1.00 16.00 6.43 7.00 7.80 1.88 油脂味、青草味、奶油味 己醛 5.00 74.93 29.10 52.60 55.48 32.56 油脂味、汗味、青草味 3-甲基丁醛 10.8 6.79 2.05 6.08 5.19 0.33 可可味、发酵香、水果味 丙醛 68.00 2.08 0.68 0.62 0.81 1.16 霉味、酵母味、坚果味 庚醛 3.00 3.78 1.51 2.67 2.87 2.90 油脂味、清香、醛香 (E)-2-壬烯醛 0.10 100.00 100.00 100.00 100.00 100.00 油脂味、清香、醛香 3-甲硫基丙醛 0.05 66.67 57.14 23.33 32.00 32.94 醛香、腊香、脂香 2-己酮 90.00 1.97 0.63 0.44 0.47 0.16 肉汤味、黄油味 戊酸乙酯 94.00 5.33 1.82 1.77 1.84 0.36 果香、杏仁味 2-正戊基呋喃 6.00 1.44 1.63 1.69 1.77 0.90 金属味、土腥味、蜡香 2-己烯 17.00 3.88 2.90 2.17 2.24 0.42 脂肪味、果香 注:气味描述来源于http://www.perflavory.com/index.html。 -
[1] 马天新. 黑鱼鱼肉ACE抑制肽的制备及快速筛选[D]. 南昌:江西师范大学, 2022. [MA T X. Preparation and rapid screening of ACE inhibitor peptides from Channa striatus[D]. Nanchang:Jiangxi Normal University, 2022.] MA T X. Preparation and rapid screening of ACE inhibitor peptides from Channa striatus[D]. Nanchang: Jiangxi Normal University, 2022.
[2] 陈胜军, 路美明, 相欢, 等. 乌鳢营养评价与加工保鲜技术研究进展[J]. 肉类研究,2023,37(2):40−45. [CHEN S J, LU M M, XIANG H, et al. Research progress on nutritional evaluation of and processing and preservation technologies for Channa argus[J]. Meat Research,2023,37(2):40−45.] CHEN S J, LU M M, XIANG H, et al. Research progress on nutritional evaluation of and processing and preservation technologies for Channa argus[J]. Meat Research, 2023, 37(2): 40−45.
[3] 黄丽金, 闻怡凡, 罗美玲, 等. 提取温度对乌鱼鱼鳞明胶功能性质和结构特性的影响[J]. 食品工业科技,2024,45(9):83−90. [HUANG L J, WEN Y F, LUO M L, et al. The effect of extraction temperature on the functional and structural properties of cuttlefish scale gelatin[J]. Science and Technology of Food Industry,2024,45(9):83−90.] HUANG L J, WEN Y F, LUO M L, et al. The effect of extraction temperature on the functional and structural properties of cuttlefish scale gelatin[J]. Science and Technology of Food Industry, 2024, 45(9): 83−90.
[4] MONTAZER M, EBRAHIMPOUR S, SURKAN J, et al. Effects of fish-oil consumption on psychological function outcomes in psychosis:A systematic review and dose–response meta-analysis of randomized controlled trials[J]. Advances in Nutrition,2022,13(6):2149−2164. doi: 10.1093/advances/nmac083
[5] 张权, 王为, 吴思纷, 等. 黑鱼油精制过程中品质及风味成分变化[J]. 食品科学,2023,44(12):208−216. [ZHANG Q, WANG W, WU S F, et al. Changes in the quality and flavor components of Snakehead fish oil during refining[J]. Food Science,2023,44(12):208−216.] ZHANG Q, WANG W, WU S F, et al. Changes in the quality and flavor components of Snakehead fish oil during refining[J]. Food Science, 2023, 44(12): 208−216.
[6] JOSCHA C, SASCHA, R, PHILIPP W. GC-IMS-tools—A new Python package for chemometric analysis of GC–IMS data[J]. Food Chem,2022,394:133476. doi: 10.1016/j.foodchem.2022.133476
[7] WANG Z L, MI S, WANG X H, et al. Characterization and discrimination of fermented sweet melon juice by different microbial strains via GC-IMS-based volatile profiling and chemometrics[J]. Food Science and Human Wellness,2023,12(4):1241−1247. doi: 10.1016/j.fshw.2022.10.006
[8] GU S, WANG Z H, CHEN W, et al. Targeted versus nontargeted green strategies based on headspace-gas chromatography-ion mobility spectrometry combined with chemometrics for rapid detection of fungal contamination on wheat kernels[J]. Journal of Agricultural and Food Chemistry,2020,68(45):12719−12728. doi: 10.1021/acs.jafc.0c05393
[9] CREXI V T, MONTE M L, SOARES L A, et al. Production and refinement of oil from carp (Cyprinus carpio) viscera[J]. Food Chemistry,2010,119(3):945−950. doi: 10.1016/j.foodchem.2009.07.050
[10] CHEW S C, ALI M A. Recent advances in ultrasound technology applications of vegetable oil refining[J]. Trends in Food Science & Technology,2021,116:468−479.
[11] 国家卫生和计划生育委员会. 食品安全国家标准 食品中酸价的测定:GB 5009.229-2016[S]. 北京:中国标准出版社, 2016:1−4. [National Health and Family Planning Commission. National food safety standard-Determination of acid price in food:GB 5009.229-2016[S]. Beijing:Standards Press of China, 2016:1−4.] National Health and Family Planning Commission. National food safety standard-Determination of acid price in food: GB 5009.229-2016[S]. Beijing: Standards Press of China, 2016: 1−4.
[12] 国家卫生和计划生育委员会. 食品安全国家标准 食品中过氧化值的测定:GB 5009.227-2023[S]. 北京:中国标准出版社, 2023:2-4. [National Health and Family Planning Commission. National food safety standard-Determination of Determination of peroxide value in food:GB 5009.227-2023[S]. Beijing:Standards Press of China, 2016:1-4.] National Health and Family Planning Commission. National food safety standard-Determination of Determination of peroxide value in food: GB 5009.227-2023[S]. Beijing: Standards Press of China, 2016: 1-4.
[13] 李冲冲, 李子豪, 柳余莉, 等. 鱼粉加工副产物中鱼油的精炼及其脂肪酸组成分析[J]. 食品科学,2015,36(20):190−193. [LI C C, LI Z H, LIU Y L, et al. Refinement of fish oil from byproducts of fish meal processing and its fatty acid composition analysis[J]. Food Science,2015,36(20):190−193.] doi: 10.7506/spkx1002-6630-201520036 LI C C, LI Z H, LIU Y L, et al. Refinement of fish oil from byproducts of fish meal processing and its fatty acid composition analysis[J]. Food Science, 2015, 36(20): 190−193. doi: 10.7506/spkx1002-6630-201520036
[14] CAPITAIN C, WELLER P. Non-targeted screening approaches for profiling of volatile organic compounds based on gas chromatography-ion mobility spectroscopy (GC-IMS) and machine learning[J]. Molecules,2021,26(18):5457. doi: 10.3390/molecules26185457
[15] 刘登勇, 周光宏, 徐幸莲. 确定食品关键风味化合物的一种新方法:“ROAV”法[J]. 食品科学,2008(7):370−374. [LIU D Y, ZHOU G H, XU X L, et al. “ROAV” Method:A new method for determining key odor compounds of rugao ham[J]. 食品科学,2008(7):370−374.] LIU D Y, ZHOU G H, XU X L, et al. “ROAV” Method: A new method for determining key odor compounds of rugao ham[J]. 食品科学, 2008(7): 370−374.
[16] LIU X, WANG W F, XU L, et al. Effects of different degumming processes on the molecular species and microstructures of phospholipids recovered from crude vegetable oils[J]. LWT-Food Science and Technology,2023,185:115126. doi: 10.1016/j.lwt.2023.115126
[17] 吴永祥, 雍张, 王茵, 等. 鳜鱼内脏副产物中鱼油的精炼及其品质分析[J]. 食品与机械,2022,38(9):204−210,226. [WU Y X, YONG Z, WANG Y, et al. Refining and quality analysis of fish oil from mandarin fish viscera byproducts[J]. Food & Machinery,2022,38(9):204−210,226.] WU Y X, YONG Z, WANG Y, et al. Refining and quality analysis of fish oil from mandarin fish viscera byproducts[J]. Food & Machinery, 2022, 38(9): 204−210,226.
[18] WANG Z, MA X, ZHENG C, et al. Effect of adsorption deacidification on the quality of peony seed Oil[J]. Foods,2023,12(2):240. doi: 10.3390/foods12020240
[19] 中国人民共和国农业部. 鱼油:SC/T 3502-2016[S]. 北京:中国标准出版社, 2016:1−2. [Ministry of Agriculture of the People's Republic of China. Fish oil:SC/T 3502-2016[S]. Beijing:China Standard Press, 2016:1−2.] Ministry of Agriculture of the People's Republic of China. Fish oil: SC/T 3502-2016[S]. Beijing: China Standard Press, 2016: 1−2.
[20] HUANG S, HU Y M, JIN W W, et al. Modeling of bleaching process of camellia oil using multiple surrogate models[J]. LWT-Food Science and Technology,2023,189:115139.
[21] 黄承都, 艾硕, 刘纯友, 等. 壳聚糖/活性白土糖用复合脱色剂的制备及其吸附特性研究[J]. 食品工业科技,2022,43(8):76−84. [HUANG C D, AI S, LIU C Y, et al. Preparation and adsorption properties of chitosan/active clay composite as sugar juice decolorization agent[J]. Science and Technology of Food Industry,2022,43(8):76−84.] HUANG C D, AI S, LIU C Y, et al. Preparation and adsorption properties of chitosan/active clay composite as sugar juice decolorization agent[J]. Science and Technology of Food Industry, 2022, 43(8): 76−84.
[22] OLLER(M)ORENOCl S, MALLAFRE(M)URO C, FERNANDEZ L, et al. GCIMS:An R package for untargeted gas chromatography–Ion mobility spectrometry data processing[J]. Chemometrics and Intelligent Laboratory Systems,2023,241:104938. doi: 10.1016/j.chemolab.2023.104938
[23] ZHANG L Y, WEI W, HUANG L Y, et al. Quality assessment of large yellow croaker (Larimichthys crocea) roe oil before and after refining[J]. RSC Advances,2021,11(23):14103−14112. doi: 10.1039/D0RA09546J
[24] WU W Y, WANG X Y, HU P, et al. Research on flavor characteristics of beef cooked in tomato sour soup by gas chromatography-ion mobility spectrometry and electronic nose[J]. LWT - Food Science and Technology,2023,179:114646. doi: 10.1016/j.lwt.2023.114646
[25] RONG Y T, XIE J L, YUAN H B, et al. Characterization of volatile metabolites in Pu-erh teas with different storage years by combining GC-E-Nose, GC-MS, and GC-IMS[J]. Food Chemistry X,2023,18:100693. doi: 10.1016/j.fochx.2023.100693
[26] 里奥 范海默特. 化合物香味阈值汇编[M]. 科学出版社, 2015. [LEOVAN H. Compilation of compound flavor thresholds[M]. Science Press, 2015.] LEOVAN H. Compilation of compound flavor thresholds[M]. Science Press, 2015.
[27] ZHU Y, CHENG J, CHEN X, et al. Use of relative odor activity value (ROAV) to link aroma profiles to volatile compounds:application to fresh and dried eel (Muraenesox cinereus)[J]. International Journal of Food Properties,2020,23(1):2257−2270. doi: 10.1080/10942912.2020.1856133
[28] ZHANG X Y, WANG A X, YAO H L, et al. Research advancements on the flavor compounds formation mechanism of pickled bamboo shoots in river snails rice noodles[J]. LWT-Food Science and Technology,2023,186:115226. doi: 10.1016/j.lwt.2023.115226
[29] SMITT B A, ENGELS J M, SMIT G. Branched chain aldehydes:production and breakdown pathways and relevance for flavour in foods[J]. Applied Microbiology and Biotechnology,2008,81(6):987−999.
[30] YUAN Q N, TU M J, GAO P, et al. Comparative analysis of rapeseed oils prepared by three different methods[J]. Journal of Oleo Science,2020,69(12):1641−1648. doi: 10.5650/jos.ess20188
[31] CAO J, JIANG X, CHEN Q Y, et al. Oxidative stabilities of olive and camellia oils:Possible mechanism of aldehydes formation in oleic acid triglyceride at high temperature[J]. LWT-Food Science and Technology,2020,118:108858. doi: 10.1016/j.lwt.2019.108858
[32] JIANG H, ZHANG M T, YE J J, et al. HS-SPME-GC(M)S and OAV analyses of characteristic volatile flavour compounds in salt-baked drumstick[J]. LWT-Food Science and Technology,2022,170:114041. doi: 10.1016/j.lwt.2022.114041
[33] HE J H, WU X H, YU Z L. Microwave pretreatment of camellia (Camellia oleifera Abel.) seeds:Effect on oil flavor[J]. Food Chemistry, 2021, 364:130388.
[34] XUE C, YOU J, ZHANG, et al. Capacity of myofibrillar protein to adsorb characteristic fishy-odor compounds:Effects of concentration, temperature, ionic strength, pH and yeast glucan addition[J]. Food Chemistry, 363:130304.
[35] VENKATESHWARLU G. , LET M. B, MEYERA. S. Modeling the sensory impact of defined combinations of volatile lipidoxidation products on fishy and metallic off-flavors[J]. Journal of Agricultural and Food Chemistry, 52(6), 1635−1641.
[36] LIU P, WANG X; XIANG Q, et al. Optimization of intelligent post-fermentation and quality analysis of pixian broad-bean paste[J]. Food Science,2020,41:166−176.
[37] FRANKEL E. N. Lipid Oxidation. Chapters 2 & 4 (2nd ed.). Woodhead Publishing Limited.
[38] DAMERAU A, AHONEN E, KORTESNIEMI M, et al. Evaluation of the composition and oxidative status of omega-3 fatty acid supplements on the Finnish market using NMR and SPME-GC-MS in comparison with conventional methods[J]. Food Chemistry,2020,330:127194. doi: 10.1016/j.foodchem.2020.127194
[39] GUO Y, SHAO J J, SUN J, et al. Optimization of Extraction and Refining Parameters of Oil from Dotted Gizzard Shad (Konosirus punctatus)[J]. Foods 2024, 13:1278.
[40] XU Y Q, ZHAO J R, LIU X, et al. Flavor mystery of Chinese traditional fermented baijiu:The great contribution of ester compounds[J]. Food Chemistry,2022,369:130920. doi: 10.1016/j.foodchem.2021.130920
[41] WANG J Q, DAI Z S, Ying G, et al. Untargeted metabolomics coupled with chemometrics for flavor analysis of Dahongpao oolong tea beverages under different storage conditions[J]. LWT-Food Science and Technology,2023,185:115128. doi: 10.1016/j.lwt.2023.115128





 下载:
下载:
 下载:
下载:
