Effects of Ball-milling Treatment on the Structural Properties of Rice Protein and Its Improvement on the Production of Antioxidant Peptides using Enzymatic Hydrolysis
-
摘要: 为改善大米蛋白的溶解度、抗氧化活性等功能性质,本研究首先采用球磨对大米蛋白进行处理,通过测定球磨处理后大米蛋白的粒径、分子量、游离巯基含量和表面疏水性,并分析其表观形态和二级结构,研究球磨处理对大米蛋白分子结构的影响。在此基础上,采用球磨联合酶解对大米蛋白进行处理,对球磨联合酶解处理后大米蛋白的溶解度、水解度和体外抗氧化活性进行分析。结果表明:随着球磨时间的延长,大米蛋白的粒径呈减小趋势;蛋白质的亚基组成无明显变化;游离巯基含量呈先升高再降低的趋势,且在球磨处理10 min时达最大值(3.32 µmol/g);表面疏水性呈显著上升趋势(P<0.05);扫描电子显微镜结果显示球磨处理使大米蛋白破裂为碎片状颗粒。此外,与未经过球磨直接水解的大米蛋白相比,球磨联合酶解制备的大米抗氧化肽水解度和溶解度显著增加(P<0.05),水解度由6.5%增加到11%,抗氧化能力增强。上述结果表明,球磨预处理可显著改变(P<0.05)蛋白质的分子结构,促进了大米蛋白的水解,有利于抗氧化肽的制备。Abstract: In order to improve the solubility, antioxidant activity and other functional properties of rice protein, rice protein was pretreated by ball-milling, and its structural properties were analyzed by determining the particle size, subunit composition, free sulfhydryl content and surface hydrophobicity. Meanwhile, the properties of rice peptides prepared by ball-milling combined enzymatic hydrolysis were also investigated by determining the solubility, hydrolysis degree, and in vitro antioxidant activity. Results showed that the particle size of rice protein decreased with the extension of the ball-milling treatment time. SDS-PAGE showed the subunits of rice protein did not change significantly after ball-milling treatment. At the same time, the free sulfhydryl content increased firstly, then decreased and reached a maximum value (3.32 µmol/g) at 10 min of ball milling treatment. The surface hydrophobicity of rice protein increased significantly (P<0.05) with the extension of the ball-milling treatment time. FTIR showed ball-milling treatment affected the secondary structure of the rice protein and scanning electron microscopy showed that the ball-milling treatment caused rice protein to break into fragmented particles. In addition, compared with the rice protein only treated by enzymatic enzyme hydrolysis, ball-milling combined with enzymatic hydrolysis treatment significantly (P<0.05) increased hydrolysis degree which increased from 6.5% to 11%, the solubility and antioxidant activity of rice protein. Results indicated that ball-milling pretreatment can significantly (P<0.05) change the structural properties of rice protein and promote its enzymatic hydrolysis in the production of antioxidant peptides.
-
Keywords:
- rice protein /
- ball-milling /
- structural properties /
- enzymatic hydrolysis /
- antioxidant activity
-
我国是世界上稻谷产量最高的国家,全国稻谷总产量每年超2亿吨[1]。稻谷中除含有80%左右的淀粉外,还含有约7%的蛋白质。大米蛋白氨基酸组成合理,具有较高的生物效价,同时具有低致敏性和高消化率的特点,适宜婴幼儿和消化功能较弱的人群食用,是世界公认优质、营养的植物蛋白资源[2]。但大米蛋白中以谷蛋白为主,疏水性氨基酸含量远高于其它常见蛋白质,导致大米蛋白溶解性较差,在食品加工中的应用受到限制,大米蛋白加工产品至今尚未形成规模[3]。因此,需采用一定方法对大米蛋白进行改性,以改善其功能特性,扩大其应用范围。当前常见的蛋白改性方法有物理改性、化学改性和酶法改性等。蛋白质的酶法修饰由于反应条件温和,反应易于控制,加上副产物较少、特异性和安全性高的优点,应用率较高。然而传统酶解法具有酶添加量多,反应时间长,酶解产物少等问题,因此研究如何进一步提高酶解效率具有重要意义[4]。
球磨法改性指在高速旋转的状态下,蛋白质与研磨介质在狭小的空间内发生高频碰撞、挤压、剪切等作用,从而使蛋白质的粒度、结构等发生变化并进一步改变其功能,是一种能耗低,高效且环境友好型蛋白质改性技术[5]。研究表明,球磨会使蛋白质的二级、三级等空间结构发生变化,蛋白质的多肽链伸展,巯基、二硫键含量与表面疏水性等也会发生改变[6−7],从而可能影响酶与底物活性位点间的接触,进而加快酶解进程并提高蛋白质的水解度。目前球磨处理对大米蛋白的结构、功能性质、酶水解进程的影响国内外未见报道。
因此,本研究比较了不同球磨处理时间对大米蛋白分子结构及表观形态的影响。在此基础上,采用球磨联合酶解制备大米抗氧化肽,探讨球磨预处理促进大米蛋白水解的内在机制。研究成果可为大米抗氧化肽等活性肽的开发提供新途径。
1. 材料与方法
1.1 材料与仪器
粳糯米 购自安徽燕之坊食品有限公司;复合蛋白酶(由蛋白内切酶、外切酶和风味酶等复合,120 U/mg) 上海源叶生物科技有限公司;三色预染宽分子量蛋白Marker(10~180 kDa) 上海万生昊天生物技术有限公司;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(5×)、BeyoGel Plus PAGE预制胶(Tris-Gly, 4%~20%,10孔) 碧云天生物技术公司;DPPH自由基清除能力、ABTS+自由基清除能力、铁离子还原能力测定试剂盒 苏州格锐思生物科技有限公司;其他所有化学试剂均为分析纯。
YD-YXQM冷冻行星液氮球磨机 长沙米淇仪器设备有限公司;S-4800扫描电子显微镜 日本Hitachi公司;Mastersizer2000激光粒度仪 英国Malvern仪器有限公司;Nicolet 6700傅里叶变换红外光谱仪 美国Thermol Nicolet公司;VICTOR Nivo酶标仪 美国Perkin Elme公司;1-16LSC冷冻干燥机 德国Christ Gamma公司;BECKMAN-Allegra高速冷冻离心机 美国Beckman科技公司。
1.2 实验方法
1.2.1 大米蛋白的提取
参考Rahim等[8]的方法稍改动,应用碱提法提取大米蛋白。取适量粳米粉碎后过100目筛,将筛下粉以1:7固液比分散于蒸馏水中。使用精密pH计调节pH,用1 mol/L NaOH溶液调节pH至12.0,室温浸提2 h。浸提液在室温下以5000 r/min转速离心15 min。过滤非蛋白质残留物,用1 mol/L HCl溶液滴定上清液至pH为4.7并混匀。在室温下以5000 r/min转速离心15 min。用蒸馏水将蛋白质沉淀物洗净,在−20 ℃预冷72 h后,在−55 ℃冷冻干燥48 h,制得大米蛋白(蛋白质含量:86.88 g/100g)。
1.2.2 大米蛋白的冷冻球磨处理
30 g大米蛋白在冷冻行星液氮球磨机的球磨罐中干磨。设置球磨机转速500 r/min,温度−10~0 ℃,样品球磨时间分别为10、20、30、40 min。以球磨前的样品为对照。
1.2.3 球磨对大米蛋白分子构象及表观形态影响的测定
1.2.3.1 大米蛋白分子粒径大小的测定
参考Jan等[9]的方法测定大米蛋白分子粒径。1 g样品均匀分散于10 mL蒸馏水中,将悬浮液引入马尔文激光粒度仪样品池中,待遮光度达到10%左右时,对样品粒径进行测定。
1.2.3.2 大米蛋白表观形态观察
使用S-4800扫描电子显微镜拍摄样品显微镜照片。真空条件下,对不同球磨时间的样品进行喷金处理,然后在500倍显微镜下观察大米蛋白的表观形态。
1.2.3.3 大米蛋白分子量的测定
参考Laemmli[10]的方法,应用SDS-PAGE测定大米蛋白的分子量。取10 mg样品溶解于1 mL 1 mol/L Tris-HCl(pH6.8)后,调整温度为0 ℃,以8000 r/min离心15 min。取16 μL上清液与4 μL SDS-PAGE蛋白上样缓冲液(5×)混匀,100 ℃水浴加热5 min。冷却后取12 μL混合液和10 μL蛋白marker,分别加入上样孔,120 V恒压电泳45 min。用考马斯亮蓝R-250染色液(0.25%考马斯亮蓝R-250,50%甲醇:冰醋酸=91:9)染色20 min后,使用脱色液(甲醇:冰醋酸:蒸馏水=2:3:35)进行24 h的脱色。
1.2.3.4 游离巯基含量的测定
参考Alavi等[11]的方法测定游离巯基含量。Tris-Gly-8M Urea溶液(10.418 g Tris,1.489 g EDTA二钠定容至1000 mL后加入480.48 g尿素),Ellman’s试剂(4 mg/mL)(4 mg DTNB溶于1 mL Tris-Gly缓冲液)取30 mg 样品充分溶解于6 mL Tris-Gly-8M Urea溶液后,调整温度为0 ℃ ,转速为8000 r/min,将溶液离心10 min。离心后取1 mL上清液与40 μL Ellman’s 试剂混匀,静置10 min。用酶标仪在412 nm处测定吸光度值。游离巯基含量按式(1)计算:
游离巯基含量(µmol/L)=75.53×A412nmρ (1) 式中:73.53由106/13600得到,1.36×104为Ellman's 试剂的摩尔消光系数, L/(mol·mL);A412 nm为样品在412 nm波长下的吸光度;ρ为样品蛋白质浓度,mg/mL。
1.2.3.5 表面疏水性的测定
参考Chelh等[12]的方法测定大米蛋白表面疏水性。取10 mg样品充分溶解于1 mL磷酸缓冲液(0.02 mol/L,pH7)和200 μL 1 mg/mL溴酚蓝中。溶液涡旋1 min后,调整温度为20 ℃,转速10000 r/min,离心15 min。在595 nm处测定吸光度值。以原磷酸缓冲液作空白对照。大米蛋白表面疏水性按式(2)计算:
溴酚蓝结合量(µg)=200µg×(A对照−A样品)A对照 (2) 式中:200 µg为溴酚蓝添加量;A对照为原磷酸缓冲液在595 nm波长下的吸光度;A样品为配制的不同样品溶液在595 nm波长下的吸光度。
1.2.3.6 大米蛋白二级结构分析
参考Wan等[13]的方法测定大米蛋白的二级结构。取1.00 mg样品与100 mg溴化钾混合后充分研磨,压成通透薄片并固定在载玻片架上。设置扫描范围400~4000 cm−1,分辨率4 cm−1,扫描32次。用PeakFit v4.12在酰胺Ⅰ带(1600~1700 cm−1)进行二级结构分析。
1.2.4 球磨联合酶解制备大米抗氧化肽
1.2.4.1 大米蛋白的酶解改性
参考张敏[14]的方法稍改动,进行大米蛋白的酶解改性。选取1.2.2中制备的样品(以球磨处理前的样品为对照,进行酶解改性)进行酶解。称取样品,加入蒸馏水制备5%(w/v)大米蛋白悬浮液。设定50 ℃恒温磁力搅拌30 min后,加入1.5%蛋白复合酶,搅拌过程中通过滴加0.1 mol/L NaOH或HCl使溶液pH保持7.0恒定。50 ℃恒温酶解2 h后,在沸水中恒温15 min使蛋白酶完全失活。室温条件下以5000 r/min的转速离心20 min,将上清液在−20 ℃温度下预冻72 h后,冻干。
1.2.4.2 溶解度的测定
取1.2.4.1中制备的样品,配制100 mg/mL的蛋白溶液。使用HJ-3磁力搅拌器在室温下以400 r/min磁力搅拌30 min后,设置离心机:20 ℃、10000 r/min,离心10 min。使用凯氏定氮法测定上清液蛋白质含量。制得的大米抗氧化肽溶解度按式(3)计算:
溶解度(%)=m1m2×100 (3) 式中:m1为上清液中蛋白质质量,mg;m2为样品中总蛋白质质量,mg。
1.2.4.3 水解度的测定
参考Nielsen等[15]的邻苯二甲醛法测定大米抗氧化肽水解度。分别取1 mL 1.2.4.1中制备的酶解液,加入12 mL去CO2的纯水搅拌均匀后,用pH计和0.10 mol/L的NaOH标准溶液滴定溶液pH至8.2。再加入4 mL pH为7的甲醛溶液,滴定溶液pH至9.2。记录消耗NaOH溶液的量。以纯水为空白实验。
1.2.4.4 DPPH自由基清除能力的测定
根据DPPH清除能力试剂盒的说明书进行测定。取1.2.4.1中制备的样品,配制0.5~8 mg/mL的蛋白溶液。设置离心机:室温、8000 r/min离心5 min,取上清液至玻璃比色皿中,在波长517 nm下用无水乙醇调零后读取吸光值。
1.2.4.5 ABTS+自由基清除能力的测定
根据ABTS+自由基清除能力试剂盒的说明书进行测定。取1.2.4.1中制备的样品,配制0.25~5 mg/mL的蛋白溶液后测定。
1.2.4.6 铁离子还原能力的测定
根据铁离子还原能力试剂盒的说明书进行测定。取1.2.4.1中制备的样品,配制0.5~8 mg/mL的蛋白溶液后测定。
1.3 数据处理
所有数据均以三次确定的标准偏差的平均值表示。统计图由Origin 2022绘制。使用SPSS 25软件进行显著性分析,P<0.05时表示数据间差异显著。
2. 结果与分析
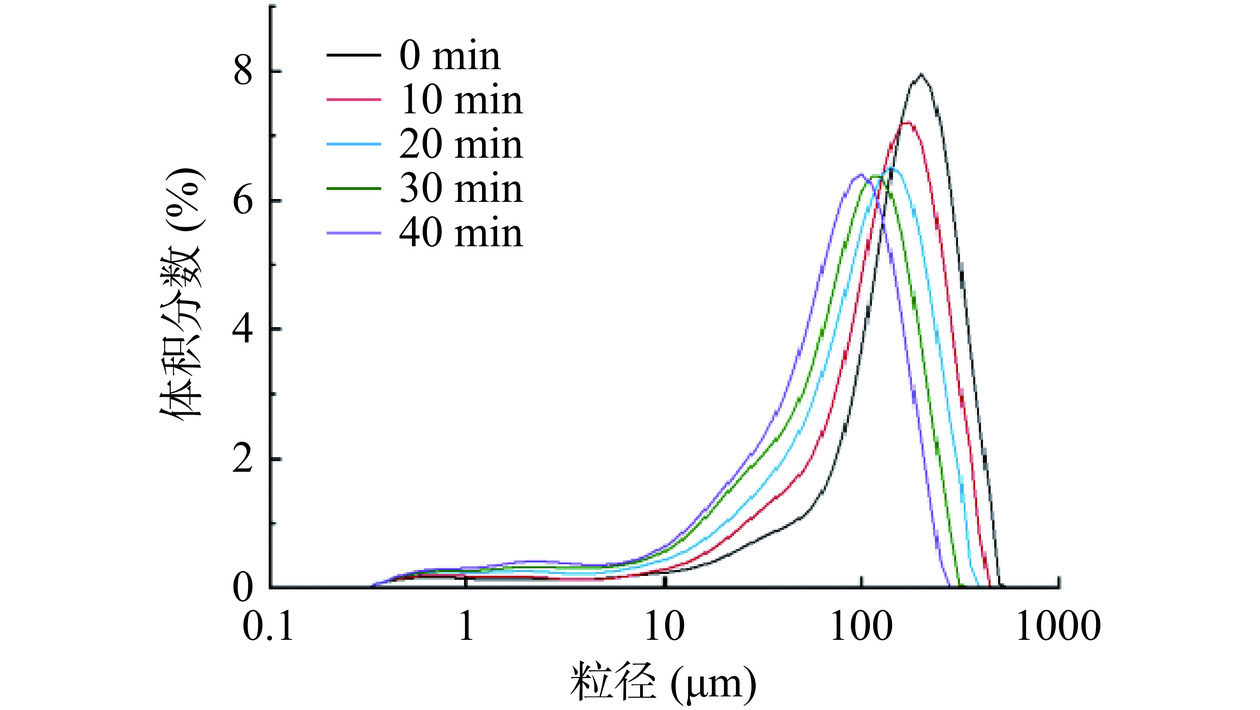
2.1 球磨处理对大米蛋白粒径分布的影响
蛋白质粒径大小不但影响蛋白质的凝解聚、絮凝程度等理化性质,还影响其溶解、乳化和起泡等功能性质[16]。图1为球磨大米蛋白的粒径分布图。由图1可见,不同冷冻球磨时间的大米蛋白均呈单峰分布,随着冷冻球磨时间的增加,蛋白粒径分布呈左移趋势,大粒径蛋白总占比呈降低趋势。经过不同的球磨时间,大米蛋白的体积平均直径(D4,3)从195.5 μm(0 min)显著(P<0.05)降低到161.8 μm(10 min),118.7 μm(20 min),101.4 μm(30 min),87.4 μm(40 min),且球磨处理时间与D4,3的相关系数为-0.99,说明球磨处理时间与大米蛋白的粒径大小呈负相关。大米蛋白的粒径变小可能与球磨过程中不同的压力共同作用使蛋白质破裂有关,Sun等[17]在观察超细粉碎处理对浓缩蛋白的粒度影响时发现了相似的结果。随着球磨处理时间的增加,20 min后大米蛋白的粒径变化趋势变缓。可能因为蛋白粒子间的弹性碰撞和磨损增大,使降低相同粒径所消耗的能量增多[18]。也可能由于球磨处理后期能量大多转化为热能,而不是完全用于蛋白质的球磨。并且进行长时间的球磨处理可能使破碎的大米蛋白暴露更多的水结合位点,使大米蛋白更易结块[19],该特性与后续球磨时间过长使蛋白溶解度下降可能存在一定相关性。
2.2 球磨处理对大米蛋白微观形态的影响
图2为扫描电镜在500倍下观察到的不同时间球磨处理大米蛋白微观结构的形态变化。由图2可见,球磨后的大米蛋白微观形态变化较大。大米蛋白在球磨前呈形状规则光滑的块状结构,颗粒大且切面平整。球磨处理10 min后,部分大米蛋白破裂为碎片状颗粒,附着于平整的大粒径蛋白。球磨处理20 min后,碎片状蛋白颗粒增多,大粒径蛋白变小。随着球磨处理时间的增加,大米蛋白破裂程度加剧,切面粗糙且不规则,出现大量的碎片状蛋白颗粒。球磨前后的大米蛋白粒度也具有明显区别。
2.3 球磨处理对大米蛋白亚基组成的影响
大米蛋白主要含谷蛋白、球蛋白、清蛋白和醇溶蛋白,在1.2.1中碱提法提取的蛋白质主要是谷蛋白。谷蛋白中3个主要亚基的分子量分别为33、22和14 kDa[20]。SDS-PAGE可以反映大米蛋白分子量亚基的变化情况。图3为不同球磨处理时间大米蛋白的SDS-PAGE分析结果。由图3可见,不同时间球磨处理的大米蛋白在10~15 kDa、15~25 kDa和25~40 kDa范围均各有一条较明显的条带,在40 kDa以上范围条带较不明显。因此清蛋白和球蛋白是少量大于40 kDa的组分,醇溶蛋白是少量小于10 kDa的组分,谷蛋白酸性亚基组分的分子量为31~38 kDa,谷蛋白碱性亚基组分的分子量为21~25 kDa。这与Amagliani 等[21]关于大米蛋白亚基分子质量的研究结果相似。而50 kDa附近的组分可能是谷蛋白前体。不同的球磨处理时间,大米蛋白中亚基条带的宽度、数量及强度无明显差异。大量实验结果也表明,球磨是一种物理改性方法,一般情况下对蛋白质的亚基组成没有影响[22−25]。
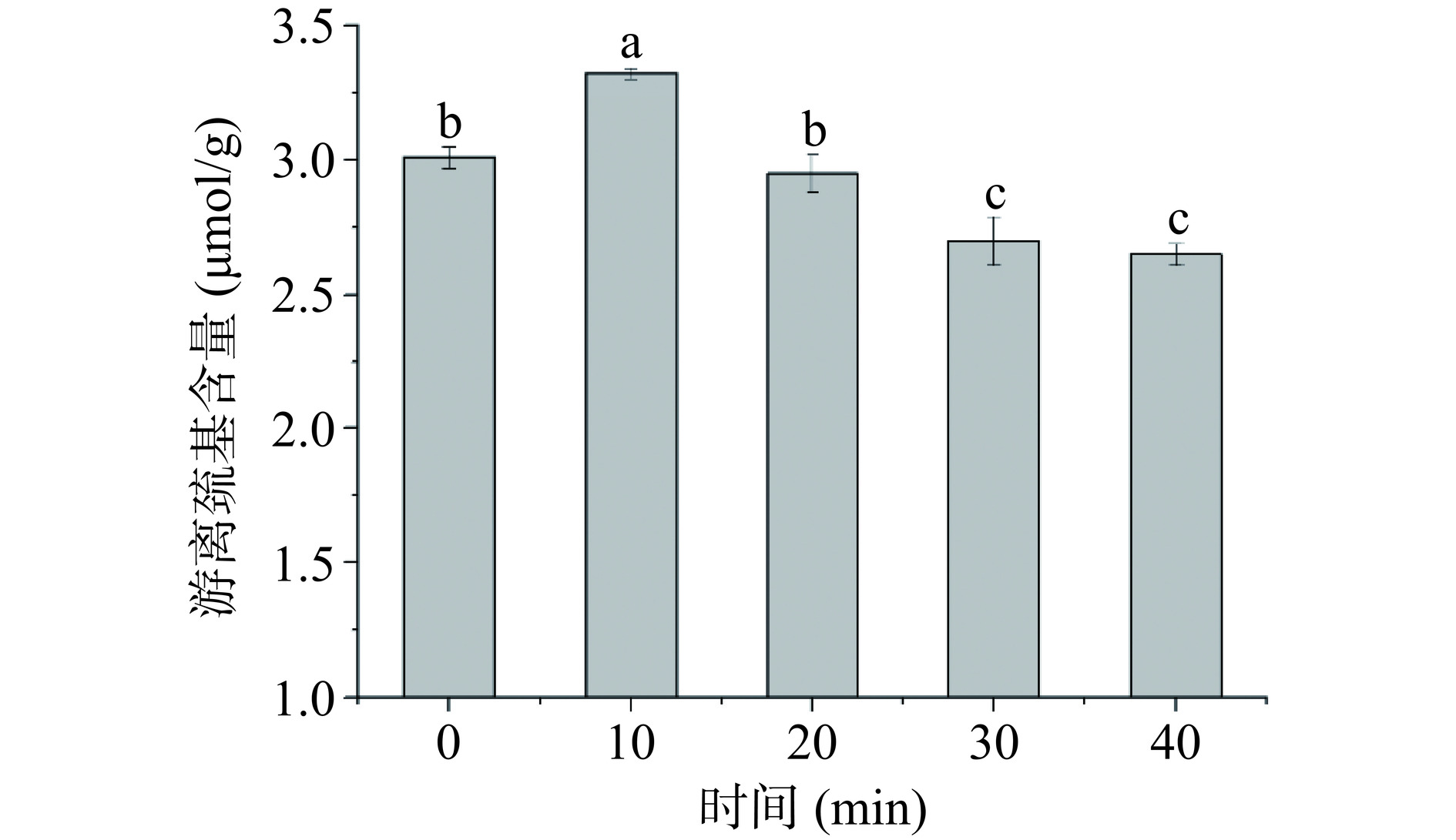
2.4 球磨处理对大米蛋白游离巯基含量的影响
根据游离巯基含量可推断大米蛋白三级结构的变化[5-6,18],游离巯基也是蛋白质分子中重要的功能基团。加工处理中蛋白质的功能性质受二硫键和巯基变化的影响。一定条件下氧化剂或还原剂存在时,游离巯基和二硫键可以相互转化。图4为不同球磨处理时间下大米蛋白游离巯基的含量。由图4可见,随着球磨时间的增加,大米蛋白游离巯基含量呈先升高再降低的趋势(P<0.05)。球磨处理10 min与0 min的大米蛋白相比,游离巯基的含量从3.01 µmol/g增加到3.32 µmol/g。可能由于大米蛋白受到各种压力导致变性,破坏了二硫键,进而导致位于蛋白质分子核心的巯基暴露,使游离巯基的含量提高[26],与球磨处理10 min时大米蛋白的溶解度明显提升的结论相符[27]。球磨处理20 min时,相较于10 min时大米蛋白的游离巯基含量开始下降,但与未经球磨处理的大米蛋白无显著差异。且在球磨处理20 min后,随着球磨时间的延长,游离巯基含量逐渐下降。长时间暴露在空气中的游离巯基氧化,重整二硫键使球磨处理30 min时游离巯基含量下降,Li等[7]对油莎草蛋白进行球磨处理时发现了相似的结果。此时大米蛋白二硫键断裂程度较强,蛋白结构展开程度较大。球磨处理时间超过30 min后,大米蛋白游离巯基的含量明显低于0 min时。这可能由于长时间的球磨加大了大米蛋白与氧气接触程度,氧化导致游离巯基含量减少,进一步形成二硫键[22]。
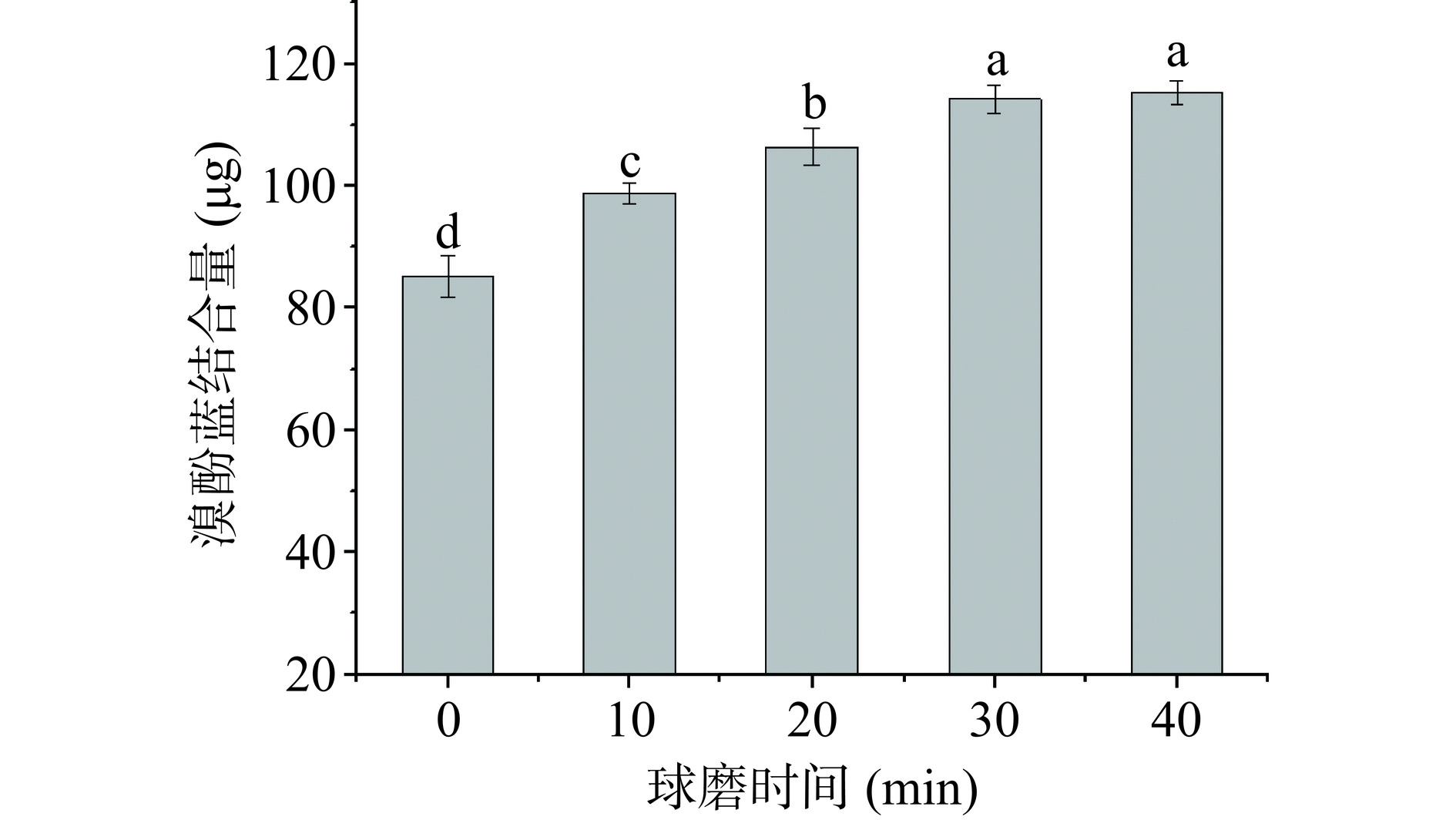
2.5 球磨处理对大米蛋白表面疏水性的影响
蛋白质分子非极性基团间的疏水相互作用是维持其三级结构的主要作用力之一,因此测定大米蛋白表面疏水性可间接反映蛋白质的结构变化。有研究表明,蛋白表面疏水性的改变也会影响其功能特性,如乳化活性等[27]。图5为不同球磨处理时间大米蛋白的溴酚蓝结合量。由图5可见,球磨处理0 min的大米蛋白的溴酚蓝结合量为85.24 μg,球磨处理10 min的大米蛋白的溴酚蓝结合量显著(P<0.05)增加到98.79 μg。随球磨处理时间从20 min增加到30 min,大米蛋白的溴酚蓝结合量呈继续(P<0.05)上升趋势,表明冷冻球磨处理使大米蛋白的结构发生改变,提高了其表面疏水性。这可能是球磨过程中的摩擦、碰撞和剪切力共同作用改变了大米蛋白的三级结构,使内部分子的疏水性基团暴露[23]。球磨有利于提高大米蛋白在水-油、空气-水界面的吸附能力,进而有利于提高蛋白质的起泡性和乳化性[28]。Li等[26]在研究球磨处理对蛋清蛋白理化及发泡活性的影响时提出了相似的结论。
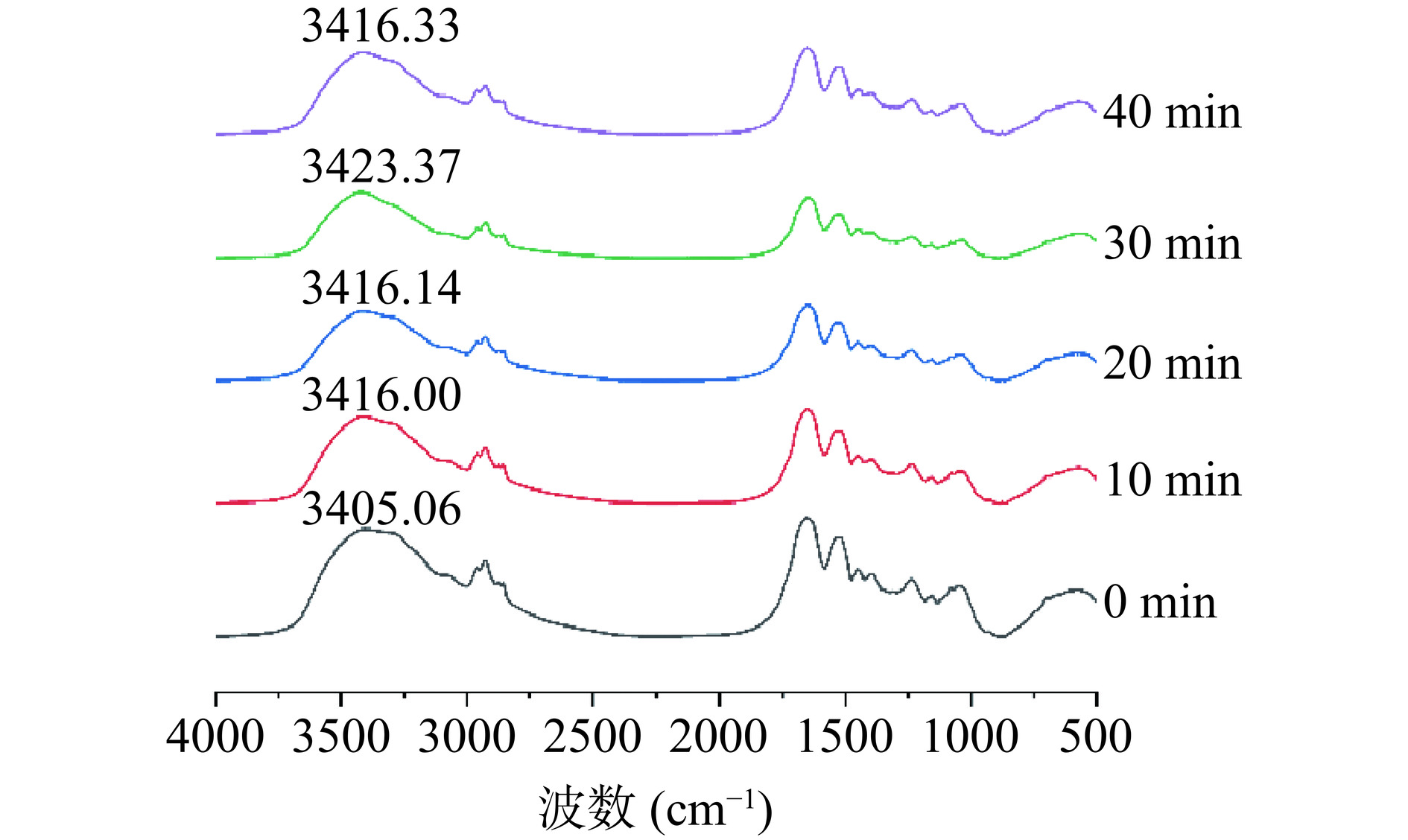
2.6 球磨处理对大米蛋白二级结构的影响
在研究蛋白质二级结构时常使用红外光谱法进行分析,图6为不同球磨处理时间大米蛋白的红外光谱图。氢键是维持蛋白质空间结构的一个重要的作用力,蛋白分子中的氢键形成后,O-H的吸收峰逐渐从高波数右移至低波数,同时和N-H的振动吸收峰重叠,形成一个强而宽的吸收峰[18]。由图6可见,未球磨的大米蛋白在3405.06 cm−1处出现一个强的吸收峰,表明蛋白分子中存在大量分子内或分子间的氢键[6]。而随球磨时间的延长,O-H的吸收峰的吸收峰向高波数移动。经过10 min的球磨后,该吸收峰的波数从3405.06 cm−1移动至3416.00 cm−1,说明球磨处理直接影响了大米蛋白的原始空间结构,维持蛋白结构的氢键在处理过程中遭到破坏。Liu等[18]研究球磨改性小麦面筋蛋白,发现经过20 min的球磨处理后,O-H的吸收峰的波数从3295.81 cm−1 移动到 3303.57 cm−1,与本研究的结果相类似。
表1为不同球磨时间处理后大米蛋白四种二级结构的相对含量。由表1可见,大米蛋白的二级结构组成中含量最多的是β-折叠与β-转角,其次是α-螺旋和无规则卷曲。经过20 min的球磨后,α-螺旋的含量从18.30%增加到19.02%,β-折叠的含量从25.75%上升到27.07%,β-转角从37.74%降低到30.27%。与此同时,无规则卷曲的数量从19.20%显著增加到23.64%。蛋白质无规则卷曲结构数量与蛋白质的界面构象强度具有相关性[29],无规则卷曲含量的显著增加表明蛋白质由有序变成无序。上述结果表明,球磨处理使蛋白质二级结构各组成间发生了复杂的转化,蛋白质空间结构的无序性增加。
表 1 球磨处理对大米蛋白二级结构含量的影响Table 1. Effects of freezing ball milling on the secondary structure content of rice proteins球磨时间(min) α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) 0 18.30±0.29c 25.75±0.67c 37.74±1.42a 19.20±1.75b 10 18.82±0.21b 27.57±0.31a 32.29±0.34b 21.33±0.29b 20 19.02±0.15a 27.07±0.23a 30.27±0.27 b 23.64±0.35a 30 19.25±0.34a 26.61±1.25ab 29.80±1.06b 24.33±0.78a 40 19.30±0.51a 25.83±2.02b 31.09±1.49b 23.77±0.21a 2.7 球磨与酶解联合处理对大米蛋白溶解度和水解度的影响
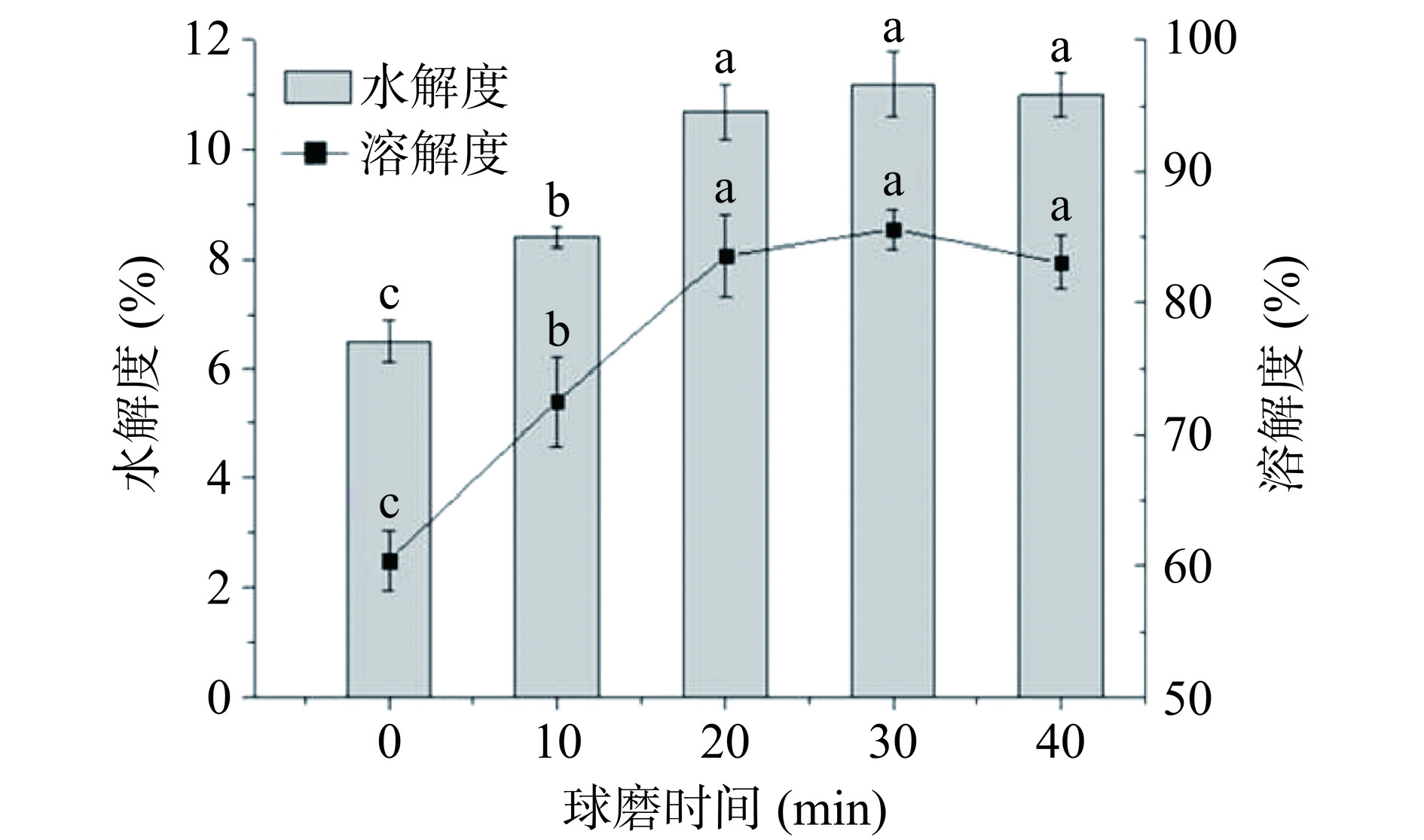
在蛋白质的酶解改性过程中,可以通过蛋白质溶解度和水解度的改变反映蛋白质的酶解效率[30]。本实验采用复合蛋白酶酶解大米蛋白,结果如图7所示。未进行球磨处理的大米蛋白的水解度为6.5%,球磨处理20 min后水解度显著(P<0.05)增大到10.7%。这是由于球磨使大米蛋白的空间结构展开,导致更多酶结合位点暴露,使酶与底物的有效接触面积增加[31−32]。在水解度增加的同时,蛋白质分子变小,释放出更多的可溶性肽,因而导致大米蛋白的溶解度显著(P<0.05)增加。经过40 min的球磨处理后,大米蛋白的水解度升至11.0%,溶解度也上升到83.6%,但与球磨20、30 min的酶解改性大米蛋白的水解度、溶解度相比无显著(P>0.05)差异。在球磨处理20 min以上时,大米蛋白二级结构中α-螺旋含量增加,无规则卷曲含量降低(表1)。同时,大米蛋白的游离巯基含量降低(图4),大米蛋白分子的有序性和聚集程度有所增加。上述分子结构变化会导致蛋白酶解效率较低,因而球磨20 min以上时,水解度变化较小。
2.8 球磨与酶解联合处理对大米蛋白体外抗氧化活性的影响
2.8.1 DPPH自由基清除能力
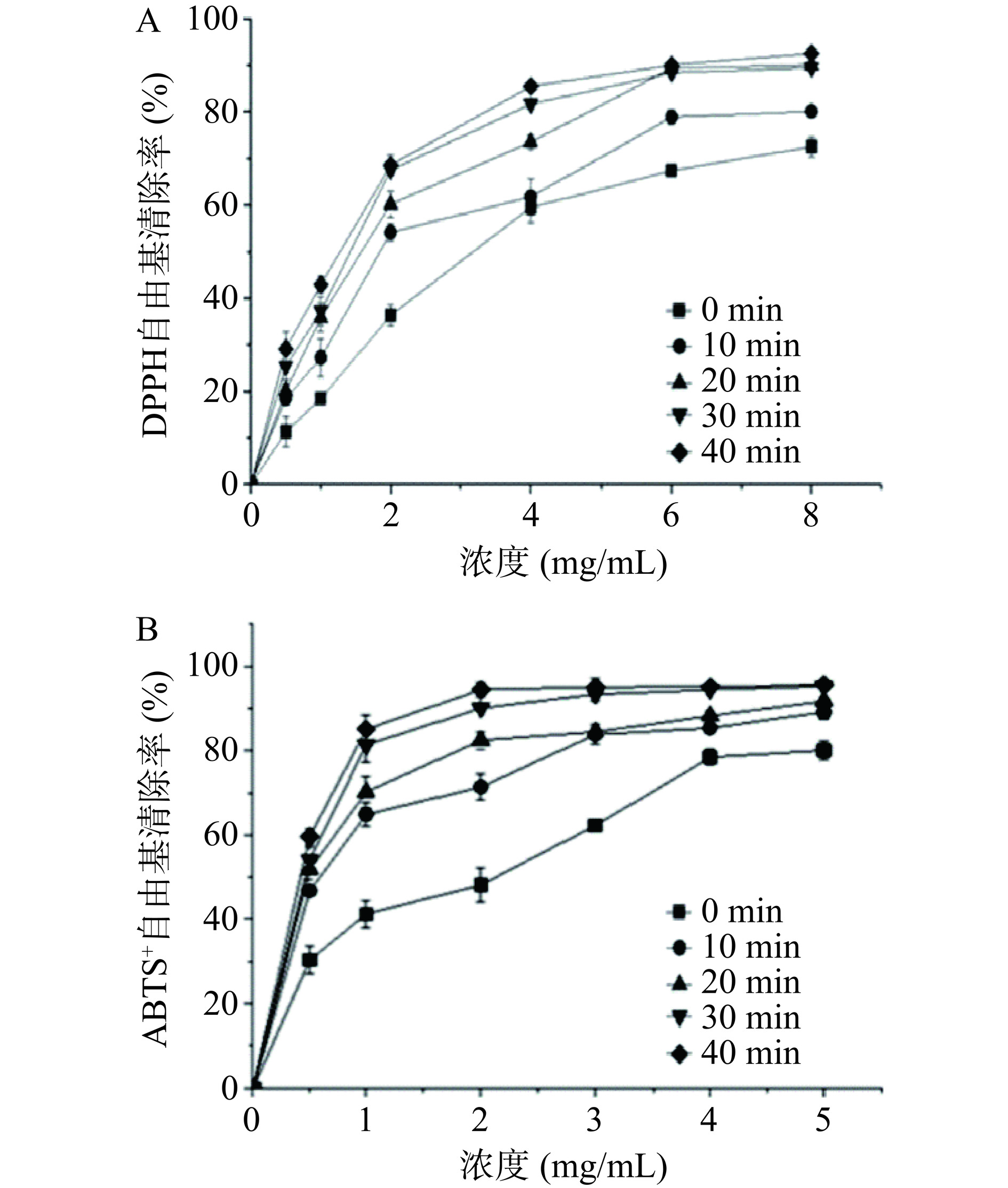
图8A为球磨联合酶解处理对大米蛋白DPPH自由基清除率的影响。由图8A可见,大米蛋白酶解后均具有较强的抗氧化能力,且自由基清除率随样品浓度的增大而增大。在较高的水解度条件下,小分子肽可以与DPPH自由基反应,将其转化为稳定的产物,并阻止自由基的链式反应[33]。与未球磨直接酶解的大米蛋白相比,球磨与酶解联合处理会显著增强酶解产物的DPPH自由基清除能力,且随着球磨时间的延长,自由基清除能力呈增加的趋势。球磨处理使蛋白质的空间构象发生改变,空间结构展开,有利于复合蛋白酶与蛋白质的结合,从而使复合蛋白酶更高效地切割肽键,使酶解产物具有更强的DPPH自由基清除率[34]。
2.8.2 ABTS+自由基清除能力
ABTS法是用于测量和表征抗氧化剂总抗氧化能力的一种方法,其原理是ABTS+与过硫酸钾反应生成稳定的蓝绿色阳离子自由基,向其中加入抗氧化剂,会与自由基发生反应而使反应体系褪色[35]。由图8B可见,在 0.5~5 mg/mL 浓度范围内,ABTS+自由基清除能力随着样品浓度的增加而逐渐增强。总体上看,球磨后酶解的样品ABTS+自由基清除率相对高于DPPH自由基的清除率。这可能是因为ABTS+自由基清除能力可以分为亲水和亲油化合物的抗氧化活性[36],而球磨后酶解的样品具有良好的亲水性,但是DPPH自由基主要是亲油化合物抗氧化活性,所以联合改性的蛋白DPPH自由基清除率低于ABTS+自由基清除率。氨基酸组成类型也对不同自由基的清除率有影响[37]。同时随着球磨时间的增长,酶解改性的蛋白ABTS+自由基清除率逐渐增加,这可能也与蛋白质溶解度逐渐增大,亲水性逐渐增加有关。
2.8.3 铁离子还原能力
还原力是衡量抗氧化活性的一个重要指标,还原力越大,说明能够贡献电子或氢的能力就越强[38]。大米蛋白及酶解物可作为电子供体将K3Fe(CN)6中Fe3+还原为Fe2+并产生普鲁士蓝色,样品在700 nm处的吸光度值即可表示还原力的大小。通常情况下,溶液的颜色越深,吸光度值越大,还原力越强[3]。由图9可见,与未球磨只酶解的蛋白相比,经过球磨与酶解联合改性后大米蛋白的还原能力变差,即提供电子或供氢的能力减弱,这可能是因为复合蛋白酶酶切产生的分子量小于3000 Da的多肽还原能力较弱[39−40],与联合改性后蛋白质中疏水性氨基酸比例的减小也存在一定相关性[41]。
3. 结论
本文通过研究球磨对大米蛋白分子结构与其酶解制备抗氧化肽效率的影响,发现随着球磨时间的延长,大米蛋白粒度显著(P<0.05)降低,游离巯基含量呈现先上升后下降的趋势,表面疏水性逐渐增大。与大米蛋白单纯进行酶解相比,经球磨与酶解联合处理后,显著(P<0.05)提高了大米蛋白的溶解度、水解度和DPPH、ABTS+自由基清除活性,说明球磨预处理可促进大米蛋白水解和抗氧化肽的释放。本研究为大米蛋白的改性和抗氧化肽的生产提供技术支撑和理论指导,有利于扩大大米蛋白在食品加工领域的应用范围。
-
表 1 球磨处理对大米蛋白二级结构含量的影响
Table 1 Effects of freezing ball milling on the secondary structure content of rice proteins
球磨时间(min) α-螺旋(%) β-折叠(%) β-转角(%) 无规则卷曲(%) 0 18.30±0.29c 25.75±0.67c 37.74±1.42a 19.20±1.75b 10 18.82±0.21b 27.57±0.31a 32.29±0.34b 21.33±0.29b 20 19.02±0.15a 27.07±0.23a 30.27±0.27 b 23.64±0.35a 30 19.25±0.34a 26.61±1.25ab 29.80±1.06b 24.33±0.78a 40 19.30±0.51a 25.83±2.02b 31.09±1.49b 23.77±0.21a -
[1] 孔祥智, 何欣玮. 粮食安全背景下早稻生产的战略价值与发展路径[J]. 农村经济,2022(10):37−46. [KONG X Z, HE X W. Strategic value and development path of early rice production in the context of food security[J]. Rural Economy,2022(10):37−46.] KONG X Z, HE X W. Strategic value and development path of early rice production in the context of food security[J]. Rural Economy, 2022(10): 37−46.
[2] 唐诚业, 秦琴, 颜正飞, 等. 产大米蛋白水解酶的菌株筛选、酶学性质及制备大米寡肽[J]. 微生物学报,2021,61(5):1200−1210. [TANG C Y, QIN Q, YAN Z F, et al. Screening of rice proteolytic protease-producing strain for preparing rice oligopeptides[J]. Acta Microbiologica Sinica,2021,61(5):1200−1210.] TANG C Y, QIN Q, YAN Z F, et al. Screening of rice proteolytic protease-producing strain for preparing rice oligopeptides[J]. Acta Microbiologica Sinica, 2021, 61(5): 1200−1210.
[3] 马晓雨, 陈先鑫, 胡振瀛, 等. 限制性酶解对大米蛋白结构、功能特性及体外抗氧化活性的影响[J]. 中国食品学报,2020,20(11):53−62. [MA X Y, CHEN X X, HU Z Y, et al. Effects of restrictive enzymatic hydrolysis on the structural and functional properties and in vitro antioxidant activity of rice protein[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(11):53−62.] MA X Y, CHEN X X, HU Z Y, et al. Effects of restrictive enzymatic hydrolysis on the structural and functional properties and in vitro antioxidant activity of rice protein[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(11): 53−62.
[4] 熊喆, 赵钰, 秦子波, 等. 超声辅助酶解促进草鱼鳞胶原肽水解进程的内在机制解析[J]. 农业工程学报,2022,38(16):313−321. [XIONG J, ZHAO Y, QIN Z B, et al. Analysis of the internal mechanism for ultrasound-assisted enzymatic hydrolysis for promoting the hydrolysis of grass carp scale collagen peptide[J]. Transactions of the Chinese Society of Agricultural Engineering,2022,38(16):313−321.] doi: 10.11975/j.issn.1002-6819.2022.16.034 XIONG J, ZHAO Y, QIN Z B, et al. Analysis of the internal mechanism for ultrasound-assisted enzymatic hydrolysis for promoting the hydrolysis of grass carp scale collagen peptide[J]. Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(16): 313−321. doi: 10.11975/j.issn.1002-6819.2022.16.034
[5] YU C P, CHA Y, WU F, et al. Effects of ball‐milling treatment on mussel (Mytilus edulis) protein:Structure, functional properties and in vitro digestibility[J]. International Journal of Food Science & Technology,2018,53(3):683−691.
[6] CHEN X Y, GUO M Z, SANG Y X, et al. Effect of ball-milling treatment on the structure, physicochemical properties and allergenicity of proteins from oyster (Crassostrea gigas)[J]. LWT,2022,166:113803. doi: 10.1016/j.lwt.2022.113803
[7] LI C X, LI W Y, ZHANG X, et al. The changed structures of Cyperus esculentus protein decide its modified physicochemical characters:Effects of ball-milling, high pressure homogenization and cold plasma treatments on structural and functional properties of the protein[J]. Food Chemistry,2024,430:137042. doi: 10.1016/j.foodchem.2023.137042
[8] RAHIM F N A, IBADULLAH W Z W, SAARI N, et al. The effect of alkaline extraction and drying techniques on the physicochemical, structural properties and functionality of rice bran protein concentrates[J]. International Journal of Biological Macromolecules,2023,242:124908. doi: 10.1016/j.ijbiomac.2023.124908
[9] JAN S, GHOROI C, SAXENA D C. Effect of particle size, shape and surface roughness on bulk and shear properties of rice flour[J]. Journal of Cereal Science,2017,76:215−221. doi: 10.1016/j.jcs.2017.04.015
[10] LAEMMLI U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[11] ALAVI F, MOMEN S, EMAM-DJOMEH Z, et al. Radical cross-linked whey protein aggregates as building blocks of non-heated cold-set gels[J]. Food Hydrocolloids,2018,81:429−441. doi: 10.1016/j.foodhyd.2018.03.016
[12] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V. Technical note:A simplified procedure for myofibril hydrophobicity determination[J]. Meat Science,2006,74(4):681−683. doi: 10.1016/j.meatsci.2006.05.019
[13] WAN Y, LIN C, LI Y N, et al. Tuning the electrostatic interaction between rice protein and carboxymethyl cellulose toward hydrophilic composites with enhanced functional properties[J]. International Journal of Biological Macromolecules,2023,235:123918. doi: 10.1016/j.ijbiomac.2023.123918
[14] 张敏. 大米蛋白水解物对小麦淀粉及面团的影响研究[D]. 合肥:安徽农业大学, 2020. [ZHANG M. Effect of rice protein hydrolysate on wheat starch and dough[D]. Hefei:Anhui Agricultural University, 2020.] ZHANG M. Effect of rice protein hydrolysate on wheat starch and dough[D]. Hefei: Anhui Agricultural University, 2020.
[15] NIELSEN P, PETERSEN D, DAMBMANN C. Improved method for determining food protein degree of hydrolysis[J]. Journal of Food Science,2001,66(5):642−646. doi: 10.1111/j.1365-2621.2001.tb04614.x
[16] AMAGLIANI L, SASSI E B, BUCZKOWSKI J, et al. Influence of protein source on the morphology, physicochemical and flow properties of protein-based emulsion particles to be used as texture modulators[J]. Food Hydrocolloids,2020,101:105581. doi: 10.1016/j.foodhyd.2019.105581
[17] SUN C C, LIU R, NI K, et al. Reduction of particle size based on superfine grinding:Effects on structure, rheological and gelling properties of whey protein concentrate[J]. Journal of Food Engineering,2016,186:69−76. doi: 10.1016/j.jfoodeng.2016.03.002
[18] LIU Z Q, ZHENG Z, ZHU G B, et al. Modification of the structural and functional properties of wheat gluten protein using a planetary ball mill[J]. Food Chemistry,2021,363:130251. doi: 10.1016/j.foodchem.2021.130251
[19] FADDA S, CINCOTTI A, CONCAS A, et al. Modelling breakage and reagglomeration during fine dry grinding in ball milling devices[J]. Powder Technology,2009,194(3):207−216. doi: 10.1016/j.powtec.2009.04.009
[20] WEN T N, LUTHE D S. Biochemical characterization of rice glutelin[J]. Plant Physiology,1985,78(1):172−177. doi: 10.1104/pp.78.1.172
[21] AMAGLIANI L, O’REGAN J, KELLY A L, et al. Composition and protein profile analysis of rice protein ingredients[J]. Journal of Food Composition and Analysis,2017,59:18−26. doi: 10.1016/j.jfca.2016.12.026
[22] SUN C C, LIU R, WU T, et al. Effect of superfine grinding on the structural and physicochemical properties of whey protein and applications for microparticulated proteins[J]. Food Science and Biotechnology,2015,24:1637−1643. doi: 10.1007/s10068-015-0212-y
[23] LIU B H, WANG H, HU T, et al. Ball-milling changed the physicochemical properties of SPI and its cold-set gels[J]. Journal of Food Engineering,2017,195:158−165. doi: 10.1016/j.jfoodeng.2016.10.006
[24] MANZOOR M, GANI A, JAGLAN S, et al. Modulation of native structural architecture and hydrodynamic properties of apple seed protein isolates[J]. Innovative Food Science & Emerging Technologies,2022,80:103083.
[25] WANG T, WANG L, WANG R, et al. Effects of freeze-milling on the physicochemical properties of rice protein isolates[J]. LWT-Food Science and Technology,2016,65:832−839. doi: 10.1016/j.lwt.2015.09.016
[26] LI M, LI M M, TAN W, et al. Effects of ball-milling treatment on physicochemical and foaming activities of egg ovalbumin[J]. Journal of Food Engineering,2019,261:158−164. doi: 10.1016/j.jfoodeng.2019.06.015
[27] WANG T, ZHANG H, WANG L, et al. Mechanistic insights into solubilization of rice protein isolates by freeze–milling combined with alkali pretreatment[J]. Food Chemistry,2015,178:82−88. doi: 10.1016/j.foodchem.2015.01.057
[28] TOWNSEND A A N N, NAKAI S. Relationships between hydrophobicity and foaming characteristics of food proteins[J]. Journal of Food Science,1983,48(2):588−594. doi: 10.1111/j.1365-2621.1983.tb10796.x
[29] JARPA-PARRA M, BAMDAD F, TIAN Z, et al. Impact of pH on molecular structure and surface properties of lentil legumin-like protein and its application as foam stabilizer[J]. Colloids and Surfaces B:Biointerfaces,2015,132:45−53. doi: 10.1016/j.colsurfb.2015.04.065
[30] NISOV A, ERCILI-CURA D, NORDLUND E. Limited hydrolysis of rice endosperm protein for improved techno-functional properties[J]. Food Chemistry,2020,302:125274. doi: 10.1016/j.foodchem.2019.125274
[31] LIU Y Q, HUANG Y Y, DENG X Q, et al. Effect of enzymatic hydrolysis followed after extrusion pretreatment on the structure and emulsibility of soybean protein[J]. Process Biochemistry,2022,116:173−184. doi: 10.1016/j.procbio.2022.03.012
[32] LI S Y, YANG X, ZHANG Y Y, et al. Effects of ultrasound and ultrasound assisted alkaline pretreatments on the enzymolysis and structural characteristics of rice protein[J]. Ultrasonics Sonochemistry,2016,31:20−28. doi: 10.1016/j.ultsonch.2015.11.019
[33] GOMES M H G, KUROZAWA L E. Improvement of the functional and antioxidant properties of rice protein by enzymatic hydrolysis for the microencapsulation of linseed oil[J]. Journal of Food Engineering,2020,267:109761. doi: 10.1016/j.jfoodeng.2019.109761
[34] RAWDKUEN S, RODZI N, PINIJSUWAN S. Characterization of sacha inchi protein hydrolysates produced by crude papain and Calotropis proteases[J]. LWT,2018,98:18−24. doi: 10.1016/j.lwt.2018.08.008
[35] 颉宇. 柠条籽蛋白抗氧化肽的制备及其延缓油脂氧化机制研究[D]. 北京:北京林业大学, 2020. [JIE Y. Novel insights to antioxidant peptides manufactured from Caragana ambigua seed’s protein which are available for retarding lipid oxidation[D]. Beijing:Beijing Forestry University, 2020.] JIE Y. Novel insights to antioxidant peptides manufactured from Caragana ambigua seed’s protein which are available for retarding lipid oxidation[D]. Beijing: Beijing Forestry University, 2020.
[36] XIE H X, HUANG J M, WOO M W, et al. Effect of cold and hot enzyme deactivation on the structural and functional properties of rice dreg protein hydrolysates[J]. Food Chemistry,2021,345:128784. doi: 10.1016/j.foodchem.2020.128784
[37] SHAHI Z, SAYYED-ALANGI S Z, NAJAFIAN L. Effects of enzyme type and process time on hydrolysis degree, electrophoresis bands and antioxidant properties of hydrolyzed proteins derived from defatted Bunium persicum Bioss. press cake[J]. Heliyon, 2020, 6(2).
[38] THAMMASENA R, LIU D C. Antioxidant and antimicrobial activities of different enzymatic hydrolysates from desalted duck egg white[J]. Asian-Australasian Journal of Animal Sciences,2020,33(9):1487. doi: 10.5713/ajas.19.0361
[39] 赵原, 金艳, 张民. 酶解麦胚制备风味活性肽的研究[J/OL]. 食品研究与开发, 2022, 43(14):42-51. [ZHAO Y, JIN Y, ZHANG M. Enzymatic Production of Wheat Germ Peptides with Flavor and Activity[J/OL]. Food Research and Development, 2022, 43(14):42-51.] ZHAO Y, JIN Y, ZHANG M. Enzymatic Production of Wheat Germ Peptides with Flavor and Activity[J/OL]. Food Research and Development, 2022, 43(14): 42-51.
[40] GARCÍA-MORENO P J, BATISTA I, PIRES C, et al. Antioxidant activity of protein hydrolysates obtained from discarded Mediterranean fish species[J]. Food Research International,2014,65:469−476. doi: 10.1016/j.foodres.2014.03.061
[41] 孙年振. 适度超声辅助酶解制备微拟球藻抗氧化肽[D]. 镇江:江苏大学, 2021. [SUN N Z. Moderate ultrasound-assisted enzymolysis to prepare antioxidant peptides from Nannochloropsis oceanica[D]. Zhenjiang:Jiangsu University, 2021.] SUN N Z. Moderate ultrasound-assisted enzymolysis to prepare antioxidant peptides from Nannochloropsis oceanica[D]. Zhenjiang: Jiangsu University, 2021.





 下载:
下载:



 下载:
下载:
