Progress in Molecular Characterization and Epitope Identification of Major Buckwheat Allergens
-
摘要: 荞麦是一种常见的食物过敏原,能够引发呼吸系统、消化系统、循环系统等方面的疾病,严重时可导致过敏性休克甚至死亡。明确荞麦中的主要过敏蛋白,确定其中的过敏原表位,对荞麦致敏机理解析及预防治疗相关的过敏疾病具有重要意义。本文综述了荞麦中的主要过敏原(Fag e 1、Fag e 2、Fag e 3、Fag e 4、Fag e 5、Fag t 2、Fag t 3、Fag t 6)结构特征及其表位的研究进展,旨在为荞麦过敏深入研究与防治提供一定参考。Abstract: Buckwheat is a common food allergen that can cause diseases related to the respiratory, digestive, and circulatory systems, and in severe cases, it can lead to anaphylactic shock or even death. Identifying the main allergenic proteins in buckwheat and determining their allergenic epitopes is of great significance for understanding the mechanism of buckwheat allergy and for the prevention and treatment of related allergic diseases. This paper reviews the structural characteristics and research progress on the epitopes of the main buckwheat allergens (Fag e 1, Fag e 2, Fag e 3, Fag e 4, Fag e 5, Fag t 2, Fag t 3, Fag t 6), aiming to provide a reference for in-depth research and prevention of buckwheat allergies.
-
荞麦是蓼科荞麦属,一年生草本植物,在世界范围内被广泛种植。荞麦具有降低胆固醇、预防胆结石、抗癌等多种生理功能,是良好的无麸质食品来源[1−2]。野生荞麦共有25种,而人工种植的荞麦主要分为两种:甜荞和苦荞[3]。我国是世界第二大荞麦生产国,2020年我国荞麦总产量为120万吨,仅次于俄罗斯。此外,我国的荞麦需求量也呈现上升趋势,2020年中国荞麦表观需求量52.3万吨,人均需求量0.37 kg/人[4]。荞麦具有广泛应用价值,但对部分人群也会造成严重的过敏反应[5−7]。病人主要通过食用荞麦类食品、吸入荞麦粉[8]、使用荞麦枕头等方式接触荞麦导致过敏。荞麦过敏症状主要包括打喷嚏、气喘、呼吸困难、水肿、胃痛、恶心、头晕、血压下降[9]等,严重可导致过敏性休克甚至危及生命[10]。
荞麦过敏是由免疫球蛋白E(Immunoglobulin E,IgE)介导的I型超敏反应[11],该过敏反应通常在患者接触过敏原0.5~2 h内发生[3]。引起过敏反应的物质称为过敏原或变应原、抗原,食物中的过敏原通常为蛋白质[12]。发挥致敏作用的“元凶”是存在于抗原表面的化学基团,即抗原表位[13−14],长度一般为5~20个氨基酸,抗原通过表位与抗原受体结合,引起机体的免疫应答,产生过敏反应[15]。深入研究荞麦过敏原蛋白及抗原表位,对于预防荞麦过敏、开展致敏性消减研究等具有重要意义。
截至2021年,经国际免疫学联合会(International Union of Immunological Societies,IUIS)确认的荞麦主要致敏蛋白包括甜荞中的Fag e 1、Fag e 2、Fag e 3、Fag e 4、Fag e 5和苦荞中的Fag t 2、Fag t 3、Fag t 6。此外还有一些荞麦过敏原也有相关报道,例如苦荞中的10[16]、17[17]、22 kDa[18]以及最近报道的苦荞中的植物非特异性脂质转移蛋白(nsLTPs)[19]。这些过敏原及其抗原表位的研究也取得一定进展,根据不同细胞所识别的抗原表位,可将表位分为T细胞表位和B细胞表位,基于不同结构又可以将其分为线性表位和构象表位[20]。常见的抗原表位鉴定方法包括:合成肽技术[21]、肽扫描技术[22]、生物信息学方法预测技术[23]、噬菌体肽库技术[24−25]等。本文将结合国内外对于甜荞过敏原Fag e 1~Fag e 5以及苦荞过敏原Fag t 2、Fag t 3、Fag t 6的研究进行分析总结,对甜荞和苦荞中主要过敏原的结构、性质、表位研究方法及研究进展进行详细介绍,旨在为荞麦过敏的防治与致敏机理研究提供一定参考。
1. 甜荞主要过敏原及表位鉴定研究进展
甜荞(Common Buckwheat)即普通荞麦,是人工种植荞麦的一种。目前,甜荞中已鉴定出的主要过敏原有五种,分别命名为:Fag e 1、Fag e 2、Fag e 3、Fag e 4、Fag e 5。Urisu等[26]从普通荞麦种子中分离并鉴定了一组蛋白质,该蛋白可与多数荞麦过敏患者血清中的免疫球蛋白发生特异性结合,其分子量约24 kDa,是荞麦种子13S球蛋白的β亚单位,被IUIS命名为Fag e 1;Tanaka等[27]发现抗胃蛋白酶的16 kDa蛋白也是引起荞麦过敏的原因之一,且该蛋白与荞麦24 kDa过敏原无同源性,被IUIS命名为Fag e 2;Choi等[28]将分子量为19 kDa的Vicilin-like蛋白鉴定为荞麦主要过敏原,发现83%的荞麦过敏患者血清中含有与荞麦19 kDa蛋白结合的特异性免疫球蛋白E(special Immunoglobulin E,sIgE),该蛋白被IUIS命名为Fag e 3;Fujimura等[29]从普通荞麦种子中分离纯化出了两种属于hevein-like抗微生物肽的IgE结合蛋白,分子量均为3.9 kDa,并对其氨基酸序列进行了测定,发现二者的一级结构中仅有一个氨基酸残基不同,这两种蛋白分别被IUIS命名为Fag e 4.0101和Fag e 4.0102。此外,还有一种Vicilin-like蛋白被IUIS命名为Fag e 5,在十二烷基硫酸钠聚丙烯酰胺凝胶电泳实验(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,SDS-PAGE)中显示出55 kDa和35 kDa两条主要条带,表明该蛋白质的两条链之间存在二硫键,在SDS-PAGE中加入还原剂时二硫键被破坏[30]。以上五种甜荞主要过敏原的生物化学特征以及生物学功能见表1。
表 1 甜荞主要过敏原Table 1. Common buckwheat major allergens过敏原IUIS名称 蛋白质种类 蛋白质家族 分子质量(kDa) 生物学功能 UniProt登录号 氨基酸个数 Fag e 1[26] 13S globulin Cupin超家族 24 种子贮存蛋白 Q9XFM4 191 Fag e 2[27] 2S albumin 醇溶蛋白超家族 16 种子贮存蛋白 Q2PS07 149 Fag e 3[28] Vicilin-like Cupin超家族 19 种子贮存蛋白 A5HIX6 136 Fag e 4[29] Antimicrobial peptide 植物防御素家族 3.9 种子贮存蛋白 P0DKH7/P0DKH8 40 Fag e 5[30] Vicilin-like protein Cupin超家族 55 种子贮存蛋白 Q6QJL1 140 1.1 甜荞主要过敏原Fag e 1、Fag e 3和Fag e 5
甜荞中的Fag e 1、Fag e 3和Fag e 5过敏原都属于Cupin超家族,Cupin这一单词来自于拉丁语“cupa”,意为“小木桶”,因为Cupin家族的基本特征结构是由6个β折叠片段组成的桶状结构。此外,根据蛋白质中含有的该桶状结构的数量又将Cupin超家族分成不同的亚群[31]。
荞麦种子中的13S球蛋白是一种中性、盐溶性的豆科类蛋白质,占荞麦种子总蛋白质的43%,在Uniprot中被命名为13S球蛋白种子储存蛋白3(13S globulin seed storage protein 3),又名豆类蛋白3(Legumin-like protein 3)[32]。该蛋白含有3条酸性链和3条碱性链,是一种六聚体结构,每个亚基由酸性和碱性链组成,碱性链衍生自单个前体,并通过二硫键连接[33]。荞麦种子13S球蛋白由538个氨基酸残基组成,其中1~20号氨基酸为信号肽,21~347号氨基酸为3条酸性链,348~538号氨基酸为3条碱性链,44~77号氨基酸以及120~354号氨基酸之间存在二硫键[32]。Fag e 1[34]是荞麦种子13S球蛋白的β多肽,其分子量为24 kDa,包含191个氨基酸残基,几乎与所有荞麦过敏患者血清IgE均具有免疫结合活性,是荞麦种子中的一种主要过敏原[35]。此外,Yoshioka等[36]已于2004年通过肽扫描法合成重叠肽库鉴定出荞麦过敏原Fag e 1的8个主要表位以及6个关键致敏性氨基酸,如表2所示,该研究发现这些表位与其他过敏原蛋白中鉴定出的表位并无同源性,说明目前这些表位是Fag e 1中特有的;同时所鉴定的6个关键氨基酸中有3个是带正电的精氨酸,表明Fag e 1的IgE结合能力可能与电荷有关。这些发现对了解荞麦过敏原的致敏机制具有重要意义。
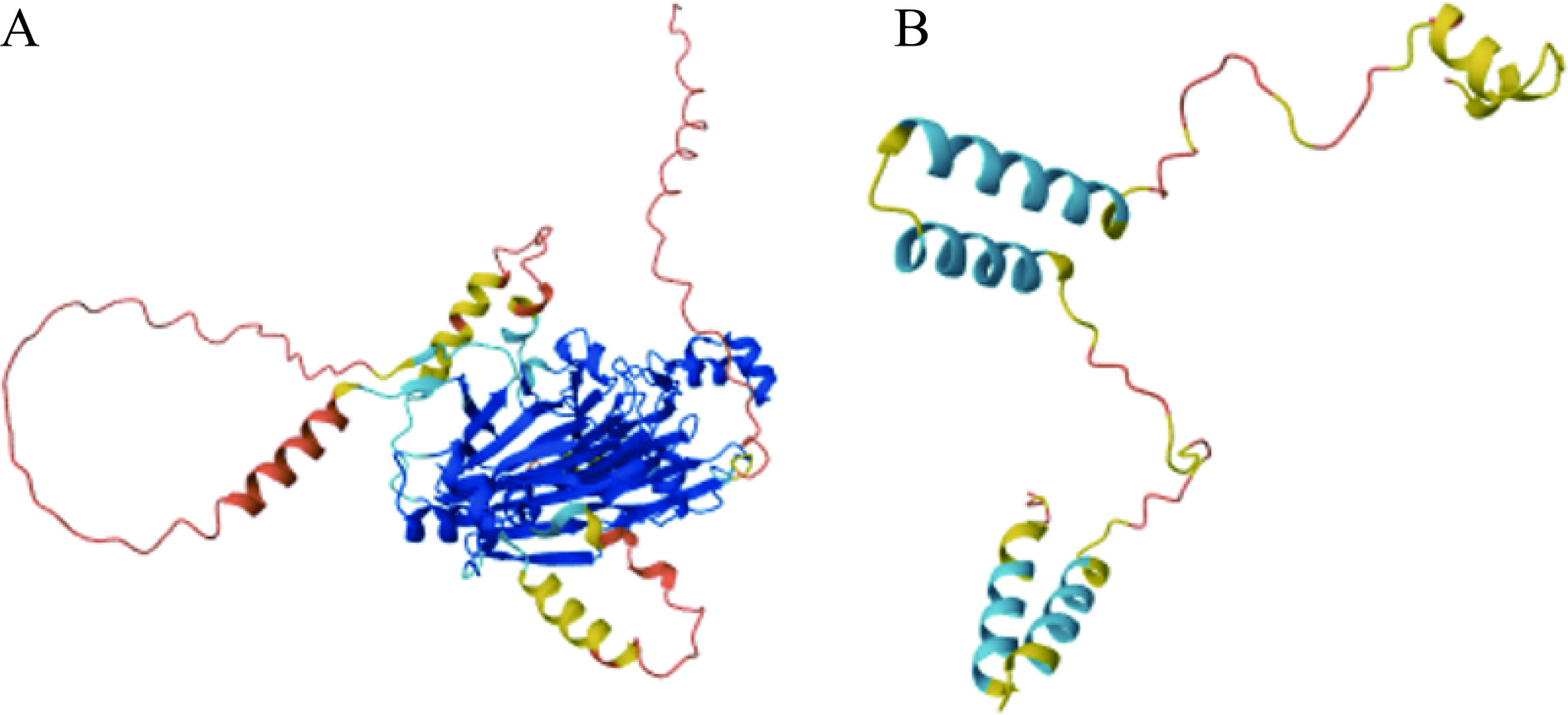
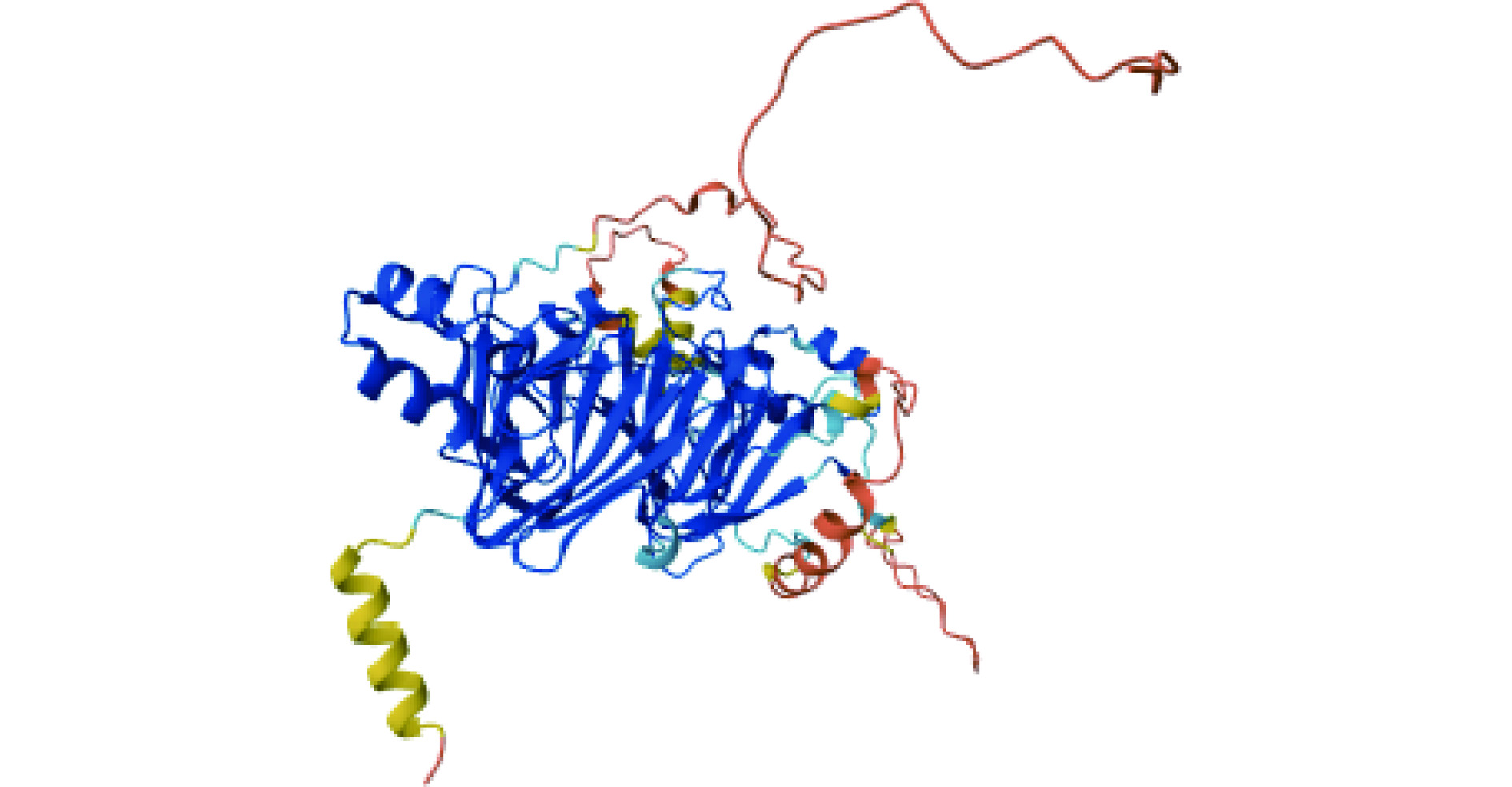
Fag e 3是Vicilin样蛋白的一个分子质量为19 kDa的片段,又名7S维西林,包含136个氨基酸残基,约有83.3%的荞麦过敏患者血清中含有与该过敏原结合的特异性免疫球蛋白[37]。Fag e 3与同为Vicilin样蛋白的英国胡桃过敏原Jug r 2具有35%的同源性、与腰果过敏原Ana o 1具有25%的同源性,与印度芝麻中的7S球蛋白具有32%的同源性[28]。此外,与其它的荞麦过敏原相比,Fag e 3与荞麦过敏患者血清中免疫球蛋白的结合具有特异性,针对该过敏原的sIgE抗体仅在接触荞麦后出现过敏症状的患者血清中发现,而在无症状的荞麦过敏患者血清中并未发现,因此可以通过检测Fag e 3的sIgE抗体来进行荞麦致敏的诊断[28]。目前,关于该过敏原表位的研究未见报道。Fag e 1和Fag e 3空间结构如图1所示。
Fag e 5是一种新发现的荞麦过敏原,通过质谱分析发现该蛋白属于Vicilin家族的7S球蛋白,由140个氨基酸残基组成,在SDS凝胶电泳实验中分成了55 kDa和35 kDa两个条带[30]。目前,关于该过敏原的空间结构及表位的研究未见报道。
1.2 甜荞主要过敏原Fag e 2
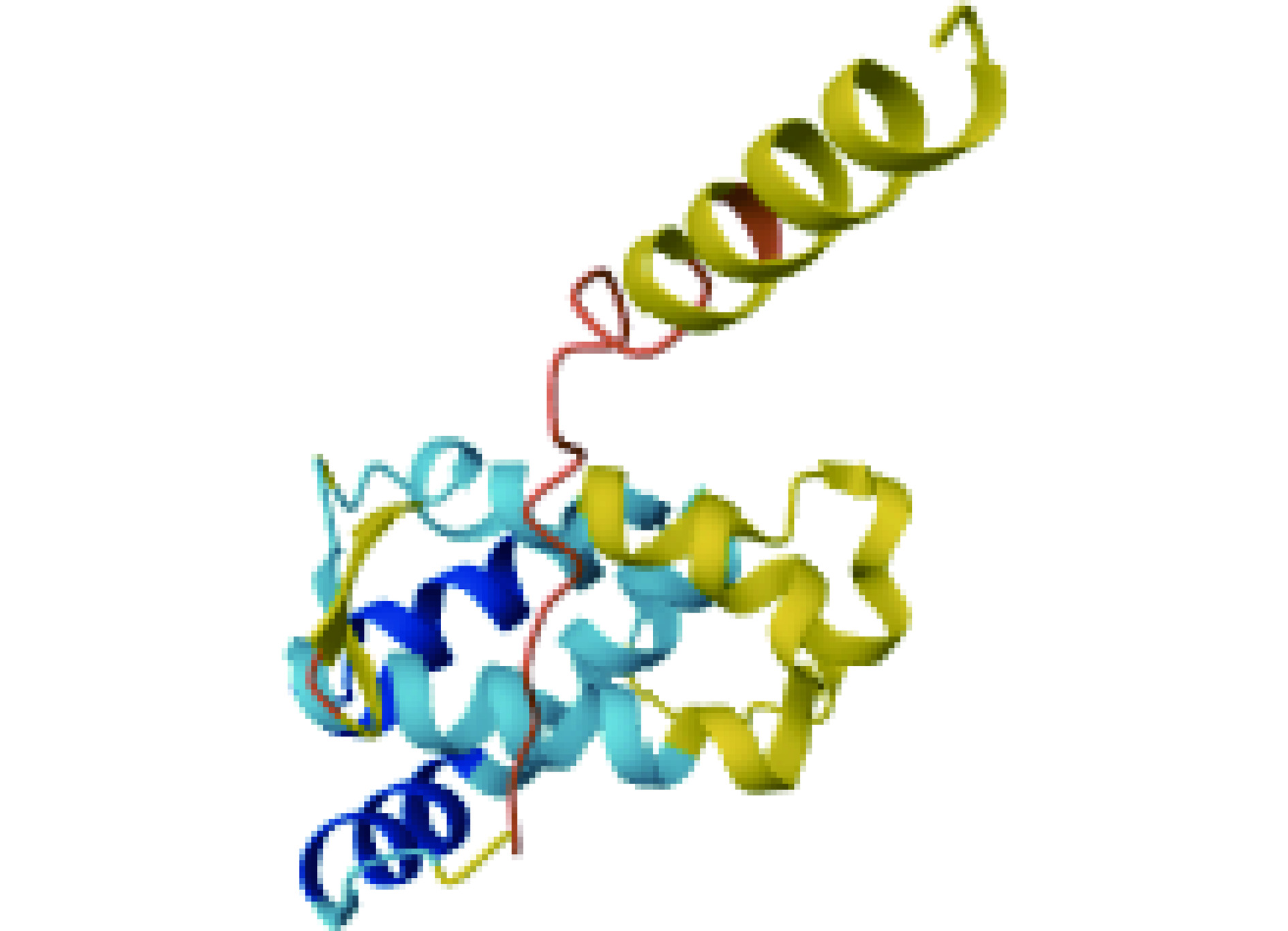
Fag e 2是属于2S白蛋白家族的种子储存蛋白,该家族通常具有由8个半胱氨酸残基构成的保守序列[38],由半胱氨酸所衍生的二硫键具有抵抗蛋白质水解的能力,因此,2S白蛋白家族中具有许多食物过敏原(图2)[39]。Fag e 2的分子量为16 kDa,含有149个氨基酸残基,其中1~22号氨基酸残基为信号肽,与荞麦8 kDa过敏原具有50%的同源性,约77.8%的荞麦过敏患者血清中含有针对Fag e 2的特异性免疫球蛋白[40]。目前,已经明确Fag e 2中的第99~106号氨基酸序列:EGVRDLKE为该蛋白的抗原表位,其中103号天冬氨酸为其关键氨基酸,此外,1~34号氨基酸的缺失以及将第38、100号半胱氨酸替换成丝氨酸均不会对Fag e 2的IgE结合能力产生显著影响;但当把52、77、83、87、88、98号半胱氨酸突变成丝氨酸以及把120~128、133号氨基酸突变成丙氨酸时,会导致其IgE结合能力的下降,其中,当125号天冬氨酸被突变成丙氨酸后,会导致Fag e 2的IgE结合能力显著下降[41],这些研究为荞麦过敏原中关键氨基酸的分析提供了重要的依据。
1.3 甜荞主要过敏原Fag e 4
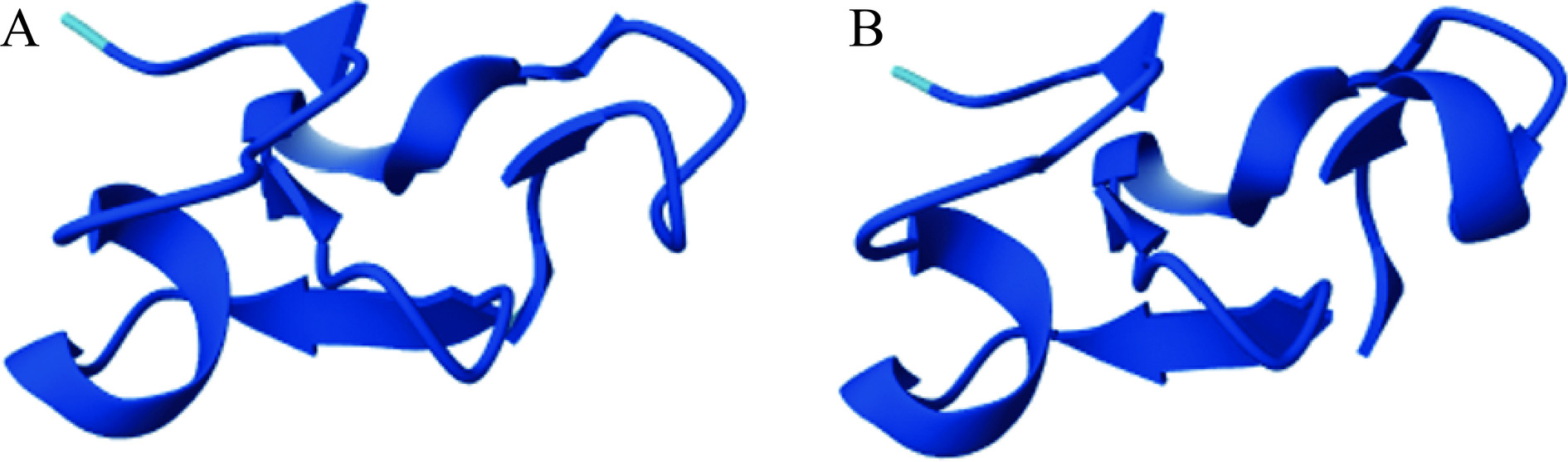
Fag e 4是从普通荞麦种子中分离出的抗菌肽(Antimicrobial Peptides,AMP)[29]。抗菌肽是一类由5~100个氨基酸组成的碱性寡肽[42],对植物病原真菌和革兰氏阴性和阳性细菌具有活性且通常含有大量的甘氨酸与半胱氨酸[43]。植物中的抗菌肽属于植物防御素家族,植物防御素可以分为两种类型:I型和II型,二者区别在于I型植物防御素含有6个半胱氨酸残基且存在由两个半胱氨酸残基组成的连续结构,而II型植物防御素含有8个半胱氨酸残基且半胱氨酸残基之间是不连续的[44]。而Geiselhart等[45]发现的荞麦中的抗菌肽Fa-AMP 1和Fa-AMP 2不同于上述两种类型,它们既含有8个半胱氨酸残基同时又具有由两个半胱氨酸残基组成的连续结构,因此荞麦中的这两种抗菌肽属于植物防御素I型和II型的一种亚型,二者均由40个氨基酸残基组成,且都含有8个半胱氨酸以及10个甘氨酸,占比45%,消光系数分别为42.8和38.9,被IUIS命名为Fag e 4.0101和Fag e 4.0102(图3)。目前,关于该过敏原的表位研究未见报道。
2. 苦荞主要过敏原及表位研究进展
苦荞(Tartary Buckwheat,TB)也是一种人工种植的荞麦[46],苦荞种子中的过敏原主要有3种,分别被IUIS命名为:Fag t 2、Fag t 3、Fag t 6。2006年,Koyano等[47]克隆了编码苦荞16 kDa蛋白(BWp 16)的cDNA,并发现纯化的重组BWp16可与荞麦阳性患者的血清发生反应,从而确认了BWp 16为苦荞的主要过敏原之一。2008年,Zhang等[48]从苦荞种子中克隆并表达出一种新的过敏原命名为Fag t 3(TBt),该过敏原的分子质量为56 kDa,具有较强的IgE结合能力。Fag t 6是一种新发现的苦荞过敏原,属于油质蛋白。2021年,Chen等[49]从苦荞种子中分离纯化出了天然油质蛋白,并对其免疫活性进行了测定,结果证明该蛋白是苦荞中的一种主要过敏原,并由IUIS命名为Fag t 6。关于上述三种苦荞主要过敏原的信息如表3所示。
2.1 苦荞主要过敏原Fag t 2
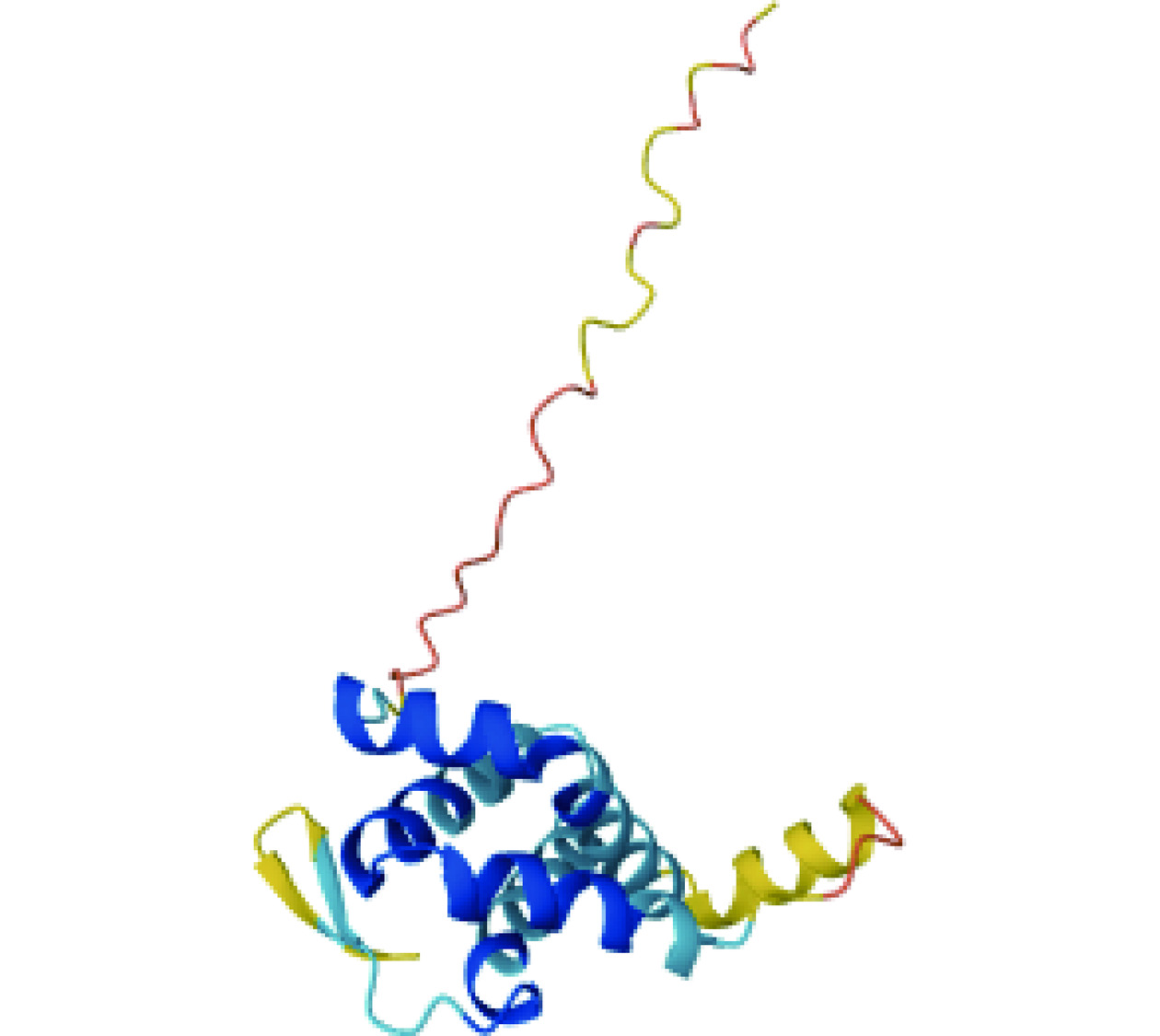
Fag t 2是苦荞中的一种主要过敏原,是属于醇溶蛋白超家族的2S白蛋白,分子质量为16 kDa,由149个氨基酸残基组成,其中1~19号氨基酸为信号肽(图4)。NCBI上的氨基酸序列同源性分析表明苦荞Fag t 2过敏原与甜荞8 kDa过敏原、甜荞16 kDa过敏原和苦荞10 kDa过敏原分别具有48.23%、82.55%、50.35%的同源性[50]。2006年,Chen等[51]纯化了重组Fag t 2蛋白,并对其免疫活性与抗胃蛋白酶消化能力进行了测定。结果表明重组Fag t 2与天然的Fag t 2具有等效的免疫学活性,同时对胃蛋白酶的消化具有一定的抵抗能力。Zheng等[52]通过生物信息学的方法预测并使用氨基酸定点突变实验、酶联免疫吸附试验(ELISA)和点杂交实验验证了苦荞Fag t 2的过敏原表位,其中,52~60号氨基酸PELVKCNRY、87~98号氨基酸EEKCLRGCCVAM、100~106号氨基酸DECVCEW、132~138号氨基酸LPNKCGI为Fag t 2的核心B细胞表位,108~117号氨基酸ENQKGRYDET、132~141号氨基酸KCGISEMECH为Fag t 2的T细胞核心表位。此外,该研究根据这些表位构建了细胞表位突变体,并分析了突变体的分子量、等电点、空间结构等信息,揭示了这些表位在过敏反应中的作用,对于理解苦荞过敏原的过敏机制及开发新的抗过敏策略具有重要意义。
2.2 苦荞主要过敏原Fag t 3
2008年,Zhang等[48]克隆了一种分子质量为56 kDa的苦荞过敏原的cDNA,该过敏原为Cupin超家族的11S球蛋白,命名为Fag t 3,并绘制出了Fag t 3的同源三聚体的空间结构模型(图5);同时,该团队还预测了该过敏原的18个IgE结合表位,为进一步的表位鉴定研究提供了理论基础(表4)。Fag t 3由515个氨基酸残基组成,其中1~22号氨基酸为信号肽,与甜荞过敏原Fag e 1具有91%的同源性,在123号与327号半胱氨酸之间形成链内二硫键,47号和8号半胱氨酸之间存在链间二硫键。该过敏原可通过C端和N端之间的裂解形成两个分子质量分别为24、35 kDa的片段,这两个片段分别被命名为TBa和TBb,酶联免疫吸附实验表明Fag t 3与荞麦患者血清的IgE结合能力弱于TBa和TBb,推测是由于Fag t 3水解成两个结构域导致部分结构的改变从而导致IgE结合能力的变化[53]。
表 4 苦荞过敏原Fag t 3表位预测结果[48]Table 4. Epitope prediction results of tartary buckwheat allergen Fag t 3[48]序号 氨基酸序列 得分 长度 位置 最大得
分位置1 FRCTGFVAVRYVIQPGG
LLLPSYSNAPYITFV1.200 32 78~109 87 2 LPILEFLQLSAQHVVLYKNAI 1.194 21 359~379 372 3 VQGVVIPGCPET 1.190 12 115~126 121 4 RGQILVVPQGFAVVVKAG 1.185 18 418~435 431 5 DLISVTLLDAN 1.172 11 185~195 189 6 RTSVLRAIPVELANSY 1.167 17 458~474 464 7 AHSALYVT 1.148 8 399~395 391 8 EGDVIPSPAGVVQW 1.121 14 164~177 172 9 RVQVVGD 1.112 7 400~406 402 10 RSFFLAGQ 1.109 8 206~213 208 11 GFIVQAQDLKLRVP 1.106 14 282-295 287 12 EVEVFRPFQS 1.105 10 490~499 494 13 VEALIGANILSG 1.091 12 242~253 245 14 QAFCNLK 1.088 7 324~330 328 15 HADVFNP 1.084 7 340-346 341 16 HHGHQQFQQQCDIQRL 1.083 16 37~52 49 17 DEILHELFRD 1.082 10 256~265 261 18 QKIFRV 1.078 6 157~162 159 TBa是苦荞主要过敏原Fag t 3的C端结构域[54],分子质量24 kDa,由195个氨基酸残基组成,具有良好的热稳定性,GenBank登录号为:AY044918。Ren等[55]将TBa分成了6个肽段片段(表5),验证它们的IgE结合能力,最终发现氨基酸序列为27~67的肽段的IgE结合能力最强,同时对其关键氨基酸进行了鉴定,发现第42号、47号、54号精氨酸可能对TBa的致敏性至关重要。
TBb是苦荞主要过敏原Fag t 3的N端结构域,分子质量为35 kDa,包含320个氨基酸残基,其氨基酸序列与甜荞Fag e 1具有84%的同源性[56]。2009年,贺东亮等[57]使用DNAStar预测了TBb的11个表位依次命名为E1~E11(表6)。2011年,Li等[58]采用合成肽方法将TBb分成四段短肽,并验证其IgE结合能力的变化,最后,发现氨基酸序列为75~150的肽段的IgE结合能力最强,并通过氨基酸定点突变的方法验证其关键氨基酸,发现当139号精氨酸,144号天冬氨酸被突变为丙氨酸后,该肽段的IgE结合能力显著增强,说明该氨基酸可能参与TBb的致敏活性;当141号精氨酸被突变为丙氨酸后,该肽段的IgE结合能力显著降低,说明该氨基酸可能是关键氨基酸。
2.3 苦荞主要过敏原Fag t 6
油质蛋白是存在于植物油体表面的碱性小分子蛋白,广泛存在于植物体的各个组织内,对于植物油脂的积累,维持植物的稳定性、抗冻性等理化性质具有重要的作用[59]。2021年,中国科学技术大学Chen等[49]从苦荞种子中提取出了一种油质蛋白,通过对该蛋白进行免疫活性的测定,发现20位荞麦过敏患者的血清中有12个血清样品可以与纯化后的苦荞油质蛋白结合,说明该油质蛋白是一种重要的苦荞过敏原,被IUIS命名为Fag t 6,分子质量为18 kDa,与甜荞油质蛋白仅有4个氨基酸不同,Fag t 6由173个氨基酸残基组成,GenBank登录号为:MW567728,具有一定的热稳定性。由于苦荞过敏原Fag t 6是最近新发现的荞麦过敏原,因此关于该蛋白的理化性质、空间结构、抗原表位等性质的研究暂时未见报道。
不同过敏原的致敏机制和程度可能存在显著差异。荞麦主要过敏原包括甜荞中的Fag e 1~Fag e 5和苦荞中的Fag t 2、Fag t 3、Fag t 6。这些致敏蛋白的结构和抗原表位不同,导致它们在引发过敏反应的过程中有不同的效力。例如,Fag e 1中的某些关键氨基酸位点对其致敏性具有重要影响。Fag e 2的抗原表位中的第99~106号氨基酸序列被鉴定为关键区域,这些区域对其IgE结合能力具有显著影响。Fag t 3水解成TBa和TBb两个结构域之后会造成IgE结合能力的变化。造成致敏程度差异的主要原因包括以下几点:a.蛋白质结构和抗原表位的差异:不同过敏原的蛋白质结构和抗原表位不同,导致其与IgE结合的能力存在差异。b.免疫反应的个体差异:不同个体的免疫系统对同一过敏原的反应可能不同,导致过敏反应的严重程度也不同。c.暴露方式和剂量:过敏原的暴露方式(如食入、吸入或接触)和暴露剂量也会影响其致敏性。通过了解和研究这些因素,可以更好地预防和治疗荞麦过敏反应,特别是在个性化医学和公共健康领域具有重要的应用前景。
3. 结语与展望
荞麦,因其营养价值很高且容易种植,在世界各地都被广泛培育,已成为许多国家饮食文化的一部分。然而,荞麦也是一种越来越受关注的食物过敏原,给荞麦过敏患者带来诸多危险与困扰。本文介绍了荞麦主要过敏原的分子特征与表位鉴定的最新研究成果,并探讨了这些成果在未来的荞麦过敏研究和治疗中的潜在应用。目前,已经确认的荞麦主要过敏原包括甜荞中的Fag e 1、Fag e 2、Fag e 3、Fag e 4、Fag e 5和苦荞中的Fag t 2、Fag t 3、Fag t 6。通过分析这些过敏原的氨基酸序列和三维结构,可有助于分析荞麦分子特征与研究致敏机制。过敏原的表位与致敏性密切相关,表位是过敏原表面的抗原决定簇,不同加工工艺会对过敏原的结构产生不同的影响,造成抗原表位的破坏或暴露,从而影响过敏原的致敏能力。此外,表位中某个氨基酸的突变也会引起过敏原IgE结合能力的显著变化。因此,明确过敏原的结构并鉴定其中的表位对于过敏原致敏性的研究尤为重要。目前,已有学者完成了甜荞过敏原Fag e 1、Fag e 2和苦荞过敏原Fag t 2、Fag t 3中的抗原表位鉴定,而关于其它荞麦过敏原的表位鉴定相关信息暂时未见报道,更多荞麦过敏原表位信息对其致敏机理解析有重要的研究意义。未来的研究可以围绕以下具体研究方向展开:a.进一步完善荞麦过敏原的信息,通过生物信息学、免疫学、X射线晶体学等技术深入解析荞麦过敏原表位的序列和结构[60−61]。b.表位的同源性与交叉反应性,关注表位同源性及反应交叉性,全面地解析致敏源头,从而制定更有效的治疗计划[62]。c.表位的合成与修饰:通过化学合成或基因工程手段,设计和制造能够诱导耐受或减少免疫反应的表位修饰物。这些修饰物可以用于过敏症的免疫治疗或疫苗开发[63]。这些研究需要在现有基础上继续深入了解荞麦过敏原的分子特征和致敏机制,以解决荞麦过敏问题,提高食品安全和公共健康水平。
-
表 1 甜荞主要过敏原
Table 1 Common buckwheat major allergens
过敏原IUIS名称 蛋白质种类 蛋白质家族 分子质量(kDa) 生物学功能 UniProt登录号 氨基酸个数 Fag e 1[26] 13S globulin Cupin超家族 24 种子贮存蛋白 Q9XFM4 191 Fag e 2[27] 2S albumin 醇溶蛋白超家族 16 种子贮存蛋白 Q2PS07 149 Fag e 3[28] Vicilin-like Cupin超家族 19 种子贮存蛋白 A5HIX6 136 Fag e 4[29] Antimicrobial peptide 植物防御素家族 3.9 种子贮存蛋白 P0DKH7/P0DKH8 40 Fag e 5[30] Vicilin-like protein Cupin超家族 55 种子贮存蛋白 Q6QJL1 140 表位 序列 起始位置 结束位置 长度 表位1 QNVNRPSR 13 20 8 表位2 NNLPILEF 37 44 8 表位3 WNLNAH 64 69 6 表位4 EGRSVF 87 92 6 表位5 KAGNEG 113 118 6 表位6 IAGKTSVLRA 135 144 10 表位7 KEAFRL 159 164 6 表位8 SRDEKERERF 179 188 10 注:加粗部分为突变后会导致IgE结合能力下降的关键氨基酸。 表 3 苦荞主要过敏原
Table 3 Tartary buckwheat major allergens
表 4 苦荞过敏原Fag t 3表位预测结果[48]
Table 4 Epitope prediction results of tartary buckwheat allergen Fag t 3[48]
序号 氨基酸序列 得分 长度 位置 最大得
分位置1 FRCTGFVAVRYVIQPGG
LLLPSYSNAPYITFV1.200 32 78~109 87 2 LPILEFLQLSAQHVVLYKNAI 1.194 21 359~379 372 3 VQGVVIPGCPET 1.190 12 115~126 121 4 RGQILVVPQGFAVVVKAG 1.185 18 418~435 431 5 DLISVTLLDAN 1.172 11 185~195 189 6 RTSVLRAIPVELANSY 1.167 17 458~474 464 7 AHSALYVT 1.148 8 399~395 391 8 EGDVIPSPAGVVQW 1.121 14 164~177 172 9 RVQVVGD 1.112 7 400~406 402 10 RSFFLAGQ 1.109 8 206~213 208 11 GFIVQAQDLKLRVP 1.106 14 282-295 287 12 EVEVFRPFQS 1.105 10 490~499 494 13 VEALIGANILSG 1.091 12 242~253 245 14 QAFCNLK 1.088 7 324~330 328 15 HADVFNP 1.084 7 340-346 341 16 HHGHQQFQQQCDIQRL 1.083 16 37~52 49 17 DEILHELFRD 1.082 10 256~265 261 18 QKIFRV 1.078 6 157~162 159 序号 所在位置 片段长度 E1 27~67 41 E2 87~137 51 E12 27~137 111 E3 120~156 37 E4 155~191 37 E34 120~191 72 -
[1] ZHU F. Buckwheat proteins and peptides:Biological functions and food applications[J]. Trends in Food Science & Technology,2021,110:155−167.
[2] SOFI S A, AHMED N, FAROOQ A, et al. Nutritional and bioactive characteristics of buckwheat, and its potential for developing gluten-free products:An updated overview[J]. Food Science & Nutrition,2023,11(5):2256−2276.
[3] NORBÄCK D, WIESLANDER G. A review on epidemiological and clinical studies on buckwheat allergy[J]. Plants-Basel,2021,10(3):607. doi: 10.3390/plants10030607
[4] 赵霞, 韩一军, 姜利娜, 等. 我国苦荞市场与产业调查分析报告[J]. 农产品市场,2021(15):42−44. [ZHAO Xia, HAN Yijun, JIANG Lina, et al. China's buckwheat market and industry research and analysis report[J]. Agricultural Market,2021(15):42−44.] ZHAO Xia, HAN Yijun, JIANG Lina, et al. China's buckwheat market and industry research and analysis report[J]. Agricultural Market, 2021(15): 42−44.
[5] KIM S A, TOUSHIK S H, LEE J E, et al. Ultrasensitive monoclonal antibodies specific to thermal stable-soluble proteins of buckwheat[J]. Food Chemistry,2023,423:136269. doi: 10.1016/j.foodchem.2023.136269
[6] MIYAMOTO M, KATO M, YOSHIHARA S, et al. Food protein-induced enterocolitis syndrome due to buckwheat:A case report[J]. Allergologia et Immunopathologia,2023,51(3):25−27. doi: 10.15586/aei.v51i3.826
[7] OLIVIERI B, SKYPALA I J. New arrivals in anaphylaxis to foods[J]. Current Opinion in Allergy and Clinical Immunology,2023,23(5):357−363. doi: 10.1097/ACI.0000000000000936
[8] ERQUICI S P, ABRAIRA M B, ARENAS S D, et al. Rhinoconjunctivitis and occupational asthma due to buckwheat flour allergy[J]. Archivos de Bronconeumologia,2020,56(7):466. doi: 10.1016/j.arbr.2020.02.004
[9] JUNGEWELTER S, AIRAKSINEN L, PESONEN M. Occupational buckwheat allergy as a cause of allergic rhinitis, asthma, contact urticaria and anaphylaxis-An emerging problem in food-handling occupations?[J]. American Journal of Industrial Medicine,2020,63(11):1047−1053. doi: 10.1002/ajim.23185
[10] FAROOQ M, WANI S M, MIR S A, et al. An overview of buckwheat allergy:A rare allergenic food[J]. Journal of Food Composition and Analysis,2023,123:105616. doi: 10.1016/j.jfca.2023.105616
[11] JUNGEWELTER S, SUOMELA S, AIRAKSINEN L. Occupational IgE-mediated psyllium allergy in contemporary gluten-free and vegan baking:A case of allergic rhinitis[J]. American Journal of Industrial Medicine,2021,64(5):431. doi: 10.1002/ajim.23238
[12] SUDHARSON S, KALIC T, HAFNER C, et al. Newly defined allergens in the WHO/IUIS Allergen Nomenclature Database during 01/2019-03/2021[J]. Allergy,2021,76(11):3359−3373. doi: 10.1111/all.15021
[13] ZHANG Z Y, LI X M, WANG H, et al. Seafood allergy:Allergen, epitope mapping and immunotherapy strategy[J]. Critical Reviews in Food Science and Nutrition,2023,63(10):1314−1338. doi: 10.1080/10408398.2023.2181755
[14] LEE A S E, SUPRUN M, SAMPSON H. Epitope-based IgE assays and their role in providing diagnosis and prognosis of food allergy[J]. Journal of Allergy and Clinical Immunology-in Practice,2023,11(10):2983−2988. doi: 10.1016/j.jaip.2023.06.043
[15] PLATTS-MILLS T A, HILGER C, JAPPE U, et al. Carbohydrate epitopes currently recognized as targets for IgE antibodies[J]. Allergy,2021,76(8):2383−2394. doi: 10.1111/all.14802
[16] MATSUMOTO R, FUJINO K, NAGATA Y, et al. Molecular characterization of a 10-kDa buckwheat molecule reactive to allergic patients' IgE[J]. Allergy,2004,59(5):533−538. doi: 10.1046/j.1398-9995.2003.00412.x
[17] 张润敏, 刘海宁, 姚慧鹏, 等. 苦荞过敏蛋白TBW17基因克隆及其抗原表位分析[J]. 基因组学与应用生物学,2016,35(12):3481−3486. [ZHANG Runmin, LIU Haining, YAO Huipeng, et al. Cloning of buckwheat allergenic protein TBW17 gene and its antigenic epitope analysis[J]. Genomics and Applied Biology,2016,35(12):3481−3486.] ZHANG Runmin, LIU Haining, YAO Huipeng, et al. Cloning of buckwheat allergenic protein TBW17 gene and its antigenic epitope analysis[J]. Genomics and Applied Biology, 2016, 35(12): 3481−3486.
[18] 侯晓军. 苦荞过敏蛋白TB22kDa的cDNA片断克隆、原核表达及初步纯化[D]. 太原:山西大学, 2003. [HOU Xiaojun. Cloning, prokaryotic expression and preliminary purification of cDNA fragment of buckwheat allergenic protein TB22kDa[D]. Taiyuan:Shanxi University, 2003.] HOU Xiaojun. Cloning, prokaryotic expression and preliminary purification of cDNA fragment of buckwheat allergenic protein TB22kDa[D]. Taiyuan: Shanxi University, 2003.
[19] CUI X D, TIAN W H, WANG W H, et al. Sequence analysis and biochemical characteristics of two non-specific lipid transfer proteins from tartary buckwheat seeds[J]. Protein and Peptide Letters,2023,30(6):520−529. doi: 10.2174/0929866530666230511154511
[20] 李俊慧, 邵军军, 常惠芸, 等. 抗原表位鉴定方法的研究进展[J]. 中国兽医科学,2021,51(6):678−683. [LI Junhui, SHAO Junjun, CHANG Huiyun, et al. Advances in antigenic epitope identification methods[J]. Chinese Veterinary Science,2021,51(6):678−683.] LI Junhui, SHAO Junjun, CHANG Huiyun, et al. Advances in antigenic epitope identification methods[J]. Chinese Veterinary Science, 2021, 51(6): 678−683.
[21] PARK J Y, CHO S H. Production of monoclonal antibody of heat-labile toxin A subunit to identify enterotoxigenic Escherichia coli by epitope mapping using synthetic peptides[J]. Frontiers in Immunology,2023,14:1152910. doi: 10.3389/fimmu.2023.1152910
[22] DANG X B, GUELEN L, HULSIK D L, et al. Epitope mapping of monoclonal antibodies:A comprehensive comparison of different technologies[J]. Mabs,2023,15(1):2285285. doi: 10.1080/19420862.2023.2285285
[23] JIA B X, OJIMA-KATO T, KOJIMA T, et al. Rapid and cost-effective epitope mapping using pure ribosome display coupled with next-generation sequencing and bioinformatics[J]. Journal of Bioscience and Bioengineering,2024,137(4):321−328. doi: 10.1016/j.jbiosc.2024.01.008
[24] JAROSZEWICZ W, MORCINEK-ORLOWSKA J, PIERZYNOWSKA K, et al. Phage display and other peptide display technologies[J]. Fems Microbiology Reviews,2022,46(2):fuab052. doi: 10.1093/femsre/fuab052
[25] ZHANG A L, ZHAO H J, PEI S H, et al. Identification and structure of epitopes on cashew allergens Ana o 2 and Ana o 3 using phage display[J]. Molecules,2023,28(4):1880. doi: 10.3390/molecules28041880
[26] URISU A, KONDO Y, MORITA Y, et al. Isolation and characterization of a major allergen in buckwheat seeds[J]. Current Advances in Buckwheat Research, 1995:965-974.
[27] TANAKA K, MATSUMOTO K, AKASAWA A, et al. Pepsin-resistant 16-kD buckwheat protein is associated with immediate hypersensitivity reaction in patients with buckwheat allergy[J]. Journal of Innate Immunity,2002,129(1):49−56.
[28] CHOI S Y, SOHN J H, LEE Y W, et al. Characterization of buckwheat 19-kD allergen and its application for diagnosing clinical reactivity[J]. International Archives of Allergy and Immunology,2007,144(4):267−274. doi: 10.1159/000106315
[29] FUJIMURA M, MINAMI Y, WATANABE K, et al. Purification, characterization, and sequencing of a novel type of antimicrobial peptides, Fa-AMP1 and Fa-AMP2, from seeds of buckwheat (Fagopyrum esculentum Moench.)[J]. Bioscience, Biotechnology, and Biochemistry,2003,67(8):1636−1642. doi: 10.1271/bbb.67.1636
[30] GEISELHART S, NAGL C, DUBIELA P, et al. Concomitant sensitization to legumin, Fag e 2 and Fag e 5 predicts buckwheat allergy[J]. Clinical & Experimental Allergy,2018,48(2):217−224.
[31] HU F, YE Z Y, DONG K, et al. Divergent structures and functions of the cupin proteins in plants[J]. International Journal of Biological Macromolecules,2023,242:124791. doi: 10.1016/j.ijbiomac.2023.124791
[32] SANO M, NAKAGAWA M, OISHI A, et al. Diversification of 13S globulins, allergenic seed storage proteins, of common buckwheat[J]. Food Chemistry,2014,155:192−198. doi: 10.1016/j.foodchem.2014.01.047
[33] ZHOU Y, OUYANG B, DU L, et al. Effects of ultra-high-pressure treatment on the structural and functional properties of buckwheat 13S globulin[J]. Food Science and Human Wellness,2022,11(4):895−903. doi: 10.1016/j.fshw.2022.03.008
[34] CHNAPEK M, GÁLOVÁ Z, BALÁZOVÁ Z, et al. Application of two-dimensional electrophoresis and mass spectrometry for the detection of allergens in selected varieties of wheat, oats and buckwheat[J]. Journal of Microbiology Biotechnology and Food Sciences,2023,13(1):e9934. doi: 10.55251/jmbfs.9934
[35] MARUYAMA FUNSTSUKI W, FUJINO K, SUZUKI T, et al. Quantification of a major allergenic protein in common buckwheat cultivars by an enzyme-linked immunosorbent assay (ELISA)[J]. Fagopyrum,2004,21:39−44.
[36] YOSHIOKA H, OHMOTO T, URISU A, et al. Expression and epitope analysis of the major allergenic protein Fag e 1 from buckwheat[J]. 2004, 161(7):761-767.
[37] YANAGIDA N, SATO S, MARUYAMA N, et al. Specific IgE for Fag e 3 predicts oral buckwheat food challenge test results and anaphylaxis:A pilot study[J]. International Archives of Allergy and Immunology,2018,176(1):8−14. doi: 10.1159/000487135
[38] SOUZA P F. The forgotten 2S albumin proteins:Importance, structure, and biotechnological application in agriculture and human health[J]. International Journal of Biological Macromolecules,2020,164:4638−4649. doi: 10.1016/j.ijbiomac.2020.09.049
[39] BUENO D C, MARTÍN P L, PARRÓN J, et al. Characterization of relevant biomarkers for the diagnosis of food allergies:An overview of the 2S albumin family[J]. Foods,2021,10(6):1235. doi: 10.3390/foods10061235
[40] CHOI S Y, SOHN J H, LEE Y W, et al. Application of the 16-kDa buckwheat 2 S storage albumin protein for diagnosis of clinical reactivity[J]. Annals of Allergy, Asthma & Immunology, 2007, 99(3):254−260.
[41] SATOH R, KOYANO S, TAKAGI K, et al. Identification of an IgE-binding epitope of a major buckwheat allergen, BWp16, by SPOTs assay and mimotope screening[J]. International Archives of Allergy and Immunology,2010,153(2):133−140. doi: 10.1159/000312630
[42] DI SOMMA A, MORETTA A, CANÈ C, et al. Antimicrobial and antibiofilm peptides[J]. Biomolecules,2020,10(4):652. doi: 10.3390/biom10040652
[43] SATHOFF A E, LEWENZA S, SAMAC D A. Plant defensin antibacterial mode of action against Pseudomonas species[J]. Bmc Microbiology,2020,20(1):1−11. doi: 10.1186/s12866-019-1672-7
[44] BROEKAERT W F, CAMMUE B P, DE BOLLE M F, et al. Antimicrobial peptides from plants[J]. Critical Reviews in Plant Sciences,1997,16(3):297−323. doi: 10.1080/07352689709701952
[45] GEISELHART S, NAGL C, DUBIELA P, et al. Concomitant sensitization to legumin, Fag e 2 and Fag e 5 predicts buckwheat allergy[J]. 2018, 48(2):217−224.
[46] LUTHAR Z, GOLOB A, GERM M, et al. Tartary buckwheat in human nutrition[J]. Plants-Basel,2021,10(4):700. doi: 10.3390/plants10040700
[47] KOYANO S, TAKAGI K, TESHIMA R, et al. Molecular cloning of cDNA, recombinant protein expression and characterization of a buckwheat 16-kDa major allergen[J]. International Archives of Allergy and Immunology,2006,140(1):73−81. doi: 10.1159/000092038
[48] ZHANG X, YUAN J M, CUI X D, et al. Molecular cloning, recombinant expression, and immunological characterization of a novel allergen from tartary buckwheat[J]. Journal of Agricultural and Food Chemistry,2008,56(22):10947−10953. doi: 10.1021/jf801855a
[49] CHEN F, LI H, FAN X, et al. Identification of a novel major allergen in buckwheat seeds:Fag t 6[J]. Journal of Agricultural and Food Chemistry,2021,69(45):13315−13322. doi: 10.1021/acs.jafc.1c01537
[50] 郑蓓. 苦荞16 kDa过敏原Fag t 2结构与功能研究[D]. 杨凌:西北农林科技大学, 2021. [ZHEN Pei. Structure and function of the buckwheat 16 kDa allergen, Fag t 2[D]. Yangling:North West Agriculture and Forestry University, 2021.] ZHEN Pei. Structure and function of the buckwheat 16 kDa allergen, Fag t 2[D]. Yangling: North West Agriculture and Forestry University, 2021.
[51] CHEN P, GUO Y, YAN Q, et al. Molecular cloning and characterization of Fag t 2:A 16‐kDa major allergen from Tartary buckwheat seeds[J]. Allergy,2011,66(10):1393−1395. doi: 10.1111/j.1398-9995.2011.02657.x
[52] ZHENG B, ZHANG H, SHEN W, et al. Core epitope analysis of 16 kDa allergen from tartary buckwheat[J]. Food Chemistry,2021,346:128953. doi: 10.1016/j.foodchem.2020.128953
[53] 贺东亮, 张政, 任晓霞, 等. 苦荞过敏原TBa和TBb基因的共表达及其包涵体复性的研究[J]. 中国农学通报,2009,25(8):50−52. [HE Dongliang, ZHANG Zheng, REN Xiaoxia, et al. Co-expression of TBa and TBb genes of buckwheat allergens and their inclusion body complexes[J]. China Agronomy Bulletin,2009,25(8):50−52.] HE Dongliang, ZHANG Zheng, REN Xiaoxia, et al. Co-expression of TBa and TBb genes of buckwheat allergens and their inclusion body complexes[J]. China Agronomy Bulletin, 2009, 25(8): 50−52.
[54] YANG Z, LI Y, LI C, et al. Synthesis of hypoallergenic derivatives of the major allergen Fag t 1 from tartary buckwheat via sequence restructuring[J]. Food and Chemical Toxicology,2012,50(8):2675−2680. doi: 10.1016/j.fct.2012.03.039
[55] REN X, ZHANG X, LI Y, et al. Epitope mapping and immunological characterization of a major allergen TBa in tartary buckwheat[J]. Biotechnology Letters,2010,32:1317−1324. doi: 10.1007/s10529-010-0281-1
[56] 赵小珍, 张政, 景巍, 等. 苦荞麦主要过敏蛋白N端基因片段的克隆及序列分析[J]. 食品科学,2006(10):41−44. [ZHAO Xiaozhen, ZHANG Zheng, JING Wei, et al. Cloning and sequence analysis of the N-terminal gene fragment of buckwheat major allergenic protein[J]. Food Science,2006(10):41−44.] ZHAO Xiaozhen, ZHANG Zheng, JING Wei, et al. Cloning and sequence analysis of the N-terminal gene fragment of buckwheat major allergenic protein[J]. Food Science, 2006(10): 41−44.
[57] 贺东亮, 崔晓东, 赵小珍, 等. 过敏蛋白TBb的免疫活性鉴定及其表位预测[J]. 免疫学杂志,2009,25(2):137−140,144. [HE Dongliang, CUI Xiaodong, ZHAO Xiaozhen, et al. Identification of immunoreactivity of the allergenic protein TBb and its epitope prediction[J]. Journal of Immunology,2009,25(2):137−140,144.] HE Dongliang, CUI Xiaodong, ZHAO Xiaozhen, et al. Identification of immunoreactivity of the allergenic protein TBb and its epitope prediction[J]. Journal of Immunology, 2009, 25(2): 137−140,144.
[58] LI P, CUI X, LI Y, et al. Epitope mapping and identification on a 3D model built for the tartary buckwheat allergic protein TBb[J]. Acta Biochim Biophys Sin,2011,43(6):441−447. doi: 10.1093/abbs/gmr036
[59] BOARD A J, CROWTHER J M, ACEVEDO-FANI A, et al. How plants solubilise seed fats:Revisiting oleosin structure and function to inform commercial applications[J]. Biophysical Reviews,2022,14(1):257−266. doi: 10.1007/s12551-021-00923-5
[60] HE X R, YANG Y, CHEN Y X, et al. Immunoglobulin e epitope mapping and structure-allergenicity relationship analysis of crab allergen scy p 9[J]. Journal of Agricultural and Food Chemistry,2023,71(45):17379−17390.
[61] TAHIR S, BOURQUARD T, MUSNIER A, et al. Accurate determination of epitope for antibodies with unknown 3D structures[J]. Mabs,2021,13(1):1961349. doi: 10.1080/19420862.2021.1961349
[62] MARINI-RAPOPORT O, FERNÁNDEZ-QUINTERO M L, KESWANI T, et al. Defining the cross-reactivity between peanut allergens Ara h 2 and Ara h 6 using monoclonal antibodies[J]. Clinical and Experimental Immunology,2024,216(1):25−35. doi: 10.1093/cei/uxae005
[63] POM A, SMITH S A, CHRUSZCZ M, et al. Precision engineering for localization, validation, and modification of allergenic epitopes[J]. Journal of Allergy and Clinical Immunology,2024,153(3):560−571. doi: 10.1016/j.jaci.2023.12.017





 下载:
下载:
 下载:
下载:
