In vitro Antioxidant Activity of Salidroside and Its Effect on the Oxidative Properties of Minced Pork
-
摘要: 为探讨红景天苷(Salidroside,SAL)对猪肉糜贮藏期间品质及各项氧化指标的影响,本文以ABTS+自由基清除率和铁离子还原能力为评价指标,对红景天苷的体外抗氧化活性进行评价。将0.2、0.4、0.6和0.8 mmol/L的红景天苷分别添加到猪肉糜中,以空白组作对照,通过测定猪肉糜的抗氧化特性、粒径、流变特性以及在不同贮藏时间的pH、持水性、巯基含量、羰基含量和TBARS值,研究红景天苷对猪肉糜贮藏期间氧化特性的影响。结果表明:红景天苷溶液的体外抗氧化能力随着浓度的增加而增强,0.8 mmol/L红景天苷组猪肉糜的ABTS+自由基清除率和FRAP值与空白对照组相比分别增大了67.89%和46.04%。红景天苷增大了猪肉糜的粒径和表观粘度,并且能够抑制贮藏期间猪肉糜的pH升高,降低了TBARS值和羰基含量,增大了持水性和巯基含量,其效果随红景天苷浓度增大而增强,0.8 mmol/L红景天苷效果最佳。综上,研究发现红景天苷在开发植物源抗氧化剂方面具有较好的应用前景,对促进肉制品品质和延长其货架期有积极的作用。Abstract: To investigate the effects of salidroside on the quality and various oxidation indices of minced pork during storage, the in vitro antioxidant activity of salidroside was evaluated by using ABTS+ radical scavenging rate, and ferric iron ion reducing capacity as evaluation indices. Salidroside concentrations of 0.2, 0.4, 0.6, and 0.8 mmol/L were added to minced pork, with a blank group used as the control. The effects of salidroside on the oxidative properties of minced pork during storage were assessed by determining the antioxidant properties, particle size distribution, rheological properties, pH, water holding capacity, sulfhydryl content, carbonyl content, and TBARS value of the minced pork at different storage times. Results showed that the in vitro antioxidant capacity of salidroside solution increased with concentration. The ABTS+ radical scavenging rate and FRAP value of minced pork in the 0.8 mmol/L salidroside group increased by 67.89% and 46.04%, respectively, compared with those of the blank control group. Salidroside increased the particle size and apparent viscosity of minced pork, inhibited the increase of pH value, decreased the TBARS value and carbonyl content, and increased the water-holding capacity and sulfhydryl content of minced pork during the storage period. The effect was enhanced with the increase of salidroside concentration, and the best effect was found at 0.8 mmol/L salidroside. In conclusion, Salidroside has promising application prospects in the development of plant-derived antioxidants, which can positively affect the quality of meat products and prolong their shelf life.
-
Keywords:
- Salidroside /
- minced pork /
- antioxidant /
- lipid oxidation /
- protein oxidation
-
高原地区特殊的地理环境造就了当地居民独特的饮食结构,多项统计结果显示,肉类在我国高原地区居民的膳食结构中占据着不可或缺的重要地位[1−2],是人体获取优质蛋白质、必需氨基酸、维生素和矿物质的重要来源。但是在肉和肉制品加工和贮藏过程中,由于蛋白质和脂肪的含量较高,极易发生氧化,导致肉品品质和食用安全性下降[3]。脂质氧化通常受脂肪酸组成、光照、温度、加工条件和包装等因素影响,虽然脂质氧化产物主要影响肉的感官品质,但其产生的有害化合物也会引发多种疾病,对人类健康也造成负面影响[4];肉类蛋白质由于活性氧的氧化攻击和侧链氨基酸的修饰也容易发生氧化降解,这会导致蛋白质聚集、羰基化、二三级结构改变[5]。脂质和蛋白质氧化反应不仅降低了肉的营养价值,还会使质地、风味等发生劣变,从而影响消费者的接受度[6],被认为是除了微生物污染外,肉及肉制品品质降低的主要原因[7−8]。
肉类行业在生产和贮存过程中抑制或延缓氧化反应的主要策略是在肉和肉制品中添加抗氧化剂[9−12],然而随着消费者对食品安全的愈发重视,以及传统的合成抗氧化剂存在与癌症等疾病发展相关的潜在风险[13],许多研究者将目光转向植物源天然抗氧化剂。天然植物源类提取物中含有许多活性化合物,这些化合物通常通过抑制脂质、蛋白质和色素等的氧化来保持产品品质,从而延长肉制品保质期[14]。
红景天是一种传统的天然药食同源性中药材,常生长在海拔1800~2700 m的高寒无污染地带,在中国西南部高海拔地区以及蒙古、俄罗斯、欧洲北部均有分布,常作为膳食补充剂,近年来被广泛用于抗高原反应[15]。红景天苷(Salidroside,SAL)是红景天的主要活性成分,可从红景天的根部提取,具有抗缺氧、抗氧化[16]、抗炎[17]、抗肿瘤及对心血管和神经系统的保护等多种活性功能[18−19],且少见不良反应,可缓解高原低压、低氧环境导致的氧化应激和炎症问题。近年来,关于红景天苷抗氧化性的研究已经取得了显著进展,多项研究表明,红景天苷具有良好的抗氧化性,能够清除体内自由基、增加抗氧化酶活性,并调节氧化还原系统,从而保护细胞免受氧化应激的损伤[20−22]。这些研究为红景天苷作为抗氧化剂在保健和医药领域的应用提供了重要的科学依据,而将红景天苷作为抗氧化剂在肉制品中应用的研究鲜有报道。因此本研究将红景天苷作为一种植物源抗氧化剂,研究其体外抗氧化特性,以及对猪肉糜中脂肪和蛋白质氧化的抑制作用等,旨在评估红景天苷对猪肉糜制品贮藏期间氧化特性和品质的影响,为红景天苷作为新型植物源抗氧化剂在肉制品领域的应用提供参考。
1. 材料与方法
1.1 材料与仪器
新鲜猪背最长肌 南京雨润鲜肉专卖店;红景天苷(纯度:98%)、氯化钠(NaCl)、三氯化铁(FeCl3)、醋酸钠(CH3COONa)、2,4,6-三吡啶基三嗪(TPTZ)、2,6-二叔丁基对甲酚(BHT)、硫酸亚铁(Fe2SO4)、过氧化氢(H2O2)、水杨酸(C7H6O3)、三氯乙酸(TCA)、乙二胺四乙酸(EDTA)、2-硫代巴比妥酸(TBA)、甘氨酸、尿素、5,5'-二硫代双(2-硝基苯甲酸)(DTNB)、2,4-二硝基苯肼(DNPH) 分析纯,上海麦克林生化科技股份有限公司;ABTS试剂盒 上海源叶生物科技有限公司。
SQP分析天平 赛多利斯科学仪器有限公司;M2多功能酶标仪 美国 Molecular Devices公司;TW20水浴锅 德国Julabo公司;PD500-TP匀浆机 英国PRIMA公司; Avanti J-C高速冷冻离心机 美国Beckman Coulter公司;MCR301型高级旋转流变仪 奥地利Anton Paar公司;马尔文3000激光粒度仪 英国Malvern公司。
1.2 实验方法
1.2.1 红景天苷溶液的抗氧化研究
1.2.1.1 ABTS+自由基清除能力的测定
综合考虑课题组前期相关研究、预实验结果及加入红景天苷后猪肉糜实际生产成本,选取0.2、0.4、0.6、0.8 mmol/L 4个红景天苷浓度梯度,以超纯水做溶剂,参照ABTS+试剂盒说明书测定红景天苷溶液的ABTS+自由基清除能力。选取相同浓度梯度的BHT溶液做阳性对照。
1.2.1.2 铁离子还原能力的测定(FRAP)
参考黄婷等[23]的方法并稍作修改。将TPTZ溶液(10 mmol/L)、FeCl3溶液(20 mmol/L)和醋酸钠缓冲溶液(300 mmol/L,pH3.6)这三种溶液按照体积比1:1:10的比例混合,即为FRAP工作液。将配好的FRAP工作液与红景天苷溶液(0.2、0.4、0.6、0.8 mmol/L,以超纯水为溶剂)按照体积比19:1的比例混合,在37 ℃孵育10 min后,于593 nm处测定吸光值。选取相同浓度梯度的BHT溶液做阳性对照。
1.2.2 肉糜抗氧化性能分析
1.2.2.1 样品制备
选取新鲜的猪背最长肌,去除筋膜和脂肪,切成小块,然后用绞肉机绞碎(3000 r/min,10 s),称取一定比例原料肉(60%)与配料(40%水、1.5%(w/w)NaCl、不同浓度红景天苷)混合后使用匀浆机进行均质,10000 r/min,50 s,重复两次。将匀浆后的肉糜倒入小烧杯中,封口膜封口,保证每个烧杯中肉糜质量一致(50±1 g)。肉糜在80 ℃加热30 min,冷却后置于4 ℃冰箱冷藏,分别在第 0、4、8、12 d测定各项指标。实验设计了5个处理组:第1组为空白对照组(未添加任何抗氧化剂);第2、3、4、5组分别添加0.2、0.4、0.6、0.8 mmol/L的红景天苷。
1.2.2.2 ABTS+自由基清除能力的测定
同1.2.1.1。
1.2.2.3 铁离子还原能力的测定(FRAP)
同1.2.1.2。
1.2.3 流变特性
参考罗明洋等[24]的方法并稍作修改。使用高级旋转流变仪测定样品的表观黏度变化情况。参数设置如下:剪切速率为0.01~100 s−1,实验探头P50(直径50 mm),固定间隙1 mm,25 ℃。
1.2.4 粒径分布情况
参考罗明洋等[24]的方法并稍作修改。使用激光粒度仪测定样品的粒径大小和分布情况。参数设置如下:以水作为分散介质,分散相折射率:1.33,遮光度:8%~20%,样品折射率:1.54,样品吸收率:0.001。
1.2.5 pH的测定
参照 GB 5009.237-2016《食品安全国家标准-食品pH值的测定》[25]测定猪肉糜的pH。
1.2.6 持水性的测定
称取猪肉糜质量记为m1,用滤纸包裹后放入离心管中。离心(5000 r/min,10 min,4 ℃)后除去包裹的滤纸,再次称取猪肉糜质量,记为m2。按公式(1)计算:
(1) 1.2.7 巯基含量的测定
参考Jiang等[26]的方法并稍作修改。取2 g猪肉糜(精确到0.01 g),加入10 mL Tris-甘氨酸缓冲液(pH8.5)均质(10000 r/min,30 s)两次。取0.5 mL的样品匀浆液和2.5 mL的Tris-甘氨酸-尿素缓冲液(含8 mol/L尿素,pH8.0)于10 mL离心管中混匀,再加入20 μL Ellman试剂混合均匀。所得混合液在37 ℃水浴15 min后离心(10000 r/min,10 min,4 ℃),收集上清液于412 nm处测定吸光值。以牛血清蛋白为标准,双缩脲法测定蛋白质含量。摩尔消光系数为13.6×103 L/(mol·cm)。按公式(2)计算:
(2) 式中:D为稀释倍数,C为蛋白质浓度。
1.2.8 羰基含量的测定
参考Liu等[27]的方法并稍作修改。取0.5 g(精确到0.01 g)猪肉糜,加入5 mL 0.02 mol/L PBS缓冲液均质(10000 r/min,30 s)两次。取两份3 mL匀浆液分别放于两个离心管中,加入3 mL10%的三氯乙酸,冰浴15 min后离心(5000 r/min,5 min,4 ℃),弃上清;其中一个离心管中加入3 mL 2 mol/L HCl作对照,另一个离心管中加入3 mL 0.2% DNPH(0.02 mol/L,溶于2 mol/L HCl),充分振荡混匀后在室温下避光反应1 h,每10 min振荡一次,离心(5000 r/min,10 min,4 ℃),弃上清液。沉淀用乙醇-乙酸乙酯混合溶液(1:1,v:v)洗涤3次,随后在沉淀中加入1 mL盐酸胍溶液(6 mol/L),充分振荡。最后在37 ℃孵育15 min后离心(8000 r/min,10 min,4 ℃),取上清液在370 nm处测定吸光值。以牛血清蛋白为标准,双缩脲法测定蛋白质含量。摩尔消光系数为22000 L/(mol·cm)。
1.2.9 TBARS值的测定
参考Su等[28]的方法并稍作修改。取3 g(精确到0.01 g)猪肉糜,加入15 mL 7.5%三氯乙酸(含0.1% EDTA)均质(8000 r/min,30 s)两次,离心(12000 r/min,10 min,4 ℃)。取2 mL上清液加入2 mL 0.02 mol/L TBA,90 ℃避光水浴30 min后避光冷却至室温,于532 nm处测定吸光值。
1.3 数据处理
使用SPSS 26.0(IBM公司,2019)分析数据,用 ANOVA 进行方差分析和显著性分析,处理组之间的显著性差异采用Duncan's法进行多重比较,P<0.05表示组间差异显著。每部分实验独立重复三次。数据以平均值±标准偏差表示。使用 Origin 2021(OriginLab,2021)软件进行图形绘制。
2. 结果与分析
2.1 红景天苷溶液抗氧化分析
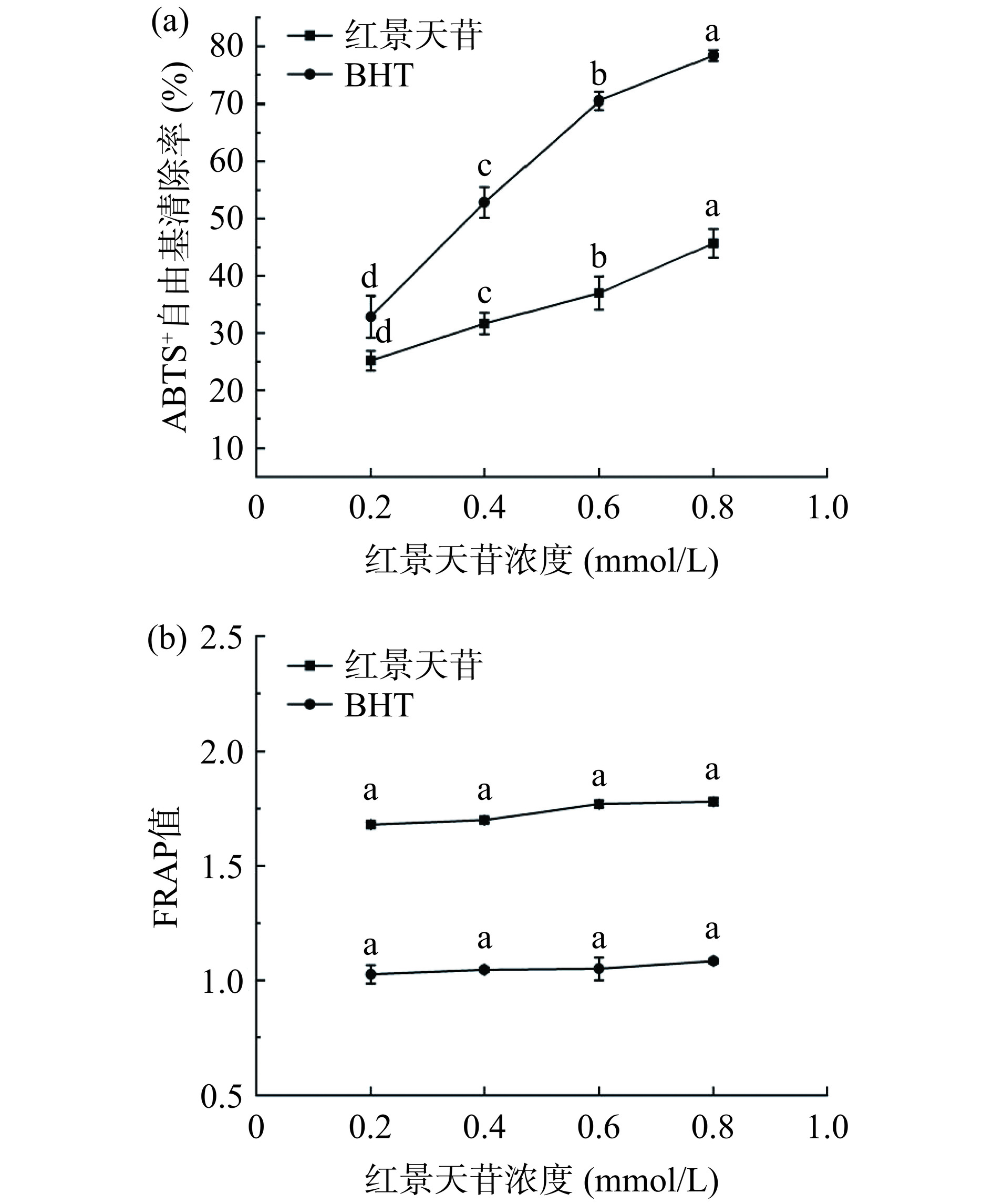
ABTS+法测定红景天苷抗氧化能力的结果如图1(a)所示。在0.2~0.8 mmol/L范围内,随着红景天苷浓度的增加,ABTS+自由基清除率呈现出增长趋势,从25.16%增长到45.69%,红景天苷浓度与ABTS+自由基清除率呈正相关。红景天苷作为一种独特的酚类化合物,具有一定的自由基清除能力,并且能够螯合Fe2+、Cu2+等金属离子,从而发挥其抗氧化作用[29]。此外,不同浓度红景天苷溶液之间的ABTS+自由基清除率差异显著(P<0.05)。但在测试浓度范围内,除0.2 mmol/L浓度外,红景天苷溶液的ABTS+自由基清除率均低于对照组BHT溶液。这也说明了,红景天苷作为一种新型的植物源抗氧化剂,其ABTS+自由基清除能力与BHT相比较弱。
![]() 图 1 红景天苷体外抗氧化活性注:(a)红景天苷的ABTS+自由基清除能力;(b)红景天苷的铁离子还原能力;“a~d”表示不同处理组之间差异显著(P<0.05),图2同。Figure 1. Antioxidant activity of salidroside in vitro
图 1 红景天苷体外抗氧化活性注:(a)红景天苷的ABTS+自由基清除能力;(b)红景天苷的铁离子还原能力;“a~d”表示不同处理组之间差异显著(P<0.05),图2同。Figure 1. Antioxidant activity of salidroside in vitroFRAP法测定红景天苷抗氧化能力的结果如图1(b)所示。在0.2~0.8 mmol/L范围内,FRAP值随着红景天苷浓度增加而增大,说明红景天苷中的抗氧化物质还原Fe3+-TPTZ产生了Fe2+-TPTZ,且还原能力随浓度增加而增大。此外,红景天苷溶液与BHT溶液的FRAP值总体上升趋势均较为平缓,红景天苷溶液在1.68~1.83范围内波动,略高于对照组BHT,说明与红景天苷相比BHT有更好的Fe3+还原能力。
2.2 猪肉糜抗氧化性能分析
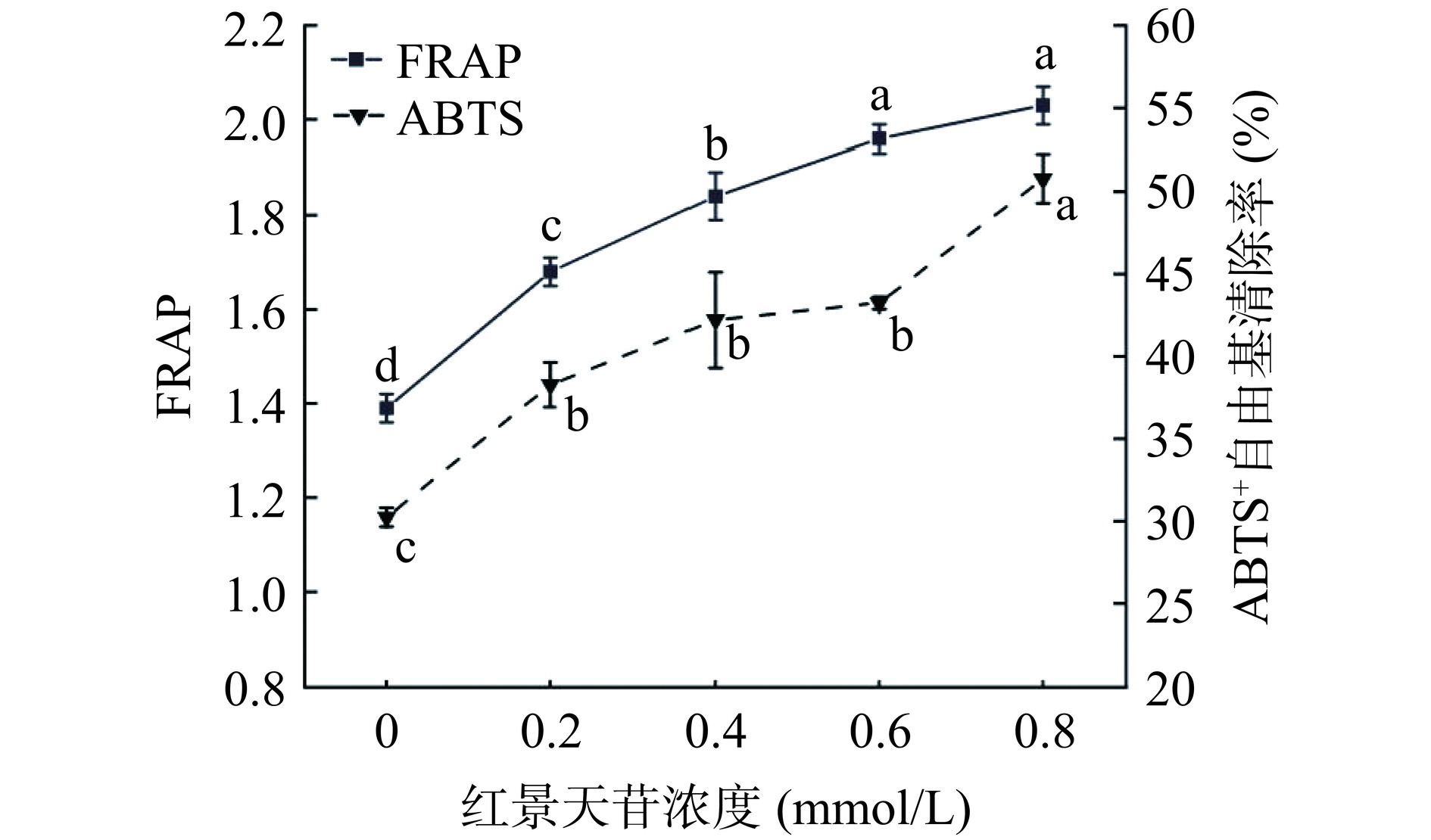
不同浓度红景天苷对猪肉糜抗氧化性能的影响如图2所示。结果表明,不添加红景天苷的对照组猪肉糜其ABTS+自由基清除能力和铁离子还原能力最弱,分别为26.24%和1.39。猪肉糜的ABTS+自由基清除能力随着红景天苷添加量的增加而增大(P<0.05),说明红景天苷浓度的增加显著提高了猪肉糜的抗氧化性。总的来看,添加了0.6 mmol/L和0.8 mmol/L红景天苷的猪肉糜相比于其他实验组呈现出更高的ABTS+自由基清除能力。另外,添加了不同浓度红景天苷猪肉糜的还原能力与其自由基清除能力的结果趋势类似,其中,添加0.8 mmol/L 红景天苷的猪肉糜还原能力最强,与空白对照组相比,0.8 mmol/L红景天苷组猪肉糜的ABTS+自由基清除率和FRAP值分别增大了67.89%和46.04%,说明红景天苷起到了较好的抗氧化作用。关于其他植物源抗氧剂在肉制品中的应用也有相似的发现,如Tamkutė等[30]研究发现蔓越莓和黑莓提取物能有效增强肉制品在口腔和胃消化阶段的抗氧化能力。
2.3 红景天苷对猪肉糜流变特性的影响
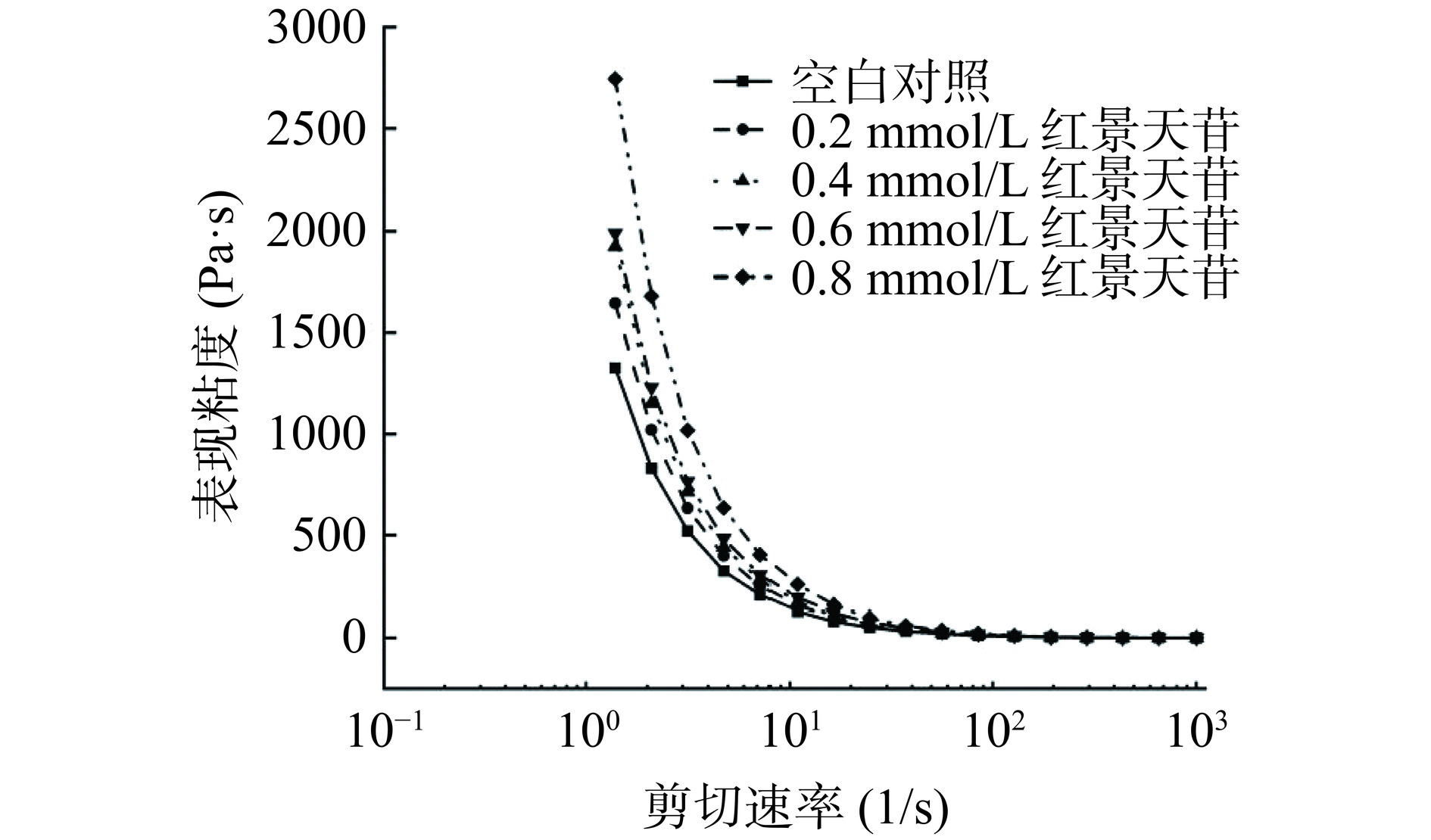
红景天苷对猪肉糜体系表观粘度的影响如图3所示。粘度反映了流体的流动内摩擦,这与蛋白质的构象和组分之间的相互作用密切相关。从图3中可以看出,在低剪切速率下,由于猪肉糜内部蛋白质等大分子物质相互缠绕,产生较大的阻力和摩擦力,各组猪肉糜均呈现出较高的表观粘度[24]。添加红景天苷后猪肉糜的表观粘度高于对照组猪肉糜,并且随着红景天苷浓度的增大,猪肉糜的表观粘度也逐渐增大,可能是由于红景天苷与肌原纤维蛋白通过共价或非共价作用改变了肌原纤维蛋白的结构,从而影响大分子物质的分布。随着剪切速率的增加,随机分布的蛋白质重新排列,最终与剪切方向一致,分子间作用力减小,从而降低了粘度[31],猪肉糜整体呈现剪切稀化的特点。并且,剪切速率在102~103 s−1范围内,各组猪肉糜表观粘度逐渐趋向一致。总体来说,加入红景天苷对猪肉糜的流变特性具有一定的改善作用。Ağar等[32]报道随着加入甜菜纤维浓度的增大,肉乳液的表观粘度也明显增大,与本研究结果一致。
2.4 粒径分布情况
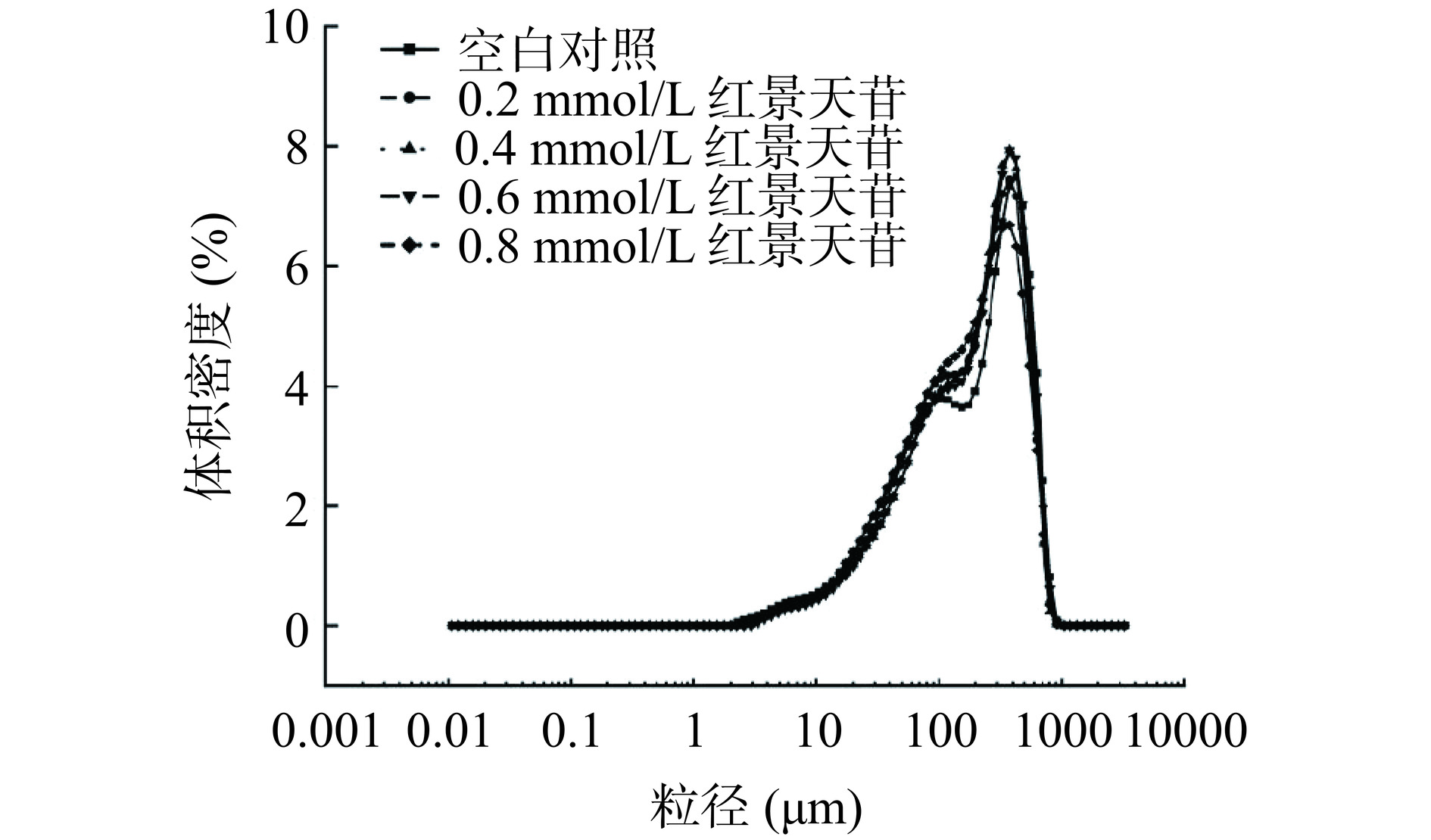
如图4所示,对照组和处理组猪肉糜的粒径分布均在1~1000 μm范围内,主要有两个峰,第1个小峰(100 μm附近)代表可溶性聚合物,第2个峰(100~1000 μm)为粒径分布的主峰。加入红景天苷后峰1分布状态发生明显变化,峰的高度增加,峰值变窄变短,同时主峰位置与对照组主峰相比轻微向左偏移,说明加入红景天苷后改变了可溶性聚合物的分布状态。如表1所示,添加红景天苷使猪肉糜的粒径参数发生了不同程度的改变。与对照组相比,当红景天苷添加量为0.4 mmol/L和0.6 mmol/L时,D3,2、D10、D50显著增加(P<0.05),可能是由于红景天苷的加入使肌原纤维蛋白发生了聚集和结构变化。与0.6 mmol/L红景天苷猪肉糜相比,当加入高浓度红景天苷(0.8 mmol/L)时,粒径参数均发生不同程度的减小,这与图4中0.8 mmol/L 红景天苷猪肉糜主峰峰值的降低相一致。Zhang等[33]研究发现加入儿茶素能够增大从肉饼中提取的肉泥的粒径,这归因于儿茶素引起的肌原纤维蛋白(MPs)聚集以及通过共价或非共价的相互作用改变肌原纤维蛋白的结构,与本研究结果相似。
表 1 不同浓度的红景天苷对猪肉糜粒径的影响Table 1. Effect of different concentrations of salidroside on the particle size of minced pork红景天苷浓度(mmol/L) D3,2 D4,3 D10 D50 D90 0 58.41±5.13c 233.47±2.44ab 26.24±2.76b 174.13±10.33c 517.33±17.26a 0.2 66.61±2.29bc 226.03±4.94b 31.8±1.54a 188.27±8.21bc 487.82±12.98b 0.4 72.98±7.03ab 237.2±8.03ab 34.09±4.11a 204.13±16.61ab 489.33±11.55b 0.6 77.82±4.19a 243.12±11.35a 35.61±1.84a 213.67±12.33a 522.3±11.05a 0.8 67.99±4.66abc 228.79±6.23ab 30.49±2.07ab 180±5.57c 504.42±9.63ab 注:数据表示为平均值±标准偏差;“a~c”表示不同处理组之间差异显著(P<0.05)。 2.5 pH的测定
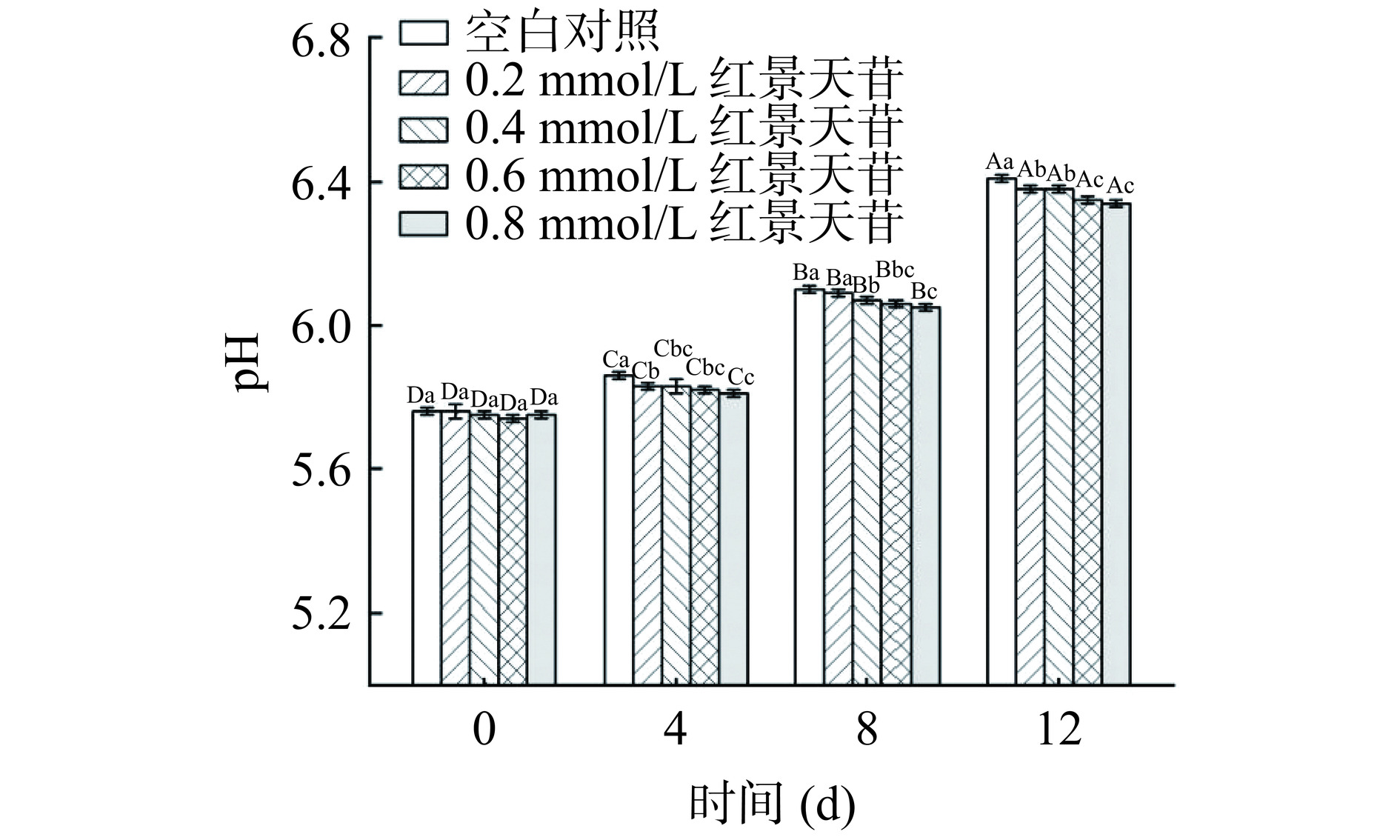
pH是评价肉类新鲜度和品质的重要指标,其对肉品的颜色、嫩度、持水性、风味以及货架期等均有不同程度的影响。如图5所示,随着贮藏时间的延长,各组pH均呈上升趋势,这是因为在贮藏过程中微生物腐败和内源性蛋白酶引起猪肉蛋白的分解,产生氨类和碱性物质[34],导致pH升高。pH6.4是肉品新鲜度的临界点,在第12 d时对照组猪肉糜的pH已超过6.4,说明猪肉糜开始变质,相比之下添加红景天苷后猪肉糜的pH增长速率下降,在第12 d时仍低于6.4。此外,在第0 d后的每个取样时间点,0.4、0.6与0.8 mmol/L红景天苷的猪肉糜处理组的pH都显著低于对照组的pH(P<0.05)。实验结果表明,红景天苷对降低贮藏过程中猪肉糜的pH具有一定的积极作用。
2.6 持水性的测定
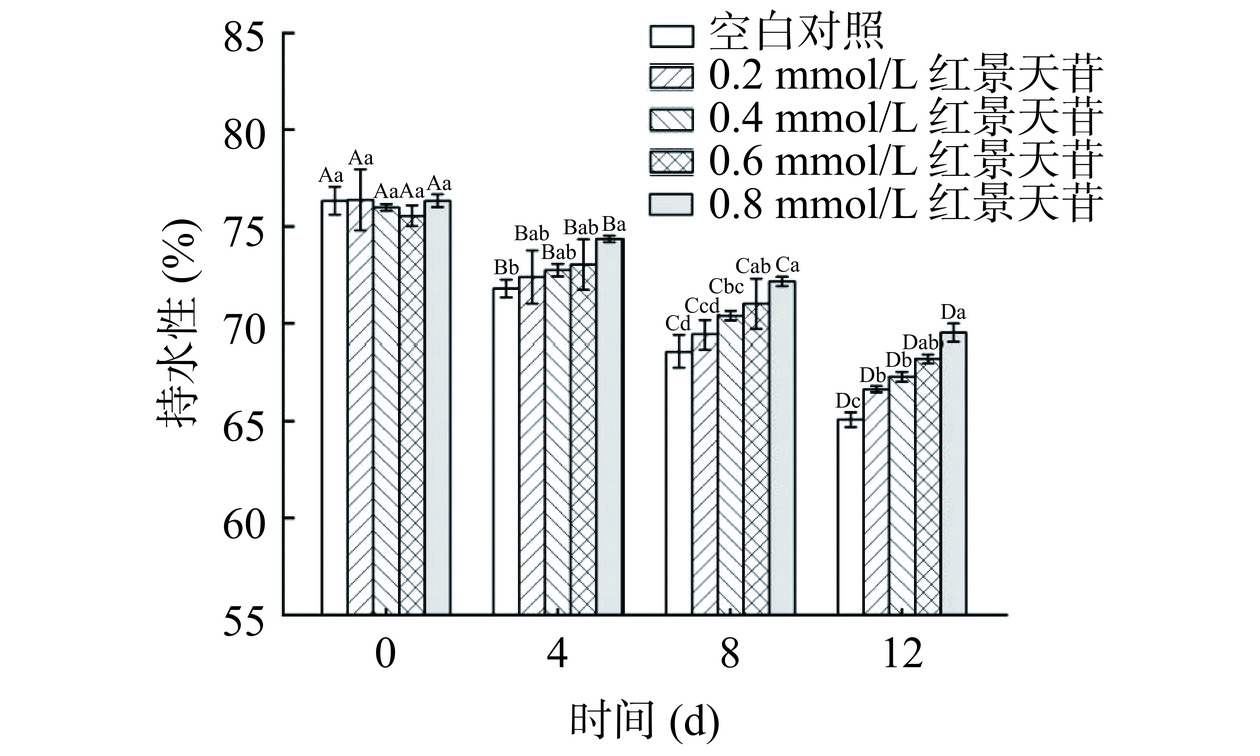
如图6所示,随着贮藏时间的延长,所有试验组猪肉糜的持水性显著下降(P<0.05),这是因为蛋白质发生变性和氧化,导致蛋白肽链骨架断裂,肌纤维间隙增大,水分发生外渗[27],从而降低了猪肉糜的持水性。保持良好的持水性对肉制品的品质十分重要,其直接影响着肉制品的口感和品质。从图中可以看出,猪肉糜的持水性随着红景天苷添加量的增加而增强,具有浓度依赖性,添加0.8 mmol/L红景天苷的猪肉糜处理组效果最佳,除第0 d外其持水性均显著高于对照组(P<0.05)。实验结果说明,加入红景天苷可以改善猪肉糜的持水性,推测与红景天苷在一定程度上延缓猪肉糜贮藏期间发生的蛋白质氧化有关。
2.7 巯基含量的测定
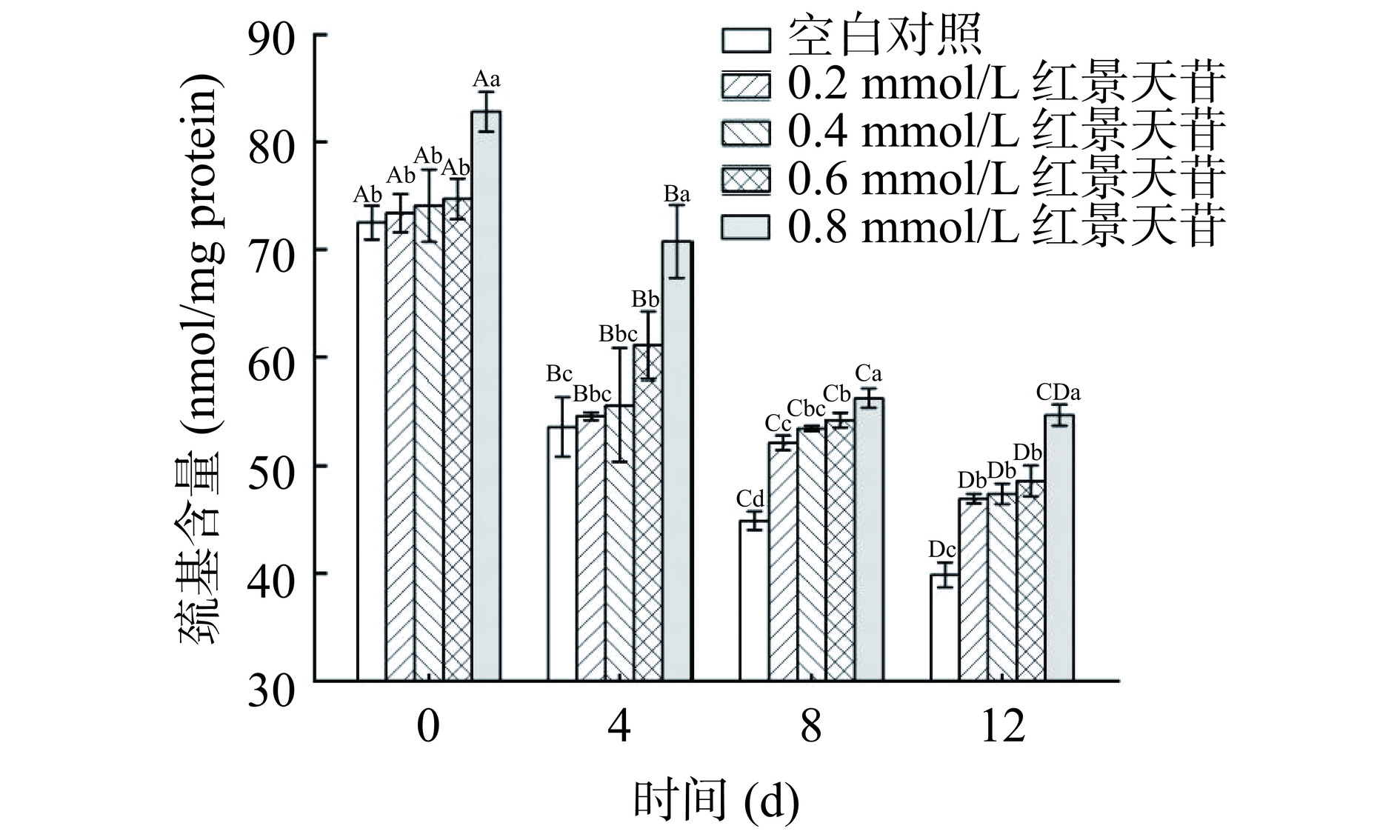
过度的蛋白质氧化会影响肉制品的营养和品质,其中,蛋白质的氧化过程也部分依赖于脂质的氧化,因为脂质氧化产生的大量自由基能够在脂质和蛋白质氧化与美拉德反应之间架起“桥梁”[5]。在氧化体系下,蛋白质中半胱氨酸残基被氧化形成二硫键,生成胱氨酸,总巯基含量下降[35],因此巯基含量常被用于表征蛋白质的氧化程度。由图7可知,在贮藏期间各组猪肉糜的巯基含量均呈下降趋势。第0 d各个实验组的巯基含量范围在72.51~82.82 nmol/mg protein,经过12 d贮藏后各实验组巯基含量范围在39.87~54.74 nmol/mg protein,说明各组猪肉糜在贮藏期间均发生了不同程度的蛋白质氧化。除第0 d外,与对照组相比,添加了红景天苷的各组猪肉糜在每个贮藏时间点的巯基含量都显著高于对照组(P<0.05),且0.8 mmol/L红景天苷添加量的猪肉糜巯基含量最高(P<0.05)。结果表明,在猪肉糜中添加红景天苷能够起到延缓蛋白质氧化的效果,随着添加量增大效果也越好。也有类似研究表明,石榴皮提取物在鱼肉糜贮藏期间能够显著减少蛋白质氧化[36];Cheng等[37]也报道了桑葚多酚显著延缓了羰基的形成和巯基向二硫键的转化。
2.8 羰基含量的测定
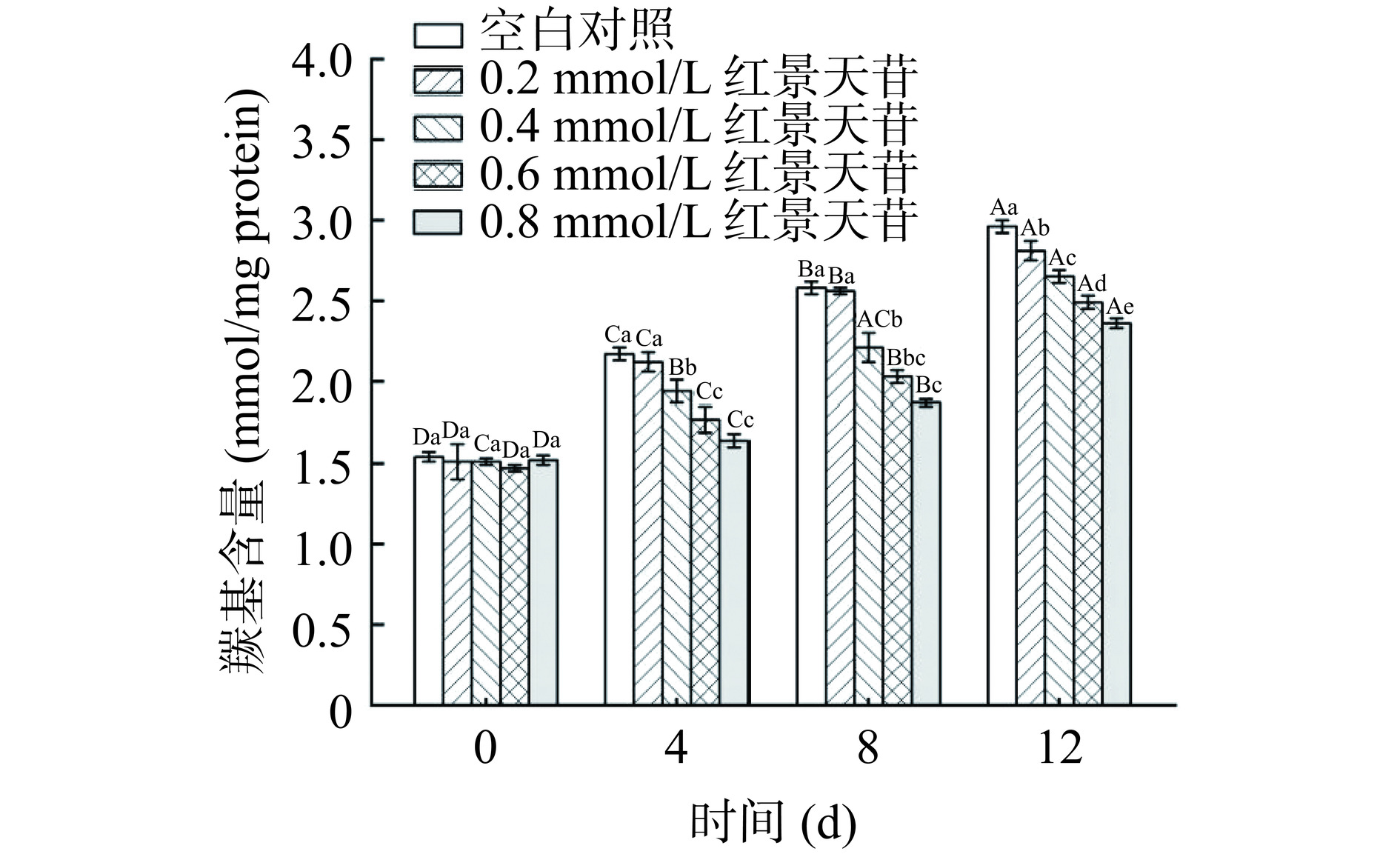
羰基化是氧化应激诱导蛋白质氧化的一个重要且不可逆的标志,可通过氨基酸侧链的直接氧化、还原糖的糖基化以及非蛋白质羰基的共价结合等发生,羰基含量常用来表征肉及肉制品的蛋白质氧化程度。由图8可知,随贮藏时间延长,猪肉糜羰基含量不断增加,蛋白质氧化程度加深。第0 d之后,加入0.4、0.6、0.8 mmol/L红景天苷组猪肉糜的羰基含量都显著低于对照组(P<0.05)。同时,红景天苷含量越高,其对蛋白质氧化的抑制作用越好,羰基形成越缓慢。第12 d时,添加0.8 mmol/L红景天苷组的羰基含量为2.36 mmol/mg protein,比对照组降低了20.27%。实验结果说明,在猪肉糜中加入红景天苷后可有效减缓羰基的形成,可能是由于SAL作为一种水溶性酚酸,具有极性基团,可能通过与蛋白质相互作用,发挥抑制氨基酸侧链氧化的作用,从而减少猪肉糜中蛋白质的氧化损伤。Jongberg等[38]也发现,在香肠中添加富含酚类化合物的绿茶或迷迭香提取物后,均可有效减少蛋白质羰基含量,与本实验结果相似。
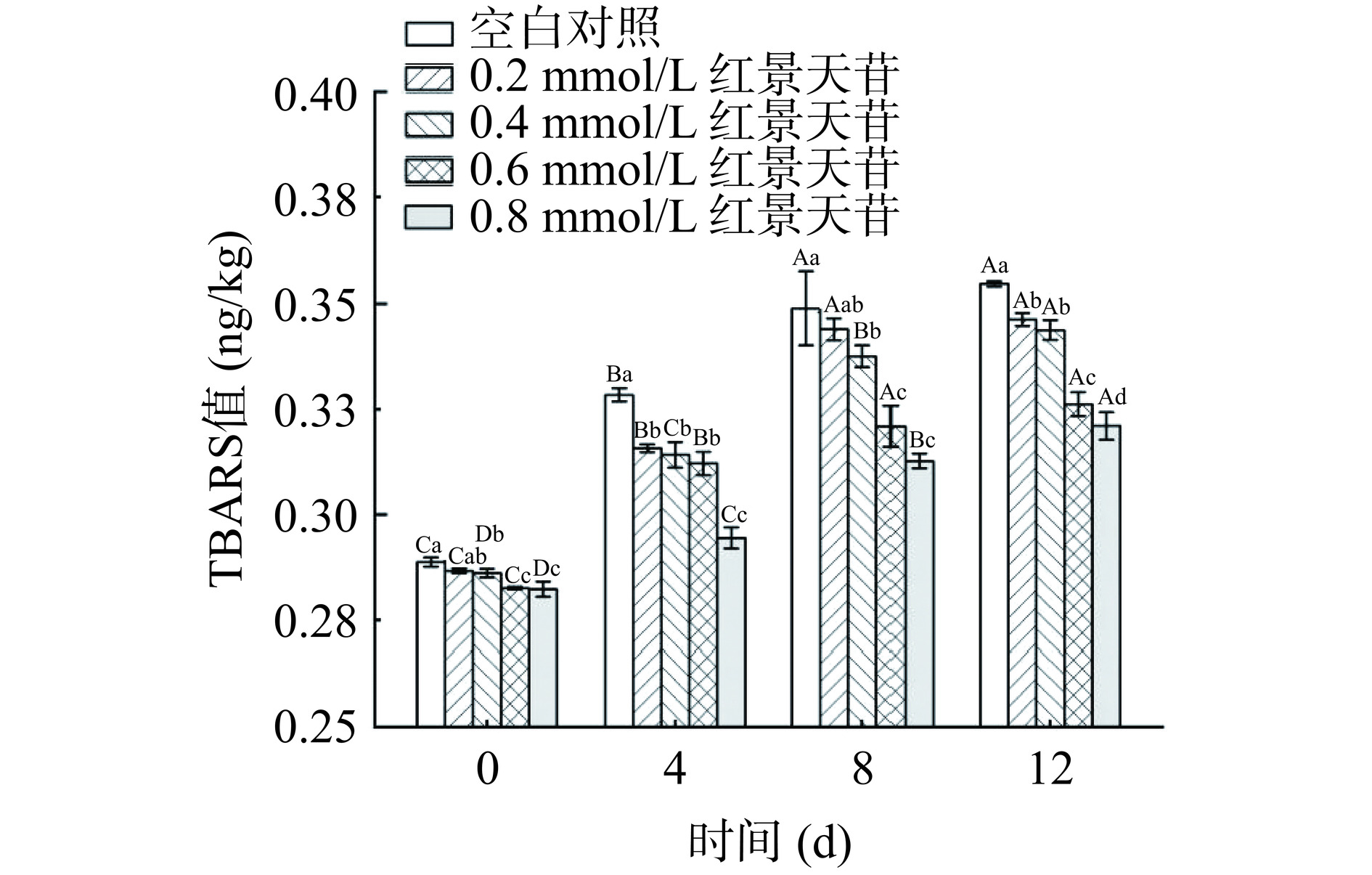
2.9 TBARS值的测定
脂肪氧化不仅会对肉的感官特性产生负面影响,还会影响肉的功能特性。丙二醛(MDA)是脂质氧化的次级产物,被认为是脂质氧化的主要标志[8]。它可以与硫代巴比妥酸发生化学反应形成有颜色的化合物,常被用来表征脂质氧化程度[39]。如图9所示,在贮藏过程中各处理组猪肉糜的TBARS值均逐步上升,表明其在贮藏期间发生了脂质氧化损伤。此外,各处理组猪肉糜的TBARS值随着SAL浓度的升高呈现逐渐下降的趋势。并且0.4、0.6和0.8 mmol/L SAL组猪肉糜的TBARS值均显著低于对照组(P<0.05),添加SAL浓度为0.8 mmol/L时TBARS值最低。通过此趋势可以说明,添加一定量的红景天苷能够对猪肉糜的脂质氧化起到一定的抑制作用,红景天苷作为一种多酚,具有自由基清除能力,能够抑制脂质氧化。许多研究表明富含多酚、黄酮等抗氧化物质的植物源提取物对抑制肉制品脂质氧化具有积极作用,例如Paglarini等[40]研究发现葡萄、迷迭香、石榴、绿茶提取物均可显著降低去骨家禽肉的TBARS值(P<0.05),与本研究结果一致。
3. 结论
通过ABTS+自由基清除实验和铁离子还原能力实验发现,红景天苷溶液具有较好的抗氧化作用,加入猪肉糜中能够增强猪肉糜的抗氧化能力,且呈浓度依赖性。红景天苷增大了猪肉糜的表观粘度,对猪肉糜的粒径分布也会产生不同程度的影响。加入红景天苷可减缓贮藏期间猪肉糜pH的升高,并且对保持猪肉糜的持水性也具有积极作用。此外,红景天苷能有效抑制猪肉糜的脂质氧化和蛋白质氧化分解,具体表现为延缓贮藏期间巯基含量的减少以及羰基含量和TBARS值的增加,其抑制效果都随红景天苷浓度增大而增强,添加浓度为0.8 mmol/L时效果最佳。综上所述,红景天苷对猪肉糜制品在贮藏期间的品质特性具有积极作用,本研究为红景天苷作为功能性成分在肉制品中的开发利用、延缓肉制品的蛋白质和脂质氧化提供了一定的理论依据,而红景天苷对于猪肉糜的口感、风味、色泽的影响以及附加健康价值还需进一步研究。
-
图 1 红景天苷体外抗氧化活性
注:(a)红景天苷的ABTS+自由基清除能力;(b)红景天苷的铁离子还原能力;“a~d”表示不同处理组之间差异显著(P<0.05),图2同。
Figure 1. Antioxidant activity of salidroside in vitro
表 1 不同浓度的红景天苷对猪肉糜粒径的影响
Table 1 Effect of different concentrations of salidroside on the particle size of minced pork
红景天苷浓度(mmol/L) D3,2 D4,3 D10 D50 D90 0 58.41±5.13c 233.47±2.44ab 26.24±2.76b 174.13±10.33c 517.33±17.26a 0.2 66.61±2.29bc 226.03±4.94b 31.8±1.54a 188.27±8.21bc 487.82±12.98b 0.4 72.98±7.03ab 237.2±8.03ab 34.09±4.11a 204.13±16.61ab 489.33±11.55b 0.6 77.82±4.19a 243.12±11.35a 35.61±1.84a 213.67±12.33a 522.3±11.05a 0.8 67.99±4.66abc 228.79±6.23ab 30.49±2.07ab 180±5.57c 504.42±9.63ab 注:数据表示为平均值±标准偏差;“a~c”表示不同处理组之间差异显著(P<0.05)。 -
[1] LI S, LI Y, WANG W, et al. Dietary habits of pastoralists on the Tibetan plateau are influenced by remoteness and economic status[J]. Food Research International,2023,174:113627. doi: 10.1016/j.foodres.2023.113627
[2] 高利伟, 徐增让, 成升魁, 等. 西藏农村居民食物消费结构及膳食营养特征分析[J]. 资源科学,2017,39(1):168−174. [GAO Liwei, XU Zengrang, CHENG Shengkui, et al. Food consumption structure and dietary nutrition of residents in rural Tibet[J]. Resources Science,2017,39(1):168−174.] GAO Liwei, XU Zengrang, CHENG Shengkui, et al. Food consumption structure and dietary nutrition of residents in rural Tibet[J]. Resources Science, 2017, 39(1): 168−174.
[3] ECHEGARAY N, PATEIRO M, MUNEKATA P E S, et al. Measurement of antioxidant capacity of meat and meat products:Methods and applications[J]. Molecules (Basel, Switzerland),2021,26(13):3880. doi: 10.3390/molecules26133880
[4] HUANG X, AHN D U. Lipid oxidation and its implications to meat quality and human health[J]. Food Science and Biotechnology,2019,28(5):1275−1285. doi: 10.1007/s10068-019-00631-7
[5] NAWAZ A, IRSHAD S, ALI KHAN I, et al. Protein oxidation in muscle-based products:Effects on physicochemical properties, quality concerns, and challenges to food industry[J]. Food Research International,2022,157:111322. doi: 10.1016/j.foodres.2022.111322
[6] PURRIÑOS L, BERMÚDEZ R, FRANCO D, et al. Development of volatile compounds during the manufacture of dry-cured “lacón, ” a Spanish traditional meat product[J]. Journal of Food Science, 2011, 76(1):C89-97.
[7] MUKUMBO F E, DESCALZO A, COLLIGNAN A, et al. Effect of Moringa oleifera leaf powder on drying kinetics, physico-chemical properties, ferric reducing antioxidant power, α-tocopherol, β-carotene, and lipid oxidation of dry pork sausages during processing and storage[J]. Journal of Food Processing and Preservation,2020,44:e14300.
[8] DOMÍNGUEZ R, PATEIRO M, GAGAOUA M, et al. A comprehensive review on lipid oxidation in meat and meat products[J]. Antioxidants (Basel, Switzerland),2019,8(10):429. doi: 10.3390/antiox8100429
[9] WANG Z F, HE Z F, ZHANG D, et al. Antioxidant activity of purslane extract and its inhibitory effect on the lipid and protein oxidation of rabbit meat patties during chilled storage[J]. Journal of the Science of Food and Agriculture,2021,101(5):1953−1962. doi: 10.1002/jsfa.10811
[10] ZAMUZ S, LÓPEZ-PEDROUSO M, BARBA F J, et al. Application of hull, bur and leaf chestnut extracts on the shelf-life of beef patties stored under MAP:Evaluation of their impact on physicochemical properties, lipid oxidation, antioxidant, and antimicrobial potential[J]. Food Research International (Ottawa, Ont.),2018,112:263−273. doi: 10.1016/j.foodres.2018.06.053
[11] LORENZO J M, PATEIRO M, DOMÍNGUEZ R, et al. Berries extracts as natural antioxidants in meat products:A review[J]. Food Research International (Ottawa, Ont.),2018,106:1095−1104. doi: 10.1016/j.foodres.2017.12.005
[12] ŠOJIĆ B, MILOŠEVIĆ S, SAVANOVIĆ D, et al. Isolation, bioactive potential, and application of essential oils and terpenoid-rich extracts as effective antioxidant and antimicrobial agents in meat and meat products[J]. Molecules (Basel, Switzerland),2023,28(5):2293. doi: 10.3390/molecules28052293
[13] AZIZ M, KARBOUNE S. Natural antimicrobial/antioxidant agents in meat and poultry products as well as fruits and vegetables:A review[J]. Critical Reviews in Food Science and Nutrition,2018,58(3):486−511.
[14] MUNEKATA P E S, ROCCHETTI G, PATEIRO M, et al. Addition of plant extracts to meat and meat products to extend shelf-life and health-promoting attributes:An overview[J]. Current Opinion in Food Science,2020,31:81−87. doi: 10.1016/j.cofs.2020.03.003
[15] CHIANG H M, CHEN H C, WU C S, et al. Rhodiola plants:Chemistry and biological activity[J]. Journal of Food and Drug Analysis,2015,23(3):359−369. doi: 10.1016/j.jfda.2015.04.007
[16] DU Y, CHEN Z X, LIANG F, et al. Effects of salidroside on functional and structural changes in highland barley proteins[J]. LWT,2022,160:113310. doi: 10.1016/j.lwt.2022.113310
[17] SONG D, ZHAO M, FENG L X, et al. Salidroside attenuates acute lung injury via inhibition of inflammatory cytokine production[J]. Biomedicine & Pharmacotherapy=Biomedecine & Pharmacotherapie,2021,142:111949.
[18] ZHONG Z F, HAN J, ZHANG J Z, et al. Pharmacological activities, mechanisms of action, and safety of salidroside in the central nervous system[J]. Drug Design, Development and Therapy,2018,12:1479−1489. doi: 10.2147/DDDT.S160776
[19] ZHANG X M, XIE L, LONG J Y, et al. Salidroside:A review of its recent advances in synthetic pathways and pharmacological properties[J]. Chemico-Biological Interactions,2021,339:109268. doi: 10.1016/j.cbi.2020.109268
[20] JI R, JIA F Y, CHEN X, et al. Salidroside alleviates oxidative stress and apoptosis via AMPK/Nrf2 pathway in DHT-induced human granulosa cell line KGN[J]. Archives of Biochemistry and Biophysics,2022,715:109094. doi: 10.1016/j.abb.2021.109094
[21] LIANG Q, GUO R, TSAO J R, et al. Salidroside alleviates oxidative stress in dry eye disease by activating autophagy through AMPK-Sirt1 pathway[J]. International Immunopharmacology,2023,121:110397. doi: 10.1016/j.intimp.2023.110397
[22] QI S S, SHAO M L, ZE S, et al. Salidroside from Rhodiola rosea L. attenuates diabetic nephropathy in STZ induced diabetic rats via anti-oxidative stress, anti-inflammation, and inhibiting TGF-β1/Smad pathway[J]. Journal of Functional Foods,2021,77:104329. doi: 10.1016/j.jff.2020.104329
[23] 黄婷, 周璐, 梅婵, 等. 枸杞中原花青素和总黄酮的抗氧化活性研究[J]. 生物化工,2020,6(1):72−75. [HUANG Ting, ZHOU Lu, MEI Chan, et al. Study on antioxidiant activity of proanthocyanidin and total flavones in wolfberry[J]. Biological Chemical Engineering,2020,6(1):72−75.] doi: 10.3969/j.issn.2096-0387.2020.01.020 HUANG Ting, ZHOU Lu, MEI Chan, et al. Study on antioxidiant activity of proanthocyanidin and total flavones in wolfberry[J]. Biological Chemical Engineering, 2020, 6(1): 72−75. doi: 10.3969/j.issn.2096-0387.2020.01.020
[24] 罗明洋, 吴菊清, 粘颖群, 等. 不同种类原料肉对婴幼儿肉泥理化性质和体外消化特性的影响[J]. 食品科学,2021,42(21):105−110. [LUO Mingyang, WU Juqing, NIAN Yingqun, et al. Physicochemical properties and in vitro digestion properties of infant puree made from different species of raw meat[J]. Food Science,2021,42(21):105−110.] doi: 10.7506/spkx1002-6630-20201008-035 LUO Mingyang, WU Juqing, NIAN Yingqun, et al. Physicochemical properties and in vitro digestion properties of infant puree made from different species of raw meat[J]. Food Science, 2021, 42(21): 105−110. doi: 10.7506/spkx1002-6630-20201008-035
[25] 国家卫生和计划生育委员会. 食品安全国家标准 食品pH值的测定:GB5009.237-2016[S]. 北京:中国标准出版社, 2016:1−3. [National Health and Family Planning Commission of the People's Republic of China. National standards for food safety Determination of food pH:GB 5009.237-2016[S]. Beijing:Standards Press of China, 2016:1−3.] National Health and Family Planning Commission of the People's Republic of China. National standards for food safety Determination of food pH: GB 5009.237-2016[S]. Beijing: Standards Press of China, 2016: 1−3.
[26] JIANG S, ZHAO D, NIAN Y, et al. Ultrasonic treatment increased functional properties and in vitro digestion of actomyosin complex during meat storage[J]. Food Chemistry,2021,352:129398. doi: 10.1016/j.foodchem.2021.129398
[27] LIU Y Y, ZHANG L T, GAO S, et al. Effect of protein oxidation in meat and exudates on the water holding capacity in bighead carp (Hypophthalmichthys nobilis) subjected to frozen storage[J]. Food Chemistry,2022,370:131079. doi: 10.1016/j.foodchem.2021.131079
[28] SU L Y, ZHAO Z R, XIA J L, et al. Protecting meat color:The interplay of betanin red and myoglobin through antioxidation and coloration[J]. Food Chemistry,2024,442:138410. doi: 10.1016/j.foodchem.2024.138410
[29] 张嵘, 相启森, 王利敏, 等. 植物多酚在肉及肉制品中的应用研究进展[J]. 中国调味品,2021,46(10):183−187. [ZHANG Rong, XIANG Qisen, WANG Limin, et al. Research progress on application of plant polyphenols in meat and meat products[J]. China Condiment,2021,46(10):183−187.] doi: 10.3969/j.issn.1000-9973.2021.10.036 ZHANG Rong, XIANG Qisen, WANG Limin, et al. Research progress on application of plant polyphenols in meat and meat products[J]. China Condiment, 2021, 46(10): 183−187. doi: 10.3969/j.issn.1000-9973.2021.10.036
[30] TAMKUTĖ L, JANČIUKĖ G, PUKALSKIENĖ M, et al. Cranberry and black chokeberry extracts isolated with pressurized ethanol from defatted by supercritical CO2 pomace inhibit colorectal carcinoma cells and increase global antioxidant response of meat products during in vitro digestion[J]. Food Research International,2022,161:111803. doi: 10.1016/j.foodres.2022.111803
[31] ZHAO X, ZHOU C, XU X L, et al. Ultrasound combined with carrageenan and curdlan addition improved the gelation properties of low-salt chicken meat paste[J]. LWT,2022,172:114230. doi: 10.1016/j.lwt.2022.114230
[32] AĞAR B, GENÇCELEP H, SARICAOĞLU F T, et al. Effect of sugar beet fiber concentrations on rheological properties of meat emulsions and their correlation with texture profile analysis[J]. Food and Bioproducts Processing,2016,100:118−131. doi: 10.1016/j.fbp.2016.06.015
[33] ZHANG G Y, BI X X, LI L L, et al. Catechins affect the oil-holding capacity of meat batters by changing the structure and emulsifying properties of surface proteins at the fat globules[J]. International Journal of Biological Macromolecules,2023,252:126474. doi: 10.1016/j.ijbiomac.2023.126474
[34] FANG Z X, LIN D, WARNER R D, et al. Effect of gallic acid/chitosan coating on fresh pork quality in modified atmosphere packaging[J]. Food Chemistry,2018,260:90−96. doi: 10.1016/j.foodchem.2018.04.005
[35] MCKERCHAR H J, CLERENS S, DOBSON R C J, et al. Protein-protein crosslinking in food:Proteomic characterisation methods, consequences and applications[J]. Trends in Food Science & Technology,2019,86:217−229.
[36] ÖZALP ÖZEN B, SOYER A. Effect of plant extracts on lipid and protein oxidation of mackerel (Scomber scombrus) mince during frozen storage[J]. Journal of Food Science and Technology,2018,55(1):120−127. doi: 10.1007/s13197-017-2847-6
[37] CHENG J R, XU L, XIANG R, et al. Effects of mulberry polyphenols on oxidation stability of sarcoplasmic and myofibrillar proteins in dried minced pork slices during processing and storage[J]. Meat Science,2020,160:107973. doi: 10.1016/j.meatsci.2019.107973
[38] JONGBERG S, TØRNGREN M A, GUNVIG A, et al. Effect of green tea or rosemary extract on protein oxidation in Bologna type sausages prepared from oxidatively stressed pork[J]. Meat Science,2013,93(3):538−546. doi: 10.1016/j.meatsci.2012.11.005
[39] ABEYRATHNE E D N S, NAM K, AHN D U. Analytical Methods for Lipid Oxidation and Antioxidant Capacity in Food Systems[J]. Antioxidants (Basel, Switzerland),2021,10(10):1587. doi: 10.3390/antiox10101587
[40] PAGLARINI C S, VIDAL V A S, NERI-NUMA I A, et al. Effect of commercial plant extracts on the oxidative stability of mechanically deboned poultry meat during chilled storage[J]. Food Research International,2023,164:112358. doi: 10.1016/j.foodres.2022.112358





 下载:
下载:
 下载:
下载:
