Antioxidant Properties and Environmental Stability of Curcumin-Loaded Zein-Tea Saponin Nanoparticles
-
摘要: 通过反溶剂共沉淀法制备负载姜黄素的玉米醇溶蛋白-茶皂素(Zein-TS-Cur)复合纳米颗粒,并测定其包埋率与负载量、荧光强度、粒径、PDI、Zeta-电位、抗氧化特性和贮藏稳定性,筛选出性能最优的制备比例,并对其环境稳定性进行探究。研究发现,与单一玉米醇溶蛋白包埋姜黄素相比,在玉米醇溶蛋白与茶皂素的比例为1:2时所制备的纳米颗粒对姜黄素包埋率最高,达到96.02%,荧光强度较强,达到4663,DPPH自由基清除率达到94.14%,总抗氧化能力为40.33%。在贮藏过程中,以及不同pH、不同离子强度和不同温度条件下,纳米颗粒受环境应力影响较小。由此表明,加入茶皂素的纳米颗粒具有更好的稳定性,显著提高了负载姜黄素纳米颗粒的包埋率、不同环境条件下的稳定性及抗氧化活性。本研究结果有利于为构建高效稳定的递送体系提供指导,以提高姜黄素等疏水生物活性物质在医药、食品等工业领域的应用。Abstract: The curcumin-loaded zein-tea saponin (Zein-TS-Cur) nanoparticles were prepared using the antisolvent co-precipitation method, and the encapsulation efficiency, loading capacity, fluorescence intensity, particle size, PDI, Zeta-potential, antioxidant properties, and storage stability of the composite nanoparticles were determined to screened for the optimal preparation ratio,and to investigate their environmental stability. It was found that compared with individual zein nanoparticles, the nanoparticles prepared at the ratio of zein to tea saponin (TS) of 1:2 had the highest encapsulation efficiency of 96.02%, stronger fluorescence intensity of 4663, higher DPPH radical scavenging activity of 94.14%, and greater total antioxidant activity of 40.33%. The nanoparticles remained stable during storage, as well as under different pH, ionic strength, and temperature conditions, indicating that the nanoparticles were less affected by environmental conditions. It was shown that the nanoparticles with the addition of TS had better stability, which significantly improved the encapsulation efficiency, stability under different environmental conditions and antioxidant activity of the curcumin (Cur)-loaded nanoparticles. The results of this study are useful in providing guidance for the construction of efficient and stable delivery systems to improve the application of hydrophobic bioactives such as curcumin in pharmaceutical, food, and other industrial fields.
-
Keywords:
- zein /
- tea saponin /
- curcumin /
- antioxidant activity
-
姜黄素作为一类二酮类化合物,是一种能够在抗炎、抗氧化、抗肿瘤、降血脂和抑制神经退行性疾病等方面起到一定作用的生物活性物质[1]。但姜黄素自身存在水溶性差,对光、热不稳定和生物利用度低等问题,极大限制了其在功能食品中的应用[2]。经研究发现,姜黄素能够由食品级蛋白质所构建的纳米颗粒更加稳定地进行递送,且递送后的姜黄素稳定性、吸收消化率、抗氧化活性都有所提高[3−4]。也有研究证实,通过构建姜黄素递送系统可以有效提高姜黄素的水溶性和生物活性[5−6]。因此,为了克服姜黄素存在的缺点,需要进一步研究能够稳定递送姜黄素的复合纳米颗粒系统,使其价值得到充分利用。
玉米醇溶蛋白作为一种从玉米种子中提取得到的食品级天然蛋白,超过50%的氨基酸残基是疏水性的,不溶于水,溶于乙醇,具有优良的生物相容性。将玉米醇溶蛋白溶解于55%~90%乙醇水溶液(v/v)中,再将玉米醇溶蛋白乙醇水溶液添加到去离子水中,由于玉米醇溶蛋白具有较强的疏水性,当体系中乙醇浓度降低时,玉米醇溶蛋白溶解度随之降低,从而发生聚集,形成玉米醇溶蛋白纳米颗粒[7]。由玉米醇溶蛋白所构成的纳米颗粒,有较好的成膜性、抗水性、生物降解性和生物相容性等。但是,仍存在单一玉米醇溶蛋白纳米颗粒对功能因子的包埋率低、稳定性差和溶解度低等问题,已有研究表明,可以通过多糖、蛋白质等分子对玉米醇溶蛋白纳米颗粒进行修饰,提高其稳定性[8−9]。可将玉米醇溶蛋白与多糖、蛋白质或小分子乳化剂通过反溶剂共沉淀法制备复合胶体颗粒,提高纳米颗粒的稳定性。根据邓卓丹等[10]的研究,玉米醇溶蛋白与卵磷脂质量比为1:2的纳米颗粒总抗氧化能力约为单一玉米醇溶蛋白纳米颗粒的3倍。茶皂素,分别由皂苷元、糖苷和有机酸三部分组成,作为油茶壳中主要的活性成分之一,具有强发泡、乳化、分散、润湿等功能特性[11],能够作为性能优良的植物源表面活性剂使用,且茶皂素具有抗炎、抗菌、保护肠胃等健康益处[12−13]。Ma等[14]通过在玉米醇溶蛋白体系中加入茶皂素的方式,改变玉米醇溶蛋白的二级结构,提高其离子稳定性,为递送姜黄素提供了方向。因此,可以利用玉米醇溶蛋白与茶皂素制备负载姜黄素的复合纳米颗粒,从而进一步提高姜黄素的稳定性和抗氧化性。
本实验通过反溶剂共沉淀法制备负载姜黄素的玉米醇溶蛋白-茶皂素复合纳米颗粒,并通过紫外分光光度计、荧光分光光度计和纳米粒度及Zeta-电位分析仪等对其结构和理化性质进行表征,探究姜黄素、玉米醇溶蛋白和茶皂素之间的相互作用,寻找玉米醇溶蛋白与茶皂素的最佳比例获得性能最优的纳米颗粒。此外,还测定复合纳米颗粒的抗氧化能力、贮藏稳定性,以及pH、离子强度和温度对此复合纳米颗粒的影响,为提高姜黄素的稳定性以及复合纳米颗粒的抗氧化活性提供了指导。
1. 材料与方法
1.1 材料与仪器
姜黄素(纯度90%) 天津光复精细化工研究所;玉米醇溶蛋白 Sigma-Aldrich(St.Louis,MO,USA);茶皂素(纯度≥90%) 湖南汉清生物科技有限公司;无水乙醇 烟台三和精细化工有限公司;2,2-联苯基-1-苦基肼基(DPPH) 上海麦克林生化科技有限公司;总抗氧化能力(TAOC)测定试剂盒(货号A 015-1) 南京建成生物试剂研究所;其他试剂均为分析级试剂。
H3-16KR高速冷冻离心机 湖南可成仪器设备有限公司;UV-5100B紫外分光光度计 上海元析仪器有限公司;F-2700荧光分光光度计 日本日立公司;NANO ZS 90纳米粒度及Zeta-电位分析仪 英国Malvern公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 复合纳米颗粒的制备方法
根据Liu等[15]的方法并进行部分修改,利用反溶剂共沉淀法进行制备。将玉米醇溶蛋白溶解在70%乙醇中,浓度为2%,在室温下磁力搅拌600 r/min,搅拌过夜。将Zein:TS分别以1:0、10:1、5:1、3:1、2:1、1:1、2:3、1:2的比例将茶皂素添加到玉米醇溶蛋白溶液中,600 r/min搅拌2 h。将2 mg/mL的姜黄素溶解在70%乙醇中,600 r/min搅拌1 h至姜黄素完全溶解。玉米醇溶蛋白-茶皂素与等体积的姜黄素混合,600 r/min搅拌2 h。量取20 mL的Zein-TS-Cur混合溶液,使用注射器缓慢注入到60 mL去离子水中,然后以600 r/min搅拌30 min,以形成纳米颗粒分散体。将分散体的pH调至4.0。在1500×g下离心20 min,收集上清液。
1.2.2 筛选制备复合纳米颗粒的最优比例
测定不同比例复合纳米颗粒的包埋率和负载量、荧光强度、粒径、PDI、Zeta-电位、抗氧化特性和贮藏稳定性,综合比较得出性能最优、最稳定的复合纳米颗粒的制备比例,以进行后续不同环境应力对其稳定性影响的测定。
1.2.2.1 包埋率和负载量测定
根据Ma等[14]的方法并进行部分调整测定复合纳米颗粒的包埋率与负载量。将分散体系与80%的乙醇混合,分散体系与乙醇的体积比为1:9(v/v),涡旋90 s使复合纳米颗粒破碎以释放出包埋的姜黄素,用80%乙醇溶液将此分散液稀释到合适的浓度,测定在合适范围的吸光度值,用紫外可见分光光度计记录了溶液在419 nm波长处的吸光度,绘制浓度标准曲线方程:A=0.1445C−0.0073,R2=0.9994,根据Dai等[16]的方法使用以下公式计算包埋率(EE)和负载量(LC)
EE(%)=包埋姜黄素的质量(mg)总姜黄素添加量(mg)×100 (1) LC(%)=包埋姜黄素的质量(mg)玉米醇溶蛋白和茶皂素的总添加量(mg)×100 (2) 1.2.2.2 荧光光谱
利用荧光光谱技术研究了姜黄素与玉米醇溶蛋白和茶皂素间的相互作用,参照Joye等[17]的方法略微改进,测定了复合纳米颗粒的荧光光谱。复合纳米颗粒分散体用去离子水(pH4.0)稀释至玉米醇溶蛋白浓度为0.1 mg/mL。将发射光谱范围设置为450~700 nm,激发波长设置为420 nm。激发和发射狭缝设置为10 nm,扫描速度设置为300 nm/min。
1.2.2.3 粒径、PDI、Zeta-电位测定
使用pH4.0的水将Zein-TS-Cur复合纳米颗粒稀释5倍,以减少多重散射效应,并降低pH对测定的影响,采用纳米粒度及Zeta电位分析仪在25 ℃下测量纳米颗粒的平均粒径、PDI和Zeta-电位。
1.2.2.4 抗氧化特性
1.2.2.4.1 DPPH自由基清除活性
根据邓卓丹等[10]的方法并进一步调整,将0.002 g的DPPH粉末溶于25 mL无水甲醇中,然后以此溶液与复合纳米颗粒以体积比为4:1的比例加入避光具塞试管中,将混合溶液充分混匀后于30 ℃水浴锅中恒温避光加热处理45 min,以甲醇为对照组,VC作为标准对照,在吸收波长为517 nm处测得样品DPPH的自由基清除能力,使用以下公式计算:
DPPH自由基清除能力(%)=A0−A1A0×100 (3) 式中:A0表示对照组甲醇的吸光值;A1表示样品的吸光值。
1.2.2.4.2 总抗氧化能力
根据总抗氧化能力(TAOC)测定试剂盒操作步骤进行操作,以蒸馏水调零,VC作为标准对照,在520 nm处测定各管的吸光值,使用以下公式计算:
总抗氧化能力(%)=A测定−A对照0.01T×V总体积V取样量×N (4) 式中:T表示反应时间30 min;N表示样品测试前稀释倍数,其余指标根据试剂盒操作获得。
1.2.2.5 贮藏稳定性
将复合纳米颗粒分散体置于透明玻璃瓶中,加入叠氮化钠(0.02wt%)以抑制微生物生长,从而评估其贮藏稳定性。将小瓶置于37 ℃的培养箱中30 d,分别在贮藏3、7、15和30 d时按照1.2.2.3节的方法测定复合纳米颗粒分散体的粒径、PDI和Zeta-电位。
1.2.3 环境应力对复合纳米颗粒稳定性的影响
将筛选得出最优比例所制备的复合纳米颗粒于不同环境条件下处理后测定其粒径、PDI和Zeta-电位,并对其稳定性进行分析。
1.2.3.1 pH
根据Hu等[18]的方法,研究pH对胶体颗粒分散液稳定性的影响。采用0.1 mol/L的NaOH或HCl将胶体颗粒分散液调节至不同pH(2、3、4、5、6、7、8、9),测定样品的粒径、PDI和电位。
1.2.3.2 离子强度
根据Chen等[19]的方法,评价离子强度(NaCl)对复合胶体颗粒稳定性的影响。将复合胶体颗粒分散液与不同浓度的NaCl等体积的混合,用0.1 mol/L的NaOH或者HCl调整pH至4.0,最终样品中的NaCl浓度分别为0、25、50、100、200、300 mmol/L。
1.2.3.3 温度
参照Hu等[20]的方法将复合胶体颗粒分散液分别在50、60、70、80、90 ℃的水浴锅中加热30 min,冷却至室温(25 ℃),测定复合颗粒的粒径、PDI和Zeta-电位。
1.3 数据处理
所有试验设定平行组,重复测定至少两次,采用Origin 2022软件对试验数据进行分析与绘图,运用IBM SPSS 27统计软件对数据进行单因素方差分析(ANOVA),采用Duncan法进行多组样本间差异显著性分析,显著水平为P<0.05。
2. 结果与分析
2.1 筛选制备复合纳米颗粒的最优比例
2.1.1 姜黄素的包埋率与负载量
由图1可以看出,单一Zein纳米颗粒包埋率及负载量较低,添加茶皂素后,包埋率和负载量整体高于未添加茶皂素的纳米颗粒,这说明茶皂素与玉米醇溶蛋白的相互作用提高了姜黄素的包埋率。玉米醇溶蛋白与茶皂素质量比为2:1至1:2范围内,包埋率增大,并在质量比为1:2时包埋率最高,达到96.02%,包埋效果最好。Zein:TS为3:1和2:1时包埋率最低,可能是因为此时玉米醇溶蛋白和茶皂素的比例导致静电荷接近0,静电相互作用消失,从而发生了沉淀,姜黄素析出,包埋率与负载量降低。综合比较,在较高的姜黄素浓度下,添加茶皂素制备的复合纳米颗粒包埋效果远超单一玉米醇溶蛋白所制备的纳米颗粒,其中玉米醇溶蛋白与茶皂素质量比为1:2时所制备的复合纳米颗粒包埋效果最好。这可能是因为玉米醇溶蛋白和茶皂素对姜黄素的包埋存在协同作用,茶皂素可促使吸附在玉米醇溶蛋白表面或游离的姜黄素包裹在复合胶体颗粒中,提高包埋率和负载量[15],而负载量整体呈下降趋势是因为在姜黄素含量相同的情况下,复合纳米颗粒的总量越大,负载量越小。
2.1.2 荧光光谱
运用荧光光谱法研究了玉米醇溶蛋白、姜黄素和茶皂素间的相互作用,蛋白质具有内源性荧光,主要来源于酪氨酸(Tyr)、色氨酸(Trp)和苯丙氨酸(Phe)残基,这些氨基酸对局部环境变化较为敏感,因此与其他组分相互作用时会导致其荧光强度发生变化[21]。从图2可以看出,当姜黄素被包埋在玉米醇溶蛋白复合纳米颗粒后,姜黄素的最大峰随着玉米醇溶蛋白与茶皂素比例的不同发生了不同程度的蓝移,玉米醇溶蛋白与茶皂素质量比为1:2时荧光强度最强,2:3、1:1强度也较强。这一结果可能是由于添加比例为1:2的复合纳米颗粒使玉米醇溶蛋白分子表面的疏水区域与姜黄素结合,导致其荧光信号发生变化[22],并且由图1可知,该比例的样品对姜黄素的包埋率最高,因此蓝移程度更强。
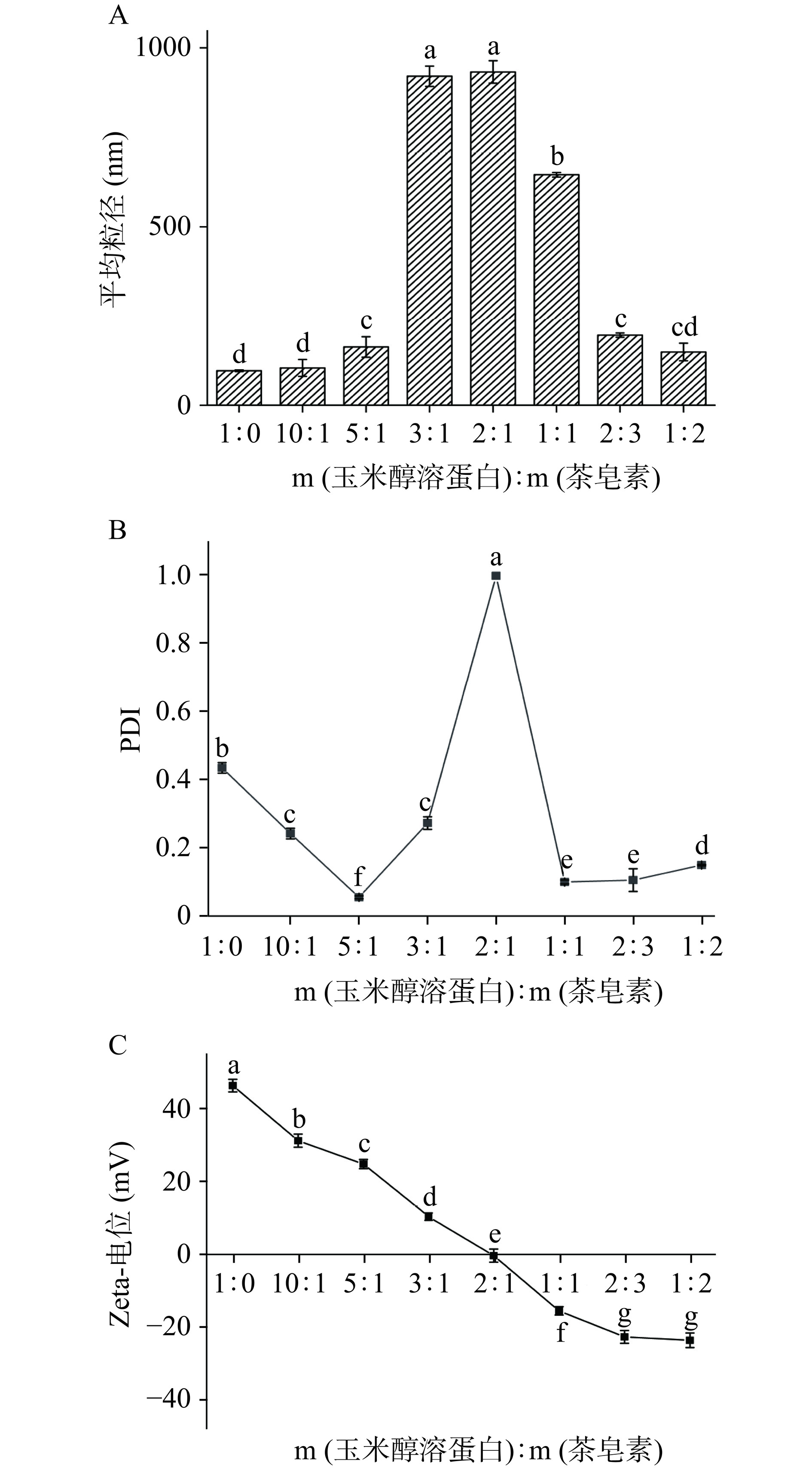
2.1.3 粒径、PDI和Zeta-电位
如图3A所示,复合纳米颗粒的粒径在玉米醇溶蛋白与茶皂素质量比为3:1到1:1范围内较大,可能是这些样品电荷绝对值较低(图3C),纳米颗粒之间由于弱的静电相互作用发生了聚集。尤其是质量比为2:1时,由于其电位几乎接近于0,此时静电相互作用几乎消失,因此粒径最大,为940.7 nm。而质量比为1:2的样品电位较大,在静电斥力和空间位阻的作用下使得玉米醇溶蛋白与姜黄素形成紧密结构,减小了复合纳米颗粒的尺寸。PDI值表示颗粒分布的均匀程度,由图3B可得知,质量比为1:1、2:3、1:2的样品PDI数值较小,这表明所制备的Zein-TS-Cur复合纳米颗粒更均一。从图3C可以看出,质量比1:0到2:1的纳米颗粒Zeta-电位的绝对值降低,这可能是因为茶皂素带少量的负电荷,能够吸附到阳离子玉米醇溶蛋白纳米颗粒的表面,发生电荷中和作用,而质量比为2:1到1:2时电位绝对值逐渐增大,这是由于随着茶皂素含量的增加,带负电荷的基团增多,纳米颗粒主要以负电形式存在。Zein-TS-Cur纳米颗粒在质量比为2:1至1:2的范围内电位绝对值逐步增大至20 mV以上,这有利于纳米颗粒的稳定。但仍小于单一Zein所制备的纳米颗粒的电位,说明带负电的茶皂素在颗粒内部增加可能降低了复合纳米颗粒的Zeta-电位[23]。
2.1.4 抗氧化特性
2.1.4.1 DPPH自由基清除率
由图4可知,玉米醇溶蛋白与茶皂素质量比为10:1、5:1、2:3、1:2的样品DPPH自由基清除率与未添加茶皂素的纳米颗粒相比有所提高,与VC相近,其中添加比例为1:2的复合纳米颗粒DPPH自由基清除率最高,为94.14%,显著高于未添加茶皂素的单一Zein纳米颗粒(P<0.05)。这可能是因为姜黄素包封后分散性较好,纳米颗粒表面吸附茶皂素,产生了较强的空间排斥力和亲水性,之前的研究也报道了通过形成纳米复合物来增强对其他疏水化合物的抗氧化作用[24]。当玉米醇溶蛋白与茶皂素质量比由5:1增加到2:1时,DPPH自由基的清除能力显著下降(P<0.05),可能是由于此时电位接近于0,玉米醇溶蛋白沉淀,游离的姜黄素析出,降低了复合纳米颗粒的自由基清除率。
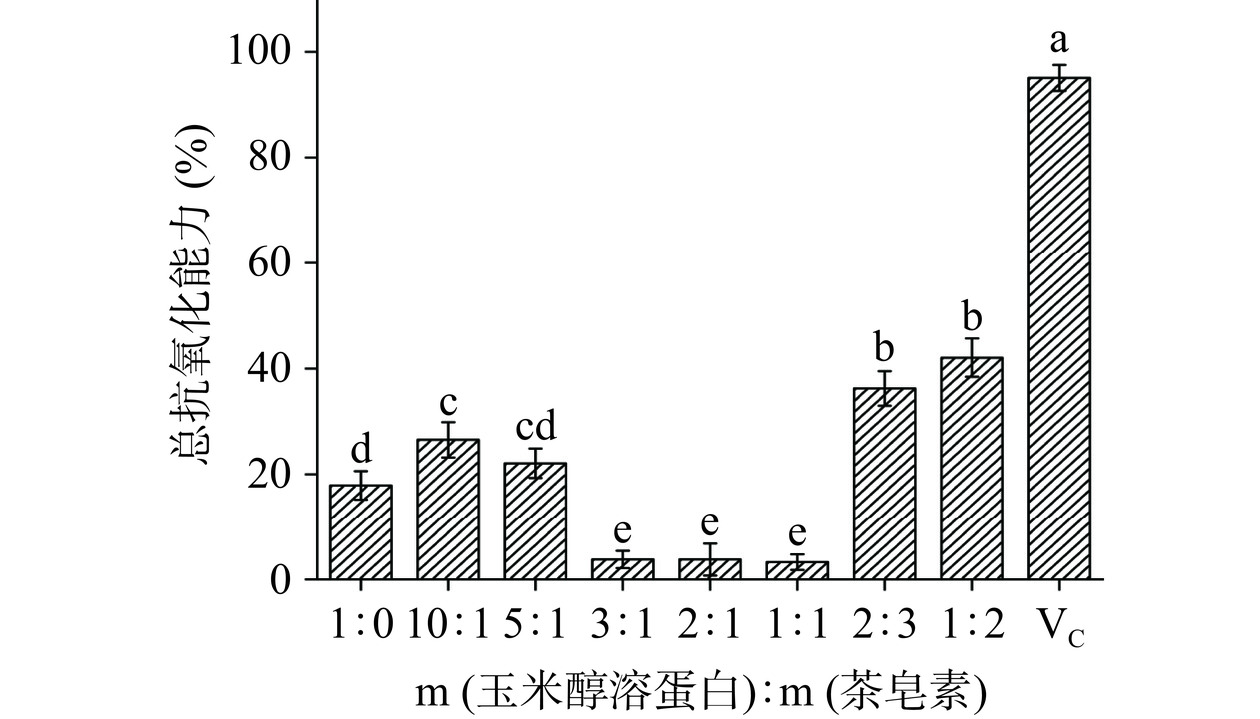
2.1.4.2 总抗氧化能力
总抗氧化能力如图5所示,在玉米醇溶蛋白与茶皂素添加比例为1:2时,总抗氧化能力与单一玉米醇溶蛋白纳米颗粒相比有显著提高(P<0.05),且1:2时总抗氧化能力最强,达到40.33%,这可能是由于茶皂素本身所具有的抗氧化能力或茶皂素改善了姜黄素原本水溶性差的问题,提高了姜黄素的溶解性,使姜黄素中更多的酚羟基暴露出来,从而能够作为电子供应体或者捕获自由基提高了复合纳米颗粒的总抗氧化能力[25]。而在添加比例为3:1、2:1和1:1时,由于静电相互作用几乎消失,玉米醇溶蛋白与茶皂素发生沉淀,导致复合纳米颗粒中具有抗氧化活性的物质减少,因此总抗氧化能力显著降低。
2.1.5 贮藏稳定性
由图6可得质量比为1:2的Zein-TS-Cur纳米颗粒在贮藏不同时间下,平均粒径、PDI和Zeta-电位与新鲜制得的样品(图3)所得的结果相近,这表明复合纳米颗粒的贮藏能力较好。如图6A所示,质量比为1:2的样品有较小粒径且30 d内粒径变化不大。有研究表明,颗粒物质在液体中的沉降速度与其粒径成反比[26],因此质量比为1:2的样品可以更好地抵御重力沉降作用,更加稳定。且在图6C中可以看出,质量比为1:2的复合纳米颗粒的Zeta-电位绝对值均大于20 mV,表明复合纳米颗粒具有较强的静电排斥作用,因此复合纳米颗粒体系较为稳定。
如图7所示在不同贮藏天数下复合纳米颗粒的沉淀情况各不相同,质量比为1:0的样品在贮藏7 d时产生明显沉淀,10:1略有沉淀,质量比为1:1的样品变清澈,其他比例样品外观无明显变化。且在贮藏30 d时,能观察到质量比为1:0与10:1的样品沉淀增加,质量比为3:1、2:1、1:1的样品更加清澈,表明包埋的姜黄素已经与溶液分离[11]。而质量比为1:2的样品变化不明显。因此表明,质量比为1:2的样品在30 d贮藏期内具有较好的贮藏稳定性。
综上所述,当玉米醇溶蛋白与茶皂素比例为1:2时所制备的复合纳米颗粒包埋率达到最高,能够较为高效地包埋姜黄素,荧光强度最强,颗粒分布均匀,粒径小,抗氧化能力与贮藏稳定性高。因此玉米醇溶蛋白与茶皂素比例为1:2时所制备的复合纳米颗粒性能最优,可以进一步测定其再不同环境条件下的稳定性。
2.2 环境应力
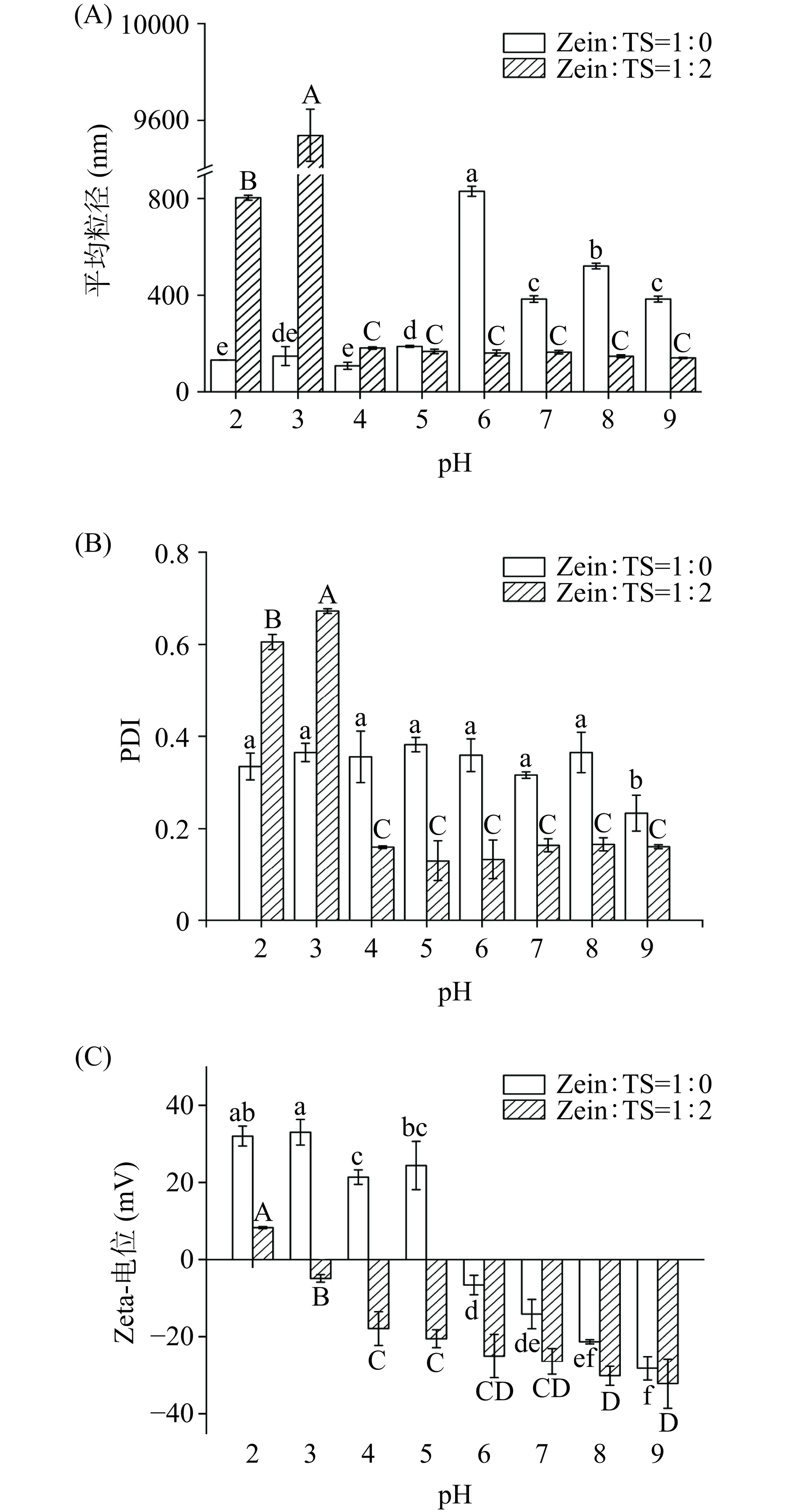
2.2.1 pH
由图8A可得,玉米醇溶蛋白与茶皂素质量比为1:2的复合纳米颗粒在pH为4~9时均具有较小的粒径。在pH为5~9时,单一玉米醇溶蛋白包埋姜黄素的纳米颗粒的粒径显著增大(P<0.05),这是由于pH的改变导致纳米颗粒的结构被破坏,形成了粒径较大的复合凝聚物[27]。单一Zein包埋姜黄素的纳米颗粒在pH6条件下具有最大的粒径,这是因为玉米醇溶蛋白的等电点为6.2,纳米颗粒之间的静电斥力减小[28],导致纳米颗粒发生聚集,粒径增大。PDI值表示颗粒分布的均匀程度,由图8B可以得出,质量比为1:2的复合纳米颗粒在pH为4~9时PDI较小,复合纳米颗粒更均一。在pH3条件下,添加茶皂素的复合纳米颗粒的粒径及PDI均较大,从图8C可以看出,此时纳米颗粒的电位为−5.51 mV,静电相互作用减弱,导致纳米颗粒发生聚集。Zein-TS-Cur纳米颗粒在pH为4~9的范围内均保持了较小的粒径及较低的PDI,这表明茶皂素的加入能够抵抗pH的影响[29]。因此质量比为1:2的复合纳米颗粒在不同的pH环境下具有较好的稳定性。
2.2.2 离子强度
由图9可得,单一Zein纳米颗粒对于离子强度的变化较为敏感,不同离子强度下的平均粒径、PDI和Zeta-电位差别较大。如图9A所示,玉米醇溶蛋白与茶皂素质量比为1:2的复合纳米颗粒在离子强度为0~50 mmol/L时,与单一Zein包埋姜黄素的纳米颗粒相比,粒径变化较小。当盐离子浓度增加到100 mmol/L时,Zein-TS-Cur复合纳米颗粒粒径增大,并且从图9B可以看出,纳米颗粒体系的PDI显著增大(P<0.05),这可能是由于Zein-TS-Cur纳米颗粒之间的静电相互作用不足以抵抗盐离子的干扰效应所导致的。根据图9C可得样品的电位值波动较小。在NaCl不存在的情况下,复合纳米颗粒之间的静电相互作用能够保持体系的稳定性[20]。加入NaCl后,Zein-TS-Cur纳米颗粒间的静电斥力被屏蔽,引起聚集。结果表明质量比为1:2的复合纳米颗粒即使在高盐浓度下也能够抵抗颗粒聚集维持稳定。
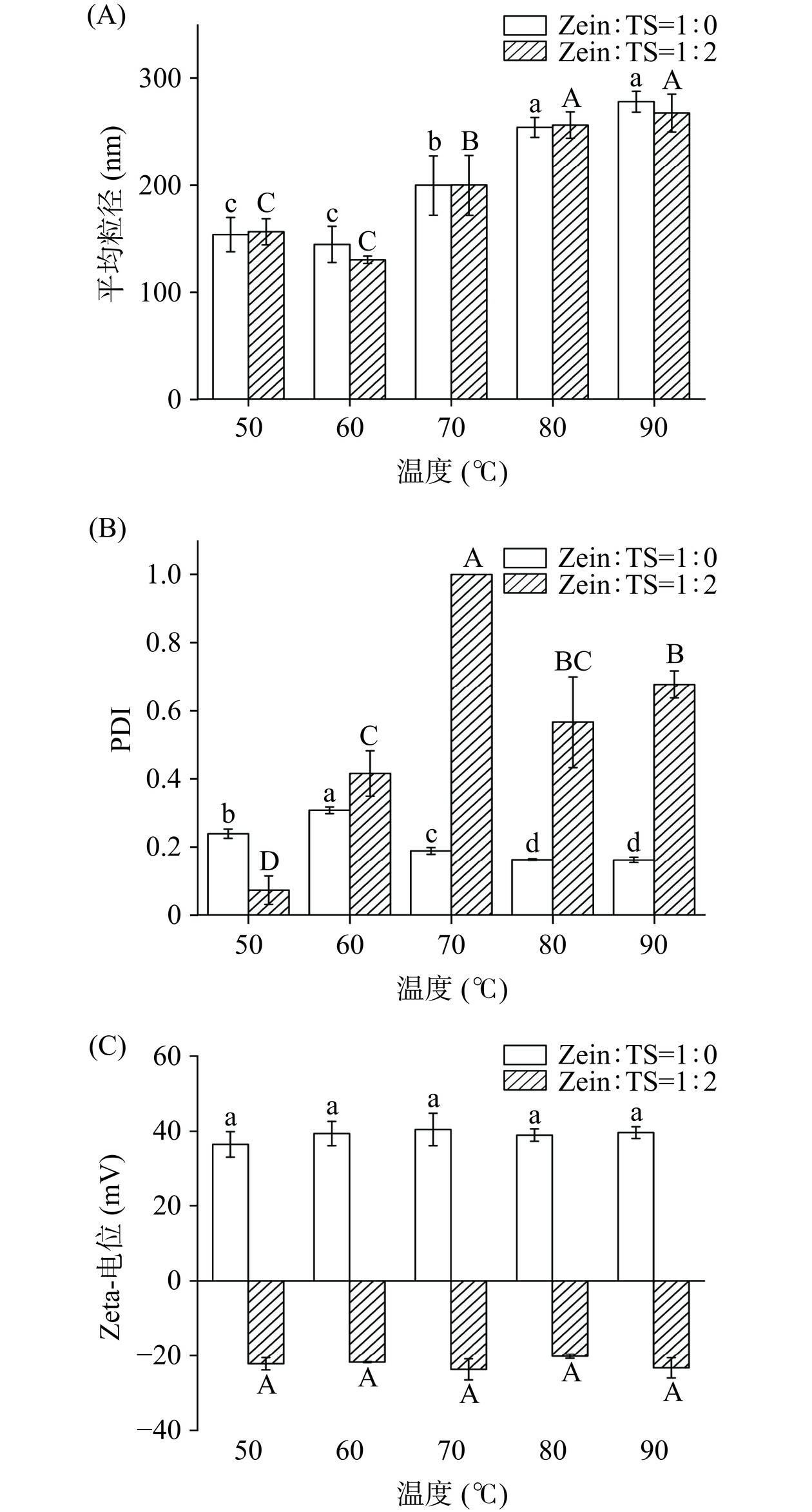
2.2.3 温度
由图10A和图10B可得,单一Zein颗粒在不同加热温度条件下,粒径均显著增大,这可能是因为,玉米醇溶蛋白纳米颗粒暴露出反应活性更强的非极性和巯基基团,增强了玉米醇溶蛋白纳米颗粒内部和颗粒之间的疏水作用,并促进了二硫键的形成,产生了较大的颗粒[30]。玉米醇溶蛋白与茶皂素比例为1:2的样品在50~60 ℃的环境下具有较小的粒径,稳定性更高。但在70~90 ℃条件下,样品的平均粒径增大且PDI值增高,可能是因为热处理破坏玉米醇溶蛋白和茶皂素之间的相互作用,导致复合胶体颗粒内分子的重组,形成的颗粒不稳定。Zein-TS-Cur复合纳米颗粒的Zeta-电位如图10C所示,在不同温度条件下,电位绝对值均较大,有利于纳米颗粒的稳定,但仍低于1:0的电位,可能是带负电的茶皂素降低了纳米颗粒的Zeta-电位值,同2.1.3的结果相同。这表明添加了茶皂素的复合纳米颗粒能够增加胶体颗粒在不同温度条件下的稳定性。
3. 结论
成功制备了载姜黄素的玉米醇溶蛋白-茶皂素复合纳米颗粒,经过测定可得出,当玉米醇溶蛋白与茶皂素添加比例为1:2时,姜黄素包埋率最大,复合物颗粒粒径小且分布均匀,荧光强度最强,贮藏稳定性较强,抗氧化活性较强。在离子强度为0~300 mmol/L、pH为4~9和温度为50~60 ℃时Zein-TS-Cur复合纳米颗粒仍保持稳定,但在pH3时粒径会发生较大变化,对颗粒的稳定性影响较大。由此表明,以玉米醇溶蛋白与茶皂素1:2的比例制备的Zein-TS-Cur复合纳米颗粒能够有效地改善姜黄素易氧化、贮藏稳定性差、溶解性差等问题。总而言之,本研究对姜黄素的贮藏和应用均有重要意义,能够促进其在食品领域的进一步应用。
-
-
[1] 曹佳勇, 刘媛, 周杰等. 姜黄素纳米载体的制备与应用研究进展[J]. 食品工业,2023,44(8):187−192. [CAO J Y, LIU Y, ZHOU J, et al. Progress in the preparation and application of curcumin nanocarriers[J]. The Food Industry,2023,44(8):187−192.] CAO J Y, LIU Y, ZHOU J, et al. Progress in the preparation and application of curcumin nanocarriers[J]. The Food Industry, 2023, 44(8): 187−192.
[2] 宋莉平, 王宇. 姜黄素药理作用及机制研究进展[J]. 中国医药导报,2020,17(20):29−33. [SONG L P, WANG Y. Research progress of curcumin pharmacological effect and mechanism[J]. China Medical Herald,2020,17(20):29−33.] SONG L P, WANG Y. Research progress of curcumin pharmacological effect and mechanism[J]. China Medical Herald, 2020, 17(20): 29−33.
[3] LI L, YAO P. High dispersity, stability and bioaccessibility of cur-cumin by assembling with deamidated zein peptide[J]. Food Chemistry,2020,319:126577. doi: 10.1016/j.foodchem.2020.126577
[4] RAI M, INGLE A P, PANDIT R, et al. Curcumin and curcumin-loaded nanoparticles:Antipathogenic and antiparasitic activities[J]. Expert Review of Anti-Infective Therapy,2020,18(4):367−379. doi: 10.1080/14787210.2020.1730815
[5] 李婷, 刘蕾, 黄敏, 等. 负载姜黄素的玉米醇溶蛋白-羧甲基壳聚糖纳米复合物的制备表征、体外消化及其抗氧化活性[J]. 现代食品科技,2022,38(12):110−117. [LI T, LIU L, HUANG M, et al. Preparation, characterization, in vitro digestion, and antioxidant activity of curcumin-loaded zein-carboxymethyl chitosan nanocomplexes[J]. Modern Food Science & Technology,2022,38(12):110−117.] LI T, LIU L, HUANG M, et al. Preparation, characterization, in vitro digestion, and antioxidant activity of curcumin-loaded zein-carboxymethyl chitosan nanocomplexes[J]. Modern Food Science & Technology, 2022, 38(12): 110−117.
[6] 陈帅, 孙翠霞, 代蕾, 等. 基于生物来源和纳米技术的姜黄素传递载体的研究进展[J]. 中国食品学报,2019,19(8):294−302. [CHEN S, SUN C X, DAI L, et al. Research progress of delivery carriers of curcumin based on biopolymers and nanotechnology[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(8):294−302.] CHEN S, SUN C X, DAI L, et al. Research progress of delivery carriers of curcumin based on biopolymers and nanotechnology[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(8): 294−302.
[7] WANG Y, PADUA G W. Nanoscale characterization of zein self-assembly[J]. Langmuir,2012,28(5):2429−2435. doi: 10.1021/la204204j
[8] WEI Y, ZHAN X Y, DAI L, et al. Formation mechanism and environmental stability of whey protein isolate-zein core-shell complex nanoparticles using the pH shifting method[J]. LWT-Food Science Technology,2020,139:110605.
[9] 王文莉, 柴向华, 范宇婷, 等. 基于玉米醇溶蛋白纳米颗粒稳定的Pickering乳液研究进展[J]. 食品与发酵工业,2021,47(18):301−307. [WANG W L, CHAI X H, FAN Y T, et al. Advances of Pickering emulsion stabilized by zein-based complex nanoparticles[J]. Food and Fermentation Industries,2021,47(18):301−307.] WANG W L, CHAI X H, FAN Y T, et al. Advances of Pickering emulsion stabilized by zein-based complex nanoparticles[J]. Food and Fermentation Industries, 2021, 47(18): 301−307.
[10] 邓卓丹, 陈文学, 兰思琪, 等. 玉米醇溶蛋白-卵磷脂-槲皮素纳米颗粒的制备与抗氧化特性[J]. 食品与发酵工业,2019,45(23):103−108. [DENG Z D, CHEN W X, LAN S Q, et al. Preparation and antioxidant properties of Zein-lecithin-quercetin nanoparticles[J]. Food and Fermentation Industries,2019,45(23):103−108.] DENG Z D, CHEN W X, LAN S Q, et al. Preparation and antioxidant properties of Zein-lecithin-quercetin nanoparticles[J]. Food and Fermentation Industries, 2019, 45(23): 103−108.
[11] FENG J, CHEN Y, LIU X, et al. Efficient improvement of surface activity of tea saponin through gemini-like modification by straightforward esterification[J]. Food Chemistry,2015,171:272−279. doi: 10.1016/j.foodchem.2014.08.125
[12] 张海凤. 油茶籽中有效成分的分离、鉴定及综合利用研究[D]. 上海:上海交通大学, 2008. [ZHANG H F. Separation, identification and comprehensive utilization of effective components in oil tea seed[D]. Shanghai:Shanghai Jiao Tong University, 2008.] ZHANG H F. Separation, identification and comprehensive utilization of effective components in oil tea seed[D]. Shanghai: Shanghai Jiao Tong University, 2008.
[13] YE P W, LU J Y, LI M C, et al. Comprehensive analysis of the compound profiles of Folium Camelliae Nitidissimae extract by ultrafast liquid chromatography with quadrupole-time-of-flight mass spectrometry and hepatoprotective effect against CCI_4-induced liver injury in mice[J]. Biomedical Chromatography,2020,34(6):e4817. doi: 10.1002/bmc.4817
[14] MA M, YAN Y, YANG S, et al. Fabrication and characterization of Zein/tea saponin composite nanoparticles as delivery vehicles of lutein[J]. Food Science and Technology,2020,125:109270.
[15] LIU C R, XU B X, MCCLEMENTS, et al. Properties of curcumin-loaded Zein-tea saponin nanoparticles prepared by antisolvent co-precipitation and precipitation[J]. Food Chemistry,2022,391:133224. doi: 10.1016/j.foodchem.2022.133224
[16] DAL L, WEI Y, SUN C X, et al. Development of protein-polysaccharide-surfactant ternary complex particles as delivery vehicles for curcumin[J]. Food Hydrocolloids,2018,85(Dec.):75−85.
[17] JOYE I J, DAVIDOV-PARDO G, LUDESCHER R D, et al. Fluorescence quenching study of resveratrol binding to zein and gliadin:Towards a more rational approach to resveratrol encapsulation using water-insoluble proteins[J]. Food Chemistry,2015,185b:261−267.
[18] HU K, MCCLEMENTS D J. Fabrication of biopolymer nanoparticles by antisolvent precipitation and electrostatic deposition:Zein-alginate core/shell nanoparticles[J]. Food Hydrocolloids,2015,44:101−108. doi: 10.1016/j.foodhyd.2014.09.015
[19] CHEN J, ZHENG J, MCCLEMENTS D J, et al. Tangeretin-loaded protein nanoparticles fabricated from zein/β-lactoglobulin:Preparation, characterization, and functional performance[J]. Food Chemistry,2014,158:466−472. doi: 10.1016/j.foodchem.2014.03.003
[20] HU K, MCCLEMENTS D J. Fabrication of surfactant-stabilized zein nanoparticles:A pH modulated antisolvent precipitation method[J]. Food Research International,2014,64:329−335. doi: 10.1016/j.foodres.2014.07.004
[21] DAI L, SUN C X, WANG D, et al. The interaction between zein and lecithin in ethanol-water solution and characterizati on of zein-lecithin composite colloidal nanoparticles[J]. PLoS One,2016,11(11):e167172.
[22] DAI, L, SUN C, WEI Y, et al. Formation and characterization of zein-propylene glycol alginate-surfactant ternary complexes:Effect of surfactant type[J]. Food Chemistry,2018,258:321−330. doi: 10.1016/j.foodchem.2018.03.077
[23] SEBAALY C, JRAIJ A, FESSI H, et al. Preparation and characterization of clove essential oil-loaded liposomes[J]. Food Chemistry,2015,178:52−62. doi: 10.1016/j.foodchem.2015.01.067
[24] WANG M, FU Y, CHEN G, et al. Fabrication and characterization of carboxymethyl chitosan and tea polyphenols coating on zein nanoparticles to encapsulate β-carotene by anti-solvent precipitation method[J]. Food Hydrocolloids,2018,77:577−587. doi: 10.1016/j.foodhyd.2017.10.036
[25] 寇梦璇. 卵白蛋白-CMC自组装纳米颗粒包埋姜黄素体系构建与表征[D]. 杭州:浙江工商大学, 2019. [KOU M X. Construction and characterization of curcumin embedded in ovalbumin-CMC self-assembled nanoparticle system[D]. Hangzhou:Zhejiang Gongshang University, 2019.] KOU M X. Construction and characterization of curcumin embedded in ovalbumin-CMC self-assembled nanoparticle system[D]. Hangzhou: Zhejiang Gongshang University, 2019.
[26] HILL L J, PINNA N, CHAR K , et al. Colloidal polymers from inorganic nanoparticle monomers[J]. Progress in Polymer Science,2015(40):85−120.
[27] 刘雪琼. 玉米醇溶蛋白—多糖纳米复合物的超声波制备技术及功能特性研究[D]. 镇江:江苏大学, 2021. [LIU X Q. Ultrasonic preparation technique and functional characterization of corn alcohol soluble protein-polysaccharide nanocomplexes[D]. Zhenjiang:Jiangsu University, 2021.] LIU X Q. Ultrasonic preparation technique and functional characterization of corn alcohol soluble protein-polysaccharide nanocomplexes[D]. Zhenjiang: Jiangsu University, 2021.
[28] GAIL L, BEDJOU F, FERRARI G, et al. Formulation and characterization of zein/gum arabic nanoparticles for the encapsulation of a rutin-rich extract from Ruta chalepensis L[J]. Food Chemistry,2022,367(15):129982.1−129982.10.
[29] CHEN H Q, ZHONG Q X. A novel method of preparing stable zein nanoparticle dispersions for encapsulation of peppermint oil[J]. Food Hydrocolloids,2015,43:593−602. doi: 10.1016/j.foodhyd.2014.07.018
[30] CHEN H, ZHONG Q. Processes improving the dispersibility of spray-dried zein nanoparticles using sodium caseinate[J]. Food Hydrocolloids,2014,35:358−366. doi: 10.1016/j.foodhyd.2013.06.012






 下载:
下载:





 下载:
下载:
