Effects of Wheat Varieties on Bacterial Community and Volatile Flavor Compounds in Nongxiangxing Daqu
-
摘要: 小麦是大曲生产主要原料,其品种特性不一。为考察小麦品种对浓香大曲细菌群落及其代谢风味物的影响,利用国标法测定小麦主要特性与成分,采用微生物可培养法联合高通量测序技术和顶空固相微萃取气质联用技术(HS-SPME-GC/MS)分别分析不同品种小麦浓香中温大曲的细菌菌群结构和挥发性风味化合物,基于Spearman相关系数,网络可视化小麦品质指标与主要细菌属的相关性。根据粗蛋白含量,5种小麦分为强筋、中强筋、中筋和弱筋小麦四类。从中温大曲中共检测到83种挥发性化合物,其中43种为特征化合物,己醇、2-甲基丁酸乙酯、异戊酸乙酯和四甲基吡嗪是强筋小麦大曲的特征风味物,丁烯醛是中筋小麦大曲的特征风味物。中筋和弱筋小麦大曲分别有最高菌落总数的好氧细菌和产酸细菌。克罗彭斯特菌属、高温放线菌属、亮杆菌属、魏斯氏菌属和芽孢杆菌属是主要优势菌群,中强筋和中筋小麦大曲中含有相对丰度较高的魏斯氏菌属和高温放线菌属,而强筋小麦大曲则相反,且前4个细菌属与特征挥发性化合物显著相关,并受小麦粗蛋白(或湿面筋)、粗淀粉及粉质率的影响。该研究结果为浓香白酒制曲小麦品种的选育及其在大曲生产中的合理化应用提供了可靠的理论依据。Abstract: Wheat was the main raw material for producing daqu, but the diversity in the characteristics of wheat varieties influenced daqu production. To investigate the effects of wheat varieties on the bacterial community and the flavor-related metabolites in Nongxiangxing daqu, the main properties and components of wheat were determined by national standard methods, 16S rDNA amplicon high-throughput sequencing technology and headspace solid-phase microextraction gas chromatography/mass spectrometry (HS-SPME-GC/MS) technology were applied to analyze the bacterial community and volatile compounds in Nongxiangxing daqu derived from different wheat varieties, respectively. The correlation between wheat quality indices and the dominant bacterial genera was visualized by constructing a Spearman rank correlation-based network diagram. According to the crude protein content, five wheat varieties were classified into the following four categories: high-gluten, medium-high-gluten, medium-gluten, and low-gluten wheat. A total of 83 volatile compounds were detected in Nongxiangxing daqu, of which 43 were differentially abundant compounds. Additionally, hexanol, ethyl 2-methylbutyrate, ethyl isovalerate, and tetramethylpyrazine were identified as potentially useful volatile compound markers of Nongxiangxing daqu produced from high-gluten wheat, whereas butenal might be used as a marker of Nongxiangxing daqu derived from medium-gluten wheat. The medium-gluten and low-gluten wheat varieties produced the Nongxiangxing daqu with the highest total aerobic bacteria and acid-producing bacteria contents, respectively, with Kroppenstedtia, Thermoactinomyces, Leucobacter, Weissella, and Bacillus identified as the predominant bacterial genera. Weissella and Thermoactinomyces bacterial species were relatively abundant in the Nongxiangxing daqu produced from medium-gluten and medium-high-gluten wheat varieties, but not in the Nongxiangxing daqu derived from the high-gluten wheat. Furthermore, the four most abundant bacterial genera were significantly related to the differentially abundant volatile compounds. Moreover, they were affected by the crude protein or wet gluten contents, the crude starch content, and the powder rate of wheat grains. The study results provide a theoretical basis for breeding ideal wheat varieties for the production of daqu, including Nongxiangxing daqu.
-
浓香型白酒为中国十二大香型白酒之一,其产量为白酒总量的50%以上[1],占据中国最大的消费市场[2]。中温大曲是浓香型白酒生产的糖化发酵剂,因其最高发酵温度(50~60 ℃)不同于高温大曲(60~70 ℃)和低温大曲(40~50 ℃),而导致其拥有独特的微生物菌群及其代谢物[3]。同时,中温大曲作为酿造原料的一部分,按投粮量20%加入粮醅,为浓香白酒的发酵提供了丰富的微生物、酶类和呈香呈味物质,决定了浓香白酒的香型风格[4]及原酒的产量和质量[5]。中温大曲多以小麦或小麦、大麦、豌豆混合物为原料,经过粗粉碎、加水搅拌、压块成型、入房发酵、出房储藏成熟等操作工艺而生产[6]。大曲这种自然开放的固态发酵和后熟过程使得来自原料、工具、周围环境等自然界的微生物得以富集、淘汰及定植,因此,大曲微生物类群复杂多样[7]。
细菌是中温大曲微生物的重要类群,目前检测到的优势细菌属主要有芽孢杆菌属(Bacillus)、芽孢乳杆菌(Lactobacillus)、魏斯氏菌属(Weissella)、糖多孢菌属(Saccharopolyspora)、高温放线菌属(Thermoactinomyces)、克罗彭斯特菌属(Kroppenstedtia)、变形菌属(Proteus)、片球菌属(Pediococcus)等[2,8]。细菌生香,恰说明了细菌对大曲质量的贡献[9]。比如,大曲细菌中的芽孢杆菌属,不仅能够代谢各种水解酶类如淀粉酶、蛋白酶、脂肪酶等[10],而且还可以代谢风味物质如吡嗪类化合物[11],同时,芽孢杆菌属还可以影响大曲微生物菌群的相互作用[12],当芽孢杆菌属作为大曲数量优势菌群时,能显著抑制芽孢乳杆菌的生长[12],因此,芽孢杆菌属对大曲的质量提升与控制起重要作用[13]。再如,芽孢乳杆菌属、魏斯氏菌属是中温大曲普遍存在的乳酸细菌,不仅与大曲酸度呈正相关[1],而且也可参与乙酯与甲酯类风味化合物的代谢[14]。随着现代分子生物学测序技术和代谢组学技术的发展,大曲中越来越多的细菌种属被认知,其代谢功能也逐渐明晰。前人的研究已逐步揭示了大曲发酵过程中细菌群落结构发生的演替变化[4]、成熟大曲中细菌群落的多样性,以及大曲细菌群落结构与环境因子、代谢产物之间的相关性[5,15]。然而,不同制曲小麦品种中温大曲细菌群落组成及其代谢物的研究,目前仍少有报道。
小麦作为中温大曲生产的主要原料,不仅是微生物生长的载体,同时也是微生物生长代谢所需的营养物质。然而,不同品种或种植区的小麦组成成分和品质特征存在差异,这些差异会影响微生物富集和代谢,进而影响大曲的理化特性[15−16]。黄瑜等[17]在实验室模拟高温大曲发酵工艺,对南方小麦和北方小麦模拟大曲的微生物组成及其风味物进行研究,发现相同品种或种植地域相邻的小麦制备的模拟大曲微生物组成较为相似,且其风味物组成也如此。也有部分研究对不同品种小麦大曲的发酵动态品质、微生物总数、小麦糖化液纯种发酵代谢风味物进行评价,发现小麦籽粒的品质性状与主要成分对大曲质量指标、细菌和真菌总数及优势菌属风味代谢物产生显著影响[16,18−19],由此表明,小麦种类影响大曲微生物群落结构,进而影响大曲风味成分组成。因此,选择适宜的制曲小麦品种,不仅可以合理化微生物生长的营养成分,还可以促进大曲优势菌群的富集,利于大曲风味物质的代谢与合成,进而提升大曲的质量特性。本研究以5种小麦及其生产的中温大曲为研究对象,采用国标法检测小麦的主要特性与成分,可培养方法联合高通量测序技术检测分析大曲细菌菌群组成,HS-SPME-GC/MS技术分析大曲挥发性风味化合物,探索制曲小麦品种对中温大曲细菌群落结构及其代谢风味物影响,以期为适宜制曲小麦品种的筛选及大曲品质的改善或稳定提供有效的技术支撑。
1. 材料与方法
1.1 材料与仪器
小麦样本 共5种,其中4个小麦品种由河南商丘农科所提供,均种植于河南商丘农科所小麦试验田,另一种小麦为酒厂收购本地(商丘宁陵县)种植的,由河南张弓老酒酒业有限公司提供;大曲样本 成熟的5种小麦中温大曲,采集于河南张弓老酒酒业有限公司;细菌平板计数琼脂(Plate count agar,PCA)培养基和MRS培养基 英国Oxoid 公司;2×Es Taq Master Mix、100-2000 bp DNA Marker 康为世纪生物科技股份有限公司;TAE电泳液、STE缓冲液、4S Green核酸染色剂、27F引物、1492引物 生工生物工程(上海)股份有限公司;琼脂糖 西班牙Biowest公司;E.Z.N.A.®土壤DNA试剂盒 美国Omega Bio-Tek公司;AxyPrep DNA胶回收纯化试剂盒 美国Axygen Biosciences公司;NEXTflexTM 快速DNA-Seq建库试剂盒 美国Bioo Scientific公司;2-辛醇(最终浓度34 μg/L) 美国Sigma-Aldrich公司。
Kjeltec8400全自动凯氏定氮仪、NIRS DA 1650近红外分析仪 丹麦FOSS公司;50/30 μm DVB/CAR/PDMS固相微萃取头 美国Supelco公司;Trace 1300气相色谱- TSQ 9000质谱联用分析仪 美国Thermo Fisher Scientiffc公司;SW-CJ-2F型超净工作台 苏州净化设备有限公司;LDZX-50FBS高压蒸汽灭菌锅 上海申安医疗器械厂;MJX-250B-Z恒温培养箱 上海博迅实业医疗设备厂;DYY-BC型电泳仪 北京市六一仪器厂;Labcycler型PCR仪 广州市华粤行仪器有限公司;NanoDrop2000超微量分光光度计 美国Thermo Fisher Scientific公司;Quantus™荧光定量仪 美国Promega公司;Illumina Miseq PE300测序平台 美国Illumina公司。
1.2 实验方法
1.2.1 小麦和大曲样本的采集
按照传统中温大曲生产工艺,小麦制曲生产试验于2021年9月在河南张弓老酒酒业公司进行。小麦样本在开始制曲时采集,采用麦堆五点取样法,5种小麦的编号分别为WA、WB、WC、WD、WE,置−20 ℃保存,用于测定主要品质指标。成熟3个月的中温大曲于2022年1月采集,共获得5种小麦中温大曲,编号分别为AMD、BMD、CMD、DMD、EMD。大曲样本采集时,分别从各品种曲堆上、中、下各层任意抽取三块大曲,磨碎后充分混合为一个样本,每个样本取三份,装入无菌袋密封,其中两份低温冷冻保存,分别用于大曲挥发性化合物测定和细菌高通量测序;另一份立即带回实验室,用于细菌群落的可培养分离。每个样本做三个重复。
1.2.2 小麦品质指标的测定
小麦籽粒容重、粗淀粉测定采用近红外法[16,20];粗蛋白测定采用凯氏定氮法(GB/T 5511-2008);湿面筋含量测定采用仪器法(GB/T 5506.2-2008);粉质率测定采用目测法[21];硬度采用硬度指数法测定(GB/T 21304-2007);脂肪测定采用索氏抽提法(GB 5009.6-2016);灰分测定采用灼烧法(GB 5009.4-2016)。
1.2.3 大曲挥发性风味物的分析
取2.0 g大曲粉末样本加入装有5 mL饱和食盐水和内标的20 mL顶空瓶中,采用50/30 μm DVB/CAR/PDMS固相微萃取头,50 ℃平衡10 min,萃取45 min;萃取头插入GC-MS进样口,230 ℃解吸5 min。GC-MS联用仪的毛细管色谱柱为TR-WAX(30 m×0.25 mm i.d.,0.25 μm),超纯氦气流速为1 mL/min,分流比为10:1。GC升温程序:35 ℃,维持2 min;5 ℃/min升至110 ℃,维持5 min;7 ℃/min升至230 ℃,维持7 min。离子源为EI源,电离能量70 eV,温度240 ℃,接口温度250 ℃,扫描范围30~450 m/z。样品总离子流图对比NIST谱库(NIST 2.3,2017),选择匹配度大于800的物质对挥发物进行定性,采用内标半定量法对检测物进行定量分析[22]。差异化合物采用软件SIMCA(14.1)进行最小偏二乘判别法(PLS-DA)分析,选择VIP值大于等于1的化合物作为特征风味物。
1.2.4 大曲可培养细菌的计数、分离与鉴定
细菌菌落计数采用10倍梯度稀释涂布法[23]。好氧细菌和产酸细菌的计数与分离分别采用PCA培养基和MRS碳酸钙琼脂培养基,培养条件为37 ℃、24~48 h,菌落总数按CFU/g进行计算。大曲样本10倍稀释液于80 ℃处理10 min,稀释涂布与培养同细菌培养法,计算芽孢细菌菌落数。分别挑选具有典型特征的单菌落进行划线纯化至镜检确定为纯种。每平板纯化菌株的数量为总数的平方根个[23]。将纯化后菌株进行16S rDNA种属的初步鉴定,细菌DNA的提取、PCR扩增及测序鉴定参照文献[24]。
1.2.5 细菌群落的高通量测序分析
大曲细菌总DNA的提取按照 E.Z.N.A.®土壤DNA试剂盒的说明步骤进行,然后用1%的琼脂糖凝胶电泳检测DNA质量并测定DNA的浓度和纯度。细菌16S rRNA的V3~V4可变区基因采用通用上游引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和下游引物806R(5’-GGACTACHVGGGTWTCTAAT-3’)进行PCR扩增。PCR扩增条件为:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),然后 72 ℃延伸10 min,最后4 ℃终止;PCR反应体系共20 μL(5×Trans Start FastPfu缓冲液4 μL,2.5 mmol/L dNTPs 2 μL,上游引物(5 µmol/L)和下游引物(5 µmol/L)各0.8 μL,TransStart FastPfu DNA聚合酶0.4 μL,模板DNA 10 ng,ddH2O补足至20 μL)。分别使用2%琼脂糖凝胶和DNA凝胶回收试剂盒对PCR产物进行回收和纯化,对回收产物使用QuantiFluor™荧光定量系统进行检测定量。将合格的纯化扩增片段按照Illumina MiSeq平台操作规程构建PE 2×300 bp的序列文库,最终获得的有效文库序列利用Illumina公司的Miseq PE300平台进行测序。
1.2.6 高通量序列数据处理与生信分析
原始序列数据由QIIME(v1.9.1,http://qiime.org/install/index.html)进行处理。使用fastp(v0.20.0,https://github.com/OpenGene/fastp)软件对原始测序序列进行质控,并使用FLASH(v1.2.11,http://www.cbcb.umd.edu/software/flash)软件进行拼接,数据优化。将数据优化后获得高质量的序列使用UPARSE(v11,http://drive5.com/uparse/)软件根据相似度≥97%水平进行操作分类单元(operational taxonomic unit,OTU)聚类,并剔除嵌合体。使用RDP分类器(v2.13,http://rdp.cme.msu.edu/)对照Silva 16S rRNA数据库(v138)对每条序列进行物种分类注释,设置比对阈值为70%。使用USEARCH(v11,http://www.drive5.com/usearch)将所有高质量序列与OTU进行比较,生成每个样本的OTU丰度统计表。基于OTU水平,评估细菌群落的Alpha和β多样性。
1.3 数据处理
采用SPSS(16.0)软件对数据进行统计分析,差异显著性(P<0.05)采用单因素方差分析(ANOVA)。采用R语言(v3.3.1)heatmap包基于斯皮尔曼(Spearman's rank)相关系数对大曲主要细菌属与差异风味化合物、小麦品质指标之间的相关性进行分析,并采用Cytoscape(v3.7.1)软件对相关性网络进行可视化,相关指数|ρ|>0.6且P<0.05被定义为显著相关。
2. 结果与分析
2.1 原料小麦的品质特性
5种制曲小麦的主要特性(硬度、容重、粉质率)和主要成分组成(水分、粗蛋白、湿面筋、淀粉、灰分和脂肪)存在一定差异(表1)。5种制曲小麦中,WC小麦具有显著高于其他小麦样本的硬度(67.95)、粉质率(95%)、粗蛋白和湿面筋含量(14.2%和29.07%)(P<0.05),而具有最低的淀粉含量(68.07%)和脂肪含量(1.65%);WB和WD小麦具有较低的硬度(55.93和54.02)及粉质率(11.00%和28.00%),WE小麦具有显著低于其他小麦样本的容重(764.67 g/L)和最低含量的粗蛋白(12.31%)与湿面筋(25.40%)(P<0.05),而含有最高的粗淀粉(达70.1%),但粗淀粉含量与小麦WA和WB的无显著差异。按照小麦品种分类标准(GB/T 17320-2013),WC和WD小麦均属于强筋小麦(粗蛋白≥14.0%),属于河南省种植区的强筋小麦品种,虽然小麦WD的粗蛋白与WA无显著差异,但其值高于14.0%,达到强筋小麦的蛋白标准。而WE小麦属于弱筋小麦(粗蛋白<12.5%,湿面筋含量<26.0%),WA、WB小麦品种的粗蛋白、湿面筋等指标分别符合中强筋小麦(粗蛋白≥13.0%,湿面筋含量≥28.0%)和中筋小麦(粗蛋白≥12.5%,湿面筋含量≥26.0%)的品质标准,因此WA、WB小麦分别属于中强筋小麦和中筋小麦。WC和WD均属于强筋小麦,但WD小麦具有较低的硬度和粉质率,与WB小麦的硬度和粉质率较相似。
表 1 制曲小麦主要品质特性与主要组成成分Table 1. Indexes of the properties and components of different wheat for daqu making小麦样本 特性指标 成分指标 硬度
(%)容重
(g/L)粉质率
(%)水分
(%)粗淀粉
(%)粗蛋白
(%)湿面筋
(%)灰分
(%)脂肪
(%)WA 62.44±0.24c 785.27±14.62b 60.00±2.00b 12.38±0.06b 69±0.12abc 13.69±0.17b 28.63±0.19b 1.77±0.06a 2.67±0.01a WB 55.93±0.2e 800.43±2.07ab 11.00±2.00e 11.78±0.01c 69.63±1.03ab 12.92±0.33c 27.17±0.12c 1.72±0.04ab 2.15±0.05c WC 67.95±0.79a 807.7±18.38a 95.00±5.00a 11.12±0.05d 68.07±0.07c 14.2±0.29a 29.07±0.08a 1.73±0.03ab 1.65±0.08d WD 54.02±1.24d 814.97±4.97a 28.00±1.00d 11.11±0.03d 68.83±0.17bc 14.07±0.05ab 29.03±0.019a 1.62±0.02c 2.18±0.11c WE 64.14±0.68b 764.67±5.66c 43.00±3.00c 12.51±0.06a 70.1±0.9a 12.31±0.05d 25.4±0.28d 1.67±0.059bc 2.36±0.01b 注:数值为平均值±标准差(SD),同列不同字母代表显著性差异(P<0.05)。 2.2 大曲可培养细菌群落的总数与种属鉴定
2.2.1 可培养细菌菌落总数
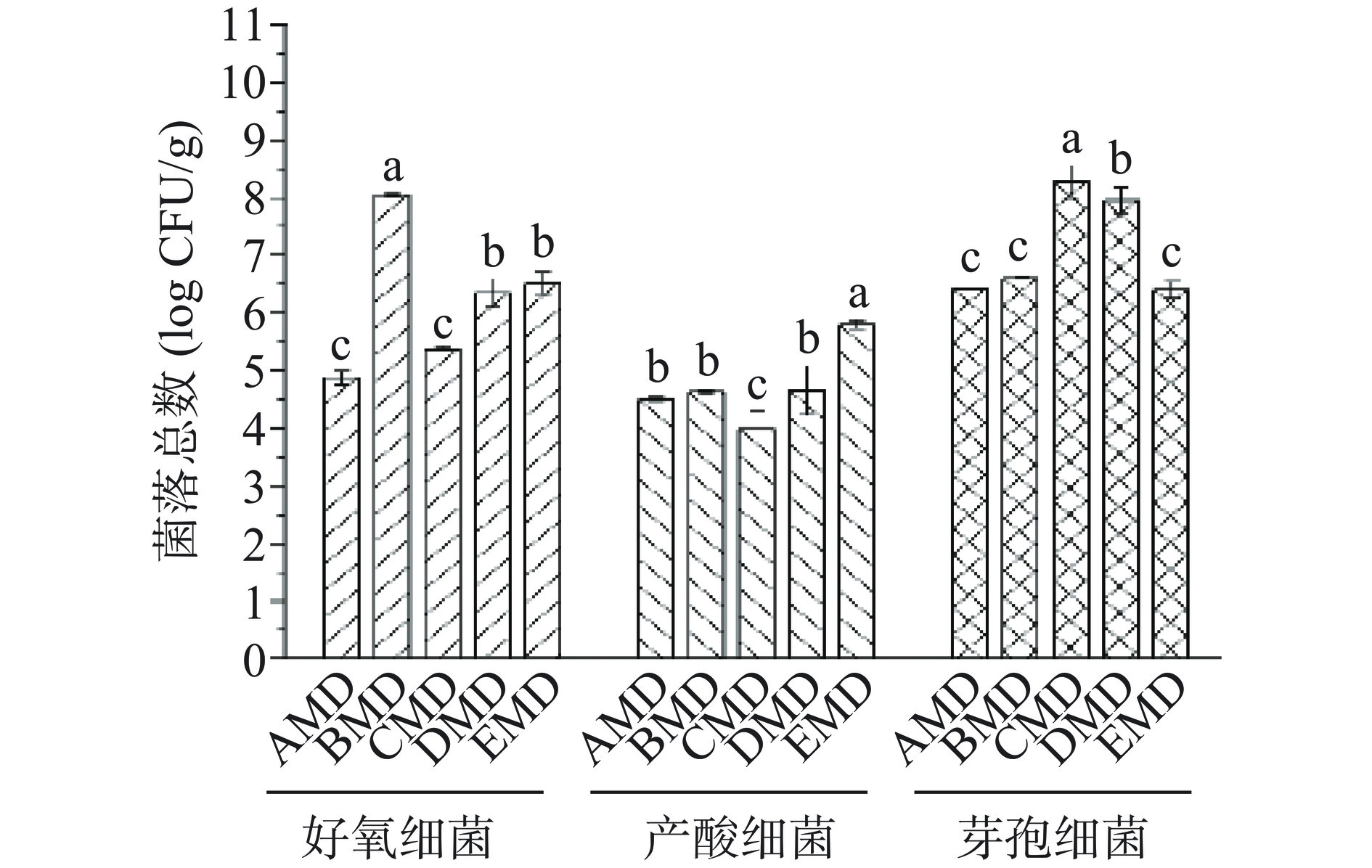
不同小麦品种中温大曲的好氧细菌、产酸细菌及耐高温芽孢细菌的菌落总数结果见图1。好氧细菌菌落总数在BMD大曲样本中最高,且显著高于其他大曲样本(P<0.05),而在CMD和AMD样本中较低;产酸细菌的菌落总数在EMD大曲中最高,而在CMD大曲中最低;耐高温芽孢细菌的菌落总数在CMD和DMD大曲样本中均较高,而在其他3个大曲样本中无显著差异(P>0.05)。该结果说明,原料小麦品种影响大曲可培养细菌的菌落总数,这与前人的研究基本相符合[25−26]。余有贵等[25]在花麦和白麦对浓香型中高温大曲微生物数量影响的研究中发现,花麦大曲中的细菌数量高于白麦大曲;朱和琴等[26]选择“宜麦7号”(蛋白质含量13.55%)和普通小麦(蛋白质含量11.5%)生产浓香型大曲,同样发现,从入房安曲到成曲阶段,中等蛋白含量的“宜麦7号”大曲细菌总数均高于低蛋白普通小麦大曲,由此证明,原料小麦品种不同,品质特性存在差异,进而影响大曲富集的细菌总数。
2.2.2 不同小麦大曲的可培养细菌种属鉴定
5种小麦大曲共分离得到70株细菌,通过分子生物学技术初步鉴定的细菌归为6个属15个种,分别为肠杆菌属(Enterobacter)的阴沟肠杆菌(Enterobacter cloacae)和霍氏肠杆菌(Enterobacter hormaechei),克罗诺杆菌属(Cronobacter)的苏黎士克罗诺杆菌(Cronobacter turicensis),耐久肠球菌属(Enterococcus)的粪肠球菌(Enterococcus faecalis)和耐久肠球菌(Enterococcus durans),芽孢乳杆菌属(Lactobacillus)的植物乳杆菌(Lactobacillus plantarum),芽孢菌普利斯特菌属(Priestia)的阿氏普利斯特菌(Priestia aryabhattai)和巨大普利斯特菌(Priestia megaterium),芽孢杆菌属(Bacillus)的厦门芽孢杆菌(Bacillus xiamenensis)、贝莱斯芽孢杆菌(Bacillus velezensis)、枯草芽孢杆菌(Bacillus subtilis)、地衣芽孢杆菌(Bacillus licheniformis)、蜡样芽孢杆菌(Bacillus cereus)、解淀粉酶芽孢杆菌(Bacillus amyloliquefaciens)、特基拉芽孢杆菌(bacillus tequilensis)和未知芽孢杆菌(Bacillus sp.)(表2)。由表2可知,植物乳杆菌在CMD大曲样本中未发现,而在其他大曲样本中均鉴定到了1株,这可能与大曲原料小麦的品种差异有关。芽孢杆菌属为优势可培养细菌属,占比为76.6%,其中数量占优势的枯草芽孢杆菌和地衣芽孢杆菌均普遍出现在所有小麦品种大曲中,但在5种小麦大曲中的分布并不相同。BMD大曲中鉴定到的地衣芽孢杆菌数量最少,仅有3株,而其他4种大曲中均鉴定到了5~6株。枯草芽孢杆菌在AMD和BMD大曲中的数量均高于其他大曲。CMD和DMD大曲鉴定到的芽孢菌数量相同(10株),但均低于AMD大曲(15株),这与CMD和DMD大曲有较高芽孢菌菌落总数不一致,原因可能是菌株纯化时大曲菌液稀释度的选择不统一,且部分菌株因PCR扩增DNA失败未能鉴定而导致。大曲芽孢菌属的贝莱斯芽孢杆菌、地衣芽孢杆菌及枯草芽孢杆菌在大曲芽孢菌群中占据优势,该类细菌具有分泌淀粉酶、蛋白酶、脂肪酶、酯化酶等各种酶类[8,27]及四甲基吡嗪、2,3-丁二醇等风味物质的功能,对大曲品质和香气的形成发挥重要作用[12]。目前,以上三种芽孢杆菌已接种应用于强化大曲的生产,可改变大曲菌群的相对丰度,促进大曲香气代谢物如己酸、己酸乙酯、己酸己酯等的形成,进而提升大曲质量[11−13]。因此,小麦品种对中温大曲优势功能芽孢杆菌的富集及其代谢影响值得进一步研究探索。
表 2 可培养细菌种属的BLAST比对鉴定及在不同大曲样本中的分布Table 2. Identification of the culture-dependent bacterial species by BLAST and its distribution in different daqu细菌种属 同源性(%) GenBank
序列号AMD BMD CMD DMD EMD Cronobacter turicensis 98 NR_044061.1 1 Enterobacter cloacae 99 NR_117679.1 2 3 2 Enterobacter hormaechei 97 NR_042154.1 1 Enterococcus faecalis 99 NR114782.1 1 1 1 1 Enterococcus durans 100 NR117562.1 1 Lactobacillus plantarum 100 NR117813.1 1 1 1 1 Bacillus xiamenensis 100 MT133332.1 1 Bacillus velezensis 100 KT583454.1 2 2 2 Bacillus sp. 97 MN826447.1 1 1 1 1 Bacillus subtilis 99 NR_112116.2 3 3 1 1 1 Bacillus cereus 98 OM900179.1 2 1 1 Bacillus licheniformis 97 MH000674.1 6 3 5 5 5 Bacillus amyloliquefaciens 98 OQ701391.1 1 1 1 Bacillus tequilensis 97 OQ405609.1 1 Priestia aryabhattai 97 OM188392.1 1 1 Priestia megaterium 97 MH261115.1 2 1 1 1 注:大曲样本对应数字为鉴定的菌株数量。 2.3 高通量测序的细菌群落多样性
2.3.1 Alpha多样性和β多样性
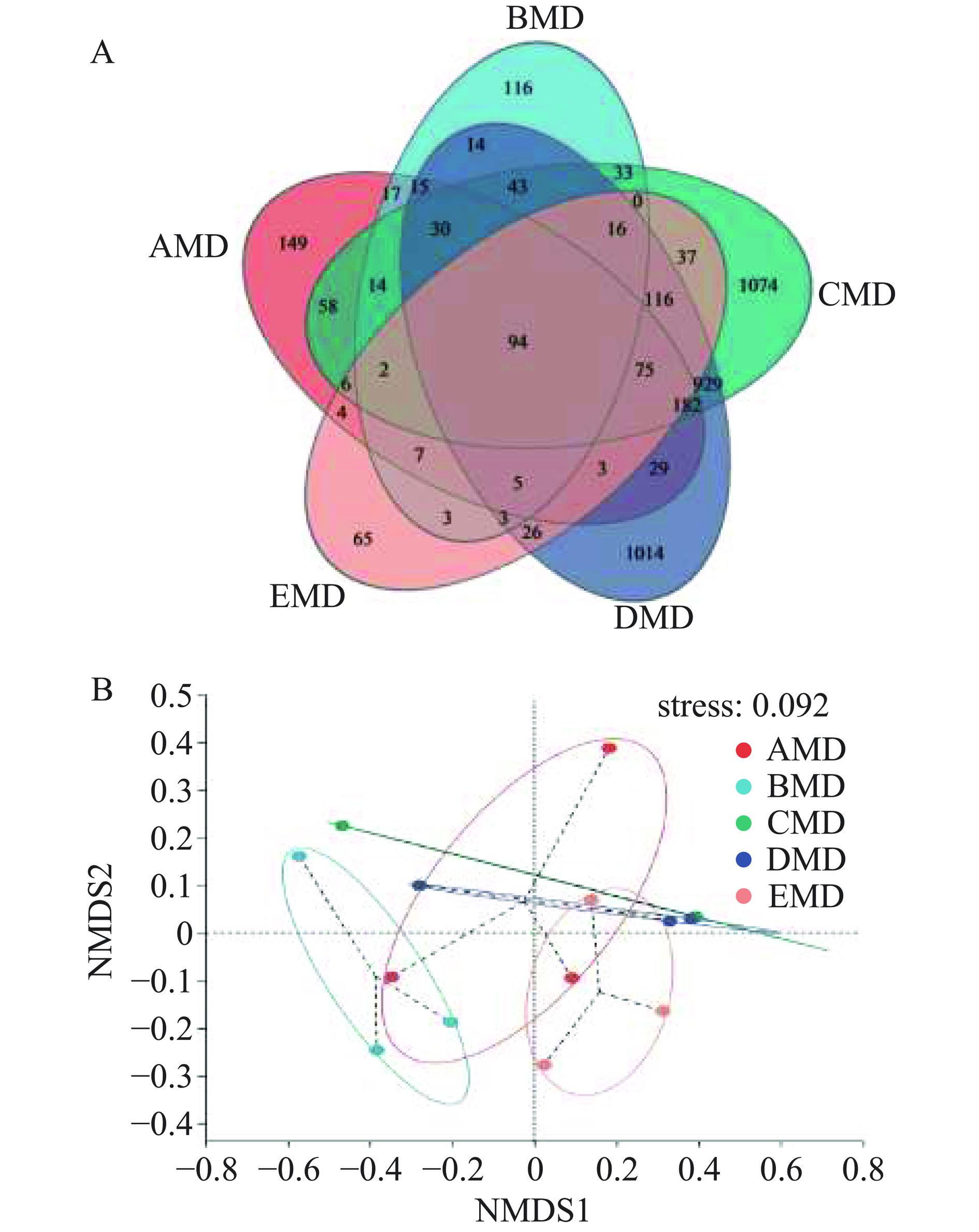
5种小麦大曲共15个样本的细菌有效序列数为54296,OTU总数在174~1240之间。采用Sobs、Chao1、Shannon指数评价大曲样本细菌群落的Alpha多样性。Sobs、Chao1指数分别反映大曲样本可观测细菌物种的丰富度和估算物种的丰富度,Shannon指数则反映大曲细菌物种的多样性。表3可知,样本细菌测序覆盖度大于99%,说明测序序列能覆盖大部分基因组序列,能正确反映样本细菌群落组成的真实信息,且5种小麦大曲细菌的丰富度及多样性并不相同,大曲CMD和DMD的OTU数、Sobs、Chao1和Shannon指数平均值均较大,说明此两种小麦大曲的细菌物种丰富度及其多样性均高于其他3种大曲样本。然而,BMD大曲样本的三个指数值均相对较小,说该小麦品种大曲含有低丰度且种类较少的细菌物种。
表 3 大曲细菌群落的Alpha多样性指数Table 3. Alpha diversity index of fungal communities in daqu样本 OTUs Sobs Shannon Chao1 Coverage AMD 295 295.00±63.51 3.98±1.05 342.70±66.80 99.94% BMD 174 173.70±22.30 3.05±0.97 211.20±33.52 99.95% CMD 1240 1240.00±896.70 5.04±1.63 1344.00±973.40 99.80% DMD 1213 1213.00±866.80 4.91±1.75 1300.00±873.20 99.82% EMD 202 201.70±26.73 4.12±0.68 245.70±25.77 99.96% 基于细菌OTU水平的Venn图(图2A)显示,AMD、BMD、CMD、DMD和EMD大曲样本共有94个OTUs,而特有的OTU数分别为149、116、1074、1014、65,CMD和DMD大曲样本具有较高的OTU总数和独有的OTU数,而EMD大曲样本具有最低的OTU总数和独有的OTU数,说明强筋小麦大曲可富集更多的细菌物种,而弱筋小麦大曲则相反。为考察大曲样本细菌群落组成之间的差异,对细菌OTU数进行了基于Bray-curtis距离算法的非度量多维尺度(NMDS)分析(图2B)。图2B显示,stress<0.1,说明大曲样本在细菌OTU水平有很好的排序。来源于强筋小麦的CMD和DMD大曲样本分布在X轴的上方,中筋小麦BMD大曲和弱筋小麦EMD大曲样本则分别分布在Y轴的左右两侧,而中强筋混合花麦AMD大曲样本较为分散,这初步说明同品种小麦原料生产的CMD和DMD大曲有相似的细菌群落组成,不同品种的小麦大曲则由不同的细菌群落组成,而多个品种混合的小麦AMD大曲细菌菌落与其他4种大曲的细菌群落密切相关。
2.3.2 细菌群落组成分析
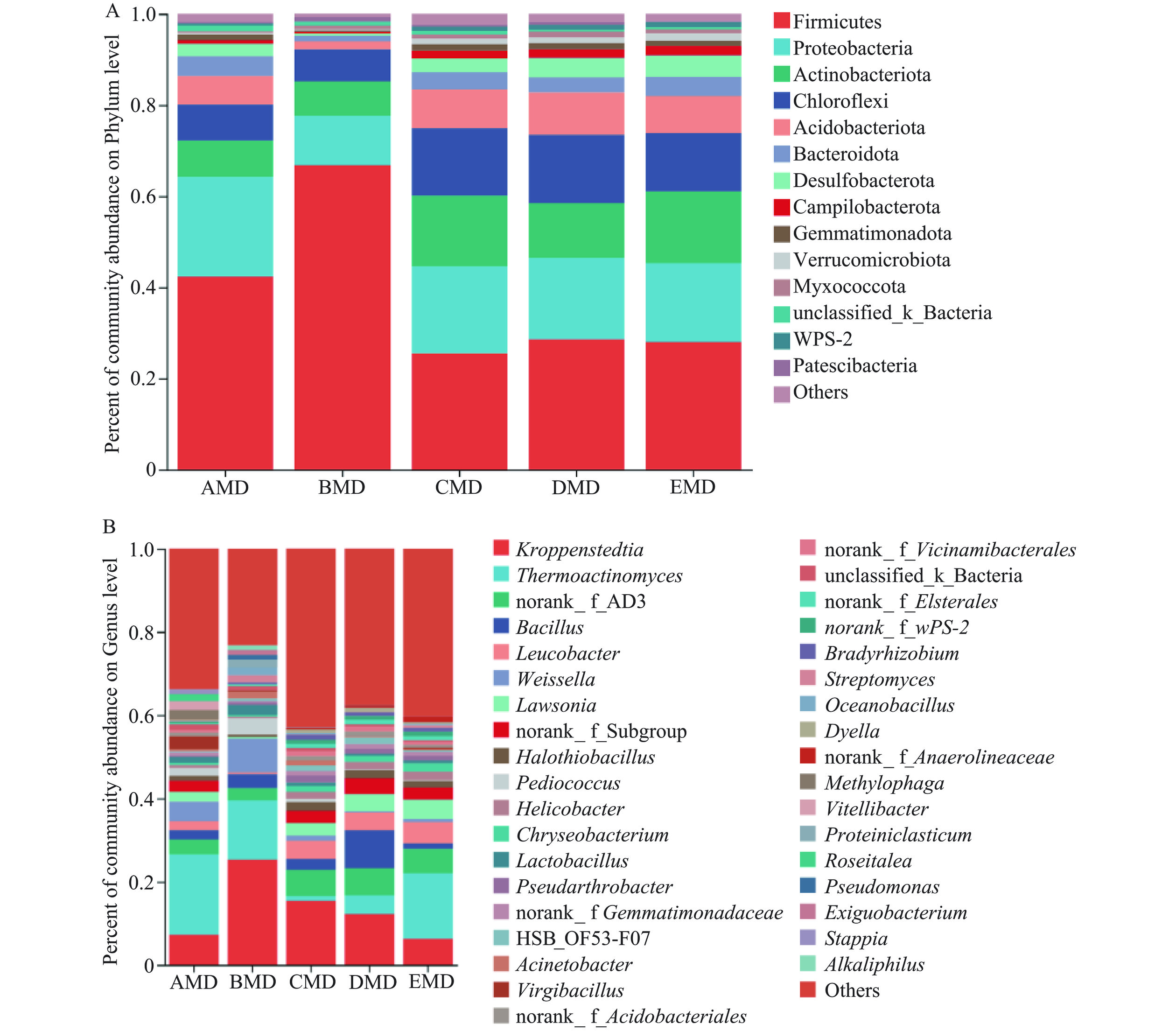
5种小麦中温大曲细菌群落组成(平均相对丰度>1.00%)如图3所示。大曲样本细菌组成均可归为14个细菌门,平均相对丰度位居前5的主要细菌门依次为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)和酸杆菌门(Acidobacteriota)。其中,前3个细菌门是浓香大曲普遍存在的优势菌门,这与以前的研究结果相一致[4]。前5个细菌门总相对丰度在所有大曲样本中均高于82.00%,但在BMD大曲中最高(达93.94%)。厚壁菌门为绝对优势菌门,其相对丰度均在25.0%以上,尤其在BMD大曲样本中占比最高(相对丰度为66.79%)。此外,放线菌门在BMD大曲样本中的相对丰度最低(1.74%),而在其他4种大曲中的相对丰度均较高(6.24%~9.25%)(图3A)。
在属水平,5种大曲样本共检测出36个优势细菌属(平均相对丰度>1.00%)。与其他4种小麦大曲相比,BMD大曲优势细菌属相对丰度占比最高(约80.00%),而CMD大曲有较低的优势细菌属总相对丰度(小于60.00%)。BMD大曲样本的Alpha多样性指数最低而CMD大曲样本的较高,这恰恰说明BMD大曲优势细菌属占比高而CMD大曲的优势细菌种属则更为丰富。所有大曲样本中,绝对优势细菌属为克罗彭斯特菌属(Kroppenstedtia)和高温放线菌属(Thermoactinomyces)(两者总相对丰度在16.40%~39.53%之间),其次为芽孢杆菌属(Bacillus)、亮杆菌属(Leucobacter)和魏斯氏菌属(Weissella)(图3B)。其中,优势芽孢杆菌属与本研究中可培养细菌属的鉴定结果相一致。BMD大曲样本中含有最高丰度的克罗彭斯特菌属(25.30%)和魏斯氏菌属(8.07%),且含有较高相对丰度的高温放线菌属(17.50%)。AMD和EMD大曲样本含有相对丰度最高的高温放线菌属(相对丰度>19.28%),而其在CMD和DMD大曲样本的相对丰度较低(1.11%和4.49%)。DMD大曲样本含有相对丰度最高的芽孢杆菌属(9.14%)和最低相对丰度的魏斯氏菌属,该结果可以用芽孢杆菌属会抑制乳酸菌生长的研究结果来解释[23]。
大曲中丰富的产酸微生物,有助于发酵过程中酸的积累,适度的酸度可以促进大曲部分功能性真菌如酵母菌、根霉菌、红曲霉菌等的生长,并抑制一些杂菌的生长,还可以促进酯类香气化合物的合成。魏斯氏菌属、片球菌属(Pediococcus)、乳杆菌属是中温大曲常见的一类乳酸菌,具有代谢产酸和促进风味物形成的功能[7]。尤其是魏斯氏菌属,具有耐高温的特性,常作为酱香高温大曲和浓香中温大曲的优势菌属[28],其不仅可以分泌代谢淀粉酶、酯化酶等丰富的酶类,而且还可促进吡嗪类等香气或香气前体物的产生[29],因此,大曲中魏斯氏菌属占比较高,有利于大曲品质的提升。上述结果说明,小麦品种不同,其大曲细菌种属组成也存在差异,主要表现为强筋小麦大曲不利于富集魏斯氏菌属,而中强筋和中筋小麦大曲则相反,由此推测,中强筋和中筋小麦提供的营养成分利于大曲魏斯氏菌属菌群生长利用,或其制备的大曲品质特性利于魏斯氏菌属菌群富集。因此,从富集功能菌角度而言,中强筋和中筋小麦大曲则更具有优势。
2.4 大曲挥发性风味化合物
2.4.1 不同小麦大曲中挥发性风味化合物的种类组成
从5个不同小麦品种成熟中温大曲样本中共检测到83种挥发性化合物,包括醇类、醛类、酮类、酸类、酯类、酚类、呋喃类,芳香化合物、含氮物质、含硫物质及其他物质共11类化合物(表4)。其中,醇类(16种)、醛类(11种)、酮(8种)、酸类(6种)、酯类(10种)、酚类(2种)、呋喃类(3种)、芳香化合物(12种)、含氮化合物(11种)、含硫化合物(1种)及其他化合物(3种)。其中,醇类、芳香化合物、醛类、含氮化合物及酯类物质最为丰富,这与前人的研究相一致[17,12−13]。而且,己醇、己醛、2–辛酮、己酸、丁酸乙酯、2,6-二丁基-4-甲苯酚、戊基呋喃、苯乙醇、四甲基吡嗪及丙位壬内酯分别在醇类、醛类、酮类、有机酸、酯类、酚类、呋喃类、芳香族化合物、含氮化合物及其他化合物中具有较高的相对含量,这些化合物与浓香中温大曲特征香气物组成基本一致[2,30],均存在于所有大曲样本中。除2-辛酮、苯乙醇外,其他化合物相对含量在5种小麦大曲中均存在显著差异,且CMD大曲中多数特征化合物的相对含量显著高于其他小麦大曲(P<0.05),如己醇、己醛、戊基呋喃、四甲基吡嗪、丙位壬内酯,而EMD大曲中有相对含量较高的己酸、2,6-二丁基-4-甲苯酚。AMD大曲有相对含量最低的丁酸乙酯,但己酸乙酯的相对含量最高,两种酯类在其他4种大曲样本中无显著差异(P>0.05)。己酸乙酯为浓香白酒的主体香气物,与丁酸乙酯同为浓香白酒香气的色谱骨架成分[31],这两种酯类在AMD大曲中的含量差异,可能归因于该小麦大曲可以富集产酯酶细菌菌群,且该酯酶能促进己酸乙酯的合成[31]。四甲基吡嗪,具有烘焙香的风味,是高温大曲和中温大曲的主要含氮物质[18,32],其形成与芽孢杆菌代谢产生3-羟基丁酮和铵途径有关[8]。四甲基吡嗪在CMD大曲和DMD大曲中的相对含量无显著差异,均最高,其他三种小麦大曲次之,这与5种小大曲好氧芽孢细菌菌落总数及其高通量测序细菌属的组成分析结果较为一致,由此说明,蛋白质含量高的小麦品种,适宜富集能促进四甲基吡嗪形成的芽孢杆菌菌群[33],这也基本符合我们以前的研究结果[34]。
表 4 不同小麦大曲的挥发性化合物(μg/g)Table 4. Volatile compounds in different daqu samples from different wheat varieties (μg/g)序号 保留时间(min) CAS号 挥发性化合物 AMD BMD CMD DMD EMD 醇类 V1 5.41 71-36-3 丁醇 0.92±0.16b 0.99±0.11b 0.59±0.84b 2.57±0.80a 2.55±1.96a V2 7.97 123-51-3 3-甲基-1-丁醇 4.85±0.22b 4.56±1.07b 4.78±0.60b 8.56±2.37ab 10.63±7.32a V3 8.44 504-61-0 2-丁醇 ND ND ND 0.81±0.20a 0.41±0.58b V4 13.37 111-27-3 1-己醇 10.94±0.78c 7.83±2.54d 22.06±0.33a 15.45±2.59b 15.57±2.95b V5 16.58 22104-80-9 2-癸烯-1-醇 ND 0.23±0.08 ND ND ND V6 16.69 3391-86-4 蘑菇醇 7.70±1.13a 2.52±1.07b 4.06±0.11b 7.03±1.58a 8.22±0.22a V7 16.79 111-70-6 庚醇 0.96±0.17ab 0.40±0.57b 1.30±0.16a 0.52±0.74b 0.94±0.12ab V8 17.92 104-76-7 乙基己醇 3.39±0.78a 3.11±1.16a 4.12±0.39a 4.11±0.45a 3.77±0.59a V9 18.55 33467-76-4 庚烯醇 ND ND 0.28±0.01a 0.27±0.01a ND V10 19.75 78-70-6 芳樟醇 0.25±0.05ab 0.19±0.12b ND 0.28±0.05ab 0.32±0.13a V11 20.6 19132-06-0 (S,S)-2,3-丁二醇 ND 0.11±0.06 ND ND ND V12 21.64 22104-78-5 2-辛烯醇 0.3±0.04b ND 0.21±0.01c 0.26±0.03bc 0.36±0.01a V13 22.32 21129-27-1 Dihydroterpineol 2.11±0.50a 2.17±1.14a ND 2.54±0.59a 2.45±0.37a V14 23.04 143-08-8 1-壬醇 0.42±0.04b 0.38±0.19b 0.57±0.01a 0.49±0.11ab 0.43±0.00b V15 24.89 22104-79-6 2-壬烯醇 ND 0.12±0.06b ND 0.20±0.04a 0.20±0.01a V16 32.61 21592-95-0 4,4,6-三甲基环己醇 ND ND 0.34±0.02a 0.16±0.05b ND 醛类 V17 0.96 15798-64-8 2-丁烯醛 31.14±2.29b 53.12±0.28a 26.35±6.68bc 20.61±6.89c 27.04±10.02bc V18 2.67 66-25-1 己醛 24.6±2.36cd 28.85±5.12bc 94.33±9.31a 35.01±10.94b 18.47±4.26e V19 6.95 111-71-7 正庚醛 0.58±0.13b 0.78±0.24b 1.32±0.10a 0.50±0.14b 0.39±0.55b V20 10.97 124-13-0 辛醛 0.69±0.13b 1.05±0.31ab 1.24±0.13a 0.80±0.28b 0.68±0.39b V21 14.67 124-19-6 壬醛 1.99±0.29b 3.04±1.37ab 3.92±0.21a 2.86±1.40ab 2.53±0.75b V22 17.8 51534-36-2 2-乙烯基十四醛 ND ND ND ND 0.27±0.07 V23 18.09 112-31-2 癸醛 0.79±0.11b 1.10±0.41ab 1.16±0.41ab 1.34±0.37ab 1.61±0.88a V24 19.18 18829-56-6 2-壬烯醛 0.52±0.01cd 0.94±0.49ab 1.25±0.26a 0.7±0.10bc 0.33±0.05d V25 24.29 6750--03-4 反式-2,4-壬二烯醛 ND 0.05±0.00b 0.23±0.11a ND ND V26 28.41 18362-36-2 6-甲基-2-羟基苯甲醛 ND ND ND 0.54±0.16 ND V27 30.08 51932-70-8 2,3-二羟-1氢-茚吡咯甲醛 0.64±0.03 ND ND ND ND 酮类 V28 6.8 110-43-0 2-庚酮 1.73±0.33b 1.89±0.64b 3.45±0.07a 2.84±0.52a 2.10±0.26b V29 10.8 111-13-7 2-辛酮 5.38±2.23a 3.18±1.93a 5.02±2.73a 4.00±2.3a 5.12±3.25a V30 12.74 110-93-0 6-甲基-5-庚烯-2-酮 1.32±0.22b 2.06±1.08ab 1.73±0.29ab 2.42±0.95a 2.48±0.41a V31 15.07 1669-44-9 3-辛烯酮 0.47±0.07bc 0.29±0.41bc 1.65±0.11a 0.54±0.12b 0.17±0.23c V32 20.23 30086-02-3 3,5-辛二烯酮 ND ND 0.66±0.25 ND ND V33 20.37 6137-26-4 4-十二酮 ND ND ND 0.28±0.08 ND V34 21.13 112-12-9 2-十一酮 0.51±0.08ab 0.37±0.21b 0.47±0.30ab 0.75±0.43a 0.25±0.05b V35 22.56 98-86-2 苯乙酮 0.33±0.05a 0.29±0.21a 0.19±0.27a 0.32±0.02a 0.26±0.36a 酸类 V36 17 64-19-7 乙酸 0.83±0.21ab 0.27±0.38b 0.55±0.77ab 0.89±1.26ab 2.20±2.38a V37 23.55 503-74-2 异戊酸 0.91±0.03a 0.70±0.36a 0.49±0.69ab ND 0.76±0.43a V38 23.55 105-43-1 3-甲基戊酸 ND ND 0.59±0.84b 1.16±0.48a ND V39 28.5 142-62-1 己酸 1.67±0.34bc 1.53±1.22bc 2.40±0.08ab 0.66±0.93c 3.02±1.10a V40 30.63 701-97-3 3-环己基丙酸 ND 0.06±0.04 ND ND ND V41 34.07 2091-29-4 棕榈油酸 ND ND ND ND 0.15±0.05 酯类 V42 0.87 105-54-4 丁酸乙酯 24.82±2.60b 38.76±2.00ab 59.46±11.53a 65.02±41.04a 43.43±4.17ab V43 1.48 7452-79-1 2-甲基丁酸乙酯 4.47±0.26c 7.04±1.22b 9.34±0.09b 13.02±2.58a 7.21±2.75b V44 2.17 108-64-5 异戊酸乙酯 5.49±0.30b 8.33±2.82b 8.15±0.81b 17.64±6.87a 8.46±2.91b V45 4.98 539-82-2 戊酸乙酯 2.27±0.46a 1.46±2.06a 1.67±0.50a 1.19±1.69a 2.81±1.19a V46 8.97 123-66-0 己酸乙酯 32.7±9.73a 12.64±13.81b 18.88±9.02ab 16.33±8.82ab 24.12±3.28ab V47 18.56 47557-83-5 亚油酸苯甲酯 0.23±0.03 ND ND ND ND V48 28.83 74367-31-0 异丁酸2-乙基-3-羟基己酯 ND 0.10±0.04 ND ND ND V49 35.21 628-97-7 棕櫚酸乙酯 0.52±0.06b 0.45±0.52b 0.39±0.03b 0.32±0.20b 0.96±0.44a V50 38.17 6114-18-7 反式-油酸乙酯 0.25±0.02a 0.34±0.37a 0.27±0.01a 0.25±0.13a 0.43±0.10a V51 38.89 544-35-4 亚油酸乙酯 0.5±0.04a 0.58±0.61a 0.43±0.02a 0.45±0.23a 0.72±0.33a 酚类 V52 29.8 128-37-0 2,6-二丁基-4-甲基苯酚 ND ND ND 8.60±7.67b 14.06±0.48a V53 34.48 7786-61-0 乙烯基愈创木酚 0.09±0.07b 0.09±0.06b 0.13±0.01ab 0.15±0.03ab 0.20±0.06a 呋喃类 V54 8.84 3777-69-3 戊基呋喃 0.92±0.21bc 0.92±0.45bc 2.77±1.89a 2.17±1.39ab 0.54±0.11c V55 23.16 98-00-0 糠醇 ND ND 0.61±0.19a 0.54±0.77a ND V56 23.17 4412-91-3 3-呋喃甲醇 0.37±0.03b 0.30±0.10b ND ND 0.75±0.59a 芳香化合物 V57 4.04 100-41-4 乙基苯 2.2±0.69b 2.69±1.08ab 2.38±0.16ab 3.60±1.12a 2.27±0.19b V58 4.92 106-42-3 对二甲苯 ND ND ND ND 1.58±0.25 V59 9.55 100-42-5 苯乙烯 0.64±0.02b 3.88±1.59ab 3.96±5.6ab 6.7±0.00a 4.15±1.29ab V60 18.77 100-52-7 苯甲醛 4.54±0.52ab 3.77±2.26ab 5.02±0.13a 3.07±0.70b 2.93±0.37b V61 22.41 122-78-1 苯乙醛 0.86±0.11a 0.84±0.38a 1.17±0.07a 0.35±0.50b 0.78±0.18a V62 25.31 91-16-7 邻苯二甲醚 0.73±0.06b 0.36±0.19c 0.98±0.02b 1.36±0.42a 0.87±0.13b V63 25.58 150-78-7 对苯二甲醚 0.23±0.02ab 0.16±0.09b 0.31±0.01a 0.30±0.07a 0.27±0.05a V64 26.91 101-97-3 苯乙酸乙酯 0.32±0.04b 0.27±0.17b 0.33±0.06b 0.57±0.23a 0.41±0.06ab V65 27.63 89-95-2 邻甲基苄醇 0.20±0.02a 0.15±0.08a 0.1±0.15ab 0.09±0.13ab ND V66 29.04 100-51-6 苯甲醇 1.36±0.06abc 0.94±0.72bc 1.53±0.14ab 0.88±0.27c 1.82±0.64a V67 29.72 60-12--8 苯乙醇 12.17±0.72a 10.73±5.70a 16.15±0.68a 14.06±5.37a 13.13±4.68a V68 32.02 6380-23-0 3,4-二甲氧基苯乙烯 0.43±0.04a 0.32±0.20a 0.51±0.07a 0.56±0.21a 0.52±0.26a 含氮化合物 V69 9.94 109-08-0 2-甲基吡嗪 ND 0.40±0.15ab 0.51±0.03a 0.49±0.70a 0.73±0.19a V70 11.96 123-32-0 2,5-二甲基吡嗪 1.49±0.04b 0.87±0.30c 1.61±0.01b 2.52±0.74a 1.34±0.34bc V71 12.19 108-50-9 2,6-二甲基吡嗪 2.40±0.06ab 2.18±0.81b 2.75±0.61ab 2.93±0.50a 2.29±0.28ab V72 12.82 5910-89-4 2,3-二甲基吡嗪 0.39±0.03ab ND 0.85±0.22a 0.84±0.40a 0.43±0.61ab V73 14.2 13360-64-0 2-乙基-5-甲基吡嗪 0.28±0.20b 0.63±0.30a ND ND ND V74 14.38 13925-03-6 2乙基-6-甲基吡嗪 0.38±0.07b 0.63±0.30a 0.57±0.04ab 0.60±0.17ab ND V75 14.8 14667-55-1 三甲基吡嗪 2.20±0.20b 1.97±0.61b 4.02±0.30a 4.15±1.28a 1.83±0.04b V76 17.11 1124-11-4 四甲基吡嗪 1.01±0.01b 0.76±0.34b 4.55±0.39a 4.06±1.81a 1.2±0.50b V77 17.69 13925-09-2 2-甲基-6-乙烯基吡嗪 0.86±0.05b 0.96±0.60b 1.42±0.06a 1.02±0.41ab 0.76±0.10b V78 23.35 95-21-6 2-甲基苯并唑 ND 0.10±0.04b 0.16±0.02a ND ND V79 30.88 1072-82-8 3-乙酰基吡咯 ND 0.27±0.15a ND ND 0.07±0.10b 含硫化合物 V80 13.83 3658-80-8 二甲基三硫 ND ND 0.28±0.01 ND ND 其它化合物 V81 20.72 13877-93-5 茴香醛 0.42±0.04 ND ND ND ND V82 31.82 104-61-0 丙位壬内酯 0.32±0.03b 0.32±0.16b 0.67±0.00a 0.39±0.12b 0.37±0.12b V83 35.05 134-20-3 邻氨基苯甲酸甲酯 0.16±0.01a 0.13±0.07a ND 0.18±0.07a 0.17±0.07a 注:数值为平均值±标准差(SD);不同字母代表显著性差异(P<0.05);“ND”为未检出。 中温大曲样本中11类挥发性风味化合物的含量及其差异性如图4所示。11类风味化合物中,除芳香类化合物在5种大曲样本中无显著差异外(P>0.05),其他种类化合物在大曲样本中均有显著差异(P<0.05),且表现最为明显的是醛类、酯类、醇类化合物及含氮化合物。醛类和酯类化合物的平均相对总含量均高于其他种类化合物,且分别在CMD和DMD大曲中表现最高,均显著高于其他大曲样本(P<0.05),与之类似的还有含氮化合物。醛类物质是白酒风味物质的重要组成部分,如己醛、庚醛、辛醛、壬醛等表现出青香、水果香和花香,但也有部分醛类会产生刺激及油脂气味,如己醛、戊醛、丁烯醛、壬烯醛等[35]。有研究表明,发酵食品中醛酮类化合物主要来源于丙酮酸的醇醛代谢、脂肪氧化及氨基酸的降解途径[36−37],强筋小麦CMD大曲有相对含量最高的醛酮类化合物,这可能与原料小麦高含量的蛋白质及其降解生产氨基酸有关。酯类物质,具有典型的花香和水果香,对很多发酵食品具有明显的提香作用[38]。四大酯类即己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯作为浓香白酒香气物质的色谱骨架成分,其比例协调利于提高酒质[39]。大曲酯类化合物的合成主要来源于酰基辅酶A参与脂肪酸与醇类的酯化合成途径[8,40]。酯类化合物在DMD大曲样本中相对含量最高,由此推测,该品种小麦大曲利于细菌代谢产生酰基辅酶A,促进了酯类物质的合成。5种大曲共检出16种醇类化合物,且均为高级醇。其中,DMD大曲高级醇种类最多(14种),而CMD大曲最少(10种),其他三种大曲高级醇种类均在10~14之间(表4),醇类化合物的总相对含量在DMD和EMD大曲中最高,而在CMD大曲中最低。高级醇在浓香白酒中占有重要地位,具有增甜和增香功能,但其浓度过高,易产生令人不愉快的刺激感。高级醇的合成主要来源于Ehrlich降解代谢途径和糖代谢合成氨基酸途径[41]。这两种途径均为氨基酸的合成途径,有氮元素参与,由此推测,大曲高级醇的形成与原料小麦蛋白质密切相关。有研究指出,在微生物生长代谢的底物中,氨基酸含量过高或氮元素利用过低,均会形成高级醇[41]。同为强筋小麦DMD和CMD大曲,原料小麦蛋白质含量均较高,而大曲高级醇的种类及其含量并不相同,这很可能是微生物对氮源的利用程度不同而导致。
2.4.2 基于PLS-DA的大曲差异风味化合物分析
偏最小二乘法判别分析(PLS_DA)是有监督分析算法,可以更直观的理解样本组间的分布情况,从而揭示样本组间的差异性和相似性。本研究以83种挥发性风味化合物为X变量,5种大曲样本为Y变量进行PLS-DA分析,所建立的PLS-DA模型置换检验R2和Q2的值分别为0.415和−0.962、R2Y(cum)和Q2(cum)值分别为0.978和0.911,说明模型没有过度拟合,具有较好的准确性和预测性。以第一主成分和第二主成分为横纵坐标建立的大曲样本和挥发性化合物的相关性得分图如图5A所示。15个小麦大曲样本相似度在95%的置信区间内,各大曲样本表现出明显的聚类趋势。AMD、BMD和EMD大曲样本在第一主成分上与CMD和DMD大曲样本明显区分,而AMD、BMD大曲样本在第二主成分上与EMD大曲样本有明显区分,且CMD和DMD大曲样本区分也较为明显,但AMD和BMD大曲样本距离较近,不能进行区分。大曲样本的这种分布结果说明了小麦品种影响大曲挥发性代谢物的组成。VIP分析显示,5个大曲样本有43种差异挥发性化合物(VIP>1.0,P<0.05),主要包括10种醇类、7种醛类、3种酮类、3种酸类、4种酯类、1种酚类、2种呋喃类、4芳香化合物、7种含氮物质、2种含硫化合物及其他化合物(图5B),且这些化合物中的大多数如己醇(V4)、2-甲基丁酸乙酯(V43)、异戊酸乙酯(V44)、四甲基吡嗪(V44)等在强筋小麦CMD大曲和DMD大曲均有较高的相对含量,可作为强筋小麦大曲区别于其他小麦大曲的挥发性代谢化合物的标志物,而丁烯醛(V17)可作为中筋小麦大曲BMD的挥发性代谢化合物的标志物。
2.5 细菌群落与大曲挥发性化合物及小麦品质指标的相关性分析
基于Spearman相关性分析的网络可视化图显示了5种小麦大曲差异挥发性化合物、小麦品质指标与相对丰度大于1%的优势细菌属之间的关系(图6)。图6可知,与16个细菌属有显著相关性的差异化合物有24种。其中,呈显著正相关的细菌属主要表现为克罗彭斯特菌属、链霉菌属(Streptomyces)、戴氏菌属(Dyella)、无色杆菌属(Achromobacter)、金黄杆菌属(Chryseobacterium)、亮杆菌属(Leucobacter)、螺杆菌(Helicobacter)、劳森菌(Lawsonia)、根瘤菌属(Bradyrhizobium)、枝芽孢杆菌属(Virgibacillus)及部分未分类的细菌属(如unclassified_d_Bacteria、norank_f_Acidobacteriales、norank_f_Vicinamibacterales),且这些细菌属的大多数与己醇(V4)、2-丁烯醛(V17)、2,5-二甲基吡嗪(V70)、1,2-二甲氧基苯(V58)、四甲基吡嗪(V76)、4,4,6-三甲基环己醇(V16)、庚2-烯醇(V5)及2-甲基丁酸乙酯(V43)呈显著的正相关(P<0.05),而魏斯氏菌和高温放线菌属与这些化合物呈显著的负相关(P>0.05),而且未发现芽孢杆菌属与四甲基吡嗪有明显的正相关。有研究指出,魏斯氏菌和高温放线菌属是中温大曲的优势菌属[42],魏斯氏菌属具有产乳酸功能[8],且与吡嗪类化合物呈显著正相关[11],高温放线菌属也可以代谢产生吡嗪类等香气或香气前体物[29],芽孢杆菌属是大曲吡嗪类风味物主要产生菌[8,28],这与本研究结果不一致。原因可能是大曲样本中复杂细菌种属之间以及细菌与真菌种属之间的相互作用削弱了魏斯氏菌和高温放线菌属的产香功能,如芽孢杆菌属接种应用于强化大曲的培养,能抑制乳酸菌生长[12];乳酸菌与酵母共培养时,乳酸菌代谢产酸形成不同的酸性环境,会影响酵母菌的代谢活动,弱酸环境可促进酵母产香[43],强酸环境则可抑制酵母产乙醇[44]。由此推测,相对丰度较高的魏斯氏菌在大曲发酵或成熟过程中分泌代谢乳酸形成了大曲较高的酸性环境,抑制了芽孢杆菌属或高温放线菌属代谢产生吡嗪类化合物的功能,这恰与魏斯氏菌相对丰度在AMD和BMD大曲中较高而在DMD大曲中较低、芽孢杆菌相对丰度则与之相反的结果相一致。此外,乙酰吡咯(V79)、异丁酸,2-乙基-3-羟基己酯(V48)、3-环己基丙酸(V40)、2-癸烯醇(V5)和(S,S)-2,3丁二醇(V11)与克罗彭斯特菌属、链霉菌属、高温放线菌属、未知细菌属、魏斯氏菌属、不动杆菌属(Acinetobacter)呈显著正相关。克罗彭斯特菌属与多数挥发风味物呈显著正相关,是小麦中温大曲的优势功能菌,该菌属高温放线菌菌科,适合生长于高温高湿的环境,是浓香中温大曲普遍存在的细菌属,其代谢活动与大曲酯类等风味物密切相关[45]。综上所述,本研究中,属于高温放线菌科的克罗彭斯特菌属、高温放线菌属、链霉菌属,耐热性的芽孢菌如枝芽孢杆菌属以及乳酸菌魏斯氏菌属是小麦中温大曲的主要挥发性风味产生菌,这与其他学者研究结果相一致[46−47]。
![]() 图 6 大曲样本中优势细菌属与差异挥发性化合物及小麦品质指标的相关性网络可视化注:节点代表显著相关的细菌属和差异挥发性化合物(VIP评分>1.0)及小麦品质指标;红线和绿线分别代表正相关(ρ>0.6且P<0.05)和负相关(|ρ|>0.6,ρ<0且P<0.05);绿色菱形代表差异挥发性风味物(序号对应于表1化合物);红色和橙色六边形分别代表细菌属和小麦品质指标。Figure 6. Network visualization of the correlation between dominant bactrial genera in daqu samples, differential volatile compounds,and quality indexes of wheat
图 6 大曲样本中优势细菌属与差异挥发性化合物及小麦品质指标的相关性网络可视化注:节点代表显著相关的细菌属和差异挥发性化合物(VIP评分>1.0)及小麦品质指标;红线和绿线分别代表正相关(ρ>0.6且P<0.05)和负相关(|ρ|>0.6,ρ<0且P<0.05);绿色菱形代表差异挥发性风味物(序号对应于表1化合物);红色和橙色六边形分别代表细菌属和小麦品质指标。Figure 6. Network visualization of the correlation between dominant bactrial genera in daqu samples, differential volatile compounds,and quality indexes of wheat制曲小麦的主要品质与组成成分指标如容重(Unit weight)、硬度(Hardness)、粉质率(Powder rate)、粗蛋白(Protein)、湿面筋(Wet gluten)、粗淀粉(Starch)、脂肪(Fat)及灰分(Ash)与18个细菌属(包括16个差异风味物显著相关的细菌属和2个优势细菌属)的相关性分析如图6所示。与细菌属呈显著相关的小麦指标主要表现为粗蛋白(或湿面筋)、角质率、粗淀粉,次之为容重、硬度和脂肪,最后为灰分。原料小麦的粉质率、粗蛋白和湿面筋含量与Halothiobacillus、norank_f_Acidobacteriales、norank_f_Vicinamibacterales呈显著正相关(P<0.05),而与链霉菌属、魏斯氏菌属呈显著负相关。此外,粉质率与克罗彭斯特菌属,粗蛋白和湿面筋含量与高温放线菌属、芽孢乳杆菌属、不动杆菌属,小麦硬度与枝芽孢杆菌属呈显著负相关,而粗淀粉与高温放线菌属、魏斯氏菌属呈显著的正相关,而与芽孢杆菌属呈显著负相关。由此表明,制曲小麦蛋白或湿面筋对中温大曲细菌属的影响与淀粉的影响则是一对相反的关系,这与之前的研究结果相一致[34]。同时,上述结果还说明,高淀粉低蛋白的原料小麦可能更利于中温大曲富集高温放线菌属、魏斯氏菌属,而高蛋白、高硬度的原料小麦可能更有利于大曲富集耐热的芽孢细菌如Halothiobacillus和枝芽孢杆菌属。本研究初步明确了小麦主要品质指标与中温大曲功能细菌属和优势细菌属的相关性,但原料小麦品种对大曲不同功能细菌的富集机制及其代谢活动的影响值得进一步研究和探索。
3. 结论
根据粗蛋白含量,5种制曲小麦分为四类即WC和WD为强筋小麦,WA为中强筋小麦,WB和WE分别为中筋和弱筋小麦。四类小麦的品质特性存在差异,强筋小麦WC具有最高的粉质率和硬度,中筋小麦WB则相反,但强筋小麦WD的粉质率和硬度接近中筋小麦WB。原料小麦的品质特性影响中温大曲的挥发性风味化合物组成和细菌群落结构。5种中温大曲中共检测出11类挥发性风味化合物,但不同小麦大曲的酯类、醛类、醇类及含氮化合物具有显著差异。强筋小麦大曲CMD和DMD有相对含量较高的醛酮类、酯类及含氮化合物,而中筋小麦大曲BMD有相对含量最低的醇类化合物。基于83种大曲挥发性风味化合物建立的PLS-DA模型明确了43种差异挥发性化合物(VIP>1.0),可以明确区分强筋小麦大曲和中筋弱筋小麦大曲样本,且己醇、2-甲基丁酸乙酯、异戊酸乙酯、四甲基吡嗪可作为强筋小麦大曲区分其他大曲特征挥发性代谢化合物,而丁烯醛可作为中筋小麦大曲的特征挥发性代谢化合物,从而可以初步实现从大曲特征挥发性风味化合物角度筛选原料小麦品种。可培养方法联合高通量测序技术分析的可培养细菌菌落总数及细菌菌群组成在5种小麦大曲中也存在一定的差异。芽孢杆菌属是大曲可培养优势细菌属,但大曲CMD和DMD样本均有最高的菌落总数,而BMD和EMD大曲样本分别有最高的细菌和产酸菌菌落总数。克罗彭斯特菌属、高温放线菌属、芽孢杆菌属、亮杆菌属和魏斯氏菌属是5种中温大曲的主要优势细菌属,但其在5种大曲样本中相对丰度并不一致,中强筋小麦大曲AMD和中筋小麦大曲BMD含有相对丰度较高的高温放线菌属和魏斯氏菌属,而强筋小麦大曲CMD和DMD则相反,且发现克罗彭斯特菌属、链霉菌属、高温放线菌属、魏斯氏菌属及部分未分类的细菌属(如unclassified_d_Bacteria、norank_f_Acidobacteriales、norank_f_Vicinamibacterales)与差异挥发性风味化合物呈显著正相关性,由此说明,相比强筋小麦和弱筋小麦,中筋小麦和中强筋小麦生产的大曲优势细菌属与大曲挥发性风味化合物的正相关性更强,原因可能是在相同的制曲工艺条件下,中筋小麦和中强筋小麦含有中等含量的蛋白质、高含量淀粉及适宜的粉质率,利于大曲成型并有相对较好的品质,能够促进优势细菌较好的利于原料的营养元素进行生长、富集及代谢,这与功能细菌与原料小麦粉质率、粗蛋白(或湿面筋)含量、粗淀粉含量的相关性分析结果相一致。整体上,就富集功能细菌而言,中强筋小麦和中筋小麦大曲更具有优势。该研究结果初步为浓香白酒制曲小麦品种的选育及其制曲应用提供了有效信息,同时也为不同品种原料小麦在大曲生产中的合理化选择提供了可靠的理论依据。
-
图 6 大曲样本中优势细菌属与差异挥发性化合物及小麦品质指标的相关性网络可视化
注:节点代表显著相关的细菌属和差异挥发性化合物(VIP评分>1.0)及小麦品质指标;红线和绿线分别代表正相关(ρ>0.6且P<0.05)和负相关(|ρ|>0.6,ρ<0且P<0.05);绿色菱形代表差异挥发性风味物(序号对应于表1化合物);红色和橙色六边形分别代表细菌属和小麦品质指标。
Figure 6. Network visualization of the correlation between dominant bactrial genera in daqu samples, differential volatile compounds,and quality indexes of wheat
表 1 制曲小麦主要品质特性与主要组成成分
Table 1 Indexes of the properties and components of different wheat for daqu making
小麦样本 特性指标 成分指标 硬度
(%)容重
(g/L)粉质率
(%)水分
(%)粗淀粉
(%)粗蛋白
(%)湿面筋
(%)灰分
(%)脂肪
(%)WA 62.44±0.24c 785.27±14.62b 60.00±2.00b 12.38±0.06b 69±0.12abc 13.69±0.17b 28.63±0.19b 1.77±0.06a 2.67±0.01a WB 55.93±0.2e 800.43±2.07ab 11.00±2.00e 11.78±0.01c 69.63±1.03ab 12.92±0.33c 27.17±0.12c 1.72±0.04ab 2.15±0.05c WC 67.95±0.79a 807.7±18.38a 95.00±5.00a 11.12±0.05d 68.07±0.07c 14.2±0.29a 29.07±0.08a 1.73±0.03ab 1.65±0.08d WD 54.02±1.24d 814.97±4.97a 28.00±1.00d 11.11±0.03d 68.83±0.17bc 14.07±0.05ab 29.03±0.019a 1.62±0.02c 2.18±0.11c WE 64.14±0.68b 764.67±5.66c 43.00±3.00c 12.51±0.06a 70.1±0.9a 12.31±0.05d 25.4±0.28d 1.67±0.059bc 2.36±0.01b 注:数值为平均值±标准差(SD),同列不同字母代表显著性差异(P<0.05)。 表 2 可培养细菌种属的BLAST比对鉴定及在不同大曲样本中的分布
Table 2 Identification of the culture-dependent bacterial species by BLAST and its distribution in different daqu
细菌种属 同源性(%) GenBank
序列号AMD BMD CMD DMD EMD Cronobacter turicensis 98 NR_044061.1 1 Enterobacter cloacae 99 NR_117679.1 2 3 2 Enterobacter hormaechei 97 NR_042154.1 1 Enterococcus faecalis 99 NR114782.1 1 1 1 1 Enterococcus durans 100 NR117562.1 1 Lactobacillus plantarum 100 NR117813.1 1 1 1 1 Bacillus xiamenensis 100 MT133332.1 1 Bacillus velezensis 100 KT583454.1 2 2 2 Bacillus sp. 97 MN826447.1 1 1 1 1 Bacillus subtilis 99 NR_112116.2 3 3 1 1 1 Bacillus cereus 98 OM900179.1 2 1 1 Bacillus licheniformis 97 MH000674.1 6 3 5 5 5 Bacillus amyloliquefaciens 98 OQ701391.1 1 1 1 Bacillus tequilensis 97 OQ405609.1 1 Priestia aryabhattai 97 OM188392.1 1 1 Priestia megaterium 97 MH261115.1 2 1 1 1 注:大曲样本对应数字为鉴定的菌株数量。 表 3 大曲细菌群落的Alpha多样性指数
Table 3 Alpha diversity index of fungal communities in daqu
样本 OTUs Sobs Shannon Chao1 Coverage AMD 295 295.00±63.51 3.98±1.05 342.70±66.80 99.94% BMD 174 173.70±22.30 3.05±0.97 211.20±33.52 99.95% CMD 1240 1240.00±896.70 5.04±1.63 1344.00±973.40 99.80% DMD 1213 1213.00±866.80 4.91±1.75 1300.00±873.20 99.82% EMD 202 201.70±26.73 4.12±0.68 245.70±25.77 99.96% 表 4 不同小麦大曲的挥发性化合物(μg/g)
Table 4 Volatile compounds in different daqu samples from different wheat varieties (μg/g)
序号 保留时间(min) CAS号 挥发性化合物 AMD BMD CMD DMD EMD 醇类 V1 5.41 71-36-3 丁醇 0.92±0.16b 0.99±0.11b 0.59±0.84b 2.57±0.80a 2.55±1.96a V2 7.97 123-51-3 3-甲基-1-丁醇 4.85±0.22b 4.56±1.07b 4.78±0.60b 8.56±2.37ab 10.63±7.32a V3 8.44 504-61-0 2-丁醇 ND ND ND 0.81±0.20a 0.41±0.58b V4 13.37 111-27-3 1-己醇 10.94±0.78c 7.83±2.54d 22.06±0.33a 15.45±2.59b 15.57±2.95b V5 16.58 22104-80-9 2-癸烯-1-醇 ND 0.23±0.08 ND ND ND V6 16.69 3391-86-4 蘑菇醇 7.70±1.13a 2.52±1.07b 4.06±0.11b 7.03±1.58a 8.22±0.22a V7 16.79 111-70-6 庚醇 0.96±0.17ab 0.40±0.57b 1.30±0.16a 0.52±0.74b 0.94±0.12ab V8 17.92 104-76-7 乙基己醇 3.39±0.78a 3.11±1.16a 4.12±0.39a 4.11±0.45a 3.77±0.59a V9 18.55 33467-76-4 庚烯醇 ND ND 0.28±0.01a 0.27±0.01a ND V10 19.75 78-70-6 芳樟醇 0.25±0.05ab 0.19±0.12b ND 0.28±0.05ab 0.32±0.13a V11 20.6 19132-06-0 (S,S)-2,3-丁二醇 ND 0.11±0.06 ND ND ND V12 21.64 22104-78-5 2-辛烯醇 0.3±0.04b ND 0.21±0.01c 0.26±0.03bc 0.36±0.01a V13 22.32 21129-27-1 Dihydroterpineol 2.11±0.50a 2.17±1.14a ND 2.54±0.59a 2.45±0.37a V14 23.04 143-08-8 1-壬醇 0.42±0.04b 0.38±0.19b 0.57±0.01a 0.49±0.11ab 0.43±0.00b V15 24.89 22104-79-6 2-壬烯醇 ND 0.12±0.06b ND 0.20±0.04a 0.20±0.01a V16 32.61 21592-95-0 4,4,6-三甲基环己醇 ND ND 0.34±0.02a 0.16±0.05b ND 醛类 V17 0.96 15798-64-8 2-丁烯醛 31.14±2.29b 53.12±0.28a 26.35±6.68bc 20.61±6.89c 27.04±10.02bc V18 2.67 66-25-1 己醛 24.6±2.36cd 28.85±5.12bc 94.33±9.31a 35.01±10.94b 18.47±4.26e V19 6.95 111-71-7 正庚醛 0.58±0.13b 0.78±0.24b 1.32±0.10a 0.50±0.14b 0.39±0.55b V20 10.97 124-13-0 辛醛 0.69±0.13b 1.05±0.31ab 1.24±0.13a 0.80±0.28b 0.68±0.39b V21 14.67 124-19-6 壬醛 1.99±0.29b 3.04±1.37ab 3.92±0.21a 2.86±1.40ab 2.53±0.75b V22 17.8 51534-36-2 2-乙烯基十四醛 ND ND ND ND 0.27±0.07 V23 18.09 112-31-2 癸醛 0.79±0.11b 1.10±0.41ab 1.16±0.41ab 1.34±0.37ab 1.61±0.88a V24 19.18 18829-56-6 2-壬烯醛 0.52±0.01cd 0.94±0.49ab 1.25±0.26a 0.7±0.10bc 0.33±0.05d V25 24.29 6750--03-4 反式-2,4-壬二烯醛 ND 0.05±0.00b 0.23±0.11a ND ND V26 28.41 18362-36-2 6-甲基-2-羟基苯甲醛 ND ND ND 0.54±0.16 ND V27 30.08 51932-70-8 2,3-二羟-1氢-茚吡咯甲醛 0.64±0.03 ND ND ND ND 酮类 V28 6.8 110-43-0 2-庚酮 1.73±0.33b 1.89±0.64b 3.45±0.07a 2.84±0.52a 2.10±0.26b V29 10.8 111-13-7 2-辛酮 5.38±2.23a 3.18±1.93a 5.02±2.73a 4.00±2.3a 5.12±3.25a V30 12.74 110-93-0 6-甲基-5-庚烯-2-酮 1.32±0.22b 2.06±1.08ab 1.73±0.29ab 2.42±0.95a 2.48±0.41a V31 15.07 1669-44-9 3-辛烯酮 0.47±0.07bc 0.29±0.41bc 1.65±0.11a 0.54±0.12b 0.17±0.23c V32 20.23 30086-02-3 3,5-辛二烯酮 ND ND 0.66±0.25 ND ND V33 20.37 6137-26-4 4-十二酮 ND ND ND 0.28±0.08 ND V34 21.13 112-12-9 2-十一酮 0.51±0.08ab 0.37±0.21b 0.47±0.30ab 0.75±0.43a 0.25±0.05b V35 22.56 98-86-2 苯乙酮 0.33±0.05a 0.29±0.21a 0.19±0.27a 0.32±0.02a 0.26±0.36a 酸类 V36 17 64-19-7 乙酸 0.83±0.21ab 0.27±0.38b 0.55±0.77ab 0.89±1.26ab 2.20±2.38a V37 23.55 503-74-2 异戊酸 0.91±0.03a 0.70±0.36a 0.49±0.69ab ND 0.76±0.43a V38 23.55 105-43-1 3-甲基戊酸 ND ND 0.59±0.84b 1.16±0.48a ND V39 28.5 142-62-1 己酸 1.67±0.34bc 1.53±1.22bc 2.40±0.08ab 0.66±0.93c 3.02±1.10a V40 30.63 701-97-3 3-环己基丙酸 ND 0.06±0.04 ND ND ND V41 34.07 2091-29-4 棕榈油酸 ND ND ND ND 0.15±0.05 酯类 V42 0.87 105-54-4 丁酸乙酯 24.82±2.60b 38.76±2.00ab 59.46±11.53a 65.02±41.04a 43.43±4.17ab V43 1.48 7452-79-1 2-甲基丁酸乙酯 4.47±0.26c 7.04±1.22b 9.34±0.09b 13.02±2.58a 7.21±2.75b V44 2.17 108-64-5 异戊酸乙酯 5.49±0.30b 8.33±2.82b 8.15±0.81b 17.64±6.87a 8.46±2.91b V45 4.98 539-82-2 戊酸乙酯 2.27±0.46a 1.46±2.06a 1.67±0.50a 1.19±1.69a 2.81±1.19a V46 8.97 123-66-0 己酸乙酯 32.7±9.73a 12.64±13.81b 18.88±9.02ab 16.33±8.82ab 24.12±3.28ab V47 18.56 47557-83-5 亚油酸苯甲酯 0.23±0.03 ND ND ND ND V48 28.83 74367-31-0 异丁酸2-乙基-3-羟基己酯 ND 0.10±0.04 ND ND ND V49 35.21 628-97-7 棕櫚酸乙酯 0.52±0.06b 0.45±0.52b 0.39±0.03b 0.32±0.20b 0.96±0.44a V50 38.17 6114-18-7 反式-油酸乙酯 0.25±0.02a 0.34±0.37a 0.27±0.01a 0.25±0.13a 0.43±0.10a V51 38.89 544-35-4 亚油酸乙酯 0.5±0.04a 0.58±0.61a 0.43±0.02a 0.45±0.23a 0.72±0.33a 酚类 V52 29.8 128-37-0 2,6-二丁基-4-甲基苯酚 ND ND ND 8.60±7.67b 14.06±0.48a V53 34.48 7786-61-0 乙烯基愈创木酚 0.09±0.07b 0.09±0.06b 0.13±0.01ab 0.15±0.03ab 0.20±0.06a 呋喃类 V54 8.84 3777-69-3 戊基呋喃 0.92±0.21bc 0.92±0.45bc 2.77±1.89a 2.17±1.39ab 0.54±0.11c V55 23.16 98-00-0 糠醇 ND ND 0.61±0.19a 0.54±0.77a ND V56 23.17 4412-91-3 3-呋喃甲醇 0.37±0.03b 0.30±0.10b ND ND 0.75±0.59a 芳香化合物 V57 4.04 100-41-4 乙基苯 2.2±0.69b 2.69±1.08ab 2.38±0.16ab 3.60±1.12a 2.27±0.19b V58 4.92 106-42-3 对二甲苯 ND ND ND ND 1.58±0.25 V59 9.55 100-42-5 苯乙烯 0.64±0.02b 3.88±1.59ab 3.96±5.6ab 6.7±0.00a 4.15±1.29ab V60 18.77 100-52-7 苯甲醛 4.54±0.52ab 3.77±2.26ab 5.02±0.13a 3.07±0.70b 2.93±0.37b V61 22.41 122-78-1 苯乙醛 0.86±0.11a 0.84±0.38a 1.17±0.07a 0.35±0.50b 0.78±0.18a V62 25.31 91-16-7 邻苯二甲醚 0.73±0.06b 0.36±0.19c 0.98±0.02b 1.36±0.42a 0.87±0.13b V63 25.58 150-78-7 对苯二甲醚 0.23±0.02ab 0.16±0.09b 0.31±0.01a 0.30±0.07a 0.27±0.05a V64 26.91 101-97-3 苯乙酸乙酯 0.32±0.04b 0.27±0.17b 0.33±0.06b 0.57±0.23a 0.41±0.06ab V65 27.63 89-95-2 邻甲基苄醇 0.20±0.02a 0.15±0.08a 0.1±0.15ab 0.09±0.13ab ND V66 29.04 100-51-6 苯甲醇 1.36±0.06abc 0.94±0.72bc 1.53±0.14ab 0.88±0.27c 1.82±0.64a V67 29.72 60-12--8 苯乙醇 12.17±0.72a 10.73±5.70a 16.15±0.68a 14.06±5.37a 13.13±4.68a V68 32.02 6380-23-0 3,4-二甲氧基苯乙烯 0.43±0.04a 0.32±0.20a 0.51±0.07a 0.56±0.21a 0.52±0.26a 含氮化合物 V69 9.94 109-08-0 2-甲基吡嗪 ND 0.40±0.15ab 0.51±0.03a 0.49±0.70a 0.73±0.19a V70 11.96 123-32-0 2,5-二甲基吡嗪 1.49±0.04b 0.87±0.30c 1.61±0.01b 2.52±0.74a 1.34±0.34bc V71 12.19 108-50-9 2,6-二甲基吡嗪 2.40±0.06ab 2.18±0.81b 2.75±0.61ab 2.93±0.50a 2.29±0.28ab V72 12.82 5910-89-4 2,3-二甲基吡嗪 0.39±0.03ab ND 0.85±0.22a 0.84±0.40a 0.43±0.61ab V73 14.2 13360-64-0 2-乙基-5-甲基吡嗪 0.28±0.20b 0.63±0.30a ND ND ND V74 14.38 13925-03-6 2乙基-6-甲基吡嗪 0.38±0.07b 0.63±0.30a 0.57±0.04ab 0.60±0.17ab ND V75 14.8 14667-55-1 三甲基吡嗪 2.20±0.20b 1.97±0.61b 4.02±0.30a 4.15±1.28a 1.83±0.04b V76 17.11 1124-11-4 四甲基吡嗪 1.01±0.01b 0.76±0.34b 4.55±0.39a 4.06±1.81a 1.2±0.50b V77 17.69 13925-09-2 2-甲基-6-乙烯基吡嗪 0.86±0.05b 0.96±0.60b 1.42±0.06a 1.02±0.41ab 0.76±0.10b V78 23.35 95-21-6 2-甲基苯并唑 ND 0.10±0.04b 0.16±0.02a ND ND V79 30.88 1072-82-8 3-乙酰基吡咯 ND 0.27±0.15a ND ND 0.07±0.10b 含硫化合物 V80 13.83 3658-80-8 二甲基三硫 ND ND 0.28±0.01 ND ND 其它化合物 V81 20.72 13877-93-5 茴香醛 0.42±0.04 ND ND ND ND V82 31.82 104-61-0 丙位壬内酯 0.32±0.03b 0.32±0.16b 0.67±0.00a 0.39±0.12b 0.37±0.12b V83 35.05 134-20-3 邻氨基苯甲酸甲酯 0.16±0.01a 0.13±0.07a ND 0.18±0.07a 0.17±0.07a 注:数值为平均值±标准差(SD);不同字母代表显著性差异(P<0.05);“ND”为未检出。 -
[1] TANG J, RAO J Q, ZOU Y F, et al. The community assembly patterns determined differences between the surface and the core microbial communities of Nongxiangxing Daqu[J]. LWT Food Science & Technology,2023,183:114936.
[2] MA S Y, SHANG Z C, CHEN J, et al. Differences in structure, volatile metabolites, and functions of microbial communities in Nongxiangxing daqu from different production areas[J]. LWT-Food Science & Technology,2022,166:113784.
[3] WU S L, DU H, XU Y. Daqu microbiota adaptability to altered temperature determines the formation of characteristic compounds[J]. International Journal of Food Microbiology,2023,385:109995. doi: 10.1016/j.ijfoodmicro.2022.109995
[4] MAO J J, LIU X L, GAO T, et al. Unraveling the correlations between bacterial diversity, physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J]. LWT-Food Science & Technology,2022,154:112764.
[5] LIU Y B, LI H D, DONG S M, et al. Dynamic changes and correlations of microbial communities, physicochemical properties, and volatile metabolites during Daqu fermentation of Taorong-type Baijiu[J]. LWT-Food Science & Technology,2023,173:114290.
[6] ZENG Y, WANG Y, CHEN Q, et al. Dynamics of microbial community structure and enzyme activities during the solid-state fermentation of Forgood Daqu:A starter of Chinese strong flavour Baijiu[J]. Archives of Microbiology,2022,204:577. doi: 10.1007/s00203-022-03198-w
[7] WANG X S, DU H, XU Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J]. International Journal of Food Microbiology,2017,244:27−35. doi: 10.1016/j.ijfoodmicro.2016.12.018
[8] XIA Y, LUO H B, WU Z Y, et al. Microbial diversity in jiuqu and its fermentation features:saccharifcation, alcohol fermentation and favors generation[J]. Applied Microbiology and Biotechnology,2023,107:25−41. doi: 10.1007/s00253-022-12291-5
[9] LI H, LIAN B, DING Y H, et al. Bacterial diversity in the central black component of Maotai Daqu and its flavor analysis[J]. Annals of Microbiology,2014,64:1659−1669. doi: 10.1007/s13213-014-0809-z
[10] ZHENG Y, ZHENG X W, HAN B Z, et al. Monitoring the ecology of Bacillus during Daqu incubation, a fermentation starter, using culture-dependent and culture-independent methods[J]. Journal of Microbiology and Biotechnology,2013,23(5):614−622. doi: 10.4014/jmb.1211.11065
[11] MENG X, WU Q, WANG L, et al. Improving flavor metabolism of Saccharomyces cerevisiae by mixed culture with Bacillus licheniformis for Chinese Maotai-flavor liquor making[J]. Journal of Industrial Microbiology and Biotechnology,2015,42(12):1601−1608. doi: 10.1007/s10295-015-1647-0
[12] HE G Q, DONG Y, HUANG J, et al. Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J]. LWT Food Science & Technology,2019,111:1−8.
[13] XU B Y, XU S S, CAI J, et al. Analysis of the microbial community and the metabolic profile in medium-temperature Daqu after inoculation with Bacillus licheniformis and Bacillus velezensis[J]. LWT Food Science & Technology,2022,160:113214.
[14] JIN Y, LI D R, AI M, et al. Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J]. Food Research International,2019,121:422−432. doi: 10.1016/j.foodres.2019.03.021
[15] KANG J M, CHEN X X, HAN B Z, et al. Insights into the bacterial, fungal, and phage communities and volatile profiles in different types of Daqu[J]. Food Research International,2022,158:111488. doi: 10.1016/j.foodres.2022.111488
[16] 刘淼, 丁丽, 赵梦梦, 等. 基于主成分分析的不同小麦品种大曲发酵动态品质评价[J]. 食品与发酵工业,2020,46(6):19−24. [LIU M, DING L, ZHAO M M, et al. Comprehensive quality evaluation of Daqu of different wheat varieties based on principal component analysis[J]. Food and Fermentation Industries,2020,46(6):19−24.] LIU M, DING L, ZHAO M M, et al. Comprehensive quality evaluation of Daqu of different wheat varieties based on principal component analysis[J]. Food and Fermentation Industries, 2020, 46(6): 19−24.
[17] 黄瑜, 杨帆, 李江华, 等. 小麦原料微生物组成对高温大曲风味的影响[J]. 食品与发酵工业,2021,47(20):22−29. [HUANG Y, YANG F, LI J H, et al. The microbiome of raw material wheat significantly influences the flavor compounds of Daqu for Chinese Baijiu production[J]. Food and Fermentation Industries,2021,47(20):22−29.] HUANG Y, YANG F, LI J H, et al. The microbiome of raw material wheat significantly influences the flavor compounds of Daqu for Chinese Baijiu production[J]. Food and Fermentation Industries, 2021, 47(20): 22−29.
[18] 陈良强, 张巧玲, 杨帆, 等. 小麦品种对库德里阿兹威氏毕赤酵母风味代谢特性影响的研究[J]. 中国酿造,2022,41(3):45−50. [CHEN L Q, ZHANG Q L, YANG F, et al. Effect of different wheat varieties on the property of flavor metabolism by Pichia kudriavzevii[J]. China Brewing,2022,41(3):45−50.] doi: 10.11882/j.issn.0254-5071.2022.03.008 CHEN L Q, ZHANG Q L, YANG F, et al. Effect of different wheat varieties on the property of flavor metabolism by Pichia kudriavzevii[J]. China Brewing, 2022, 41(3): 45−50. doi: 10.11882/j.issn.0254-5071.2022.03.008
[19] 余有贵, 罗俊, 熊翔, 等. 小麦品种对偏高温大曲发酵动态影响的研究[J]. 食品科学,2007,28(10):405−408. [YU Y G, LUO J, XIONG X, et al. Study on dynamic influence on wheat variety to fermented course of deviating high-temperature Daqu[J]. Food Science,2007,28(10):405−408.] doi: 10.3321/j.issn:1002-6630.2007.10.099 YU Y G, LUO J, XIONG X, et al. Study on dynamic influence on wheat variety to fermented course of deviating high-temperature Daqu[J]. Food Science, 2007, 28(10): 405−408. doi: 10.3321/j.issn:1002-6630.2007.10.099
[20] HELL J, PRÜCKLER M, DANNER L, et al. A comparison between near-infrared (NIR) and mid-infrared (ATR-FTIR) spectroscopy for the multivariate determination of compositional properties in wheat bran samples[J]. Food Control,2016,60:365−369. doi: 10.1016/j.foodcont.2015.08.003
[21] GORRETT N, ROGER J, AUBERT M, et al. Determining vitreousness of durum wheat kernels using near infrared hyperspectral imaging[J]. Journal of Near Infrared Spectroscopy,2006,14(4):231−239. doi: 10.1255/jnirs.640
[22] TANG H L, LIANG H B, SONG J K, et al. Comparison of microbial community and metabolites in spontaneous fermentation of two types Daqu starter for traditional Chinese vinegar production[J]. Journal of Bioscience and Bioengineering,2019,128:307−315. doi: 10.1016/j.jbiosc.2019.03.011
[23] ZHAO Q S, YANG J G, ZHANG K Z, et al. Lactic acid bacteria in the brewing of traditional Daqu liquor[J]. Journal of the Institute of Brewing,2020,126(1):14−23. doi: 10.1002/jib.593
[24] HOU X G, HUI M, SUN Z K, et al. Comparative analysis of the microbiotas and physicochemical properties inside and outside medium-temperature Daqu during the fermentation and storage[J]. Frontiers in Microbiology,2022,13:934696. doi: 10.3389/fmicb.2022.934696
[25] 余有贵, 刘安然, 罗俊, 等. 小麦品种对偏高温大曲质量的影响[J]. 酿酒科技,2006(10):46−48. [YU Y G, LIU A R, LUO J, et al. Effects of wheat varieties on the quality of high-temperature-deviating Daqu[J]. Liquor-making Science & Technology,2006(10):46−48.] doi: 10.3969/j.issn.1001-9286.2006.10.011 YU Y G, LIU A R, LUO J, et al. Effects of wheat varieties on the quality of high-temperature-deviating Daqu[J]. Liquor-making Science & Technology, 2006(10): 46−48. doi: 10.3969/j.issn.1001-9286.2006.10.011
[26] 朱和琴, 周瑞平, 江东材, 等. 不同小麦生产偏高温大曲的研究[J]. 酿酒科技,2012(10):65−68. [ZHU H Q, ZHOU R P, JIANG D C, et al. Research on the production of high-temperature-deviating Daqu by different Kinds of wheat[J]. Liquor-making Science & Technology,2012(10):65−68.] ZHU H Q, ZHOU R P, JIANG D C, et al. Research on the production of high-temperature-deviating Daqu by different Kinds of wheat[J]. Liquor-making Science & Technology, 2012(10): 65−68.
[27] XIA Y, ZHOU W, DU Y K, et al. Difference of microbial community and gene composition with saccharification function between Chinese nongxiangxing daqu and jiangxiangxing daqu[J]. Journal of the Science of Food and Agriculture,2023,103(2):637−647. doi: 10.1002/jsfa.12175
[28] ZHANG Y D, DING F, SHEN Y, et al. Characteristics of the microbiota and metabolic profile of high-temperature Daqu with different grades[J]. World Journal of Microbiology and Biotechnology,2022,38(8):137. doi: 10.1007/s11274-022-03303-7
[29] ZHENG X W, YAN Z, ROBERT N M J, et al. Characterization of the microbial community in different types of Daqu samples as revealed by 16S rRNA and 26S rRNA gene clone libraries[J]. World Journal of Microbiology and Biotechnology,2014,31(1):199−208.
[30] 徐千惠, 饶家权, 邹永芳, 等. 浓香型大曲储存期微生物群落演替及代谢产物的变化机制[J]. 食品科学,2023,44(22):225−234. [XU Q H, RAO J Q, ZOU Y F, et al. Mechanism of microbial community succession and metabolic products change of Nongxiangxing Daqu during storage[J]. Food Science,2023,44(22):225−234.] doi: 10.7506/spkx1002-6630-20230228-257 XU Q H, RAO J Q, ZOU Y F, et al. Mechanism of microbial community succession and metabolic products change of Nongxiangxing Daqu during storage[J]. Food Science, 2023, 44(22): 225−234. doi: 10.7506/spkx1002-6630-20230228-257
[31] MAO F J, HUANG J, ZHOU R Q, et al. Effects of Daqu properties on the microbial community and their metabolites in fermented grains in Baijiu fermentation system[J]. Canadian Journal of Microbiology,2023,69:170−181. doi: 10.1139/cjm-2022-0213
[32] 张清玫, 赵鑫锐, 李江华, 等. 不同香型白酒大曲微生物群落及其与风味的相关性[J]. 食品与发酵工业,2022,48(10):1−8. [ZHANG Q M, ZHAO X R, LI J H, et al. The relationship between microbial community and flavors of three types of Daqu[J]. Food and Fermentation Industries,2022,48(10):1−8.] ZHANG Q M, ZHAO X R, LI J H, et al. The relationship between microbial community and flavors of three types of Daqu[J]. Food and Fermentation Industries, 2022, 48(10): 1−8.
[33] SUN H L, NI B, YANAG J G, et al. Nitrogenous compounds and Chinese baijiu:A review[J]. The Institute of Brewing & Distilling,2022,128:5−14.
[34] HOU X G, HUI M, SUN Z K, et al. Associations between wheat varieties and the functional microbial community of Nongxiangxing daqu from northern China[J]. LWT-Food Science & Technology,2023,185:115119.
[35] 谢建春. 香味分析原理与技术[M]. 北京:化学工业出版社, 2020, 4:239−293. [XIE J C. Flavor analysis principles and techniques[M]. Beijing:Chemical Industry Press, 2020, 4:239−293.] XIE J C. Flavor analysis principles and techniques[M]. Beijing: Chemical Industry Press, 2020, 4: 239−293.
[36] ZHANG Y D, SHEN Y, NIU J, et al. Bacteria-induced amino acid metabolisms involve in appearance characteristics of high-temperature Daqu[J]. Journal of the Science of Food and Agriculture,2023,103(1):243−254. doi: 10.1002/jsfa.12136
[37] LUO T, FAN W L, XU Y. Characterization of volatile and semivolatile compounds in Chinese rice wines by headspace solid phase microextraction followed by gas chromatographymass spectrometry[J]. Journal of the Institute of Brewing,2008,114(2):172−179. doi: 10.1002/j.2050-0416.2008.tb00323.x
[38] ZHAO Y J, WU Z Y, MIYAO S, et al. Unraveling the flavor profile and microbial roles during industrial Sichuan radish paocai fermentation by molecular sensory science and metatranscriptomics[J]. Food Bioscience,2022,48:101815. doi: 10.1016/j.fbio.2022.101815
[39] HE M W, JIN Y, ZHOU R Q, et al. Dynamic succession of microbial community in Nongxiangxing daqu and microbial roles involved in flavor formation[J]. Food Research International,2022,159:111559. doi: 10.1016/j.foodres.2022.111559
[40] CORDENTE A G, SWIEGERS J H, HEGARDT F G, et al. Modulating aroma compounds during wine fermentation by manipulating Carnitine acetyltransferases in Saccharomyces cerevisiae[J]. Fems Microbiology Letters,2007,267:159−166. doi: 10.1111/j.1574-6968.2006.00548.x
[41] 赵述淼, 葛向阳. 酿造学[M]. 北京:高等教育出版社, 2018:211-252. [ZHAO S M, GE X Y. Zymurgy[M]. Beijing:Higher Education Press, 2018:211-252.] ZHAO S M, GE X Y. Zymurgy[M]. Beijing: Higher Education Press, 2018: 211-252.
[42] XIAO C, LU Z M, ZHANG X J, et al. Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J]. Applied Environmental Microbiology,2017,83:e01550−e1617.
[43] 张艳, 杜海, 吴群, 等. 酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J]. 微生物学通报,2015,42(11):2087−2097. [ZHANG Y, DU H, WU Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China,2015,42(11):2087−2097.] ZHANG Y, DU H, WU Q, et al. Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J]. Microbiology China, 2015, 42(11): 2087−2097.
[44] 罗青春, 郑佳, 赵东, 等. 浓香型白酒中优势乳酸菌和酵母菌间的相互关系[J]. 应用与环境生物学报,2019,25(5):1192−1199. [LUO Q C, ZHENG J, ZHAO D, et al. Interaction between dominant lactic acid bacteria and yeasts strains in strong aroma Baijiu[J]. Chinese Journal of Applied and Environmental Biology,2019,25(5):1192−1199.] LUO Q C, ZHENG J, ZHAO D, et al. Interaction between dominant lactic acid bacteria and yeasts strains in strong aroma Baijiu[J]. Chinese Journal of Applied and Environmental Biology, 2019, 25(5): 1192−1199.
[45] DU Y K, XIN W, XIA Y, et al. Analysis of fermentation control factors on volatile compounds of primary microorganisms in Jiang-flavor Daqu[J]. Journal of Food Biochemistry,2022,46(10):e14277.
[46] YANG Y, WANG S T, LU Z M, et al. Metagenomics unveils microbial roles involved in metabolic network of flavor development in medium-temperature daqu starter[J]. Food Research International,2021,140:110037. doi: 10.1016/j.foodres.2020.110037
[47] 薄涛, 吕娜, 杨凯环, 等. 白酒大曲发酵过程中微生物群落及功能研究进展[J]. 食品科学,2023,44(19):385−393. [BO T, LÜ N, YANG K H, et al. Overview and recent advances in the composition and function of microbial community in the fermentation of Baijiu Daqu[J]. Food Science,2023,44(19):385−393.] doi: 10.7506/spkx1002-6630-20221020-196 BO T, LÜ N, YANG K H, et al. Overview and recent advances in the composition and function of microbial community in the fermentation of Baijiu Daqu[J]. Food Science, 2023, 44(19): 385−393. doi: 10.7506/spkx1002-6630-20221020-196





 下载:
下载:



 下载:
下载:
