Optimization of Polysaccharide Extraction Process from Rosa rugosa Residue and Analysis of Its Antioxidant Activity in Vitro
-
摘要: 玫瑰花渣是玫瑰精油提取过程中产生的主要废弃物之一。以玫瑰花渣为原料,采用单因素实验结合Box-Behnken响应面法优化了超声辅助纤维素酶与果胶酶复合提取玫瑰花渣多糖的提取工艺,并对多糖体外抗氧化活性进行了研究。结果表明,在料液比为1:15,复合酶(纤维素酶:果胶酶=1:1)添加量为1.9%,酶解温度47 ℃,酶解时长84.5 min的条件下,玫瑰花渣多糖得率为4.308%±0.03%。体外抗氧化实验表明,玫瑰花渣多糖总抗氧化能力较强,当多糖溶液浓度为5 mg/mL时,其FRAP值为0.30,对DPPH·、ABTS+·的清除能力较强,清除率分别为98.93%和92.19%,对O2−·的清除能力较弱,清除率为24.93%。同时,玫瑰花渣多糖对DPPH·、ABTS+·、O2−·清除能力的IC50值大小分别为0.357、0.608、64.206 mg/mL。该研究为玫瑰花渣的回收再利用提供了理论依据。Abstract: Rose flower residue, a major by-product of rose essential oil extraction, was used as the raw material in this study. The extraction process of polysaccharides from rose flower residue was optimized using single factor experiments combined with the Box-Behnken response surface method, with ultrasonic assistance and a composite enzyme treatment of cellulase and pectinase. The in vitro antioxidant activity of the polysaccharides was also investigated. Results showed that under the conditions of a material-to-liquid ratio of 1:15, a composite enzyme addition (cellulase to pectinase at a 1:1 ratio) of 1.9%, an enzymatic hydrolysis temperature of 47 ℃, and a duration of 84.5 min, the yield of polysaccharides from rose flower residue was 4.308%±0.03%. In vitro antioxidant tests showed that the rose flower residue polysaccharides had strong overall antioxidant capacity. At a polysaccharide solution concentration of 5 mg/mL, the FRAP value was 0.30, with strong scavenging abilities against DPPH· and ABTS+·, with scavenging rates of 98.93% and 92.19%, respectively. A weaker scavenging ability against O2−·, with a scavenging rate of 24.93%. Meanwhile, the IC50 value of DPPH·, ABTS+·, O2−· respective clearance capacity was 0.357, 0.608, and 64.206 mg/mL. This research provides a theoretical basis for the recycling and reuse of rose flower residue.
-
玫瑰(Rosa rugose Thunb.)属于蔷薇科(Rosaceae),归类于常绿或落叶性灌木,是一种药食同源的植物,在中国有着悠久的栽培历史,品种众多且种植面积广泛[1−2]。由于玫瑰花具有独特风味,被用来生产各种玫瑰精油、花茶、醋和酒。玫瑰的各个部分具有药用效果,具有预防和治疗效果,如初开的玫瑰花和根入药,便有理气、活血的功效,玫瑰果肉含有丰富维生素,可防御冠心病和肝病[3]。玫瑰花含有丰富的活性物质,如挥发油、黄酮、膳食纤维、多酚和多糖化合物。此外,研究发现玫瑰花具有抗氧化、抑菌、降血脂、降血糖和抗肿瘤等多种功效[4]。
多糖作为一种天然产物,广泛存在于动植物中,具有多种生物活性和较高的药用价值,如免疫调节、抗氧化、抗肿瘤和神经保护[5]。玫瑰花在食品和化妆品行业大量应用,产生的花渣多直接丢弃、焚烧或作为肥料,其潜力并未得到充分开发[6]。因此对于玫瑰花中多糖的研究,从提取、分离纯化、结果表征到抗氧化能力等方面,具备较大的发展潜力。
本文以玫瑰花渣为原料,采用单因素实验和响应面优化试验相结合的方法,研究了超声辅助纤维素酶与果胶酶复合提取玫瑰花渣多糖的最佳工艺,并对玫瑰花渣多糖的体外抗氧化活性进行了分析,为玫瑰花渣的回收再利用的研究提供一定的理论基础。
1. 材料与方法
1.1 材料与仪器
玫瑰花渣(多为平阴玫瑰) 济南天卉玫瑰电子商务有限公司;纤维素酶、果胶酶 食品级,上海麦克林生化科技有限公司;2,4,6-三苯基三嗪(TPTZ)、2,2'-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 分析纯,北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、邻苯三酚 分析纯,上海源叶生物科技有限公司;三氯化铁、硫酸亚铁、过硫酸钾 分析纯,国药集团化学试剂有限公司;试验用水均为超纯水。
BS-150型中药粉碎机 北京毅事合科技有限公司;TGL-1650型台式高速冷冻离心机 四川蜀科仪器有限公司;TECAN Spark型多功能酶标仪 赛默飞世尔科技(中国)有限公司;DHG-9140A型电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;LC-UC-21型超声清洗机 宁波新芝生物科技股份有限公司;HH-600型恒温水浴锅 嘉兴市中新医疗仪器有限公司;PHS-3C型pH计 上海仪电科学仪器股份有限公司;IKA RV10 digital型旋转蒸发仪 嵘汇创新科技(成都)有限公司。
1.2 实验方法
1.2.1 玫瑰花渣多糖的提取工艺
玫瑰花渣经过烘干、粉碎后,使用60目过筛,然后进行脱脂脱色,并在烘干机内设置65 ℃烘干,随后加入一定量复合酶[7]和一定比例的水,使用360 W进行超声然后离心,将其进行过滤、并将滤液进行浓缩,再进行醇沉然后离心、过滤,使用丙酮对其洗涤,最后再次65 ℃烘干得玫瑰花渣多糖。
1.2.2 玫瑰花渣多糖提取单因素实验
按1.2.1的玫瑰花渣多糖提取方法,准确称取1.0 g玫瑰花渣实验样品于50 mL离心管中,将料液比1:20 g/mL、复合酶添加量2.0%、酶解温度45 ℃、酶解时长90 min设置为实验的基本条件进行单因素实验,考察料液比、复合酶添加量、酶解温度、酶解时长4个因素对玫瑰花渣多糖得率的影响。
以水为溶剂,设置料液比为1:10、1:15、1:20、1:25、1:30 g/mL,考察料液比对玫瑰花渣多糖得率的影响。以水为溶剂,将纤维素酶与果胶酶按1:1的比例混匀,设置复合酶添加量为1.5%、2.0%、2.5%、3.0%、3.5%,考察复合酶添加量对玫瑰花渣多糖得率的影响。以水为溶剂,将酶解温度设置为35、40、45、50、55 ℃,考察酶解温度对玫瑰花渣多糖得率的影响。以水为溶剂,将酶解时长设置为30、60、90、120、150 min,考察酶解时长对玫瑰花渣多糖得率的影响。
1.2.3 响应面试验优化多糖提取工艺设计
选取玫瑰花渣多糖提取的单因素实验中的适宜条件,以玫瑰花渣多糖得率为响应值,通过Box-Behnken响应面设计优化试验,具体的试验因素及水平见表1,得出最佳提取工艺条件。
表 1 响应面试验设计因素与水平Table 1. Factors and levels used in response surface design因素 水平 −1 0 1 A料液比(g/mL) 1:10 1:15 1:20 B复合酶添加量(%) 1.5 2.0 2.5 C酶解温度(℃) 40 45 50 D酶解时长(min) 30 60 90 1.2.4 玫瑰花渣多糖得率的计算
1.2.4.1 葡萄糖标准曲线的制作
精密称取干燥至恒重的无水葡萄糖25 mg于250 mL容量瓶中,用水定容至刻度线制得葡萄糖标准品溶液,将其梯度稀释为0.02、0.04、0.06、0.08、0.1 mg/mL,量取不同浓度葡萄糖溶液各1 mL,加入5%苯酚0.5 mL,浓硫酸2.5 mL,混匀后于90 ℃水浴锅中加热30 min,冷却至室温,于490 nm波长测定样品吸光度。以葡萄糖标准品浓度C(mg/mL)为横坐标,吸光度A为纵坐标,绘制葡萄糖标准曲线,得回归方程A=5.848C+0.0637,R2=0.9999。
1.2.4.2 玫瑰花渣多糖的测定及得率的计算
用苯酚-硫酸法[8−9]测定玫瑰花渣中的多糖得率。将1.2.2中不同条件下得到的玫瑰花渣多糖用水于50 mL容量瓶中溶解并定容,按葡萄糖标准溶液处理方法处理待测样品,测得玫瑰花渣多糖溶液的吸光度,根据公式计算出多糖得率。
多糖得率(%)=n×C×VW×103×100 式中,C为将不同条件下的待测溶液吸光度带入葡萄糖标准曲线方程计算得出多糖样品浓度,mg/mL;V为样品溶液总体积,mL;W为样品质量,g;n为稀释倍数。
1.2.5 总抗氧化能力(T-AOC)测定
参考Birhanie等[10]的方法,略有改动,用FRAP法测定玫瑰花渣多糖总抗氧化能力。制备30 mmol/L乙酸钠缓冲液、0.1 mmol/mL TPTZ溶液、0.03 mol/mL FeCl3溶液,按10:1:1的比例混合配制FRAP工作液,配制好后放置于37 ℃,现配现用。以1 mmol/L FeSO4为标准物质建立FRAP标准曲线,得到回归方程:y=0.2295x−0.0184,R²=0.9979。取1.5 mL FRAP工作液与50 μL待测溶液混匀,室温放置4 min后在593 nm处测定吸光度。以FRAP值代表被测样品的总抗氧化能力。1 FRAP单位=1 mmol/L FeSO4,即样品抗氧化能力相当于Fe3+被还原成Fe2+的mmol数。
1.2.6 ABTS+自由基(ABTS+·)清除能力的测定
参考裴育等[11]的方法,稍作修改,测定玫瑰花渣多糖对ABTS+·的清除能力。将7 mmol/L的ABTS水溶液与2.45 mmol/mL K2S2O8水溶液1:1混合制备ABTS母液,于4 ℃冰箱暂存。使用时,用无水乙醇稀释ABTS母液使其吸光度在0.7±0.1,作为ABTS工作液用于检测。取0.1 mL待测玫瑰花渣多糖溶液与1.9 mL ABTS工作液混合,避光静置6 min后,在734 nm处测得吸光值A1。以无水乙醇代替工作液,测得吸光值A2。以无水乙醇代替待测溶液,测得吸光值A0。以VC为标准品。平行测定3次取平均值,代入公式计算ABTS+·清除率。计算公式如下:
ABTS+⋅清除率(%)=(1−A1−A2A0)×100 1.2.7 DPPH自由基(DPPH·)清除能力的测定
参考王若男等[12]的方法,稍作修改,测定玫瑰花渣多糖对DPPH·的清除能力。配制0.2 mmol/L的DPPH工作液。实验组取待测玫瑰花渣多糖溶液0.5 mL与0.5 mL 0.2 mmol/LDPPH溶液混合,避光静置30 min后,在517 nm处测得吸光度A1。对照组以无水乙醇代替工作液,测得吸光度A2。空白组以无水乙醇代替待测溶液,测得吸光度A0。以VC为标准品。平行测定3次取平均值,代入公式计算DPPH自由基清除率。计算公式如下:
DPPH⋅清除率(%)=(1−A1−A2A0)×100 1.2.8 超氧阴离子自由基(O2−·)清除能力的测定
采用加入终止剂对邻苯三酚自氧化进行改进后的方法[11−12]测定玫瑰花渣多糖对超氧阴离子的清除能力。配制pH8.2,50 mmol/L Tris-HCl缓冲液,按Tris-HCl缓冲液:水:无水乙醇=9:9:2的比例混合,作试剂一;用10 mmol/L HCl配制3 mmol/L邻苯三酚溶液,作试剂二;用5% VC溶液(终止剂)作试剂三;试剂一与试剂二使用前于25 ℃水浴中保温20 min。实验组:180 μL试剂一、30 μL待测玫瑰花渣多糖溶液与20 μL的试剂二混匀后室温下反应3 min,再加入10 μL的试剂三,室温下反应3 min,于325 nm处测得吸光度A1。对照组以水替代试剂二,测得吸光度A2。空白组以水代替待测溶液,测得吸光度A0。以VC为标准品。平行测定3次取平均值,代入公式计算超氧阴离子自由基清除率。计算公式如下:
O−2⋅清除率(%)=(1−A1−A2A0)×100 1.2.9 IC50值的计算
采用IBM SPSS Statistics对各浓度所对应的清除率进行分析计算,得出不同自由基清除率的IC50值。
1.3 数据处理
数据整理采用Excel 2010软件进行;单因素实验和体外抗氧化活性研究、显著性分析采用SPSS软件分析(P<0.05);Box-Behnken试验设计和结果分析采用Design-Expert 11软件进行。实验平行测定三次,取平均值,实验结果以平均值±标准方差表示。采用OriginPro 2021软件进行绘图。
2. 结果与分析
2.1 单因素实验结果
2.1.1 料液比对多糖得率的影响
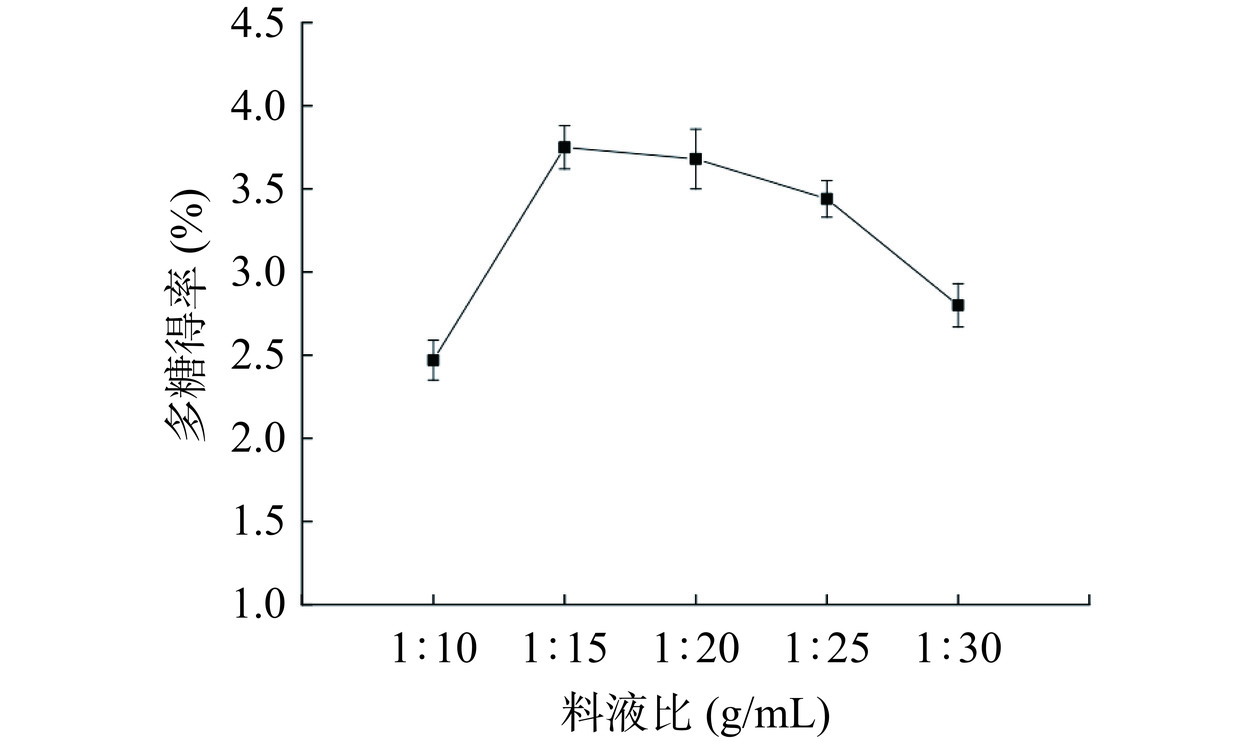
以水为溶剂,在超声功率360 W,酶解温度45 ℃,复合酶添加量为2.0%的条件下超声90 min。由图1可知,随着溶剂用量增多,多糖得率呈现先增加后减小的趋势,等量的复合酶被分散到逐渐增加的溶剂中,对玫瑰花渣酶解不充分。同时,随着料液比的增大,杂质的溶出抑制了多糖提取,使得多糖得率呈现增大后减小的趋势[12−13]。当料液比为1:15时,多糖得率最大为3.75%。所以选择适宜玫瑰花渣多糖提取的料液比为1:15。
2.1.2 复合酶添加量对多糖得率的影响
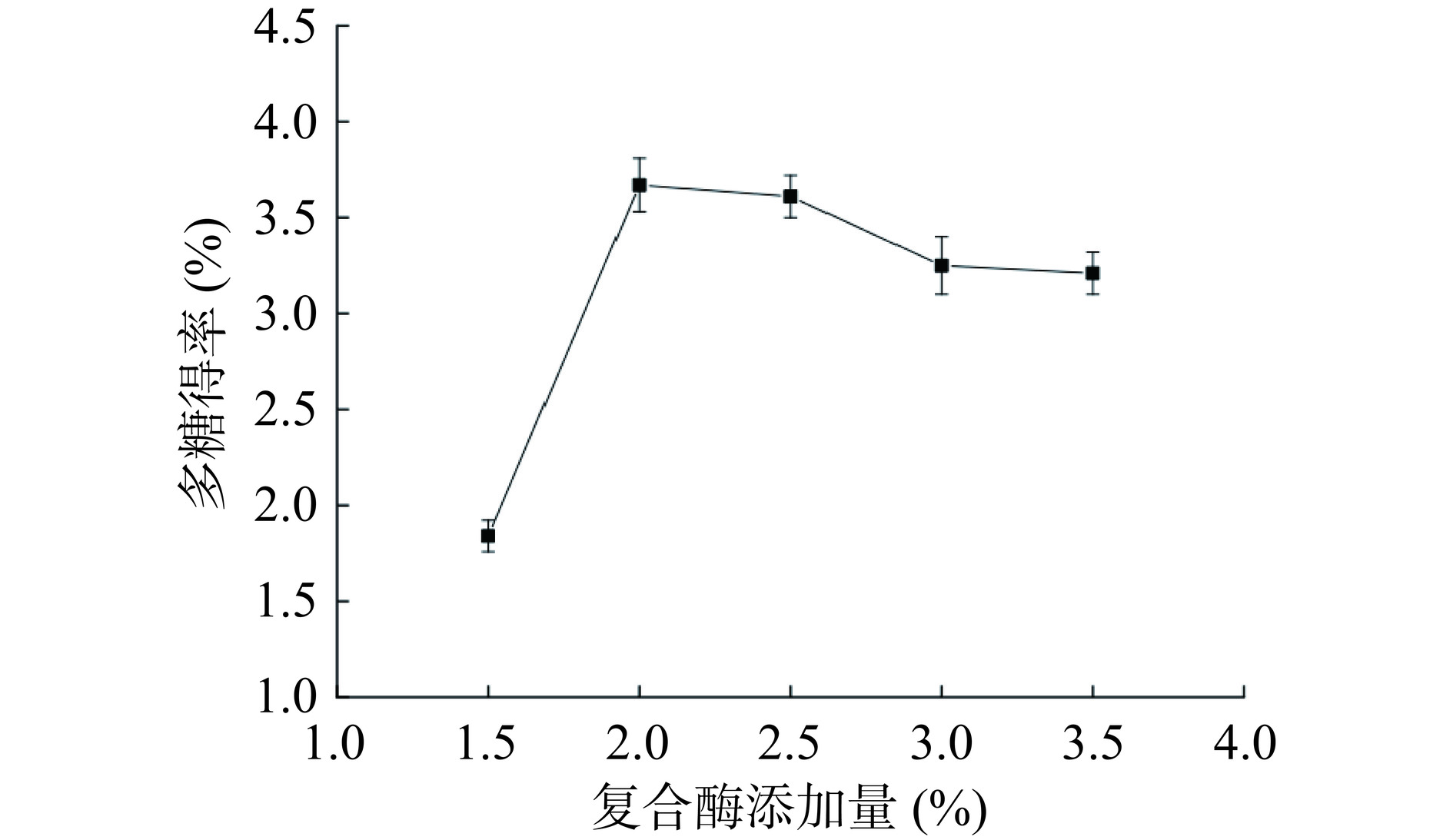
以水为溶剂,在料液比为1:20,超声功率360 W,酶解温度45 ℃的条件下超声90 min。由图2可知,随着复合酶添加量的增多,多糖得率呈现先增加后略有减小而后逐渐平稳的趋势。当复合酶添加量为2.0%时,多糖得率最大,为3.67%。当复合酶添加量大于2.0%时,多糖得率变化并不明显,可能是由于酶添加量在2.0%左右时,玫瑰花渣酶解完全,多糖溶出达到饱和[14−15]。所以选择适宜玫瑰花渣多糖提取的复合酶添加量为2.0%。
2.1.3 酶解温度对多糖得率的影响
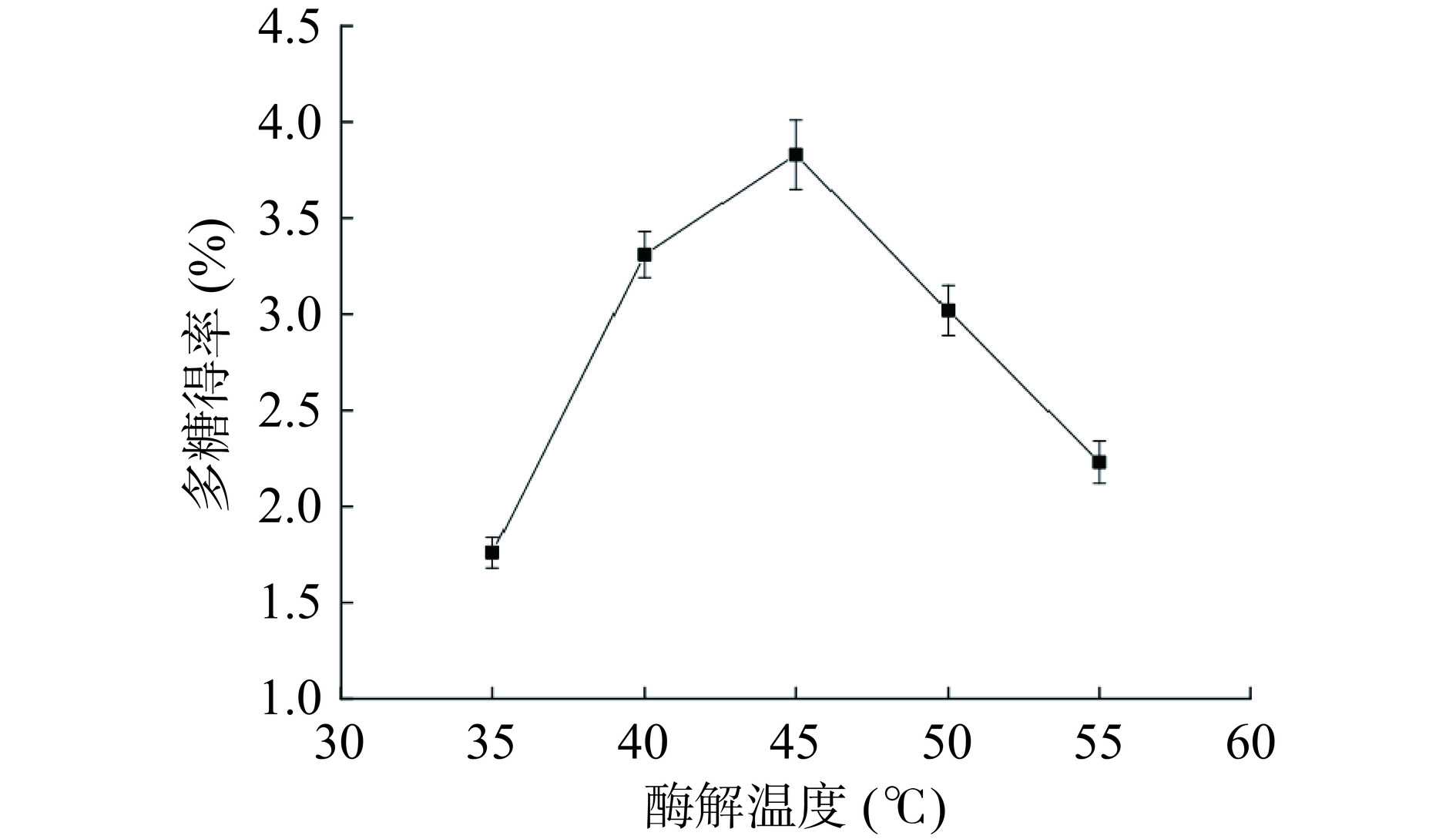
以水为溶剂,在料液比为1:20,超声功率360 W,复合酶添加量为2.0%的条件下超声90 min。由图3可知,随着酶解温度的升高,多糖得率呈现先增加后减小的趋势,温度升高能提高多糖的溶解度,提高多糖的得率,但温度越高,复合酶失活的可能性增大。同时温度越高,液体表面张力会逐渐降低,多糖溶液黏度增大,超声效果衰减,影响多糖得率[16−18]。当酶解温度为45 ℃时,多糖得率最大,为3.83%。所以选择适宜玫瑰花渣多糖提取的酶解温度为45 ℃。
2.1.4 酶解时长对多糖得率的影响
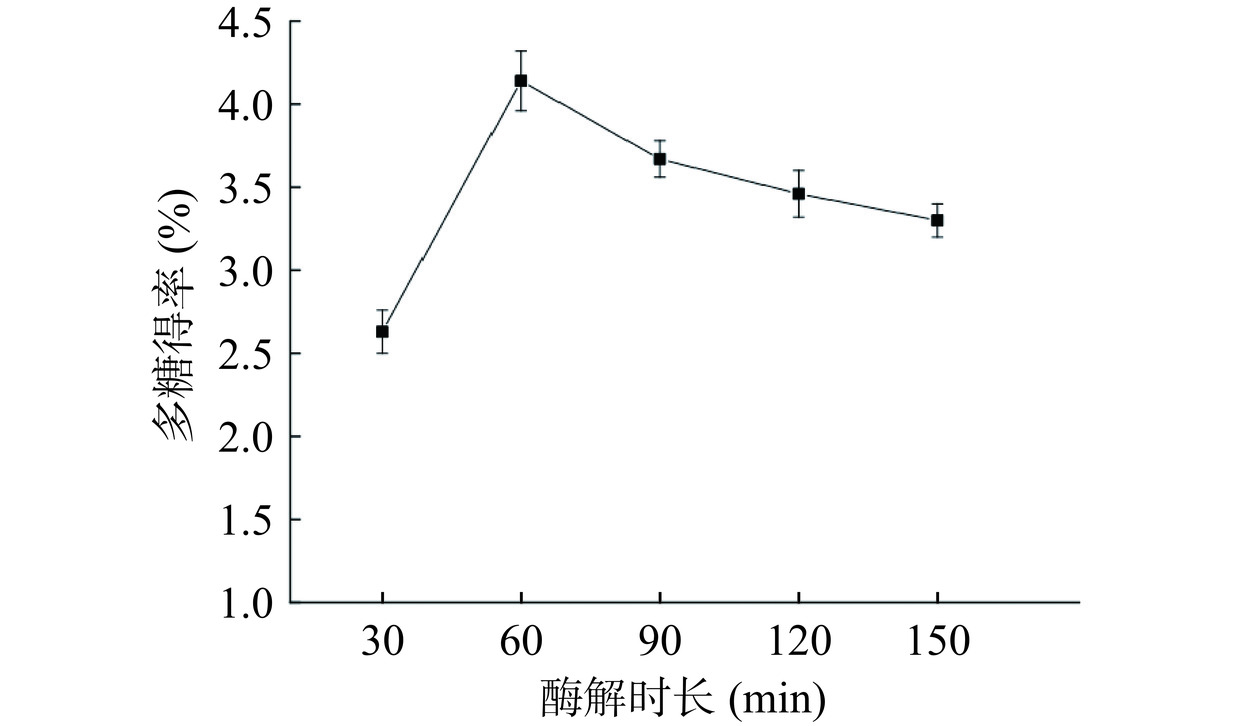
以水为溶剂,超声功率为360 W,在料液比为1:20,复合酶添加量为2.5%,酶解温度为45 ℃的条件下超声。由图4可知,随着酶解时长的增加,多糖得率呈现增加的趋势,当酶解时长为60 min时,多糖得率最大,为4.14%。而后,酶解时长逐渐增加,但多糖得率开始降低。酶是生物体的细胞产生的具有催化能力的蛋白质,在超声的作用下,其化学键会遭到一定的破坏,使其失去活性[19];多糖常由多个单糖结构通过糖苷键相连接,部分糖苷键通过超声获得能量发生断裂,使其遭到破坏[20−21]。随着酶解时长的增加,复合酶和多糖结构遭到一定的破坏,导致多糖得率降低。所以选择适宜玫瑰花渣多糖提取的酶解时长为60 min。
2.2 响应面优化玫瑰花渣多糖提取试验结果
2.2.1 Box-Behnken试验结果与分析
以玫瑰花渣中多糖的得率为考察指标,A料液比、B复合酶添加量、C酶解温度、D酶解时长为影响因素设计四因素三水平响应面试验。试验方案及结果见表2,试验方差分析及显著性检验见表3。
表 2 Box-Behnken试验设计及结果Table 2. Design and results of Box-Behnken test试验号 A料液比 B复合酶添加量 C酶解温度 D酶解时长 多糖得率(%) 1 0 1 1 0 3.11±0.12 2 0 0 −1 −1 3.42±0.29 3 0 0 0 0 4.99±0.36 4 −1 0 0 −1 3.34±0.18 5 0 −1 1 0 3.11±0.12 6 −1 0 0 1 3.99±0.21 7 0 0 −1 1 3.59±0.16 8 0 1 −1 0 3.29±0.22 9 0 0 0 0 4.79±0.18 10 1 0 1 0 2.52±0.23 11 0 −1 0 1 3.51±0.31 12 −1 0 1 0 3.10±0.13 13 1 0 0 1 3.31±0.17 14 1 1 0 0 3.56±0.15 15 0 1 0 1 3.60±0.21 16 0 1 0 −1 3.41±0.11 17 0 0 1 1 3.46±0.29 18 0 0 0 0 4.59±0.23 19 1 0 0 −1 3.16±0.16 20 0 −1 −1 0 2.93±0.12 21 −1 1 0 0 3.06±0.12 22 −1 −1 0 0 3.24±0.31 23 0 0 0 0 4.65±0.23 24 0 −1 0 −1 3.10±0.17 25 0 0 0 0 4.93±0.22 26 1 −1 0 0 2.72±0.33 27 1 0 −1 0 3.06±0.16 28 0 0 1 −1 2.68±0.29 29 −1 0 −1 0 3.15±0.17 表 3 响应面试验方差分析结果Table 3. Response surface variance analysis项目 平方和 自由度 均方 F值 P值 显著性 模型 12.3 14 0.8786 32.33 0.0001 ** A 0.1996 1 0.1996 7.34 0.0169 * B 0.1666 1 0.1666 6.13 0.0267 * C 0.1824 1 0.1824 6.71 0.0214 * D 0.4589 1 0.4589 16.88 0.0011 ** AB 0.2583 1 0.2583 9.5 0.0081 ** AC 0.0607 1 0.0607 2.23 0.1574 AD 0.0626 1 0.0626 2.3 0.1515 BC 0.033 1 0.033 1.21 0.2893 BD 0.0125 1 0.0125 0.4584 0.5094 CD 0.0907 1 0.0907 3.34 0.0892 A² 4.64 1 4.64 170.87 <0.0001 ** B² 4.05 1 4.05 148.92 0.0001 ** C² 5.75 1 5.75 211.48 <0.0001 ** D² 1.94 1 1.94 71.42 0.0001 ** 残差 0.3805 14 0.0272 失拟项 0.2644 10 0.0264 0.8873 0.6027 不显著 纯误差 0.1192 4 0.0298 总差 12.68 28 R2 0.9700 R2adj 0.9411 注:*:0.01<P<0.05,表示差异显著;**:P<0.01,表示差异极显著。 通过表3可知,回归模型F值较高(F=32.22),P值较低(P<0.0001),表明响应面回归模型极显著。失拟项P=0.6027,不显著,说明非试验因素对试验结果影响较小。决定系数R2=0.9700,校正后系数R2adj=0.9411,说明该模型与试验拟合较好。在表3中,一次项料液比(A),复合酶添加量(B),酶解温度(C)的P<0.05,酶解时长(D)的P<0.01,说明这四个因素对玫瑰花渣多糖得率的影响显著;根据F值大小可以得出影响多糖得率的因素主次顺序是D>A>C>B,即酶解时长>料液比>酶解温度>复合酶添加量;该试验AB的交互作用对玫瑰花渣多糖的得率有极显著影响(P<0.01);二次项A2、B2、C2、D2对玫瑰花渣多糖的得率有极显著影响影响(P<0.01)。由软件拟合得回归方程为:
Y=4.79−0.129A+0.1178B−0.1233C+0.1955D+0.2541AB−0.1231AC−0.125AD−0.0908BC−0.0558BD+0.1505CD−0.8461A2−0.7899B2−0.9413C2−0.547D2
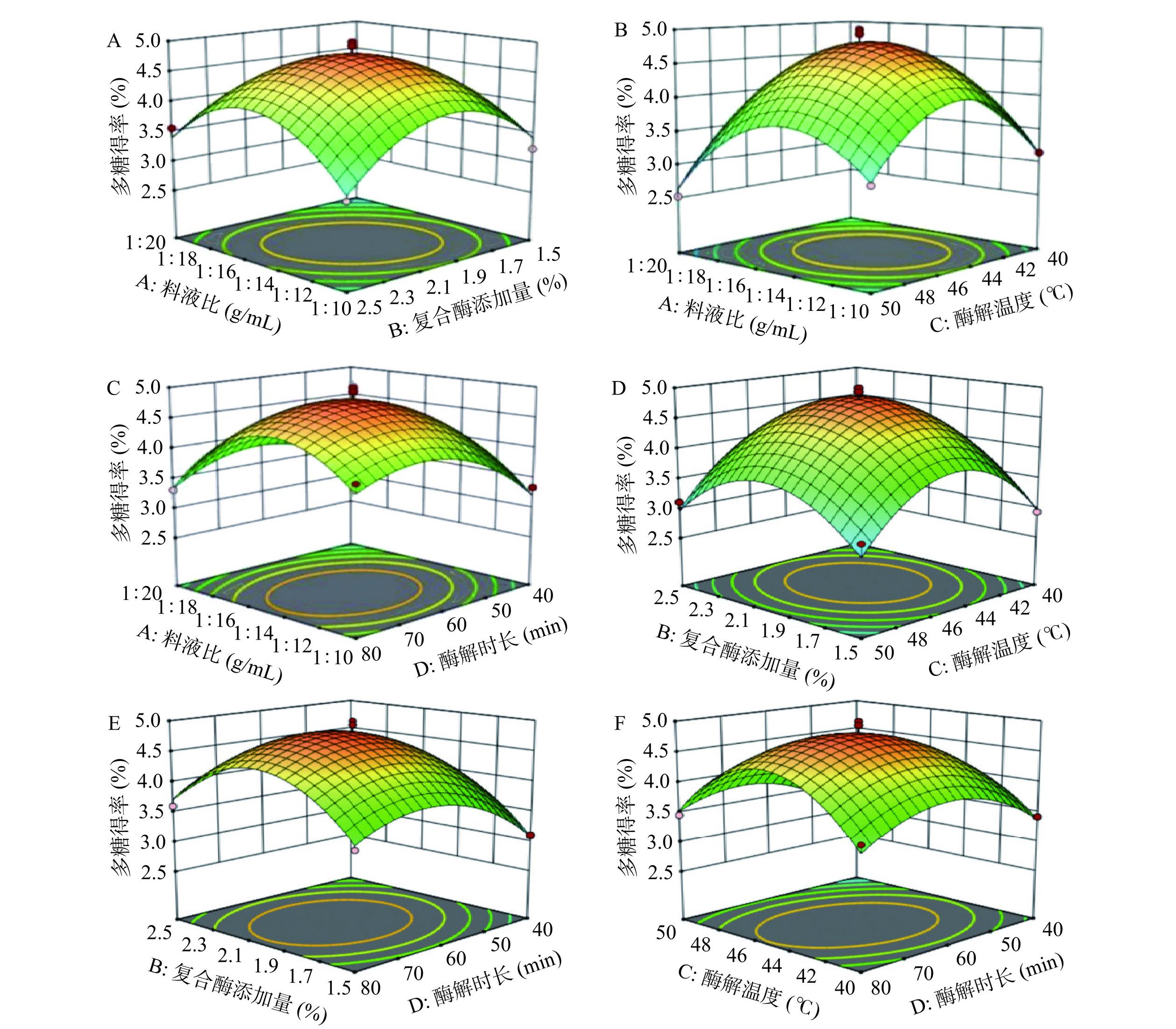
2.2.2 两因素间交互作用
等高线的密集程度及形状、响应面曲面坡度体现出两因素对响应值的影响的情况,其中等高线排列密集并趋于椭圆、响应面坡度陡峭则表示交互作用对响应值影响显著,等高线排列稀疏并趋于圆形、响应面坡度平缓则表示交互作用对响应值影响不显著[22]。图5A所示,料液比对多糖得率的影响大于复合酶的添加量,等高线呈椭圆,说明两因素交互作用对多糖得率的影响较强;图5B所示,料液比对多糖得率的影响大于酶解温度,等高线排列相对稀疏且呈趋于圆形,说明两因素交互作用对多糖得率影响较弱;图5C所示,浸提时长对多糖得率的影响大于料液比,等高线排列稀疏且趋于圆形,说明两因素对多糖得率影响较弱;图5D所示,酶解温度对多糖得率的影响大于复合酶的添加量,等高线排列稀疏且趋于圆形,说明两因素对多糖得率影响较弱。图5E所示,酶解时长对多糖得率的影响大于复合酶的添加量,等高线排列稀疏且趋于圆形,说明两因素对多糖得率影响较弱;图5F所示,酶解时长对多糖得率的影响大于酶解温度,等高线排列稀疏且趋于圆形,说明两因素对多糖得率影响较弱。
2.2.3 验证试验
通过Design Expert 11优化得出玫瑰花渣多糖提取最优条件,即:料液比1:14.9,复合酶添加量1.93%,酶解温度47.4℃,酶解时长84.8 min,多糖得率4.35%,按照试验条件,将其调整成:料液比=1:15,复合酶添加量1.9%,酶解温度47 ℃,酶解时长84.5 min,进行3次验证性试验,实际得率平均值为4.308%±0.03%,与理论值4.35%相接近,证明试验实际值与理论值吻合性良好,表示此优化方案具备可行性。
2.3 玫瑰花渣多糖体外抗氧化活性结果分析
2.3.1 T-AOC结果分析
不同浓度玫瑰花渣多糖溶液的T-AOC见图6,随着样品浓度的升高,FRAP值也逐渐递增,表明Fe3+被还原成Fe2+的物质的量增多,样品具有一定的抗氧化能力。当玫瑰花渣多糖溶液的浓度为1 mg/mL时,多糖溶液的FRAP值明显低于VC,当多糖溶液浓度为5 mg/mL时,其FRAP值为0.30,与VC的FRAP值接近。
2.3.2 ABTS+·清除能力结果分析
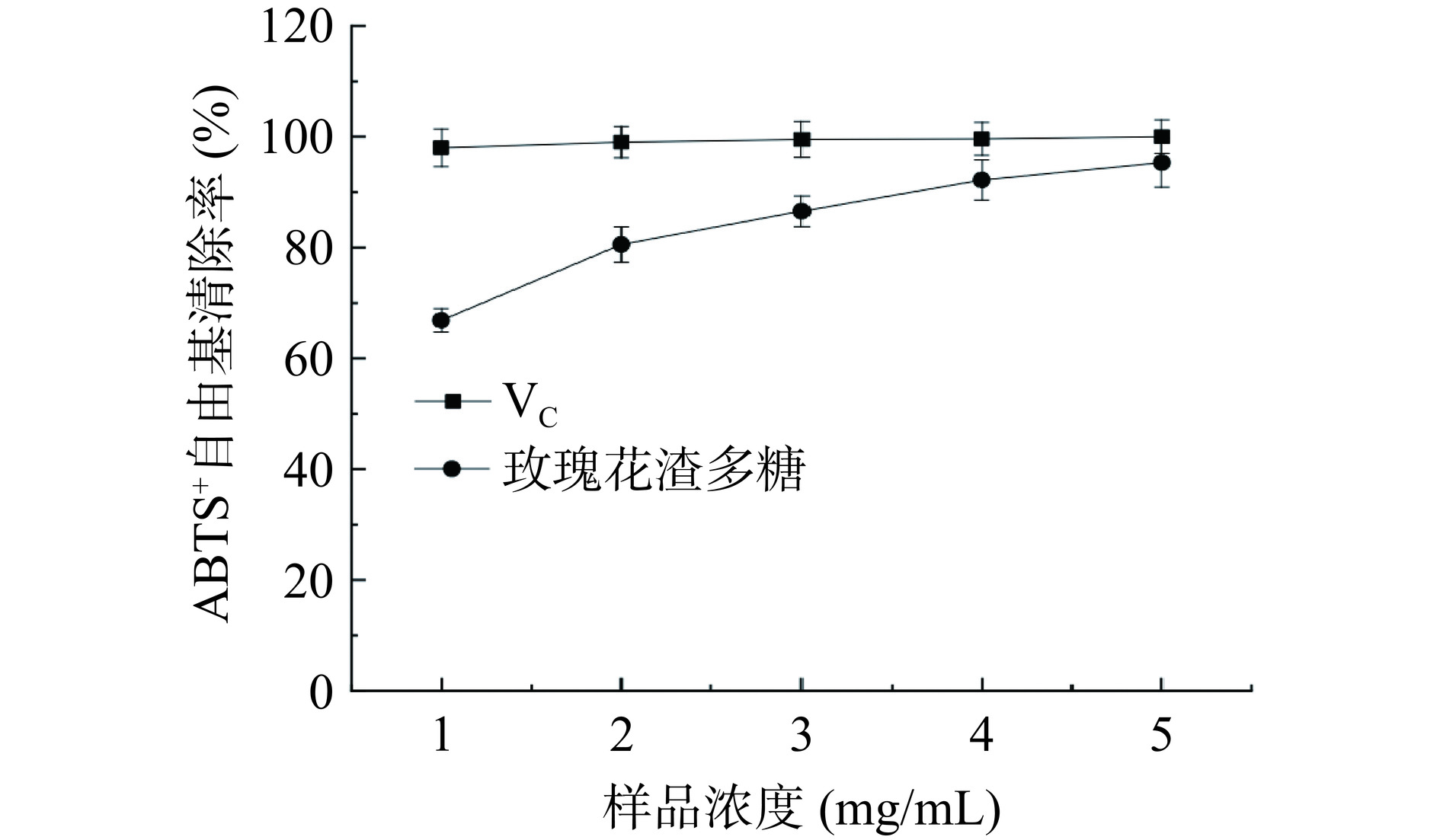
ABTS与K2S2O8能生成稳定的ABTS+,该阳离子溶液呈蓝绿色,抗氧化物质与ABTS+发生反应使溶液褪色,根据反应后溶液的吸光度可计算出抗氧化物质对ABTS+·的清除能力[23]。由图7可知,随着玫瑰花渣多糖溶液浓度增加,对ABTS+·清除率逐渐增大,当多糖溶液浓度为1 mg/mL时,其对ABTS+·清除率为66.87%,远小于VC对ABTS+·的清除率。当多糖溶液浓度为5 mg/mL时,其对ABTS+·清除率为92.19%,小于VC对ABTS+·的清除率,证明玫瑰花渣多糖对ABTS+·有一定的清除能力。
2.3.3 DPPH·清除能力结果分析
DPPH醇溶液呈紫色,抗氧化物质与其醇溶液反应使其颜色变浅或褪色,颜色越浅其吸光度越低,由吸光度可计算出该抗氧化物质对DPPH·的清除能力[24−26]。由图8可知,随着玫瑰花渣多糖浓度的增加,多糖对DPPH·的清除率逐渐增大,当多糖溶液浓度为1 mg/mL时,其对DPPH·清除率为80.78%,此时同浓度的VC对DPPH·的清除率为97.13%。当多糖溶液浓度为5 mg/mL时,其对DPPH·清除率为98.93%,与VC对DPPH·的清除率99.99%相接近,证明玫瑰花渣多糖对DPPH·的清除能力较强。
2.3.4 O2−·清除能力结果分析
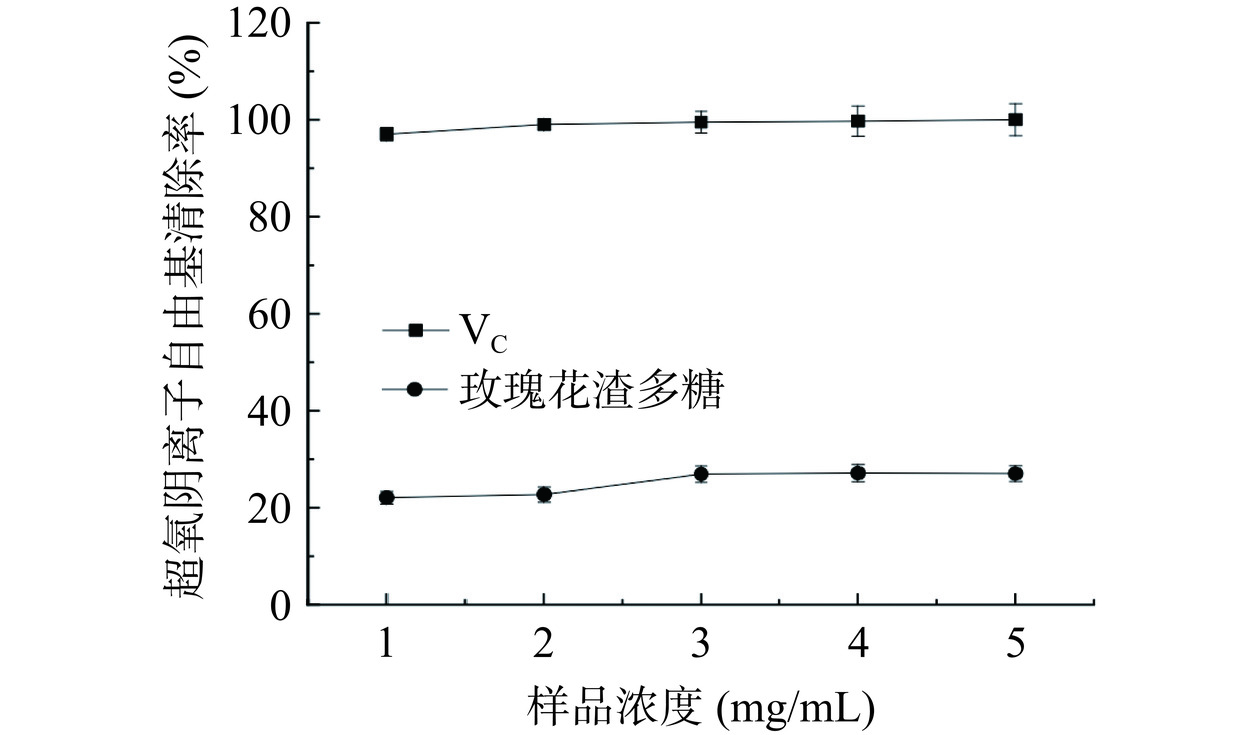
在弱碱性条件下,邻苯三酚能发生自氧化反应产生O2−·和有色中间产物,抗氧化剂能与O2−·反应阻止中间产物的积累,使其吸光度减小,进一步可计算出该抗氧化剂对O2−·的清除率[27]。由图9可知,玫瑰花渣多糖溶液浓度在1~5 mg/mL时,对O2−·的清除率在20%~25%之间浮动,对O2−·的清除能力并未随着玫瑰花渣多糖溶液浓度的增加而增大,且远小于VC对O2−·的清除能力,证明玫瑰花渣多糖对O2−·有一定的清除能力,但其清除能力较弱。
2.3.5 对不同自由基清除能力的IC50值的结果对比与分析
以VC为对照,测定玫瑰花渣多糖对ABTS+·、DPPH·、O2−·的清除能力,并计算IC50值,结果如表4所示。玫瑰花渣多糖对DPPH·的清除能力最强,对ABTS+·的清除能力次之,对O2−·较弱,其IC50值大小分别为0.357、0.608、64.206 mg/mL,由该结果可知,玫瑰花渣多糖对不同自由基清除能力大小与IC50值大小呈负相关。同时,玫瑰花渣多糖对不同自由基清除能力的IC50值均大于阳性对照。
表 4 玫瑰花渣多糖对不同自由基清除能力的IC50值的结果对比Table 4. Comparison of IC50 values for the scavenging ability of rose residue polysaccharides against different free radicals指标 自由基 玫瑰花渣多糖 VC ABTS+· 0.608 0.065 IC50(mg/mL) DPPH· 0.357 0.153 O2−· 64.206 0.155 3. 结论
本文以玫瑰花渣为原料,研究超声辅助纤维素酶与果胶酶复合提取玫瑰花渣多糖,通过响应面优化试验的结果得出:酶解时长>料液比>酶解温度>复合酶添加量;提取的最佳工艺为料液比1:15,复合酶添加量1.9%,酶解温度47 ℃,酶解时长84.5 min,此工艺下玫瑰花渣多糖得率为4.308%。体外抗氧化试验结果表明,增加多糖溶液浓度能显著提升T-AOC及DPPH·、ABTS+·等物质的清除能力,而对O2−·的清除表现出较弱作用。通过对不同自由基清除能力的IC50值大小对比得知,其与玫瑰花渣多糖对不同自由基清除能力大小呈负相关。多糖的抗氧化机制是研究的热点之一。多糖通过消除自由基、结合金属离子、抑制脂质过氧化等多种机制发挥抗氧化作用。本文研究了T-AOC、DPPH·清除、ABTS+·清除、O2−·清除的抗氧化能力,可以作为潜在的自由基清除剂,然而本研究只在体外对自由基的清除效果进行了研究,在生物体内玫瑰渣多糖是否具有抗氧化作用还有待于进一步研究。同时也为玫瑰花渣多糖的体外抗氧化结果对玫瑰花渣的回收再利用提供了理论依据。
-
表 1 响应面试验设计因素与水平
Table 1 Factors and levels used in response surface design
因素 水平 −1 0 1 A料液比(g/mL) 1:10 1:15 1:20 B复合酶添加量(%) 1.5 2.0 2.5 C酶解温度(℃) 40 45 50 D酶解时长(min) 30 60 90 表 2 Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken test
试验号 A料液比 B复合酶添加量 C酶解温度 D酶解时长 多糖得率(%) 1 0 1 1 0 3.11±0.12 2 0 0 −1 −1 3.42±0.29 3 0 0 0 0 4.99±0.36 4 −1 0 0 −1 3.34±0.18 5 0 −1 1 0 3.11±0.12 6 −1 0 0 1 3.99±0.21 7 0 0 −1 1 3.59±0.16 8 0 1 −1 0 3.29±0.22 9 0 0 0 0 4.79±0.18 10 1 0 1 0 2.52±0.23 11 0 −1 0 1 3.51±0.31 12 −1 0 1 0 3.10±0.13 13 1 0 0 1 3.31±0.17 14 1 1 0 0 3.56±0.15 15 0 1 0 1 3.60±0.21 16 0 1 0 −1 3.41±0.11 17 0 0 1 1 3.46±0.29 18 0 0 0 0 4.59±0.23 19 1 0 0 −1 3.16±0.16 20 0 −1 −1 0 2.93±0.12 21 −1 1 0 0 3.06±0.12 22 −1 −1 0 0 3.24±0.31 23 0 0 0 0 4.65±0.23 24 0 −1 0 −1 3.10±0.17 25 0 0 0 0 4.93±0.22 26 1 −1 0 0 2.72±0.33 27 1 0 −1 0 3.06±0.16 28 0 0 1 −1 2.68±0.29 29 −1 0 −1 0 3.15±0.17 表 3 响应面试验方差分析结果
Table 3 Response surface variance analysis
项目 平方和 自由度 均方 F值 P值 显著性 模型 12.3 14 0.8786 32.33 0.0001 ** A 0.1996 1 0.1996 7.34 0.0169 * B 0.1666 1 0.1666 6.13 0.0267 * C 0.1824 1 0.1824 6.71 0.0214 * D 0.4589 1 0.4589 16.88 0.0011 ** AB 0.2583 1 0.2583 9.5 0.0081 ** AC 0.0607 1 0.0607 2.23 0.1574 AD 0.0626 1 0.0626 2.3 0.1515 BC 0.033 1 0.033 1.21 0.2893 BD 0.0125 1 0.0125 0.4584 0.5094 CD 0.0907 1 0.0907 3.34 0.0892 A² 4.64 1 4.64 170.87 <0.0001 ** B² 4.05 1 4.05 148.92 0.0001 ** C² 5.75 1 5.75 211.48 <0.0001 ** D² 1.94 1 1.94 71.42 0.0001 ** 残差 0.3805 14 0.0272 失拟项 0.2644 10 0.0264 0.8873 0.6027 不显著 纯误差 0.1192 4 0.0298 总差 12.68 28 R2 0.9700 R2adj 0.9411 注:*:0.01<P<0.05,表示差异显著;**:P<0.01,表示差异极显著。 表 4 玫瑰花渣多糖对不同自由基清除能力的IC50值的结果对比
Table 4 Comparison of IC50 values for the scavenging ability of rose residue polysaccharides against different free radicals
指标 自由基 玫瑰花渣多糖 VC ABTS+· 0.608 0.065 IC50(mg/mL) DPPH· 0.357 0.153 O2−· 64.206 0.155 -
[1] 赵冰怡, 陈庆生, 龚盛昭. 玫瑰精油和玫瑰花水的制备及其护肤功效介绍[J]. 日用化学品科学,2018,41(11):30−33. [ZHAO B Y, CHEN Q S, GONG S Z. Preparation and skin care efficacy of rose essential oil and rose water[J]. Detergent & Cosmetics,2018,41(11):30−33.] ZHAO B Y, CHEN Q S, GONG S Z. Preparation and skin care efficacy of rose essential oil and rose water[J]. Detergent & Cosmetics, 2018, 41(11): 30−33.
[2] 吴志奔, 罗秋兰, 罗玉成. 玫瑰花色素对羊毛织物染色性能的研究[J]. 纺织科技进展,2017(12):26−29. [WU Z B, LUO Q L, LUO Y C. Study on dyeing properties of wool fabric with rose pigment[J]. Progress in Textile Science & Technology,2017(12):26−29.] doi: 10.3969/j.issn.1673-0356.2017.12.010 WU Z B, LUO Q L, LUO Y C. Study on dyeing properties of wool fabric with rose pigment[J]. Progress in Textile Science & Technology, 2017(12): 26−29. doi: 10.3969/j.issn.1673-0356.2017.12.010
[3] 张月, 周航, 吴海军. 玫瑰在食品中的应用及前景展望[J]. 现代食品,2021(11):25−27. [ZHANG Y, ZHOU H, WU H J. Application and prospect of Rosa rugosa in food[J]. Modern Food,2021(11):25−27.] ZHANG Y, ZHOU H, WU H J. Application and prospect of Rosa rugosa in food[J]. Modern Food, 2021(11): 25−27.
[4] 高嘉宁, 张丹, 龙伟, 等. 玫瑰花主要化学成分和药理作用研究进展[J]. 化学工程与装备,2021(3):205−206. [GAO J N, ZHANG D, LONG W, et al. Research progress on main chemical constituents and pharmacological effects of rose[J]. Chemical Engineering & Equipment,2021(3):205−206.] GAO J N, ZHANG D, LONG W, et al. Research progress on main chemical constituents and pharmacological effects of rose[J]. Chemical Engineering & Equipment, 2021(3): 205−206.
[5] WU Q Y, CHENG N, FANG D J, et al. Recent advances on application of polysaccharides in cosmetics[J]. Journal of Dermatologic Science and Cosmetic Technology,2024(1):100004.
[6] 宋志德, 余姝侨, 吕乐. 利用玫瑰花渣制作护肤产品探索[J]. 山东化工,2023,52(9):38−39,44. [SONG Z D, YU S Q, LÜ L. Exploration on making skin care products from rose dregs[J]. Shandong Chemical Industry,2023,52(9):38−39,44.] doi: 10.3969/j.issn.1008-021X.2023.09.011 SONG Z D, YU S Q, LÜ L. Exploration on making skin care products from rose dregs[J]. Shandong Chemical Industry, 2023, 52(9): 38−39,44. doi: 10.3969/j.issn.1008-021X.2023.09.011
[7] 李根. 荷叶多糖的提取、分离纯化、理化性质及生物活性研究[D]. 杭州:浙江工商大学, 2023. [LI G. Extraction, purification, physicochemical properties and bioactivities of Lotus leaf polysaccharides[D]. Hangzhou:Zhejiang Gongshang University, 2023.] LI G. Extraction, purification, physicochemical properties and bioactivities of Lotus leaf polysaccharides[D]. Hangzhou: Zhejiang Gongshang University, 2023.
[8] JAIDHAR D. Economic analysis of the influence of Rose cultivation on agricultural economic growth[J]. Journal of Global Economy, 2022, 4 (2):2.
[9] 鲁雷震, 贾紫伟, 封成玲, 等. 玫瑰植物中活性物质及其功效研究进展[J]. 食品研究与开发,2021,42(20):206−213. [LU L Z, JIA Z W, FENG C L, et al. Review of biologically active substances in rose plants and their functions[J]. Food Research and Development,2021,42(20):206−213.] doi: 10.12161/j.issn.1005-6521.2021.20.031 LU L Z, JIA Z W, FENG C L, et al. Review of biologically active substances in rose plants and their functions[J]. Food Research and Development, 2021, 42(20): 206−213. doi: 10.12161/j.issn.1005-6521.2021.20.031
[10] BIRHANIE Z, XIAO A P, YANG D W, et al. Polysaccharides, total phenolic, and flavonoid content from different kenaf (Hibiscus cannabinus L.) genotypes and their antioxidants and antibacterial properties[J]. Plants, 2021, 10(9):43−48.
[11] 裴育, 杨胜涛, 冯瑞. 细毛石花菜多糖自由基清除能力和理化性质的研究[J]. 食品与发酵工业,2022,48(4):235−242. [PEI Y, YANG S T, FENG R. Research on the free radical scavenging ability and physicochemical properties of the polysaccharides in Gelidium crinale[J]. Food and Fermentation Industries,2022,48(4):235−242.] PEI Y, YANG S T, FENG R. Research on the free radical scavenging ability and physicochemical properties of the polysaccharides in Gelidium crinale[J]. Food and Fermentation Industries, 2022, 48(4): 235−242.
[12] 王若男, 钱程, 郑鹏, 等. 黄精发酵液制备工艺优化及其抗氧化活性分析[J]. 中国酿造,2022,41(5):153−158. [WANG R N, QIAN C, ZHENG P, et al. Optimization of preparation technology and its antioxidant activity analysis of Polygonatum sibiricum fermentation broth[J]. China Brewing,2022,41(5):153−158.] doi: 10.11882/j.issn.0254-5071.2022.05.027 WANG R N, QIAN C, ZHENG P, et al. Optimization of preparation technology and its antioxidant activity analysis of Polygonatum sibiricum fermentation broth[J]. China Brewing, 2022, 41(5): 153−158. doi: 10.11882/j.issn.0254-5071.2022.05.027
[13] ZHANG Q A, WANG X, SONG Y. Optimization of pyrogallol autoxidation conditions and its application in evaluation of superoxide anion radical scavenging capacity for four antioxidants[J]. Journal of AOAC International,2016,99(2):504−511. doi: 10.5740/jaoacint.15-0223
[14] FEI Y M, LIU X C, ZHANG G S, et al. Study on ultrasonic-assisted water extraction of polysaccharides from sunflower tray[J]. IOP Conference Series:Earth and Environmental Science,2021,766(1):32−39.
[15] SONG J T, SHI D Q, HANG S, et al. Optimization of ultrasonic extraction of Lycium barbarum polysaccharides using response surface methodology[J]. International Journal of Food Engineering,2020,16(11):41−47.
[16] HU T G, ZOU Y X, LI E N, et al. Effects of enzymatic hydrolysis on the structural, rheological, and functional properties of mulberry leaf polysaccharide[J]. Food Chemistry,2021,355(1):70−76.
[17] 方芳, 杨丹, 张超, 等. 油茶籽粕多糖超声辅助盐酸降解工艺及动力学的研究[J]. 中国粮油学报,2022,37(8):188−193. [FANG F, YANG D, ZHANG C, et al. Ultrasonic-assisted hydrochloric acid degradation process and kinetics of polysaccharide from camellia seed meal[J]. Journal of the Chinese Cereals and Oils Association,2022,37(8):188−193.] doi: 10.3969/j.issn.1003-0174.2022.08.027 FANG F, YANG D, ZHANG C, et al. Ultrasonic-assisted hydrochloric acid degradation process and kinetics of polysaccharide from camellia seed meal[J]. Journal of the Chinese Cereals and Oils Association, 2022, 37(8): 188−193. doi: 10.3969/j.issn.1003-0174.2022.08.027
[18] 王鑫, 韩烨, 马永强, 等. 超声辅助提取甜玉米芯多糖工艺优化及抗氧化性评价[J]. 粮食与油脂,2022,35(7):115−119. [WANG X, HAN Y, MA Y Q, et al. Optimization of ultrasonic assisted extraction of polysaccharide from sweet corncob and evaluation of its antioxidant activity[J]. Cereals & Oils,2022,35(7):115−119.] doi: 10.3969/j.issn.1008-9578.2022.07.025 WANG X, HAN Y, MA Y Q, et al. Optimization of ultrasonic assisted extraction of polysaccharide from sweet corncob and evaluation of its antioxidant activity[J]. Cereals & Oils, 2022, 35(7): 115−119. doi: 10.3969/j.issn.1008-9578.2022.07.025
[19] HUANG Q Q, XIAO B, CHEN S, et al. Effect of enzyme-assisted extraction on the chemical properties and antioxidant activities of polysaccharides obtained from the wood ear mushroom, auricularia auricula (Agaricomycetes)[J]. International Journal of Medicinal Mushrooms,2022,24(2):61−67.
[20] 宋笛. 响应面优化微波辅助提取白鬼笔多糖及其抗氧化和抗糖化能力[J]. 食品研究与开发,2021,42(20):130−136. [SONG D. Response surface methodology for optimization of microwave-assisted extraction of polysaccharides from Phallus impudicus and their antioxidation and antiglycation abilities[J]. Food Research and Development,2021,42(20):130−136.] doi: 10.12161/j.issn.1005-6521.2021.20.019 SONG D. Response surface methodology for optimization of microwave-assisted extraction of polysaccharides from Phallus impudicus and their antioxidation and antiglycation abilities[J]. Food Research and Development, 2021, 42(20): 130−136. doi: 10.12161/j.issn.1005-6521.2021.20.019
[21] XU K Q, DOU J F, WU C E, et al. Effects of ultrasound-assisted Fenton treatment on structure and hypolipidemic activity of apricot polysaccharides[J]. Food Bioscience,2022,50(PA):80−88.
[22] 胡罗松, 郑青松, 文雨欣, 等. 微波辅助提取莲子心多糖的工艺优化及其抗氧化活性研究[J]. 食品研究与开发,2022,43(15):109−116. [HU L S, ZHENG Q S, WEN Y X, et al. Microwave-assisted extraction optimization and antioxidant activity of polysaccharide from Plumula nelumbinis[J]. Food Research and Development,2022,43(15):109−116.] HU L S, ZHENG Q S, WEN Y X, et al. Microwave-assisted extraction optimization and antioxidant activity of polysaccharide from Plumula nelumbinis[J]. Food Research and Development, 2022, 43(15): 109−116.
[23] 李雪晖, 田龙, 罗心雨, 等. 米糠多糖提取工艺优化及抗氧化活性研究[J]. 粮食与油脂,2022,35(6):120−123,130. [LI X H, TIAN L, LUO X Y, et al. Optimization of extraction process and antioxidant activity of polysaccharide from rice bran[J]. Cereals & Oils,2022,35(6):120−123,130.] LI X H, TIAN L, LUO X Y, et al. Optimization of extraction process and antioxidant activity of polysaccharide from rice bran[J]. Cereals & Oils, 2022, 35(6): 120−123,130.
[24] MENG Q R, CHEN Z H, CHEN F, et al. Optimization of ultrasonic-assisted extraction of polysaccharides from Hemerocallis citrina and the antioxidant activity study[J]. Journal of Food Science,2021,86(7):42−48.
[25] 刘薇, 邱乐, 杨婧. ABTS与邻二氮菲-Fe3+法测定保健食品抗氧化能力比较分析[J]. 食品工业,2013,34(3):120−124. [LIU W, QIU L, YANG J. Comparisons of the performance of ABTS and (1,10)-2 phenanthroline-Fe3+ in antioxidant capacity measuring[J]. The Food Industry,2013,34(3):120−124.] LIU W, QIU L, YANG J. Comparisons of the performance of ABTS and (1,10)-2 phenanthroline-Fe3+ in antioxidant capacity measuring[J]. The Food Industry, 2013, 34(3): 120−124.
[26] MAYRFIS D, HAINIL S, WIDIASTUTI S. Antioxidant activity of methanol extract natuna marune sponge (porifera) with DPPH method[J]. Asian Journal of Pharmaceutical and Clinical Research,2021,42(4):62−69.
[27] ABDALLA H, ADARPSY M H, HEGAZY H S, et al. Potential of green synthesized titanium dioxide nanoparticles for enhancing seedling emergence, vigor and tolerance indices and DPPH free radical scavenging in two varieties of soybean under salinity stress[J]. BMC Plant Biology,2022,22(1):70−76. doi: 10.1186/s12870-022-03458-3





 下载:
下载:

 下载:
下载:
