Ameliorating Effect of Polyphenol Extract of Rosa roxburghii on Obese Mice Induced by High Fat Diet
-
摘要: 目的:为了研究刺梨多酚提取物对高脂饮食诱导的肥胖小鼠的改善作用。方法:分别以多酚含量400 mg/kg BW/d的剂量对高脂饮食小鼠进行干预。连续灌胃4周,测定小鼠体重、肝脏指数、白色脂肪及肝脏组织形态学变化、血清生化指标、脏器抗氧化能力和肠道屏障。结果:与CON组相比,MODEL组胰岛素水平(Insulln,INS)和炎症因子水平均显著(P<0.05,P<0.01)提高,血脂四项中高密度脂肪(High-density lipoproteincholesterol,HDL-C)水平显著降低(P<0.01),总胆固醇(Total cholesterol,TC)、甘油三酯(Triglyceride,TG)和低密度脂肪(Low-density lipoprolesterol,LDL-C)水平显著升高(P<0.01);抗氧化物中超氧化物歧化酶(Superoxide Dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)活力显著下降(P<0.01),肠道屏障蛋白表达水平及短链脂肪酸(Short-chain fatty acids,SCFAs)水平均显著降低(P<0.01);与MODEL相比,多酚干预组(RF、RP组)炎症因子和氧化应激水平显著降低(P<0.05,P<0.01),RF组抗氧化物SOD、GPx活力显著提升(P<0.01),RF组和RP组肠道内ZO-1、Claduin-1和SCFAs水平均发生显著逆转(P<0.01)。结论:刺梨多酚提取物能有效缓解高脂饮食诱导的肥胖小鼠体内代谢紊乱,减缓体重增长,保护脂肪和肝脏组织细胞形态变化,缓解肥胖小鼠体内炎症和氧化应激水平,增强肠道屏障功能,且RF效果优于RP。Abstract: Objective: To investigate the beneficial effects of phenolic extracts of Rosa roxburghii Tratt. on obese mice induced by a high-fat diet. Methods: The intervention involved administering polyphenol extract at a dose of 400 mg/kg body weight per day to mice on a high-fat diet. The mice were orally gavaged continuously for 4 weeks, and various parameters such as body weight, liver index, histomorphological changes in white fat and liver tissues, serum biochemical markers, organ antioxidant capacity, and intestinal barrier function were examined. Results: In comparison to control group (CON), the MODEL group (MODEL) exhibited significantly (P<0.05, P<0.01) increased the level of insulin and inflammatory factors. The levels of high-density lipoprotein cholesterol (HDL-C) decreased in the four blood lipids, while the levels of total cholesterol (TC), triglycerides (TG), and low-density lipoprotein cholesterol (LDL-C) significantly increased (P<0.01). The activities of superoxide dismutase (SOD) and glutathione peroxidase (GPx) in antioxidants were significantly reduced (P<0.01), the expression levels of intestinal barrier proteins and short chain fatty acids (SCFAs) were significantly reduced (P<0.01). In comparison to MODEL group, the polyphenol intervention groups (RF and RP) showed significantly decreased levels of inflammatory factors and oxidative stress (P<0.05, P<0.01), The activity of antioxidant SOD and GPx in the RF group was significantly increased, and the levels of ZO-1, Claduin-1, and SCFAs in the gut of both the RF and RP groups were significantly reversed (P<0.01). Conclusion: Prickly pear polyphenol extract effectively alleviated metabolic disorders in high-fat diet-induced obese mice in vivo, resulting in reduced body weight gain, protection against cellular changes in adipose and hepatic tissues, alleviation of inflammation and oxidative stress, and enhanced intestinal barrier function. Notably, the RF group showed a superior effect to the RP group.
-
肥胖是遗传和环境因素之间复杂的相互作用的结果。世界卫生组织估计,2016年全球有超过19亿成年人超重,到2025年全球成年人肥胖人数将占总人数五分之一[1]。众所周知,肥胖会增加多种疾病的风险[2],例如非酒精性脂肪肝、糖尿病、心血管疾病、中风和高脂血症。目前,治疗肥胖的药物有奥利司他(减少肠道脂肪吸收)和西布曲明(抑制食欲),但这两种药物都有副作用,如转氨酶升高、头晕、重度肝炎[3]。天然来源的抗肥胖剂是当前研究的热点,研究表明酚类可能在肥胖的治疗中发挥相关作用,调节涉及能量代谢和肥胖的生理和分子途径[4],通过与消化菌群相互作用参与代谢途径的改变,这类有益菌群能产生短链脂肪酸如乙酸、丙酸及丁酸等,增加宿主三大营养物质糖、脂肪和蛋白质的能量代谢,减少脂肪贮存,改善肥胖状况[5]。已有研究证实从生姜、桃、辣椒中提取出的酚类物质具有抗脂肪形成和脂肪分解的作用[6]。
刺梨是贵州一种极具特色水果,富含活性成分,尤其是酚类物质种类和含量极其丰富,已有研究证明刺梨多酚提取物具有抗炎、抗氧化、降血压和降血糖的功能[7-8],通过液相色谱-串联质谱从刺梨中鉴定出533种代谢物,其中酚类物质都与至少一种抗氧化物活性显著相关[9]。刺梨果渣多酚能够提高SOD、GPx活性和抑制MDA生成,达到减轻氧化应激反应和减少细胞凋亡的效果[10]。刺梨多酚提取物能够提高高血压小鼠一氧化氮水平,改善内皮细胞功能从而降低血压[11]。刺梨却少见刺梨多酚提取物抑制肥胖的作用机制的报道。
本研究利用刺梨多酚提取物干预肥胖小鼠并观测其对肥胖小鼠糖脂代谢紊乱的改善作用,旨在探究其调节糖脂代谢紊乱的作用机制,为刺梨多酚提取物功能研究及产品应用提供新的方向。
1. 材料与方法
1.1 材料与仪器
刺梨 由贵州山王果健康实业有限公司提供;高脂饲料(D12492,Research Diets)、总胆固醇(total cholesterol,TC)试剂盒、甘油三酯(triglyceride,TG)试剂盒、高密度脂蛋白胆固醇(High-density lipoproteincholesterol,HDL-C)试剂盒、低密度脂蛋白胆固醇(Low-density lipoproteincholesterol,LDL-C)测试盒、丙二醛(Malondialdehyde,MDA)含量试剂盒、髓过氧化物酶(myeloperoxidase,MPO)、超氧化物歧化酶(Superoxide Dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GPx)试剂盒 南京建成生物工程研究所;胰岛素(Insulln,INS)ELISA检测试剂盒、肿瘤坏死因子α(TNF-α)ELISA检测试剂盒、小鼠白细胞介素1β(IL-1β)ELISA检测试剂盒、内毒素(LPS)ELISA 检测试剂盒 上海酶联生物科技有限公司;乙酸(Acetic acid)、丙酸(Propionic acid)、丁酸(Butyric acid)标准品 Dr.Ehrenstorfer;C57BL/6J小鼠 雄性,32只,4周龄,(16±2) g,(实验动物生产许可证编号SCXK(京)2019-0010),购于斯贝福(北京)生物技术有限公司,实验动物经贵州大学动物实验伦理委员会批准(编号:EAE-GZU-2020-P005)。
Accu-Chek Performa血糖仪 德国Roche Diagnostics GmbH;mlISKANMK3酶标仪 Thermo;DYCZ-40电泳仪 北京六一仪器厂;HI650离心机 湖南湘仪实验室仪器开发有限公司;GC-2030气相色谱、QP2020 NX质谱仪 岛津;LEiCA RM2016病理切片机 上海徕卡仪器有限公司;FI3成像系统 日本尼康;Pannoramic MIDI高分辨玻片扫描系统 匈牙利3DHISTECH Ltd;HM525冰冻切片机、Qubit 4.0荧光定量仪 Thermo公司;JY600C双稳定时电泳仪 北京君意东方电泳设备有限公司。
1.2 实验方法
1.2.1 刺梨多酚提取
参考Wang等[12]的研究方法,将整个刺梨鲜果、榨汁后果渣在55 ℃下干燥10 h。用80%乙醇溶液以10:1(v/w)的液固比提取多酚。重复浸提三次。50 Hz超声3 h搅拌浸泡提取,抽滤除去杂质,将提取物合并过滤,然后于50 ℃真空浓缩。用AB-8大孔树脂纯化浓缩后的提取物,得到纯化的刺梨全果和刺梨渣多酚提取物。将所得的刺梨全果多酚提取物(RF)(纯度55%)、刺梨果渣多酚提取物(RP)(纯度58%)冷冻干燥,储存在−80 ℃下。
1.2.2 动物实验设计
32只4周龄雄性C57BL/6J小鼠(16±2) g,于温度(25±1) ℃、光暗周期12 h循环的动物房饲养,给予正常饮食饮水,适应性喂养1周。消除运输过程中小鼠的应激反应后将小鼠随机分成四组:普通饮食组(CON,n=8)、肥胖模型组(MODEL组,n=8)、果多酚灌胃组(RF组,n=8)、渣多酚灌胃组(RP组,n=8)。普通饮食给予普通饲料,MODEL组、RF组、RP组给予高脂饲料。RF组和RP组在饲喂高脂饲料的同时,经前期预实验,分别进行刺梨果多酚灌胃(400 mg/kg BW/d)和刺梨果渣多酚灌胃(400 mg/kg BW/d)。持续7周,当MODEL组小鼠体质量超过CON组小鼠体质量20%即代表造模成功。实验结束后,进行12 h的禁食不禁水,用乙醚麻醉后脱颈处死,收集血液在4 ℃、3000 r/min下离心10 min以获得血清。清洗并称量肝组织重量,以计算器官指数。然后将部分肝脏(肝左叶)置于4%多聚甲醛中固定、附睾白色脂肪置于专用的脂肪固定液中固定,随后进行组织病理学分析。血清、结肠内容物及剩余组织置于−80 ℃,备用。
1.2.3 小鼠体重参数的变化
于每周一对体重、饮水量和饲料消耗量进行如实记录并统计,处死前1 d进行称重,解剖后对肝脏进行称重,式(1)用于计算肝脏指数。
肝脏指数(%)=肝脏重量(g)活体重量(g)×100 (1) 1.2.4 组织学分析
苏木精-伊红(HE)染色:将存于结肠固定液或4%多聚甲醛中的结肠组织进行梯度乙醇脱水后,用石蜡包埋后进行切片,随后用二甲苯、乙醇依次进行梯度洗脱后水洗,然后进行苏木精和伊红染色,再使用乙醇、正丁醇、二甲苯依次梯度脱水,晾干后用中性树胶封片。利用Pannoramic MIDI高分辨玻片扫描系统进行病理学分析。将肝脏组织样品用OTC包埋剂浸没组织,置于−20 ℃冷冻。采用冰冻切片机对存于4%多聚甲醛中的肝脏组织进行冰冻切片,将冰冻切片肝脏组织进行复温干燥,用4%多聚甲醛固定15 min,有助于保持切片的稳定性和细胞结构。使用蒸馏水进行水洗后晾干,然后进行油红O染色的复染,用滤纸吸去周围的水分,使用甘油明胶封片,完成扫描并进行病理学分析。
1.2.5 口服葡萄糖耐量试验
在杀鼠前一周,小鼠禁食不禁水12 h,每组小鼠按体重灌胃葡萄糖溶液(2 g/kg BW),随后分别在0、30、60、90和120 min采集尾部血样,利用血糖仪测定血糖,并计算葡萄糖曲线下面积(AUC)值。
1.2.6 胰岛素抵抗
血清中INS水平用试剂盒测定。详细实验步骤参照试剂盒说明书。胰岛素抵抗利用式(2)计算[13]:
胰岛素抵抗(HOMA−IR)=(FBG×FINS)/22.5 (2) 式中,HOMA-IR为胰岛素抵抗指数(homeostasis model assess-ment for insulin resistance);FINS为血清空腹胰岛素(fasting serum lisulin);FBG为血清空腹血糖(fasting blood glucose)。
1.2.7 小鼠生化指标检测
采用试剂盒检测血清组织及肝脏组织的TNF-α、IL-1β,肝脏组织MDA、MPO、SOD、GPx、LPS。详细的步骤参照对应的试剂盒说明书。
1.2.8 Western Blot检测
将少量的结肠组织剪碎置于2 mL EP管中,每管加入钢珠和300 μL单去污剂裂解液,置于自动匀浆机中匀浆,匀浆完成后将EP管置于冰上裂解30 min后,在4 ℃下12000 r/min离心5 min,所得上清液即为蛋白液。接着采用BCA法(Bicinchoninic Acid Assay,BCA)测定蛋白质浓度。将提取的蛋白上清与上样缓冲液(体积比按照4:1混合),放入沸水中进行沸水浴10 min使其变性。采用SDS-PAGE(十二烷基硫酸钠-聚丙烯酰胺凝胶电泳)凝胶分离蛋白质,并转移到0.45 μm的PVDF膜上。接着用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。然后与一抗(β-actin、ZO-1、Claudin-1与封闭液以1:1100稀释、Claudin1与封闭液以1:2000稀释)在4 ℃下孵育过夜后洗去多余的一抗,用TBST以1:3000稀释相应的HRP标记二抗,使PVDF膜浸泡于二抗孵育液中,常温摇床孵育2 h后洗去多余的二抗。加入ECL试剂,反应数分钟待荧光带明显后,X光胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。最后用IPP分析胶片灰度值。
1.2.9 结肠内容物SCFAs
1.2.9.1 样品的预处理
取结肠内容物于2 mL EP管中,加入1 mL纯水,涡旋10 s;加入钢珠,40 Hz研磨仪处理4 min,冰水浴超声5 min,重复3次;接着在4 ℃下,5000 r/min离心20 min;移取0.8 mL上清液于2 mL EP管中;加入0.1 mL 50% H2SO4,加入0.8 mL提取液(含内标2-甲基戊酸,25 mg/L,甲基叔丁基醚),涡旋10 s,振荡10 min,冰水浴超声10 min再将样本于4 ℃、10000 r/min离心15 min;在−20 ℃下静置30 min;取出上清液于进样瓶中,备用。前期研究表明乙酸、丙酸和丁酸是最重要的三种脂肪酸,配制乙酸、丙酸、丁酸的混标溶液,梯度稀释后,进行气相色谱仪分析[14],绘制标准曲线如表1。SCFAs的含量以μg/g结肠内容物干重表示[14]。
表 1 3种脂肪酸的标准曲线Table 1. Standard curve for 3 fatty acids编号 组分 保留时间(min) 线性方程 决定系数R2 线性范围(mg/L) 1 乙酸 5.380 y=0.015x+0.0022 0.9999 1~50 2 丙酸 6.350 y =0.0113x+0.0012 0.9998 1~50 3 丁酸 7.365 y=0.0413x−0.0036 0.9998 1~20 1.2.9.2 GC-MS检测
采用配有Agilent HP-FFAP毛细管(30 m×250 μm×0.25 μm,J&W Scientific,Folsom,CA)的岛津GC2030-QP2020 NX气相色谱质谱联用仪对样品中的SCFAs进行检测。载体气体为氢气,传输线温度和进样口温度均设置为240 ℃。检测程序:80 ℃保持1 min,以10 ℃/min的速度升温到200 ℃,保持5 min,并以40 ℃/min的速度持续升温到230 ℃,保持1 min,分流比为5:1,进样量为1.0 μL。MS条件:电子轰炸(EI)离子源;电子能量70 eV;离子源温度为320 ℃;传输线温度为250 ℃;质量扫描范围m/z 40~580。
1.3 数据处理
数值定义为平均值±标准差(Mean±SD)。使用GraphPad Prism 9做图,使用单因素方差分析和Newman-Keuls多重比较检验。差异的显著性描述为与MODEL组相比,*P<0.05、**P<0.01和***P<0.001。
2. 结果与分析
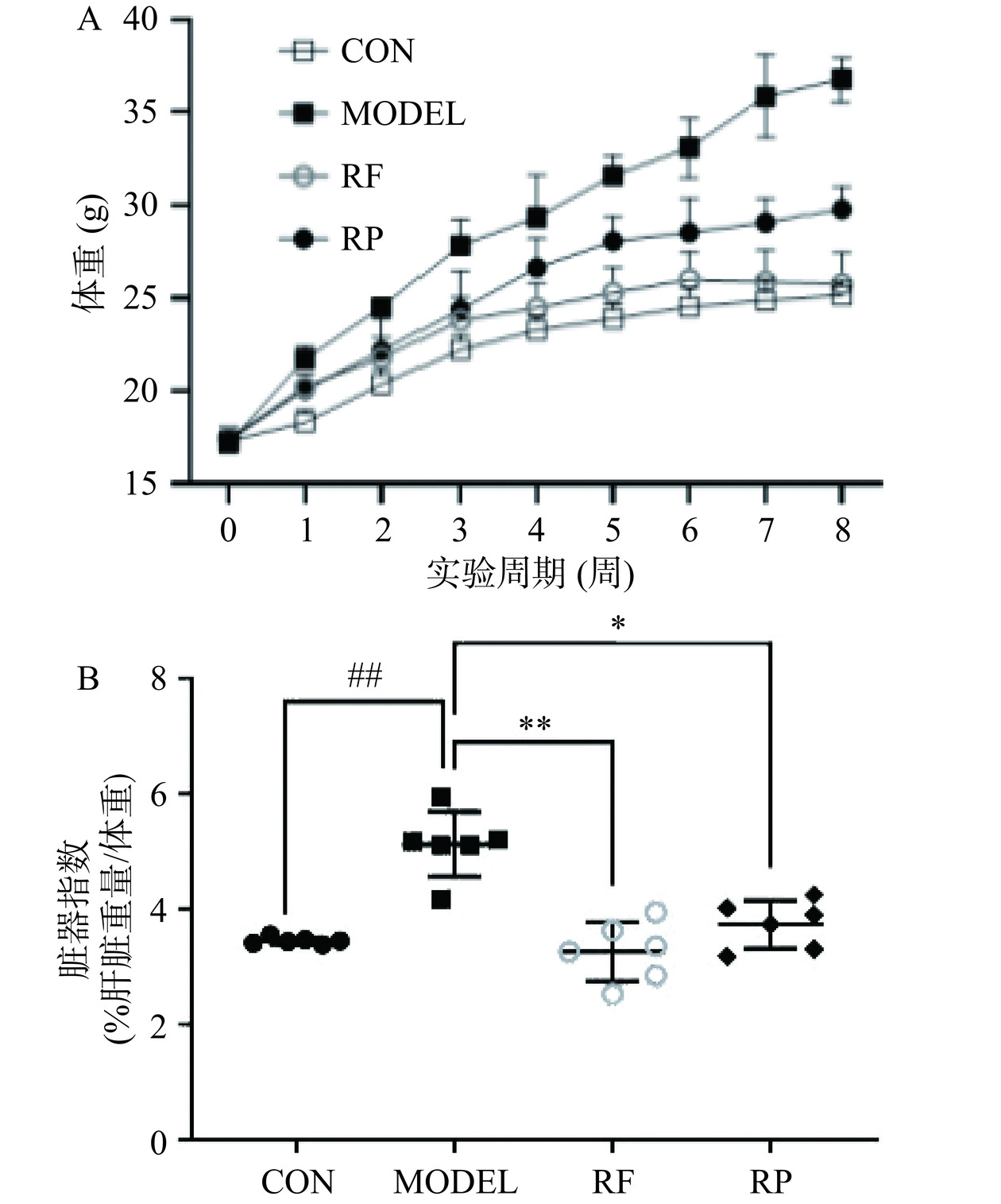
2.1 刺梨多酚提取物对肥胖小鼠体重、脏器指数的影响
由图1可知,与CON组相比,经过高脂饲料喂养后第7周 MODEL组体重和肝脏指数显著提升(P<0.01),表明肥胖小鼠体内代谢产生紊乱。经过刺梨果、渣多酚干预后,RF组、RP组体重和肝脏指数明显得到控制,其中RF组体重在喂养结束后与CON组无显著差异(P>0.05)。与MODEL相比,RF组、RP组肝脏指数分别降低44.24%、36.12%。有研究报道,如苏麻[15]、枸杞[16]中的天然多酚提取物也具有减轻体重的作用。推测刺梨果、渣多酚能明显缓解小鼠肥胖症状,且刺梨果多酚效果好于渣多酚。
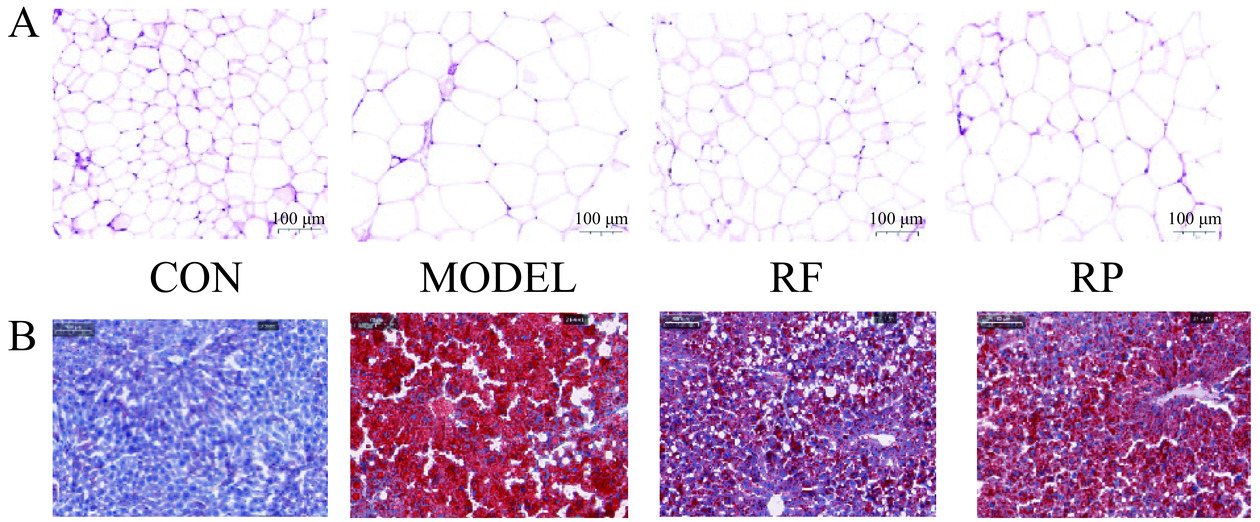
2.2 刺梨多酚提取物对肥胖小鼠脂肪和肝脏组织学分析
如图2A所示,CON组小鼠的白色脂肪组织中,脂肪细胞体积较小,且细胞的分布排列均一整齐,MODEL组脂肪细胞明显增大,脂滴增多。RF组和RP组相差不大,且两组脂肪细胞体积都比MODEL组小,比CON组略大。因此刺梨多酚的干预可以减小脂肪细胞体积,避免肥胖导致的脂肪堆积。
如图2B所示小鼠肝脏组织HE染色,CON组肝脏组织细胞结构完整,分布整齐;与CON组相比,MODEL组肝脏组织细胞无明显细胞形态,且空泡数量多、空泡面积大。与MODEL组相比,RF组、RP组肝脏组织细胞排列略整齐,脂肪空泡面积减小更接近CON组。综上结果表明,刺梨多酚可干预肥胖引起的肝损伤,保护肝脏组织,维持肝脏的脂代谢功能正常。
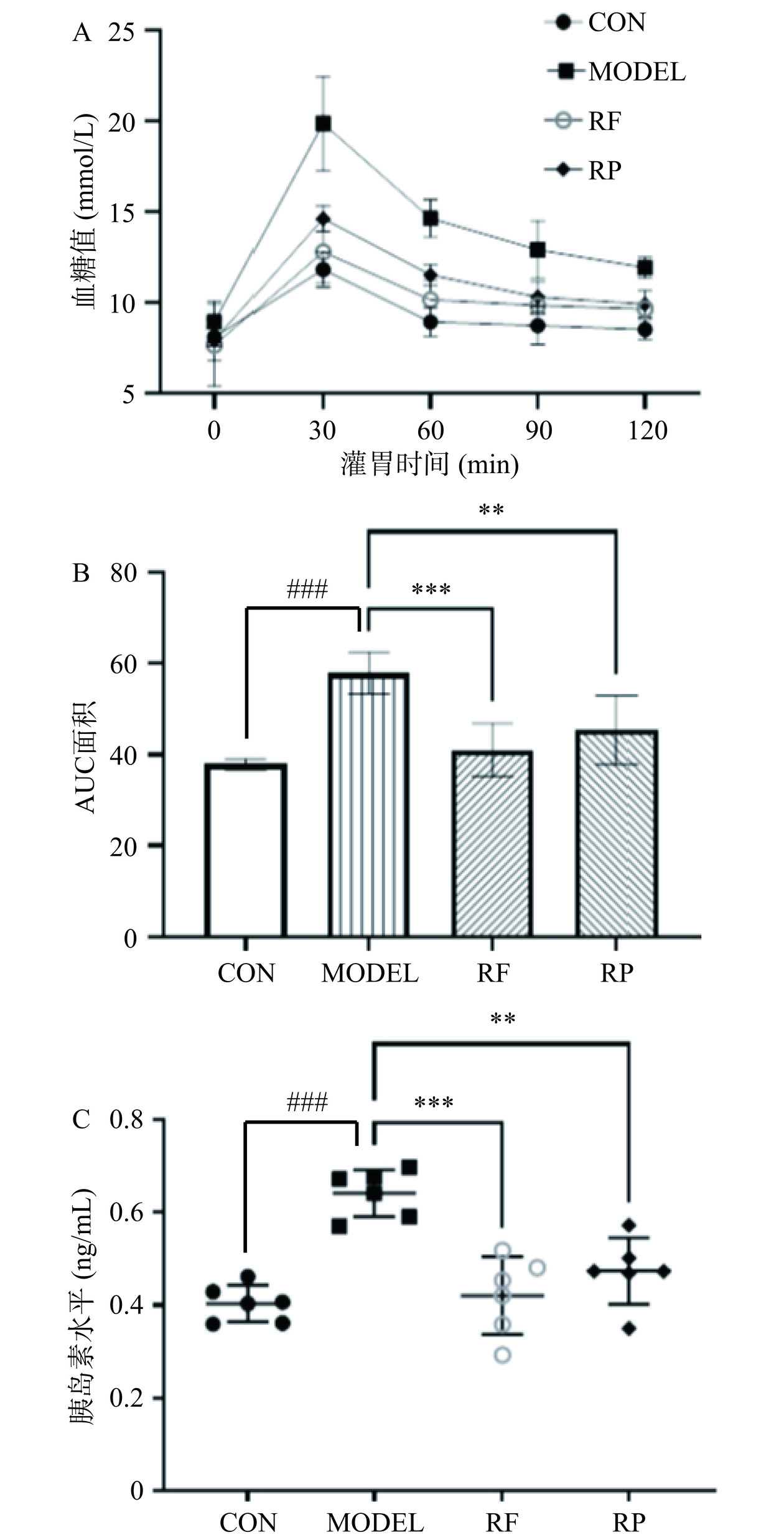
2.3 刺梨多酚提取物对肥胖小鼠胰岛素抵抗和糖耐量的影响
如图3所示,与CON组相比,MODEL组小鼠的OGTT、AUC值及INS水平均显著升高(P<0.001),说明高脂饮食诱导了MODEL组小鼠血糖升高,显现出胰岛素抵抗和葡萄糖不耐受症状,有患2型糖尿病的风险。与MODEL组相比,RF组和RP组的OGTT值、AUC值及INS水平均显著降低(P<0.01,P<0.001),且RF组的INS水平(0.42 ng/mL)低于RP组(0.47 ng/mL)。多酚物质如黄瓜多酚提取物、菠萝多酚提取物可以有效降低小鼠胰岛素水平,维持血液中葡萄糖稳态[17−18]。本研究中刺梨果、渣多酚明显干预高脂饮食引起的葡萄糖不耐受,且刺梨果多酚干预效果好于渣多酚。
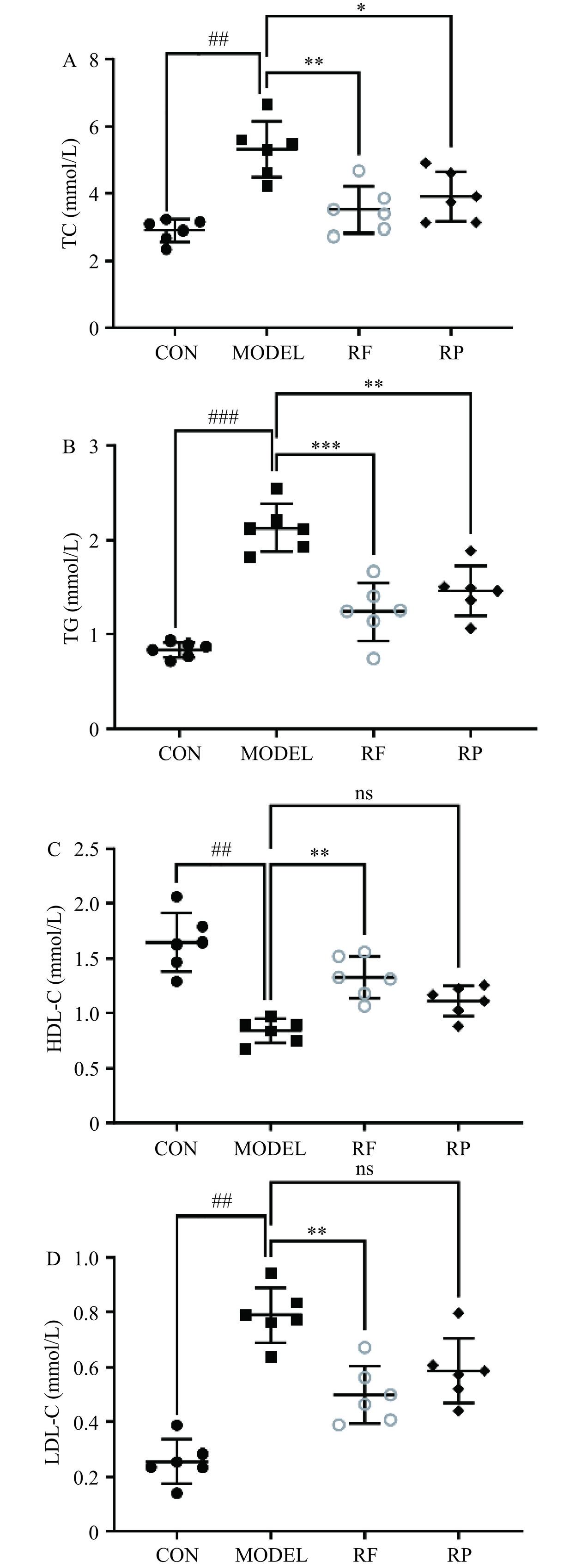
2.4 刺梨多酚提取物对肥胖小鼠血清生化指标的影响
如图4所示,与CON组相比,MODEL组TC、TG、LDL-C的水平均显著升高45.59%、60.41%、67.60%,HDL-C水平则降低了49.07%(P<0.001,P<0.01)。表明高脂饮食喂养的MODEL组小鼠体内出现血脂异常。HDL-C的变化通常与TG和LDL-C的变化同时发生,通过介导胆固醇从外周组织、肝细胞和巨噬细胞流出而发挥逆胆固醇转运的作用,HDL-C水平的下降会导致肥胖发生[19]。而多酚类化合物可改善血脂四项,给高脂肪饮食喂养的大鼠口服富含多酚的紫苏叶提取物,可显著降低肥胖小鼠血清中TC、TG、LDL-C水平,升高HDL-C水平[20]。高剂量洋葱多酚提取组具有降低肝脏中TC、TG和LDL-C水平的能力,同时增加HDL-C水平的能力[21]。本研究结果显示,与MODEL组相比,RF组、RP组的TC、TG含量则显著降低(P<0.001),经干预后RF组LDL-C含量显著降低(P<0.01)。RF组的TC(3.51 mmoL/L)、TG(1.24 mmoL/L)、LDL-C(0.50 mmoL/L)含量均在高脂饮食喂养组中最低,RF组、RP组HDL-C水平则分别升高了36.93%、24.57%。提示刺梨多酚可以改善高脂饮食引起的高血脂,减少体内脂肪堆积,降低且刺梨果多酚的效果优于刺梨渣多酚。
2.5 刺梨多酚提取物对肥胖小鼠炎症因子的影响
研究表明,肥胖和氧化应激可导致炎症因子水平增加,炎症可能在产生胰岛素抵抗、胰岛素分泌缺陷以及能量稳态其他方面的破坏方面发挥着致病作用[22]。如图5所示,与CON组相比,MODEL组小鼠血清及肝脏中IL-1β及TNF-α水平均显著升高(P<0.05,P<0.01),表明MODEL组小鼠体内出现慢性炎症。通过刺梨多酚干预后,与MODEL组相比,RF组IL-1β、TNF-α分别下降35.03%、26.67%。RP组IL-1β、TNF-α及分别下降23.70%、21.28%。通过刺梨多酚的干预,肥胖小鼠体内炎症水平下降,减少了发生慢性炎症的可能性。同时检测了肥胖小鼠肝脏部位炎症因子,经刺梨多酚干预后,炎症水平整体出现相同下降趋势。表明肥胖小鼠体内均出现不同程度的慢性炎症侵入,通过刺梨多酚的干预能有效地缓解体内炎症情况。
2.6 刺梨多酚提取物对肥胖小鼠氧化应激水平的影响
有研究指出,氧化应激是肥胖及相关代谢综合征的主要原因[23]。氧化应激氧化剂和抗氧化酶/底物之间的不平衡将导致一系列氧化还原反应,随后通过诱导细胞应激反应并刺激细胞死亡而引起细胞毒性[24]。抗氧化剂如SOD、GPx等可以通过捕获自由基和恢复细胞功能来保护细胞免受氧化应激[25]。图6显示了肥胖小鼠血清中氧化应激的水平。与CON组相比,MODEL组MDA、MPO水平显著升高71.17%、37.20%(P<0.01),SOD、GPx抗氧化物水平则分别显著下降269.47%、95.17%(P<0.01)。与MODEL组相比,RF组MDA、MPO水平显著降低55.84%、39.71%(P<0.01),SOD、GPx抗氧化物水平则分别显著上升62.72%、29.87%(P<0.01)。与MODEL组相比,RP组的MDA、MPO水平分别显著降低48.93%、32.51%(P<0.01),SOD、GPx抗氧化物水平则分别上升7.74%、34.61%,但不显著。在Li等[26]的研究中也表明添加枇杷多酚可以有效缓解高脂饮食诱导的小鼠氧化应激。提示刺梨多酚的干预能通过减少氧化产物(MDA、MPO)的量和增加抗氧化物(SOD、GPx)的量,来降低高脂饮食引起氧化损伤的风险。
2.7 刺梨多酚提取物对肥胖小鼠肠道通透性的影响
脂多糖(lipopolysaccharide,LPS)可引起肠道乃至全身的炎症反应,通过激活肠道内的TLR4释放TNF-α、IL-1β等炎症因子,导致肠道局部炎症反应,局部炎症又通过破环由Zo-1和Claudin-1相互作用形成的紧密连接结构使肠道通透性升高[27−28]。如图7A刺梨多酚对肥胖小鼠肠道中LPS浓度的影响,与CON组比,MODEL组LPS浓度显著增加了60.49%(P<0.01);刺梨多酚干预高脂饮食后,RF组、RP组肥胖小鼠体内LPS浓度显著降低(P<0.01)。通过对小鼠肠道屏障通透性蛋白的检测发现(图7B、图7C),与CON组相比,MODEL组的ZO-1、Claudin-1蛋白表达量均显著降低(P<0.001),表明肥胖能导致小鼠结肠上皮细胞屏障受损。通过刺梨多酚的治疗,与MODEL组相比,RF组ZO-1、Claudin-1蛋白表达量分别提高62.43%、63.53%(P<0.001)。RP组ZO-1、Claudin-1蛋白表达量分别提高21.71%(P>0.05)、41.84%(P<0.05)。表明刺梨多酚能促进肥胖小鼠肠道屏障的修复,且RF组干预对肥胖小鼠肠道屏障蛋白干预效果明显优于RP组。
2.8 刺梨多酚对肥胖小鼠短链脂肪酸浓度的影响
SCFAs是肠道微生物介导的抗性淀粉或膳食纤维发酵的产物,由于缺乏特定的酶,它们不能在我们的消化系统中完全水解[29]。在结肠中发现浓度约为60%乙酸盐、25%丙酸盐和15%丁酸盐的短链脂肪酸,短链脂肪酸可以减少脂肪组织增加,其中乙酸发挥主要作用[30],丁酸和丙酸通过刺激增加厌食性肠道激素来抑制食物摄入,从而调节体重[31]。刺梨多酚对肥胖小鼠SCFAs的影响如图8所示,与CON组相比,MODEL组SCFAs显著浓度减少了63.94%(P<0.01),通过刺梨多酚的干预后,与MODEL组相比,RF组SCFAs浓度显著提高了32.67%(P<0.01),RP组SCFAs浓度提高了19.26%,但不显著。为深入验证多酚对短链脂肪酸产生的影响,单独检测了短链脂肪酸中乙酸、丙酸、丁酸的浓度,结果表明,刺梨多酚的干预能显著提高乙酸的浓度,与MODEL组相比,RF组乙酸浓度提高了31.56%,RP组乙酸浓度则提高了12.01%(P<0.01),丙酸、丁酸浓度也有所升高,但效果略次于丁酸。提示刺梨多酚的干预通过恢复小鼠体内短链脂肪酸的浓度,尤其是丁酸的浓度来维持小鼠肠道健康。
3. 结论
高脂饮食诱导小鼠在为期7周的刺梨多酚提取物干预后,结果表明刺梨多酚提取物能有效抑制小鼠体重和肝脏指数的增长,改善血脂四项指数,有效减少肥胖小鼠中脂肪细胞的体积,并对肝脏组织的氧化损伤有一定的抑制效果;同时减少了TNF-α、IL-1β的含量,抑制高脂饮食引起的MPO和MDA含量上升,提高SOD和GPx活力,增强肝脏组织的抗氧化能力;通过减少肠道内LPS浓度,增加肠道屏障蛋白ZO-1和Claudin-1水平和短链脂肪酸含量维持肥胖小鼠肠道稳定。
综上所述,刺梨多酚提取物对高脂膳食诱导引起小鼠肥胖和血脂代谢异常、肠道损伤有良好的改善作用,且RF改善效果优于RP,这与项目组成员前期对刺梨多酚提取物的体外抗氧化活性及体外葡萄糖相对消耗量结果一致,但其对肠道稳定研究较浅,下一步可深入肠道菌群对肥胖小鼠的影响。为刺梨多酚在保健和食品等领域的研究提供了理论基础,对于通过饮食预防肥胖,提高机体抗氧化活性,维持肠道稳定提供了可靠的理论依据。
-
表 1 3种脂肪酸的标准曲线
Table 1 Standard curve for 3 fatty acids
编号 组分 保留时间(min) 线性方程 决定系数R2 线性范围(mg/L) 1 乙酸 5.380 y=0.015x+0.0022 0.9999 1~50 2 丙酸 6.350 y =0.0113x+0.0012 0.9998 1~50 3 丁酸 7.365 y=0.0413x−0.0036 0.9998 1~20 -
[1] 王馥仪, 于双, 董新玉, 等. 海洋多糖的结构、组成及其抑制肥胖作用机制的研究进展[J/OL]. 食品科学:1−24[2024-02-28]. http://kns.cnki.net/kcms/detail/11.2206.TS.20240226.1743.006.html. [WANG F Y, YU S, DONG X Y, et al. Research progress on the structure, composition, and anti-obesity mechanism of marine polysaccharides[J/OL]. Food Science:1−24[2024-02-28]. http://kns.cnki.net/kcms/detail/11.2206.TS.20240226.1743.006.html.] WANG F Y, YU S, DONG X Y, et al. Research progress on the structure, composition, and anti-obesity mechanism of marine polysaccharides[J/OL]. Food Science: 1−24[2024-02-28]. http://kns.cnki.net/kcms/detail/11.2206.TS.20240226.1743.006.html.
[2] 马玉辉, 谭斌, 吕莹果, 等. 谷物多酚降糖降脂作用的研究进展[J/OL]. 中国粮油学报:1−15[2024-02-28]. https://doi.org/10.20048/j.cnki.issn.1003-0174.000745. [MA Y H, TAN F, LV Y G et al. Research progress on the hypoglycemic and lipid-lowering effects of grain polyphenols[J/OL]. Journal of the Chinese Cereals and Oils Association:1−15[2024-02-28]. https://doi.org/10.20048/j.cnki.issn.10030174.000745.] MA Y H, TAN F, LV Y G et al. Research progress on the hypoglycemic and lipid-lowering effects of grain polyphenols[J/OL]. Journal of the Chinese Cereals and Oils Association: 1−15[2024-02-28]. https://doi.org/10.20048/j.cnki.issn.10030174.000745.
[3] ZHAO J, TAN Z, ZHANG R, et al. Effects of brine-and NaCl-fermented carrots on lipid metabolism and gut microbiota in high-fat diet-fed mice[J]. Journal of Functional Food,2023,105:105564. doi: 10.1016/j.jff.2023.105564
[4] GIL-LESPINARD M, CAPURRO C B, MONTSERRAT M, et al. Effects of a (poly) phenol-rich supplement on anthropometric, biochemical, and inflammatory parameters in participants with morbid obesity:Study protocol for a randomised controlled trial[J]. Contemporary Clinical Trials Communications,2022,30:101034. doi: 10.1016/j.conctc.2022.101034
[5] 邹燕, 罗圣群, 曾婕, 等. 茶多酚在医学研究中的进展[J]. 福建茶叶,2023,45(6):146−148. [ZOU Y, LUO S Q, ZENG J, et al. Advances in medical research on tea polyphenols[J]. Journal of Fujian Tea,2023,45(6):146−148.] doi: 10.3969/j.issn.1005-2291.2023.06.051 ZOU Y, LUO S Q, ZENG J, et al. Advances in medical research on tea polyphenols[J]. Journal of Fujian Tea, 2023, 45(6): 146−148. doi: 10.3969/j.issn.1005-2291.2023.06.051
[6] GEMBE-OLIVAREZ G, PRECIADO-ORTIZ M E, CAMPOS-PEREZ W, et al. A mix of ginger phenols exhibits anti-adipogenic and lipolytic effects in mature adipocytes derived from 3T3-L1 cells[J]. Experimental and Therapeutic Medicine,2023,26(1):1−9.
[7] 陈珍, 陆敏涛, 徐方艳, 等. 刺梨果酒对高脂诱导肥胖小鼠脂代谢的影响[J]. 食品工业科技,2022,43(3):358−366. [CHEN Z, LU M T, XU F Y, et al. Effect of Roseberry wine on lipid metabolism in hyperlipid-induced obese mice[J]. Science and Technology of Food Industry,2022,43(3):358−366.] CHEN Z, LU M T, XU F Y, et al. Effect of Roseberry wine on lipid metabolism in hyperlipid-induced obese mice[J]. Science and Technology of Food Industry, 2022, 43(3): 358−366.
[8] 陈超, 谭书明, 王画, 等. 刺梨及其活性成分对2型糖尿病小鼠糖脂代谢的影响[J]. 食品科学,2022,43(13):146−154. [CHENG C, TAN S M, WANG H, et al. Effects of Rosa roxburghii Tratt. fruit and its active ingredients on glucose and lipid metabolism in type 2 diabetic mice[J]. Food Science,2022,43(13):146−154.] doi: 10.7506/spkx1002-6630-20210420-290 CHENG C, TAN S M, WANG H, et al. Effects of Rosa roxburghii Tratt. fruit and its active ingredients on glucose and lipid metabolism in type 2 diabetic mice[J]. Food Science, 2022, 43(13): 146−154. doi: 10.7506/spkx1002-6630-20210420-290
[9] LI N Y, JIANG L L, LIU Y Y, et al. Metabolomics combined with transcriptomics analysis revealed the amino acids, phenolic acids, and flavonol derivatives biosynthesis network in developing rosa roxburghii fruit[J]. Foods,2022,11(11):120−132.
[10] 杜小娟. 刺梨果渣多酚对小鼠运动抗疲劳的影响及其机制研究[J]. 中国食品添加剂,2023,34(6):281−288. [DU X J. Effect of Rosa roxburghii pomace polyphenols on exercise anti-fatigue in mice and its mechanism[J]. China Food Additives,2023,34(6):281−288.] DU X J. Effect of Rosa roxburghii pomace polyphenols on exercise anti-fatigue in mice and its mechanism[J]. China Food Additives, 2023, 34(6): 281−288.
[11] 徐青, 谭书明, 俞露, 等. 刺梨多酚对NG-硝基-L-精氨酸甲酯诱导小鼠高血压的影响及机制[J]. 食品科学,2023,44(17):94−100. [XU Q, TAN S M, YU L, et al. Effect and mechanism of Rosa roxburghii fruit polyphenols on hypertension induced by ng-nitro-l-arginine methyl ester in mice[J]. Food Science,2023,44(17):94−100.] doi: 10.7506/spkx1002-6630-20220810-124 XU Q, TAN S M, YU L, et al. Effect and mechanism of Rosa roxburghii fruit polyphenols on hypertension induced by ng-nitro-l-arginine methyl ester in mice[J]. Food Science, 2023, 44(17): 94−100. doi: 10.7506/spkx1002-6630-20220810-124
[12] WANG H, CHEN Z, WANG M, et al. The effect of polyphenol extract from Rosa roxburghii fruit on plasma metabolome and gut microbiota in type 2 diabetic mice[J]. Foods,2022,11(12):27−35.
[13] WANG R, ZHANG L, ZHANG Q, et al. Glycolipid metabolism and metagenomic analysis of the therapeutic effect of a phenolics-rich extract from noni fruit on type 2 diabetic mice[J]. Journal of Agricultural and Food Chemistry,2022,70(9):2876−2888. doi: 10.1021/acs.jafc.1c07441
[14] 陈宝霞, 白珊泽, 任建明, 等. 白头翁汤对C57BL/6小鼠粪便中短链脂肪酸含量的影响[J]. 中国兽医杂志,2023,59(7):124−130. [CHENG B X, BAII S Z, REN J M, et al. Effects of pulsatilla decoction on short-chain fatty acids contents in feces of C57BL/6 mice[J]. Chinese Journal of Veterinary Medicine,2023,59(7):124−130.] CHENG B X, BAII S Z, REN J M, et al. Effects of pulsatilla decoction on short-chain fatty acids contents in feces of C57BL/6 mice[J]. Chinese Journal of Veterinary Medicine, 2023, 59(7): 124−130.
[15] WU Z H, ZHANG Y, GONG X R, et al. The preventive effect of phenolic-rich extracts from Chinese sumac fruits against nonalcoholic fatty liver disease in rats induced by a high-fat diet[J]. Food & Function,2020,11(1):799−812.
[16] TIAN B M, ZHAO J H, XIE X Q, et al. Anthocyanins from the fruits of Lycium ruthenicum Murray improve high-fat diet-induced insulin resistance by ameliorating inflammation and oxidative stress in mice[J]. Food & Function,2021,12(9):3855−3871.
[17] XIE W, ZHANG S, LEI F, et al. Ananas comosus L. leaf phenols and p-coumaric acid regulate liver fat metabolism by upregulating CPT-1 expression[J]. Evid Based Complement Alternat Med,2014,2014:903258.
[18] OLOFINNADE A T, ONAOLAPO A Y, STEFANUCCI A, et al. Cucumeropsis mannii reverses high-fat diet induced metabolic derangement and oxidative stress[J]. Frontiers in bioscience (Elite edition),2021,13(1):54−76. doi: 10.2741/872
[19] SIRI-TARINO P W. Effects of diet on high-density lipoprotein cholesterol[J]. Curr Atheroscler Rep,2011,13(6):453−60. doi: 10.1007/s11883-011-0207-y
[20] WANG Z, TU Z, XIE X, et al. Perilla frutescens leaf extract and fractions:polyphenol composition, antioxidant, enzymes (alpha-glucosidase, acetylcholinesterase, and tyrosinase) inhibitory, anticancer, and antidiabetic activities[J]. Foods,2021,10(2):118−127.
[21] LI W, YANG C, MEI X, et al. Effect of the polyphenol-rich extract from Allium cepa on hyperlipidemic sprague-dawley rats[J]. J Food Biochem,2021,45(1):e13565.
[22] SALTIEL A R, OLEFSKY J M. Inflammatory mechanisms linking obesity and metabolic disease[J]. J Clin Invest,2017,127(1):1−4. doi: 10.1172/JCI92035
[23] CARRIER A. Metabolic syndrome and oxidative stress:A complex relationship[J]. Antioxid Redox Signal,2017,26(9):429−431. doi: 10.1089/ars.2016.6929
[24] GRANT C M. Metabolic reconfiguration is a regulated response to oxidative stress[J]. Journal of Biology,2008,7(1):1. doi: 10.1186/jbiol63
[25] MATSUDA M, SHIMOMURA I. Roles of oxidative stress, adiponectin, and nuclear hormone receptors in obesity-associated insulin resistance and cardiovascular risk[J]. Hormone Molecular Biology and Clinical Investigation,2014,19(2):75−88. doi: 10.1515/hmbci-2014-0001
[26] LI W F, YANG H Y, ZHAO Q, et al. Polyphenol-rich loquat fruit extract prevents fructose-induced nonalcoholic fatty liver disease by modulating glycometabolism, lipometabolism, oxidative stress, inflammation, intestinal barrier, and gut microbiota in mice[J]. Journal of Agricultural and Food Chemistry,2019,67(27):7726−7737. doi: 10.1021/acs.jafc.9b02523
[27] NIGHOT M, RAWAT M, AL-SADI R, et al. Lipopolysaccharide-induced increase in intestinal permeability is mediated by TAK-1 activation of IKK and MLCK/MYLK gene[J]. American Journal of Pathology,2019,189(4):797−812. doi: 10.1016/j.ajpath.2018.12.016
[28] WU J T, HE C M, BU J, et al. Betaine attenuates LPS-induced downregulation of Occludin and Claudin-1 and restores intestinal barrier function[J]. Bmc Veterinary Research,2020,16(1):1−8. doi: 10.1186/s12917-019-2207-z
[29] MANDALIYA D K, SESHADRI S J P. Short chain fatty acids, pancreatic dysfunction and type 2 diabetes[J]. Pancreatology,2019,19(4):617−622. doi: 10.1016/j.pan.2019.04.013
[30] LU Y, FAN C, LI P, et al. Short chain fatty acids prevent high-fat-diet-induced obesity in mice by regulating G protein-coupled receptors and gut microbiota[J]. Scientific Reports,2016,6(1):37589. doi: 10.1038/srep37589
[31] LIN H V, FRASSETTO A, KOWALIK JR E J, et al. Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms[J]. PLoS One,2012,7(4):e35240. doi: 10.1371/journal.pone.0035240





 下载:
下载:




 下载:
下载:
