Effects of Lactobacillus acidophilus LA15 on Immune Enhancement and Regulation of Gut Microbiota in Mice
-
摘要: 本研究旨在探讨嗜酸乳杆菌LA15对环磷酰胺(CTX)诱导的BALB/c小鼠免疫抑制的增强作用。采用注射CTX建立体内免疫抑制模型,并通过测定小鼠表观指标、免疫指标、肠道菌群来评价免疫增强效果。结果表明,CTX诱导后的小鼠体重、胸腺指数、脾脏指数、免疫球蛋白、细胞因子含量降低,而LA15显著增加小鼠脾脏、胸腺指数(P<0.05),缓解小肠黏膜组织肿胀及炎症损伤。LA15组小鼠肠道sIgA含量为486.39 μg/mL,显著高于模型组(294.72 μg/mL)(P<0.01),细胞因子TNF-α、IL-6、IL-10、IL-1β、IL-17含量均增加;16S rDNA基因测序显示,LA15降低了厚壁菌门/拟杆菌门的比例,增加了拟普雷沃氏菌和毛螺菌属相对丰度,降低了脱硫弧菌属相对丰度。因此,LA15可以恢复CTX引起的免疫抑制,并能重塑肠道菌群,被认为是一种潜在的免疫刺激剂,用于治疗免疫抑制紊乱。Abstract: The purpose of this study was to investigate the enhancing effect of Lactobacillus acidophilus LA15 on cyclophosphamide (CTX)-induced immunosuppression in BALB/c mice. The in vivo immunosuppression model was established by administering CTX through injection, and the immunomodulatory effects were assessed by measuring murine phenotypic indicators, immune markers, and gut microbiota. The results indicated that after induction by CTX, mice in the CTX group exhibited decreased body weight, thymus index, spleen index, immunoglobulin levels, and cytokine content. In contrast, LA15 significantly enhanced the thymus index, spleen index (P<0.05), relieve the swelling and inflammatory injury of small intestinal. The intestinal immunoglobulin A (sIgA) content in the LA15 group was 486.39 μg/mL, which was significantly higher than that in the model control group (294.72 μg/mL) (P<0.01), and the levels of TNF-α, IL-6, IL-10, IL-1β, IL-17 increased. 16S rDNA gene sequencing revealed that LA15 reduced the ratio of Firmicutes/Bacteroidetes, increased the relative abundance of Alloprevotella and Lachnospiraceae, and decreased the relative abundance of Desulfurvibrio. Therefore, LA15 could alleviate CTX-induced immunosuppression, reshape the gut microbiota, and was considered a potential immunostimulant for the treatment of immune suppression disorders.
-
Keywords:
- Lactobacillus acidophilus /
- cyclophosphamide /
- immunosuppression /
- cytokine /
- intestinal flora
-
免疫系统包括固有免疫和适应性免疫。它是一个严格调控的网络,在正常生理条件下维持稳态[1],在人类和其他哺乳动物中,不同微生物群成分的相互作用,对不同T细胞亚群的建立和发展至关重要,包括自然杀伤T细胞(NK)、Treg细胞和Th17细胞,它们以适当的比例实现稳态。淋巴细胞和巨噬细胞在这两种免疫中都起着至关重要的作用[2]。NK细胞是固有免疫的关键组成部分,保护宿主免受肿瘤和病毒感染。T和B淋巴细胞是适应性免疫的主要效应细胞[3]。巨噬细胞在固有免疫应答中发挥关键作用,并作为抗原提呈细胞启动适应性免疫应答[4]。激活状态的淋巴细胞和巨噬细胞会产生炎症介质[5],如一氧化氮(NO)、肿瘤坏死因子(TNF)-α和白细胞介素(IL)-1β等。
目前,服用益生菌作为免疫相关疾病的一种治疗手段,受到广泛关注。益生菌在维持肠道菌群平衡、免疫调节、预防胃肠道感染以及改善血液指标方面具有重要作用[6]。益生菌可以通过直接或间接地调节免疫系统来实现机体的免疫调节,尤其是乳杆菌的免疫调节功能一直备受关注。据报道,罗伊氏乳杆菌通过激活巨噬细胞群[7]、产生IgA和IgG表现出免疫调节活性;含有嗜酸乳杆菌的食物可以显著降低大鼠血清TNF-α和白细胞介素(IL)-6的含量[8]。含有嗜酸乳杆菌的益生菌产品可显著提高肉仔鸡血清免疫球蛋白M(IgM)浓度[9]。薛梅[10]研究了鼠李糖乳杆菌对免疫低下大鼠的影响,发现鼠李糖乳杆菌可显著增加其血清中的IgA、IL-2含量,提高大鼠的肝、脾巨噬细胞廓清指数、吞噬指数,以及提高单核巨噬细胞系统功能。这些试验结果表明,乳杆菌可通过调节宿主免疫反应[11]来增强免疫力,在肠道菌群丰富的环境中,乳杆菌还可通过分泌细胞因子和抗菌肽等可溶性因子,在免疫调节中发挥关键作用,有助于宿主防御。
近年来,益生菌通过调节宿主免疫反应,改善肠道微生态来增强免疫力的报道增多[12],但关于嗜酸乳杆菌菌株对全身免疫和免疫抑制及肠道菌群改善的影响研究较少。为此,本文在环磷酰胺免疫抑制小鼠模型上进行了研究,以评价嗜酸乳杆菌提高机体免疫力和调节肠道菌群的能力。
1. 材料与方法
1.1 材料与仪器
小鼠 雄性SPF级Balb/c小鼠(20±2 g),6~8周龄,购自斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010,饲养于湖北省疾病预防控制中心动物房,实验动物使用许可证号:安评中心动(福)第202210219号;嗜酸乳杆菌LA15 从中国婴儿粪便中分离;鼠李糖乳杆菌LGG 购买自广东省微生物菌种保藏中心;环磷酰胺、蛋白胨、牛肉浸粉、酵母粉、葡萄糖、无水乙酸钠、柠檬酸氢二铵、吐温80、K2HPO4、MgSO4、MnSO4、琼脂粉 阿拉丁试剂有限公司;注射用生理盐水 四川科伦药业有限公司;小鼠sIgA、IL-10、IL-6、IL-17、IL-1β、TNF-α试剂盒 武汉贝茵莱生物科技有限公司;TGuide S96磁性粪便DNA试剂盒 天根生物技术(北京)有限公司;Qubit dsDNA HS检测试剂盒 美国赛默飞世尔科技公司。
JY10002电子天平 上海衡平仪器仪表厂;SPX-250B-2型恒温培养箱 上海福玛实验设备有限公司;FA1204分析天平 上海精其仪器有限公司;CX-23显微镜 奥林巴斯(中国)有限公司;pHS-3C型pH计 上海仪电科股份有限公司;5415D台式冷冻离心机、6333PCR仪 德国Eppendorf公司;1530酶标仪、Qubit 4.0荧光仪 美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 实验动物及菌悬液制备
将嗜酸乳杆菌LA15、鼠李糖乳杆菌LGG在MRS培养液中,37 ℃培养24 h。在4 ℃,6500×g离心5 min,收集菌体[13]。并将收集的菌体加入甘油,−80 ℃冷冻保藏,每天将LA15以及LGG菌株取出,接种到MRS培养基中,37 ℃培养24 h,并取菌悬液,用无菌生理盐水洗涤3次,调整为5×109 CFU/mL进行灌胃喂养。
1.2.2 小鼠实验分组及模型建立
采用Balb/c小鼠,在25±2 ℃和12/12 h的光/暗循环下,自由喂养和饮水,预饲养7 d,然后随机分组,每组10只,实验设置对照组(NC组),药物组(MC组),嗜酸乳杆菌LA15组(LA15组),鼠李糖乳杆菌LGG组(LGG组)分别灌胃嗜酸乳杆菌LA15(0.2 mL,5×109 CFU/mL),鼠李糖乳杆菌LGG(0.2 mL,5×109 CFU/mL)连续给药14 d。正常对照组和模型组小鼠给予等量无菌生理盐水灌胃,连续灌胃14 d。并在实验第7、8、9 d,将药物环磷酰胺(CTX)按照剂量80 mg/kg腹腔注射MC、LA15、LGG组,并进行实验建模[14]。分别于实验第1、7、10、14 d记录小鼠体重。
1.2.3 免疫器官指数测定
处死小鼠前进行体重称量,然后立即颈椎脱臼,摘除胸腺和脾脏,清理结缔组织后,放到分析天平上,分别称重,并计算免疫器官[15]指数。公式如下:
1.2.4 回肠形态学测定
将回肠组织取出后固定在10%福尔马林中。将固定的回肠石蜡包埋并切成5 μm切片,进行苏木精-伊红(HE)染色。使用光学显微镜对所有载玻片进行观察[16]。观察绒毛的高度,从绒毛顶部到隐窝的多余部分,隐窝的深度为两隐窝之间的凹陷。
1.2.5 小肠免疫球蛋白及细胞因子水平测定
收集小肠组织,取1 g组织加入9 mL PBS(pH7.4),使用匀浆器将标本充分混匀,然后1500×g,离心5 min,取匀浆上清液,采用ELISA试剂盒检测分泌型免疫球蛋白(Secretory Immunoglobulin A,sIgA)水平,以及检测细胞因子TNF-α、IL-1β、IL-6、IL-17和IL-10水平[17]。用试剂盒中提供的方法来测定,并根据试剂盒中各细胞因子标准品的标准曲线,来计算细胞因子的产生水平,细胞因子含量表示为每毫升肠组织匀浆上清液中的细胞因子浓度(pg/mL)。
1.2.6 肠道菌群测定与分析
实验结束后,以颈椎脱臼法处死小鼠,腹部消毒后解剖,取实验各组小鼠盲肠内容物[18]。按照试剂盒的方法,从小鼠粪便样本中提取微生物基因组DNA,采用Qubit dsDNA HS检测试剂盒和Qubit 4.0荧光仪检测样本DNA浓度,并进行定量。在Illumina novaseq 6000测序平台上对样本中所有细菌的V3~V4高变区进行了16S rDNA测序,本研究借助百迈客云进行生物信息学分析,以确定肠道微生物群的特征。
1.3 数据处理
试验数据均进行3次重复,数据及制图采用GraphPad Prism V8软件进行处理,采用 SPSS 20.0软件进行显著性分析。所有数据均表示为均值±标准偏差,各组结果以均数±标准差表示,组间比较采用单因素方差分析和Duncan检验,成对组间比较采用t检验,P<0.05或P<0.01为差异具有统计学意义。
2. 结果与分析
2.1 嗜酸乳杆菌LA15对小鼠体重的影响
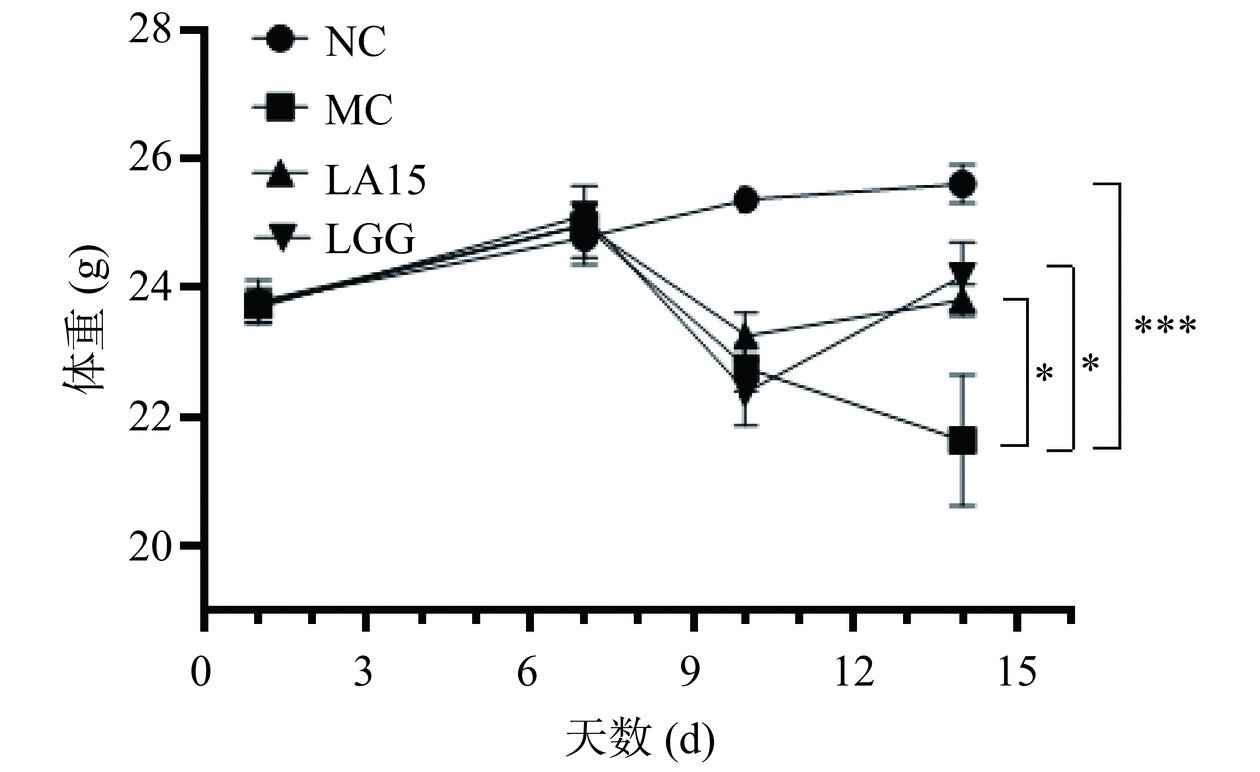
在整个实验期间进行体重监测,如图1所示,连续腹腔注射3 d环磷酰胺后,与对照组相比,其他组免疫抑制小鼠体重均降低。这是由于环磷酰胺具有较强的免疫抑制毒性,注射后小鼠免疫系统发生紊乱,体重下降。在第10 d开始,嗜酸乳杆菌LA15组,阳性对照LGG组,体重缓慢增加,而模型组小鼠体重仍持续下降。在实验最后一天,与NC相比,MC组小鼠的体重极显著降低(P<0.001);与MC组相比,益生菌组小鼠的体重显著升高(P<0.05)。结果表明停药后,益生菌干预组能缓解环磷酰胺药物所导致的小鼠体重下降。
2.2 嗜酸乳杆菌LA15对小鼠免疫器官的影响
胸腺和脾脏是机体重要的免疫器官,也是免疫细胞生长和增殖的部位,免疫器官的发育状况直接影响宿主的免疫功能,免疫器官指数被用来反映免疫器官的发育情况。如表1所示,对免疫器官指数进行分析发现,与NC组相比,MC组胸腺指数和脾脏指数,均显著降低(P<0.05);模型组小鼠免疫器官指数均降低,表明CTX注射后,导致免疫器官萎缩,有明显的免疫抑制作用。而灌胃嗜酸乳杆菌LA15,小鼠胸腺指数和脾脏指数分别为0.96和2.95 mg/g,与MC组差异显著(P<0.05)。与模型组相比,灌胃LGG组小鼠免疫器官指数显著升高(P<0.05)。以上结果表明,嗜酸乳杆菌LA15和LGG对环磷酰胺注射后导致的免疫器官指数降低有较为显著的改善作用,能抵抗免疫抑制带来免疫器官萎缩的不良影响。
表 1 嗜酸乳杆菌LA15对小鼠免疫器官指数影响Table 1. Effects of Lactobacillus acidophilus LA15 on immune organ index in mice组别 胸腺指数(mg/g) 脾脏指数(mg/g) NC 2.30±0.17a 3.72±0.14a MC 0.49±0.01c 1.21±0.12d LA15 0.96±0.19b 2.95±0.27b LGG 0.84±0.08b 2.56±0.20c 注:同列不同字母表示存在显著差异(P<0.05)。 2.3 嗜酸乳杆菌LA15对小鼠回肠组织的影响
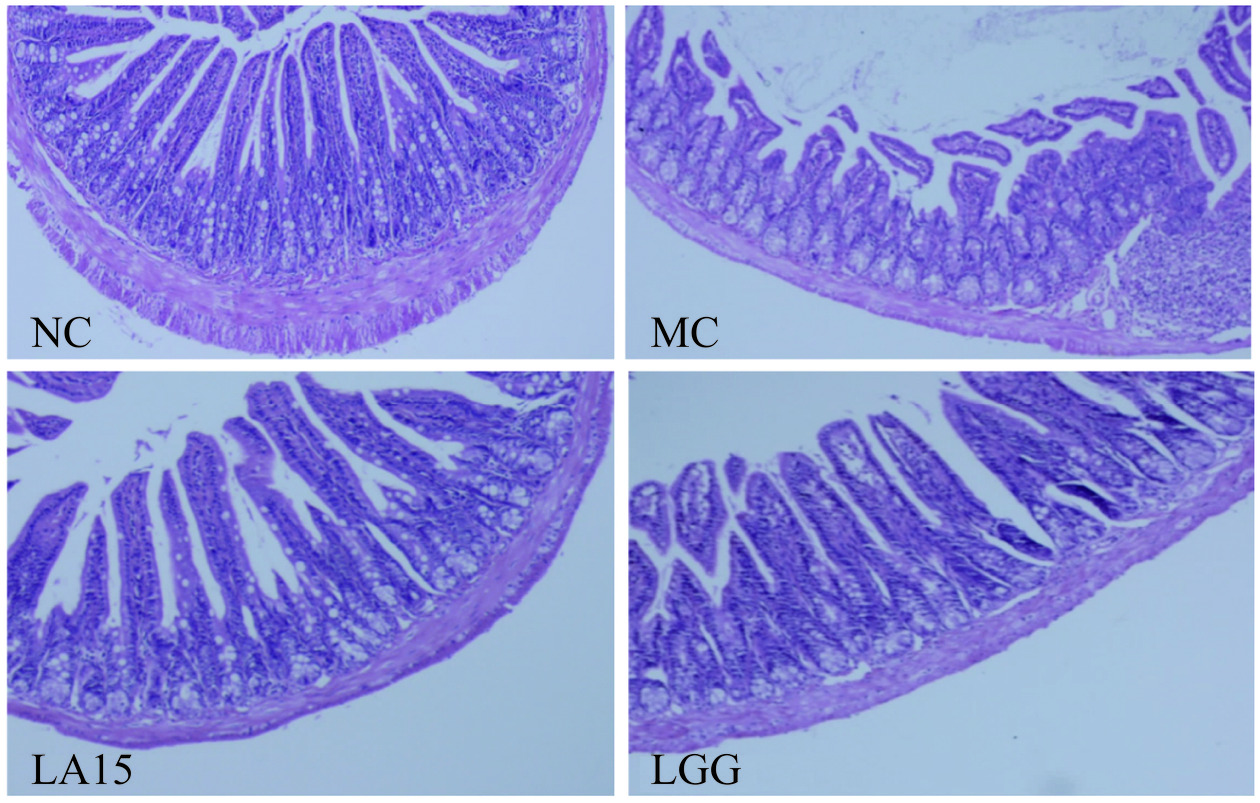
回肠染色切片显示(图2),NC组大鼠肠绒毛紧致良好,排列整齐,隐窝结构完整,肠上皮细胞上皮形态完整;MC组小肠黏膜病变严重,结构不完整,排列疏松,绒毛明显肿胀坏死和破裂,隐窝损伤,炎症细胞浸润;LA15组、LGG组小肠绒毛损伤均有不同程度缓解,隐窝结构完好,炎性细胞浸润程度被明显减轻,未出现大面积溃疡,且两组益生菌处理组均未见明显差异,以上结果表明,嗜酸乳杆菌LA15和LGG均能缓解CTX所致的回肠结构肿胀和组织发生炎症损伤的情况。
2.4 嗜酸乳杆菌LA15对小鼠小肠组织免疫球蛋白和细胞因子的影响
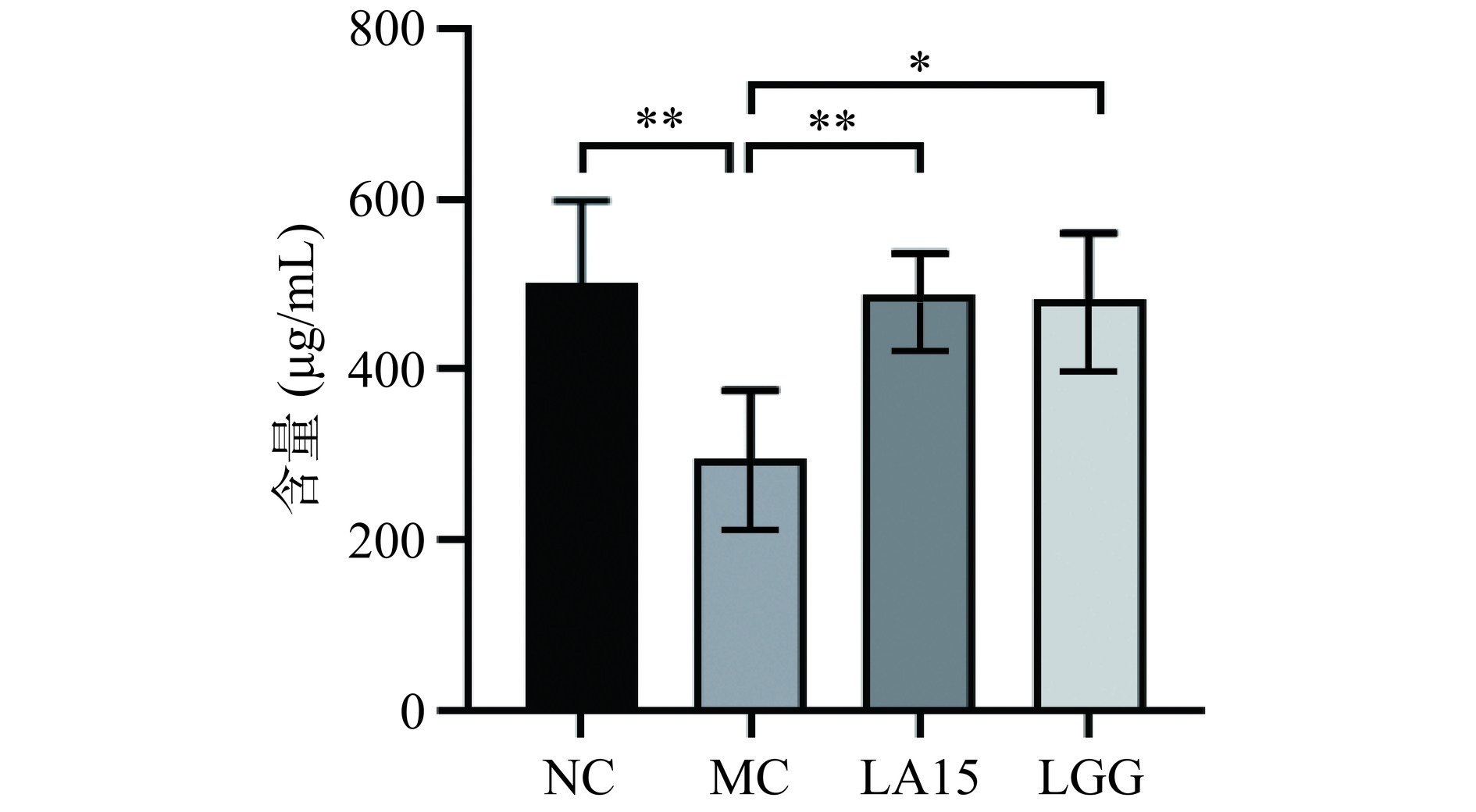
sIgA是肠黏液层的主要免疫球蛋白,由肠道固有层的B细胞分泌,是一种重要的效应分子,可以保护黏膜表面,维持肠道菌群和上皮表面之间的空间隔离,而不破坏微生物代谢[19]。如图3所示,MC组小鼠小肠中免疫球蛋白A的含量高度显著低于NC组(P<0.01)。与MC组相比,给药LA15后,小鼠sIgA含量为486.39 μg/mL,高度显著高于MC组(294.72 μg/mL)(P<0.01)。而给药LGG后,小鼠sIgA含量为480.49 μg/mL,与LA15组趋势一致。
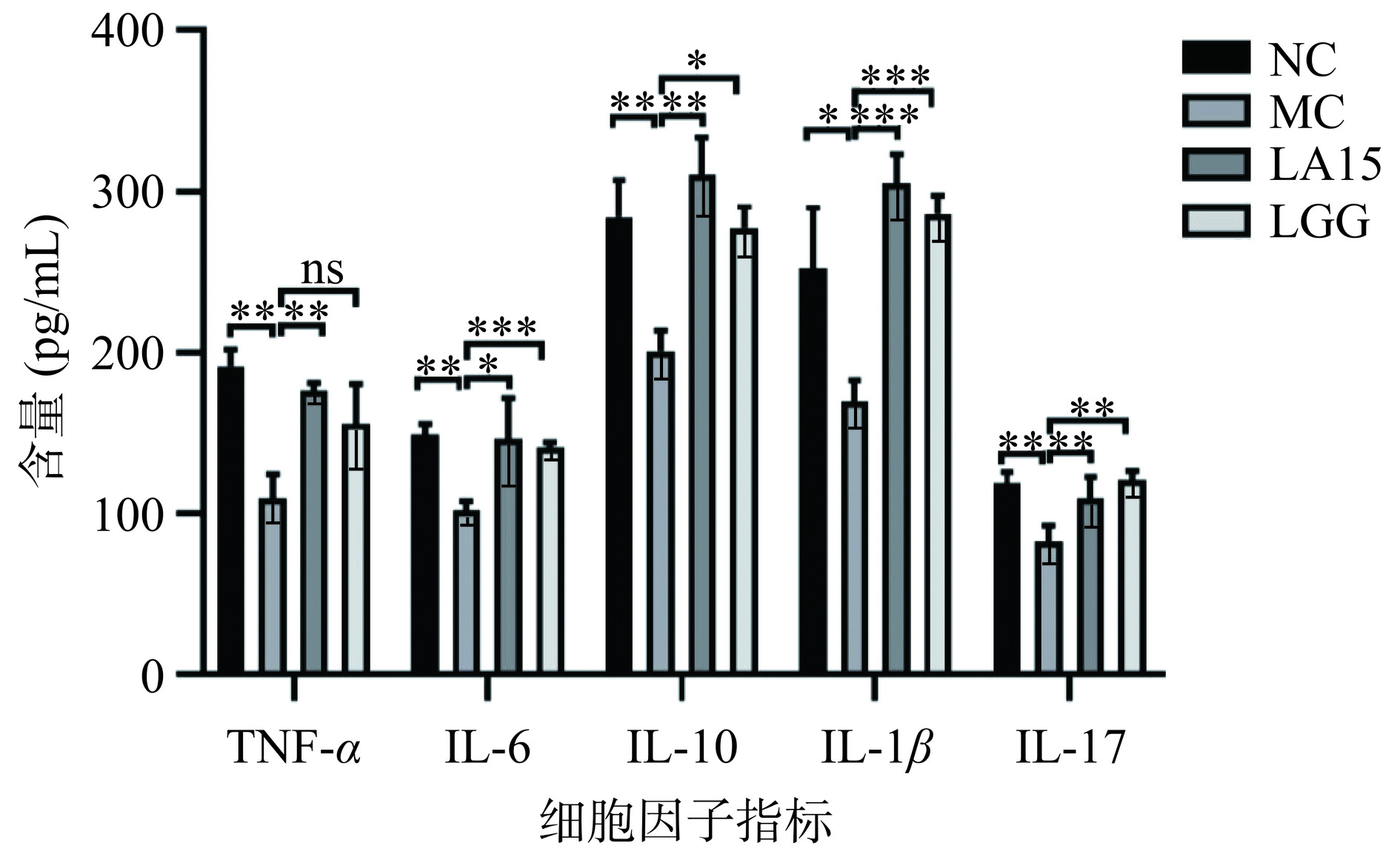
益生菌通过刺激辅助性T细胞1(helper T cells 1,Th1)和辅助性T细胞2(helper T cells 2,Th2),辅助性T细胞17(helper T cells 17,Th17),分泌多种细胞因子[20],从而增强免疫力。由图4可知,与NC组相比,MC组小鼠小肠中细胞因子TNF-α、IL-6、IL-10、IL-1β、IL-17含量显著降低(P<0.05),说明环磷酰胺能抑制和破坏小肠黏膜免疫;灌胃嗜酸乳杆菌LA15后,TNF-α、IL-6、IL-10、IL-1β、IL-17细胞因子的含量均显著升高(P<0.05)。而与MC组相比,LGG组IL-6、IL-10、IL-1β、IL-17细胞因子含量均显著升高(P<0.05),TNF-α细胞因子含量无显著性差异(P>0.05)。说明嗜酸乳杆菌LA15可刺激Th1相关促炎细胞因子(IL-1β、TNF-α)的分泌,Th2相关促炎因子(IL-6)和抗炎因子(IL-10)的分泌,以及Th17相关促炎细胞因子(IL-17)的分泌。这表明,LA15可能通过上调Th1细胞因子和促炎细胞因子启动免疫应答,上调Th2细胞因子和抗炎细胞因子维持肠道免疫稳态,从而促进小鼠的保护性免疫反应,使肠黏膜免疫表现出增强的作用。
2.5 嗜酸乳杆菌LA15对小鼠肠道菌群的影响
2.5.1 小鼠肠道菌群α多样性分析
α多样性是指特定区域或生态系统内的多样性。采用Simpson指数和PD_Whole_tree指数来描述微生物群落的多样性和均匀性[21]。Simpson指数和PD_Whole_tree指数与多样性呈正相关。图5中,MC组的Simpson指数和PD_Whole_tree指数高度显著低于NC组(P<0.01)。与MC组比较,LA15组和LGG组的Simpson指数有升高的趋势。LA15组和LGG组的PD_Whole_tree指数显著高于MC组(P<0.05),且LA15组较LGG组更接近NC组。说明嗜酸乳杆菌LA15能恢复免疫低下小鼠微生物多样性,使小鼠肠道菌群结构更接近对照组。
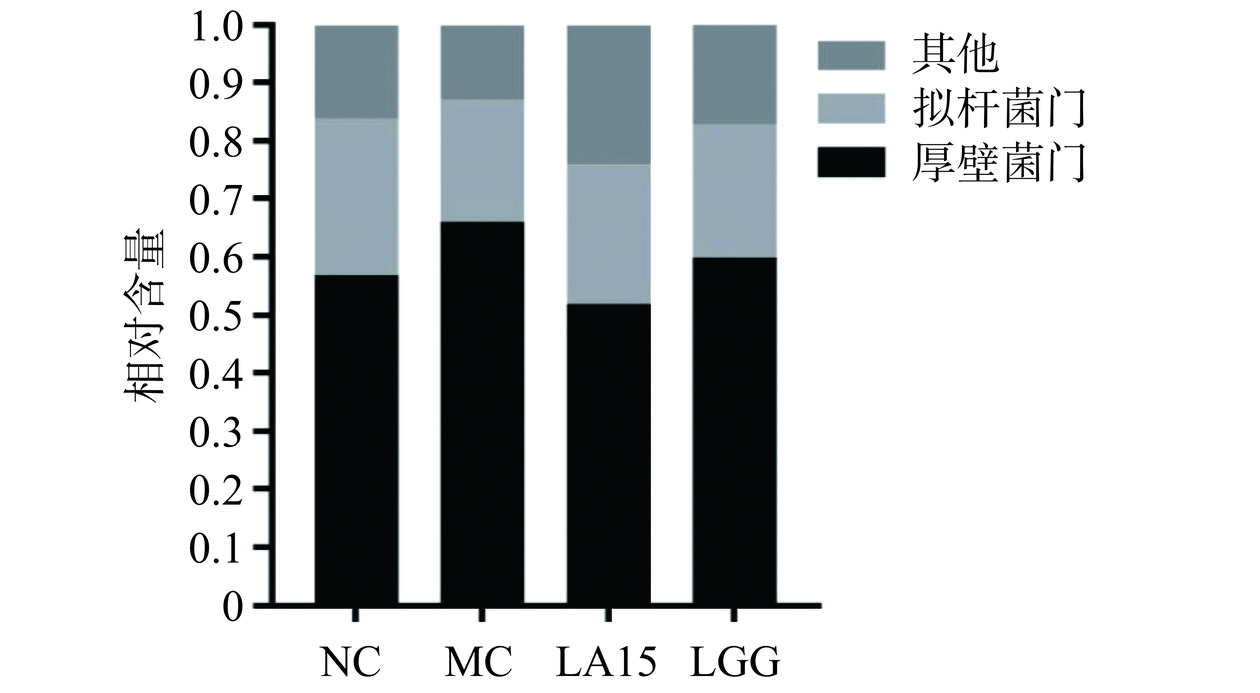
2.5.2 小鼠肠道菌群门、属水平分析
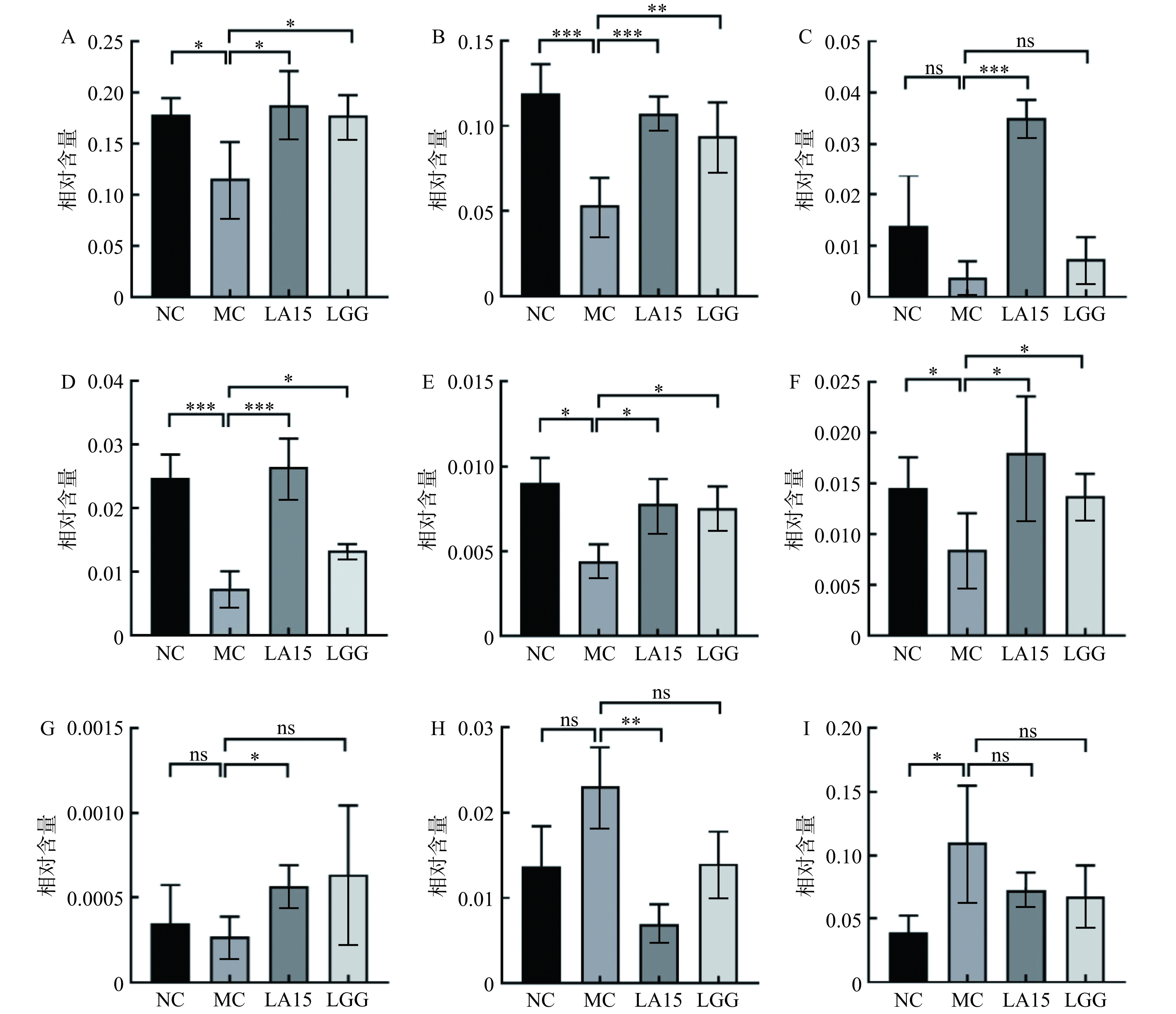
如图6所示,在门水平上,微生物群落主要由厚壁菌门(50.41%~66.29%)和拟杆菌门(21.26%~26.80%)组成,占总序列的75%以上。与NC组相比,MC组厚壁菌门丰度增加,拟杆菌门减少。而LA和LGG组均逆转了这一趋势。这与Ma等[22]的报道一致。在属水平上,环磷酰胺处理降低了MC组中毛螺菌属(Lachnospiraceae_NK4A136)、未分类的Muribaculaceae、拟普雷沃氏菌属(Alloprevotella)、拟杆菌属(Bacteroides)、Candidatus_Saccharimonas相对含量(P<0.05),上调螺杆菌属(Helicobacter)相对含量。然而,摄入LA15可以恢复毛螺菌属、未分类的Muribaculaceae、未分类的[Eubacterium]_coprostanoligenes_group、拟普雷沃氏菌属、拟杆菌属、Candidatus_Saccharimonas、乳杆菌属的丰度。摄入LGG可以恢复毛螺菌属、未分类的Muribaculaceae、拟普雷沃氏菌属、拟杆菌属、Candidatus_Saccharimonas丰度。其中,拟普雷沃氏菌属、拟杆菌属、毛螺菌属能产生短链脂肪酸(SCFAs),SCFAs可以单独或与Toll样受体配体联合诱导促炎细胞因子的产生,Muribaculaceae与自然杀伤细胞和NF-κB信号传导等免疫反应正相关,并且Muribaculaceae家族成员可以通过IgA与先天性或适应性[23]免疫反应相互作用。[Eubacterium]_coprostanoligenes_group可以降低胆固醇,预防心血管疾病。据Xie等[24]研究,Candidatus_Saccharimonas能在免疫缺陷患者的免疫恢复中发挥重要作用。同时,给药LA15可以减弱环磷酰胺的影响,降低脱硫弧菌属的相对丰度,使菌群结构和相对丰度更接近于对照。而螺杆菌属常见于胃肠道黏膜层,可引起与炎症事件相关的免疫反应。这表明,LA15通过调节肠道菌群,平衡肠道微生态,改变肠道菌群的相对丰度来减轻环磷酰胺对机体的免疫抑制作用。
![]() 图 7 小鼠肠道菌群属水平变化注:图中A-I分别为:毛螺菌属(Lachnospiraceae_NK4A136)、未分类的Muribaculaceae、未分类[Eubacterium]_coprostanoligenes_group、拟普雷沃氏菌属(Alloprevotella)、拟杆菌属(Bacteroides)、Candidatus_Saccharimonas、乳杆菌属(Lactobacillu)、硫弧菌属(Desulfovibrionaceae)、螺杆菌属(Helicobacter)。Figure 7. Genus level changes of intestinal flora in mice
图 7 小鼠肠道菌群属水平变化注:图中A-I分别为:毛螺菌属(Lachnospiraceae_NK4A136)、未分类的Muribaculaceae、未分类[Eubacterium]_coprostanoligenes_group、拟普雷沃氏菌属(Alloprevotella)、拟杆菌属(Bacteroides)、Candidatus_Saccharimonas、乳杆菌属(Lactobacillu)、硫弧菌属(Desulfovibrionaceae)、螺杆菌属(Helicobacter)。Figure 7. Genus level changes of intestinal flora in mice3. 讨论与结论
宿主免疫系统由免疫器官、免疫细胞和免疫反应物质组成[25]。免疫反应的失调可能会导致疾病进展,免疫低下,产生炎症和自身免疫性疾病。作为烷化剂的环磷酰胺,主要用于恶性淋巴瘤、白血病等癌症的化疗,可抑制细胞免疫、体液免疫应答[26−27],干扰正常的免疫反应。因此,注射环磷酰胺的小鼠可作为免疫功能抑制的动物模型[28−29]来验证益生菌的免疫调节能力。
筛选可用于免疫增强功能的益生菌菌株具有重要意义,胸腺和脾脏指数是衡量机体免疫系统功能的重要指标[30]。而在本研究中,嗜酸乳杆菌LA15能缓解免疫低下小鼠体重减轻以及脾脏,胸腺器官萎缩,增加sIgA、TNF-α、IL-6、IL-10、IL-1β、IL-17等免疫因子含量。肠道是人体的最大免疫器官,嗜酸乳杆菌LA15通过缓解小肠黏膜组织损伤,减轻组织病变程度,增加小肠绒毛高度,改善肠道组织结构。此外,LA15与LGG均改变了CTX所致免疫低下小鼠的肠道菌群。嗜酸乳杆菌LA15通过改善肠道微生物群落的多样性和增加肠道毛螺菌属、拟杆菌属、拟普雷沃氏菌属的丰度来调节肠道微生物生态,减轻环磷酰胺对机体的免疫抑制作用;通过抑制脱硫弧菌属和螺杆菌属[31]来防止肠道菌群失调。根据以上结果,推测嗜酸乳杆菌LA15可能通过刺激免疫因子的分泌,改善肠道结构,重塑肠道菌群,或恢复肠道屏障功能来加强肠道免疫系统。因此,嗜酸乳杆菌LA15有望作为一种激活宿主免疫系统益生菌剂,本研究为嗜酸乳杆菌LA15在免疫增强以及癌症的联合治疗方面提供了重要实验基础。
-
图 7 小鼠肠道菌群属水平变化
注:图中A-I分别为:毛螺菌属(Lachnospiraceae_NK4A136)、未分类的Muribaculaceae、未分类[Eubacterium]_coprostanoligenes_group、拟普雷沃氏菌属(Alloprevotella)、拟杆菌属(Bacteroides)、Candidatus_Saccharimonas、乳杆菌属(Lactobacillu)、硫弧菌属(Desulfovibrionaceae)、螺杆菌属(Helicobacter)。
Figure 7. Genus level changes of intestinal flora in mice
表 1 嗜酸乳杆菌LA15对小鼠免疫器官指数影响
Table 1 Effects of Lactobacillus acidophilus LA15 on immune organ index in mice
组别 胸腺指数(mg/g) 脾脏指数(mg/g) NC 2.30±0.17a 3.72±0.14a MC 0.49±0.01c 1.21±0.12d LA15 0.96±0.19b 2.95±0.27b LGG 0.84±0.08b 2.56±0.20c 注:同列不同字母表示存在显著差异(P<0.05)。 -
[1] KIM J Y, KIM J Y, KIM H, et al. Probiotic strains Bifidobacterium animalis ssp. lactis HY8002 and Lactobacillus plantarum HY7717 improved immunosuppression in cyclophosphamide-treated mice[J]. Journal of Animal Science and Technology,2022,10(51):61−84.
[2] JUNG J Y, SHIN J S, LEE S G, et al. Lactobacillus sakei K040706 evokes immunostimulatory effects on macrophages through TLR2-mediated activation[J]. International Immunopharmacology,2015,28(1):88−96. doi: 10.1016/j.intimp.2015.05.037
[3] VIVIER E, RAULET D H, MORETTA A, et al. Innate or adaptive immunity? The example of natural killer cells[J]. Science,2011,331(6013):44−59. doi: 10.1126/science.1198687
[4] ZHU J, ZHAO L, GUO H Y, et al. Immunomodulatory effects of novel Bifidobacterium and Lactobacillus strains on murine macrophage cells[J]. African Journal of Microbiology Research,2011,5(1):8−15.
[5] ARANGO D G, DECOTEAUX A. Macrophage cytokines:Involvement in immunity and infectious diseases[J]. Frontiers in Immunology,2014,5(4):67−91.
[6] ALI M S, LEE E B, QUAH Y X. Heat-killed Limosilactobacillus reuteri PSC102 ameliorates impaired immunity in cyclophosphamide-induced immunosuppressed mice[J]. Frontiers in Microbioloy,2022,13(8):20−38.
[7] ZHHENG J, WITTOUCK S, SALVETTI E, et al. A taxonomic note on the genus Lactobacillus:Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae[J]. International Journal of Systematic and Evolutionary Microbiology,2020,70(4):2782−2858. doi: 10.1099/ijsem.0.004107
[8] ABU-ELSAAD N M, ABD-ELHAMMEED A G, EL-KAREF A, et al. Yogurt containing the probacteria Lactobacillus acidophilus combined with natural antioxidants mitigates doxorubicin-induced cardiomyopathy in rats[J]. Journal of Medicinal Food,2015,18(9):950−959. doi: 10.1089/jmf.2014.0104
[9] AHMED S T, MUN H S, IALAM M M, et al. Effects of citrus junos by-products fermented with multistrain probiotics on growth performance, immunity, caecal microbiology and meat oxidative stability in broilers[J]. British Poultry Science,2014,55(4):540−547. doi: 10.1080/00071668.2014.938021
[10] 薛梅. 鼠李糖乳杆菌LV108对免疫低下大鼠肠道菌群及代谢的影响研究[D]. 扬州:扬州大学, 2016. [XUE M. Effects of Lactobacillus rhamnosus LV108 on intestinal flora and metabolism in immunocompromised rats [D]. Yangzhou:Yangzhou University, 2016.] XUE M. Effects of Lactobacillus rhamnosus LV108 on intestinal flora and metabolism in immunocompromised rats [D]. Yangzhou: Yangzhou University, 2016.
[11] ZHAO W, LIU Y, KWOK L Y, et al. The immune regulatory role of Lactobacillus acidophilus:An updated meta-analysis of randomized controlled trials[J]. Food Bioscience,2020,36(6):65−100.
[12] JANG S E, JOH E H, LEE H Y, et al. Lactobacillus plantarum HY7712 ameliorates cyclophosphamide-induced immunosuppression in mice[J]. Journal of Microbiology and Biotechnology,2013,23(3):414−421. doi: 10.4014/jmb.1210.10010
[13] SUN M, WU T, ZHANG G, et al. Lactobacillus rhamnosus LRa05 improves lipid accumulation in mice fed with a high fat diet via regulating intestinal microbiota, reducing glucose content and promoting liver carbohydrate metabolism[J]. Food Function,2020,11(11):9514−9525. doi: 10.1039/D0FO01720E
[14] XUE L Y, LI Z Q, XUE J B, et al. Lactobacillus acidophilus LA85 ameliorates cyclophosphamide-induced immunosuppression by modulating Notch and TLR4/NF-κB signal pathways and remodeling the gut microbiota[J]. Food Function,2022,13(15):8107−8118. doi: 10.1039/D1FO04331E
[15] MENG Y, WANG J, WANG Z, et al. Lactobacillus plantarum KLDS1.0318 ameliorates impaired intestinal immunity and metabolic disorders in cyclophosphamide-treated mice[J]. Frontiers in Microbiology,2019,70(4):731−741.
[16] WU T, ZHANG Y L, LI W et al. Lactobacillus rhamnosus LRa05 ameliorate hyperglycemia through a regulating glucagon-mediated signaling pathway and gut microbiota in type 2 diabetic mice[J]. Journal of Agricultural and Food Chemistry,2021,69(31):8797−8806.
[17] 许女, 魏莎莎, 杨光, 等. 鼠李糖乳杆菌DHC32对小鼠肠道菌群和肠道黏膜免疫的影响[J]. 中国食品学报,2020,20(6):73−80. [XU N, WEI S S, YANG G, et al. Effects of Lactobacillus rhamnosus DHC32 on intestinal microbiota and intestinal mucosal immunity in mice[J]. Chinese Journal of Food Science,2020,20(6):73−80.] XU N, WEI S S, YANG G, et al. Effects of Lactobacillus rhamnosus DHC32 on intestinal microbiota and intestinal mucosal immunity in mice[J]. Chinese Journal of Food Science, 2020, 20(6): 73−80.
[18] SHANG J C, WAN F, ZHAO L, et al. Potential immunomodulatory activity of a selected strain Bifidobacterium bifidum H3-R2 as evidenced in vitro and in immunosuppressed mice[J]. Frontiers in Microbiology,2020,11(89):1−13.
[19] WANG J, LI M H, GAO Y W, et al. Effects of exopolysaccharides from Lactiplantibacillus plantarum JLAU103 on intestinal immune response, oxidative stress, and microbial communities in cyclophosphamide-induced immunosuppressed mice[J]. Journal of Agricultural and Food Chemistry,2022,70(7):2197−2210. doi: 10.1021/acs.jafc.1c06502
[20] SHONYELA S M, FENG B, YANG W T, et al. The regulatory effect of Lactobacillus rhamnosus GG on T lymphocyte and the development of intestinal villi in piglets of different periods[J]. AMB Express,2020,10(1):63−76. doi: 10.1186/s13568-020-00998-5
[21] LI X, CHEN S, WANG W J, et al. Effects of polysaccharides from Yingshan Yunwu tea on meat quality, immune status and intestinal microflora in chickens[J]. International Journal of Biological Macromolecules,2020,155:61−70. doi: 10.1016/j.ijbiomac.2020.03.198
[22] MA W, LI W, YU S, et al. Immunomodulatory effects of complex probiotics on the immuno-suppressed mice induced by cyclophosphamide[J]. Frontiers in Microbiology,2023,11(89):1−13.
[23] HUANG K Y, YAN Y M, DAN C, et al. Ascorbic acid derivative 2-O-β-D-glucopyranosyl-L-ascorbic acid from the fruit of lycium barbarum modulates microbiota in the small intestine and colon and exerts an immunomodulatory effection cyclophosphamide-treated BALB/c mice[J]. Journal of Agricultural and Food Chemistry,2020,68(40):11128−11143. doi: 10.1021/acs.jafc.0c04253
[24] XIE Y, SUN J, HU C, et al. Oral microbiota is associated with immune recovery in human immunodeficiency virus-Infected individuals[J]. Frontiers in Microbiology,2021,12(1):1−11.
[25] WANG B, YAO M L, LING LZ et al, The human microbiota in health and disease[J]. Engineering, 2017, 3(1):71-82.
[26] 张振忠, 岳寿松, 陈靓. 乳酸菌制剂对环磷酰胺致大鼠免疫抑制的调节作用[J]. 食品与药品,2020,22(2):103−107. [ZHANG Z Z, YUE S S, CHEN L. Effect of lactic acid bacteria on immunosuppression induced by cyclophosphamide in rats[J]. Food and Medicine,2020,22(2):103−107.] doi: 10.3969/j.issn.1672-979X.2020.02.004 ZHANG Z Z, YUE S S, CHEN L. Effect of lactic acid bacteria on immunosuppression induced by cyclophosphamide in rats[J]. Food and Medicine, 2020, 22(2): 103−107. doi: 10.3969/j.issn.1672-979X.2020.02.004
[27] PARK H E, LEE W K. Immune enhancing effects of Weissella cibaria JW15 on BALB/c mice immunosuppressed by cyclophosphamide[J]. Journal of Functional Foods,2018,49:518−525. doi: 10.1016/j.jff.2018.09.003
[28] ZHAO S, PENG X, ZHOU Q Y, et al. Bacillus coagulans 13002 and fructo-oligosaccharides improve the immunity of mice with immunosuppression induced by cyclophosphamide through modulating intestinal-derived and fecal microbiota[J]. Food Research International, 2021, 140(3):97−109.
[29] 赵琳, 范雅宸, 黄子争. 嗜酸乳杆菌LA85对小鼠免疫机能的研究[J]. 中国食物与营养,2021,27(10):65−69. [ZHAO L, FAN Y C, HUANG Z Z. Study on the immune function of Lactobacillus acidophilus LA85 in mice[J]. Chinese Food and Nutrition,2021,27(10):65−69.] ZHAO L, FAN Y C, HUANG Z Z. Study on the immune function of Lactobacillus acidophilus LA85 in mice[J]. Chinese Food and Nutrition, 2021, 27(10): 65−69.
[30] 蒙月月, CHOW D S, SHUVAN K S, 等. 植物乳杆菌KLDS 1.0318对小鼠免疫调节作用初步研究[J]. 食品工业科技,2018,39(7):303−308. [MENG Y Y, CHOW D S, SHUVAN K S, et al. Preliminary study on the immunomodulatory effect of Lactobacillus plantarum KLDS 1.0318 on mice[J]. Science and Technology of Food Industry,2018,39(7):303−308.] MENG Y Y, CHOW D S, SHUVAN K S, et al. Preliminary study on the immunomodulatory effect of Lactobacillus plantarum KLDS 1.0318 on mice[J]. Science and Technology of Food Industry, 2018, 39(7): 303−308.
[31] ZHU G, JIANG Y, YAO Y, et al. Ovotransferrin ameliorates the dysbiosis of immunomodulatory 2 function and intestinal microbiota induced by cyclophosphamide[J]. Food Function,2019,10(2):1−38.





 下载:
下载:

 下载:
下载:
