Antioxidant Activity and Stability of Polysaccharide from Banana Flower
-
摘要: 目的:以香蕉花多糖为研究对象,研究其抗氧化活性及稳定性。方法:采用热水提醇沉法从香蕉花中制备活性多糖,首先分析香蕉花多糖的化学组成成分,并以总抗氧化能力和DPPH、羟基、超氧阴离子等自由基清除能力为评价指标,探索香蕉花多糖的抗氧化活性;在此基础上进一步以羟基自由基清除能力为评价指标,通过模拟光照、pH、温度、金属离子、食品配料以及灭菌方式等常见食品加工条件,系统地研究香蕉花多糖的抗氧化稳定性。结果:香蕉花多糖的得率为14.56%,多糖中总糖、糖醛酸、蛋白、多酚和黄酮含量依次为515.61、287.88、53.46、2.23和7.94 mg/g。香蕉花多糖具有较强的还原铁离子能力和自由基清除活性。光照条件会快速降低香蕉花多糖的抗氧化活性,而强酸性和碱性条件对香蕉花多糖的抗氧化稳定性影响较小。香蕉花多糖耐热性较好,尤其是温度在60~80 ℃、加热时间2~3.5 h的条件下,其抗氧化稳定性较强。金属钠离子的添加几乎不影响香蕉花多糖的抗氧化活性,但随着金属钾离子、铁离子、铜离子浓度的增大,香蕉花多糖的抗氧化活性会明显下降。此外,添加柠檬酸、苯甲酸钠有利于提高香蕉花多糖的抗氧化活性,但蔗糖、葡萄糖的添加对香蕉花多糖的抗氧化稳定性影响较大。灭菌方式对香蕉花多糖的抗氧化活性有一定的影响,因此对香蕉花加工产品进行灭菌时可优先选择高压杀菌。结论:香蕉花多糖具有较强的抗氧化活性,长期光照、金属铁离子和铜离子、食品配料蔗糖和葡萄糖会影响其抗氧化稳定性,在香蕉花的加工贮藏中应避免与此类条件或物质直接接触。Abstract: Objective: Banana flower polysaccharide was used as raw materials to analyze the antioxidant activity and stability. Methods: Bioactive polysaccharide from banana flower was extracted using hot-water extraction method combining with alcohol-precipitation method. Initially, the chemical composition of banana flower polysaccharide was detected and analyzed. Then, the total antioxidant capacity (T-AOC), as well as DPPH, hydroxyl and superoxide anion radicals scavenging activities were utilized to analyze the antioxidant activity of banana flower polysaccharide in vitro. On this basis, the antioxidant stability of banana flower polysaccharide was evaluated further by simulating different food processing conditions, including light, pH value, temperature, metal ions, common food ingredients, as well as sterilization methods, using the hydroxyl radical scavenging activity as the evaluation index. Results: The extraction yield of banana flower polysaccharide was about 14.56%, and the total sugar content, uronic acid content, protein content, phenolic content and flavonoid content of banana flower polysaccharide were 515.61, 287.88, 53.46, 2.23 and 7.94 mg/g, respectively. The result in this paper showed that polysaccharide obtained from banana flower possessed good reducing power, as well as DPPH and hydroxyl radicals scavenging capacities. The antioxidant property of banana flower polysaccharide was degraded by lighting, but remained stable under strong acidic as well as alkaline conditions. Banana flower polysaccharide had good heat resistance, specially under heating 60~80 ℃ from 2 to 3.5 h, its antioxidant stability was strong. Then, the good antioxidant stability of banana flower polysaccharide was observed in the presence of Na+ metal ion, whereas the antioxidant activity of banana flower polysaccharide was decreased with the increasing in the concentration of K+, Fe3+ and Cu2+ metal ions. Additionally, the antioxidant activity of banana flower polysaccharide was improved within the common food ingredients such as citric acid and sodium benzoate, but was decreased under sucrose and glucose as common food ingredients. The sterilization methods had different degrees of adverse effect on the antioxidant activity of banana flower polysaccharide, hence, high pressure sterilization could be used for sterilizing banana flower processing products. Conclusion: Banana flower polysaccharide had good antioxidant activity. The environmental factors including continuous light, Fe3+ and Cu2+ metal ions, as well as sucrose and glucose as common food ingredients might have the great influence on the antioxidant activity of banana flower polysaccharide. Hence, the direct contact with these environmental factors should be avoided during the processing and storage of banana flower.
-
香蕉(Musa spp.)是我国大宗高效的经济果树,种植面积和产量居世界前列,我国主要的香蕉种植区域有广东、广西、云南、海南、福建五大省份[1]。在规模化的香蕉生产中,香蕉花是香蕉成熟采摘后产生的几乎与果实等量的废弃物,但现阶段还未得到充分利用。长期丢弃在蕉园的香蕉花容易引起病虫害,这不仅造成蕉园环境二次污染,也导致大量植物资源的浪费[2]。因此,充分研究和利用香蕉花这一废弃资源,加强香蕉花综合开发力度,生产高附加值的产品,对保护环境、减少资源浪费和提高香蕉产业经济效益有着重要意义。
中医记载香蕉花味甘、微辛,具有化痰软坚、平肝熄风、活血调经、美肤养颜、安神减压等功效[3]。我国南部部分地区居民将香蕉花用来煮水或煎食。在斯里兰卡、老挝、菲律宾等东南亚地区,香蕉花也长期作为蔬菜和药材食用[4−5]。香蕉花的活性成分包括多糖类[6]、酚类、黄酮类和皂苷类[7],其中植物多糖是由超过10个单糖分子脱水缩合而成的一类结构复杂的天然高分子碳水化合物,安全性高、副作用小,具有抗氧化、降血糖、抗肿瘤、提高免疫、调节肠道菌群等生物活性[8]。
在正常情况下,机体内产生的自由基通过低分子化合物和酶的作用维持着动态平衡,然而随着机体年龄增大,体内自由基积累过多,自由基具有的强氧化性会导致疾病的产生,如糖尿病、肿瘤、心血管疾病等[9]。可见,天然抗氧化剂的摄入对预防和治疗多种疾病具有重要意义。越来越多的植物多糖被证实是一类天然的抗氧化剂,主要通过清除过量的自由基[10]、提高抗氧化酶活性[11]、抑制脂质过氧化[12]进而发挥抗氧化活性。与动物多糖和微生物多糖相比,植物多糖具有来源广泛、易于获得、得率较高等特点,已在功能食品、食品添加剂、日化用品、生物医药等领域得到广泛应用[13]。近年来,许多研究表明香蕉花的酚类[14−17]、黄酮类[18−20]等活性成分具有很好的抗氧化活性,而关于香蕉花多糖的抗氧化活性及稳定性报道较少。因此,本文评价香蕉花多糖的抗氧化活性,进一步模拟不同的食品加工条件考察香蕉花多糖的抗氧化稳定性,为香蕉花多糖作为天然抗氧化剂的开发利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
香蕉花 来源于广西壮族自治区农业科学院武鸣里建科学研究基地的桂蕉1号(2022年8月采摘);1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;半乳糖醛酸、没食子酸、芦丁、总抗氧化能力(T-AOC)检测试剂盒(FRAP法,BC1315) 北京索莱宝科技有限公司;羟自由基测试试剂盒(A018-1-1)、抑制与产生超氧阴离子自由基测定试剂盒(A052-1-1) 南京建成生物工程研究所;硝酸铝(Al(NO3)3)、维生素C(VC)、磷酸氢二钠(Na2HPO4)、柠檬酸、蔗糖、葡萄糖、苯甲酸钠、氯化钠(NaCl)、氯化钾(KCl)、氯化铜(CuCl2)、氯化铁(FeCl3) 天津市大茂化学试剂厂;所有试剂均为分析纯。
WGLL-230BE型电热鼓风干燥箱 天津市泰斯特仪器有限公司;UV-1800型紫外分光光度计 上海美析仪器有限公司;HH-S4型数显恒温水浴锅 金坛市万华实验仪器厂;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;LGJ-18型冷冻干燥机 北京松源华兴科技发展有限公司;3-18ks型台式高速冷冻离心机 美国Sigma公司;BioTek Epoch全波长酶标仪 美国BioTek公司;G80F20CSL-B8(R1)型微波炉 广东格兰仕微波生活电器制造有限公司;YAMATO SQ510C型立式压力蒸汽灭菌器 日本Yamato Scientific公司。
1.2 实验方法
1.2.1 香蕉花多糖的制备及组成成分分析
1.2.1.1 多糖提取与纯化
新鲜的香蕉花采摘后,将花蕾部分分离、清洗沥干,热风干燥后粉碎过80目筛。向香蕉花粉末中加入体积分数90%乙醇去除色素类和脂质类成分,剩余物经过滤、冻干得到脱色香蕉花粉末[21]。香蕉花多糖提取方法参考前期建立的热水提醇沉法[22],脱色香蕉花粉末按固液比1:50(g/mL)加入去离子水,提取温度设置为90 ℃,提取时间设置为2 h,提取2次,合并两次提取液并按体积比1:4(v/v)加入体积分数95%乙醇,于4 ℃静置12 h。收集沉淀并将沉淀完全溶解于去离子水中,按体积比1:4(v/v)加入Sevag溶液去除蛋白类成分。脱蛋白的多糖溶液旋转蒸发浓缩,最后冻干得到香蕉花多糖,称量并按公式(1)计算香蕉花多糖得率。
多糖得率(%)=香蕉花多糖质量(g)香蕉花原料质量(g)×100 (1) 1.2.1.2 多糖组成成分分析
香蕉花多糖的总糖含量采用苯酚-硫酸法,糖醛酸含量采用硫酸-咔唑法[23],蛋白含量采用考马斯亮蓝(Bradford)法[22],总多酚含量采用福林酚法[24],总黄酮含量测定采用Al(NO3)3比色法[25]。
1.2.2 香蕉花多糖抗氧化活性分析
1.2.2.1 总抗氧化能力(T-AOC)测定
采用Fe3+还原试剂盒(FRAP法)测定香蕉花多糖的总抗氧化能力[26],操作步骤参照试剂盒说明书进行,香蕉花多糖溶液质量浓度范围0.01~1.0 mg/mL,阳性对照为相同质量浓度范围的VC溶液。
1.2.2.2 DPPH自由基清除能力
参考何雪梅等[27]的方法,移取0.2 mL不同质量浓度的香蕉花多糖溶液(0.1~1.0 mg/mL)或无水乙醇(空白对照),加入0.2 mL的DPPH溶液,振荡混匀,避光静置于室温30 min后,于517 nm处测定吸光度值。DPPH自由基清除率按公式(2)计算,阳性对照为相同质量浓度范围的VC溶液。
DPPH自由基清除率(%)=A0−(Ai−Aj)A0×100 (2) 式中,A0为DPPH溶液和无水乙醇的吸光度值;Ai为DPPH溶液和不同质量浓度的多糖溶液的吸光度值;Aj为多糖溶液和无水乙醇的吸光度值。
1.2.2.3 羟基自由基清除能力
采用羟自由基测定试剂盒测定香蕉花多糖的羟基自由基清除能力,操作步骤参照试剂盒说明书进行,香蕉花多糖溶液质量浓度范围0.05~0.8 mg/mL,阳性对照为相同质量浓度范围的VC溶液。
1.2.2.4 超氧阴离子自由基清除能力
采用抑制与产生超氧阴离子自由基测定试剂盒测定香蕉花多糖的超氧阴离子自由基清除能力,操作步骤按照试剂盒说明书进行,香蕉花多糖溶液质量浓度范围0.05~10 mg/mL,阳性对照为相同质量浓度范围的VC溶液。
1.2.3 香蕉花多糖抗氧化稳定性分析
1.2.3.1 光照对多糖抗氧化稳定性的影响
参考孟良玉等[28]的方法并略作改动,配制质量浓度0.1 mg/mL的香蕉花多糖溶液,置于烧杯中,并用保鲜膜封住杯口。烧杯分别置于自然光、日光灯和避光处存放,每隔2 d取样,测定香蕉花多糖溶液的羟基自由基清除能力。
1.2.3.2 pH对多糖抗氧化稳定性的影响
参考刘晓艺等[29]的方法并略作改动,将香蕉花多糖样品分别溶解在pH为3、4、5、6、7、8的Na2HPO4-柠檬酸缓冲液中,配制成质量浓度0.1 mg/mL的香蕉花多糖溶液,并用HCl或NaOH溶液微调pH,室温避光放置2 h后[30],测定香蕉花多糖溶液的羟基自由基清除能力。
1.2.3.3 温度对多糖抗氧化稳定性的影响
参考宋姗姗等[31]的方法并略作改动,配制质量浓度0.1 mg/mL的香蕉花多糖溶液,置于试管中,并用封口膜密封。试管分别置于40、60、80、100 ℃的避光条件下保温,每隔0.5 h取样,取出后冷却至室温,测定香蕉花多糖溶液的羟基自由基清除能力。
1.2.3.4 金属离子对多糖抗氧化稳定性的影响
参考宋姗姗等[31]的方法并略作改动,分别用浓度为2、4、6、8、10、12 mmol/L的NaCl、KCl、CuCl2和FeCl3溶液配制香蕉花多糖溶液(质量浓度0.1 mg/mL),室温避光放置2 h后,测定香蕉花多糖溶液的羟基自由基清除能力。
1.2.3.5 常用食品配料对多糖抗氧化稳定性的影响
参考赵广河等[30]的方法,分别用蔗糖溶液(质量浓度0%、1%、2%、3%、4%和5%)、葡萄糖溶液(质量浓度0%、1%、2%、3%、4%和5%)、柠檬酸溶液(质量浓度0%、0.1%、0.2%、0.3%、0.4%和0.5%)和苯甲酸钠溶液(质量浓度0%、0.005%、0.010%、0.015%、0.020%和0.025%)配制香蕉花多糖溶液(质量浓度0.1 mg/mL),室温避光放置2 h后,测定香蕉花多糖溶液的羟基自由基清除能力。
1.2.3.6 灭菌方式对多糖抗氧化稳定性的影响
参考赵广河等[30]的方法并略作改动,分别用煮沸灭菌(100 ℃条件下加热10 min)、巴氏灭菌(70 ℃条件下加热30 min)、微波灭菌(微波功率2.4 W/g条件下处理10 min)、高压灭菌(121 ℃、0.11 MPa条件下加热15 min)等灭菌方式处理质量浓度0.1 mg/mL的香蕉花多糖溶液,测定香蕉花多糖溶液的羟基自由基清除能力。
1.3 数据处理
每组做3次重复实验,结果以“平均值±标准偏差(Mean±SD)”表示。采用IBM SPSS Statistics 26软件进行数据的统计分析,通过单因素方差分析(ANOVE)和Duncan多重比较确定显著性差异(P<0.05)。采用GraphPad Prism 9.0进行绘图。
2. 结果与分析
2.1 香蕉花多糖得率与组成成分的分析
首先,根据公式(1)计算出香蕉花多糖的得率为14.56%±1.33%。以标准品溶液的质量浓度为横坐标、吸光度值为纵坐标分别绘制总糖、糖醛酸、蛋白质、总多酚、总黄酮等含量指标的标准曲线。葡萄糖标准曲线回归方程及相关系数为y=0.0084x−0.0063(R2=0.9994),半乳糖醛酸标准曲线回归方程及相关系数为y=0.0066x−0.0319(R2=0.9993),牛血清白蛋白标准曲线回归方程及相关系数为y=0.0067x+0.0912(R2=0.9993),没食子酸标准曲线回归方程及相关系数为y=0.001x+0.0495(R2=0.9993)以及芦丁标准回归方程及相关系数为y=0.0036x+0.0131(R2=0.9991)。结果显示,采用热水提醇沉法从脱色香蕉花粉末中获得的提取物主要成分是多糖类(总糖含量超过50%),其中糖醛酸含量287.88 mg/g、蛋白质含量53.46 mg/g。此外,香蕉花多糖中含有少量的酚类、黄酮类等色素成分(见表1)。
表 1 香蕉花多糖得率和组成成分分析Table 1. Extraction yield and chemical composition of banana flower polysaccharide指标 香蕉花多糖 多糖得率(%) 14.56±1.33 总糖含量(mg/g干重) 515.61±2.33 糖醛酸含量(mg/g干重) 287.88±5.44 蛋白质含量(mg/g干重) 53.46±0.75 多酚含量(mg/g干重) 2.23±0.38 黄酮含量(mg/g干重) 7.94±0.33 2.2 香蕉花多糖抗氧化活性分析
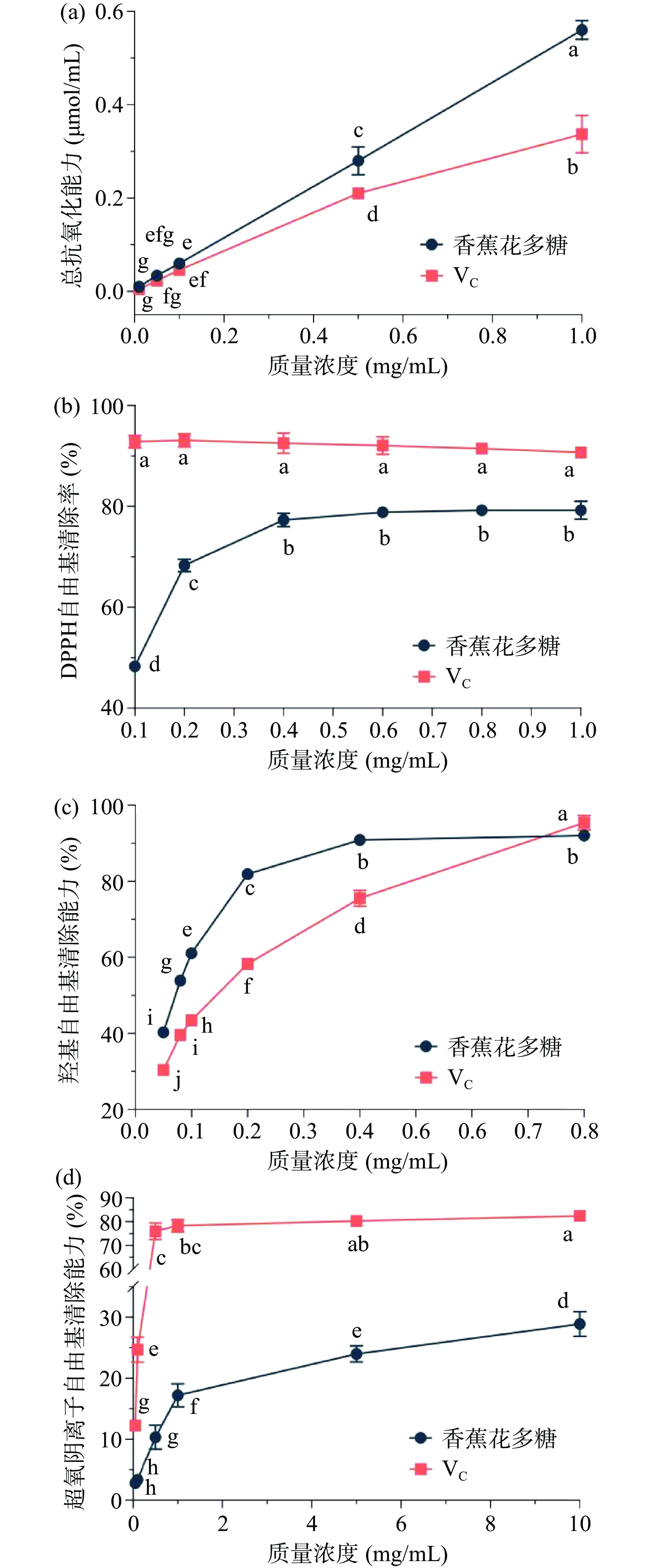
香蕉花多糖的总抗氧化能力结果如图1a所示,香蕉花多糖和VC对Fe3+均有一定的还原力,且随着溶液质量浓度的增加而呈现上升趋势。当质量浓度大于0.1 mg/mL时,香蕉花多糖的T-AOC显著高于VC,尤其是当多糖溶液质量浓度为1.0 mg/mL时,其T-AOC达到(0.56±0.02) μmol/mL。香蕉花多糖的DPPH自由基清除能力结果如图1b所示,香蕉花多糖与VC均具有一定的DPPH自由基清除能力。在0.1~0.6 mg/mL质量浓度内,香蕉花多糖的DPPH自由基清除能力与其浓度呈正相关性,当质量浓度大于0.6 mg/mL后,其清除能力趋于稳定;而当VC的质量浓度为0.1 mg/mL时,其对DPPH自由基的清除率超过90%。香蕉花多糖和VC的DPPH自由基清除能力的IC50值见表2,结果显示VC的DPPH自由基清除能力(IC50=0.05±0.01 mg/mL)显著高于香蕉花多糖(IC50=0.11±0.02 mg/mL)。当溶液质量浓度为1.0 mg/mL时,香蕉花多糖对DPPH自由基的清除率为79.24%±1.78%。
表 2 香蕉花多糖自由基清除能力的IC50值Table 2. IC50 values of free radical scavenging activities in banana flower polysaccharide样品 DPPH自由基
清除能力羟基自由基
清除能力超氧阴离子
自由基清除能力香蕉花多糖(mg/mL) 0.11±0.02b 0.07±0.01a / VC(mg/mL) 0.05±0.01a 0.14±0.01b 0.29±0.02 注:同列中不同小写字母表示组间差异显著(P<0.05)。 香蕉花多糖的羟基自由基清除能力结果如图1c所示,香蕉花多糖与VC均具有一定的羟基自由基清除能力,且随着溶液质量浓度的增加而呈现上升趋势。香蕉花多糖羟基自由基清除能力的IC50值为(0.07±0.01)mg/mL,这显著低于VC羟基自由基清除能力的IC50值(P<0.05)(见表2)。当香蕉花多糖质量浓度为0.4 mg/mL时,其羟基自由基清除能力达到90.86%±1.34%。香蕉花多糖的超氧阴离子自由基清除能力结果如图1d所示,香蕉花多糖与VC对超氧阴离子自由基均有一定的抑制作用,且随着溶液质量浓度的增加而呈现上升趋势。然而,与DPPH、羟基等自由基清除能力相比,香蕉花多糖对超氧阴离子自由基的清除能力较弱,且显著低于VC的清除能力。当香蕉花多糖质量浓度为10 mg/mL时,其超氧阴离子自由基的清除能力仅为28.89%±2.05%。
2.3 香蕉花多糖抗氧化稳定性的分析
2.3.1 光照对多糖抗氧化稳定性的影响
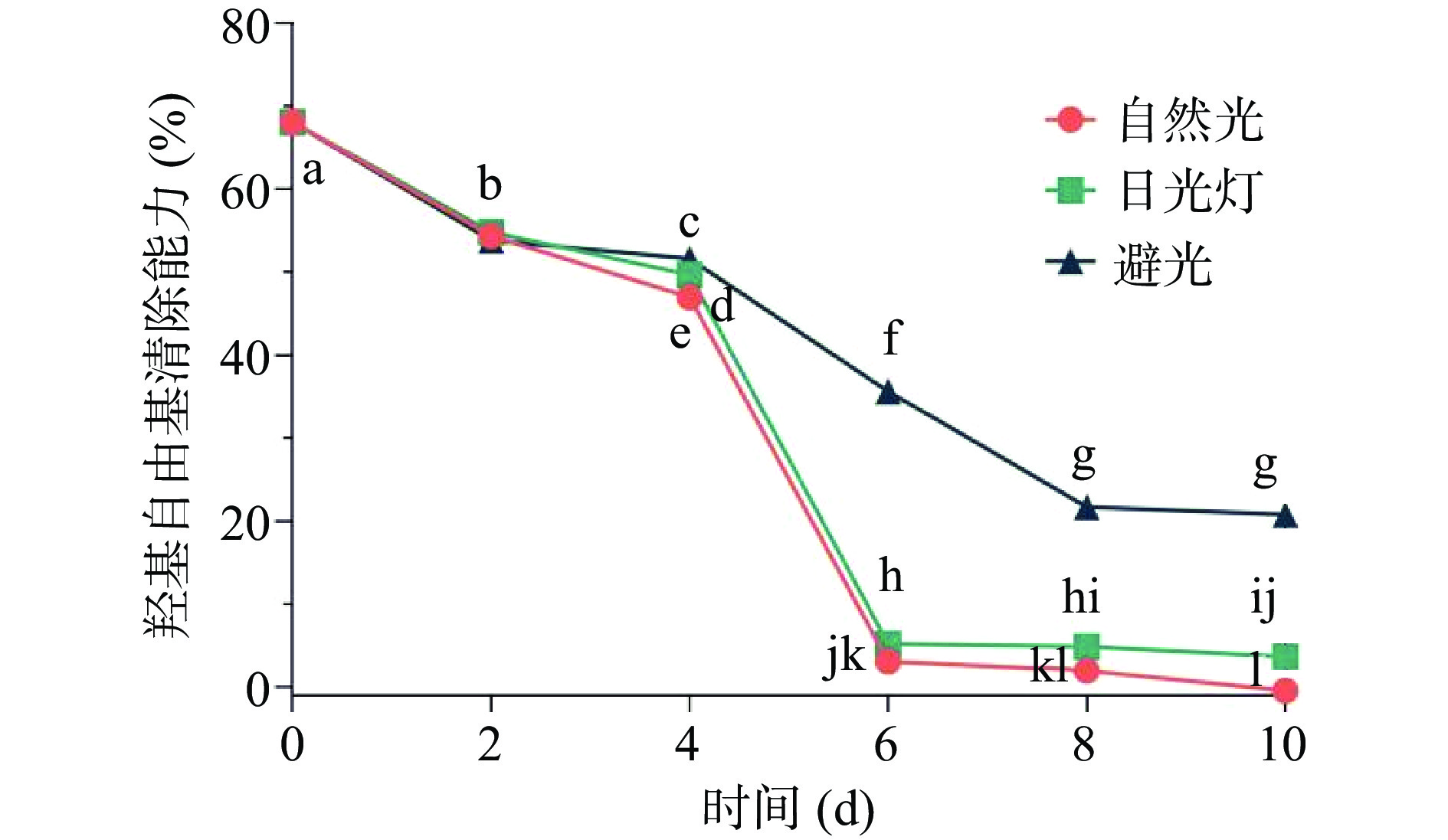
光照对香蕉花多糖抗氧化活性的影响见图2。整体来看,光照对香蕉花多糖的抗氧化稳定性有较大的影响,随着光照时间的增加,香蕉花多糖的羟基自由基清除能力快速降低。自然光和日光灯2种光照方式对香蕉花多糖的羟基自由基清除能力的影响趋势较为相似。在0~6 d时,多糖的羟基自由基清除能力下降速度较快,放置在自然光和日光灯条件下的多糖溶液,其羟基自由基清除能力降低超过90%;而光照6 d以后,香蕉花多糖对羟基自由基的清除能力接近于0%。在避光条件下,随着时间的增加,香蕉花多糖的抗氧化活性下降速度相对缓慢,第10 d时,香蕉花多糖的羟基自由基清除能力保持在20.78%±0.68%,显著高于光照条件下的多糖溶液(P<0.05)。因此,对含有香蕉花多糖的产品建议避光包装,若加工生产过程较长,亦建议尽量做到避光。
2.3.2 pH对多糖抗氧化稳定性的影响
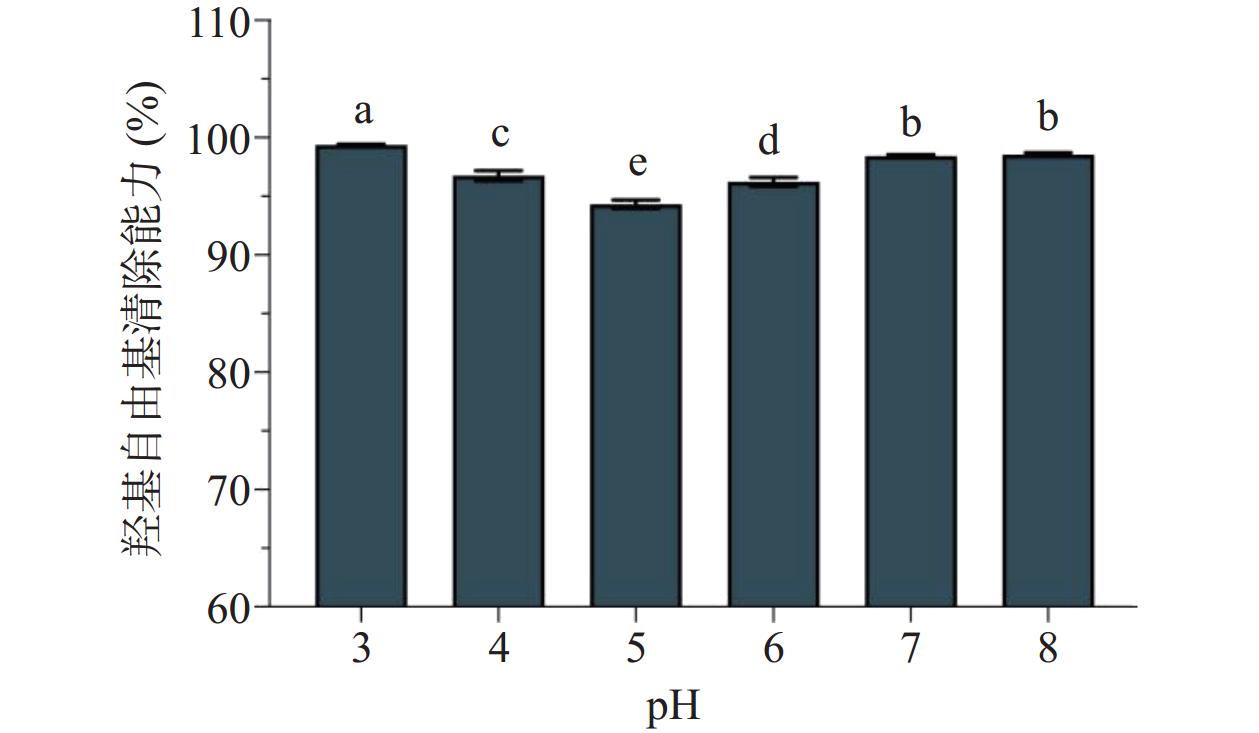
pH对香蕉花多糖抗氧化活性的影响见图3。整体来看,当pH在3~8范围时,香蕉花多糖的抗氧化活性呈现先降低后升高的趋势。当pH<6时,香蕉花多糖的羟基自由基清除能力降低。当pH在6~8范围内,香蕉花多糖的羟基自由基清除能力缓慢增加。这可能是由于在强酸条件下,酚类、黄酮类等色素成分与多糖之间易形成交联结构,协同提高多糖溶液的整体抗氧化活性;而随着pH增加,香蕉花多糖中色素成分会发生不同程度的降解[32],香蕉花多糖溶液的抗氧化活性随之降低。另一方面,香蕉花多糖中含有一定量的蛋白质,蛋白质-多糖的相互作用也易受pH的影响[33],推测当pH≤4或>6时,溶液中易形成具有强抗氧化活性的蛋白质-多糖复合物,故香蕉花多糖溶液的抗氧化活性随之增强。由此看出,在强酸性及碱性条件下,香蕉花多糖溶液的抗氧化活性比较稳定。
2.3.3 温度对多糖抗氧化稳定性的影响
温度对香蕉花多糖抗氧化活性的影响见图4。在温度40~100 ℃的条件下,随着加热时间的延长,香蕉花多糖的抗氧化活性变化是先降低后升高并逐渐平缓。由图4可知,在温度40~100 ℃、加热时间1 h内的条件下,香蕉花多糖溶液对羟基自由基的清除能力迅速下降。随着加热时间的进一步延长,在温度40~80 ℃的条件下,香蕉花多糖溶液的羟基自由基清除能力缓慢回升。当加热时间超过2 h时,所有温度条件下的香蕉花多糖溶液的抗氧化活性变化趋于稳定。特别是,当温度60~80 ℃、加热时间2~3.5 h的条件下,香蕉花多糖的抗氧化活性相对较高。这可能是由于在加热初期,香蕉花多糖溶液中的部分多糖和色素类成分被降解,溶液的抗氧化活性随之降低;另一方面推测,随着环境温度和加热时间增加,香蕉花多糖溶液中蛋白质-多糖的互作也受到影响,进而使得溶液的抗氧化能力产生波动。
2.3.4 金属离子对多糖抗氧化稳定性的影响
金属离子对香蕉花多糖抗氧化活性的影响见图5。由图可知,在不同质量浓度的K+溶液处理下,香蕉花多糖的羟基自由基清除能力有一定程度的波动,尤其是当K+溶液质量浓度超过10 mmol/L时,香蕉花多糖对羟基自由基的清除能力下降。在Cu2+、Fe3+溶液中,香蕉花多糖的羟基自由基清除能力随着金属离子浓度的增加而显著降低。此外,当金属离子溶液质量浓度达到12 mmol/L时,与Fe3+溶液相比,Cu2+溶液会加速降低香蕉花多糖的抗氧化活性。而相较于K+、Cu2+和Fe3+三种金属离子溶液,在不同质量浓度的Na+溶液处理下,香蕉花多糖的羟基自由基清除能力相对稳定,这与桃金娘果实、太行菊、败酱草多糖的抗氧化稳定特性一致[28,30,34]。这可能是由于香蕉花多糖与这些金属离子结合,形成部分复合物,使得多糖含量降低,进而不利于香蕉花多糖的抗氧化稳定性[35];亦或是香蕉花多糖与不同金属离子之间的配位能力、配位方式等差异所造成了络合物空间结构的不同[36],如Fe3+被还原成Fe2+、Cu2+被还原成Cu+,因而导致多糖抗氧化能力的变化。
2.3.5 常用食品配料对多糖抗氧化稳定性的影响
常用食品配料对香蕉花多糖抗氧化活性的影响见图6,常见食品配料蔗糖、葡萄糖、柠檬酸以及苯甲酸钠对香蕉花多糖的抗氧化活性有显著的影响。加入甜味剂(蔗糖和葡萄糖)后,香蕉花多糖的羟基自由基清除能力显著降低(图6a、6b所示);而加入酸性添加剂(柠檬酸)和碱性添加剂(苯甲酸钠)后,香蕉花多糖的羟基自由基清除能力显著提高(图6c、6d所示)。这可能是由于在高浓度的H+或OH-条件下,香蕉花多糖的结构仍能保持稳定;亦或是在酸碱性介质的干预下,香蕉花多糖得失电子的能力增强,进而提高其氧化还原能力。因此,在制作香蕉花加工产品中,尽量避免蔗糖、葡萄糖的食品添加剂的使用,可以考虑使用代糖或不添加传统甜味剂。
2.3.6 灭菌方式对多糖抗氧化稳定性的影响
灭菌方式对香蕉花多糖抗氧化活性的影响见图7。煮沸杀菌、巴氏杀菌、微波杀菌以及高压杀菌对香蕉花多糖的抗氧化活性有不同程度的影响,其中高压杀菌对香蕉花多糖的羟基自由基清除能力的影响相对较小。因此,对香蕉花加工产品进行灭菌时可优先选择高压杀菌。
3. 结论
以香蕉花多糖为研究对象,对其化学组成成分、抗氧化活性及稳定性进行了分析。研究结论指出,香蕉花多糖具有较好的还原力以及对DPPH、羟基自由基有较强的抑制能力,且随着质量浓度的增加,香蕉花多糖的抗氧化活性增加。然而,香蕉花多糖的抗氧化活性易受到食品加工条件的影响,尤其是长期光照、金属铁离子和铜离子、食品配料蔗糖和葡萄糖等条件会显著影响其稳定性,在香蕉花的加工贮藏中应避免与此类条件或物质直接接触。后续研究将采用氧化应激细胞模型和动物模型,对香蕉花多糖的抗氧化能力系统性深入研究与分析,以进一步促进香蕉花多糖作为天然抗氧化剂应用于食品加工业。
-
表 1 香蕉花多糖得率和组成成分分析
Table 1 Extraction yield and chemical composition of banana flower polysaccharide
指标 香蕉花多糖 多糖得率(%) 14.56±1.33 总糖含量(mg/g干重) 515.61±2.33 糖醛酸含量(mg/g干重) 287.88±5.44 蛋白质含量(mg/g干重) 53.46±0.75 多酚含量(mg/g干重) 2.23±0.38 黄酮含量(mg/g干重) 7.94±0.33 表 2 香蕉花多糖自由基清除能力的IC50值
Table 2 IC50 values of free radical scavenging activities in banana flower polysaccharide
样品 DPPH自由基
清除能力羟基自由基
清除能力超氧阴离子
自由基清除能力香蕉花多糖(mg/mL) 0.11±0.02b 0.07±0.01a / VC(mg/mL) 0.05±0.01a 0.14±0.01b 0.29±0.02 注:同列中不同小写字母表示组间差异显著(P<0.05)。 -
[1] 孙健, 何雪梅, 唐雅园, 等. 香蕉加工研究进展[J]. 热带作物学报,2020,41(10):2022−2033. [SUN Jian, HE Xuemei, TANG Yayuan, et al. Research progress of banana processing[J]. Chinese Journal of Tropical Crops,2020,41(10):2022−2033.] doi: 10.3969/j.issn.1000-2561.2020.10.009 SUN Jian, HE Xuemei, TANG Yayuan, et al . Research progress of banana processing[J]. Chinese Journal of Tropical Crops,2020 ,41 (10 ):2022 −2033 . doi: 10.3969/j.issn.1000-2561.2020.10.009[2] 赵佳莹, 唐善虎, 李思宁, 等. 香蕉花提取物对牦牛肉自然发酵香肠理化品质及挥发性风味物质的影响[J]. 食品科学,2023,44(8):30−39. [ZHAO Jiaying, TANG Shanhu, LI Sining, et al. Effect of banana flower extract on protein oxidation in naturally fermented sausages of yak meat[J]. Food Science,2023,44(8):30−39.] ZHAO Jiaying, TANG Shanhu, LI Sining, et al . Effect of banana flower extract on protein oxidation in naturally fermented sausages of yak meat[J]. Food Science,2023 ,44 (8 ):30 −39 .[3] 马博, 苏仕林, 黄娇丽. 野生芭蕉花与假茎的营养成分分析[J]. 食品工业,2018,39(6):313−316. [MA Bo, SU Shilin, HUANG Jiaoli. Nutrient constituent evaluation of flower and pseudostem from wild Musa basjoo[J]. Food Industry,2018,39(6):313−316.] MA Bo, SU Shilin, HUANG Jiaoli . Nutrient constituent evaluation of flower and pseudostem from wild Musa basjoo[J]. Food Industry,2018 ,39 (6 ):313 −316 .[4] BHASKAR J J, MAHADEVAMMA S, CHILKUNDA N D, et al. Banana ( Musa sp. var. elakki bale) flower and pseudostem:Dietary fiber and associated antioxidant capacity[J]. Journal of Agricultural and Food Chemistry,2012,60:427−432. doi: 10.1021/jf204539v
[5] LAU B F, KONG K W, LEONG K H, et al. Banana inflorescence:Its bio-prospects as an ingredient for functional foods[J]. Trends in Food Science & Technology,2020,97(3):14−28.
[6] 胡莹莹, 郑丽丽, 艾斌凌, 等. 汽爆处理对香蕉花可溶性膳食纤维理化性质的影响[J]. 中国食品学报,2018,18(2):134−140. [HU Yingying, ZHENG Lili, AI Binling, et al. Effects of steam explosion on physicochemical properties of soluble dietary fiber from banana flowers[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(2):134−140.] HU Yingying, ZHENG Lili, AI Binling, et al . Effects of steam explosion on physicochemical properties of soluble dietary fiber from banana flowers[J]. Journal of Chinese Institute of Food Science and Technology,2018 ,18 (2 ):134 −140 .[7] SHENG Z W, MA W H, JIN Z Q, et al. Investigation of dietary fiber, protein, vitamin E and other nutritional compounds of banana flower of two cultivars grown in China[J]. African Journal of Biotechnology,2010,9(25):3888−3895.
[8] 王文丽, 张金玲, 魏亚宁, 等. 天然多糖提取、纯化及生物活性研究进展[J]. 食品工业科技,2022,43(22):470−480. [WANG Wenli, ZHANG Jinling, WEI Yaning, et al. Extraction, purification and bioactivity of natural polysaccharides:A review[J]. Science and Technology of Food Industry,2022,43(22):470−480.] WANG Wenli, ZHANG Jinling, WEI Yaning, et al . Extraction, purification and bioactivity of natural polysaccharides: A review[J]. Science and Technology of Food Industry,2022 ,43 (22 ):470 −480 .[9] SIES H, BELOUSOV V V, CHANDEL N S, et al. Defining roles of specific reactive oxygen species (ROS) in cell biology and physiology[J]. Nature Reviews Molecular Cell Biology,2022,23(7):499−515. doi: 10.1038/s41580-022-00456-z
[10] WANG S, YANG Y, XIAO D, et al. Polysaccharides from banana ( Musa spp.) blossoms:Isolation, identification and anti-glycation effects[J]. International Journal of Biological Macromolecules,2023,236(5):123957.
[11] MU S, YANG W, HUANG G. Antioxidant activities and mechanisms of polysaccharides[J]. Chemical Biology & Drug Design,2021,97(3):628−632.
[12] SHEN Z W, MA W H, GAO J H, et al. Antioxidant properties of banana flower of two cultivars in China using 2, 2-diphenyl-1-picrylhydrazyl (DPPH) reducing power, 2, 2'-azinobis-(3-ethylbenzthiazoline-6-sulphonate (ABTS) and inhibition of lipid peroxidation assays[J]. African Journal of Biotechnology,2011,10(21):4470−4477.
[13] 刘思扬, 陆雅琦, 海日汉, 等. 功能性植物多糖及其应用研究进展[J]. 食品工业科技,2022,43(21):444−453. [LIU Siyang, LU Yaqi, HAI Rihan, et al. Research progress on plant functional polysaccharides and its application[J]. Science and Technology of Food Industry,2022,43(21):444−453.] LIU Siyang, LU Yaqi, HAI Rihan, et al . Research progress on plant functional polysaccharides and its application[J]. Science and Technology of Food Industry,2022 ,43 (21 ):444 −453 .[14] RAMU R, SHIRAHATTI P S, ANILAKUMAR K R, et al. Assessment of nutritional quality and global antioxidant response of banana ( Musa sp. cv. Nanjangud Rasa Bale) pseudostem and flower[J]. Pharmacognosy Research,2017,9(Suppl 1):S74−S83.
[15] ARUN K B, THOMAS S, RESHMITHA T R, et al. Dietary fibre and phenolic-rich extracts from Musa paradisiaca inflorescence ameliorates type 2 diabetes and associated cardiovascular risks[J]. Journal of Functional Foods,2017,31(4):198−207.
[16] BHASKAR J J, PUNEETH K A, SALIMATH P V. Effect of banana ( Musa sp. var elakki bale) flower and pseudostem on antioxidant and lysosomal enzyme activities in streptozotocin-induced diabetic rats[J]. Journal of Pharmacy Research,2011,4:1087−1091.
[17] REVADIGAR V, AL-MANSOUBl M A, ASIF M, et al. Anti-oxidative and cytotoxic attributes of phenolic rich ethanol extract of Musa balbisiana Colla inflorescence[J]. Journal of Applied Pharmaceutical Science,2017,7(5):103−110.
[18] NISHA P, MINI S. Flavanoid rich ethyl acetate fraction of Musa paradisiaca inflorescence down-regulates the streptozotocin induced oxidative stress, hyperglycaemia and mRNA levels of selected inflammatory genes in rats[J]. Journal of Functional Foods,2013,5(4):1838−1847. doi: 10.1016/j.jff.2013.09.003
[19] BASUMATARY S, NATH N. Assessment of chemical compositions and in vitro antioxidant properties of Musa balbisiana Colla inflorescence[J]. International Journal of Pharmaceutical Research,2018,10(1):80−85.
[20] DIVYA R S, VENKATALAKSHMI P, VADIVEL V, et al. In vitro studies on the biological activities of flowers of banana ( Musa Paradisiaca L. )[J]. Der Pharmacia Lettre,2016,8:238−246.
[21] CHEN C, WANG P, HUANG Q, et al. A comparison study on polysaccharides extracted from Fructus mori using different methods:Structural characterization and glucose entrapment[J]. Food & Function,2019,10(6):3684−3695.
[22] TANG Y, HE X, LIU G, et al. Effects of different extraction methods on the structural, antioxidant and hypoglycemic properties of red pitaya stem polysaccharide[J]. Food Chemistry,2023,405(6):134804.
[23] 唐雅园, 何雪梅, 孙健, 等. 火龙果茎多糖在护手霜中的应用及性能评价[J]. 日用化学工业,2022,52(4):410−417. [TANG Yayuan, HE Xuemei, SUN Jian, et al. Application and properties of the polysaccharide from red pulp pitaya stem in hand creams[J]. China Surfactant Detergent & Cosmetics,2022,52(4):410−417.] TANG Yayuan, HE Xuemei, SUN Jian, et al . Application and properties of the polysaccharide from red pulp pitaya stem in hand creams[J]. China Surfactant Detergent & Cosmetics,2022 ,52 (4 ):410 −417 .[24] TANG Y, CAI W, XU B. From rice bag to table:Fate of phenolic chemical compositions and antioxidant activities in waxy and non-waxy black rice during home cooking[J]. Food Chemistry,2016,191(2):81−90.
[25] TANG Y Y, HE X M, SUN J, et al. Polyphenols and alkaloids in byproducts of longan fruits ( Dimocarpus longan Lour.) and their bioactivities[J]. Molecules,2019,24(6):1186. doi: 10.3390/molecules24061186
[26] 唐雅园, 何雪梅, 孙健, 等. 富硒大米中不同溶解性硒蛋白理化特性和抗氧化活性[J]. 食品工业科技,2021,42(9):44−50. [TANG Yayuan, HE Xuemei, SUN Jian, et al. Physicochemical properties and antioxidant activities of different se-proteins from selenium-enriched rice[J]. Science and Technology of Food Industry,2021,42(9):44−50.] TANG Yayuan, HE Xuemei, SUN Jian, et al . Physicochemical properties and antioxidant activities of different se-proteins from selenium-enriched rice[J]. Science and Technology of Food Industry,2021 ,42 (9 ):44 −50 .[27] 何雪梅, 岳健, 邱福荣, 等. 动态超高压微射流辅助提取对滇黄精多糖结构和活性的影响[J]. 食品科学,2022,43(19):95−101. [HE Xuemei, YUE Jian, QIU Furong, et al. Effect of dynamic high-pressure microfluidization assisted extraction on the structure and activity of polysaccharides from Polygonatum kingianum Coll. et Hemsl J]. Food Science,2022,43(19):95−101.
[28] 孟良玉, 刘锦峰, 渠宏雁, 等. 败酱草粗多糖抗氧化稳定性的研究[J]. 食品工业科技,2012,33(20):109−111,115. [MENG Liangyu, LIU Jinfeng, QU Hongyan, et al. Study on antioxidant stability of the crude polysaccharide from Herba patriniae[J]. Science and Technology of Food Industry,2012,33(20):109−111,115.] MENG Liangyu, LIU Jinfeng, QU Hongyan, et al . Study on antioxidant stability of the crude polysaccharide from Herba patriniae[J]. Science and Technology of Food Industry,2012 ,33 (20 ):109 −111,115 .[29] 刘晓艺, 周玉岩, 过利敏, 等. 不同分子量红花籽抗氧化肽稳定性研究[J]. 食品工业科技,2022,43(13):94−102. [LIU Xiaoyi, ZHOU Yuyan, GUO Limin, et al. Study on the stability of antioxidant peptides from safflower seeds with different molecular weight[J]. Science and Technology of Food Industry,2022,43(13):94−102.] LIU Xiaoyi, ZHOU Yuyan, GUO Limin, et al . Study on the stability of antioxidant peptides from safflower seeds with different molecular weight[J]. Science and Technology of Food Industry,2022 ,43 (13 ):94 −102 .[30] 赵广河, 陆玺文, 胡梦琪, 等. 桃金娘果实多糖抗氧化稳定性的研究[J]. 食品研究与开发,2021,42(16):65−70. [ZHAO Guanghe, LU Xiwen, HU Mengqi, et al. Study of antioxidant stability of polysaccharides from Rhodomyrtus tomentosa (Ait.) Hassk berries[J]. Food Research and Development,2021,42(16):65−70.] ZHAO Guanghe, LU Xiwen, HU Mengqi, et al . Study of antioxidant stability of polysaccharides from Rhodomyrtus tomentosa (Ait.) Hassk berries[J]. Food Research and Development,2021 ,42 (16 ):65 −70 .[31] 宋姗姗, 杨艾华, 王微微, 等. 火炭母提取物抗氧化性及稳定性研究[J]. 中国食品添加剂,2021,32(12):23−30. [SONG Shanshan, YANG Aihua, WANG Weiwei, et al. Study on antioxidant activity and stability of the extracts from Polygonum chinense L J]. China Food Additives,2021,32(12):23−30.
[32] 曾繁森, 叶妍琦, 张美清, 等. 紫薯花色苷的抗氧化活性及其稳定性研究[J]. 闽南师范大学学报(自然科学版),2019,32(3):60−67. [ZENG Fansen, YE Yanqi, ZHANG Meiqing, et al. Study on antioxidant activity and stability of purple potato anthocyanin[J]. Journal of Minnan Normal University (Natural Science),2019,32(3):60−67.] ZENG Fansen, YE Yanqi, ZHANG Meiqing, et al . Study on antioxidant activity and stability of purple potato anthocyanin[J]. Journal of Minnan Normal University (Natural Science),2019 ,32 (3 ):60 −67 .[33] 汪少芸, 冯雅梅, 伍久林, 等. 蛋白质-多糖多尺度复合物结构的形成机制及其应用前景[J]. 食品科学,2021,42(17):1−9. [WANG Shaoyun, FENG Yamei, WU Jiulin, et al. Formation mechanism of protein-polysaccharide multi-scale complexes and their future applications[J]. Food Science,2021,42(17):1−9.] WANG Shaoyun, FENG Yamei, WU Jiulin, et al . Formation mechanism of protein-polysaccharide multi-scale complexes and their future applications[J]. Food Science,2021 ,42 (17 ):1 −9 .[34] 葛水莲, 陈建中, 刘娜, 等. 太行菊多糖抗氧化活性及稳定性研究[J]. 食品科技,2020,45(4):169−174. [GE Shuilian, CHEN Jianzhong, LIU Na, et al. Study on antioxidant activity and stability of polysaccharides from Opisthopappus taihangensis[J]. Food Science and Technology,2020,45(4):169−174.] GE Shuilian, CHEN Jianzhong, LIU Na, et al . Study on antioxidant activity and stability of polysaccharides from Opisthopappus taihangensis[J]. Food Science and Technology,2020 ,45 (4 ):169 −174 .[35] 朱苗, 朱启燕, 李刚凤, 等. 酶法提取沙子空心李多糖的工艺优化及稳定性研究[J]. 粮食与油脂,2023,36(4):103−107. [ZHU Miao, ZHU Qiyan, LI Gangfeng, et al. Study on the optimization of enzymatic extraction process and stability of polysaccharides from Prunus salicina Lindl. cv. ‘Shazikongxinli’[J]. Cereals & Oils,2023,36(4):103−107.] ZHU Miao, ZHU Qiyan, LI Gangfeng, et al . Study on the optimization of enzymatic extraction process and stability of polysaccharides from Prunus salicina Lindl. cv. ‘Shazikongxinli’[J]. Cereals & Oils,2023 ,36 (4 ):103 −107 .[36] 杨艾华, 宋姗姗, 王微微. 湄潭白茶多糖抗氧化活性及稳定性研究[J]. 食品科技,2021,46(10):194−199. [YANG Aihua, SONG Shanshan, WANG Weiwei. Antioxidant activity and stability of polysaccharides from Meitan white tea[J]. Food Science and Technology,2021,46(10):194−199.] YANG Aihua, SONG Shanshan, WANG Weiwei . Antioxidant activity and stability of polysaccharides from Meitan white tea[J]. Food Science and Technology,2021 ,46 (10 ):194 −199 .





 下载:
下载:




 下载:
下载:
