Optimization of Cellulase-Assisted Ultrasound Extraction and Antioxidant Analysis of Flavonoids from Syringa oblata Leaves
-
摘要: 为研究丁香叶中总黄酮的高效提取方法,本文首次采用纤维素酶辅助超声法对4种丁香叶中的总黄酮进行提取。以总黄酮提取得率为指标,单因素实验分析纤维素酶用量、pH、超声时间、超声功率、液料比、温度、乙醇体积分数对小叶丁香叶总黄酮提取得率的影响,应用响应面法优化,得到最优提取工艺,并通过体外抗氧化检测丁香叶总黄酮对DPPH自由基和OH自由基的清除能力。结果表明,最优提取工艺为加酶量2%,pH5.5,超声时间40 min,超声功率400 W,乙醇体积分数63%,温度56 ℃,液料比30:1(mL/g),在该条件下,小叶丁香叶总黄酮提取得率为32.21±0.16 mg/g,与回归模型的预测值32.57 mg/g接近。抗氧化活性结果表明,4种丁香叶总黄酮对DPPH自由基的清除能力为小叶丁香>暴马丁香>白丁香>紫丁香;对OH自由基的清除能力为小叶丁香>暴马丁香>紫丁香>白丁香。纤维素酶辅助超声法能高效提取丁香叶中的总黄酮,且丁香叶总黄酮具有较好的抗氧化性,具有一定的开发潜力。
-
关键词:
- 丁香叶 /
- 纤维素酶辅助超声提取 /
- 总黄酮 /
- 响应面法 /
- 抗氧化性
Abstract: To investigate the efficient method of total flavonoids from Syringa oblata leaves, this paper firstly used cellulase-assisted ultrasound method to extract flavonoids from four Syringa oblata leaves. The effects of cellulase dosage, pH, ultrasound time, ultrasound power, liquid-material ratio, temperature and ethanol volume fraction on the extraction rate of total flavonoids from Syringa pubescens Turcz. leaves were analyzed by single-factor experiments, and the best extraction process was obtained by applying response surface methodology optimization. The scavenging ability of Syringa oblata leaves flavonoids on DPPH and OH radicals was also examined in vitro as an antioxidant. The results showed that, the optimum extraction process was enzyme addition 2%, pH5.5, sonication time 40 min, sonication power 400 W, ethanol volume fraction 63%, temperature 56 ℃, liquid to material ratio 30:1 (mL/g), and under these conditions, the Syringa oblata flavonoids content was 32.21±0.16 mg/g, which was in proximity to the predicted value of 32.57 mg/g from the regression model. The results of antioxidant activity showed that the scavenging ability of the four Syringa oblata leaf flavonoids on DPPH was Syringa pubescens Turcz.>Syringa reticulata var. mamds huricq.>Syringa oblata var. affinis lingdelsh.>Syringa oblata Linal. The scavenging ability on OH was Syringa pubescens Turcz.>Syringa reticulata var. mamds huricq.> Syringa oblata Linal.>Syringa oblata var. affinis lingdelsh. The cellulase-assisted ultrasonication method can efficiently extract flavonoids from Syringa oblata leaves, and the flavonoids of Syringa oblata leaves have good antioxidant properties and have certain potential for development. -
丁香叶(Syringa oblata leaves)是木犀科(Oleaceae)丁香属(Syringa)植物的干燥叶。木犀科丁香属植物全属有40多种,中国有20余种,广泛分布于我国的东北、华北、西南及西北地区,资源丰富,是街道及庭院绿化的重要树种。现代研究表明,丁香叶具有抗菌消炎[1]、保肝利胆[2−3]、抗氧化[4]、抗病毒[1]等功效,民间常用丁香叶的水煎液用于止泻,预防菌痢。现丁香叶已载入黑龙江省药品标准[4],以丁香叶为原料生产的药对于治疗痢疾、急性黄疽性肝炎都有很好的效果。目前为止,已经从丁香叶中分离出近100种有效成分,这些成分多以总黄酮类、有机酸类、苷类、挥发油类等形式存在[5]。研究显示,总黄酮具有抗氧化[6]、抗疲劳[7]、抗衰老[8]、抗癌[9]、抗菌[10]、抗病毒[11]等多种药理活性,受到广大学者的关注,开发应用前景较广,因此对丁香叶中总黄酮的提取具有重要意义。
近年来,从绿色植物中提取分离总黄酮类物质的研究受到广大学者的关注,常用的总黄酮提取方法有索式提取法(Soxhlet Extraction,SE)、酶解法(Enzymatic hydrolysis,EH)和超声提取法(Ultrasonic Extraction,UE)等。索式提取法有用时长、有机溶剂消耗大等缺点[12]。酶解法的优点是反应条件温和,对设备要求简单,但具有反应速度慢,酶成本高的缺点。超声提取法是利用超声波的空化效应,使植物细胞壁受到强大压力而瞬间破裂,有利于细胞内物质的快速溶出[13]。酶辅助超声提取法(Enzyme-assisted ultrasonic extraction,EAUE)结合了超声提取和酶解法的优点,具有耗时短、效率高、能保持提取物活性等优势,该方法已被广泛使用于活性物质的提取[13]。何静等[14]研究表明酶辅助超声提取技术对驼皮源胶原蛋白的降解较传统酶解法和超声提取法其降解程度更高,且能获得一种抑制ACE(一种含锌离子的二肽羧基酶)的生物活性多肽。李栋等[15]运用酶辅助超声提取技术对红枣中的多糖进行提取且进行遗传算法优化,结果显示红枣多糖的得率为7.68%±0.01%,该研究为红枣多糖的提取提供了一种绿色高效的方法。
本研究通过单因素和响应面法对小叶丁香叶中总黄酮的最优提取工艺进行研究,并在最佳提取工艺条件下对紫丁香、白丁香、暴马丁香、小叶丁香四个品种中总黄酮的提取得率进行比较,同时分别对其总黄酮的粗提物进行抗氧化性研究,为进一步探索丁香叶总黄酮提取工艺、研究不同品种丁香叶的药理功能提供一定理论依据。
1. 材料与方法
1.1 材料和仪器
丁香叶 采自东北林业大学校园,由东北林业大学杨逢建教授鉴定为木犀科丁香属植物,新鲜叶片自然风干,粉碎过筛备用;芦丁标准品(HPLC级,纯度≥98%)、1,1-二苯基-2-三硝基苯肼(DPPH) 上海源叶科技有限公司;无水乙醇 天津市致远化学试剂有限公司;纤维素酶(10000 U/g) 上海麦克林生化科技有限公司;纯净水 杭州娃哈哈集团有限公司;抗坏血酸 天津市瑞金特化学品有限公司。
LG-04型微型中药粉碎机 瑞安市百信制药机械有限公司;Neo15型离心机 上海力申科学仪器有限公司;UH620H型分析天平 日本岛津公司;KQ-500DM-22.5型超声波清洗仪 昆山市超声仪器有限公司;UV-2600型紫外可见分光光度计 日本岛津公司。
1.2 实验方法
1.2.1 实验材料的筛选
精确称量小叶丁香、暴马丁香、紫丁香、白丁香粗粉各0.50 g于50 mL离心管中,按照所需液料比加入一定体积分数的乙醇溶液,用磷酸缓冲溶液调节溶液pH,加入纤维素酶。摇匀后,按照超声频率40 kHz,功率300 W,超声温度50 ℃,提取40 min,离心后取上清液,测定不同种丁香叶的总黄酮含量,筛选出总黄酮含量较高的丁香叶种类。
1.2.2 丁香叶黄酮提取工艺比较
1.2.2.1 超声提取法
参考李菁等[16]实验方法稍作修改,准确称定小叶丁香叶粗粉0.50 g,提取剂为65%乙醇,液料比30:1 (mL/g),在超声温度50 ℃,超声功率400 W的条件下,提取40 min,离心后取上清液。即得超声提取法下样品溶液。
1.2.2.2 酶解法
参考张小梅等[17]方法稍作修改,准确称定小叶丁香叶粗粉0.50 g,水为提取剂,液料比30:1 (mL/g),调节pH为5,加入质量分数为2%的纤维素酶,温度50 ℃下提取40 min,离心后取上清液。即得酶解法下样品溶液。
1.2.2.3 酶辅助超声提取法
精确称量0.50 g小叶丁香粗粉于50 mL离心管中,按照液料比30:1加入质量分数为65%的乙醇溶液,用磷酸缓冲溶液调节溶液pH为5,加入纤维素酶。摇匀后,按照超声频率40 kHz,功率300 W,超声温度50 ℃,提取40 min,离心后取上清液,即得总黄酮粗提液。
1.2.3 丁香叶中总黄酮得率的测定
精密称定5.70 mg芦丁,置于烧杯中,加入乙醇,超声溶解并定容至10 mL,摇匀即得0.57 mg/mL芦丁标准品溶液。
参考杨观兰等[18]的方法稍作修改,精密吸取上述对照品溶液0.2、0.4、0.6、0.8、1.0、1.2 mL,置于10 mL容量瓶中,加入水至2 mL,加入0.6 mL 5%亚硝酸钠,摇匀静置6 min再加入0.6 mL 10%硝酸铝,摇匀静置6 min,最后加入3 mL 4%氢氧化钠,加水至刻度,摇匀后放置15 min。以相应试剂为空白对照,在最大吸收波长510 nm处测吸光值。以芦丁的质量浓度(mg/mL)为横坐标,吸光值为纵坐标,绘制标准曲线,得回归方程:y=22.5x−0.004,R2=0.997。
取2 mL小叶丁香总黄酮提取液于10 mL容量瓶中按上述方法测定吸光值。总黄酮提取得率按式(1)计算:
总黄酮提取得率(mg/g)=C×V×Nm (1) 式中,C为丁香叶总黄酮的浓度,mg/g;V为提取液体积,mL;m为丁香叶的质量,g;N为稀释倍数。
1.2.4 单因素实验
准确称定小叶丁香叶粗粉0.50 g,置于50 mL离心管中,以65%乙醇为提取剂,按30:1 mL/g液料比,调节pH为5后,加入质量分数为1%纤维素酶,在50 ℃和超声功率300 W的条件下提取40 min。离心后取上清液,测定上清液中总黄酮提取得率。分别考察纤维素酶用量为0%、1%、1.5%、2%和2.5%;液料比为10:1、20:1、30:1、40:1和50:1 (mL/g);乙醇体积分数为45%、55%、65%、75%和85%;超声功率为100、200、300、400和500 W;超声时间为20、30、40、50和60 min;pH为4、4.5、5、5.5和6;温度为20、30、40、50、60和70 ℃时对小叶丁香叶总黄酮提取得率的影响。
1.2.5 响应面法优化提取工艺
根据单因素实验的结果,超声功率、温度及乙醇体积分数对小叶丁香叶总黄酮提取得率影响较大,故超声功率(A)、温度(B)和乙醇体积分数(C)为自变量以丁香叶总黄酮提取得率为响应值,设计三因素三水平的Box-Beheken Design试验,试验因素与水平如表1所示。
表 1 响应面试验因素水平设计Table 1. Box-Beheken design水平 因素 A超声功率 (W) B温度 (℃) C乙醇体积分数 (%) −1 300 40 55 0 400 50 65 1 500 60 75 1.2.6 丁香叶总黄酮体外抗氧化活性的研究
在最佳提取工艺条件下提取丁香叶总黄酮,旋转蒸发提取液至无醇味,即得丁香叶总黄酮粗提液,以DPPH自由基和OH自由基清除率为指标测定粗提液的体外抗氧化实验。并通过IC50值对自由基清除率进行判断。
1.2.6.1 丁香叶黄酮对DPPH自由基的清除率
参考傅贤明等[19]的方法稍作修改,将小叶丁香叶总黄酮粗提液配成浓度为1、0.75、0.5、0.25和0.125 mg/mL的提取液。A组:各取1 mL提取液,再分别加入0.04 mg/mL的DPPH自由基溶液2 mL,B组:各取1 mL提取液,再分别加入无水乙醇溶液2 mL,A0:取1 mL蒸馏水,再加入0.04 mg/mL的DPPH自由基溶液2 mL。A组、B组、A0均避光反应30 min后,在517 nm处测定吸光值Ax、Bx、A0,平行3次,计算清除率。DPPH自由基溶液现配现用。以VC为阳性对照。DPPH自由基清除率计算如下:
DPPH自由基清除率(%)=[1−(Ax−Bx)A0]×100 1.2.6.2 丁香叶黄酮对OH自由基的清除
参考付依依等[20]的方法稍作修改,将小叶丁香叶总黄酮粗提液配成浓度为1、0.75、0.5、0.25、0.125 mg/mL的提取液。A组:各取1 mL提取液,再分别加入1.5 mmol/L的FeSO4·7H2O溶液2 mL和3 mmol/L的水杨酸-乙醇溶液1 mL,再加入0.1% H2O2溶液1 mL启动反应。B组:各取1 mL提取液,再分别加入1.5 mmol/L的FeSO4·7H2O溶液2 mL和3 mmol/L的水杨酸-乙醇溶液1 mL,再加入蒸馏水1 mL启动反应。A0:取1 mL蒸馏水,加入1.5 mmol/L的FeSO4·7H2O溶液2 mL和3 mmol/L的水杨酸-乙醇溶液1 mL,再加入1 ml 0.1% H2O2 mL反应。A组、B组、A0均在37 ℃恒温水浴30 min后,在510 nm处测定吸光值Ax、Bx、A0,平行3次,计算清除率,以VC为阳性对照。OH自由基清除率计算如下:
OH自由基清除率(%)=[1−(Ax−Bx)A0]×100 1.3 数据处理
所有实验均重复平行3次,数据的表现形式均为算术平均值±标准差。实验数据的处理与统计软件为Origin 2023和Design Expert 13 Trial。用软件SPSS Statistics 26进行方差分析,P<0.01表示差异性极显著,P<0.05表示差异性显著。
2. 结果与分析
2.1 原料样品的筛选
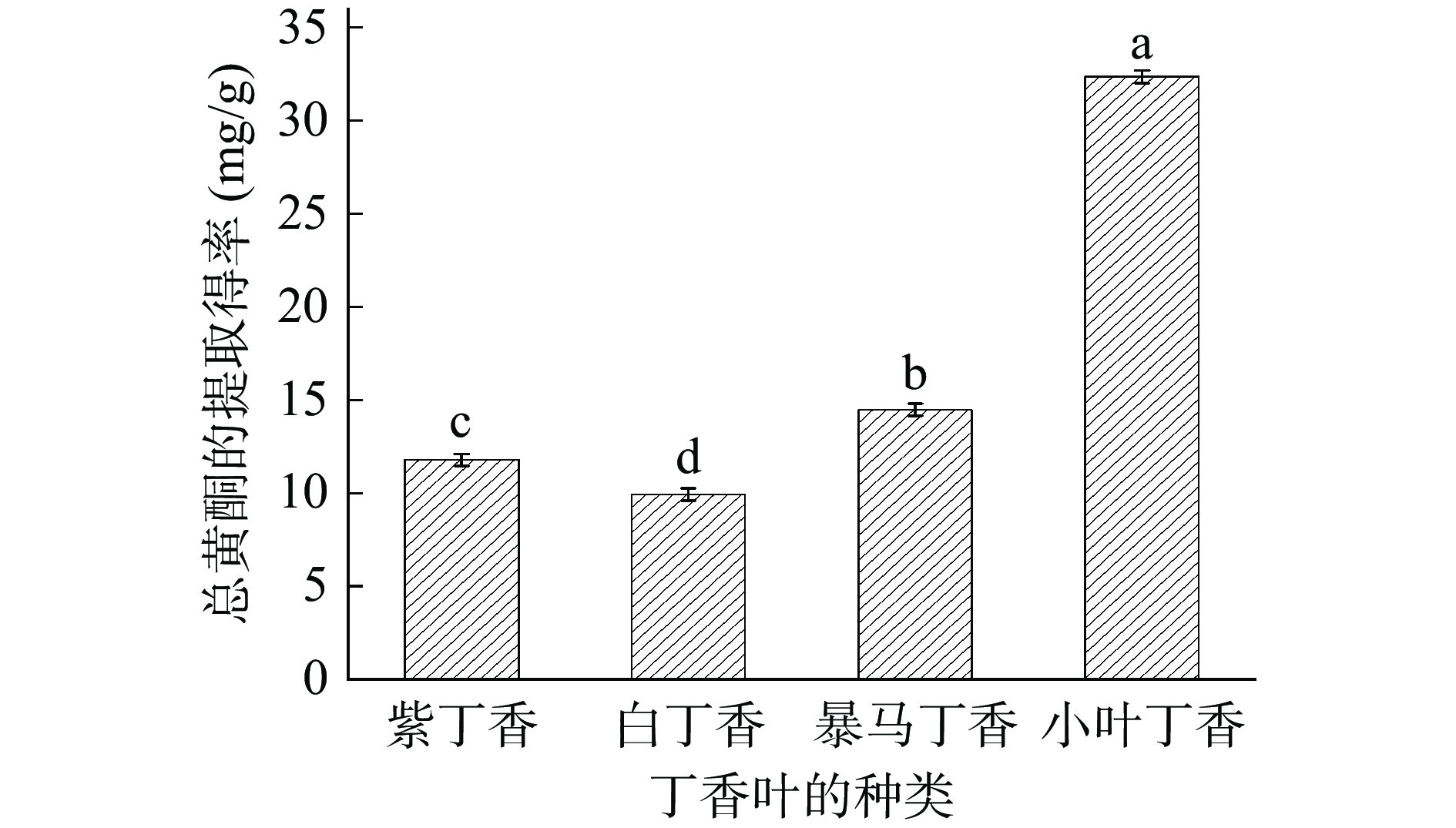
为筛选出总黄酮提取得率最高的丁香叶原材料,测定了小叶丁香、暴马丁香、紫丁香和白丁香4种丁香叶总黄酮的提取得率,结果见图1。4种丁香叶总黄酮提取得率存在显著差异(P<0.05)。小叶丁香叶总黄酮提取得率显著高于其他三种(P<0.05),白丁香叶的总黄酮提取得率最少。总黄酮提取得率由高到低依次为小叶丁香>暴马丁香>紫丁香>白丁香。故后续试验选择小叶丁香叶为实验材料。
2.2 不同提取工艺比较
为筛选出小叶丁香叶总黄酮最佳提取工艺,探究了超声提取法、酶解法、酶辅助超声提取法3种工艺对小叶丁香叶总黄酮提取得率的影响,结果见表2。酶辅助超声提取法提取的丁香叶总黄酮提取得率高于超声提取和酶解法提取,具有高效、节省时间的优点。穆易君[21]运用酶辅助超声提取法、酶解法和超声提取法对菠菜叶的黄酮进行提取,结果显示酶辅助超声提取法的最佳提取率为15.56%,纤维素酶提法的最佳提取率为14.10%,超声提取法的最佳提取率为13.05%,说明酶辅助超声提取法较其它两种方法有提取效率高的优点,该方法结合了酶的专一性、反应条件温和及超声提取的时间短、高效性等特点,具有较好的应用前景,为其他活性物质的提取提供参考。
表 2 不同提取方法总黄酮提取得率比较Table 2. Comparison of flavonoids content in different extraction methods提取方法 乙醇体积分数 (%) 液料比 (mL/g) 时间 (min) 总黄酮提取得率 (mg/g) 酶辅助超声提取法 65 30:1 40 31.97±0.38a 酶解法 0 30:1 40 22.68±1.21c 超声提取法 65 30:1 40 28.60±0.87b 2.3 单因素实验结果
2.3.1 纤维素酶的添加量对小叶丁香叶总黄酮提取得率的影响
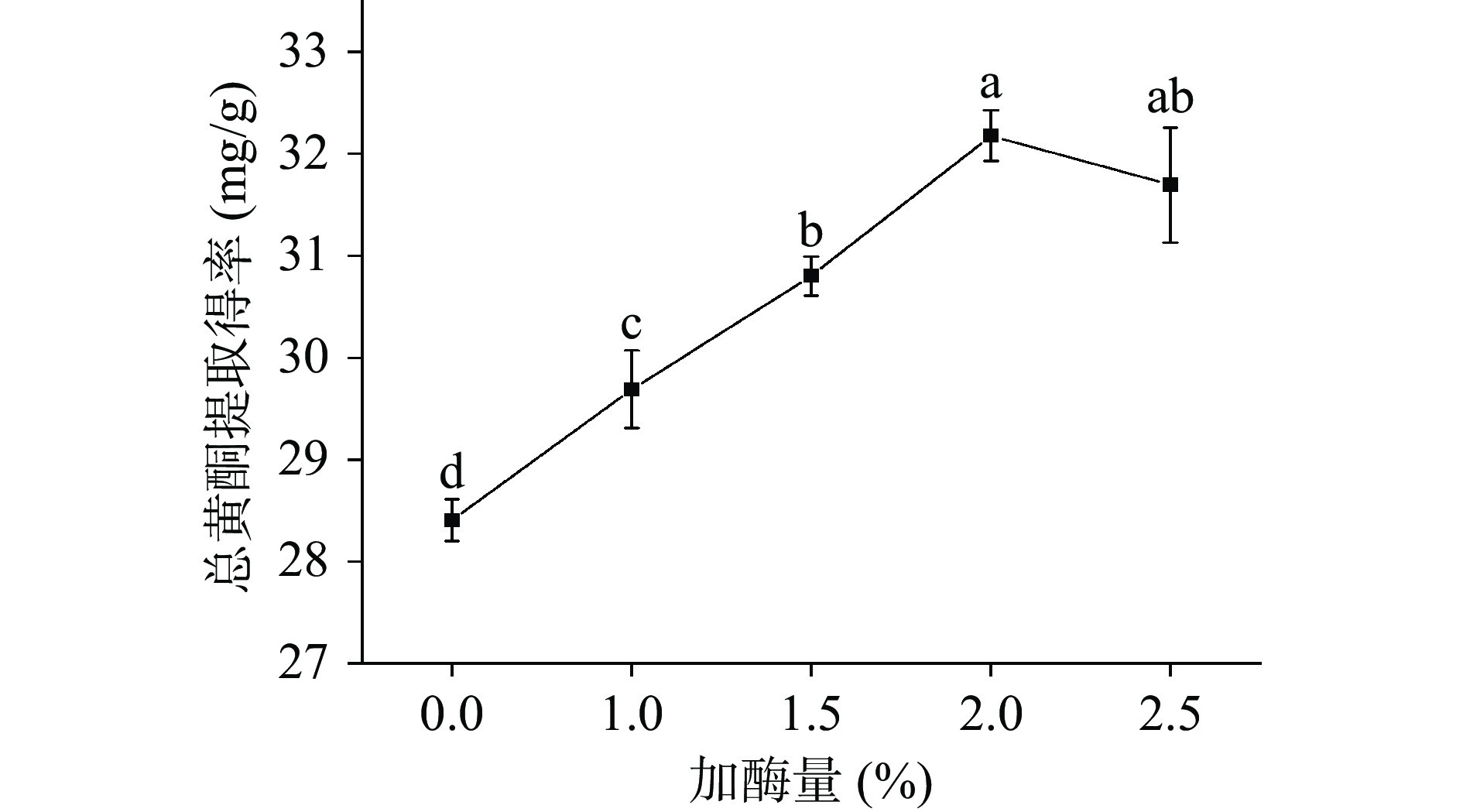
图2是纤维素酶的添加量对丁香叶总黄酮提取得率的影响。纤维素酶可以较好地作用于丁香叶的细胞壁并使其分解,使溶剂与丁香叶细胞内物质相互作用,有利于丁香叶总黄酮的提取[22]。当酶添加量为2%以下时,小叶丁香叶总黄酮的提取得率随加酶量的增加而显著提高(P<0.05),当酶添加量超过2%时,总黄酮的提取得率下降,差异性不显著(P>0.05)。这是因为随着酶的添加量的增加,酶对小叶丁香叶细胞壁的破坏能力增强,使小叶丁香叶总黄酮溶出增加,酶含量继续增加使得细胞壁的多糖降解物和纤维素等物质大量存在,影响超声的空化作用和小叶丁香叶总黄酮的溶出[23],使小叶丁香叶总黄酮提取得率降低。当其添加量为2%时,丁香叶总黄酮的提取得率最高,故选择纤维素酶的添加量为2%作为最优加酶量。
2.3.2 液料比对小叶丁香叶总黄酮提取得率的影响
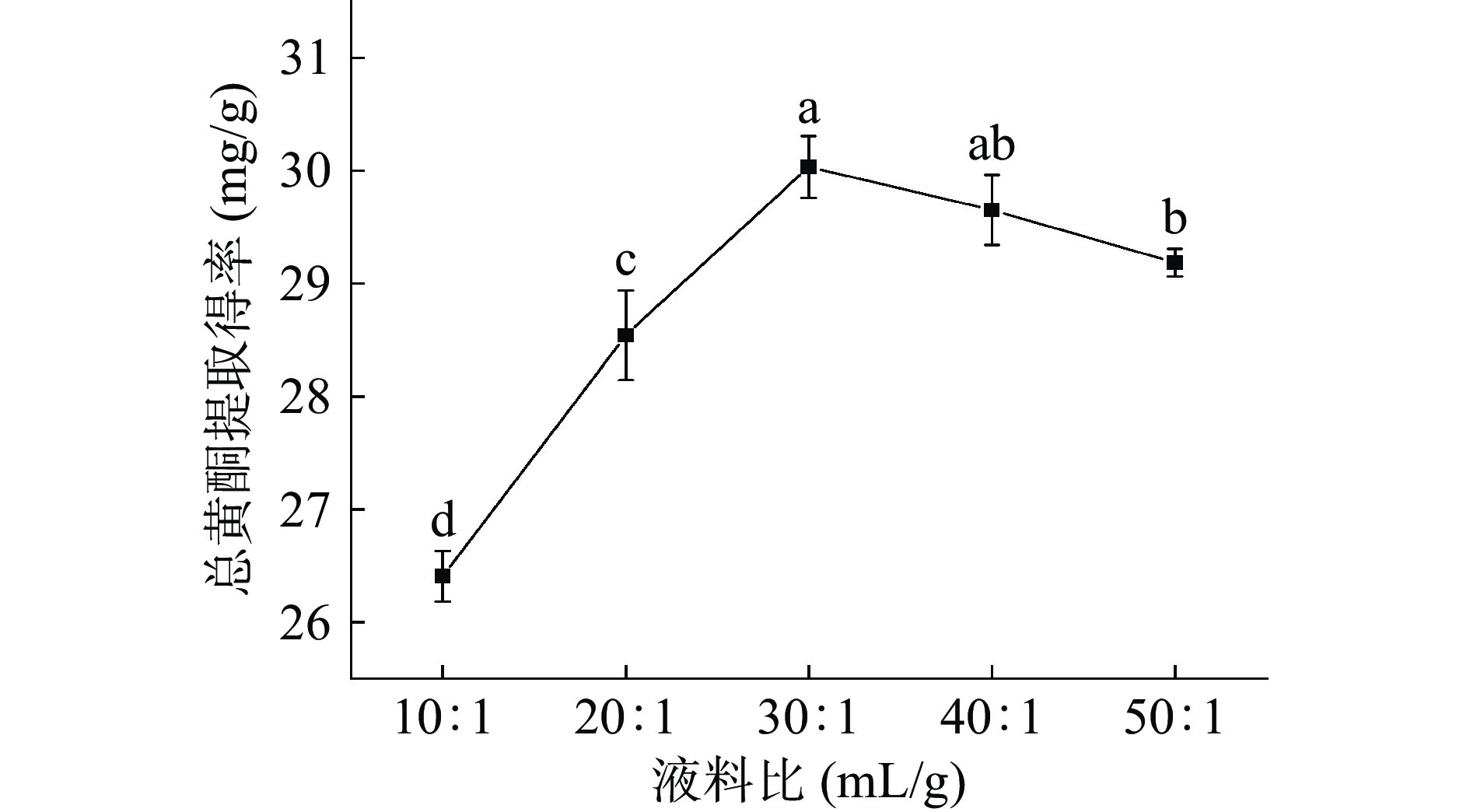
图3是不同液料比对总黄酮提取得率的影响。当液料比30:1 (mL/g) 时小叶丁香叶总黄酮的提取得率最高,在液料比10:1~30:1 (mL/g)之间,随着液料比的增大,小叶丁香叶总黄酮提取得率显著提高(P<0.05),继续增大液料比,总黄酮提取得率逐渐降低且差异性不显著(P>0.05)。因此在一定范围内,增大液料比使得丁香叶粗粉与提取溶剂的接触率增大,使小叶丁香叶总黄酮更易溶出[22];当液料比高于30:1 (mL/g)后,超声波的空化作用受到一定阻碍,可能会伴随着杂质的溶出[23],降低丁香叶中总黄酮的提取得率,而且造成有机溶剂的浪费以及增加后续纯化工业的成本[23]。故选择液料比为30:1 (mL/g)进行试验。
2.3.3 乙醇体积分数对小叶丁香叶总黄酮提取得率的影响
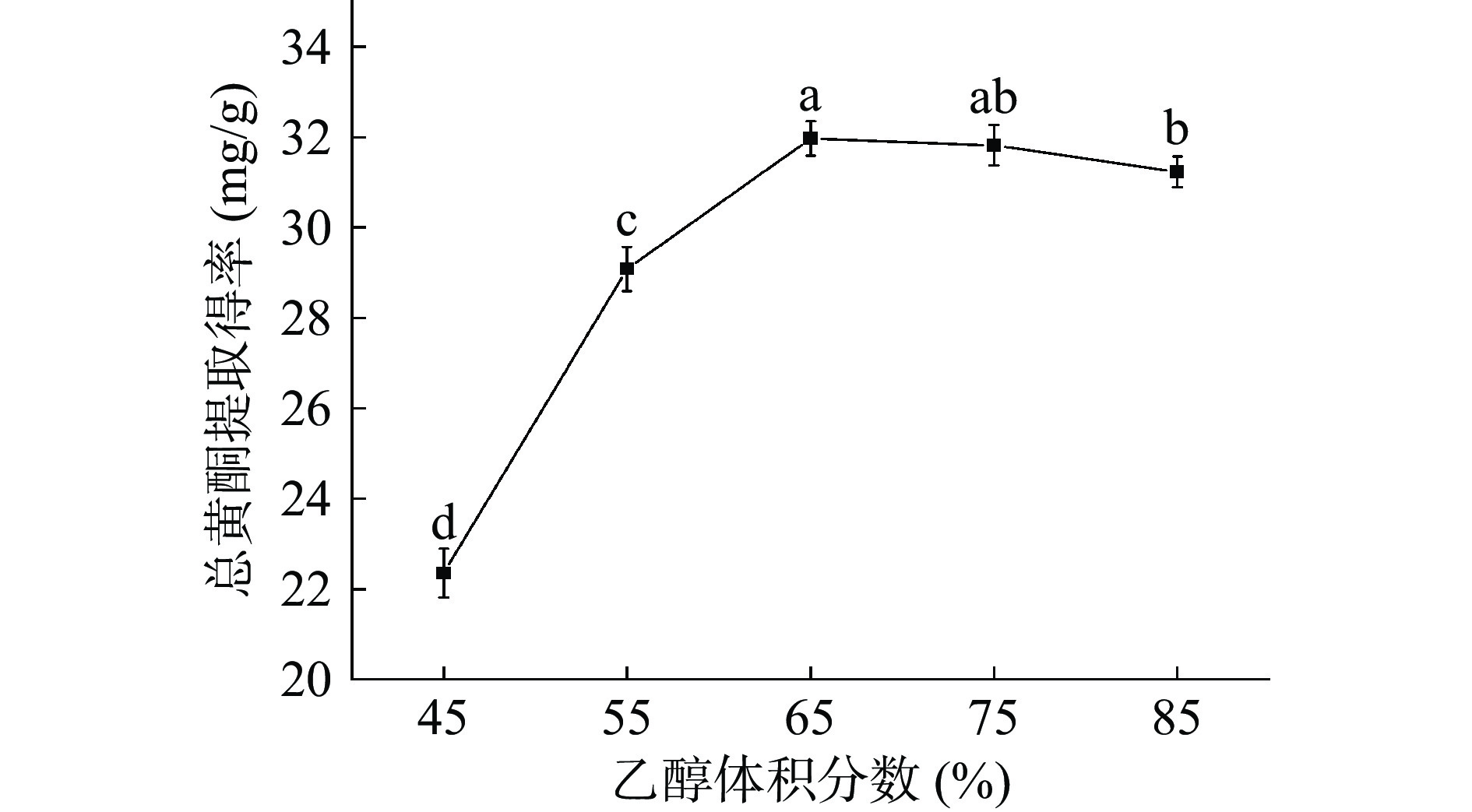
图4是不同乙醇体积分数对总黄酮提取得率的影响。当乙醇体积分数小于65%时,小叶丁香叶总黄酮提取得率随乙醇体积分数的增加而显著提高(P<0.05),继续增大乙醇体积分数,小叶丁香叶总黄酮提取得率随乙醇体积分数的增加而逐渐降低,且差异性不显著(P>0.05)。这说明体积分数较高的乙醇溶液不利于目标化合物的溶出,65%乙醇极性与小叶丁香叶总黄酮的极性接近,小叶丁香叶总黄酮最大程度地溶出[24]。当体积分数高于65%时,极性差异增大,引起小叶丁香叶中其他醇溶性物质的溶出,使总黄酮得率下降[17]。由于乙醇体积分数对总黄酮提取得率的影响较大,故选择体积分数为55%~75%的乙醇进行后续试验的优化。
2.3.4 超声功率对小叶丁香叶总黄酮提取得率的影响
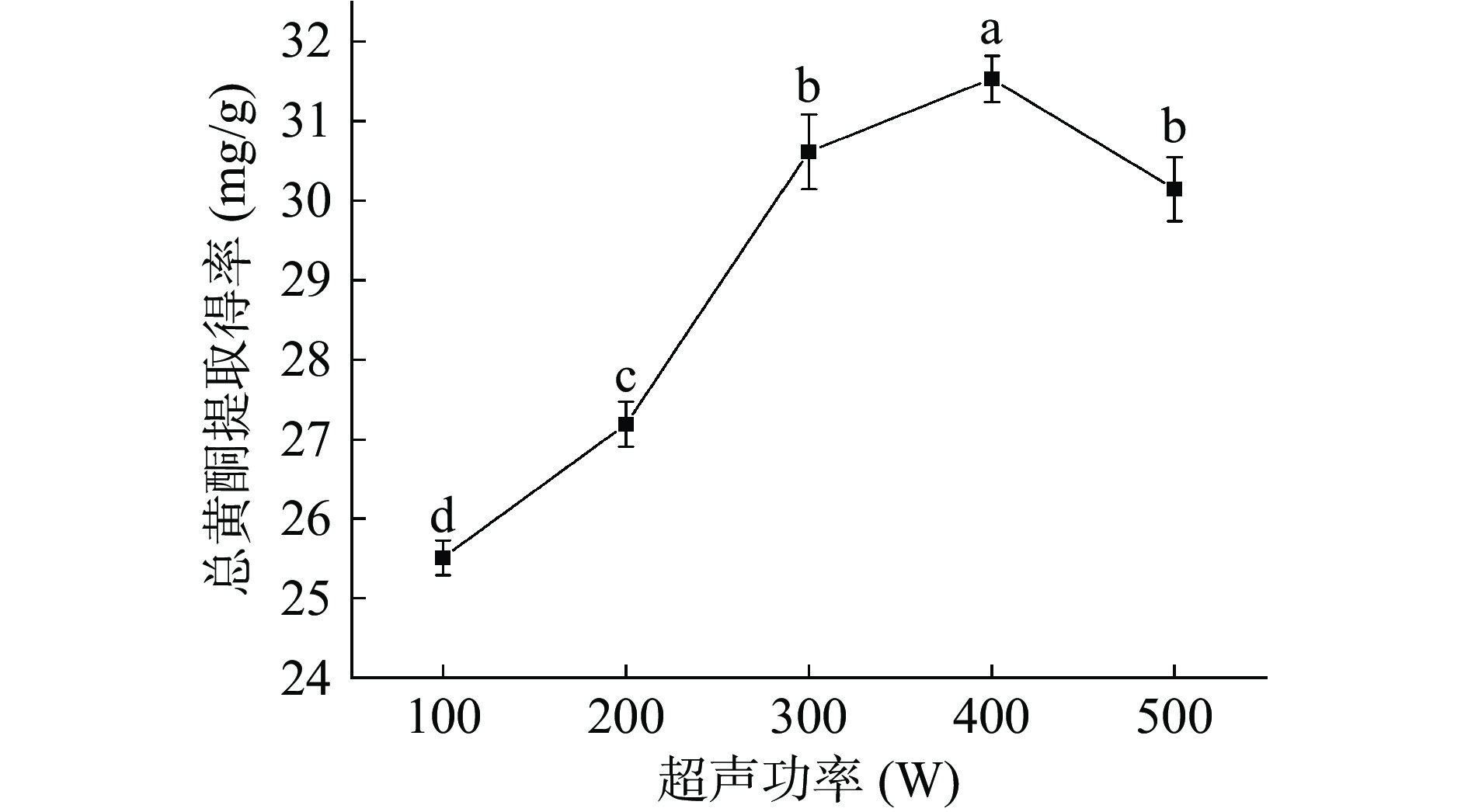
图5是不同超声功率对小叶丁香叶总黄酮提取得率的影响。小叶丁香叶总黄酮的提取得率随超声功率的增大而提高,当超声功率达400 W时,提取得率最大,继续增加超声功率,小叶丁香叶总黄酮提取得率开始下降,均表现出显著差异性(P<0.05)。说明超声作用促进植物细胞壁的破裂,促进了小叶丁香叶总黄酮的溶出,超声功率过高可能使小叶丁香叶总黄酮结构遭到破坏,其他活性物质进一步溶出,进而使小叶丁香叶总黄酮提取得率降低[25]。故后续选择300~500 W的超声功率进行优化试验。
2.3.5 超声时间对小叶丁香叶总黄酮提取得率的影响
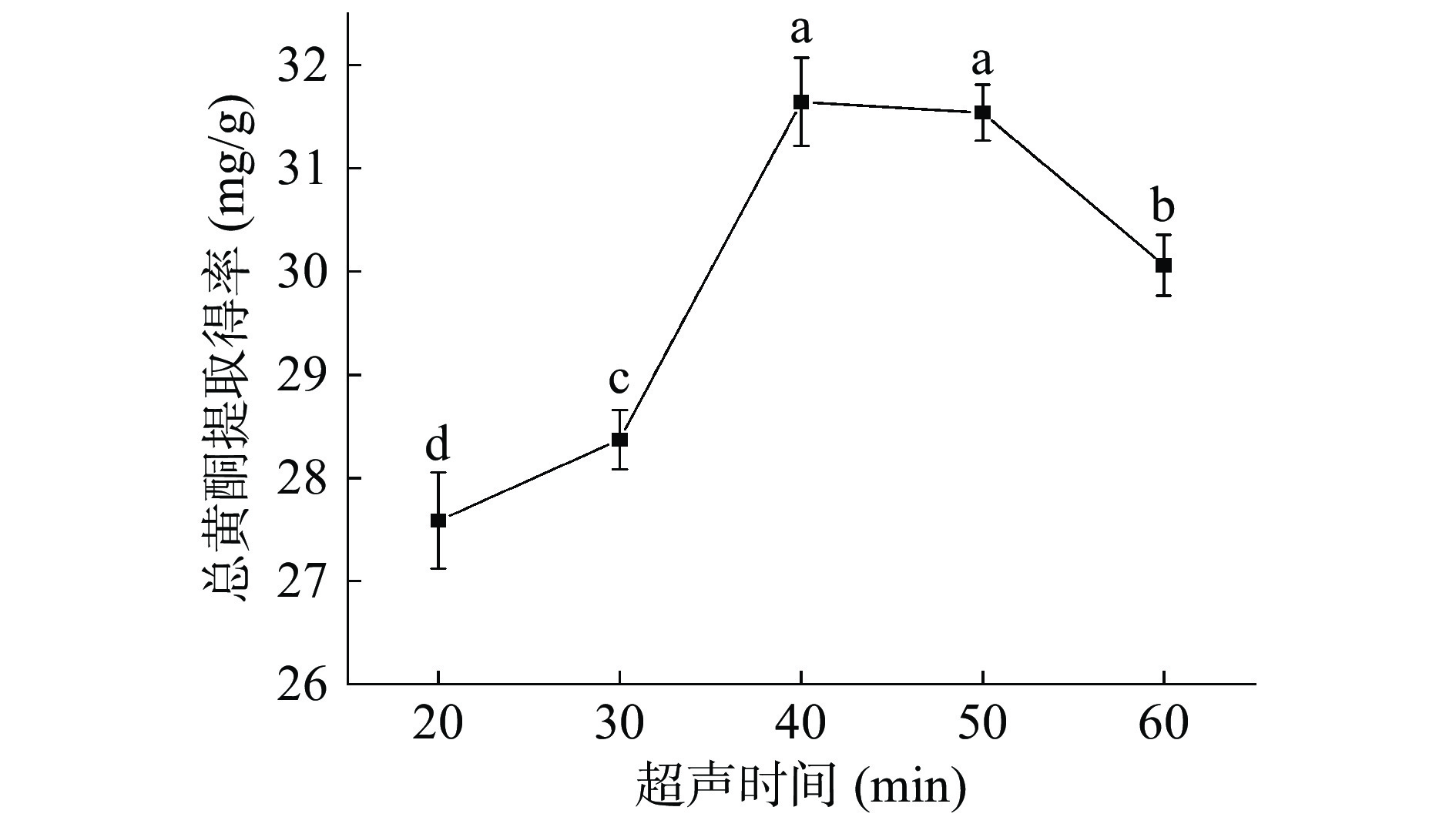
图6是不同超声时间对小叶丁香叶总黄酮提取得率的影响。小叶丁香叶总黄酮的提取得率随时间的增加而提高。随着超声时间的增加,细胞壁破碎程度逐渐增加,使小叶丁香叶总黄酮溶出增加。当超声时间小于40 min时,总黄酮提取得率随超声功率的增大显著增大(P<0.05),超声时间超过40 min后随着时间延长提取得率下降,且差异性不显著(P>0.05)。这是由于提取时间延长,超声效应增强,可能伴随着其他杂质的溶出,且随着超声时间的增加,溶液温度可能会上升,影响到黄酮的稳定性,使总黄酮提取得率下降[26]。故选择超声时间为40 min进行后续的试验。
2.3.6 pH对小叶丁香叶总黄酮提取得率的影响
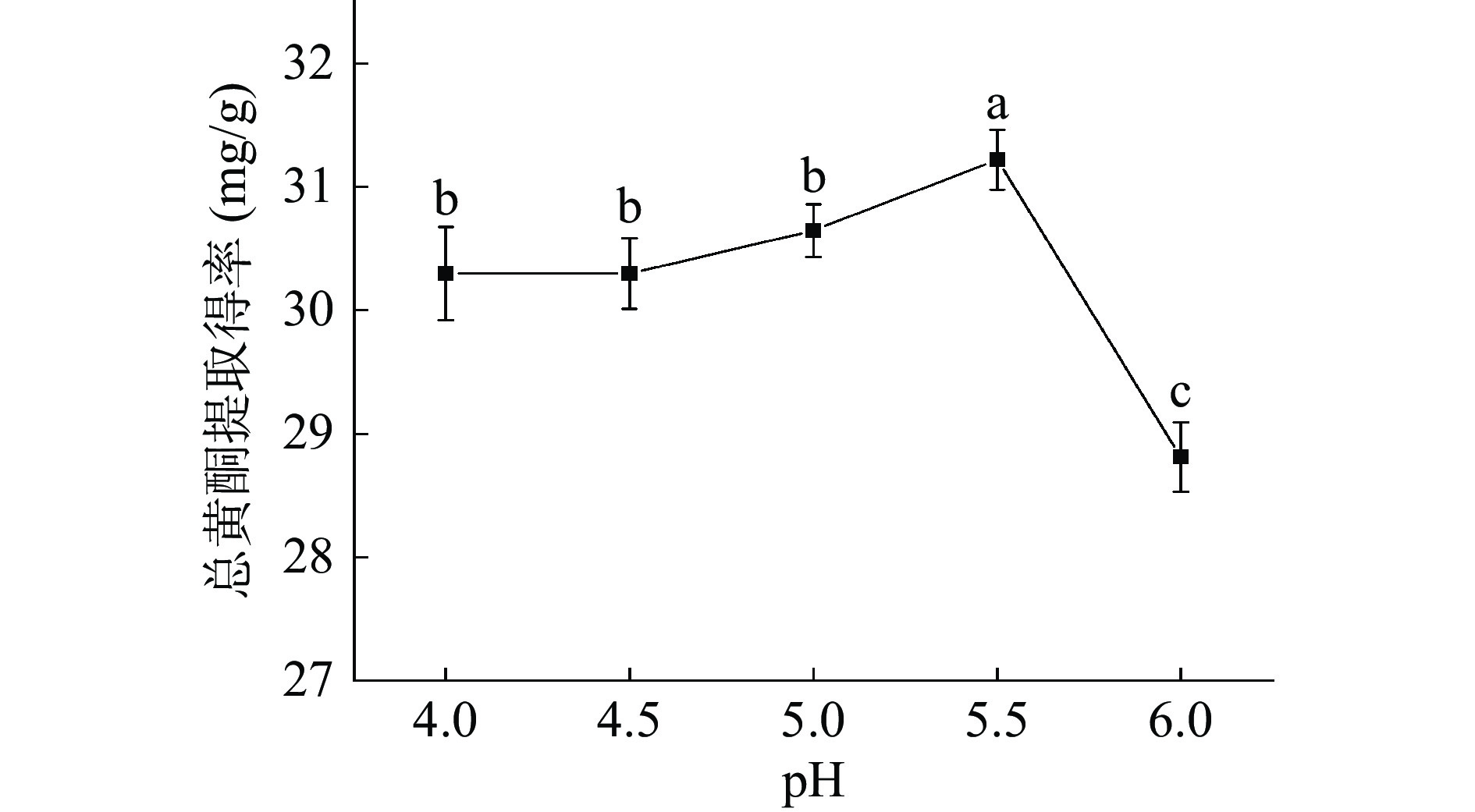
图7是不同pH对小叶丁香叶总黄酮提取得率的影响。pH在4.0~5.0范围内时,小叶丁香叶总黄酮的提取得率的差异性不显著(P>0.05),pH达到5.5时,提取得率达到最大。纤维素酶的活性随着pH的增大而增强,进而对细胞壁的破坏程度增加,使总黄酮类物质更快地溶出,总黄酮提取得率增加[26]。当pH大于5.5时,纤维素酶的结构可能会发生变化进而影响酶的稳定性,降低了酶的活性,使酶对植物细胞壁的破坏能力降低,细胞内的总黄酮不能充分溶出,使得小叶丁香叶总黄酮提取得率下降。故选择5.5为最适pH。
2.3.7 温度对小叶丁香叶总黄酮提取得率的影响
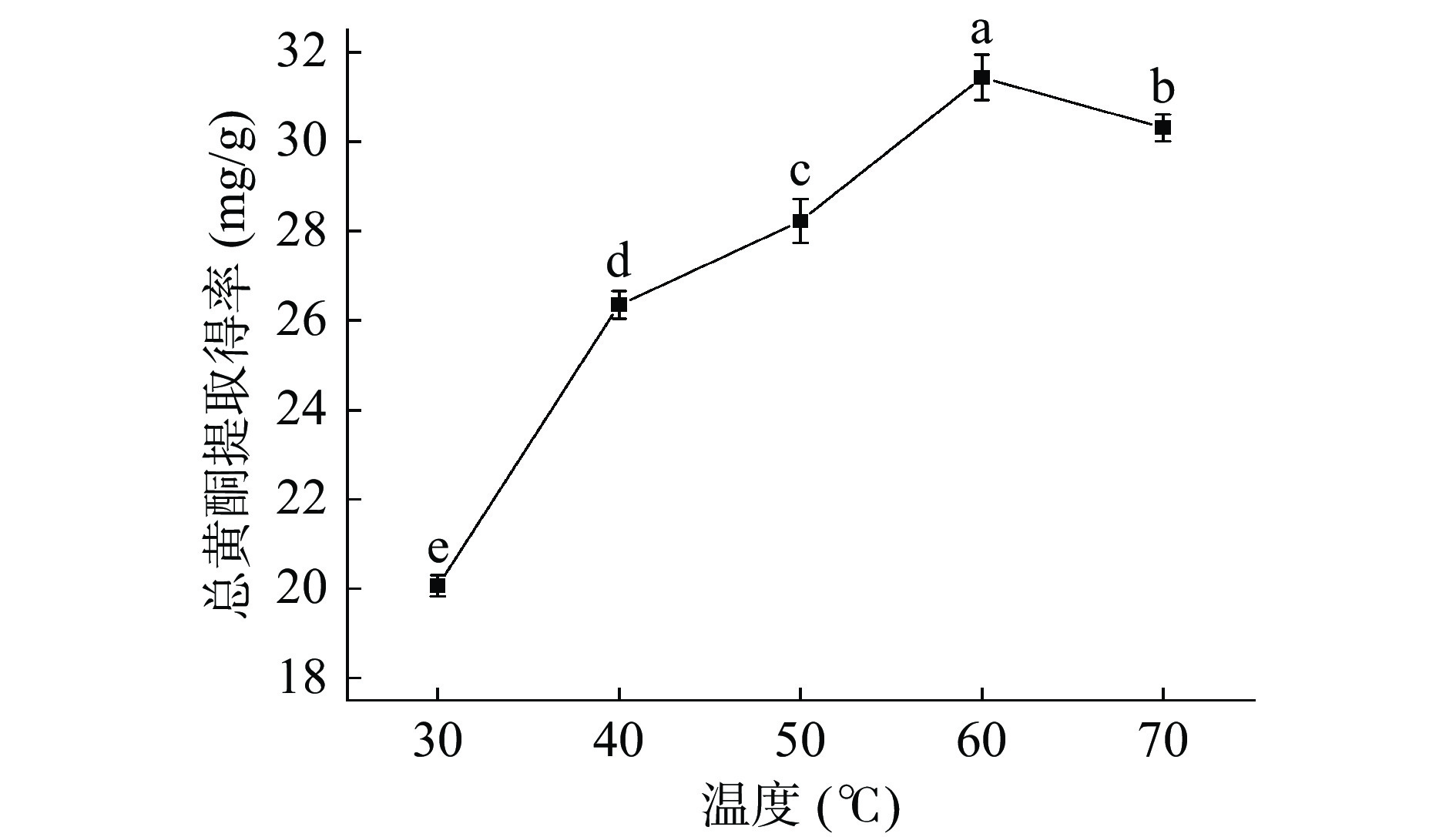
图8是不同温度对总黄酮提取得率的影响。温度在30~60 ℃范围内时,丁香叶总黄酮的提取得率随温度的升高而显著增大(P<0.05),当温度达到60 ℃时,提取得率达到最大,温度超过60 ℃提取得率逐渐下降。随着温度升高,分子的热运动加速,使总黄酮更容易浸出。但温度继续升高导致纤维素酶活性降低,酶对细胞壁的破坏程度减小,使总黄酮类化合物溶出速度减慢,且温度升高可能使黄酮结构遭到破坏,提取得率降低[26]。选择50~70 ℃的温度范围进行后续的优化试验。
2.4 响应面优化试验结果
2.4.1 响应面模型的建立与显著性检验
响应面优化结果显示见表3~表4,模型的预测系数R2为0.8623,调整决定系数R2为0.9672,说明本模型有较高的拟合度。变异系数(CV)小于2%,说明实验具有一定的稳定性,不是偶然发生的[27]。后续的实验结果可用本模型和方程进行分析与预测,可用于优化丁香叶总黄酮类化合物的提取工艺。
表 3 中心组合优化方案及结果Table 3. Scheme and results of central combinatorial optimization实验号 A超声功率 B温度 C乙醇体积分数 总黄酮提取得率(mg/g) 1 0 0 0 31.64±0.13 2 −1 0 1 25.91±0.08 3 0 1 1 30.71±0.08 4 −1 1 0 31.36±0.16 5 0 0 0 31.52±0.25 6 −1 0 −1 28.82±0.06 7 0 1 −1 30.61±0.03 8 1 1 1 27.56±0.25 9 1 0 1 26.06±0.04 10 0 −1 −1 28.22±0.17 11 1 −1 0 27.84±0.31 12 0 0 0 32.28±0.06 13 0 −1 1 25.14±0.16 14 1 0 0 32.29±0.08 15 −1 −1 0 25.68±0.53 16 0 0 0 32.44±0.03 17 1 0 −1 26.78±0.14 表 4 响应面拟合回归方程方差分析结果Table 4. Response surface fitted regression equation analysis of variance results来源 自由度 平方和 均方 F值 P值 模型 9 109.16 12.13 53.38 <0.0001** A 1 1.56 1.56 6.87 0.0344* B 1 22.25 22.25 97.94 <0.0001** C 1 5.47 5.47 24.06 0.0017* AB 1 8.90 8.90 39.17 0.0004** AC 1 1.20 1.20 5.27 0.0553 BC 1 2.52 2.52 11.10 0.0126* A2 1 34.29 34.29 150.89 <0.0001** B2 1 4.85 4.85 21.36 0.0024* C2 1 22.09 22.09 97.20 <0.0001** 残差 7 1.59 0.2272 失拟项 3 0.8843 0.2948 1.67 0.3093 总离差 4 0.7062 0.1766 合计 16 110.75 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 运用 Design Expert 13 Trial 软件对响应面试验结果进行拟合,得到总黄酮提取得率 (Y) 对超声功率(A)、温度(B) 和乙醇体积分数(C)的回归方程为:
Y=32.04−0.4417A+1.67B−0.8267C−1.49AB+0.5472AC+0.7939BC−2.85A2−1.07B2−2.29C2
由表4可知,P<0.01,表明模型差异极显著,该模型具有统计学意义。失拟项的P值为0.3093>0.05,表明差异性不显著,说明该模型能科学的对丁香叶总黄酮提取得率进行预测,可对实验结果进一步分析。
模型AB的P值<0.01,表明A(超声功率)和B(温度)对总黄酮提取得率的影响极显著;模型BC的P值>0.01且<0.05,表明B(温度)和C(乙醇体积分数)对总黄酮提取得率的影响显著;模型AC的P值>0.05,表明A(超声功率) 和C(乙醇体积分数)对总黄酮提取得率的影响不显著[28]。F值是评价各种影响因素重要性的参考指标,即F值越大表明该因素对实验结果影响越大。由F值大小可知B>C>A,说明B(温度)对总黄酮的提取得率的影响最大。二次项B2的P值>0.01且<0.05,说明温度对总黄酮提取得率的影响显著,二次项A2和C2的P值均<0.01,说明对总黄酮提取得率的影响极显著。
2.4.2 响应曲面分析各因素的交互作用
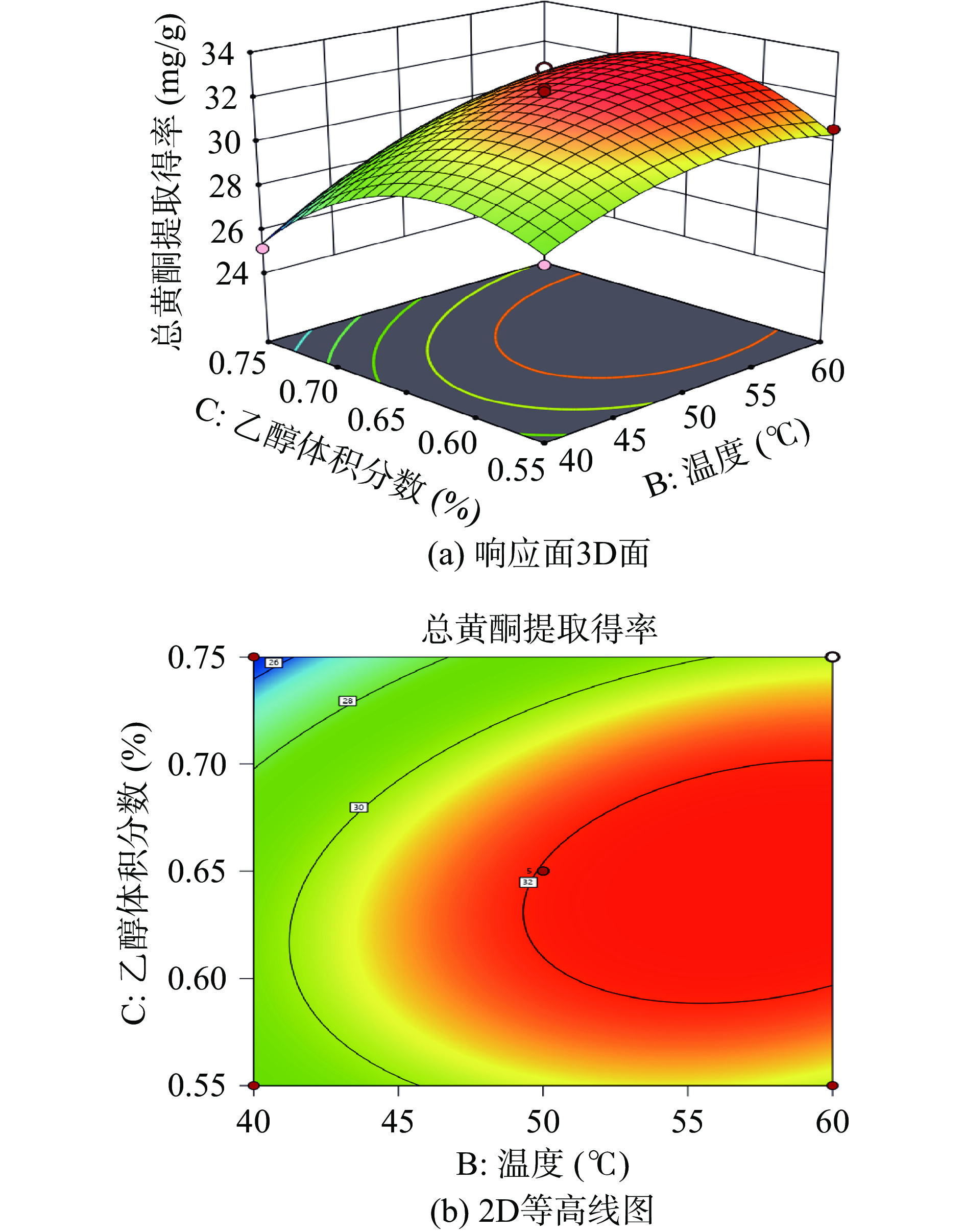
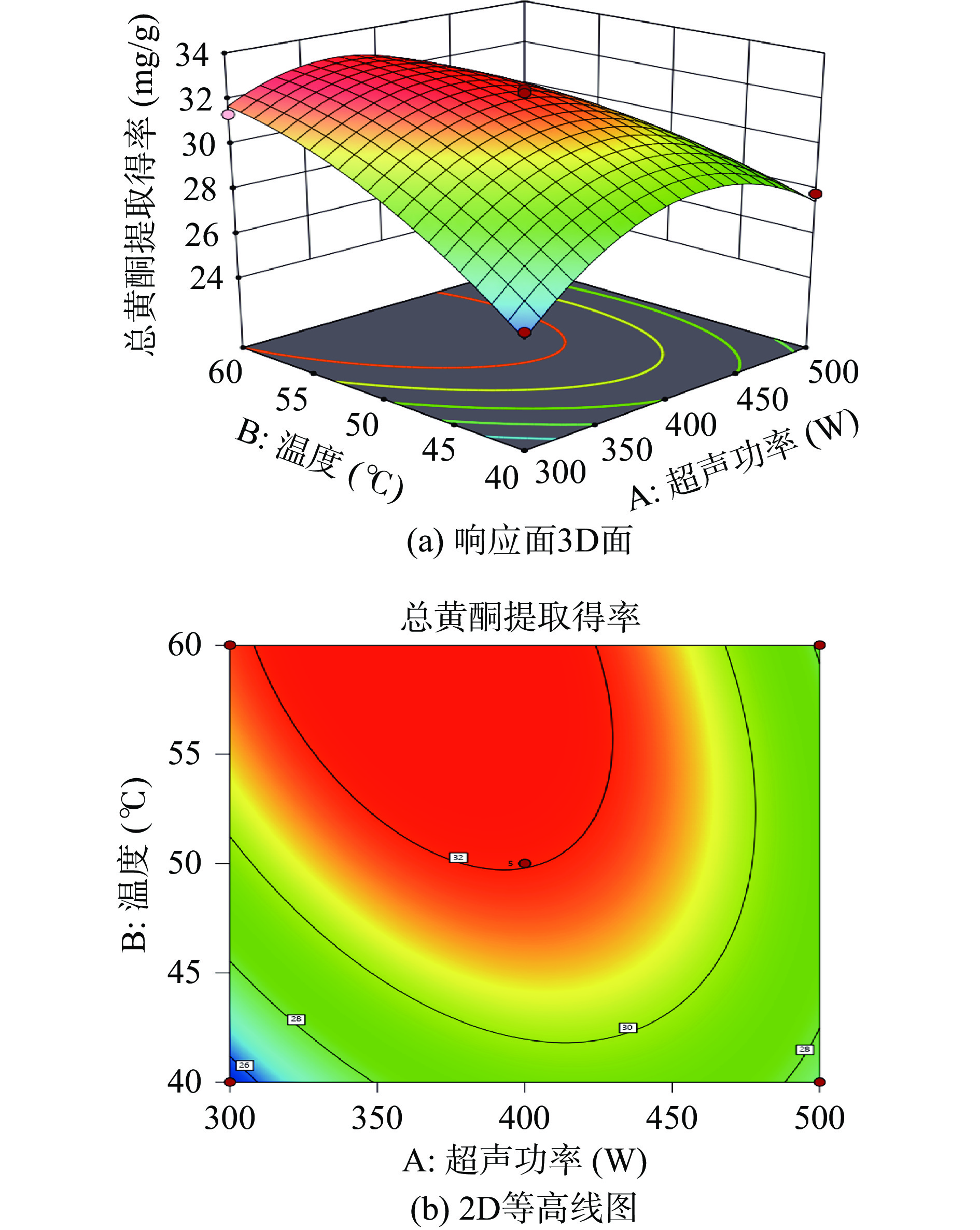
两个变量之间的交互作用由响应面3D图的陡峭程度和等高线的形状反映[29]。响应面3D图的坡面越陡峭表明两因素交互作用越显著,反之,响应面3D图坡面越平缓表明两因素交互作用越小;等高线形状呈椭圆形表明两因素交互作用显著,等高线形状呈圆形表明两因素交互作用很小甚至可忽略[30]。由图9~图11可知,响应面的3D图和等高线图都存在顶点,即在所选范围内存在极值[31]。AB、BC的等高线形状呈椭圆形,说明超声功率与温度、温度与乙醇体积分数两因素的交互作用显著,AC的等高线呈圆形,说明超声功率和乙醇体积分数的交互作用对响应值的影响不显著,与表4分析结果一致。
由图9(a)和图9(b)可知,3D 图的坡面较平缓,等高线趋于圆形,说明超声功率与乙醇体积分数的交互作用对响应值的影响不显著。当超声功率一定时,总黄酮提取得率随乙醇体积分数的增加呈现先上升后下降的趋势;当乙醇体积分数一定时,总黄酮提取得率随超声功率的增加,先上升后下降;与单因素实验结果一致。
由图10(a)和图10(b)可知,3D 图的坡面较陡,等高线呈椭圆形,说明温度和乙醇体积分数的交互作用对响应值的影响显著。当温度一定时,总黄酮提取得率随乙醇体积分数呈现先上升后下降的趋势;当乙醇体积分数一定时,总黄酮提取得率随温度的增加呈现上升的趋势。
由图11(a)和图11(b)可知,3D 图的坡面较陡,等高线呈椭圆形,说明超声功率与温度的交互作用对响应值的影响较显著。当超声功率一定时,总黄酮的提取得率随温度的增加呈现上升趋势;当温度一定时,总黄酮提取得率随超声功率的增加呈现先上升后下降的趋势。
2.4.3 验证试验
基于上述模型,优化得到的小叶丁香叶总黄酮的最优工艺条件为:pH5.5,加酶量为2%,液料比30:1 mL/g,超声功率404.75 W,超声时间40 min,乙醇体积分数63.4%,温度55.86 ℃。最优预测提取得率为32.57 mg/g。考虑到实际操作的需要,调整参数为加酶量2%,pH5.5,超声时间40 min,超声功率400 W,乙醇体积分数63%,温度56 ℃,液料比30:1 (mL/g)。为验证实验的可靠性,在调整后的条件下重复实验,实验结果表明丁香叶总黄酮的提取得率为32.21±0.16 mg/g ,与预测值接近,说明该优化条件可信。
2.5 丁香叶总黄酮体外抗氧化活性
2.5.1 丁香叶总黄酮对DPPH自由基的清除能力
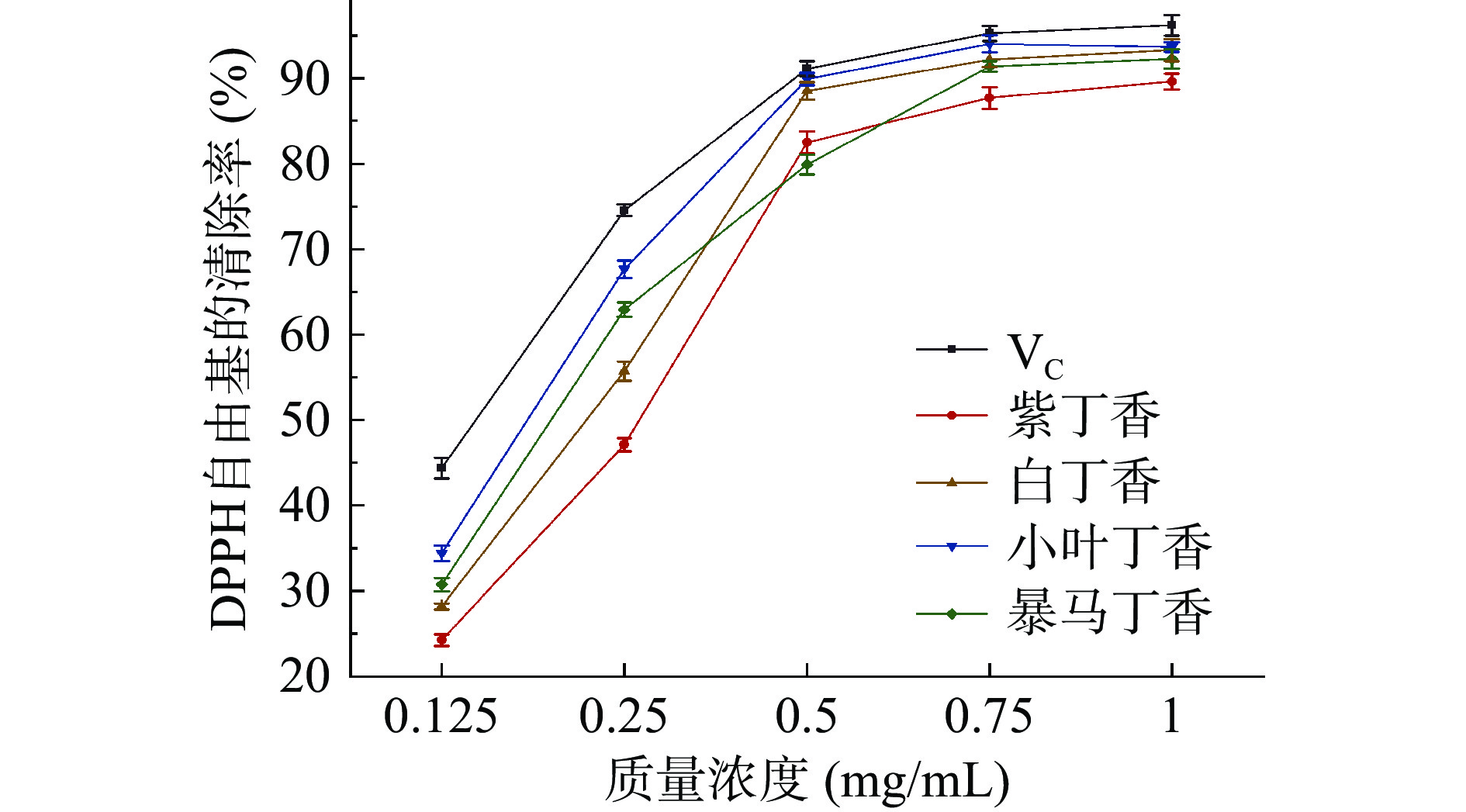
由图12可见,丁香叶总黄酮提取物对DPPH自由基的清除率随丁香叶总黄酮浓度的增大而提高,呈持续升高的趋势。VC作为阳性对照组其IC50值为0.167 mg/mL,自由基清除能力越强IC50值越小,小叶丁香叶、暴马丁香、白丁香和紫丁香叶总黄酮的IC50值依次为0.184、0.221、0.243和0.374 mg/mL。相同质量浓度下,小叶丁香叶总黄酮清除自由基的能力弱于VC但强于其他三种丁香叶总黄酮,有较高的清除自由基的能力。在质量浓度为0.75~1.0 mg/mL时,暴马丁香叶总黄酮与小叶丁香叶总黄酮对DPPH自由基的清除率相接近,但仍小于小叶丁香叶。当质量浓度达到0.75 mg/mL时,VC对DPPH自由基的清除率高于90%,4种丁香叶总黄酮对DPPH自由基的清除率均高于80%,四种丁香叶总黄酮对DPPH自由基的清除能力为小叶丁香>暴马丁香>白丁香>紫丁香。虽然丁香叶总黄酮对DPPH自由基的清除能力弱于VC,但其也达到了对DPPH自由基的较好的清除效果。
2.5.2 丁香叶总黄酮对OH自由基的清除能力
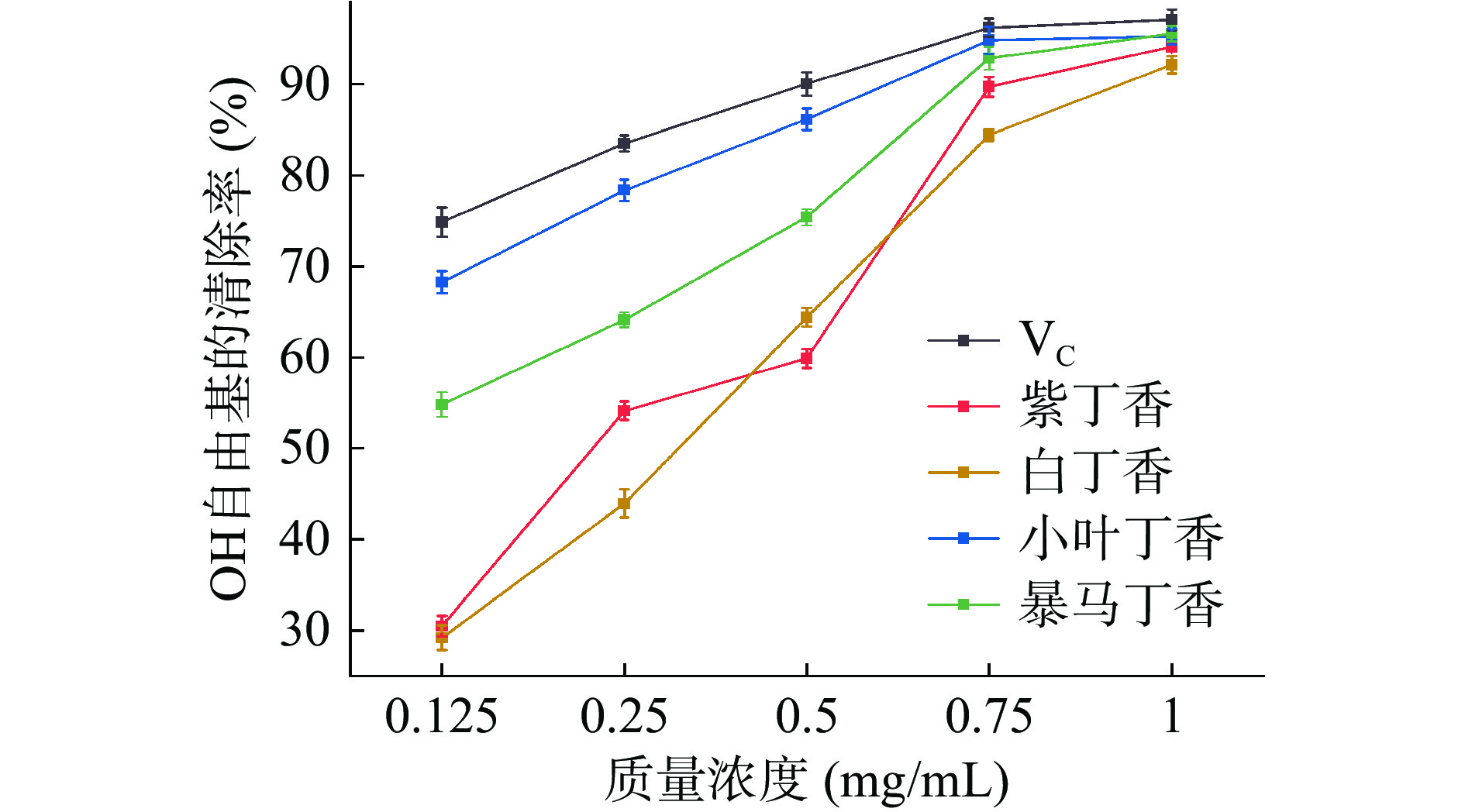
由图13可知丁香叶总黄酮提取物对OH自由基的清除率与丁香叶总黄酮浓度呈正相关。VC作为阳性对照组其IC50值为0.059 mg/mL,自由基清除能力越强IC50值越小,小叶丁香叶、暴马丁香、紫丁香和白丁香叶总黄酮的IC50值依次为0.078、0.106、0.225和0.354 mg/mL。小叶丁香叶总黄酮的IC50值都低于其他种丁香叶,表明小叶丁香叶总黄酮对OH自由基的清除效果最好;当质量浓度达0.75 mg/mL时,小叶丁香叶和暴马丁香叶总黄酮与VC的清除能力相差较小,且清除率均达80%以上,表明在此浓度下两种丁香叶黄酮的清除能力较强。当丁香叶总黄酮质量浓度为1 mg/mL时,四种丁香叶总黄酮对OH自由基的清除率均大于80%,虽然丁香叶总黄酮提取物对OH自由基的清除能力均低于同等质量浓度下的VC,但也表现出较强的OH自由基清除效果。四种丁香叶对OH自由基的清除能力依次为小叶丁香>暴马丁香>紫丁香>白丁香。
3. 结论
本文对纤维素酶辅助超声提取小叶丁香叶中总黄酮的提取工艺及4种丁香叶总黄酮粗提物的抗氧化性进行了较全面的研究。以单因素实验为基础,运用响应面实验进行优化,考虑到实际操作的需要,最佳工艺优化为:pH5.5,加酶量为2%,液料比30:1 (mL/g),超声功率400 W,超声时间40 min,乙醇体积分数63%,温度56 ℃。在该条件下,小叶丁香叶总黄酮提取得率为32.21±0.16 mg/g。通过对4种丁香叶中的总黄酮对DPPH自由基、OH自由基清除能力的研究,表明4种丁香叶总黄酮提取物都具有良好的抗氧化能力。本研究表明纤维素酶辅助超声提取法在小叶丁香叶总黄酮的提取中有一定优势,为小叶丁香叶的进一步开发和利用提供参考。本研究仅对小叶丁香叶总黄酮的提取工艺进行了研究,小叶丁香叶总黄酮的纯化及药用活性还需深入研究。
-
表 1 响应面试验因素水平设计
Table 1 Box-Beheken design
水平 因素 A超声功率 (W) B温度 (℃) C乙醇体积分数 (%) −1 300 40 55 0 400 50 65 1 500 60 75 表 2 不同提取方法总黄酮提取得率比较
Table 2 Comparison of flavonoids content in different extraction methods
提取方法 乙醇体积分数 (%) 液料比 (mL/g) 时间 (min) 总黄酮提取得率 (mg/g) 酶辅助超声提取法 65 30:1 40 31.97±0.38a 酶解法 0 30:1 40 22.68±1.21c 超声提取法 65 30:1 40 28.60±0.87b 表 3 中心组合优化方案及结果
Table 3 Scheme and results of central combinatorial optimization
实验号 A超声功率 B温度 C乙醇体积分数 总黄酮提取得率(mg/g) 1 0 0 0 31.64±0.13 2 −1 0 1 25.91±0.08 3 0 1 1 30.71±0.08 4 −1 1 0 31.36±0.16 5 0 0 0 31.52±0.25 6 −1 0 −1 28.82±0.06 7 0 1 −1 30.61±0.03 8 1 1 1 27.56±0.25 9 1 0 1 26.06±0.04 10 0 −1 −1 28.22±0.17 11 1 −1 0 27.84±0.31 12 0 0 0 32.28±0.06 13 0 −1 1 25.14±0.16 14 1 0 0 32.29±0.08 15 −1 −1 0 25.68±0.53 16 0 0 0 32.44±0.03 17 1 0 −1 26.78±0.14 表 4 响应面拟合回归方程方差分析结果
Table 4 Response surface fitted regression equation analysis of variance results
来源 自由度 平方和 均方 F值 P值 模型 9 109.16 12.13 53.38 <0.0001** A 1 1.56 1.56 6.87 0.0344* B 1 22.25 22.25 97.94 <0.0001** C 1 5.47 5.47 24.06 0.0017* AB 1 8.90 8.90 39.17 0.0004** AC 1 1.20 1.20 5.27 0.0553 BC 1 2.52 2.52 11.10 0.0126* A2 1 34.29 34.29 150.89 <0.0001** B2 1 4.85 4.85 21.36 0.0024* C2 1 22.09 22.09 97.20 <0.0001** 残差 7 1.59 0.2272 失拟项 3 0.8843 0.2948 1.67 0.3093 总离差 4 0.7062 0.1766 合计 16 110.75 注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。 -
[1] 张喜武, 杨斯棋, 李永吉, 等. 基于丁香苦苷抗菌药效研究的丁香叶质量标志物指认[J]. 中医药学报,2020,48(11):23−27. [ZHANG X W, YANG S Q, LI Y J, et al. Quality markers identification of Folium syringe based on antibacterial effect of Syringopicroside[J]. Acta Chinese Medicine and Pharmacology,2020,48(11):23−27.] ZHANG X W, YANG S Q, LI Y J, et al . Quality markers identification of Folium syringe based on antibacterial effect of Syringopicroside[J]. Acta Chinese Medicine and Pharmacology,2020 ,48 (11 ):23 −27 .[2] 赵常伟, 刘芳萍, 左咏梅, 等. 丁香叶总黄酮对小鼠药物性肝损伤的保护作用研究[J]. 中国兽医杂志,2017,53(2):90−92,121. [ZHAO C W, LIU F P, ZUO Y M, et al. Study on protective effects of flavonoids in Folium syringe on drug hepatic injury in mice[J]. Chinese Journal of Veterinary Medicine,2017,53(2):90−92,121.] ZHAO C W, LIU F P, ZUO Y M, et al . Study on protective effects of flavonoids in Folium syringe on drug hepatic injury in mice[J]. Chinese Journal of Veterinary Medicine,2017 ,53 (2 ):90 −92,121 .[3] LI Y, LI Z, LI C W, et al. Evaluation of hepatoprotective activity of Syringa oblata leaves ethanol extract with the indicator of glutathione S-transferase A1[J]. Revista Brasileira de Farmacognosia,2018,28(4):489−494. doi: 10.1016/j.bjp.2018.05.011
[4] 冯馨慧, 刘志明, 王海英. 暴马丁香叶乙醇提取物的体外抗氧化活性[J]. 中国野生植物资源,2019,38(5):43−47. [FENG X H, LIU Z M, WANG H Y. Antioxidant activity in vitro of ethanol extracts from leaves of Syringa reticulata val. amurensis[J]. Chinese Wild Plant Resources,2019,38(5):43−47.] FENG X H, LIU Z M, WANG H Y . Antioxidant activity in vitro of ethanol extracts from leaves of Syringa reticulata val. amurensis[J]. Chinese Wild Plant Resources,2019 ,38 (5 ):43 −47 .[5] 李博, 朱俊访. 丁香叶中所含有效成分的种类及药理作用研究进展[J]. 黑龙江医药,2009,22(4):510−511. [LI B, ZHU J F. Research progress on the types and pharmacological effects of active components in clove leaves[J]. Heilongjiang Medicine Journal,2009,22(4):510−511.] doi: 10.3969/j.issn.1006-2882.2009.04.048 LI B, ZHU J F . Research progress on the types and pharmacological effects of active components in clove leaves[J]. Heilongjiang Medicine Journal,2009 ,22 (4 ):510 −511 . doi: 10.3969/j.issn.1006-2882.2009.04.048[6] HU Y, WANG Z, SHEN C, et al. Influence of the pKa value on the antioxidant activity of licorice flavonoids under solvent‐mediated effects[J]. Archiv Der Pharmazie, 2023:e2200470.
[7] 丛登立, 孟宪兰, 李鹏飞. 柴胡茎叶总黄酮生物活性研究[J]. 人参研究,2021,33(6):32−34. [CONG D L, MENG X L, LI P F. Study on the biological activity of total flavonoids from the stems and leaves of Bupleurum chinense[J]. Ginseng Research,2021,33(6):32−34.] CONG D L, MENG X L, LI P F . Study on the biological activity of total flavonoids from the stems and leaves of Bupleurum chinense[J]. Ginseng Research,2021 ,33 (6 ):32 −34 .[8] SZEWCZYK K, PIETRZAK W, KLIMEK K, et al. Flavonoid and phenolic acids content and in vitro study of the potential anti-aging properties of eutrema japonicum (Miq.) Koidz cultivated in wasabi farm poland[J]. International Journal of Molecular Sciences,2021,22(12):6219. doi: 10.3390/ijms22126219
[9] PICOS S M A, HEREDIA J B, LEYVALÓPEZ N, et al. Extraction processes affect the composition and bioavailability of flavones from Lamiaceae plants:A comprehensive review[J]. Processes,2021,9(9):1675. doi: 10.3390/pr9091675
[10] 章烨雯, 臧青民, 蒋德旗, 等. 白眉草总黄酮超声辅助提取工艺优化及抗菌活性研究[J]. 中国饲料,2022(3):29−33. [ZHANG H W, ZANG Q M, JIANG D Q, et al. Optimization of ultrasonic-assisted extraction technology and antibacterial activity of total flavonoids from Gerbera piloselloides (L.) cass[J]. China Feed,2022(3):29−33.] ZHANG H W, ZANG Q M, JIANG D Q, et al . Optimization of ultrasonic-assisted extraction technology and antibacterial activity of total flavonoids from Gerbera piloselloides (L.) cass[J]. China Feed,2022 (3 ):29 −33 .[11] 李化, 张明晓, 白羽琦, 等. 基于总黄酮类成分含量构成特征和体外抗病毒活性的不同产地黄芩的质-效评价研究[J]. 中国药房,2020,31(10):1166−1171. [LI H, ZHANG M Y, BAI Y Q, et al. Study on quality-efficiency evaluation of Scutellaria baicalensis from different origins based on content constituent characteristics of flavonoids and in vitro antiviral activity[J]. China Pharmacy,2020,31(10):1166−1171.] doi: 10.6039/j.issn.1001-0408.2020.10.03 LI H, ZHANG M Y, BAI Y Q, et al . Study on quality-efficiency evaluation of Scutellaria baicalensis from different origins based on content constituent characteristics of flavonoids and in vitro antiviral activity[J]. China Pharmacy,2020 ,31 (10 ):1166 −1171 . doi: 10.6039/j.issn.1001-0408.2020.10.03[12] 罗琥捷, 杨宜婷, 黄寿根, 等. 超声提取法与索氏提取法提取陈皮总黄酮类有效成分的分析比较[J]. 中药材,2016,39(2):371−374. [LUO H J, YANG Y T, HUANG S G, et al. Analysis and comparison of flavonoids extracted from orange peel by ultrasonic extraction and Soxhlet extraction[J]. Journal of Chinese Medicinal Materials,2016,39(2):371−374.] LUO H J, YANG Y T, HUANG S G, et al . Analysis and comparison of flavonoids extracted from orange peel by ultrasonic extraction and Soxhlet extraction[J]. Journal of Chinese Medicinal Materials,2016 ,39 (2 ):371 −374 .[13] 马全民, 刘王梅, 聂复礼, 等. 响应面法优化酶辅助超声提取蓝莓花青素工艺研究[J]. 浙江农业科学,2022,63(11):2606−2611. [MA Q M, LIU W M, NIE F L, et al. Optimization of anthocyanins extraction from blueberry with enzymatic-assisted ultrasound extraction by response surface methodology[J]. Journal of Zhejiang Agricultural Sciences,2022,63(11):2606−2611.] MA Q M, LIU W M, NIE F L, et al . Optimization of anthocyanins extraction from blueberry with enzymatic-assisted ultrasound extraction by response surface methodology[J]. Journal of Zhejiang Agricultural Sciences,2022 ,63 (11 ):2606 −2611 .[14] 何静, 史睿, 吉日木图. 超声辅助酶提取技术对驼皮源胶原蛋白降解及其活性肽的影响[J]. 食品与发酵工业, 2023, 49(15):153−159. [HE J, SHI R, JI R M T, Effect of ultrasound-assisted enzyme extraction on the protein degradation and biological of peptides in camel skin collagen[J]. Food and Fermentation Industries, 2023, 49(15):153−159.] HE J, SHI R, JI R M T, Effect of ultrasound-assisted enzyme extraction on the protein degradation and biological of peptides in camel skin collagen[J]. Food and Fermentation Industries, 2023, 49(15): 153−159.
[15] 李栋, 薛瑞婷. 响应面耦合遗传算法优化超声辅助复合酶提取红枣多糖工艺[J]. 食品研究与开发, 2021, 42(6):96−103. [LI D, XUE R T, Optimization of ultrasonic-assisted complex enzyme extraction polysaccharides from jujube by response surface methodology coupled with genetic algorithm[J]. Food Research and Development, 2021, 42(6):96−103.] LI D, XUE R T, Optimization of ultrasonic-assisted complex enzyme extraction polysaccharides from jujube by response surface methodology coupled with genetic algorithm[J]. Food Research and Development, 2021, 42(6): 96−103.
[16] 李菁, 杜少兵, 杨蕾, 等. 响应面法优化紫丁香叶总黄酮超声提取工艺[J]. 广东药科大学学报,2022,38(4):52−57. [LI J, DU S B, YANG L, et al. Optimization of ultrasonic extraction process of total flavonoids from leaves of Syringa oblate by response surface methodology[J]. Journal of Guangdong Pharmaceutical University,2022,38(4):52−57.] LI J, DU S B, YANG L, et al . Optimization of ultrasonic extraction process of total flavonoids from leaves of Syringa oblate by response surface methodology[J]. Journal of Guangdong Pharmaceutical University,2022 ,38 (4 ):52 −57 .[17] 张小梅, 王聪, 靳晓琳, 等. 百香果皮总黄酮的复合酶辅助超声波提取工艺优化及其抗氧化活性分析[J]. 食品工业科技,2022,43(12):215−222. [ZHANG X M, WANG C, JIN X L, et al. Optimization of extraction technology of total flavonoids from passiflora edulis peel by ultrasonic assisted with complex enzyme and its antioxidant activity[J]. Science and Technology of Food Industry,2022,43(12):215−222.] ZHANG X M, WANG C, JIN X L, et al . Optimization of extraction technology of total flavonoids from passiflora edulis peel by ultrasonic assisted with complex enzyme and its antioxidant activity[J]. Science and Technology of Food Industry,2022 ,43 (12 ):215 −222 .[18] 杨观兰, 钟朝玲, 张强, 等. 响应面优化南酸枣叶总黄酮的提取及其抗氧化活性研究[J]. 粮食与油脂,2022,35(9):133−137. [YANG G L, ZHONG C L, ZHANAG Q, et al. Optimization of extraction of total flavonoids from Choerospondias axillaris leaves by response surface methodology and analysis of antioxidant activity[J]. Cereals & Oils,2022,35(9):133−137.] YANG G L, ZHONG C L, ZHANAG Q, et al . Optimization of extraction of total flavonoids from Choerospondias axillaris leaves by response surface methodology and analysis of antioxidant activity[J]. Cereals & Oils,2022 ,35 (9 ):133 −137 .[19] 傅贤明, 卢诗, 黄欣, 等. 超声提取福鼎白茶总黄酮工艺优化及抗氧化能力研究[J]. 粮食与油脂,2022,35(12):114−118,122. [FU X M, LU S, HUANG X, et al. Study on ultrasonic extraction and antioxidant capacity of total flavonoids from Fuding white tea[J]. Cereals & Oils,2022,35(12):114−118,122.] FU X M, LU S, HUANG X, et al . Study on ultrasonic extraction and antioxidant capacity of total flavonoids from Fuding white tea[J]. Cereals & Oils,2022 ,35 (12 ):114 −118,122 .[20] 付依依, 王永霞, 李月, 等. 大果沙棘中总黄酮的体外抗炎及抗氧化活性研究[J]. 中国食品添加剂,2021,32(10):67−74. [FU Y Y, WANG Y X, LI Y, et al. Study on in vitro anti-inflammatory and antioxidant activities of flavonoids from sea buckthorn[J]. China Food Additives,2021,32(10):67−74.] FU Y Y, WANG Y X, LI Y, et al . Study on in vitro anti-inflammatory and antioxidant activities of flavonoids from sea buckthorn[J]. China Food Additives,2021 ,32 (10 ):67 −74 .[21] 穆易君. 菠菜黄酮的制备、成分分析及其抗氧化活性研究[D]. 锦州:锦州医科大学, 2019. [MU Y J. The preparation, component analysis and study on antioxidant activity of flavonoids from spinach [D]. Jinzhou:Jinzhou Medical University, 2019.] MU Y J. The preparation, component analysis and study on antioxidant activity of flavonoids from spinach [D]. Jinzhou: Jinzhou Medical University, 2019.
[22] 贾凯慧, 李占君, 姚远, 等. 超声辅助提取紫苏粕迷迭香酸工艺优化及其抗氧化能力[J]. 森林工程,2022,38(4):89−97. [JIA K H, LI Z J, YAO Y, et al. Optimization of ultrasonic assisted extraction of rosmarinic acid from Perilla frutescens Meal and It’s antioxidant capacity[J]. Forest Engineering,2022,38(4):89−97.] JIA K H, LI Z J, YAO Y, et al . Optimization of ultrasonic assisted extraction of rosmarinic acid from Perilla frutescens Meal and It’s antioxidant capacity[J]. Forest Engineering,2022 ,38 (4 ):89 −97 .[23] 张庆芬, 李占君, 李晓雪, 等. 匀浆结合超声-微波协同提取桔梗中桔梗皂苷D和党参炔苷工艺研究[J]. 森林工程,2022,38(5):110−120. [ZHANG Q F, LI Z J, LI X X, et al. Homogenate pretreatment followed by ultrasonic-microwave synergistic extraction of platycodin D and lobetyolin from the Platycodon radix[J]. Forest Engineering,2022,38(5):110−120.] ZHANG Q F, LI Z J, LI X X, et al . Homogenate pretreatment followed by ultrasonic-microwave synergistic extraction of platycodin D and lobetyolin from the Platycodon radix[J]. Forest Engineering,2022 ,38 (5 ):110 −120 .[24] BAZABANG S A, MAKENA W, ONIMISI O B, et al. Flavonoid-rich extract from Citrullus lanatus (Watermelon) seed attenuated ethanol-induced kidney injury in wistar rats[J]. Pharmacological Research-Modern Chinese Medicine, 2023, 7:100236.
[25] 周伟, 于笛, 迟治平, 等. 超声微波协同萃取紫丁香叶总黄酮工艺及其稳定性研究[J]. 中国食品添加剂,2018,174(8):111−119. [ZHOU W, YU DI, CHI Z P, et al. Study on ultrasonic-microwave synergistic extraction process and stability of total flavonoids from Syringa oblata leaves[J]. China Food Additives,2018,174(8):111−119.] ZHOU W, YU DI, CHI Z P, et al . Study on ultrasonic-microwave synergistic extraction process and stability of total flavonoids from Syringa oblata leaves[J]. China Food Additives,2018 ,174 (8 ):111 −119 .[26] 穆易君, 陈洋, 孙晶, 等. 纤维素酶-超声联合提取菠菜中总黄酮及其成分分析[J]. 食品工业科技,2019,40(19):187−193. [MU Y J, CHEN Y, SUN J, et al. Extraction of total flavonoids from spinach by cellulase-ultrasound and its composition analysis[J]. Science and Technology of Food Industry,2019,40(19):187−193.] MU Y J, CHEN Y, SUN J, et al . Extraction of total flavonoids from spinach by cellulase-ultrasound and its composition analysis[J]. Science and Technology of Food Industry,2019 ,40 (19 ):187 −193 .[27] MRNG Y M, XIAO Q C, ZHENG H W, et al. Extraction, composition, and antioxidant activity of flavonoids from Xanthoceras sorbifolium Bunge leaves[J]. Journal of AOAC International, 2022, 106(3):769-777.
[28] 王杰, 王瑞芳, 王园, 等. 响应面优化马齿苋黄酮水提工艺及其抗氧化活性评价[J]. 食品与发酵工业,2020,46(19):197−204. [WANG J, WANG R F, WANG Y, et al. Optimization of water extraction technology by response surface methodology for flavonoids in Portulaca oleracea L. and its antioxidant activity assessment[J]. Food and Fermentation Industries,2020,46(19):197−204.] WANG J, WANG R F, WANG Y, et al . Optimization of water extraction technology by response surface methodology for flavonoids in Portulaca oleracea L. and its antioxidant activity assessment[J]. Food and Fermentation Industries,2020 ,46 (19 ):197 −204 .[29] LIANG J S, ZHANG H, ZHU C H. Optimization of ultrasonic-assisted aqueous two-phase extraction of flavonoids from hawthorn leaves using response surface methodology[J]. Journal of Physics: Conference Series,2022,2329(1):012041. doi: 10.1088/1742-6596/2329/1/012041
[30] 朱梅琴, 郭鹏, 任学花, 等. 响应面法优化红枣黑枸杞人参果复合饮料的研制[J]. 食品科技,2021,46(4):87−95. [ZHU M Q, GUO P, REN X H, et al. Optimization of red jujube, black wolfberry and Sozamnmuiiatnm compound drink by response surface methodology[J]. Food Science and Technology,2021,46(4):87−95.] ZHU M Q, GUO P, REN X H, et al . Optimization of red jujube, black wolfberry and Sozamnmuiiatnm compound drink by response surface methodology[J]. Food Science and Technology,2021 ,46 (4 ):87 −95 .[31] CHEN F Z, WANG B, ZHAO G H, et al. Optimization extraction of flavonoids from peony pods by response surface methodology, antioxidant activity and bioaccessibility in vitro[J]. Journal of Food Measurement and Characterization,2023,17(1):460−471. doi: 10.1007/s11694-022-01649-y





 下载:
下载:

 下载:
下载:
