Identification and Physicochemical Properties of Collagen from Sika Antler Base
-
摘要: 本研究以梅花鹿角盘为原料,利用酸法和酶法提取梅花鹿角盘酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC),研究其结构和理化性质,为开发胶原蛋白新资源,提高鹿产品附加值提供理论依据。结果表明,梅花鹿角盘ASC和PSC符合Ⅰ型胶原蛋白氨基酸的特征分布。其中蛋氨酸含量最低,羟基化程度较高,分别为45.69%和46.30%。ASC和PSC至少由两条α链(α1和α2)组成,β链含量较高,并含有少量的γ链。ASC和PSC二级结构相似,均出现酰胺A、B、Ⅰ、Ⅱ和Ⅲ的特征吸收峰,保存着三螺旋结构。ASC和PSC在280 nm处基本无吸收,其最大吸收峰位于219.0 nm和224.0 nm处。ASC和PSC溶液的pH越接近pI值,其溶解性、乳化能力和乳化稳定性越小。当NaCl浓度为0~2 mol/L时,增加盐量可以增大ASC和PSC的溶解性、起泡性;盐浓度在0~0.4 mol/L范围内,能提高ASC和PSC乳化性和乳化稳定性。蛋白浓度0.5%时,两者的乳化稳定性最大,蛋白浓度4%时,两者的乳化稳定性最小。Abstract: The structure and physicochemical properties of ASC and PSC extracted from the antler plate of plum blossom deer were studied, which provided a theoretical basis for developing new collagen resources and improving the added value of deer products. The results showed that ASC and PSC were consistent with the characteristic distribution of amino acids of type Ⅰ collagen. The methionine content was the lowest and the hydroxylation degree was higher (45.69% and 46.30%, respectively). ASC and PSC consisted of at least two α chains (α1 and α2), a high amount of β chain, and a small amount of γ chain. The secondary structures of ASC and PSC were similar, with the characteristic absorption peaks of amide A, B, Ⅰ, Ⅱ and Ⅲ, preserving the triple helix structure. ASC and PSC had almost no absorption at 280 nm. The maximum absorption peaks of ASC and PSC were at 219.0 nm and 224.0 nm. The closer the pH values of ASC and PSC solutions was to pI values, the worse the solubility, emulsifying capacity, and emulsifying stability. The solubility, foaming of ASC and PSC could be enhanced by increasing NaCl concentration in the range of 0~2 mol/L. In the range of 0~0.4 mol/L, the emulsifying capacity and emulsifying stability of ASC and PSC could be improved. The emulsifying stability of the them was at the maximum level when the protein concentration was 0.5%, and the emulsifying stability of them was at the minimum level when the protein concentration was 4%.
-
Keywords:
- sika antler base /
- collagen /
- identification /
- physicochemical properties
-
梅花鹿角盘是雄性梅花鹿或马鹿经锯茸后,于次年脱落的,介于鹿茸骨化和未骨化之间十分坚硬的盘状骨化残角[1]。世界上养鹿业较发达的国家除中国外,只有新西兰、俄罗斯、韩国等少数几个国家,受饲养条件的限制,国内外从事鹿产品研究的并不多,对于梅花鹿角盘中主要药效成分之一胶原蛋白的研究报道甚少[2]。鹿角盘在民间药用较为广泛,具有温补肝肾、益精养血等功效,常用于腰膝酸冷、崩漏下血、阴疽肿痛等的治疗[3−4]。目前市场上的梅花鹿角盘,简单打粉,销售初级原料,没有充分开发其药用价值[5−7]。
通过利用酸溶液中的离子破坏蛋白分子内部的次级作用力和醛胺交联键,引起纤维膨胀、溶解,从而水解得到产物,即酸溶性胶原蛋白。作为溶剂使用的酸主要有乙酸、柠檬酸、甲酸和盐酸等,盐酸溶液浓度一般为0.01 mol/L,有机酸在0.1~0.5 mol/L之间[8]。酸法提取能最大程度地保持胶原蛋白的三螺旋结构,但产品得率低。通过酶作用不同类型的肽键,利用其催化专一性将胶原进行限制性酶解,从而水解得到产物,即酶溶性胶原蛋白。蛋白酶会将分子末端肽Lys相互作用形成的共价交联键切割下来,主体部分(三螺旋结构)即可溶于溶液中,进而再被提取出来,这样溶解的胶原仍有完整的螺旋区段。本研究比较了酸法和酶法提取的梅花鹿角盘胶原蛋白的结构及理化性质,为梅花鹿角盘中胶原蛋白的开发利用奠定理论基础。
1. 材料与方法
1.1 材料与仪器
梅花鹿角盘粉 由辽宁西丰养鹿场提供;胃蛋白酶(酶活力≥3000 U/mg)、三羟甲基氨基甲烷(Tris)(AR分析纯)、甲叉双丙烯酰胺 (AR分析纯)、考马斯亮蓝G-250 美国Sigma公司;十二烷基硫酸钠(SDS)(AR分析纯) 臻鼎生物有限公司;(Bis)蛋白质标准分子量(BR生化试剂) 德国巴斯夫公司;丙烯酰胺(Acr)(AR分析纯) 天津市科密欧化学试剂有限公司;四甲基乙二胺(TMEDA)(AR分析纯) 国药集团化学试剂有限公司;过硫酸铵(APS)(AR分析纯) 美国Amresco公司。
L-8800氨基酸自动分析仪 日本日立公司;DYY-6C稳压稳流电泳仪 北京六一仪器厂;ZHWY-2102恒温振荡摇床 国华电器有限公司;Nicolet 6700傅立叶红外光谱仪 Thermo Fisher Scientific公司;UV-2100型紫外可见分光光度计 (尤尼柯)上海仪器有限公司;CT14RD型冷冻离心机 上海天美科学仪器有限公司;CR21G高速离心机 东京日立公司;210 mm玻璃干燥器 郑州中天实验仪器有限公司;JY2001型电子天平 上海方瑞仪器有限公司;pH S-25型酸度计 上海理达仪器厂;40270520型移液枪 美国热电公司。
1.2 实验方法
1.2.1 梅花鹿角盘ASC的制备
梅花鹿角盘经超微粉碎后,浸于0.5 mol/L HCl溶液中,料液比为1:10,振荡脱钙60 min,振荡频率200 r/min,然后用0.5 mol/L的Na2CO3溶液浸泡,液面没过梅花鹿角盘粉,搅拌10 h用纱布滤净,蒸馏水冲洗三遍,冷冻干燥成粉末;选用0.3 mol/L乙酸在pH为2.7,固液比为1:15的条件下水解36 h后过滤,向上清液中加入5 mL NaCl进行盐析24 h,使溶液终浓度为3.0 mol/L,析出絮状白色沉淀于8000 r/min离心30 min,沉淀部分用十倍体积的0.5 mol/L乙酸溶解后,装入透析袋中,在0.1 mol/L的乙酸中透析12 h,再在蒸馏水中透析48 h,将透析液冷冻干燥得到酸溶性胶原蛋白ASC[9−10]。
1.2.2 梅花鹿角盘PSC的制备
将1.2.1中乙酸水解后的沉淀选用胃蛋白酶(酶活力≥3000 U/mg)在加酶量为1.6%,固液比为1:20,温度为4 ℃条件下酶解2.5 h,将过滤后的上清液在95 ℃条件下进行灭酶5 min并离心30 min,转速6000 r/min。上清液部分用10倍体积的0.5 mol/L乙酸溶解后,装入透析袋中,在0.1 mol/L的乙酸中透析12 h,再在蒸馏水中透析48 h,将透析液冷冻干燥得到酶溶性胶原蛋白PSC[11−12]。
1.2.3 氨基酸分析
将1 g的鹿角盘ASC与PSC样品放入反应管,添加15 mL 5 mol/L HCl溶液与3~4滴苯酚溶液。真空封管,110 ℃条件下水解24 h。水解液加水至50 mL。量取2 mL水解液,在50 ℃下干燥,再将其溶解于2 mL pH2.2的磷酸缓冲试剂中。经过滤后,放入氨基酸自动分析仪进行测定[13]。
1.2.4 SDS-PAGE 凝胶电泳
1.2.4.1 电泳胶配方
SDS-PAGE凝胶电泳采用5%的浓缩胶与7.5%的分离胶,用于非连续电泳系统[14],具体配方如表1所示。
表 1 SDS-PAGE 凝胶电泳配方Table 1. Formula of SDS-polyacrylamide gel electrophoresis7.5%分离胶 5%浓缩胶 Tris-HCl(mol·L−1) 1.5 0.5 缓冲液(mL) 2.5(pH8.8) 1.25(pH6.8) Acr/Bis存贮液(mL) 2.5 0.8 SDS(g) 0.04 0.02 TMEDA (μL) 5 5 10% APS(μL) 50 25 总体积(mL) 10 5 1.2.4.2 上样缓冲液配方
上样缓冲液配方采用2倍还原缓冲液与2倍非还原缓冲液,具体配方如表2所示。
表 2 还原和非还原上样缓冲液Table 2. Sample buffer of reduction and non-reduction2倍还原缓冲液 2倍非还原缓冲液 去离子水(mL) 1 − β-巯基乙醇(mL) − 1 0.5 mol/L Tris-HCl(pH6.8)(mL) 2.5 2.5 甘油(mL) 2 2 10% SDS(mL) 4 4 0.1%溴酚蓝(mL) 0.5 0.5 总体积(mL) 10 10 1.2.4.3 样品制备及电泳
将胶原蛋白样品ASC和PSC分别溶解于0.1 mol/L的Tris-HCl(pH6.8)缓冲液中,至最终浓度为0.5 mg/mL,4 ℃下放置24 h,10000 r/min离心3 min。将蛋白上清液与上样缓冲液l:1等体积混合,60 ℃加热3 min,取10 μL上清液点样。在槽中倒入含有1% SDS(w/v)的Tris-甘氨酸电泳液(pH8.3)。并于20 V的浓缩胶和60 V的分离胶电压下进行电泳。
1.2.4.4 染色及脱色
在电泳完成后将凝胶取下。用0.05%的考马斯亮蓝染色l h。用脱色液在摇床内脱色2 h,并观察结果。
1.2.5 傅立叶变换红外光谱(FTIR)扫描
将冷冻干燥的鹿角盘ASC和PSC固体样品分别与干燥过的KBr固体以2:100的比例混合。然后研磨均匀,装样并压片。小心取出样品进行测定,设置傅立叶变换红外扫描仪分辨率为10 cm−1。在扫描区间为4000~400 cm−1区间对样品红外扫描[14]。
1.2.6 紫外扫描
将冷冻干燥的鹿角盘ASC和PSC固体样品分别溶于0.3 mol/L乙酸溶液中,配成2 mg/mL的胶原蛋白溶液,置于1 cm比色皿中,设置紫外-可见分光光度计在波长范围为200~400 nm内对其扫描,波长间隔为1 nm,测出最大吸收波长[15]。
1.2.7 梅花鹿角盘胶原蛋白的溶解度
用0.5 mol/L乙酸分别溶解梅花鹿角盘ASC和PSC冻干品,分别制成质量浓度为3 mg/mL和6 mg/mL的蛋白溶液,测定胶原蛋白的溶解度。胶原蛋白的溶解度采用蛋白质分散指数(PDI)表示[16]。
PDI(%)=m1m2×100 (1) 式中:m1为上清液蛋白质含量,g;m2为总蛋白质含量,g。
1.2.7.1 pH对胶原蛋白溶解度的影响
取8 mL配好的蛋白溶液(质量浓度为3 mg/mL)加入到50 mL离心管中,用磷酸缓冲液调节pH分别为4.0、5.0、6.0、7.0、8.0、9.0、10.0 7个水平后用蒸馏水定容至10 mL,在4 ℃条件下10000 r/min离心20 min。测定胶原蛋白溶解度。
1.2.7.2 NaCl浓度对胶原蛋白溶解度的影响
取5 mL配好的蛋白溶液(质量浓度为6 mg/mL)加入到50 mL离心管中,与5 mL浓度为0、0.5、1.0、1.5、2.0、2.5和3.0 mol/L的NaCl溶液混合,在4 ℃条件下10000 r/min离心20 min。测定胶原蛋白溶解度。
1.2.8 梅花鹿角盘胶原蛋白的起泡性和起泡稳定性
取10 mg/mL梅花鹿角盘ASC和PSC溶液100 mL于高速搅拌机中,10000 r/min的速度搅打1 min,倒入量筒中读取泡沫体积;再将泡沫静置30 min后,观察记录泡沫体积,以大豆分离蛋白作为对照。胶原蛋白起泡性(FE)和泡沫稳定性(FS)的计算公式如下[17]。
FE(%)=V−V0V0×100 (2) FS(%)=V30V×100 (3) 式中:V为搅打后泡沫的体积,mL;V0为搅打前的初始液体体积,mL;V30为搅打30 min后泡沫的体积,mL。
1.2.8.1 pH对胶原蛋白起泡性和泡沫稳定性的影响
设置pH分别为4、5、6、7、8、9 这6个水平,分别测定FE和FS。
1.2.8.2 NaCl浓度对胶原蛋白起泡性和泡沫稳定性的影响
设置NaCl溶液浓度分别为0、0.5、1.0、1.5、2.0和2.5 mol/L 6个水平,分别测定FE和FS。
1.2.9 梅花鹿角盘胶原蛋白的乳化性和乳化稳定性
称量一定量梅花鹿角盘ASC和PSC冻干品溶解于0.05 mol/L Tris-HCI缓冲液(pH7.5)中,取1 mL大豆色拉油与3 mL 0.5%胶原蛋白溶液,12000 r/min高速匀浆机乳化1 min,分别于0、10 min时用移液枪吸取50 μL乳浊液,加入到5 mL 0.1% SDS溶液中混合均匀,于500 nm处分别测定吸光度A0和A10,以0.1% SDS溶液为空白对照。乳化活性指数(EAI)及乳化稳定指数(ESI)计算公式如下[18]。
EAI(m2/g)=A0×100 (4) ESI(min)=A10×ΔtA0 (5) 式中:A0为0 min时测得的吸光值;A10为乳化液10 min后测定的吸光值;Δt为10 min。
1.2.9.1 pH对胶原蛋白乳化性和乳化稳定性的影响
设置pH分别为4、5、6、7、8、9这 6个水平,分别测定EAI和ESI。
1.2.9.2 NaCl浓度对胶原蛋白乳化性和乳化稳定性的影响
设置NaCl溶液浓度分别为0、0.2、0.4、0.6、0.8和1.0 mol/L 6个水平,分别测定EAI和ESI。
1.2.9.3 蛋白浓度对胶原蛋白乳化性和乳化稳定性的影响
设置胶原蛋白浓度分别为0.5%、1%、2%、3%和4% 5个水平,分别测定EAI和ESI。
1.3 数据处理
用Excel 2003对数据进行处理(计算平均值和标准偏差等)及绘图;用SPSS Statistics 17.0对数据进行显著性分析,通过Duncan对平均数间的差异进行比较分析(P<0.05)。
2. 结果与分析
2.1 梅花鹿角盘胶原蛋白分析鉴定
2.1.1 梅花鹿角盘胶原蛋白的氨基酸分析
由表3可知,鹿角盘通过不同方法制备的ASC和PSC的氨基酸组成极为相近,且含量丰富。占氨基酸残基总数最大的是甘氨酸。氨基酸总量为1000时,分别占184、195。这是因为在氨基酸的序列中,甘氨酸是以重复序列存在,而且该序列一直循环存在于胶原蛋白中。因此通过结构式,可以判断出甘氨酸残基约占残基总数的33%;其次是苏氨酸;蛋氨酸含量最低。同时发现酪氨酸、组氨酸和异亮氨酸含量也很低,而且没有检测到胱氨酸。以上事实均证明实验所制备的胶原蛋白都符合Ⅰ型胶原蛋白氨基酸的模式构成[19]。
表 3 梅花鹿角盘ASC和PSC的氨基酸组成(残基数/1000个残基)Table 3. Amino acid composition of ASC and PSC from deer antler base (residues/1000 residues)氨基酸名称 ASC PSC 天门冬氨酸 (Asp) 57 54 苏氨酸 (Thr) 118 111 丝氨酸 (Ser) 26 27 谷氨酸 (Glu) 109 100 脯氨酸 (Pro) 82 87 甘氨酸 (Gly) 184 195 丙氨酸 (Ala) 87 90 羟脯氨酸 (Hyp) 69 75 缬氨酸 (Val) 31 33 蛋氨酸 (Met) 12 10 异亮氨酸 (Ile) 35 38 亮氨酸 (Leu) 16 21 酪氨酸 (Tyr) 17 15 苯丙氨酸 (Phe) 32 26 赖氨酸 (Lys) 43 41 组氨酸 (His) 10 14 精氨酸 (Arg) 72 63 氨基酸总量 1000 1000 亚氨基酸 151 162 胶原蛋白的特征氨基酸是Pro和Hyp的总和。在总数为1000氨基酸残基中,ASC和PSC中的脯氨酸分别为82和87。同理,可计算羟脯氨酸分别为69和75。Pro在脯氨酰羟化酶羟基化作用后,胶原蛋白多肽链转录生成羟脯氨酸。ASC和PSC的脯氨酸羟基化程度分别为45.69%和46.30%。亚氨基酸(Pro和Hyp之和),同样在残基总数为1000的情况下,ASC和PSC的残基中依次为151和162。亚氨基酸是环状氨基酸,数量越多,需要破坏胶原蛋白主体结构的温度就越高。因此热稳定性就越好。所以胶原蛋白的热变性温度与亚氨基酸浓度有一定关联性[20]。因此与ASC相比较,PSC的热稳定性更好。
2.1.2 胶原蛋白SDS-PAGE电泳分析
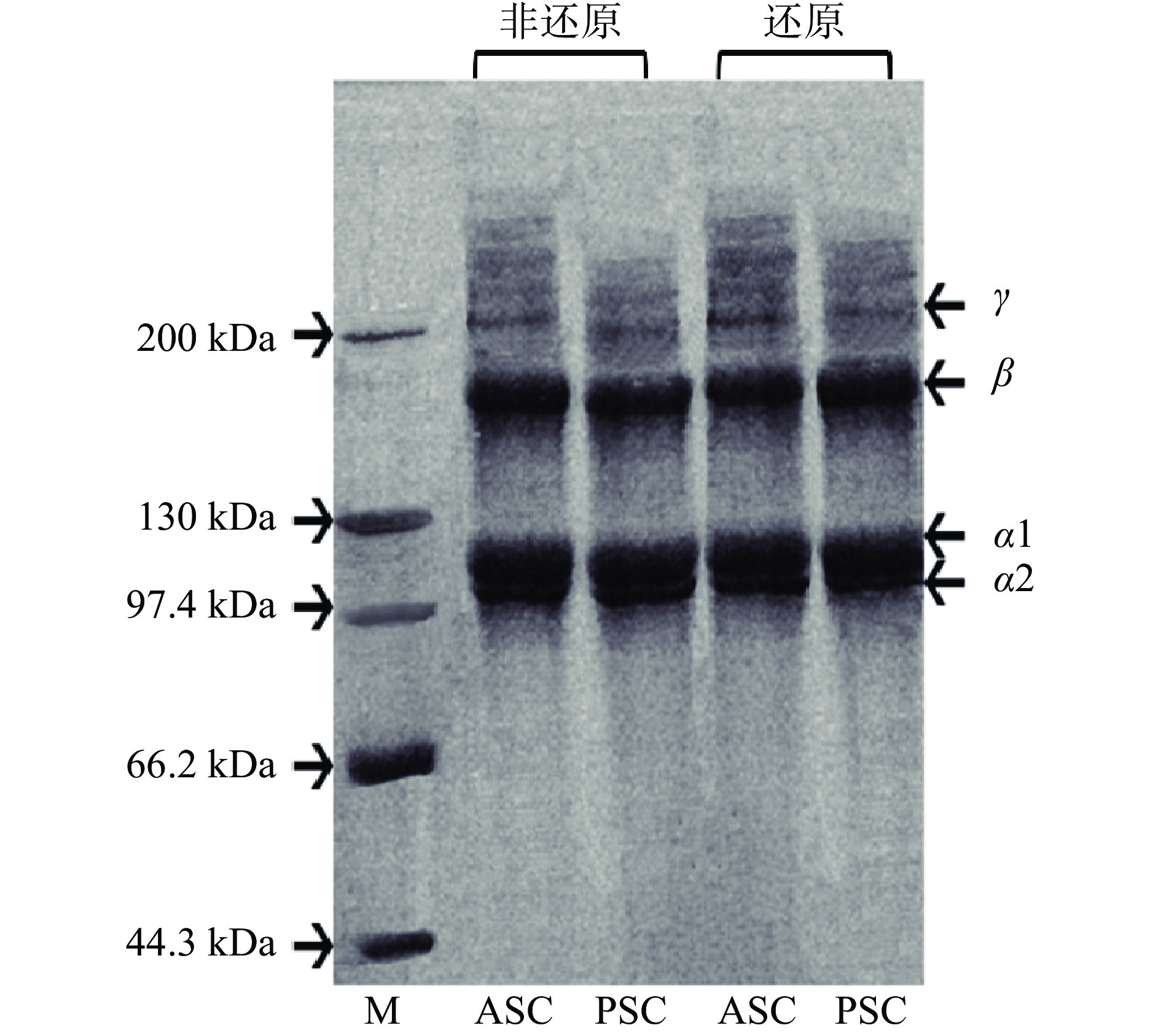
由图1可知,鹿角盘ASC和PSC具有极相似的蛋白谱图,图中主要由α1和α2、二聚体β链及三聚体γ链组成。而且α1链的含量要远大于α2链,二聚体β链含量较高,三聚体γ链含量较低。ASC中β链和γ链的条带强度比PSC稍高,可能是由于ASC中含有较高比例的分子间或分子内的交联成分。相比于ASC,PSC会有稍大的电泳迁移速率,这主要是因为胃蛋白酶会定位切割蛋白中端肽部位的肽,因此会使PSC的分子量略小于ASC[21]。
比较还原和非还原条件下的蛋白电泳图,会发现不同条件下的条带几乎一样。可以得出β-巯基乙醇对ASC和PSC的SDS-PAGE谱图无影响。胶原蛋白中不含有二硫键,这也印证了表3的氨基酸组成的结论,即并没有检测到含硫氨基酸—Cys。
2.1.3 胶原蛋白傅里叶变换红外光谱(FTIR)分析
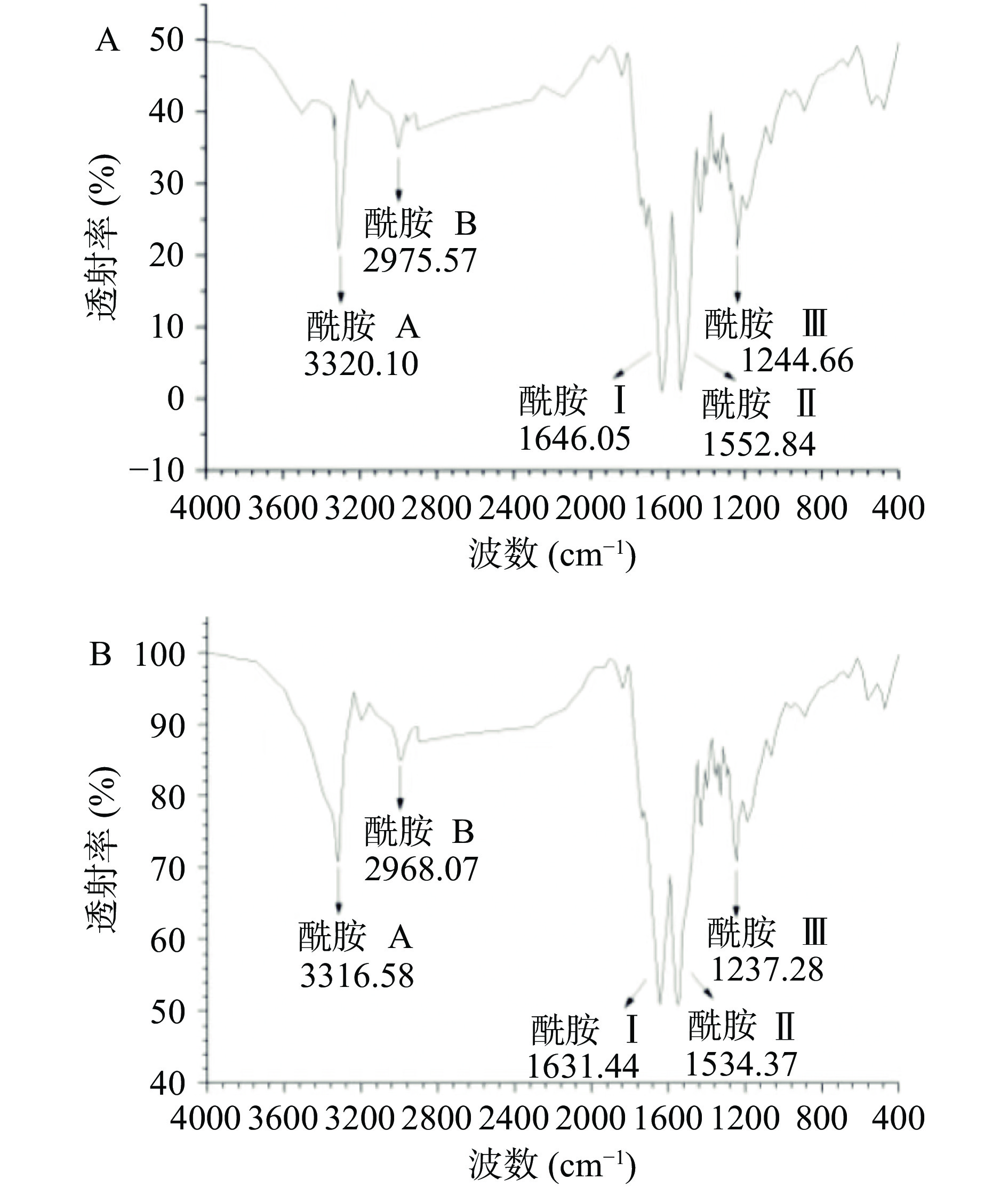
如图2 A、B所示,除个别特征吸收峰存在吸收强度的微小差别外,二者的特征吸收峰基本一样。由酰胺A谱可以证明三螺旋之间氢键的存在。酰胺Ⅰ谱带与蛋白的二级结构密切相关,同时跟酰胺Ⅲ带一起证明了三螺旋完整结构的存在[22]。因此,红外光谱图图谱也表明了鹿角盘胶原蛋白很好地保留了三螺旋构型,是后续理化性质准确测定的重要前提。
表4为鹿角盘ASC和PSC的红外光谱的特征吸收峰位置及相关说明。由N-H的伸缩振动而产生的酰胺A,其吸收峰一般出现在3400~3450 cm−1之间。一旦蛋白中的N-H基团与氢键缔合,N-H的伸缩振动便会向低频率移动,对应的波数会发生位移,一般在3300 cm−1左右[23]。FTIR图谱表明,ASC和PSC分别位于3320.10、3316.58 cm−1处的吸收峰是由酰胺A的N-H的伸缩振动与氢键的缔合所引起的。酰胺A与酰胺Ⅱ带的泛频耦合,即发生费米共振,分子中CH2基团的不对称伸缩振动则会产生酰胺B带[24],一般出现在3000 cm−1附近。ASC和PSC酰胺B的较弱吸收峰分别位于2975.57、2968.07 cm−1处。
表 4 鹿角盘ASC和PSC的红外光谱吸收峰位置以及相关说明Table 4. Spectra peak locations of FTIR and assignment of ASC and PSC from deer antler base波数(cm−1) 说明 ASC PSC 酰胺A 3320.10 3316.58 N-H伸缩振动和与氢键的缔合 酰胺B 2975.57 2968.07 CH2不对称伸缩振动 酰胺Ⅰ 1646.05 1631.44 C=O伸缩振动 酰胺Ⅱ 1552.84 1534.37 N-H弯曲振动和C-N伸缩振动 酰胺Ⅲ 1244.66 1237.28 N-H变形 在双键区(2000~1500 cm−1),酰胺Ⅰ谱带特征吸收波数通常在1625~1690 cm−1,是由C=O伸缩振动引起,其吸收峰最强,ASC和PSC分别在1646.05、1631.44 cm−1处存在较强的吸收。C=O的伸缩振动只取决于肽链的构型,不受肽链侧基的影响,故其对胶原的三螺旋结构较为敏感,与胶原蛋白的二级结构关系密切[25]。由异相N-H面内弯曲振动和具有双键性质的C-N伸缩振动共同作用产生的酰胺Ⅱ带,不易受肽链侧基影响[26]。ASC和PSC分别位于1552.84、1534.37 cm−1,因此它是由N-H弯曲振动以及C-N伸缩振动引起。酰胺Ⅲ是由N-H变形振动所引起的,位于1200~1400 cm−1左右,是由于Gly骨架和Pro侧链的CH2摇摆振动所产生的,证明了胶原蛋白螺旋结构的存在[27]。ASC和PSC的N-H的变形峰分别位于1244.66、1237.28 cm−1处。
2.1.4 胶原蛋白紫外扫描分析
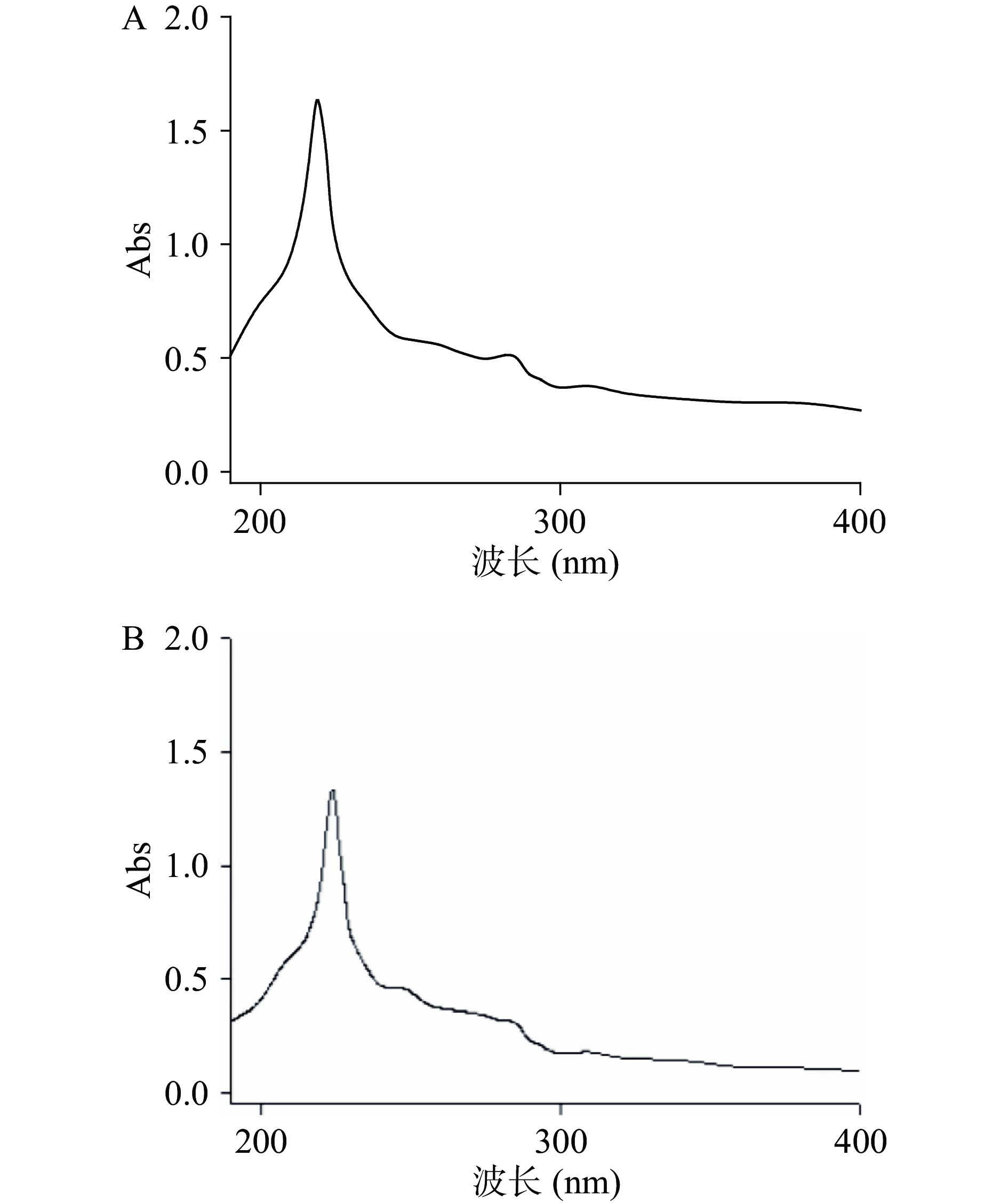
由图3A、B可知胶原蛋白在280 nm处并无最大吸收峰,表明Try、Tyr和Phe等芳香族氨基酸的比例非常小,符合Ⅰ型胶原蛋白特征[28]。胶原蛋白肽键中存在羰基等生色基团。具体表现为在200~230 nm有强吸收峰,219.0 nm和224.0 nm分别是鹿角盘ASC和PSC的最大吸收峰处。二者最大吸收峰存在一定差异,可能是其氨基酸组成及结构不同所导致,与其他相关文献所报道中华鲟胶原蛋白的紫外光谱在230 nm处左右达到最大吸收峰值结论相一致[29]。
2.2 梅花鹿角盘胶原蛋白理化性质分析
2.2.1 梅花鹿角盘胶原蛋白的溶解度
2.2.1.1 pH对胶原蛋白溶解度的影响
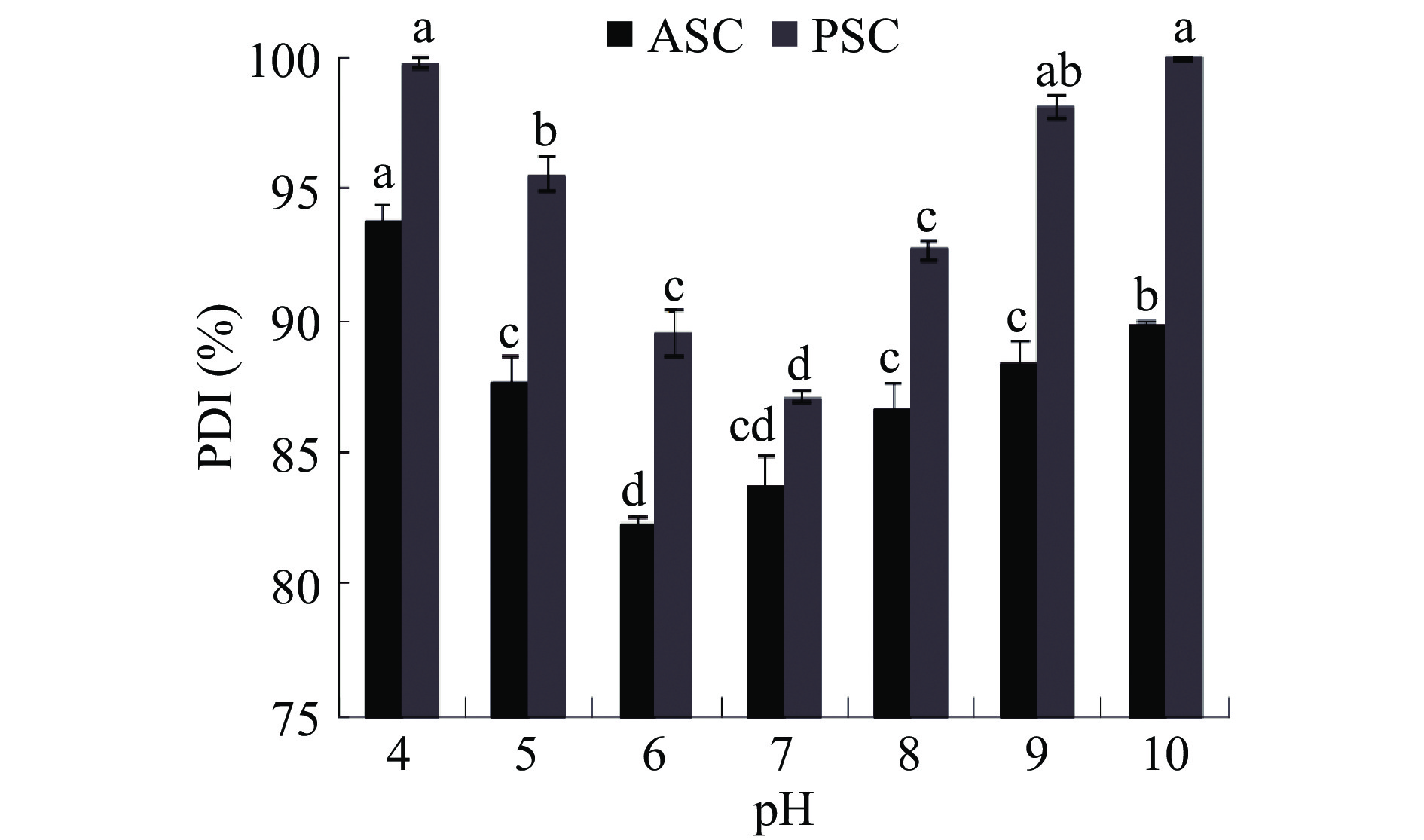
比较pH分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0时对胶原蛋白溶解度的影响,结果如图4所示。通过实验测定,ASC等电点是6.4±0.1,PSC等电点是6.9±0.1。ASC和PSC的溶解度均在pI附近达到最低值。因为当pH处于pI时,胶原蛋白主要以两性离子状态存在,静电荷为零,相邻蛋白质分子间的静电力最小,使蛋白质分子易于结聚而产生沉淀,因此溶解度最低(P<0.05)。当 pH 分别为 4 和 10 时,ASC 和 PSC 溶解性均较好(P<0.05),这是因为此时胶原蛋白分子自身带有一定量的正电荷或负电荷,呈现出复杂的阳离子或阴离子状态,分子之间存在互相排斥力,阻止了单分子结聚成沉淀物,从而使胶原蛋白分子具有良好的分散性,溶解度也随之增大[30]。
2.2.1.2 NaCl浓度对胶原蛋白溶解度的影响
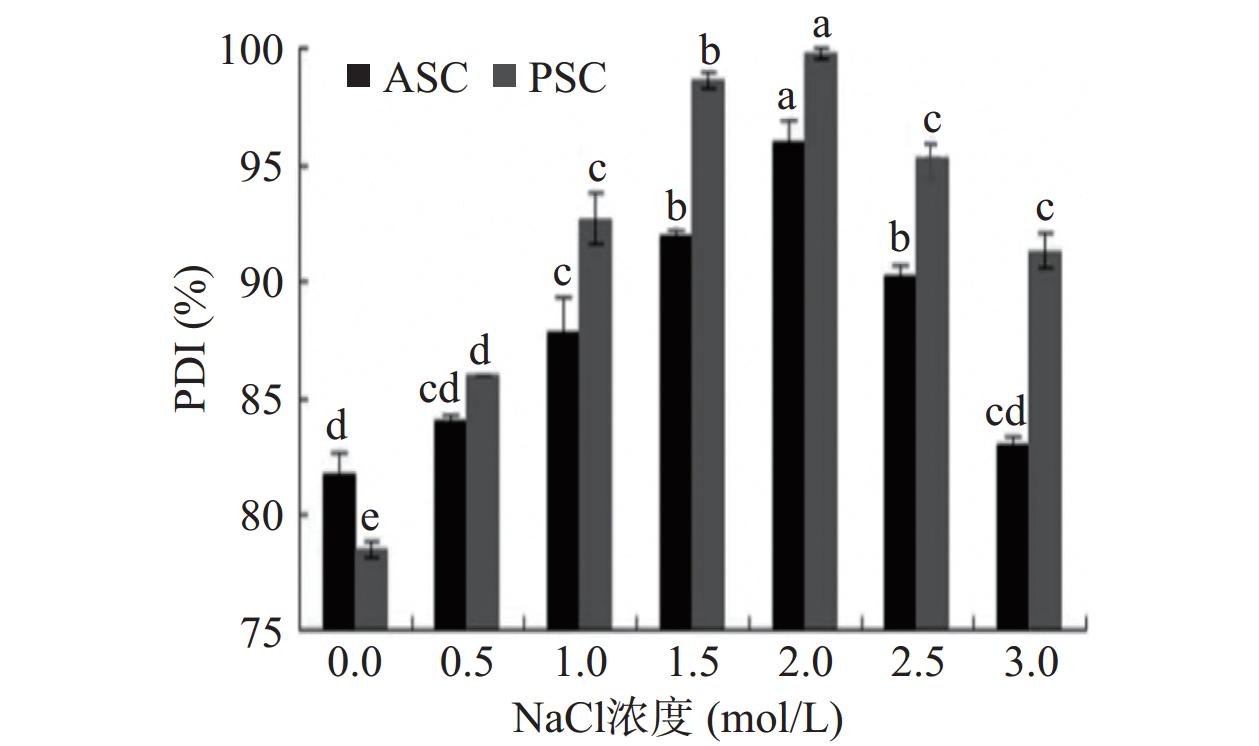
将配制好的梅花鹿角盘ASC和PSC溶液5 mL与浓度分别为0.5、1.0、1.5、2.0、2.5和3.0 mol/L的NaCl溶液混合后,比较其溶解度的变化,结果如图5所示。当NaCl浓度为0~2 mol/L时,增加盐量可以增大胶原蛋白在水中的溶解度,即“盐溶”现象[31]。此时盐浓度对PSC溶解度的影响显著大于对ASC的影响(P<0.05),使其所带的正电荷逐渐增强,增大了相互间的排斥力,蛋白质的结构趋于稳定且具有较好的分散性,增大了胶原蛋白的溶解度[32]。当NaCl浓度大于2 mol/L时,二者的溶解度均随盐浓度的增大而下降,即“盐析”现象。这是因为盐类解离出的高浓度的盐离子,同周围水分子结合形成一层水化膜,降低了胶原蛋白的水合作用,引发脱水而析出沉淀,从而减小了胶原蛋白的溶解度(P<0.05)[33]。
2.2.2 梅花鹿角盘胶原蛋白的起泡性和泡沫稳定性
2.2.2.1 pH对胶原蛋白起泡性和泡沫稳定性的影响
比较pH分别为4、5、6、7、8和9时,对胶原蛋白起泡性和泡沫稳定性的影响,结果如图6所示。梅花鹿角盘ASC和PSC在接近pI(6.4±0.1和6.9±0.1)时,两者所形成的泡沫体系很稳定(P<0.05)。这是由于胶原蛋白分子间的排斥力很小,静电吸引作用却很大,会提高被吸附在气/液界面上蛋白膜的厚度和硬度,利于蛋白与蛋白之间的相互作用及蛋白在膜上的吸附作用,从而形成黏稠的吸附膜,提高胶原蛋白的起泡性和泡沫稳定性[34]。即使胶原蛋白在pI处不溶解,只有很少的蛋白参与泡沫形成,泡沫稳定性仍然可以提高。因为不溶部分的胶原蛋白对泡沫形成虽然没有贡献,但却可以增加蛋白膜的黏度,从而间接提高泡沫稳定性。在非pI时,ASC和PSC其泡沫稳定性显著降低(P<0.05)。
2.2.2.2 NaCl浓度对胶原蛋白起泡性和泡沫稳定性的影响
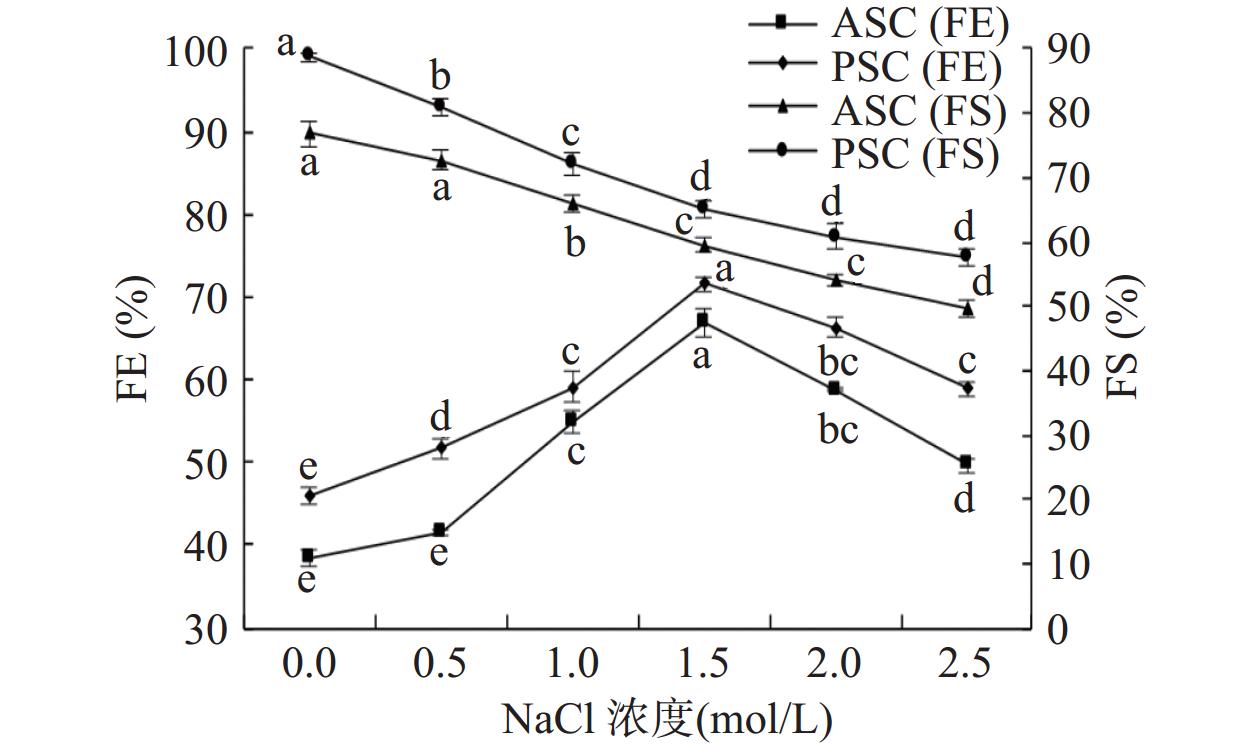
比较NaCl溶液浓度分别为0、0.5、1.0、1.5、2.0和2.5 mol/L时,对胶原蛋白起泡性和泡沫稳定性的影响,结果如图7所示。NaCl的添加可提高梅花鹿角盘ASC和PSC的起泡性能,可能是其有助于提高胶原蛋白溶液黏度的原因。当NaCl浓度为0.5~1.5 mol/L时,钠离子能同蛋白中的羧基形成盐桥而显著降低了胶原蛋白泡沫的稳定性(P<0.05)[35]。
2.2.3 梅花鹿角盘胶原蛋白的乳化性和乳化稳定性
2.2.3.1 pH对胶原蛋白乳化性和乳化稳定性的影响
比较pH分别为4、5、6、7、8和9时对胶原蛋白乳化性和乳化稳定性的影响,结果如图8所示。梅花鹿角盘ASC和PSC的pH处于pI时,其乳化能力和乳化稳定性达到最低值(P<0.05),偏离pI时,均具有较高的乳化性和乳化稳定性,PSC的乳化性略高于ASC,可能是因为PSC的氨基酸侧链发生解离,产生了静电斥力,利于乳浊液的稳定。ASC的乳化稳定性高于PSC,可能因为此时的条件有利于胶原蛋白的溶解,并提高胶原蛋白对水的结合能力,进而提高了蛋白膜的乳化稳定性[36]。
2.2.3.2 NaCl浓度对胶原蛋白乳化性和乳化稳定性的影响
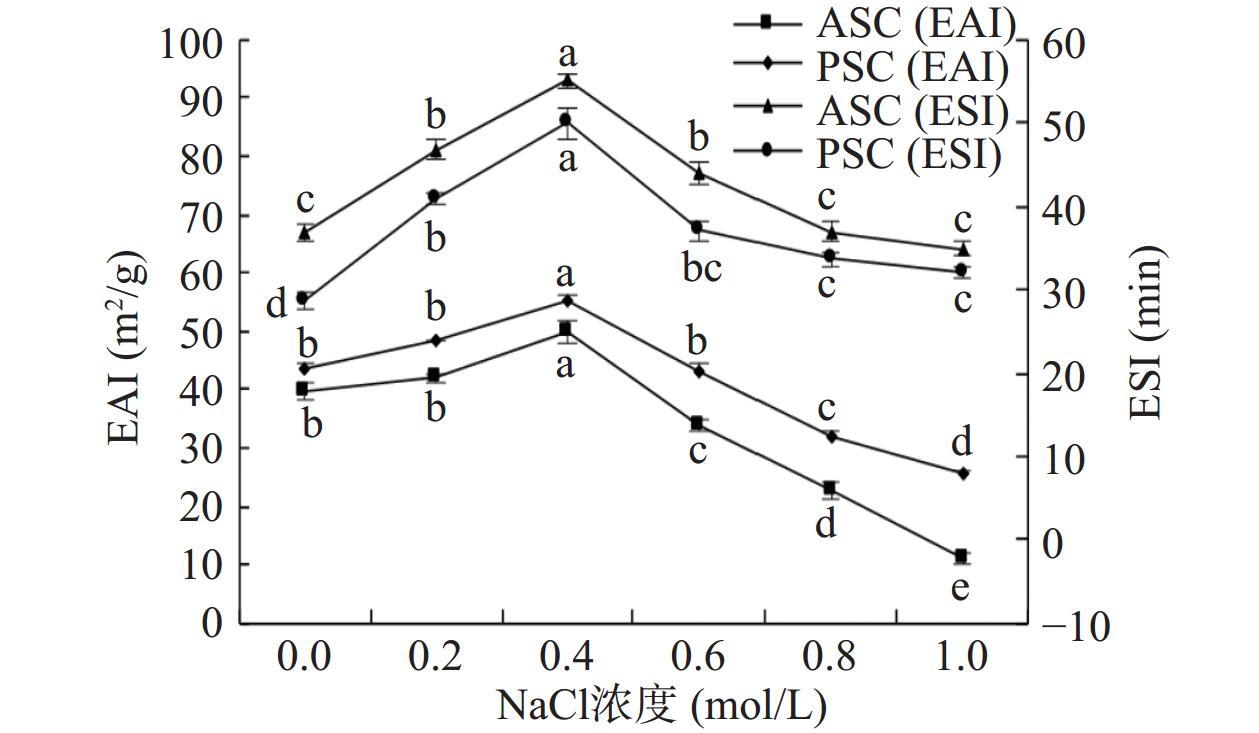
比较NaCl溶液浓度分别为0、0.2、0.4、0.6、0.8和1.0 mol/L时,对胶原蛋白乳化性和乳化稳定性的影响,结果如图9所示。适当的NaCl浓度会降低胶原分子间的斥力,促进盐溶,从而进一步提高胶原蛋白的乳化性和乳化稳定性;但当NaCl浓度过大时,电离后的离子会降低乳液表面电位,斥力能垒也随之下降,反而会对乳化性和乳化稳定性产生不利影响。在NaCl浓度在0~0.4 mol/L范围内,能促进梅花鹿角盘ASC和PSC溶解能力的提高,造成乳化性和乳化稳定性呈显著增加的趋势(P<0.05);当浓度大于0.4 mol/L时,梅花鹿角盘ASC和PSC的乳化性和乳化稳定性随NaCl浓度的增大而缓慢下降(P<0.05)[37]。
2.2.3.3 蛋白浓度对胶原蛋白乳化性和乳化稳定性的影响
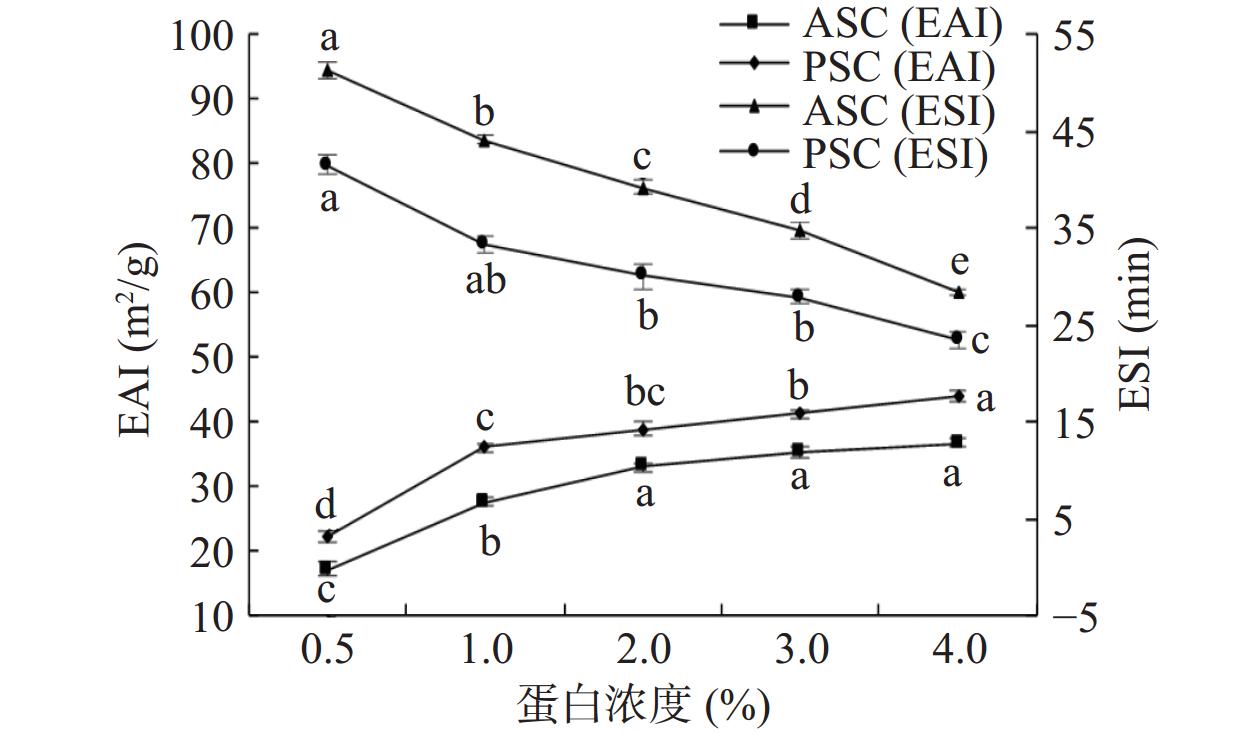
比较蛋白浓度分别为0.5%、1%、2%、3%、和4%时,对胶原蛋白乳化性和乳化稳定性的影响,结果如图10所示。在蛋白浓度0.5%~2%时,梅花鹿角盘ASC和PSC的乳化性显著增大(P<0.05)。浓度大于2%时,增长幅度缓慢,基本保持平稳状态(P>0.05)。这是因为当蛋白浓度超过一定值,吸附层不再有明显变化,使得膜厚度和强度增加幅度减小[38]。相反ASC和PSC的乳化稳定性随着蛋白浓度的增大而降低,在蛋白浓度0.5%时,两者的乳化稳定性最大,蛋白浓度4%时,两者的乳化稳定性最小(P<0.05)[39]。
3. 结论
梅花鹿角盘ASC和PSC符合Ⅰ型胶原蛋白氨基酸的特征分布。其中蛋氨酸含量最低。ASC和PSC的羟基化程度较高,分别为45.69%和46.30%。ASC和PSC至少由两条α链(α1和α2)组成,β链含量较高,并含有少量的γ链。胶原蛋白分子量约为110 kDa,说明鹿角盘胶原蛋白为Ⅰ型胶原蛋白且达到电泳纯。ASC和PSC二级结构相似,均出现酰胺A、B、Ⅰ、Ⅱ和Ⅲ的特征吸收峰,保存着三螺旋结构。ASC和PSC在280 nm处基本无吸收。其最大吸收峰位于219.0 nm和224.0 nm处。ASC和PSC溶液的pH越接近胶原蛋白pI,蛋白溶解性越小。当NaCl浓度为0~2 mol/L时,发生“盐溶”现象,ASC和PSC的溶解度随盐浓度增大而提高;浓度大于2 mol/L时,出现“盐析”现象,溶解度反而下降。梅花鹿角盘ASC和PSC溶液的pH越接近pI,其乳化能力和乳化稳定性越小。当NaCl浓度为0~2 mol/L时,增加盐量可以增大ASC和PSC的溶解性、起泡性;盐浓度在0~0.4 mol/L范围内,能提高ASC和PSC乳化性和乳化稳定性。蛋白浓度0.5%时,两者的乳化稳定性最大,蛋白浓度4%时,两者的乳化稳定性最小。梅花鹿角盘胶原蛋白结构及理化性质的研究为产品的开发奠定了理论基础。
-
表 1 SDS-PAGE 凝胶电泳配方
Table 1 Formula of SDS-polyacrylamide gel electrophoresis
7.5%分离胶 5%浓缩胶 Tris-HCl(mol·L−1) 1.5 0.5 缓冲液(mL) 2.5(pH8.8) 1.25(pH6.8) Acr/Bis存贮液(mL) 2.5 0.8 SDS(g) 0.04 0.02 TMEDA (μL) 5 5 10% APS(μL) 50 25 总体积(mL) 10 5 表 2 还原和非还原上样缓冲液
Table 2 Sample buffer of reduction and non-reduction
2倍还原缓冲液 2倍非还原缓冲液 去离子水(mL) 1 − β-巯基乙醇(mL) − 1 0.5 mol/L Tris-HCl(pH6.8)(mL) 2.5 2.5 甘油(mL) 2 2 10% SDS(mL) 4 4 0.1%溴酚蓝(mL) 0.5 0.5 总体积(mL) 10 10 表 3 梅花鹿角盘ASC和PSC的氨基酸组成(残基数/1000个残基)
Table 3 Amino acid composition of ASC and PSC from deer antler base (residues/1000 residues)
氨基酸名称 ASC PSC 天门冬氨酸 (Asp) 57 54 苏氨酸 (Thr) 118 111 丝氨酸 (Ser) 26 27 谷氨酸 (Glu) 109 100 脯氨酸 (Pro) 82 87 甘氨酸 (Gly) 184 195 丙氨酸 (Ala) 87 90 羟脯氨酸 (Hyp) 69 75 缬氨酸 (Val) 31 33 蛋氨酸 (Met) 12 10 异亮氨酸 (Ile) 35 38 亮氨酸 (Leu) 16 21 酪氨酸 (Tyr) 17 15 苯丙氨酸 (Phe) 32 26 赖氨酸 (Lys) 43 41 组氨酸 (His) 10 14 精氨酸 (Arg) 72 63 氨基酸总量 1000 1000 亚氨基酸 151 162 表 4 鹿角盘ASC和PSC的红外光谱吸收峰位置以及相关说明
Table 4 Spectra peak locations of FTIR and assignment of ASC and PSC from deer antler base
波数(cm−1) 说明 ASC PSC 酰胺A 3320.10 3316.58 N-H伸缩振动和与氢键的缔合 酰胺B 2975.57 2968.07 CH2不对称伸缩振动 酰胺Ⅰ 1646.05 1631.44 C=O伸缩振动 酰胺Ⅱ 1552.84 1534.37 N-H弯曲振动和C-N伸缩振动 酰胺Ⅲ 1244.66 1237.28 N-H变形 -
[1] 关晴, 赵海平, 李春义, 等. 鹿角盘化学成分、药理作用及应用现状的研究进展[J]. 特产研究,2018,40(4):119−123. [GUAN Qing, ZHAO Haiping, LI Chunyi, et al. Research progress on the chemical composition, pharmacological effects, and application status of deer antler discs[J]. Specialty Research,2018,40(4):119−123. doi: 10.16720/j.cnki.tcyj.2018.04.023 GUAN Qing, ZHAO Haiping, LI Chunyi, et al . Research progress on the chemical composition, pharmacological effects, and application status of deer antler discs[J]. Specialty Research,2018 ,40 (4 ):119 −123 . doi: 10.16720/j.cnki.tcyj.2018.04.023[2] 王佳宁, 郜玉钢, 姬庆, 等. 鹿角盘有效成分及功效研究进展[J]. 上海中医药杂志,2015,49(4):102−105. [WANG Jianing, GAO Yugang, JI Qing, et al. Research progress on active ingredient and efficacy of antler plate[J]. Shanghai Journal of Traditional Chinese Medicine,2015,49(4):102−105. doi: 10.16305/j.1007-1334.2015.04.033 WANG Jianing, GAO Yugang, JI Qing, et al . Research progress on active ingredient and efficacy of antler plate[J]. Shanghai Journal of Traditional Chinese Medicine,2015 ,49 (4 ):102 −105 . doi: 10.16305/j.1007-1334.2015.04.033[3] 吴菲菲, 金礼吉, 李化强, 等. 鹿角盘天然活性成分和药理功能研究的新进展[J]. 黑龙江畜牧兽医,2013,35(1):23−25. [WU Feifei, JIN Liji, LI Huaqiang, et al. New progress in the study of natural active ingredients and pharmacological functions of deer antler discs[J]. Heilongjiang Animal Science and Veterinary Medicine,2013,35(1):23−25. doi: 10.13881/j.cnki.hljxmsy.2013.01.009 WU Feifei, JIN Liji, LI Huaqiang, et al . New progress in the study of natural active ingredients and pharmacological functions of deer antler discs[J]. Heilongjiang Animal Science and Veterinary Medicine,2013 ,35 (1 ):23 −25 . doi: 10.13881/j.cnki.hljxmsy.2013.01.009[4] 李月, 陈丹阳, 王懿璞, 等. 梅花鹿鹿角盘胶原肽制备及其活性作用研究[J]. 上海中医药杂志,2020,54(7):80−85. [LI Yue, CHEN Danyang, WANG Yipu, et al. Study on the preparation and activity of collagen peptide from sika deer antler disk[J]. Shanghai Journal of Traditional Chinese Medicine,2020,54(7):80−85. doi: 10.16305/j.1007-1334.2020.07.012 LI Yue, CHEN Danyang, WANG Yipu, et al . Study on the preparation and activity of collagen peptide from sika deer antler disk[J]. Shanghai Journal of Traditional Chinese Medicine,2020 ,54 (7 ):80 −85 . doi: 10.16305/j.1007-1334.2020.07.012[5] 张旭霞, 田玉华, 齐琳, 等. 梅花鹿鹿角脱盘化学成分的研究[J]. 吉林畜牧兽医,2013,34(8):11−16. [ZHANG Xuxia, TIAN Yuhua, QI Lin, et al. Studies on the chemical constituents of sika deer antlers[J]. Jilin Animal Husbandry and Veterinary Medicine,2013,34(8):11−16. doi: 10.3969/j.issn.1672-2078.2013.08.003 ZHANG Xuxia, TIAN Yuhua, QI Lin, et al . Studies on the chemical constituents of sika deer antlers[J]. Jilin Animal Husbandry and Veterinary Medicine,2013 ,34 (8 ):11 −16 . doi: 10.3969/j.issn.1672-2078.2013.08.003[6] 卫功庆, 刘少华, 陈大勇, 等. 鹿产品中胶原蛋白的研究及应用进展[J]. 经济动物学报,2014,18(2):116−120. [WEI Gongqing, LIU Shaohua, CHEN Dayong, et al. Research and application progress of collagen in deer products[J]. Economic Current Zoology,2014,18(2):116−120. doi: 10.13326/j.jea.2014.0026 WEI Gongqing, LIU Shaohua, CHEN Dayong, et al . Research and application progress of collagen in deer products[J]. Economic Current Zoology,2014 ,18 (2 ):116 −120 . doi: 10.13326/j.jea.2014.0026[7] 皮钰珍, 王雨施, 何建斌, 等. 梅花鹿鹿角盘多肽双酶水解工艺及优化研究[J]. 食品工业科技,2015,36(22):203−208. [PI Yuzhen, WANG Yushi, HE Jianbin, et al. Study on double enzymatic hydrolysis technology and optimization of sika deer antler plate polypeptide[J]. Science and Technology of Food Industry,2015,36(22):203−208. doi: 10.13386/j.issn1002-0306.2015.22.034 PI Yuzhen, WANG Yushi, HE Jianbin, et al . Study on double enzymatic hydrolysis technology and optimization of sika deer antler plate polypeptide[J]. Science and Technology of Food Industry,2015 ,36 (22 ):203 −208 . doi: 10.13386/j.issn1002-0306.2015.22.034[8] PHANAT K, SOOTTAWAT B, WONNOP V, et al. Isolation and characterization of collagen from the skin of brownbanded bamboo shark ( Chiloscyllium punctatum)[J]. Food Chemistry,2010,b,119:1519−1526.
[9] 包玉龙, 陈孙福, 罗永康. 酸法和酶法提取鳄鱼皮胶原蛋白及性质研究[J]. 肉类研究,2012,26(7):1−4. [BAO Yulong, CHEN Sunfu, LUO Yongkang. Extraction and properties of crocodile skin collagen by acid and enzyme methods[J]. Research on Rabbit Meat Products,2012,26(7):1−4. BAO Yulong, CHEN Sunfu, LUO Yongkang . Extraction and properties of crocodile skin collagen by acid and enzyme methods[J]. Research on Rabbit Meat Products,2012 ,26 (7 ):1 −4 .[10] 张强, 黄鑫, 符安卫, 等. 中华鳖裙边胶原蛋白的提取、鉴定及其理化性质[J]. 食品与发酵工业,2019,45(12):176−182. [ZHANG Qiang, HUANG Xin, FU Anwei, et al. Extraction, identification and physicochemical properties of collagen from turtle skirt[J]. Food and Fermentation Industry,2019,45(12):176−182. doi: 10.13995/j.cnki.11-1802/ts.019442 ZHANG Qiang, HUANG Xin, FU Anwei, et al . Extraction, identification and physicochemical properties of collagen from turtle skirt[J]. Food and Fermentation Industry,2019 ,45 (12 ):176 −182 . doi: 10.13995/j.cnki.11-1802/ts.019442[11] KAEWDANG O, BENJAKUL S, KAEWMANEE T, et al. Characteristics of collagens from the swim bladders of yellowfin tuna ( Thunnus albacares)[J]. Food Chemistry,2014,155(15):264−270.
[12] 于颖, 肖刚, 陈晚华, 等. 鱼皮胶原蛋白的提取工艺及特性研究[J]. 上海医药,2019,40(3):70−73. [YU Ying, XIAO Gang, CHEN Wanhua, et al. Study on the extraction process and characteristics of collagen from fish skin[J]. Shanghai Pharmaceutical,2019,40(3):70−73. doi: 10.3969/j.issn.1006-1533.2019.03.024 YU Ying, XIAO Gang, CHEN Wanhua, et al . Study on the extraction process and characteristics of collagen from fish skin[J]. Shanghai Pharmaceutical,2019 ,40 (3 ):70 −73 . doi: 10.3969/j.issn.1006-1533.2019.03.024[13] TANAKA T, TAKAHASHI K, TSUBAKI K, et al. Isolation and characterization of acid-soluble bluefin tuna ( Thunnus orientalis) skin collagen[J]. Fisheries and Aquatic Sciences,2018,21(1):712−724.
[14] CHEN J D, LI J Y, LI Z B, et al. Physicochemical and functional properties of type I collagens in red stingray ( Dasyatis akajei) skin[J]. Marine Drugs,2019,17(10):558−567. doi: 10.3390/md17100558
[15] CAO W, SHI L, WENG W, et al. Histological distribution and characterization of collagen in European eel ( Anguilla anguilla) muscle[J]. Journal of Aquatic Food Product Technology,2019,29(1):211−221.
[16] MATMROH K, BENJAKUL S, PRODPRAN T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish ( Parupeneus heptacanthus)[J]. Food Chemistry,2011,129(3):1179−1186. doi: 10.1016/j.foodchem.2011.05.099
[17] 赵玉红, 金秀明, 王珊珊, 等. 不同生长阶段鹿茸中胶原含量比较及提取条件优化[J]. 食品科学,2012,33(10):67−71. [ZHAO Yuhong, JIN Xiuming, WANG Shanshan, et al. Comparison of collagen content in deer antler at different growth stages and optimization of extraction conditions[J]. Food Science,2012,33(10):67−71. ZHAO Yuhong, JIN Xiuming, WANG Shanshan, et al . Comparison of collagen content in deer antler at different growth stages and optimization of extraction conditions[J]. Food Science,2012 ,33 (10 ):67 −71 .[18] 赵玉红, 金秀明. 梅花鹿鹿茸胶原的理化特性研究[J]. 食品科学,2012,33(11):75−78. [ZHAO Yuhong, JIN Xiuming. Study on physicochemical properties of sika deer antler collagen[J]. Food Science,2012,33(11):75−78. ZHAO Yuhong, JIN Xiuming . Study on physicochemical properties of sika deer antler collagen[J]. Food Science,2012 ,33 (11 ):75 −78 .[19] DENG Y J, HUANG L X, ZHANG C H, et al. Physicochemical and functional properties of Chinese quince seed protein isolate[J]. Food Chemistry,2019,283(3):539−548.
[20] JONGJAREONRAK A, BENJAKUL S, VISESSANGUAN W, et al. Isolation and characterization of acid and pepsin-solubilized collagens from the skin of brown stripe red snapper ( Lutjanus vitta)[J]. Food Chemistry,2005,93(5):475−484.
[21] NALINANON S, BENJAKUL S, VISESSANGUAN W, et al. Use of pepsin for collagen extraction from the skin of big eye snapper ( Priacanthus tayenus)[J]. Food Chemistry,2007,104(8):593−601.
[22] SUNGPERM P, KHONGLA C, YONGSAWATDIGUL J, et al. Physicochemical properties and angiotensin I converting enzyme inhibitory peptides of freshwater fish skin collagens[J]. Journal of Aquatic Food Product Technology,2020,29(7):650−660. doi: 10.1080/10498850.2020.1788683
[23] YAN M Y, LI B F, ZHAO X, et al. Characterization of acid-soluble collagen from the skin of walleye pollock ( Theragra chalcogramma)[J]. Food Chemistry,2008,107:1581−1586. doi: 10.1016/j.foodchem.2007.10.027
[24] ABE Y, KRIMM S. Normal vibrations of crystalline poly glycine I[J]. Biopolymers-Peptide Science,1972,11:1817−1839. doi: 10.1002/bip.1972.360110905
[25] 黄利华, 梁兰兰. 水产加工副产物高值化利用的研究现状与展望[J]. 食品安全导刊,2019(30):155−157. [HUANG Lihua, LIANG Lanlan. Research status and prospect of high-value utilization of aquatic products[J]. China Food Safety Magazine,2019(30):155−157. doi: 10.16043/j.cnki.cfs.2019.30.122 HUANG Lihua, LIANG Lanlan . Research status and prospect of high-value utilization of aquatic products[J]. China Food Safety Magazine,2019 (30 ):155 −157 . doi: 10.16043/j.cnki.cfs.2019.30.122[26] LIU H Y, LI D, GUO S D. Studies on collagen from the skin of channel catfish ( Ictalurus punctaus)[J]. Food Chemistry,2007,101:621−625. doi: 10.1016/j.foodchem.2006.01.059
[27] MUYONGA J H, COLE C G B, DUODU K G. Characterization of acid soluble collagen from skins of young and adult Nile perch ( Lates niloticus)[J]. Food Chemistry,2004,a,85:81−89.
[28] DUAN R, ZHANG J J, DU X Q. et al. Properties of collagen from skin, scale and bone of carp ( Cyprinus carpio)[J]. Food Chemistry,2009,112:702−706. doi: 10.1016/j.foodchem.2008.06.020
[29] LUO Q B, CHI C F, YANG F, et al. Physicochemical properties of acid- and pepsin-soluble collagens from the cartilage of Siberian sturgeon[J]. Environmental Science and Pollution Research,2018,25(31):31427−31438. doi: 10.1007/s11356-018-3147-z
[30] WOO J W, YU S J, CHO S M, et al. Extraction optimization and properties of collagen from yellowfin tuna ( Thunnus albacares) dorsal skin[J]. Food Hydrocolloids,2008,22(5):879−887. doi: 10.1016/j.foodhyd.2007.04.015
[31] 陈丽丽. 鮰鱼皮中胶原蛋白的提取、性质及其应用研究[D]. 南昌:江西科技师范大学, 2012:20−30. [CHEN Lili. Extraction, properties, and application of collagen from channel fish skin[D]. Nanchang:Jiangxi Science and Technology Normal University, 2012:20−30. CHEN Lili. Extraction, properties, and application of collagen from channel fish skin[D]. Nanchang: Jiangxi Science and Technology Normal University, 2012: 20−30.
[32] TANG Y P, JIN S J, LI X Y. et al. Physicochemical properties and biocompatibility evaluation of collagen from the skin of giant croaker ( Nibea japonica)[J]. Marine Drugs,2018,16(7):222−229. doi: 10.3390/md16070222
[33] TAKESHI N, SUZUKI N, TANOUE Y, et al. Collagen from tendon of Yezo sika deer ( Cervus nippon yesoensis) as by-product[J]. Food Science & Nutrition,2012,3(1):72−79.
[34] SUKERI N, SAMPATH K N S, SHAIK M I, et al. Extractability and physicochemical properties of cobia ( Rachycentron canadum) skin collagen as influenced by lactic acid concentration[J]. Journal of Food Processing and Preservation,2020,45(1):615−622.
[35] 黎彩, 陈春松, 任涛, 等. pH和甜味剂对胶原蛋白溶液稳定性的影响[J]. 食品工业,2017,38(2):32−35. [LI Cai, CHEN Chunsong, REN Tao, et al. The effect of pH and sweeteners on the stability of collagen solution[J]. Food Industry,2017,38(2):32−35. LI Cai, CHEN Chunsong, REN Tao, et al . The effect of pH and sweeteners on the stability of collagen solution[J]. Food Industry,2017 ,38 (2 ):32 −35 .[36] 高玲玲, 侯成立, 高远, 等. 胶原蛋白热稳定性研究进展[J]. 中国食品学报,2018,18(5):195−207. [GAO Lingling, HOU Chengli, GAO Yuan, et al. Research progress on thermal stability of collagen protein[J]. Journal of China Foods Limited,2018,18(5):195−207. doi: 10.16429/j.1009-7848.2018.05.024 GAO Lingling, HOU Chengli, GAO Yuan, et al . Research progress on thermal stability of collagen protein[J]. Journal of China Foods Limited,2018 ,18 (5 ):195 −207 . doi: 10.16429/j.1009-7848.2018.05.024[37] 康俊霞, 康永锋, 包斌, 等. Na+、Ca2+和pH值对鲸鲨皮胶原蛋白热变性温度的影响[J]. 食品科学,2011,32(13):66−70. [KANG Junxia, KANG Yongfeng, BAO Bin, et al. The Effects of Na+, Ca2+, and pH values on the thermal denaturation temperature of collagen from whale shark skin[J]. Food Science,2011,32(13):66−70. KANG Junxia, KANG Yongfeng, BAO Bin, et al . The Effects of Na+, Ca2+, and pH values on the thermal denaturation temperature of collagen from whale shark skin[J]. Food Science,2011 ,32 (13 ):66 −70 .[38] 张桂艳, 祝超智, 茹昂, 等. 胶原蛋白乳化特性影响因素的研究进展[J]. 肉类研究,2020,34(10):82−87. [ZHANG Guiyan, ZHU Chaozhi, RU Ang, et al. Research progress on influencing factors of collagen emulsifying properties[J]. Research on Rabbit Meat Products,2020,34(10):82−87. doi: 10.7506/rlyj1001-8123-20200901-213 ZHANG Guiyan, ZHU Chaozhi, RU Ang, et al . Research progress on influencing factors of collagen emulsifying properties[J]. Research on Rabbit Meat Products,2020 ,34 (10 ):82 −87 . doi: 10.7506/rlyj1001-8123-20200901-213[39] 缪楠. 鲫鱼皮胶原蛋白理化性质及其自组装行为研究[D]. 镇江:江苏科技大学, 2019:35−42. [MIAO Nan. Study on the physicochemical properties and self-assembly behavior of collagen from crucian carp skin[D]. Zhenjiang:Jiangsu University of Science and Technology, 2019:35−42. MIAO Nan. Study on the physicochemical properties and self-assembly behavior of collagen from crucian carp skin[D]. Zhenjiang: Jiangsu University of Science and Technology, 2019: 35−42.





 下载:
下载:


 下载:
下载:
