Changes of Microorganisms and Flavor Compounds in the Fourth Round Jiupei of Sauce-flavored Baijiu in Beijing
-
摘要: 酱香型白酒具有典型酱香味,口感细腻,其发酵过程共有七个生产轮次,每轮次产生一种基酒,其中第四轮次酒风味物质丰富、品质极佳。发酵过程中微生物处于动态变化,风味物质各有差异,本文对第四轮次入窖酒醅中微生物变化及其对风味物质的影响进行研究。通过高通量测序对第四轮次发酵酒醅进行物种多样性分析,通过顶空固相微萃取结合气相色谱质谱分析技术对样品风味物质分析。结果表明,第四轮次入窖酒醅中优势细菌属为Lactobacillus(乳酸杆菌属)、Virgibacillus(枝芽孢杆菌属)和Kroppenstedtia(克罗彭斯特菌属),优势真菌属为Thermoascus(嗜热子囊菌属)、Aspergillus(曲霉属)和Issatchenkia(伊萨酵母属),在发酵中后期酒醅微生物呈现明显的动态变化;入窖酒醅中的醇类、酯类物质种类最为丰富,醇类、酯类、酸类化合物的相对含量随着入窖发酵时间的增加呈现先上升后下降的规律。本文对属水平真菌和细菌分别与风味物质进行关联性分析,发现Monascus(红曲霉属)、Lactobacillus和Wickerhamomyces(维克汉姆酵母)分别与白酒中关键风味物质乙酸乙酯、乳酸乙酯和己酸乙酯呈正相关,为酱香型白酒第四轮次发酵过程中的微生物以及风味物质与其他轮次的比较提供数据基础,为白酒品质提升提供理论依据。Abstract: Sauce-flavor Baijiu shows a typical sauce flavor, with a delicate mouthfeel. Its fermentation process consists of seven cycles, and each cycle produces one kind of base liquor. The fourth cycle liquor has a rich flavor and excellent quality. During the fermentation process, microorganisms are in a dynamic state, while flavor substances differ. This study investigated the microbial changes of Jiupei in the fourth cycle and their impact on flavor substances. Species diversity analysis was conducted on the fourth cycle Jiupei sample using high-throughput sequencing. Flavor substances were analyzed using headspace solid-phase microextraction combined with gas chromatography-mass spectrometry. Results showed that the dominant bacteria in the Jiupei were Lactobacillus, Virgibacillus, and Kroppenstedtia, while dominant fungi were Thermoascus, Aspergillus, and Issatchenkia. The microbial community in the Jiupei showed significant dynamic changes during the later stage of fermentation. The Jiupei showed the richest variety of alcohol and ester substances at the beginning of fermentation, with the relative content of alcohol, ester, and acid compounds showing a pattern of increasing firstly and then gradually decreased during fermentation. This study conducted a correlation analysis between fungi and bacteria at the genus level and flavor substances, revealing that Monascus, Lactobacillus, and Wickerhamomyces were positively correlated with key flavor substances, such as ethyl acetate, ethyl lactate, and ethyl hexanoate, respectively. The data provided a basis for comparing the microorganisms and flavor substances in the fourth cycle of sauce-flavor Baijiu, and offered a theoretical basis for improving the quality of Baijiu.
-
Keywords:
- sauce-flavor Baijiu /
- fourth round /
- microbial diversity /
- flavor substances
-
传统发酵白酒是中国特色蒸馏酒,生产历史悠久[1]。由于自然环境、原料、发酵剂的种类和生产工艺不同,白酒形成了许多风格独特的香型[2]。随着白酒研究的不断深入,人们也认识到不同香型白酒风味的形成与发酵微生物的组成和演替变化是紧密相关的。作为三大基本香型之一,酱香型白酒以优雅独特的酱香味著称[3],发酵过程需要一年时间,期间需要经历7轮次取酒[4]。普遍认为,第一轮、第二轮的基酒涩味大,这很可能是由于原料高粱中的化学物质单宁和多酚引起的,这些化学物质可以通过蒸馏迁移到基酒中,第三、第四和第五轮的基酒质量较好[5],又称为“大回酒”,而第六轮和第七轮基酒质量再度变差,有苦味和焦糊的味道[6]。综合比较,第四轮次的基酒风味最为突出[7−8],作为酱香型白酒勾调过程中最重要的组成部分,具有较高的研究价值。
微生物的代谢是酱香型白酒酿造过程物料转化的内在动力[9],在整个酿造周期中,微生物种类和丰度处于动态变化之中,影响最终风味化合物的形成。酱香型白酒酿造工艺复杂,条件独特,酿造过程的微生物来源主要包括大曲、酒醅和环境微生物三部分。在堆积发酵的整个过程中,酒醅暴露在开放式环境中,富集了许多环境中的微生物,这些微生物参与到后续入窖发酵过程中,赋予轮次酒独特风味[10]。例如,王琳等[11]对茅台镇酱香型白酒的七个轮次发酵的酿造环境进行细菌菌群分析,在第四轮次中发现特殊菌属Corynebacterium(棒状杆菌属),可利用环境中的碳源发酵产生赖氨酸改善酒的风味;张春林等[12]对第二轮次堆积发酵酒醅进行研究,发现对风味形成影响最大的微生物为Bacillus(芽孢杆菌属)、Emericella(裸胞壳属)、Oceanobacillus(海洋芽孢杆菌属);胡小霞等[13]对堆积和窖池发酵过程的细菌菌群结构进行分析发现,入窖发酵过程中细菌多样性和丰度均低于堆积发酵,即堆积发酵中富集的微生物需要在入窖发酵过程中进一步演替。这些研究表明,分析入窖之后酒醅发酵过程中微生物及风味物质变化具有重要意义,有助于合理调节白酒发酵过程,提高酱香型白酒产品质量。团队前期研究[14]发现第五、六轮次酒醅中的优势细菌属均为Lactobacillus(乳芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Virgibacillus(枝芽孢杆菌属),但入窖发酵过程中丰度并不一致,第六轮次优势真菌属为Issatchenkia(伊萨酵母属)、Thermoascus(嗜热子囊菌属)和Byssochlamys(丝衣菌属),而Thermoascus(嗜热子囊菌属)和Aspergillus(曲霉属)的对应丰度远低于第五轮,并提出第六轮次入窖酒醅中酯合成真菌的减少可能是酯类风味物质浓度下降的原因。团队近期研究[15]通过分析前三轮次入窖酒醅的微生物和风味物质,发现第三轮入窖酒醅中的风味物质浓度有所提高,提出风味物质的变化是第三轮次基酒质量提高的重要原因。然而,总体来讲目前对于酱香型白酒入窖酒醅发酵过程的研究较少,限制了人们对发酵过程的科学认知,特别是对于关键轮次第四轮次入窖酒醅发酵过程中微生物和风味物质的变化尚未见报道。
本文通过高通量测序技术对北京地区酱香型白酒第四轮次入窖发酵过程中酒醅微生物群落结构进行了研究,分析了微生物菌群的演替变化;利用顶空固相微萃取-气相色谱-质谱联用技术对酒醅的挥发性风味成分进行了定性和相对定量分析。通过分析白酒发酵过程中微生物及风味物质的变化,定位核心微生物,探讨微生物与风味物质的相互关联,从中挖掘与风味相关的功能微生物,有助于为后续通过功能微生物理性扰动发酵体系,为提高北京地区酱香型白酒的产品品质提供基础数据依据。
1. 材料与方法
1.1 材料与仪器
磷酸缓冲液、Taq DNA聚合酶试剂盒 北京全式金生物技术有限公司;4-辛醇(色谱级) 天津福晨化学试剂有限公司;琼脂糖 南京生兴生物技术有限公司;50×TAE缓冲液 北京索莱宝科技有限公司;DNA Marker Takara;核酸染料Gengreen 上海赛百盛有限公司;引物 上海捷瑞生物工程股份有限公司;E.Z.N.A. Soil DNA Kit试剂盒 Omega Bio-Tek公司。
CP153电子天平 奥豪斯仪器(上海)有限公司;T100-Thermal Cycler PCR仪 美国Bio-Rad公司;EPS301琼脂糖凝胶电泳仪 北京六一仪器厂;YXQ-LS-50SII立式压力蒸汽灭菌器 上海博迅实业有限公司医疗设备厂;Aquaplore3S超纯水系统 美国艾科浦公司;KQ5200DA 超声波清洗仪 上海超声仪器厂;GC 7890-5975 MSD气相色谱-质谱联用仪 美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 抽样方法
酒醅样品采自北京华都酒厂窖池发酵生产车间2020年第四轮次12号南池入窖发酵酒醅,入窖前已提前进行5 d的薄层堆积发酵。根据前期研究基础[15],入窖酒醅选取入窖0、7、14、21、30 d为取样时间点,15点取样,窖池发酵周期为30 d。在每个取样时间点取样时,按酒醅上、中、下三个层面,每个层面选择中间及四周边缘位置采取样品,取样位点参考图1,各层样品混匀后作为一个时间点的取样样品。将采集的样品分为两份:一份用于提取总DNA,另一份储存在−80 ℃用于进行微生物群落结构分析。
1.2.2 样品DNA提取和PCR扩增
通过E.Z.N.A. Soil DNA Kit提取试剂盒提取酒醅样品中的微生物宏基因组,提取步骤参照说明书。根据前期研究方法[16]进行基因扩增,细菌扩增16S rRNA基因所用引物,338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTA CHVGGGTWTCTAAT-3');真菌扩增18S rRNA基因所用引物,ITS1F(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2R(5'-GCTGCGTTCTTCATCGATGC-3'),使用1%琼脂糖凝胶电泳检测目的条带大小。
表 1 PCR反应体系Table 1. PCR reaction system试剂 体积(μL) 5×TransStart FastPfu Buffer 4 2.5 mmol/L dNTPs 2 上游引物(5 μmol/L) 0.8 下游引物(5 μmol/L) 0.8 模板 1 TransStart FastPfu DNA聚合酶 0.4 ddH2O 11 共计 20 表 2 PCR反应程序Table 2. PCR reaction procedure温度(℃) 程序 时间(min) 循环数 95 预变性 3 1 95 变性 0.50 29 55 退火 0.50 72 延伸 0.75 72 延伸 10 1 4 − 1.2.3 Illumina公司MiSeq测序
将纯化的扩增产物等分子量汇集在Illumina MiSeq PE300平台/NovaSeq PE250平台(Illumina,上海),并根据上海Majorbio生物制药科技有限公司(中国,上海)的标准方案进行配对端测序。原始测序数据已提交到NCBI SRA数据库,提交编号为SUB8652827。
1.2.4 挥发性化合物的提取与分析
结合宫俐莉等[17]的研究,本研究通过顶空-固相微萃取分析挥发性化合物。样品前处理方法参照李凤兰等[5]的研究进行:准确称取2.00 g酒醅样品于20 mL顶空瓶中,向其中加入5 mL的饱和氯化钠溶液,加入6 μL 4-辛醇(0.5 mg/mL)作为内标物,以90 W功率超声10 min。顶空-固相微萃取使用TG-5MS色谱柱(30 m×0.25 mm×0.25 μm,J&W Science,Folsom,CA,USA),通过火焰电离检测器分析风味化合物。气相色谱条件:温度以2 ℃/min的速率升至100 ℃并保持5 min,然后以2 ℃/min的速率升至150 ℃并保持2 min,最后以10 ℃/min速率升至230 ℃并保持5 min。氦气载气的流速为1.5 mL/min。质谱采用电子轰击电离(EI)离子源,离子源温度230 °C,电子能量70 eV,离子扫描范围为35~450 m/z。风味成分的鉴定通过与NIST 11 a.L数据库(安捷伦科技公司)中的标准质谱图进行比对,使用内标法对风味化合物进行相对定量分析。通过自动积分程序获得各色谱峰的面积,计算样品中各组分峰面积分别与内标物质峰面积之比,定量各风味组分的含量。酒醅中风味物质的定量数据处理主要采用Microsoft Office Excel 2021应用程序进行数据计算,通过TBtools、R语言完成相关图形的绘制。
1.3 数据处理
所有测定平行三次进行,结果表示为平均值±标准差。方差分析使用SPSS 26.0软件(SPSS Inc.,美国伊利诺伊州芝加哥)进行。使用Origin 8.5软件进行挥发性成分分析和微生物图谱分析。采用Pheatmap软件包进行相关性分析,使用相关热图进行可视化,分析风味物质与微生物之间的关联性。
2. 结果与分析
2.1 第四轮次酿造过程中微生物群落结构多样性
2.1.1 细菌多样性
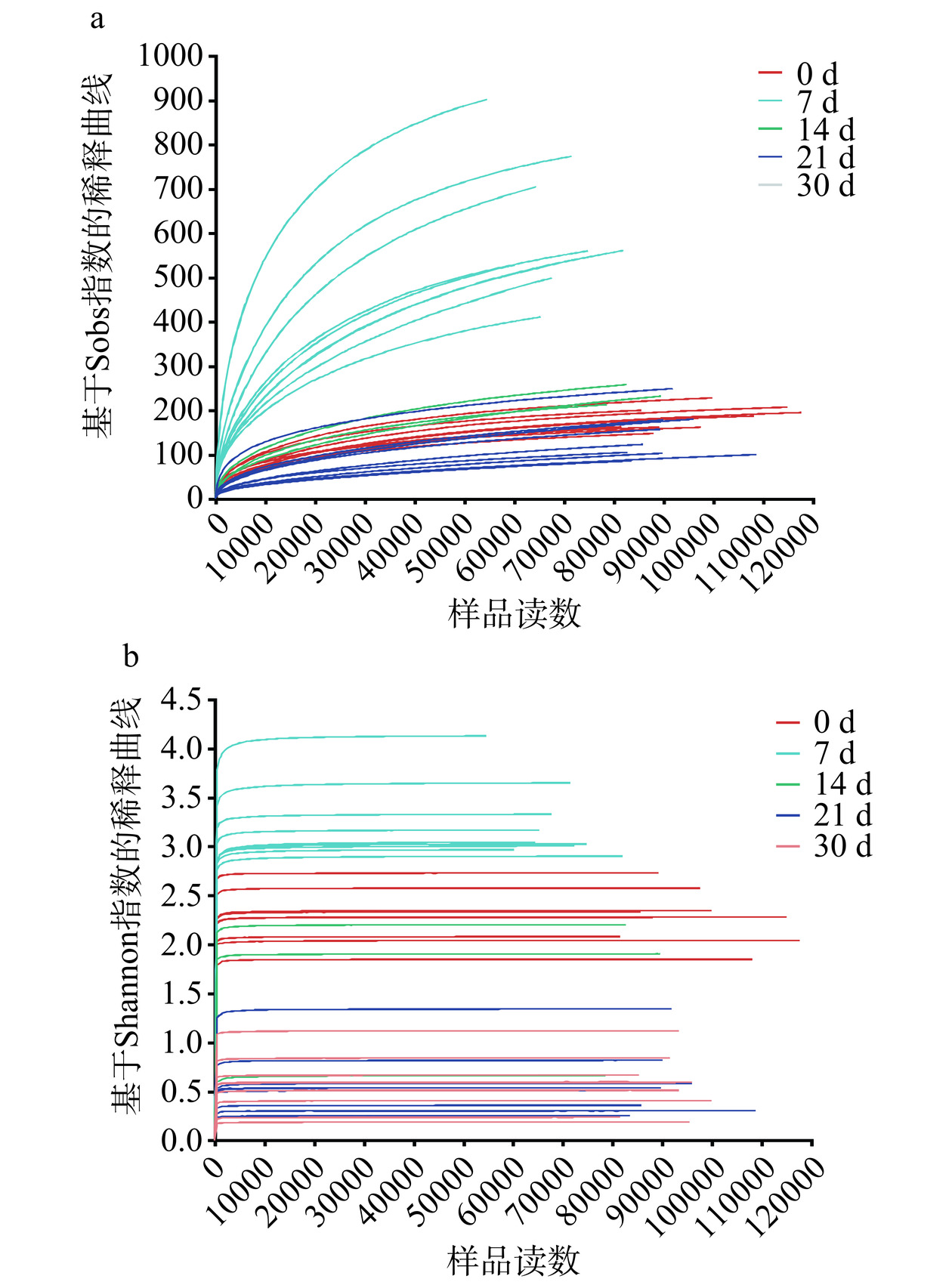
稀释曲线可以比较不同的测量数据样本的物种丰富度,也可以说明样本的测序数据量是否合理,图2中稀释性曲线趋于平坦,说明测序的数据量和丰富度是合理的[18]。图2a展示了酱香型白酒第四轮次入窖酒醅细菌样本的稀释曲线在测序数5000时骤增,后逐渐趋于平坦,这表明本实验的各细菌样本测序数据量合理,测序深度达到要求,与实际生物信息相符合。利用Shannon曲线对不同样本的物种多样性进行了比较,如图2b所示,所有样本中细菌的Shannon曲线在测序数1000左右时骤增,后变得平坦,说明测量数据的量可以覆盖样本中绝大多数细菌多样性信息,测序数据量和深度是可靠的。实际测量结果可以代表样本的实际情况。
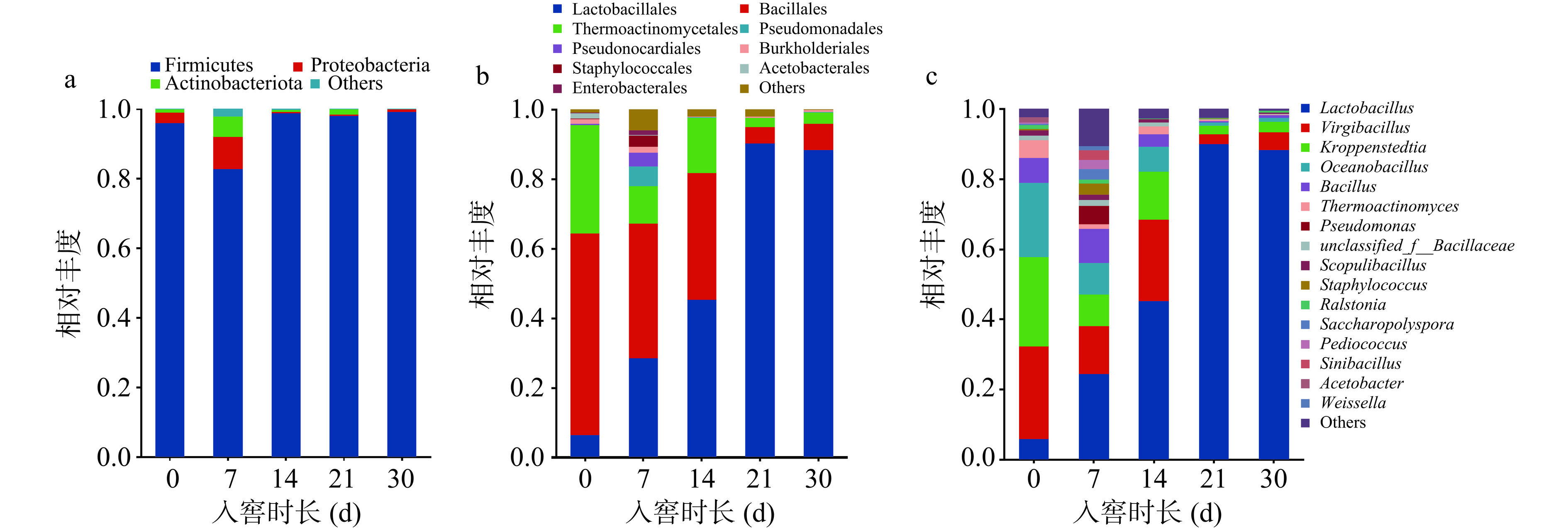
门水平上,在酱香型白酒第四轮次入窖酒醅中共检出16个细菌门。图3a展示了酒醅中相对丰度大于1%的细菌门,有Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)、Actinobacterieta(放线菌门)。在整个发酵期间,Firmicutes(厚壁菌门)一直处于绝对的优势地位,平均相对丰度>85%,该结果与酱香型白酒(山东产区)[19]、清香型白酒[20]、浓香型白酒[21]、芝麻香型白酒[22]研究结论一致。在酱香型、芝麻香型、清香型白酒酿造过程中发现Firmicutes(厚壁菌门)也是主要细菌门,说明Firmicutes是中国白酒发酵过程中的关键微生物。不同的是,南方产区的酱香型白酒优势细菌门有两种,研究发现贵州产区的酱香型白酒发酵过程中,Firmicutes(厚壁菌门)、Proteobacteria(变形菌门)两个门占主导地位[9]。以上结果表明白酒发酵中后期(14~30 d),细菌门水平群落多样性降低,发酵微生态结构由多菌系演替为单一的Firmicutes(厚壁菌门)为主导的发酵模式,是白酒酒醅发酵细菌门水平演替的普遍模式。目水平上,共检出89个细菌目,丰度大于1%的有9个,包括Lactobacillales(乳酸杆菌目)、Bacillales(杆菌目)、Thermoactinomycetales(热放线菌目)、Pseudomonadales(假单胞菌目)、Propionibacteriales(丙酸杆菌目)、Burkholderiales(伯克霍尔德氏菌目)、Staphylococcales(葡萄球菌目)、Acetobacterales(醋酸菌目)、Enterobactrales(肠杆菌目)(如图3b所示)。在发酵前期(1~14 d),Lactobacillales(乳酸杆菌目)相对丰度较低,Bacillales(杆菌目)则相对丰度较高,其次是Thermoactinomycetales(热放线菌目)。发酵14 d,细菌物种多样性丰富且相对丰度分布比较多样。之后,Lactobacillales(乳酸杆菌目)相对丰度显著增加,说明此时的环境适宜乳酸杆菌的生长,此时窖池处于厌氧环境,厌氧型细菌成为优势种群出现,且一直持续到出窖阶段。属水平上,共检出260个细菌属,丰度大于1%的有16个,如图3c所示,其中平均相对丰度较高的10个菌属包括Lactobacillus(乳酸杆菌属)、Virgibacillus(枝芽孢杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)、Bacillus(芽孢杆菌属)、Thermoactinomyces(高温放线菌属)、Pseudomtonas(假单胞菌属)、unclassified_f_Bacillacese(未分类芽孢细菌属)、Scopulibacillus(火山渣芽胞杆菌属)、Ralstonia(罗尔斯通菌属)。其中,Lactobacillus(乳酸杆菌属)占细菌数量的3.55%~89.96%,平均相对丰度为67.70%,入窖初期相对含量较低,在入窖第21 d达到最高值,后期保持在较高水平。Virgibacillus(枝芽孢杆菌属)占细菌数量的2.90%~26.32%,平均相对丰度为14.28%,Kroppenstedtia(克罗彭斯特菌属)占细菌数量的2.32%~25.57%,平均相对丰度为10.70%,两个菌属在入窖初期相对含量较高,相对丰度均在入窖第21 d开始降低。
发酵0 d时,酒醅中Virgibacillus(枝芽孢杆菌属)相对丰度最高,Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)、Lactobacillus(乳杆菌属)、Bacillus(芽孢杆菌属)和Thermoactinomyces(热放线菌属)依次降低。在发酵第7 d,Lactobacillus(乳杆菌属)在酒醅中的相对丰度明显增大,Virgibacillus(枝芽孢杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Oceanobacillus(海洋芽孢杆菌属)的相对丰度均降低。发酵14 d,丰度小于1%的其余细菌总相对丰度占比增加。与目水平一致的是,发酵前期(0~7 d)以Virgibacillus(枝芽孢杆菌属)和Kroppenstedtia(克罗彭斯特菌属)两个为优势属,14 d始,Lactobacillus(乳杆菌属)演替为绝对的优势属,这表明细菌在整个发酵阶段以发酵14 d为分界线出现了明显的优势属的交替,在第一、二、五、六轮次的发酵14 d入窖酒醅中均发生了优势属Lactobacillus的相对丰度明显升高的现象[14−15]。
随着发酵时间的延长,发酵中后期Lactobacillus(乳杆菌属)相对丰度增加,尤其是发酵第14 d开始相对丰度显著增加,且一直维持到出窖,这期间窖池处于厌氧状态,适应厌氧呼吸的乳杆菌属快速生长,一些好氧或兼性好氧性细菌生长受到抑制,这也是细菌演替变化的表现,在王玉荣等[23]的研究中也发现Lactobacillus为第四轮次出窖酒醅中的绝对优势细菌属。而作为好氧的枝芽孢杆菌属则是呈现明显的减少趋势,与乳杆菌属相比,几乎呈现完全相反的变化趋势。研究将平均相对丰度>1%且至少在50%的样品中丰度超过1%的微生物定义为核心微生物[24−25],本文将酱香型白酒第四轮次入窖酒醅的优势细菌属定位到乳杆菌属和芽孢杆菌属,这两种优势细菌属在多种香型白酒发酵过程均有报道[19−20,22,26]。芽孢杆菌可代谢产生多种水解发酵原料的酶类,包括淀粉酶、糖化酶、蛋白酶等,发酵时产生吡嗪类、有机酸等风味物质,对于白酒风味具有重要影响[27−29]。乳杆菌属在发酵过程中利用糖类产生乳酸,为乳酸乙酯的合成提供前体物质,提高了酒体的醇厚感,其产生的有机酸类也与酒体酸味呈现显著的相关性[26,30]。此外,与南方酱香型白酒发酵中优势细菌属相比[12],Virgibacillus(枝芽孢杆菌属)、Oceanobacillus(海洋芽孢杆菌属)、Ralstonia(罗尔斯通菌属)是北京地区酱香型白酒发酵中独有的优势细菌属,而这些特有菌属在白酒酿造中的功能及对白酒风味的贡献尚无深入研究。以上结果表明北京地区酱香型白酒发酵优势细菌属除了具有和南方地区酱香型白酒发酵的优势共性细菌属外,还存在着其所特有的优势细菌属(图3c)。
2.1.2 真菌多样性
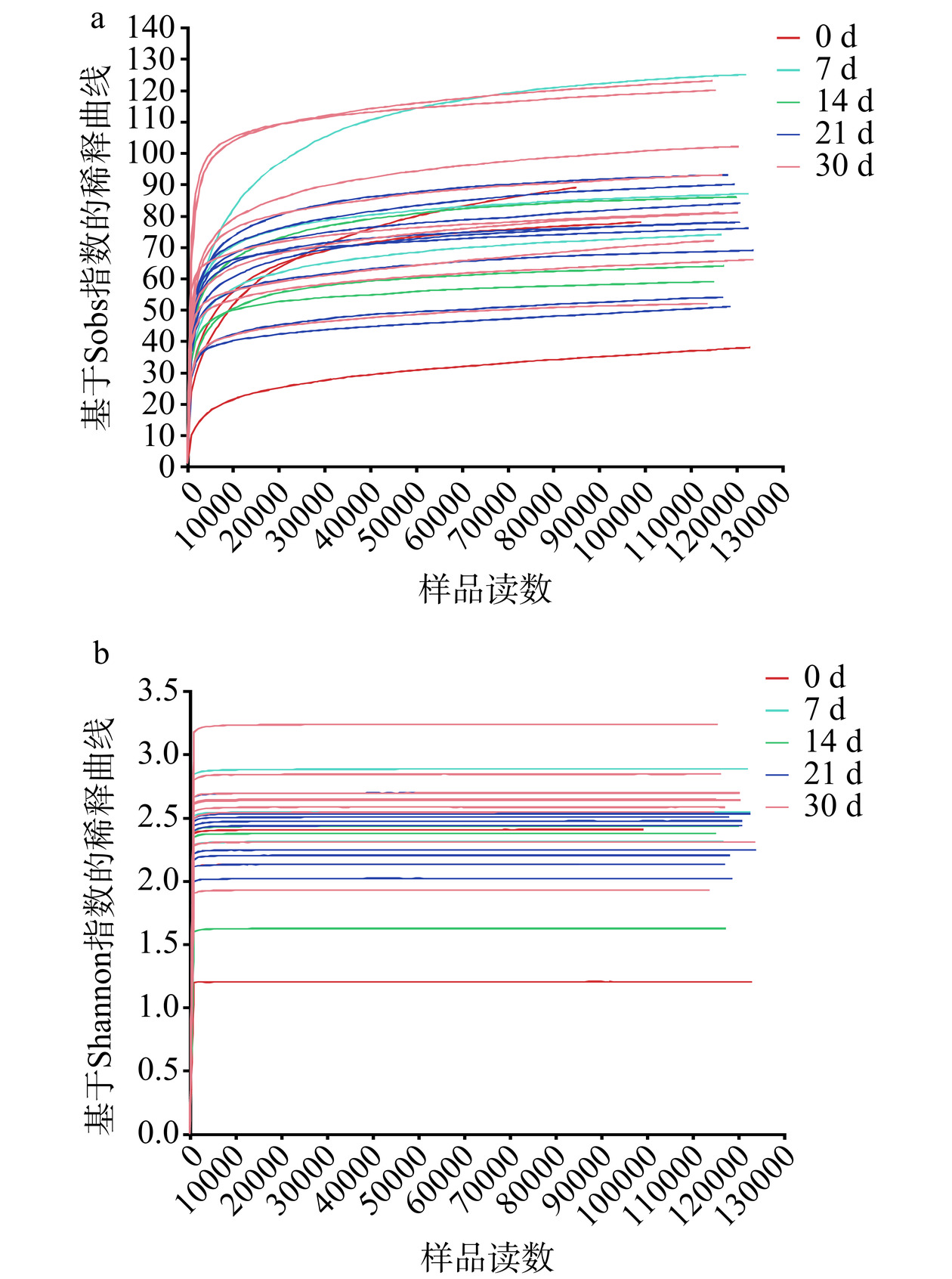
如图4a所示为酱香型白酒第四轮次入窖酒醅中所测样品的真菌Sobs指数稀释曲线,各真菌样本的测序数据量合理,测序深度足够,与实际生物信息相符合。如图4b所示,所有样品的真菌Shannon曲线在测序数在1000左右时均趋向平坦,说明本实验中样本的测序数据量足够大,已经覆盖了样本中绝大多数真菌的多样性信息,结果科学可靠。
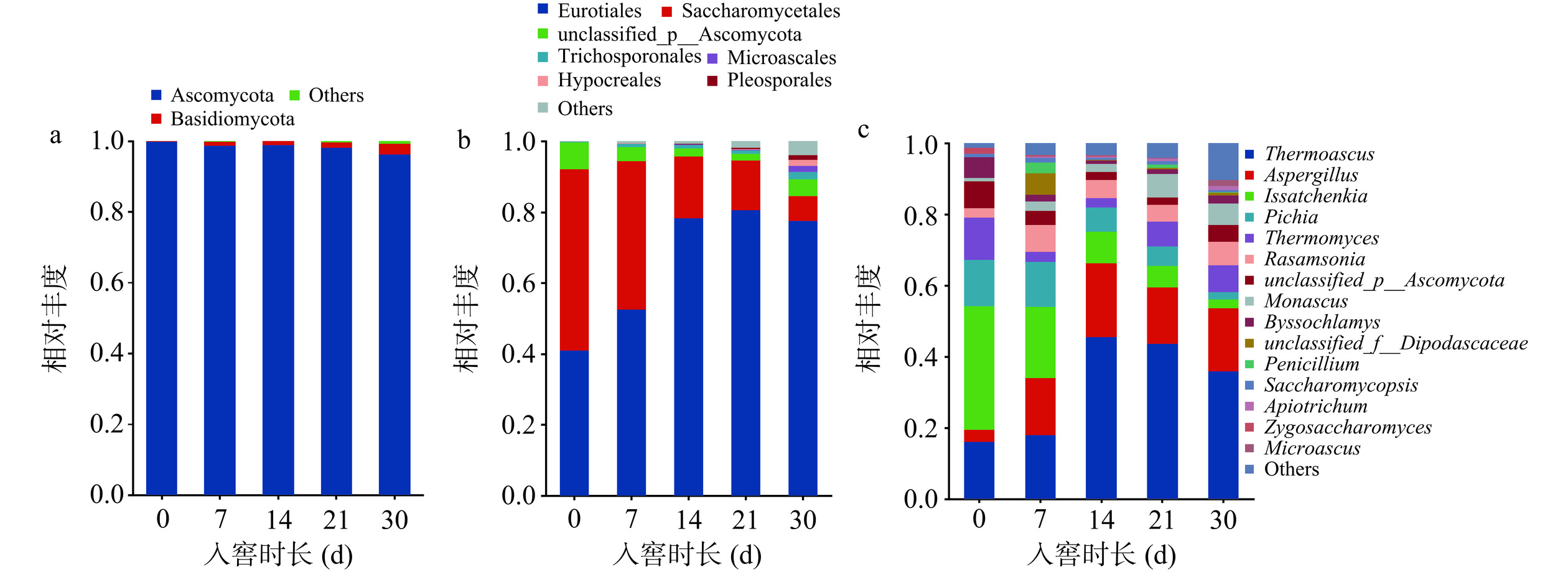
门水平上,在酱香型白酒第四轮次入窖发酵酒醅中共检测到7个门,其中丰度大于1%的真菌门包含Ascomycota(子囊菌门)、Basidiomycota(担子菌门)(图5a)。其中,Ascomycota(子囊菌门)在酱香型白酒第四轮次入窖发酵过程中相对丰度达95%以上,占绝对主导地位,这与戴亦杰[31]研究结果相同,说明在白酒发酵过程中,真菌门水平群落多样性较低,发酵微生态结构是由Ascomycota和Basidiomycota为主导的真菌微生物组合。
目水平上,共检出36个真菌目,丰度大于1%的有7个,包括Eurotiales(散囊菌目)、Saccharomycetales(酵母菌目)、unclassified_p_Ascomycota(未分类子囊菌目)、Trichosporonalles(毛孢菌)、Microascales(小囊菌目)、Hypocreales(肉座菌目)、Pleosporales(格孢腔菌目)(图5b)。在发酵期间,Eurotiales相对丰度呈现先增加后稳定的趋势,在第21 d处于最高值。相反的,Saccharomycetales的相对丰度逐渐减小,同样,在第30 d达到最小值。在目水平上,Eurotiales和Saccharomycetales占据绝对优势。
属水平上共检出169个真菌属,丰度大于1%的有16个,其中排名前10的包括Thermoascus(嗜热子囊菌属)、Aspergillus(曲霉属)、Issatchenkia(伊萨酵母属)、Pichia(毕赤酵母属)、Thermomyces(嗜热真菌属)、Rasamsonia、unclassified_o_Saccharomycetales(未分类酵母菌属)、Monascus(红曲霉属)、Byssochlamys(丝衣霉属)、Penicillium(青霉属)(图5c)。其中,Thermeascus(嗜热子囊菌属)占真菌数量的15.34%~45.46%,平均相对丰度为35.40%,在入窖第14 d达到最高值。Aspergillus(曲霉属)占真菌数量的3.44%~20.74%,平均相对丰度为14.76%,在入窖第7 d相对含量开始剧增,在第14 d达到最高值。Issatchenkia(伊萨酵母属)占真菌数量的2.46%~35.92%,平均相对丰度为14.45%,在发酵前期相对丰度较高,后逐步下降。在整个发酵期间,Thermeascus(嗜热子囊菌属)、Aspergillus(曲霉属)相对丰度呈现逐渐增加的趋势,相反的,Issatchenkia(伊萨酵母属)相对丰度呈现减少的趋势,这与目水平的结果一致,也进一步说明了Thermeascus(嗜热子囊菌属)、Aspergillus(曲霉属)和Issatchenkia(伊萨酵母属)均为优势属。
真菌的代谢活动产生了丰富的酶类物质,如酸性蛋白酶、纤维素酶、糖化酶、液化酶、酯化酶等,这些酶类物质对于粮食中大分子的物质如蛋白质、淀粉、脂质等起到了一定的转化作用[32]。虽然不同香型白酒主要的香味物质不同,但它们共同的特点是大部分都来自于酿造过程中微生物的代谢,真菌群落组成结构分析结果显示,霉菌、酵母菌占比较大,这与后期白酒的酒精含量和香气成分紧密相关。酵母菌和霉菌作为主要的功能菌,酵母菌通过代谢活动产生酒精,霉菌则为发酵前期生成有机酸和酯类物质的主要菌种[33]。在酱香型白酒的生产中,通过吸附萃取和热脱附结合气质联用仪测定白酒中酯类成分,可以发现霉菌不仅代谢产生柠檬酸、葡萄糖酸、草酸等有机酸,还能生成淀粉酶、蛋白酶等酶制剂[34]。综合分析上述结果,酱香型白酒第四轮次入窖发酵酒醅中的核心微生物包括细菌属的Lactobacillus(乳酸杆菌属)、Kroppenstedtia(克罗彭斯特菌属)、Virgibacillus(枝芽孢杆菌属),以及真菌属的Thermeascus(嗜热子囊菌属)、Issatchenkia(伊萨酵母属)、Aspergillus(曲霉属)。酱香型白酒第四轮次入窖酒醅中,与细菌多样性相比,真菌的多样性差异较小,其余轮次中酒醅的微生物多样性与第四轮次类似,也表现为真菌多样性低于细菌多样性的特征[14−15]。
2.2 第四轮次酿造过程中风味物质变化
2.2.1 白酒发酵过程酒醅风味物质分析
第四轮次酒醅样品共检出50种挥发性物质,包含酯类28种、醇类9种、脂肪酸5种、醛类2种、其他化合物6种。表3展示了酒醅中挥发性化合物的相对含量,其中酯类占比最高,其次是醇类和酸类。在白酒发酵过程中醇类、酯类、酸类化合物的含量随着入窖发酵时间的增加呈现先上升后下降的规律,而总酯相对含量在每一个发酵时间点都较高。
表 3 基于气相色谱-质谱分析的样品挥发性化合物含量(mg/kg)Table 3. Volatile compound content of samples based on GC-MS spectrometry (mg/kg)化合物 含量(mg/kg) 编号 名称 入窖0 d 入窖7 d 入窖14 d 入窖21 d 入窖30 d A1 乙酸乙酯 0.12±0.01b 0.09±0.01c 0.17±0.02b 0.28±0.03a 0.31±0.02a A2 乳酸乙酯 2.99±0.17d 1.25±0.23e 3.74±0.56c 4.51±0.59b 7.01±0.70a A3 2-甲氧基乙酸十三酯 0.02±0.00a − 0.01±0.00a − − A4 DL-白氨酸乙酯 0.46±0.01b 0.33±0.02c 0.56±0.00a − − A5 琥珀酸二乙酯 0.28±0.03d 0.25±0.02d 0.41±0.05c 0.60±0.06b 0.87±0.05a A6 2-羟基-4-甲基-戊酸乙酯 0.32±0.00d 0.11±0.00e 0.68±0.12c 0.78±0.06b 1.17±0.05a A7 14-(2-辛基环丙基)十四烷酸甲酯 0.08±0.03a 0.01±0.00c 0.04±0.00b 0.03±0.00b 0.05±0.00a A8 (E)-10-十七碳烯-8-炔二酸甲酯 0.07±0.03a 0.01±0.00c 0.02±0.01b 0.02±0.00b 0.03±0.01b A9 苯乙酸乙酯 0.22±0.00d 0.23±0.02d 0.37±0.06c 0.45±0.03b 0.56±0.01a A10 乙酸苯乙酯 0.22±0.03b 0.08±0.01c 0.29±0.06a 0.21±0.00b 0.24±0.02b A11 十六烷酸乙酯 0.04±0.00c 0.61±0.24b − 5.29±0.53a 0.06±0.01c A12 [1,1'-双环丙基]-2-辛酸甲酯 0.05±0.00a 0.01±0.00c 0.03±0.01b 0.02±0.00b 0.02±0.01bc A13 肉豆蔻酸乙酯 0.31±0.02c 0.21±0.03d 0.28±0.02c 0.40±0.03b 0.48±0.04a A14 反油酸乙酯 1.14±0.10b 1.31±0.31b 1.24±0.18b 1.72±0.06a 1.78±0.17a A15 9-十六碳烯酸乙酯 0.02±0.00a 0.01±0.00b 0.02±0.00a 0.02±0.00a 0.03±0.00a A16 十六烷酸丙酯 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.02±0.00a A17 反式十八二烯酸乙酯 0.07±0.01a 0.04±0.01b 0.10±0.03a 0.05±0.01b 0.07±0.01a A18 9,12-十八烯酸乙酯 1.46±0.11c 1.85±0.26b 1.15±0.37c 1.94±0.67b 3.31±0.64a A19 己酸乙酯 0.17±0.01e 0.75±0.16c 0.47±0.10d 1.12±0.25b 1.30±0.21a A20 2,5-十八酸甲酯 0.01±0.00a 0.01±0.00a 0.02±0.01a 0.01±0.00a 0.02±0.00a A21 9,12-十八二烯酸正丙酯 4.40±0.02a − 2.74±0.70b 1.74±0.59c 2.15±0.30c A22 癸酸乙酯 0.03±0.00c 0.05±0.01c 0.08±0.01b 0.10±0.01b 0.20±0.01a A23 棕榈酸乙酯 0.31±0.00b 0.02±0.00d 0.03±0.01c 0.05±0.01c 1.96±0.00a A24 琥珀酸单乙酯 0.01±0.01b 0.02±0.00b − 0.03±0.00a 0.02±0.00b A25 月桂酸乙酯 − 0.02±0.00b 0.01±0.00b − 0.12±0.03a A26 9,12,15-十八碳三烯酸乙酯 0.10±0.02a 0.07±0.01b 0.06±0.01b 0.12±0.01a 0.13±0.02a A27 乙醇 3.75±0.28b 2.95±0.43c 5.45±0.68a 5.68±0.75a 5.43±0.66a A28 异戊醇 0.30±0.04a 0.10±0.01b 0.11±0.02b 0.07±0.00c 0.08±0.02c A29 亚麻酸乙酯 0.01±0.01b 0.02±0.00b − 0.03±0.00a − A30 苯甲醇 0.07±0.01a 0.04±0.00b 0.07±0.01a 0.06±0.00b − A31 糠醇 0.21±0.02a 0.07±0.02c 0.11±0.00c 0.20±0.01a 0.15±0.00b A32 1-七烷醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a − A33 苯乙醇 2.90±0.19b 2.10±0.41c 3.77±0.55a 4.26±0.18a 4.28±0.27a A34 十一乙醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a A35 十二乙醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a A36 正戊醇 0.49±0.05a 0.16±0.00b 0.19±0.00b 0.09±0.00c − A37 α−(1-羟乙基)-苯丙酸 0.09±0.01c 0.65±0.14a 0.09±0.02c 0.12±0.01c 0.17±0.01b A38 正己酸 0.32±0.02a − 0.37±0.01a 0.35±0.01a − A39 棕榈酸 0.11±0.01b 0.07±0.01c 0.09±0.02b 0.11±0.01b 0.19±0.03a A40 苯甲酸 0.02±0.00b 0.02±0.00b 0.03±0.00b 0.03±0.00b 0.04±0.00a A41 乙酸 1.38±0.00b − − 2.33±0.00a 0.08±0.00c A42 11,13-二羟基四癸-5-炔酸甲酯 0.01±0.00a 0.01±0.00a − − − A43 十二烷基七聚乙二醇醚 0.01±0.00b 0.01±0.00b 0.01±0.00b 0.02±0.00a 0.01±0.00b A44 苯甲醛 0.14±0.00b 0.15±0.00a 0.12±0.02c 0.15±0.01a − A45 苯酚 0.02±0.00a 0.01±0.00b 0.02±0.00a 0.02±0.00a 0.02±0.00a A46 4-乙基愈创木酚 0.11±0.02b 0.08±0.00c 0.12±0.00b 0.19±0.00a 0.18±0.01a A47 1,2-二-4-吡啶-1,2-乙二醇 0.03±0.00c 0.01±0.00d 0.03±0.00b 0.03±0.01b 0.06±0.00a A48 十八乙二醇单十二烷基醚 0.02±0.01c 0.01±0.00d 0.02±0.00b 0.02±0.00b 0.04±0.00a A49 2-乙酰基吡咯 0.06±0.00b 0.03±0.00c 0.07±0.01b 0.07±0.00b 0.11±0.00a A50 N-甲基-2-吡咯甲醛 − 0.02±0.00c 0.01±0.00d 0.31±0.01a 0.05±0.00b 注:−表示未检出;不同小写字母表示同种化合物在不同入窖时间之间的差异显著,P<0.05。 发酵30 d时酒醅中挥发性化合物中,酯类物质的种类是所有测出的挥发性成分中最丰富的。我国的白酒与其他蒸馏酒的不同之一就是以酯香为主,尤其是体现在酱香型白酒中[35],大回酒酒质较好就是由于酯类、酸类物质占比高[36]。戴奕杰等[37]的研究显示在酒质较好的“大回酒”中,四大酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)的含量达到了酿造过程中的最高含量。本研究中乳酸乙酯(7.01±0.70 mg/kg)含量最高,其次是(E)-9-十八烯酸乙酯(3.31±0.64 mg/kg)、己酸乙酯(1.30±0.21 mg/kg)、琥珀酸二乙酯(0.87±0.05 mg/kg)、乙酸乙酯(0.31±0.02 mg/kg)等,均高于前三轮次入窖酒醅相应的酯含量[15],为酱香型白酒提供酯香风味。其中,乳酸乙酯含量由0 d的2.99±0.17 mg/kg提高到7.01±0.70 mg/kg;己酸乙酯含量由0.17±0.01 mg/kg提高到1.30±0.21 mg/kg;乙酸乙酯含量由0.12±0.01 mg/kg提高到0.31±0.02 mg/kg。醇类在21 d含量最高,其中乙醇含量最高,其次为苯乙醇、糠醇、正戊醇、异戊醇、苯甲醇。其中乙醇含量由 0 d 的 3.75±0.28 mg/kg 增加到 21 d 的5.68±0.75 mg/kg,此后含量基本稳定不变;苯乙醇是除乙醇以外含量最高的醇类物质,含量由 0 d 的 2.90±0.19 mg/kg 增加到 30 d 的 4.28±0.27 mg/kg,在发酵后期(21~30 d)基本保持不变。高级醇在形成酒的味道、提高酒的丰满度和厚重感方面起着重要作用,它不仅本身可以呈香呈味,而且是白酒中甜味剂和助香剂的主要来源[38−39]。21 d酒醅中酸性物质含量较高,出窖时含量降低,酸性物质中乙酸含量最高,其次为正己酸、α-(1-羟乙基)-苯丙酸、棕榈酸、苯甲酸。与其它香型相比,酱香型白酒中含量最高的酸是乙酸和丙酸[40],尤其是乙酸,在本研究中酒醅乙酸相对含量也较为突出,酸类物质的作用主要是影响白酒的口感和后味,起到呈香、助香、减少刺激和缓冲平衡的作用。在发酵过程中,其他挥发物(如酚类和醛类)的量没有观察到显著差异。
2.2.2 风味化合物与微生物群落的相关性
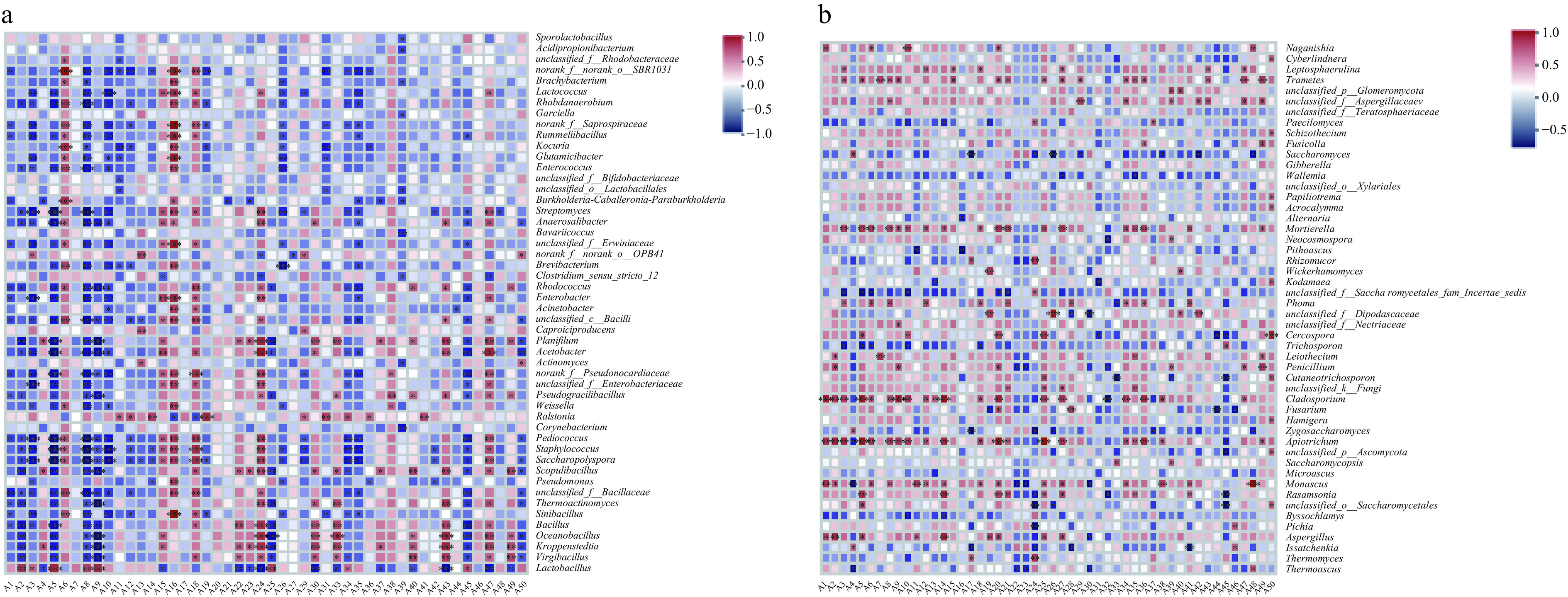
微生物代谢是白酒中风味化合物的重要来源,如Lactobacillus等产酸微生物使白酒酸味增加,Bacillus、Saccharomyces等相对丰度的提高能够使醛酮类、酯类等香气成分含量增加[41],图6分析了北方酱味白酒第四轮次发酵过程中不同微生物与风味物质的相关性。
在关键细菌群落中(图6a),Lactobacillus与乳酸乙酯(A2)、琥珀酸二乙酯(A5)、(E)-10-十七碳烯-8-炔二酸甲酯(A8)、苯乙酸乙酯(A9)、月桂酸乙酯(A25)等呈显著正相关(P<0.01),结合已报道的其余轮次入窖发酵情况,发现Lactobacillus在酱香型白酒发酵过程中具有重要的酯类合成作用[14−15,42],是一种重要的功能微生物;Virgibacillus与苯甲酸(A40)、十二烷基七聚乙二醇醚(A43)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈显著正相关(P<0.01),与乳酸乙酯(A2)、琥珀酸二乙酯(A5)和苯乙酸乙酯(A9)呈显著负相关(P<0.01);同样地,Kroppenstedtia与琥珀酸单乙酯(A24)、苯甲醇(A30)、苯乙醇(A33)、十二烷基七聚乙二醇醚(A43)、1,2-二-4-吡啶-1,2-乙二醇(A47)、1-(1H-吡咯-2-基)-乙酮(2-乙酰基吡咯)(A49)呈显著正相关(P<0.01),这与Virgibacillus正相关的风味化合物相近,而两种菌的负相关性化合物也极为相似,包括乳酸乙酯(A2)、琥珀酸二乙酯(A5)、苯乙酸乙酯(A9)以及月桂酸乙酯(A25),这些显著相关的风味化合物与白酒发酵过程中酒醅细菌群落多样性的演替相对应,即发酵过程中优势属由Virgibacillus、Kroppenstedtia逐渐转变为Lactobacillus。
在关键真菌群落中,Thermoascus与十八乙二醇单十二烷基醚(A48)呈正相关,与DL-亮氨酸乙酯(A4)、癸酸乙酯(A22)、棕榈酸乙酯(A23),苯甲醇(A30)呈负相关(图6b)。Aspergillus曲霉菌与乳酸乙酯(A2)、(E)-9十八烯酸乙酯(A14)呈显著正相关(P<0.01),与苯甲醇(A30)呈负相关(图6b)。Issatchenkia与DL-亮氨酸乙酯(A4)、4-乙基愈创木酚(A46)呈正相关,与丁酸(A41)呈显著负相关(P<0.01)。Thermoascus与Issatchenkia相关的部分风味化合物呈现出相反的相关性,这对发酵期间优势属Thermeascus相对丰度呈现逐渐增加而Issatchenkia相对丰度逐渐减少的演替过程提供佐证(图5c)。
在之前的研究中发现,对白酒风味具有贡献的关键酯类物质有48种[2],传统观点中与白酒的风味密切相关的四大乙酯(乙酸乙酯、乳酸乙酯、丁酸乙酯和己酸乙酯)均包含在内,通过对第四轮次发酵酒醅中微生物与风味物质的关联性分析,发现Monascus、Lactobacillus和Wickerhamomyces分别与乙酸乙酯、乳酸乙酯和己酸乙酯呈显著正相关(P<0.01)。已有研究显示红曲霉通过产酯化酶可提升白酒中乙酸乙酯[43]、己酸乙酯[44]等酯类含量,石馨等[45]已将Wickerhamomyces应用于模拟发酵提升己酸乙酯含量,同样地可以在白酒发酵过程中利用功能微生物菌属Monascus、Lactobacillus等改善其余轮次基酒风味,有助于提高白酒的品质。
3. 结论
酱香型白酒采用传统的固态发酵模式,开放式的发酵过程导致环境中多种微生物参与其中,随着入窖发酵的进行,原料消耗、窖池环境变化使每轮入窖都形成感官有差异的轮次酒,不同轮次酒的微生物结构和风味物质组成存在着明显不同,其中以大回酒中第四轮次酒风味最佳。本文以北京地区酱香型白酒第四轮次发酵酒醅为研究对象,分析了发酵过程中核心微生物的结构变化和风味物质的差异。第四轮次发酵酒醅中,优势细菌属为Lactobacillus、Virgibacillus和Kroppenstedtia,优势真菌属为Thermoascus、Issatchenkia和Aspergillus,在整个发酵过程中,优势菌属由Virgibacillus、Kroppenstedtia、Issatchenkia交替为Lactobacillus、Thermoascus、Aspergillus。白酒发酵过程中关键风味化合物醇类、酯类、酸类的含量随着入窖发酵时间的增加呈现先上升后下降的规律,并且酯类相对含量较高,这显著影响酱香型白酒的产品品质。关联性分析显示Monascus、Lactobacillus和Wickerhamomyces分别与白酒中关键风味物质乙酸乙酯、乳酸乙酯和己酸乙酯呈正相关。本研究有助于寻找酱香型白酒发酵过程中潜在的功能微生物、明晰微生物与风味物质的相关性,为不同轮次酱香型白酒微生物区系波动和风味物质关联比较分析提供基础数据,有助于推动提高酱香型白酒品质的研究。
-
表 1 PCR反应体系
Table 1 PCR reaction system
试剂 体积(μL) 5×TransStart FastPfu Buffer 4 2.5 mmol/L dNTPs 2 上游引物(5 μmol/L) 0.8 下游引物(5 μmol/L) 0.8 模板 1 TransStart FastPfu DNA聚合酶 0.4 ddH2O 11 共计 20 表 2 PCR反应程序
Table 2 PCR reaction procedure
温度(℃) 程序 时间(min) 循环数 95 预变性 3 1 95 变性 0.50 29 55 退火 0.50 72 延伸 0.75 72 延伸 10 1 4 − 表 3 基于气相色谱-质谱分析的样品挥发性化合物含量(mg/kg)
Table 3 Volatile compound content of samples based on GC-MS spectrometry (mg/kg)
化合物 含量(mg/kg) 编号 名称 入窖0 d 入窖7 d 入窖14 d 入窖21 d 入窖30 d A1 乙酸乙酯 0.12±0.01b 0.09±0.01c 0.17±0.02b 0.28±0.03a 0.31±0.02a A2 乳酸乙酯 2.99±0.17d 1.25±0.23e 3.74±0.56c 4.51±0.59b 7.01±0.70a A3 2-甲氧基乙酸十三酯 0.02±0.00a − 0.01±0.00a − − A4 DL-白氨酸乙酯 0.46±0.01b 0.33±0.02c 0.56±0.00a − − A5 琥珀酸二乙酯 0.28±0.03d 0.25±0.02d 0.41±0.05c 0.60±0.06b 0.87±0.05a A6 2-羟基-4-甲基-戊酸乙酯 0.32±0.00d 0.11±0.00e 0.68±0.12c 0.78±0.06b 1.17±0.05a A7 14-(2-辛基环丙基)十四烷酸甲酯 0.08±0.03a 0.01±0.00c 0.04±0.00b 0.03±0.00b 0.05±0.00a A8 (E)-10-十七碳烯-8-炔二酸甲酯 0.07±0.03a 0.01±0.00c 0.02±0.01b 0.02±0.00b 0.03±0.01b A9 苯乙酸乙酯 0.22±0.00d 0.23±0.02d 0.37±0.06c 0.45±0.03b 0.56±0.01a A10 乙酸苯乙酯 0.22±0.03b 0.08±0.01c 0.29±0.06a 0.21±0.00b 0.24±0.02b A11 十六烷酸乙酯 0.04±0.00c 0.61±0.24b − 5.29±0.53a 0.06±0.01c A12 [1,1'-双环丙基]-2-辛酸甲酯 0.05±0.00a 0.01±0.00c 0.03±0.01b 0.02±0.00b 0.02±0.01bc A13 肉豆蔻酸乙酯 0.31±0.02c 0.21±0.03d 0.28±0.02c 0.40±0.03b 0.48±0.04a A14 反油酸乙酯 1.14±0.10b 1.31±0.31b 1.24±0.18b 1.72±0.06a 1.78±0.17a A15 9-十六碳烯酸乙酯 0.02±0.00a 0.01±0.00b 0.02±0.00a 0.02±0.00a 0.03±0.00a A16 十六烷酸丙酯 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.02±0.00a 0.02±0.00a A17 反式十八二烯酸乙酯 0.07±0.01a 0.04±0.01b 0.10±0.03a 0.05±0.01b 0.07±0.01a A18 9,12-十八烯酸乙酯 1.46±0.11c 1.85±0.26b 1.15±0.37c 1.94±0.67b 3.31±0.64a A19 己酸乙酯 0.17±0.01e 0.75±0.16c 0.47±0.10d 1.12±0.25b 1.30±0.21a A20 2,5-十八酸甲酯 0.01±0.00a 0.01±0.00a 0.02±0.01a 0.01±0.00a 0.02±0.00a A21 9,12-十八二烯酸正丙酯 4.40±0.02a − 2.74±0.70b 1.74±0.59c 2.15±0.30c A22 癸酸乙酯 0.03±0.00c 0.05±0.01c 0.08±0.01b 0.10±0.01b 0.20±0.01a A23 棕榈酸乙酯 0.31±0.00b 0.02±0.00d 0.03±0.01c 0.05±0.01c 1.96±0.00a A24 琥珀酸单乙酯 0.01±0.01b 0.02±0.00b − 0.03±0.00a 0.02±0.00b A25 月桂酸乙酯 − 0.02±0.00b 0.01±0.00b − 0.12±0.03a A26 9,12,15-十八碳三烯酸乙酯 0.10±0.02a 0.07±0.01b 0.06±0.01b 0.12±0.01a 0.13±0.02a A27 乙醇 3.75±0.28b 2.95±0.43c 5.45±0.68a 5.68±0.75a 5.43±0.66a A28 异戊醇 0.30±0.04a 0.10±0.01b 0.11±0.02b 0.07±0.00c 0.08±0.02c A29 亚麻酸乙酯 0.01±0.01b 0.02±0.00b − 0.03±0.00a − A30 苯甲醇 0.07±0.01a 0.04±0.00b 0.07±0.01a 0.06±0.00b − A31 糠醇 0.21±0.02a 0.07±0.02c 0.11±0.00c 0.20±0.01a 0.15±0.00b A32 1-七烷醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a − A33 苯乙醇 2.90±0.19b 2.10±0.41c 3.77±0.55a 4.26±0.18a 4.28±0.27a A34 十一乙醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a A35 十二乙醇 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a 0.01±0.00a A36 正戊醇 0.49±0.05a 0.16±0.00b 0.19±0.00b 0.09±0.00c − A37 α−(1-羟乙基)-苯丙酸 0.09±0.01c 0.65±0.14a 0.09±0.02c 0.12±0.01c 0.17±0.01b A38 正己酸 0.32±0.02a − 0.37±0.01a 0.35±0.01a − A39 棕榈酸 0.11±0.01b 0.07±0.01c 0.09±0.02b 0.11±0.01b 0.19±0.03a A40 苯甲酸 0.02±0.00b 0.02±0.00b 0.03±0.00b 0.03±0.00b 0.04±0.00a A41 乙酸 1.38±0.00b − − 2.33±0.00a 0.08±0.00c A42 11,13-二羟基四癸-5-炔酸甲酯 0.01±0.00a 0.01±0.00a − − − A43 十二烷基七聚乙二醇醚 0.01±0.00b 0.01±0.00b 0.01±0.00b 0.02±0.00a 0.01±0.00b A44 苯甲醛 0.14±0.00b 0.15±0.00a 0.12±0.02c 0.15±0.01a − A45 苯酚 0.02±0.00a 0.01±0.00b 0.02±0.00a 0.02±0.00a 0.02±0.00a A46 4-乙基愈创木酚 0.11±0.02b 0.08±0.00c 0.12±0.00b 0.19±0.00a 0.18±0.01a A47 1,2-二-4-吡啶-1,2-乙二醇 0.03±0.00c 0.01±0.00d 0.03±0.00b 0.03±0.01b 0.06±0.00a A48 十八乙二醇单十二烷基醚 0.02±0.01c 0.01±0.00d 0.02±0.00b 0.02±0.00b 0.04±0.00a A49 2-乙酰基吡咯 0.06±0.00b 0.03±0.00c 0.07±0.01b 0.07±0.00b 0.11±0.00a A50 N-甲基-2-吡咯甲醛 − 0.02±0.00c 0.01±0.00d 0.31±0.01a 0.05±0.00b 注:−表示未检出;不同小写字母表示同种化合物在不同入窖时间之间的差异显著,P<0.05。 -
[1] SUN J, ZHAO D, ZHANG F, SUN B, et al. Joint direct injection and GC-MS chemometric approach for chemical profile and sulfur compounds of sesame-flavor Chinese Baijiu (Chinese liquor)[J]. European Food Research and Technology,2018,244(1):145−160. doi: 10.1007/s00217-017-2938-7
[2] XU Y Q, ZHAO J R, LIU X, et al. Flavor mystery of Chinese traditional fermented Baijiu:The great contribution of ester compounds[J]. Food Chemistry,2022,369:130920. doi: 10.1016/j.foodchem.2021.130920
[3] ZHANG H, WANG L, TAN Y, et al. Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J]. International Journal of Food Microbiology,2021,336:108898. doi: 10.1016/j.ijfoodmicro.2020.108898
[4] GAN S H, YANG F, SAHU S K, et al. Deciphering the composition and functional profile of the microbial communities in Chinese Moutai liquor starters[J]. Frontiers in Microbiology,2019,10:1540. doi: 10.3389/fmicb.2019.01540
[5] 李凤兰, 付平, 邓代霞, 等. 酱香型第五轮次酒中挥发性物质的分析与研究[J]. 食品与发酵科技,2022,58(6):53−59. [LI F L, FU P, DENG D X, et al. Analysis and study of volatile substances in the fifth round of sauce-flavored Baijiu[J]. Food and Fermentation Science and Technology,2022,58(6):53−59.] doi: 10.3969/j.issn.1674-506X.2022.06-008 LI F L, FU P, DENG D X, et al. Analysis and study of volatile substances in the fifth round of sauce-flavored Baijiu[J]. Food and Fermentation Science and Technology, 2022, 58(6): 53−59. doi: 10.3969/j.issn.1674-506X.2022.06-008
[6] DAI Y J, TIAN Z G, MENG W N, et al. Microbial diversity and physicochemical characteristics of the Maotai-flavored liquor fermentation process[J]. Journal of Nanoscience and Nanotechnology,2020,20(7):4097−4109. doi: 10.1166/jnn.2020.17522
[7] 杨大金, 蒋英丽, 陈小林, 等. 酱香单次酒风格质量、香味组分特点与作用及工艺对其影响[J]. 酿酒科技,2004(4):35−37. [YANG D J, JIANG Y L, CHEN X L, et al. Styles and flavoring components characteristics and functions of Maotai-flavor liquor of different production turn and production techniques influence[J]. Liquor-making Science and Technology,2004(4):35−37.] doi: 10.3969/j.issn.1001-9286.2004.04.009 YANG D J, JIANG Y L, CHEN X L, et al. Styles and flavoring components characteristics and functions of Maotai-flavor liquor of different production turn and production techniques influence[J]. Liquor-making Science and Technology, 2004(4): 35−37. doi: 10.3969/j.issn.1001-9286.2004.04.009
[8] 李旭, 霍颖玙, 曹正珂, 等. 砂石板窖底在酱香型白酒大回酒轮次中的应用研究[J]. 酿酒科技,2023(4):65−69. [LI X, HUO Y Y, CAO Z K, et al. Application of sandstone pit bottom in the important production rounds of Jiangxiang Baijiu[J]. Liquor-making Science and Technology,2023(4):65−69.] doi: 10.13746/j.njkj.2022193 LI X, HUO Y Y, CAO Z K, et al. Application of sandstone pit bottom in the important production rounds of Jiangxiang Baijiu[J]. Liquor-making Science and Technology, 2023(4): 65−69. doi: 10.13746/j.njkj.2022193
[9] 黄蕴利, 黄永光, 胡建峰, 等. 酱香型白酒第二轮次酒发酵过程微生物多样性研究[J]. 中国酿造,2017,36(9):30−35. [HUANG Y L, HUANG Y G, HU J F, et al. Microbial diversity of the second rounds liquid of Moutai-flavor Baijiu during fermentation process[J]. China Brewing,2017,36(9):30−35.] HUANG Y L, HUANG Y G, HU J F, et al. Microbial diversity of the second rounds liquid of Moutai-flavor Baijiu during fermentation process[J]. China Brewing, 2017, 36(9): 30−35.
[10] 陈曦, 张成楠, 李秀婷, 等. 北京地区酱香型白酒第六轮次堆积不同位置细菌差异比较研究[J]. 酿酒科技,2023(1):15−23. [CHEN X, ZHANG C N, LI X T, et al. Differences in bacteria at different positions of the sixth-round fermentation stack of Jiangxiang Baijiu[J]. Liquor-making Science and Technology,2023(1):15−23.] doi: 10.13746/j.njkj.2022232 CHEN X, ZHANG C N, LI X T, et al. Differences in bacteria at different positions of the sixth-round fermentation stack of Jiangxiang Baijiu[J]. Liquor-making Science and Technology, 2023(1): 15−23. doi: 10.13746/j.njkj.2022232
[11] 王琳, 胡小霞, 黄永光. 茅台镇酱香型白酒不同生产轮次酿造环境的细菌菌群结构特征[J]. 食品科学,2021,42(22):185−192. [WANG L, HU X X, HUANG Y G. Characteristics of bacterial microflora structure in environmental samples from different rounds of Maotai-flavor liquor fermentation in Maotai town[J]. Food Science,2021,42(22):185−192.] doi: 10.7506/spkx1002-6630-20200708-113 WANG L, HU X X, HUANG Y G. Characteristics of bacterial microflora structure in environmental samples from different rounds of Maotai-flavor liquor fermentation in Maotai town[J]. Food Science, 2021, 42(22): 185−192. doi: 10.7506/spkx1002-6630-20200708-113
[12] 张春林, 杨亮, 李喆, 等. 酱香型白酒酒醅堆积微生物多样性及其与风味物质的关系[J]. 食品科技,2022,47(4):111−118. [ZHANG C L, YANG L, LI Z, et al. Microbial community and its relationship with volatile compounds in Moutai-flavor Baijiu stacking fermentation process[J]. Food Science and Technology,2022,47(4):111−118.] doi: 10.13684/j.cnki.spkj.2022.04.036 ZHANG C L, YANG L, LI Z, et al. Microbial community and its relationship with volatile compounds in Moutai-flavor Baijiu stacking fermentation process[J]. Food Science and Technology, 2022, 47(4): 111−118. doi: 10.13684/j.cnki.spkj.2022.04.036
[13] 胡小霞, 黄永光, 涂华彬, 等. 酱香型白酒1轮次酿造细菌的菌群结构[J]. 食品科学,2020,41(14):175−182. [HU X X, HUANG Y G, TU H B, et al. Bacterial diversity structure during the first round of pile and pit fermentation of Moutai-flavor Baijiu[J]. Food Science,2020,41(14):175−182.] HU X X, HUANG Y G, TU H B, et al. Bacterial diversity structure during the first round of pile and pit fermentation of Moutai-flavor Baijiu[J]. Food Science, 2020, 41(14): 175−182.
[14] WANG W H, XU Y Q, HUANG H Q, et al. Correlation between microbial communities and flavor compounds during the fifth and sixth rounds of sauce-flavor Baijiu fermentation[J]. Food Research International,2021,150:110741. doi: 10.1016/j.foodres.2021.110741
[15] XU Y Q, WU M Q, NIU J L, et al. Characteristics and correlation of the microbial communities and flavor compounds during the first three rounds of fermentation in Chinese sauce-flavor Baijiu[J]. Foods,2023,12:207. doi: 10.3390/foods12010207
[16] XU Y Q, WU M Q, ZHAO D, et al. Simulated fermentation of strong-flavor Baijiu through functional microbial combination to realize the stable synthesis of important flavor chemicals[J]. Foods,2023,12:644. doi: 10.3390/foods12030644
[17] 宫俐莉, 李安军, 孙金沅, 等. 溶剂辅助风味蒸发法与顶空-固相微萃取法结合分析白酒酒醅中挥发性风味成分[J]. 食品与发酵工业,2016,42(9):169−177. [GONG L L, LI A J, SUN J Y, et al. Analysis on volatile flavor compounds of fermented grains by SAFE and HS-SPME coupled with GC-MS[J]. Food and Fermentation Industries,2016,42(9):169−177.] doi: 10.13995/j.cnki.11-1802/ts.201609030 GONG L L, LI A J, SUN J Y, et al. Analysis on volatile flavor compounds of fermented grains by SAFE and HS-SPME coupled with GC-MS[J]. Food and Fermentation Industries, 2016, 42(9): 169−177. doi: 10.13995/j.cnki.11-1802/ts.201609030
[18] NAM Y D, LEE S Y, LIM S I. Microbial community analysis of Korean soybean pastes by nextgeneration sequencing[J]. International Journal of Food Microbiology,2012,155(1-2):36−42. doi: 10.1016/j.ijfoodmicro.2012.01.013
[19] 沈世明, 何猛超, 刘桂珍, 等. 酱香型大曲贮存初期微生物及风味物质变化的分析研究[J]. 酿酒科技,2023(2):128−135. [SHEN S M, HE M C, LIU G Z, et al. Changes of microorganisms and flavor substances of Jiangxiang Daqu in the early stage of storage[J]. Liquor-making Science and Technology,2023(2):128−135.] doi: 10.13746/j.njkj.2022204 SHEN S M, HE M C, LIU G Z, et al. Changes of microorganisms and flavor substances of Jiangxiang Daqu in the early stage of storage[J]. Liquor-making Science and Technology, 2023(2): 128−135. doi: 10.13746/j.njkj.2022204
[20] 王雪山. 不同环境清香类型白酒发酵微生物种群结构比较及溯源解析[D]. 无锡:江南大学, 2018. [WANG X S. Microbial community structure and microbial source tracking of Chinese light-flavor liquor fermentation in different environments[D]. Wuxi:Jiangnan University, 2018.] WANG X S. Microbial community structure and microbial source tracking of Chinese light-flavor liquor fermentation in different environments[D]. Wuxi: Jiangnan University, 2018.
[21] WANG X S, DU H, XU Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor Baijiu[J]. International Journal of Food Microbiology,2017,244:27−35. doi: 10.1016/j.ijfoodmicro.2016.12.018
[22] WANG H Y, ZHANG X J, ZHAO L P, et al. Analysis and comparison of the bacterial community in fermented grains during the fermentation for two different styles of Chinese Baijiu[J]. Journal of Industrial Microbiology and Biotechnology,2008,35(6):603−609. doi: 10.1007/s10295-008-0323-z
[23] 王玉荣, 侯强川, 田龙新, 等. 酱香白酒第四轮次窖池不同分层酒醅微生物群落与理化性质差异分析[J]. 现代食品科技,2023,39(2):180−187. [WANG Y R, HOU Q C, TIAN L X, et al. Differences in microbial community and physicochemical properties of different layers of fermentative material in the pit of the fourth round of Jiangxiang Baijiu[J]. Modern Food Science and Technology,2023,39(2):180−187.] doi: 10.13982/j.mfst.1673-9078.2023.2.0318 WANG Y R, HOU Q C, TIAN L X, et al. Differences in microbial community and physicochemical properties of different layers of fermentative material in the pit of the fourth round of Jiangxiang Baijiu[J]. Modern Food Science and Technology, 2023, 39(2): 180−187. doi: 10.13982/j.mfst.1673-9078.2023.2.0318
[24] WOLFE B E, BUTTON J E, ANTARELLI M, et al. Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J]. Cell,2014,158(2):422−433. doi: 10.1016/j.cell.2014.05.041
[25] HU X, DU H, REN C, et al. Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese Baijiu fermentation pit muds[J]. Applied and Environmental Microbiology,2016,82(8):2506−2515. doi: 10.1128/AEM.03409-15
[26] LI X R, MA E B, YAN L Z, et al. Bacterial and fungal diversity in the traditional Chinese Baijiu fermentation process[J]. International Journal of Food Microbiology,2011,146(1):31−37. doi: 10.1016/j.ijfoodmicro.2011.01.030
[27] 李小龙, 吴群, 徐岩. 乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替[J]. 微生物学报,2019,46(1):1−10. [LI X L, WU Q, XU Y. Synergism between ethanol and acidity drives microbial community succession during roasted sesame-flavor liquor solid-state fermentation[J]. Microbiology China,2019,46(1):1−10.] LI X L, WU Q, XU Y. Synergism between ethanol and acidity drives microbial community succession during roasted sesame-flavor liquor solid-state fermentation[J]. Microbiology China, 2019, 46(1): 1−10.
[28] 吴建峰. 白酒中四甲基吡嗪全程代谢机理研究[D]. 无锡:江南大学, 2013. [WU J F. Study on the biosynthesis mechanism of tetra-methyl pyrazine during the Chinese liquor brewing[D]. Wuxi:Jiangnan University, 2013.] WU J F. Study on the biosynthesis mechanism of tetra-methyl pyrazine during the Chinese liquor brewing[D]. Wuxi: Jiangnan University, 2013.
[29] 郝飞. 枯草芽孢杆菌发酵生产乙偶姻的研究[D]. 无锡:江南大学, 2013. [HAO F. Improvement to acetoin fermentation technology by Bacillus subtilis CCTCC M 208157[D]. Wuxi:Jiangnan University, 2013.] HAO F. Improvement to acetoin fermentation technology by Bacillus subtilis CCTCC M 208157[D]. Wuxi: Jiangnan University, 2013.
[30] WANG L, WANG Y Y, WANG D Q, et al. Dynamic changes in the bacterial community in Moutai Baijiu fermentation process characterized by deep sequencing[J]. Journal of the Institute of Brewing,2015,121(4):603−608. doi: 10.1002/jib.259
[31] 戴奕杰. 酱香型白酒酿造过程中微生物群落组成及其与酒品质的关系[D]. 长沙:湖南农业大学, 2019. [DAI Y J. The Composition of microbial community and its relationship with liquor quality in the brewing process of Maotai-flavor liquor[D]. Changsha:Hunan Agricultural University, 2019.] DAI Y J. The Composition of microbial community and its relationship with liquor quality in the brewing process of Maotai-flavor liquor[D]. Changsha: Hunan Agricultural University, 2019.
[32] 张中义, 畅晓霞, 钟其顶. 酒曲酶系、菌系特征及酿造过程中微生物动态变化[J]. 酿酒,2008(5):24−29. [ZHANG Z Y, CHANG X X, ZHONG Q D. Liquor Qu fungus system and enzymatic system character and microbial dynamic variety during vintage[J]. Liquor Making,2008(5):24−29.] ZHANG Z Y, CHANG X X, ZHONG Q D. Liquor Qu fungus system and enzymatic system character and microbial dynamic variety during vintage[J]. Liquor Making, 2008(5): 24−29.
[33] 曾娟, 施思, 吴正云, 等. 浓香型白酒醅中高产酒精酵母菌的定向筛选及分子鉴定[J]. 中国酿造,2011(2):26−28. [ZENG J, SHI S, WU Z Y, et al. Directional selection and molecular analysis of yeast strains with high alcohol yield in fermented grains of strong-flavor liquor[J]. China Brewing,2011(2):26−28.] ZENG J, SHI S, WU Z Y, et al. Directional selection and molecular analysis of yeast strains with high alcohol yield in fermented grains of strong-flavor liquor[J]. China Brewing, 2011(2): 26−28.
[34] 王保兴, 侯英, 杨蕾, 等. SBSE-TDs-GC-MS测定白酒中酯类成分的方法研究[J]. 食品工业科技,2008(7):250−253. [WANG B X, HOU Y, YANG L, et al. Determination of esters in wine using stir bar sorptive extraction-thermal desorption and gas chromatography-mass spectrometry[J]. Science and Technology of Food Industry,2008(7):250−253.] doi: 10.13386/j.issn1002-0306.2008.07.065 WANG B X, HOU Y, YANG L, et al. Determination of esters in wine using stir bar sorptive extraction-thermal desorption and gas chromatography-mass spectrometry[J]. Science and Technology of Food Industry, 2008(7): 250−253. doi: 10.13386/j.issn1002-0306.2008.07.065
[35] FRANITZA L, GRANVOGL M, SCHIEBERLE P. Influence of the production process on the key aroma compounds of rum:From molasses to the spirit[J]. Journal of Agricultural and Food Chemistry,2016,64(47):9041−9053. doi: 10.1021/acs.jafc.6b04046
[36] 张娇娇, 郭松波, 余硕文, 等. 基于多元色谱和主成分分析解析酱香型白酒大回酒风味品质研究[J]. 中国酿造, 2021, 40(11):161−168. [ZHANG J J, GUO S B, YU S W, et al. Flavor quality analysis of sauce-flavor Dahui-jiu based on multivariate chromatography and principal component analysis[J], China Brewing, 2021, 40(11):161−168.] ZHANG J J, GUO S B, YU S W, et al. Flavor quality analysis of sauce-flavor Dahui-jiu based on multivariate chromatography and principal component analysis[J], China Brewing, 2021, 40(11): 161−168.
[37] 戴奕杰, 李宗军, 田志强, 等. 酱香型白酒的轮次酒以及“二次制曲”过程中的风味物质分析[J]. 食品研究与开发,2019,40(19):24−32. [DAI Y J, LI Z J, TIAN Z Q, et al. Flavor components analysis of rounds wine and during the process of secondary starter-making of Maotai-flavor Baijiu[J]. Food Research and Development,2019,40(19):24−32.] doi: 10.12161/j.issn.1005-6521.2019.19.005 DAI Y J, LI Z J, TIAN Z Q, et al. Flavor components analysis of rounds wine and during the process of secondary starter-making of Maotai-flavor Baijiu[J]. Food Research and Development, 2019, 40(19): 24−32. doi: 10.12161/j.issn.1005-6521.2019.19.005
[38] 范文来, 胡光源, 徐岩, 等. 药香型董酒的香气成分分析[J]. 食品与生物技术学报,2012,31(8):810−819 [FAN W L, HU G Y , XU Y, et al. Analysis of aroma components in Chinese herbaceous aroma type liquor[J]. Journal of Food Science and Biotechnology,2012,31(8):810−819.] FAN W L, HU G Y , XU Y, et al. Analysis of aroma components in Chinese herbaceous aroma type liquor[J]. Journal of Food Science and Biotechnology, 2012, 31(8): 810−819.
[39] 聂庆庆, 范文来, 徐岩, 等. 洋河系列绵柔型白酒香气成分研究[J]. 食品工业科技,2012,33(12):68−74. [NIE Q Q, FAN W L, XU Y, et al. Identification of aroma compounds of supple and mellow aroma style liquors of Yanghe series[J]. Journal of Food Science and Biotechnology,2012,33(12):68−74.] doi: 10.13386/j.issn1002-0306.2012.12.033 NIE Q Q, FAN W L, XU Y, et al. Identification of aroma compounds of supple and mellow aroma style liquors of Yanghe series[J]. Journal of Food Science and Biotechnology, 2012, 33(12): 68−74. doi: 10.13386/j.issn1002-0306.2012.12.033
[40] 吴钱弟, 周榆林, 王久明, 等. 酱香型白酒第四、五轮次基酒中游离氨基酸分析[J]. 中国酿造,2020,39(5):54−59. [WU Q D, ZHOU Y L, WANG J M, et al. Analysis of free amino acids in the fourth and fifth rounds base liquor of sauce-flavor Baijiu[J]. China Brewing,2020,39(5):54−59.] doi: 10.11882/j.issn.0254-5071.2020.05.011 WU Q D, ZHOU Y L, WANG J M, et al. Analysis of free amino acids in the fourth and fifth rounds base liquor of sauce-flavor Baijiu[J]. China Brewing, 2020, 39(5): 54−59. doi: 10.11882/j.issn.0254-5071.2020.05.011
[41] 韩兴林, 潘学森, 刘民万, 等. 云门酱香型白酒风味特征的分析研究[J]. 酿酒科技,2014(10):6−8. [HAN X L, PAN X S, LIU M W, et al. Analysis of the flavoring components of Yunmen Jiangxiang Baijiu (liquor)[J]. Liquor-Making Science and Technology,2014(10):6−8.] doi: 10.13746/j.njkj.2014.0327 HAN X L, PAN X S, LIU M W, et al. Analysis of the flavoring components of Yunmen Jiangxiang Baijiu (liquor)[J]. Liquor-Making Science and Technology, 2014(10): 6−8. doi: 10.13746/j.njkj.2014.0327
[42] 孙利林, 李立郎, 胡萍, 等. 酱香型白酒第四轮次酒酿造过程中细菌多样性分析[J]. 中国酿造,2020,39(5):35−39. [SUN L L, LI L L, HU P, et al. Analysis of bacterial diversity during the fourth round of sauce-flavor Baijiu fermentation[J]. China Brewing,2020,39(5):35−39.] SUN L L, LI L L, HU P, et al. Analysis of bacterial diversity during the fourth round of sauce-flavor Baijiu fermentation[J]. China Brewing, 2020, 39(5): 35−39.
[43] XU Y Q, WANG X C, LIU X, et al. Discovery and development of a novel short-chain fatty acid ester synthetic biocatalyst under aqueous phase from Monascus purpureus isolated from Baijiu[J]. Food Chemistry,2021,338:12805.
[44] 许春艳, 孙宝国, 徐友强, 等. 合成己酸乙酯酯化酶产生菌的鉴定及产酶条件优化[J]. 中国食品学报,2020,20(5):138−147. [XU C Y, SUN B G, XU Y Q, et al. Identification of ethyl hexanoate synthesis esterifying enzymes production strain and its enzyme production conditions optimization[J]. Journal of Chinese Institute of Food Science and Technology,2020,20(5):138−147.] doi: 10.16429/j.1009-7848.2020.05.018 XU C Y, SUN B G, XU Y Q, et al. Identification of ethyl hexanoate synthesis esterifying enzymes production strain and its enzyme production conditions optimization[J]. Journal of Chinese Institute of Food Science and Technology, 2020, 20(5): 138−147. doi: 10.16429/j.1009-7848.2020.05.018
[45] 石馨, 惠明, 田青, 等. 异常威克汉姆酵母Y-1对模拟固态发酵白酒酒醅理化指标及风味的影响[J]. 中国酿造,2022,41(9):31−36. [SHI X, HUI M, TIAN Q, et al. Effects of Wickerhamomyces anomalus Y-1 on physicochemical parameters and flavor of Baijiu fermented grains with simulated solid-state fermentation[J]. China Brewing,2022,41(9):31−36.] SHI X, HUI M, TIAN Q, et al. Effects of Wickerhamomyces anomalus Y-1 on physicochemical parameters and flavor of Baijiu fermented grains with simulated solid-state fermentation[J]. China Brewing, 2022, 41(9): 31−36.





 下载:
下载:
 下载:
下载:
