Determination of Amylose and Amylopectin in Sorghum by Iodine Colorimetric Method
-
摘要: 目的:高粱中淀粉含量与其衍生物的品质密切相关,对其中直链淀粉(Am)和支链淀粉(Ap)含量的测定很有必要。本文采用碘比色法对高粱籽粒中淀粉(Am、Ap)含量的进行测定,探讨最佳预处理与检测方法。方法:以高粱籽粒中的Am与Ap为主要研究对象,比较碘比色法中的三种检测方法,即:单波长混标法(I)、双波长单标法(II)及双波长混标法(III),通过精密度、检出限、定量限等对三种测定方法进行了一系列的方法学验证,并对预处理及测定过程中NaOH和KOH分散剂、糊化温度、糊化时间、乙酸和盐酸pH调节剂、碘试剂用量和显色时间进行了比较优化,最后通过重复性验证、回收率验证和常见谷物样品的测定验证了最佳方法的准确性。结果:三种方法的检出限和定量限均能满足实际样品的测定范围需求,其中检出限:Am均≤0.55 mg/L,Ap均≤2.75 mg/L,定量限:Am均≤1.65 mg/L,Ap均≤8.33 mg/L;样品准确率实验发现,混标溶液标曲得到的误差绝对值较小(0.13%),但单标溶液标曲误差较大(7.47%),因此需要选用混标溶液配制标曲;高粱籽粒中淀粉的最佳预处理与测定条件是:以NaOH作分散剂,以乙酸或盐酸为pH调节剂,70 ℃糊化10~20 min,采用标准碘试剂浓度,显色20~30 min内测定结果较为稳定、准确;测定方法中,双波长混标法(III)所测定的Am、Ap及总淀粉含量准确,且与理论粗淀粉含量吻合,重复性和回收率(80%~120%)高。结论:碘比色双波长混标法是测定高粱籽粒中直链淀粉和支链淀粉含量的最佳测定方法,可用于实际样品的测定。Abstract: Objective: The content of starch was closely related to the derivative products of sorghum. It was very important to determination of the content of starch, including amylose (Am) and amylopectin (Ap) in sorghum. In this study, the content of Am and Ap was determined by the iodine colorimetry. And conditions of pretreatment and determination were optimized. Method: Using Am and Ap in sorghum as the main object, the content of starch was measured by the iodine colorimetry with different detection methods, including the single wavelength mixed standard method (I), the dual wavelength single standard method (II), and the dual wavelength mixed standard method (III). A series of methodological verifications, such as the precision, detection limit and quantification limit, were compared. And the conditions of pretreatment, such as NaOH and KOH dispersant, gelatinization temperature and time, acetic acid and hydrochloric acid pH regulator, dosage of iodine reagent and color rendering time were optimized. The repeatability verification recovery rate and the determination of common grain samples of the obtained method was also tested, which verified the accuracy of the method. Result: The detection limits and quantification limits of the three methods could meet the requirements of the actual sample measurement range, with detection limits of Am≤0.55 mg/L, Ap≤2.75 mg/L, quantification limits of Am≤1.65 mg/L, Ap≤8.33 mg/L. The absolute error of the accuracy experiments was 0.13% from the mixed standard solution calibration curve, the single standard solution calibration curve error was relatively large (7.47%), thus the mixed standard solution was better to prepare the calibration curve. The optimal preprocessing of sorghum: Using NaOH as the dispersant, the gelatinization temperature at 70 ℃ for 10~20 min, with acetic acid or hydrochloric acid as pH regulator, using standard iodine reagent concentration, controlling the coloring time at 20~30 min, the determination results were relatively stable and accurate. The total content of starch was consistent with the starch content in theory, and it had a good repeatability and recovery (80%~120%). Conclusion: In summary, the dual wavelength mixed standard method of iodine colorimetry was a best method for measuring the content of Am and Ap in sorghum, and it was more suitable for the determination of actual samples in crops.
-
Keywords:
- amylose /
- amylopectin /
- iodine colorimetry /
- sorghum /
- analytical detection
-
白酒酿造的原料包括高粱、玉米、小麦、大米、糯米等多种粮食[1],其中高粱在白酒酿造中具有出酒率高,醇厚浓郁,香正甘冽等优点,远胜其他酿酒原料[2]。迄今为止,高粱的种类已经超过了10000种,大多数高粱品种在大小、结构、色素沉着、质地、硬度和生化特性上都有差异[3]。但并不是所有高粱都适合酿酒,只有品质优良的高粱才能酿出品质优异的好酒。高粱的主要成分是淀粉(Starch,St,占70%左右)[4]。淀粉是由直链淀粉(Amylose,Am)和支链淀粉(Amylopectin,Ap)两种主要成分组成的复杂微粒,通常伴有水、脂类、磷脂、可溶性/不可溶性纤维和一些矿物质[5]。Am与Ap的比例因淀粉的植物来源而异。除高Am[6]和蜡质淀粉[7]外,大部分原生淀粉中Am含量在20%~30%之间[8]。用于酿造白酒的高粱中Am和Ap的含量直接关系到白酒的质量和产量[9]。因此需要对酿酒高粱中的Am和Ap的含量进行准确测定,从而筛选出最佳的酿酒原料。目前测定Am和Ap含量的方法有体积排阻色谱分析法[10]、差示扫描量热法[11]、近红外光谱分析法[12-13]、连续流动测定法[14]、伴刀豆球蛋白法[15]、碘亲和力滴定法[16]等。这几种测定方法都是基于碘比色法衍生而来,但这些测定法由于仪器及试剂价格高、操作复杂等难于推广应用[17-18]。
碘结合法是最传统且常用的方法[19],最先由Mccready和Hassid[20]提出用于马铃薯淀粉中Am的测定,具有易操作、成本低、速度快、准确度高的特点。国标方法就是采用碘结合法进行测定,如GB/T 15683-2008大米直链淀粉含量的测定[21]和GB 7648-1987水稻、玉米、谷子籽粒直链淀粉测定法[22]分别在单波长720、620 nm处测定Am的含量,但该方法不能直接测定Ap含量,需用理论总淀粉含量减去Am含量计算得到,因此测定结果有一定的局限性。2012年发布的江苏省地标DB32/T 2265-2012[23]采用双波长分光光度法测定鲜食玉米中Am和Ap含量,可以同时测定Am和Ap的含量,近些年,许多文献研究也提出碘结合-双波长法,由于排除了相应干扰组分的影响,具有更高的精密度和准确度[24-25]。双波长法的原理是利用溶液中某溶质对两个波长的吸光度(Absorbance,ABS)差值消减两类淀粉吸收背景的相互影响,选用了两个测定波长和两个参比波长,可以同时测出Am和Ap的含量,因此提高了测定的灵敏度和选择性[26]。
然而,目前研究报道的双波长法多采用单标溶液绘制标曲[23],但待测样品中同时含有Am和Ap的混合组分,因此单标溶液做标曲是否合理需进一步验证,而单波长法通常采用混标溶液配制标曲,溶液本身可扣除相应支链淀粉的影响,具有一定的合理性[27]。这两种测定方法和原理不同,对同一样品中Am和Ap的测定可能给出不同的值[28]。因此需要详细地考察单标溶液和混标溶液,单波长法和双波长法对测定结果的影响,以筛选出最佳测定Am和Ap含量的方法。另外,相关文献报道大多集中于木薯、玉米、糯米粉等的测定[29],而测定高粱的相关报道较少。因此,本文以高粱样品为主要测定对象,通过单波长混标法(I)、双波长单标法(II)、双波长混标法(III)三种方法进行检出限、定量限、精密度的方法探讨,并对高粱样品处理过程中分散剂(NaOH、KOH)进行比较,对高粱糊化温度、糊化时间、乙酸和盐酸pH调节剂、碘试剂用量和显色时间等因素进行考察,进而筛选出适宜测定酿酒高粱中Am和Ap测定的最佳方法,以期为酿酒原料的测定方法改进提供参考。
1. 材料与方法
1.1 材料与仪器
直链淀粉Am(马铃薯,A8160)、支链淀粉Ap(玉米,A8150) 标准品,Solarbio公司;氢氧化钠、氢氧化钾、乙酸 分析纯,国药集团化学试剂有限公司;碘 分析纯,天津市科密欧试剂有限公司;碘化钾 分析纯,天津市光复科技发展有限公司;高粱籽粒 购自市场。
TU-1810型双波长紫外分光光度计 北京普析通用仪器有限责任公司;Seven Excellence型pH计 梅特勒-托利多国际贸易(上海)有限公司。
1.2 实验方法
1.2.1 标准溶液的配制
Am标准溶液(1 mg/mL):取烘干(55~56 ℃真空干燥)的马铃薯Am纯品,称取重量相当于含0.1000 g淀粉,放入100 mL容量瓶中,加入1 mL无水乙醇湿润样品,再加9 mL的1 mol/L的NaOH溶液,于沸水浴分散10 min,迅速冷却后,用水定容;Ap标准溶液(1 mg/mL):选择与待测谷物样品相应的蜡质谷物标准品,称取重量相当于含0.1000 g淀粉,放入100 mL容量瓶中,加1 mL无水乙醇,再加9 mL的1 mol/L的NaOH溶液,于沸水浴中加热10 min,迅速冷却后,用水定容。
1.2.2 标准曲线的绘制
用50 mL容量瓶配制三种测定方法的标准溶液,其中单波长混标法(方法I)参考GB 7648-1987绘制Am的标准曲线;双波长单标法(方法II)参考DB 32/T 2265-2012中7.2绘制单标溶液的双波长Am、Ap的标准曲线;双波长混标法(方法III)按照St含量一定,Am和Ap不同比例进行配制,具体用量见表1;加入一定量Am和Ap后,加入25 mL蒸馏水,0.5 mL浓度为1 mol/L乙酸溶液调节pH,再加入0.5 mL碘试剂后用蒸馏水定容至刻度。其中单波长法的测定波长为620 nm,双波长法通过20 mg/L的Am标准溶液和100 mg/L的Ap标准溶液进行全谱扫描得到测定波长和参比波长。
表 1 三种方法绘制标曲的Am和Ap用量Table 1. Amounts of Am and Ap for plotting standard curves by three methods序号 方法 I II III Am(mL) Ap(mL) Am(mL) Ap(mL) Am(mL) Ap(mL) 1 0 5.00 0.30 2.00 0 5.00 2 0.25 4.75 0.50 2.50 0.50 4.50 3 0.50 4.50 0.70 3.00 1.00 4.00 4 1.00 4.00 0.90 3.50 1.50 3.50 5 1.50 3.50 1.10 4.00 2.00 3.00 6 2.00 3.00 1.30 4.50 2.50 2.50 7 / / / 5.00 3.00 2.00 8 / / / / 3.50 1.50 1.2.3 样品测定
按国标法(GB 7648-1987)对样品进行处理,并参考ZBX 66027-87 粗淀粉测定方法测定样品的水分和粗淀粉含量。具体操作方法为:称取粉碎后的绝干样品0.1000 g,加入1.0 mL乙醇溶液浸润样品,用9 mL NaOH溶液分散10~20 min,加蒸馏水定容至100 mL,摇匀静置溶液澄清,移取上清液5.0 mL至100 mL容量瓶中,加入25 mL蒸馏水,以0.1 mol/L盐酸溶液调节pH至3左右,再加入1.0 mL碘试剂,加蒸馏水定容至刻度,于室温静置10 min后,以样品空白液为对照,用1 cm比色皿,分别用单波长混标法(I)、双波长单标法(II)及双波长混标法(III)三种方法测定样品液吸光值,再通过标准曲线进行定量分析。结果计算:
(1) (2) 式中:W直表示0.1 g试样中Am的质量,mg;其中W支与W直计算公式相同;C表示标准曲线查得的样品液中Am或Ap的浓度,mg/L;W总表示0.1 g试样中St的质量,mg。
1.2.4 高粱样品测定条件的选择
参考1.2.3方法进一步对样品测定进行优化实验,主要考察:NaOH和KOH分散剂、糊化温度(50、60、70、80、90和100 ℃)、糊化时间(5、10、20、30、40、50、60 min)、1 mol/L盐酸或乙酸溶液调节pH、碘试剂加入量(0.25、0.5、1.0、1.5、2.0、2.5、3.0、5.0 mL)和显色时间稳定性(1、3、5、10、20、30、60 min)。通过以上单因素实验,考察高粱样品中Am、Ap含量的最佳测定条件,同时考察三种测定方法的准确性,并对测定方法进行重复性验证,回收率测定和样品普适性验证。
1.2.5 样品准确率测定
分别移取1 mg/mL的Am、Ap标准贮备液制备三个不同浓度(其中Am理论测得值为30、20、10 mg/L,Ap理论测得值为70、80、90 mg/L)混合样品溶液,通过三种方法验证已知浓度溶液中Am、Ap含量与理论值的准确率。
1.2.6 精密度、检出限、定量限的测定
称取等量的10份高粱样品,分别用三种方法测定样品的Am、Ap含量,计算得到样品的St含量、平均值、标准偏差(SD)、精密度(RSD)、检出限和定量限,其中,平均值、精密度通过样品的百分含量计算得到,检出限和定量限通过样品吸光度值计算得到。
1.3 数据处理
每组实验均进行三次平行实验,所有结果均以“平均值”的形式表示。数据处理软件、数据分析软件和绘图软件使用Excel 97-2003、SPSS22.0软件和Origin9.0进行处理;实验结果用SPSS 22.0的单因素分析(analysis of variance, ANOVA)法进行统计分析。
2. 结果与分析
2.1 标准曲线
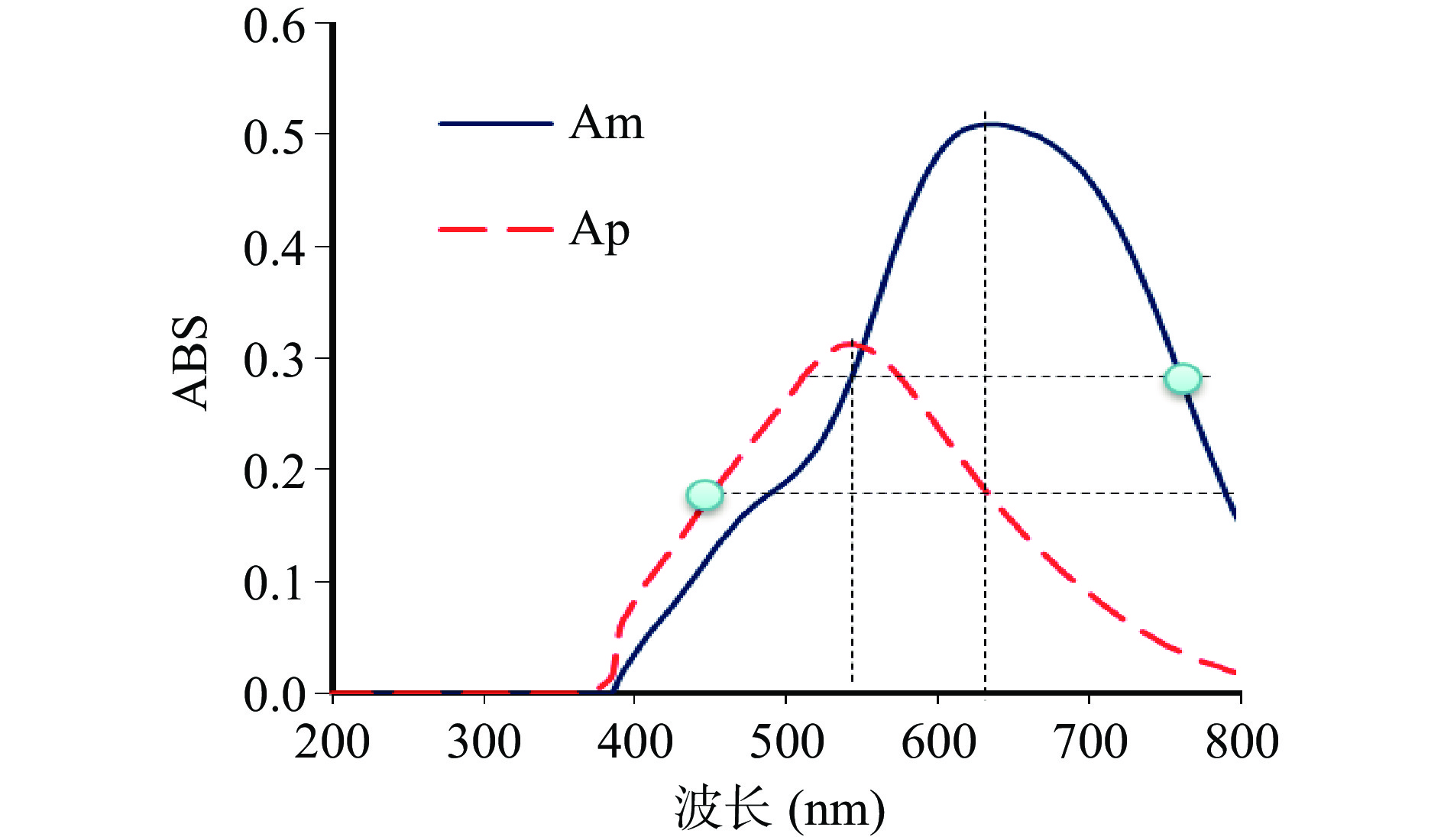
单波长混标法在620 nm波长处进行测定得到标准曲线,如表2所示,双波长法(方法II和III)通过Am和Ap得到全谱扫描图,如图1所示,再根据原理[24]得到Am最大吸收波长λ1=635 nm,参比波长λ2 =450 nm,Ap的测定波长λ3 =540 nm,参比波长λ4 =760 nm。按照双波长测定原理分别在λ635、λ450两波长下测定ΔA直,在λ540、λ760两波长下测定ΔA支,以ΔA为纵坐标,Am和Ap浓度(mg/L)为横坐标,绘制双波长混合标曲的Am、Ap标准曲线(见表2),三种测定方法所得标曲均具有良好的线性回归系数:R2>0.996。
表 2 三种方法测得的标准曲线Table 2. Standard curves measured by three methods方法 Am Ap I y=0.02x+0.1586 R2=0.9973 / / II y=0.0186x−0.00254 R2=0.9999 y=0.01835x+0.0372 R2=0.9968 III y=0.00258x+0.0385 R2=0.9963 y=0.00275x−0.00302 R2=0.9987 2.2 方法学验证
2.2.1 配制已知浓度样品溶液验证方法准确率
结果如表3所示。方法I和方法III具有较高的准确率(绝对误差<0.5%),是因为方法I和方法III均采用Am和Ap的混合溶液进行标曲配制,可以从溶液本身扣除部分彼此之间的吸光度值影响[30],其中方法III比方法I更接近100%,主要是因为方法III采用了双波长法,在相应最大吸光波长处能更有效的扣除彼此吸光值之间的干扰[31]。方法II的误差较高(7.47%),虽然方法II采用双波长法测定,也可以在彼此吸光波长处扣除吸光值的干扰,但由于采用单标溶液配制标曲,无法从实际溶液本身扣除干扰,导致同浓度溶液测得的吸光度小于混标溶液的吸光度,因此得到的样品溶液浓度偏高,淀粉含量高于实际值。
表 3 三种方法测定标准样品的准确性分析Table 3. Accuracy analysis of standard samples determined by three methods配制样品 方法I
(mg/L)准确率
(%)方法II
(mg/L)准确率
(%)方法III
(mg/L)准确率
(%)30% Am 29.302 97.67 33.458 111.52 29.782 99.27 20% Am 19.677 98.39 23.193 115.97 19.936 99.68 10% Am 10.339 103.39 12.283 122.83 10.021 100.21 70% Ap 70.698 100.98 67.28 96.11 70.056 100.08 80% Ap 80.323 100.40 78.553 98.19 80.015 100.02 90% Ap 89.661 99.62 90.189 100.21 89.948 99.94 平均值 / 100.08 / 107.47 / 99.87 误差(%) / 0.08 / 7.47 / -0.13 2.2.2 精密度、检出限和定量限
结果如表4所示,几种测定方法的变异系数均小于8%,说明三种测定方法均具有较高的准确度和精密度。通过公式计算检出限和定量限(公式(3)、公式(4)),发现三种测定方法对于Am的检出限均≤0.55 mg/L,而Ap在高粱中含量较高,因此检出限也比Am高,Ap≤2.75 mg/L,定量限:Am均≤1.65 mg/L,Ap均≤8.33 mg/L,均符合实际高粱样品的测定需求。因此,高粱样品的精密度、检出限和定量限均符合样品中淀粉含量的检测要求。进一步通过酸水解滴定法测得高粱的粗淀粉含量为64.1%,与三种测定方法得到的St含量进行对比,其中方法I只能测定Am的含量,具有局限性,无法与实际粗淀粉含量进行比较,表4中方法II得到的St含量高于实际淀粉含量20%左右,而方法III得到的St含量与之接近,说明方法III测定结果更符合实际值,但方法III得到的St含量差异较大,标准偏差SD为3.68,因此需要对实验方法进行优化,提高方法的准确率和精密度。
表 4 三种方法对10份高粱样品淀粉含量的测定比较(%)Table 4. Comparison of starch content of 10 sorghum samples determined by three methods (%)序号 方法I 方法II 方法III Am Ap St Am Ap St Am Ap St 1 12.83 87.17 100 16.05 83.95 93.58 22.73 77.27 66.09 2 13.43 86.57 100 15.61 84.39 94.82 19.57 80.43 75.64 3 13.23 86.77 100 12.62 87.38 95.73 17.69 82.31 68.27 4 13.13 86.87 100 15.57 84.43 90.49 21.81 78.19 62.89 5 12.83 87.17 100 15.49 84.51 95.55 21.80 78.20 67.89 6 12.83 87.17 100 15.73 84.27 94.09 22.31 77.69 66.34 7 12.53 87.47 100 15.54 84.46 93.87 22.06 77.94 66.13 8 12.63 87.37 100 15.14 84.86 93.44 21.54 78.46 65.69 9 13.23 86.77 100 13.89 86.11 86.17 19.28 80.72 62.09 10 13.03 86.97 100 16.53 83.47 88.89 22.25 77.75 66.03 平均值 12.97 87.03 100 15.22 84.78 92.66 21.10 78.90 66.71 SD 0.29 0.29 0.00 1.14 1.14 3.13 1.66 1.66 3.68 RSD 2.22 0.33 0.00 7.48 1.34 3.38 7.87 2.11 5.52 检出限(mg/L) 0.49 / / 0.55 2.75 / 0.53 2.35 / 定量限(mg/L) 1.47 / / 1.65 8.33 / 1.61 7.13 / 注:Am和Ap表示占淀粉总量的百分比;St表示占试样的百分比;表9同。 检出限和定量限的计算公式:
(3) (4) 式中:δ表示10份样品空白显色液吸光值的标准偏差;S表示Am、Ap标准曲线的斜率,斜率的具体数值即对应表1中标曲方程中的斜率。
进一步以高粱样品的单因素优化实验考察高粱样品中Am、Ap含量的最佳测定条件,同时考察三种测定方法的准确性,并对方法进行重复性验证,回收率测定和样品普适性验证。
2.3 测定高粱样品的优化实验
2.3.1 NaOH和KOH对高粱样品中Am、Ap含量的影响
单波长和双波长的测定方法中均包括碱分散样品的步骤,充分分散样品有利于淀粉溶液的均一性,最常用的就是NaOH溶液,也有研究提出KOH具有更高的分散性[28]。因此通过实验对比,考察KOH和NaOH对高粱淀粉的分散效果。显色结果如图2所示,KOH分散的高粱样品与碘试剂络合显色后,颜色偏紫,NaOH分散的样品则颜色偏蓝,进一步通过三种方法测量Am、Ap的含量进行对比,结果如表5所示,发现NaOH分散的样品中Am含量在15.54%~16.90%之间,而KOH分散的样品中,Am含量仅为3.75%~6.25%,两种分散剂测定结果相差较大,对比文献[32]发现NaOH分散得到的值更符合理论结果,与多种仪器方法检测结果一致;而KOH具有更强的碱性,导致溶液pH过高,虽然对Ap分散效果更好(得到的Ap含量更高,见表5),但双波长法测定同时含有Am和Ap的混合样品,需扣除Am和Ap之间的干扰,而KOH分散得到的Am含量过低,不符合高粱中Am/Ap的正常比例。如果是单一的支链淀粉溶液,则选用KOH能达到更好的分散效果[33],但本文中高粱籽粒的测定则选用NaOH做分散剂更符合实际结果。
表 5 NaOH和KOH分散高粱样品测定Am,Ap的含量Table 5. Determination of Am and Ap in NaOH and KOH dispersed sorghum sample方法 分散剂种类 NaOH KOH Am(%) Ap(%) Am(%) Ap(%) 方法I 15.54 84.46 6.24 93.76 方法II 16.90 83.10 3.75 96.25 方法III 15.75 84.25 6.25 93.75 2.3.2 糊化温度对高粱样品吸光度/St含量的影响
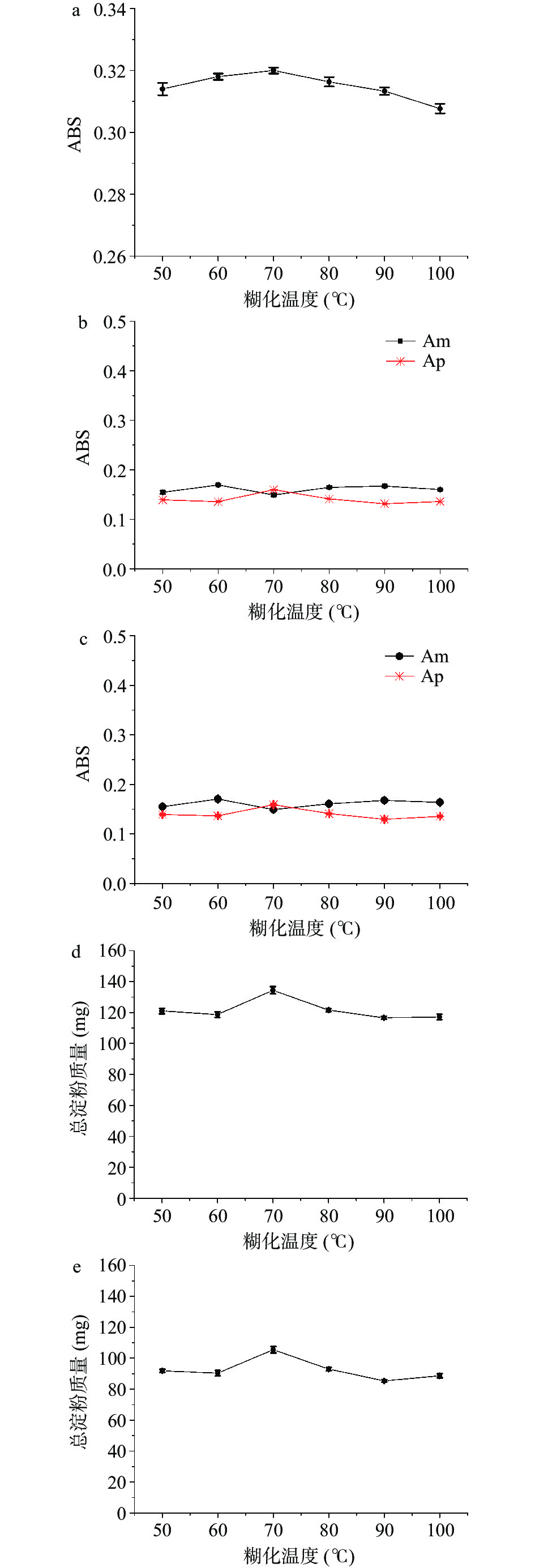
通过考察高粱样品在不同糊化温度50、60、70、80、90和100 ℃得到的吸光度值(或St含量),考察高粱样品的最佳糊化温度。由图3可见,方法I(图3a)高粱样品在70 ℃时吸光度值最高,但在双波长法(图3b、图3c)的吸光度-糊化温度图中判断不出最佳温度,是因为Am与Ap呈现相反的吸光度关系,彼此需要扣除吸光度的影响,当Am含量高时,Ap的吸光度则较低[32]。但通过双波长法糊化温度-St含量关系图(图3d、图3e)可以明显看出糊化温度在70 ℃时具有最高的St含量,综合考虑,70 ℃为最佳糊化温度。
2.3.3 糊化时间对高粱样品吸光度值的影响
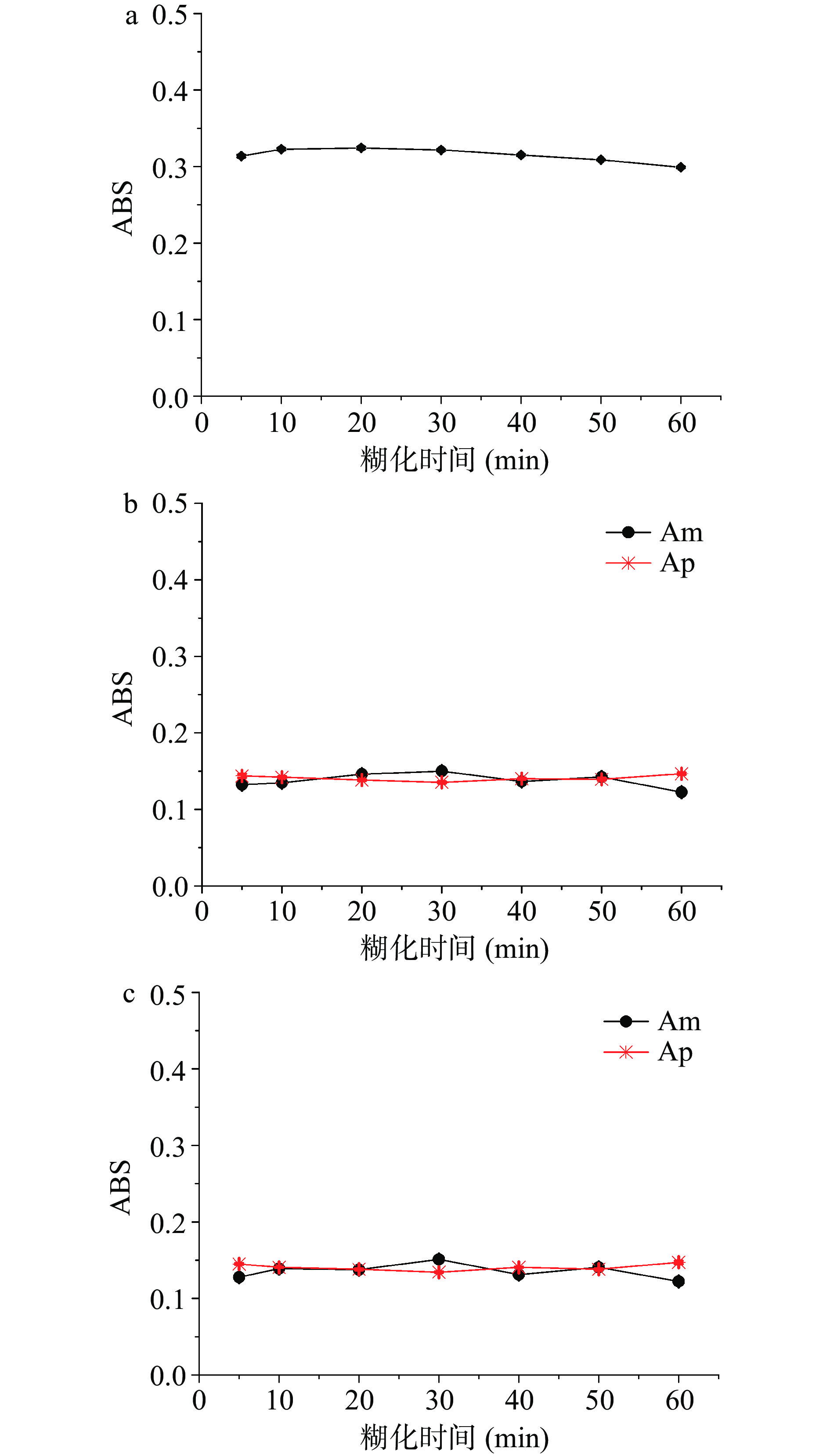
通过考察高粱样品的糊化时间在5、10、20、30、40、50、60 min时测定的吸光度值,得到高粱样品的最佳糊化时间。由图4可见,通过方法I(图4a)可以明显看出高粱样品在糊化10~20 min时具有稳定且较高的吸光度值,双波长法中(图4b、图4c)Am在10~30 min时呈现增长趋势,30 min时具有最佳吸光度值,Ap在10~20 min时较为稳定。综合考虑,高粱淀粉的糊化时间在10~20 min最佳。
2.3.4 乙酸和盐酸调节溶液pH对高粱样品吸光度值的影响
常用于调节溶液pH的有盐酸和乙酸两种,如江苏省地标方法(DB32/T 2265-2012)中采用盐酸溶液调节样品的pH,国标方法(GB 7648-1987)中采用乙酸用于样品溶液pH的调节。本文通过乙酸和盐酸两种方式调节溶液的pH,并测定相应溶液的吸光度,考察乙酸和盐酸对高粱样品显色的影响。结果如表6所示,GB 7648-1987法中用乙酸1 mL(1 mol/L)测得高粱样品的pH为4.65,DB32/T 2265-2012法给出用盐酸调节pH至3,发现加入0.5 mL(1 mol/L)的盐酸可达到pH=3.78;进一步加大乙酸的用量,直到加入量为4.0 mL时,得到与以上盐酸相接近的pH,通过对乙酸(1 mol/L,1 mL;pH=4.65),乙酸(1 mol/L,4 mL;pH=3.84)和盐酸(1 mol/L,0.5 mL;pH=3.78)进行吸光度的对比,发现pH相接近的样品溶液,在相同测定方法下测定的吸光度值基本相同,说明乙酸和盐酸仅起到调节溶液pH的作用,试剂本身不会对样品产生影响,而尽管pH=4.65与pH接近3时测定的结果值略有不同,但也在误差范围内(ΔA<0.01),因此,只要溶液为弱酸性(pH=3~5),pH的确切值并不影响测定含量。
表 6 溶液pH对吸光度值的影响Table 6. Influence of solution pH value on absorbance value名称 pH 方法I 方法II
(Am)方法II
(Ap)方法III
(Am)方法III
(Ap)参比溶液 3.27 0 0 0 0 0 样品溶液 11.65 / / / / / 乙酸(1 mL,1 mol/L) 4.65 0.337 0.170 0.164 0.171 0.164 乙酸(4 mL, 1 mol/L) 3.84 0.340 0.163 0.172 0.163 0.172 盐酸(0.5 mL, 1 mol/L) 3.78 0.339 0.163 0.171 0.163 0.169 2.3.5 碘试剂加入量对高粱样品吸光度值的影响
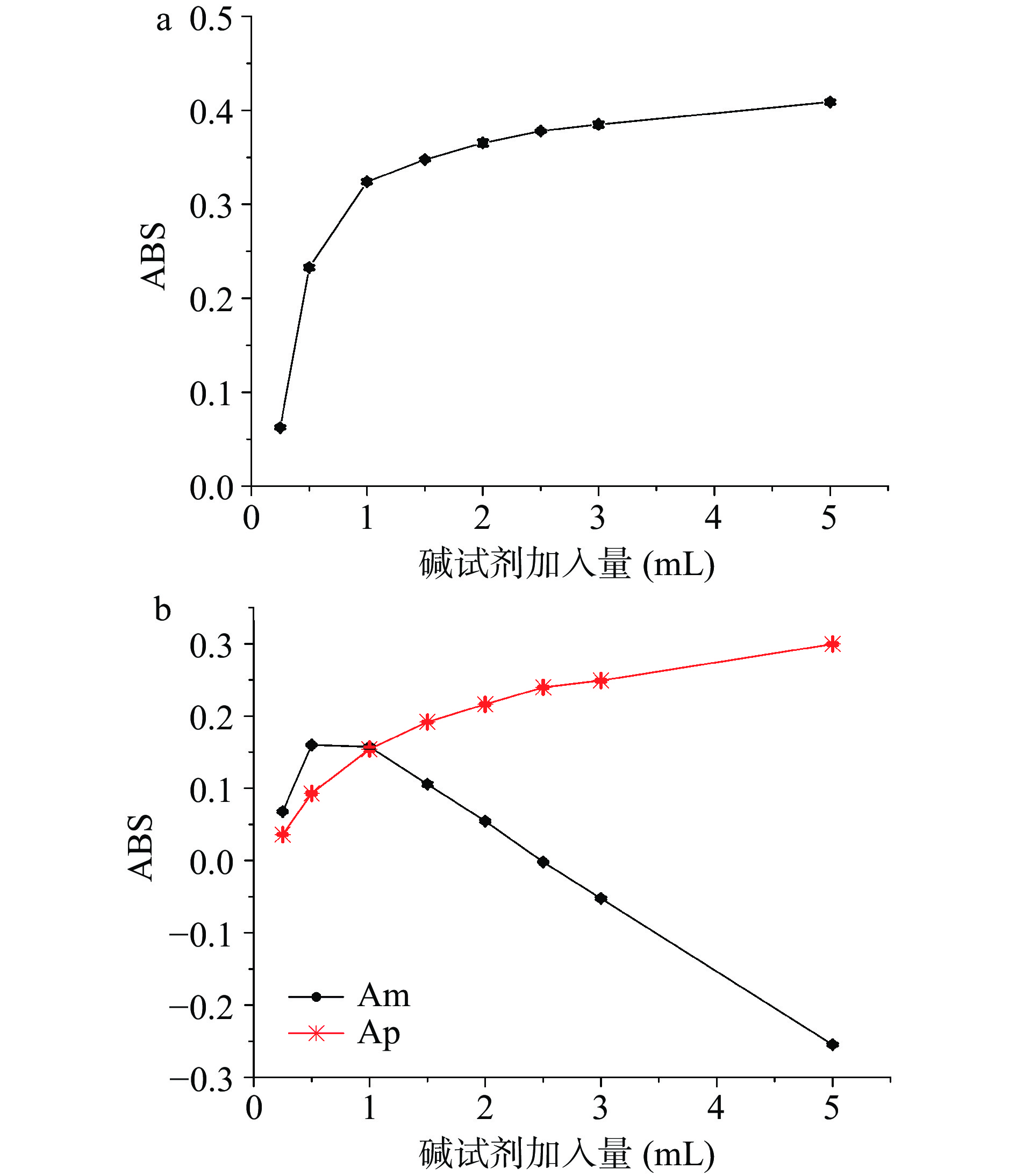
通过考察碘试剂用量(0.25、0.5、1.0、1.5、2.0、2.5、3.0、5.0 mL)对高粱淀粉与碘络合的吸光度值变化,得到最佳碘试剂用量。结果如图5所示,方法I(图5a)中随着碘试剂的加入量增加,吸光度值也增加,这是因为碘试剂本身具有颜色,因此无法从单波长法判断出碘试剂用量的最佳值[34-35];双波长法(图5b、图5c)中,随着碘试剂加入量的增加,Ap的含量随之增加,而Am的含量在碘试剂用量大于1.0 mL之后出现下降趋势,甚至降低为负值,这与1943年Bates等[36]给出的结论一致,同时采用标准碘化物浓度,可防止由三碘化物的形成而使碘化物浓度发生明显的变化。图5b和图5c中当碘试剂用量在0.25~1.0 mL时,Am和Ap均呈现吸光度增加的趋势,其中在1.0 mL时,Am和Ap的吸光度值均较高,因此选择1.0 mL碘试剂用量作为最佳显色剂用量。
2.3.6 显色时间对高粱样品吸光度值的影响
通过考察显色时间(1、3、5、10、20、30、60 min)与吸光度值的变化,得到稳定且最佳的样品测定时间。结果如图6所示,由方法I(图6a)可以判断显色时间在10~30 min内,吸光度值最大,较为稳定,30 min后吸光度值下降。方法II(图6b)、III(图6c)中Ap在10~30 min较为稳定,Am在20~30 min内较为稳定,综合考虑,显色时间在20~30 min时比较稳定。
综上所述,得到最佳测定条件是:用NaOH溶液分散高粱样品10~20 min,加1 mol/L乙酸或盐酸溶液调节pH至3左右,采用1.0 mL标准碘试剂,显色20~30 min进行测定,同时由于方法III具有与实际St含量相接近的值,因此更适于实际样品中淀粉含量的测定。
需要注意的是:a:样品粉碎程度不同,测定的结果也不同,因此需要充分粉碎研磨样品,并对样品进行筛分,以保证测定的结果具有较好的平行性;b:样品中含有水分或有吸潮的现象也会影响测定结果的准确性,因此需要对样品进行烘干处理,称取绝干样品,而烘干温度和时间对样品的测定结果影响很大,因此需要保证样品的烘干温度和时间固定,建议低温长时间烘干(50~60 ℃烘干3 h);c:加乙醇和氢氧化钠分散液时,轻摇瓶底,缓慢加入液体,以保证充分分散样品,不粘黏在瓶底或壁上。
2.4 重复性验证
选取三个不同厂家的高粱对方法III进行3次重复性测定,每个样品称取3个平行样,结果如表7所示,三个样品在不同时期测定的Am和Ap含量之间的差值小于2%,St的测定结果小于5%,因此样品的测定具有可重复性。
表 7 高粱样品中淀粉含量的重复性测定Table 7. Repeatability of starch content in sorghum samples样品名称 重复次数 Am(mg) Ap(mg) St(mg) Ap/Am 1号样 1 12.19±0.28 55.42±0.76 67.6±0.47 4.55±0.33 2 10.88±0.47 60.07±0.54 70.95±0.63 5.52±0.58 3 10.99±0.35 56.97±0.38 67.95±0.57 5.18±0.40 2号样 1 12.84±0.23 67.82±0.47 80.66±0.55 5.28±0.26 2 12.08±0.15 68.59±0.59 80.89±0.62 5.68±0.24 3 12.3±0.18 62.39±0.39 74.47±0.73 5.07±0.21 3号样 1 13.28±0.32 65.49±0.44 78.77±0.58 4.93±0.30 2 12.19±0.44 71.69±0.56 83.88±0.25 5.88±0.52 3 12.30±0.37 71.62±0.63 83.92±0.31 5.82±0.45 2.5 回收率验证
通过方法III测定样品的加标回收率,在已测得Am和Ap含量的高粱样品中,分别添加一定浓度的Am和Ap标准品溶液,测定其含量,求得回收率,结果见表8。回收率实验表明,Am和Ap的回收率在80%~120%之间,符合样品测定要求,具有较高的准确率。
表 8 高粱样品的加标回收率验证Table 8. Verification of spiked recovery rate of sorghum samples样品 加入量(mg/L) 实测值(mg/L) 回收率(%) Am 0.25 0.271 108.40 1.0 0.872 87.20 6.0 5.443 90.72 Ap 3.5 3.871 110.60 20 19.745 98.73 70 69.253 98.93 2.6 测定酿酒常用谷物
选择酿酒常用谷物(高粱、小麦、玉米、大米)进行样品普适性测定,首先称取磨碎筛分后的0.1000 g的谷物样品,再按照上述优化后的测定方法进行分散测定,得到结果如表9所示。高粱中Am含量14.01%,Ap含量85.99%与文献[37]结果相符,小麦的Am含量为18.85%,Ap含量为81.15%,St含量为63.51%,这与文献[38]给出的St含量65%左右相符合,玉米中Am占12.14%,Ap占87.86%,与普通玉米中Ap含量80%~90%结果相符合,大米中Am含量15.43%与文献给出的12%~19%结果相符合[39]。因此方法III可以测得常见谷物样品中Am、Ap和St的含量,具有普适性。
表 9 不同谷物样品中Am、Ap和St含量Table 9. Am, Ap and total starch contents in different grain samples样品 Am(%) Ap(%) St(%) Ap/Am 高粱 14.01±0.42 85.99±0.18 69.86±0.47 6.14±0.32 小麦 18.85±0.29 81.15±0.32 63.51±0.26 4.31±0.25 玉米 12.14±0.46 87.86±0.42 83.36±0.39 7.24±0.35 大米 15.43±0.28 84.57±0.52 93.75±0.27 5.48±0.44 3. 结论
高粱中直链淀粉(Amylose,Am)和支链淀粉(Amylopectin,Ap)含量与白酒的产量和质量息息相关,但现有的检测方法对同一样品的测定结果可能不同。本文通过详实的实验数据比较了基于碘比色法测定高粱中Am、Ap含量的三种方法(方法I:单波长混标法、方法II:双波长单标法、方法III:双波长混标法),结果发现,三种方法的检出限和定量限均能满足实际样品的测定范围需求,其中检出限:Am均≤0.55 mg/L,Ap均≤2.75 mg/L,定量限:Am均≤1.65 mg/L,Ap均≤8.33 mg/L;样品准确率实验发现,混标溶液标曲得到的误差绝对值较小(0.13%),但单标溶液标曲误差较大(7.47%),因此需要选用混标溶液配制标曲;进一步采用三种方法对高粱样品的测定条件进行优化,结果为:用NaOH作分散剂,70 ℃糊化10~20 min,以乙酸或盐酸为pH剂,加入1.0 mL碘试剂,显色20~30 min内为高粱样品的最佳测定条件,并通过测定Am、Ap含量得到总淀粉含量与实际粗淀粉含量相比较,发现方法III得到的值更接近理论结果,该方法也具有较好的可重复性和回收率(80%~120%),因此方法III更适用于实际样品的测定,通过方法III测定常见谷物样品中Am、Ap及St含量,测定结果与文献值相符,具有普适性。本文提供了选用碘比色双波长混标法的实验和理论依据,但该方法仅对高粱样品进行测定优化,其他具体的谷物样品还需具体的实验分析;未来还需深入探明淀粉的特性和客观因素的干扰,以得出更系统的结论。
-
表 1 三种方法绘制标曲的Am和Ap用量
Table 1 Amounts of Am and Ap for plotting standard curves by three methods
序号 方法 I II III Am(mL) Ap(mL) Am(mL) Ap(mL) Am(mL) Ap(mL) 1 0 5.00 0.30 2.00 0 5.00 2 0.25 4.75 0.50 2.50 0.50 4.50 3 0.50 4.50 0.70 3.00 1.00 4.00 4 1.00 4.00 0.90 3.50 1.50 3.50 5 1.50 3.50 1.10 4.00 2.00 3.00 6 2.00 3.00 1.30 4.50 2.50 2.50 7 / / / 5.00 3.00 2.00 8 / / / / 3.50 1.50 表 2 三种方法测得的标准曲线
Table 2 Standard curves measured by three methods
方法 Am Ap I y=0.02x+0.1586 R2=0.9973 / / II y=0.0186x−0.00254 R2=0.9999 y=0.01835x+0.0372 R2=0.9968 III y=0.00258x+0.0385 R2=0.9963 y=0.00275x−0.00302 R2=0.9987 表 3 三种方法测定标准样品的准确性分析
Table 3 Accuracy analysis of standard samples determined by three methods
配制样品 方法I
(mg/L)准确率
(%)方法II
(mg/L)准确率
(%)方法III
(mg/L)准确率
(%)30% Am 29.302 97.67 33.458 111.52 29.782 99.27 20% Am 19.677 98.39 23.193 115.97 19.936 99.68 10% Am 10.339 103.39 12.283 122.83 10.021 100.21 70% Ap 70.698 100.98 67.28 96.11 70.056 100.08 80% Ap 80.323 100.40 78.553 98.19 80.015 100.02 90% Ap 89.661 99.62 90.189 100.21 89.948 99.94 平均值 / 100.08 / 107.47 / 99.87 误差(%) / 0.08 / 7.47 / -0.13 表 4 三种方法对10份高粱样品淀粉含量的测定比较(%)
Table 4 Comparison of starch content of 10 sorghum samples determined by three methods (%)
序号 方法I 方法II 方法III Am Ap St Am Ap St Am Ap St 1 12.83 87.17 100 16.05 83.95 93.58 22.73 77.27 66.09 2 13.43 86.57 100 15.61 84.39 94.82 19.57 80.43 75.64 3 13.23 86.77 100 12.62 87.38 95.73 17.69 82.31 68.27 4 13.13 86.87 100 15.57 84.43 90.49 21.81 78.19 62.89 5 12.83 87.17 100 15.49 84.51 95.55 21.80 78.20 67.89 6 12.83 87.17 100 15.73 84.27 94.09 22.31 77.69 66.34 7 12.53 87.47 100 15.54 84.46 93.87 22.06 77.94 66.13 8 12.63 87.37 100 15.14 84.86 93.44 21.54 78.46 65.69 9 13.23 86.77 100 13.89 86.11 86.17 19.28 80.72 62.09 10 13.03 86.97 100 16.53 83.47 88.89 22.25 77.75 66.03 平均值 12.97 87.03 100 15.22 84.78 92.66 21.10 78.90 66.71 SD 0.29 0.29 0.00 1.14 1.14 3.13 1.66 1.66 3.68 RSD 2.22 0.33 0.00 7.48 1.34 3.38 7.87 2.11 5.52 检出限(mg/L) 0.49 / / 0.55 2.75 / 0.53 2.35 / 定量限(mg/L) 1.47 / / 1.65 8.33 / 1.61 7.13 / 注:Am和Ap表示占淀粉总量的百分比;St表示占试样的百分比;表9同。 表 5 NaOH和KOH分散高粱样品测定Am,Ap的含量
Table 5 Determination of Am and Ap in NaOH and KOH dispersed sorghum sample
方法 分散剂种类 NaOH KOH Am(%) Ap(%) Am(%) Ap(%) 方法I 15.54 84.46 6.24 93.76 方法II 16.90 83.10 3.75 96.25 方法III 15.75 84.25 6.25 93.75 表 6 溶液pH对吸光度值的影响
Table 6 Influence of solution pH value on absorbance value
名称 pH 方法I 方法II
(Am)方法II
(Ap)方法III
(Am)方法III
(Ap)参比溶液 3.27 0 0 0 0 0 样品溶液 11.65 / / / / / 乙酸(1 mL,1 mol/L) 4.65 0.337 0.170 0.164 0.171 0.164 乙酸(4 mL, 1 mol/L) 3.84 0.340 0.163 0.172 0.163 0.172 盐酸(0.5 mL, 1 mol/L) 3.78 0.339 0.163 0.171 0.163 0.169 表 7 高粱样品中淀粉含量的重复性测定
Table 7 Repeatability of starch content in sorghum samples
样品名称 重复次数 Am(mg) Ap(mg) St(mg) Ap/Am 1号样 1 12.19±0.28 55.42±0.76 67.6±0.47 4.55±0.33 2 10.88±0.47 60.07±0.54 70.95±0.63 5.52±0.58 3 10.99±0.35 56.97±0.38 67.95±0.57 5.18±0.40 2号样 1 12.84±0.23 67.82±0.47 80.66±0.55 5.28±0.26 2 12.08±0.15 68.59±0.59 80.89±0.62 5.68±0.24 3 12.3±0.18 62.39±0.39 74.47±0.73 5.07±0.21 3号样 1 13.28±0.32 65.49±0.44 78.77±0.58 4.93±0.30 2 12.19±0.44 71.69±0.56 83.88±0.25 5.88±0.52 3 12.30±0.37 71.62±0.63 83.92±0.31 5.82±0.45 表 8 高粱样品的加标回收率验证
Table 8 Verification of spiked recovery rate of sorghum samples
样品 加入量(mg/L) 实测值(mg/L) 回收率(%) Am 0.25 0.271 108.40 1.0 0.872 87.20 6.0 5.443 90.72 Ap 3.5 3.871 110.60 20 19.745 98.73 70 69.253 98.93 表 9 不同谷物样品中Am、Ap和St含量
Table 9 Am, Ap and total starch contents in different grain samples
样品 Am(%) Ap(%) St(%) Ap/Am 高粱 14.01±0.42 85.99±0.18 69.86±0.47 6.14±0.32 小麦 18.85±0.29 81.15±0.32 63.51±0.26 4.31±0.25 玉米 12.14±0.46 87.86±0.42 83.36±0.39 7.24±0.35 大米 15.43±0.28 84.57±0.52 93.75±0.27 5.48±0.44 -
[1] PAIANO V, BIANCHI G, DAVOLI E, et al. Risk assessment for the Italian population of acetaldehyde in alcoholic and non-alcoholic beverages[J]. Food Chemistry,2014,154:26−31. doi: 10.1016/j.foodchem.2013.12.098
[2] 毛祥, 温雪瓶, 黄丹, 等. 5种常用酿酒高粱的主要成分及淀粉特性差异分析[J]. 中国酿造,2020,39(3):57−62. [MAO X, WEN X P, HUANG D, et al. Difference analysis on main components and starch properties in five commonly used liquor-making sorghum[J]. China Brewing,2020,39(3):57−62. doi: 10.11882/j.issn.0254-5071.2020.03.012 MAO X, WEN X P, HUANG D, et al. Difference analysis on main components and starch properties in five commonly used liquor-making sorghum[J]. China Brewing, 2020, 39(3): 57-62. doi: 10.11882/j.issn.0254-5071.2020.03.012
[3] NNAMCHI C I, OKOLO B N, MONEKE A N. Grain and malt quality properties of some improved Nigerian sorghum varieties[J]. Journal of the Institute of Brewing,2014,120:353−359.
[4] SINGH H, SODHI N S, DHILLON B, et al. Physicochemical and structural characteristics of sorghum starch as affected by acid-ethanol hydrolysis[J]. Journal of Food Measurement and Characterization,2021,15(3):2377−2385. doi: 10.1007/s11694-020-00792-8
[5] LONDONO-RESTREPO S M, RINCON-LONDONO N, CONTRERAS-PADILLA M, et al. Morphological, structural, thermal, compositional, vibrational, and pasting characterization of white, yellow, and purple Arracacha Lego-like starches and flours (Arracacia xanthorrhiza)[J]. International Journal of Biological Macromolecules,2018,113:1188−1197. doi: 10.1016/j.ijbiomac.2018.03.021
[6] ESPITIA-HERNÁNDEZ P, CHAVEZ GONZALEZ M L, ASCACIO-VALDÉS J A, et al. Sorghum (Sorghum bicolor L.) as a potential source of bioactive substances and their biological properties[J]. Critical Reviews in Food Science and Nutrition,2022,62(8):2269−2280. doi: 10.1080/10408398.2020.1852389
[7] JAISWAL S, BANSIRAR A, SINGH A, et al. Diversity in grain and wax characteristics of twelve cultivars of Indian sorghum[J]. Materials Today: Proceedings,2022,57:1933−1937. doi: 10.1016/j.matpr.2022.03.041
[8] SOE HTET M N, WANG H, TIAN L, et al. Integrated starches and physicochemical characterization of sorghum cultivars for an efficient and sustainable intercropping model[J]. Plants,2022,11(12):1574. doi: 10.3390/plants11121574
[9] 曹文伯. 高粱与酿酒[J]. 酿酒,1999(1):20−21. [CAO W B. Sorghum and winemaking[J]. Liquor Making,1999(1):20−21. CAO W B. Sorghum and winemaking[J]. Liquor Making, 1999, (1): 20-21.
[10] ZHU Y, CUI B, YUAN C, et al. A new separation approach of amylose fraction from gelatinized high amylose corn starch[J]. Food Hydrocolloids,2022,131:107759. doi: 10.1016/j.foodhyd.2022.107759
[11] JUNG S J, SONG Y B, PARK C S, et al. Different physicochemical properties of entirely α-glucan-coated starch from various botanical sources[J]. Food Science and Biotechnology,2022,31(9):1179−1188. doi: 10.1007/s10068-022-01113-z
[12] NIETO-ORTEGA B, ARROYO J J, WALK C, et al. Near infrared reflectance spectroscopy as a tool to predict non-starch polysaccharide composition and starch digestibility profiles in common monogastric cereal feed ingredients[J]. Animal Feed Science and Technology,2022,285:115214. doi: 10.1016/j.anifeedsci.2022.115214
[13] 叶沁, 赵紫薇, 徐明雅, 等. 基于中红外漫反射光谱技术测定精米中直链淀粉含量的研究[J]. 中国粮油学报,2018,33(2):115−119,127. [YE Q, ZHAO Z W, XU M Y, et al. Amylose content detection in polished rice based on diffuse reflectance fourier transform infrared spectroscopy[J]. Journal of the Chinese Cereals and Oils Association,2018,33(2):115−119,127. doi: 10.3969/j.issn.1003-0174.2018.02.019 YE Q, ZHAO Z W, XU M Y, et al. Amylose content detection in polished rice based on diffuse reflectance fourier transform infrared spectroscopy[J]. Journal of the Chinese Cereals and Oils Association, 2018, 33(2): 115-119, 127. doi: 10.3969/j.issn.1003-0174.2018.02.019
[14] 吴玉萍, 高云才, 徐昭梅, 等. 连续流动法测定新鲜烟叶中的直链淀粉和支链淀粉[J]. 云南大学学报,2018,40(2):315−320. [WU Y P, GAO Y C, XU Z M, et al. Determination of amylose and amylopectin of fresh tobacco by continuous flow method[J]. Journal of Yunnan University,2018,40(2):315−320. WU Y P, GAO Y C, XU Z M, et al. Determination of amylose and amylopectin of fresh tobacco by continuous flow method[J]. Journal of Yunnan University, 2018, 40(2): 315-320.
[15] DHIR A, KAUR C, DEVI V, et al. A rapid single kernel screening method for preliminary estimation of amylose in maize[J]. Food Analytical Methods,2022,15:2163−2171. doi: 10.1007/s12161-022-02277-4
[16] YU M, LIU B, ZHONG F, et al. Interactions between caffeic acid and corn starch with varying amylose content and their effects on starch digestion[J]. Food Hydrocolloids,2021,114:106544. doi: 10.1016/j.foodhyd.2020.106544
[17] BUTARDO V M, SREENIVASULU N, JULIANO B O. Improving rice grain quality: State-of-the-art and future prospects[J]. Rice Grain Quality,2019,1892:19−55.
[18] HUANG J, WANG Z, FAN L, et al. A review of wheat starch analyses: Methods, techniques, structure and function[J]. International Journal of Biological Macromolecules,2022,203:130−142. doi: 10.1016/j.ijbiomac.2022.01.149
[19] CHAVAN P, SINHMAR A, NEHRA M, et al. Impact on various properties of native starch after synthesis of starch nanoparticles: A review[J]. Food Chemistry,2021,364:130416. doi: 10.1016/j.foodchem.2021.130416
[20] MCCREADY R M, HASSID W Z. The separation and quantitative estimation of amylose and amylopectin in potato starch[J]. Journal of the American Chemical Society,1943,65(6):1154−1157. doi: 10.1021/ja01246a038
[21] 中华人民共和国国家质量监督检验检疫总局. GB/T 15683-2008 大米直链淀粉含量的测定[S]. 北京: 中国标准出版社, 2008. The State General Administration of Quality Supervision, Inspection and Quarantine, PRC. GB/T 15683-2008 Determination of amylose content in rice[S]. Beijing: China Standards Press, 2008.
[22] 中华人民共和国农牧渔业部. GB 7648-1987 水稻、玉米、谷子籽粒直链淀粉测定法[S]. 北京: 中国标准出版社, 1987. Ministry of Agriculture, Animal Husbandry and Fisheries of the Peoples Republic of China. GB 7648-1987 Determinatlon of amylase in grains of rice, maize and millet[S]. Beijing: Standards Press of China, 1987.
[23] 江苏省质量技术监督局. DB 32/T 2265-2012 鲜食玉米中直链淀粉和支链淀粉含量的测定双波长分光光度法[S]. 江苏: 江苏省地方标准出版社, 2012. Jiangsu Provincial Bureau of Quality and Technical Supervision. DB 32/T 2265-2012 Determination of amylose and amylopectin content in fresh maize by dual wavelength spectrophotometry[S]. Jiangsu: Jiangsu Local Standards Press, 2012.
[24] REDDAPPA S B, CHHABRA R, TALUKDER Z A, et al. Development and validation of rapid and cost-effective protocol for estimation of amylose and amylopectin in maize kernels[J]. 3 Biotech,2022,12(3):1−8.
[25] SHAO Y, ZHU D, YU J, et al. Development of certified reference materials for the determination of apparent amylose content in rice[J]. Molecules,2022,27(14):4647. doi: 10.3390/molecules27144647
[26] SONG Y H, SHI W L, ZHANG J, et al. Development and application of an efficient method for the amylose/amylopectin ratio determination in potato tubers[J]. Acta Horticulturae Sinica,2021,48(3):600.
[27] OKPALA N E, ALORYI K D, AN T, et al. The roles of starch branching enzymes and starch synthase in the biosynthesis of amylose in rice[J]. Journal of Cereal Science,2022,104:103393. doi: 10.1016/j.jcs.2021.103393
[28] DÍAZ E O, KAWAMURA S, ISHIZU H, et al. Non-destructive assessment of amylose content in rice using a quality inspection system at grain elevators[J]. Food Chemistry,2022,379:132144. doi: 10.1016/j.foodchem.2022.132144
[29] 焦梦悦, 高涵, 王伟娜, 等. 四种测定直链淀粉和支链淀粉方法的比较[J]. 食品工业科技,2019,40(12):259−264. [JIAO M Y, GAO H, WANG W N, et al. Comparison of four methods for the determination of amylose and amylopectin[J]. Science and Technology of Food Industry,2019,40(12):259−264. doi: 10.13386/j.issn1002-0306.2019.12.042 JIAO M Y, GAO H, WANG W N, et al. Comparison of four methods for the determination of amylose and amylopectin[J]. Science and Technology of Food Industry, 2019, 40(12): 259-264. doi: 10.13386/j.issn1002-0306.2019.12.042
[30] WANG J P, LI Y, TIAN Y Q, et al. A novel triple-wavelength colorimetric method for measuring amylose and amylopectin contents[J]. Starch-Stä rke,2010,62(10):508−516.
[31] ZHU T, JACKSON D S, WEHLING R L, et al. Comparison of amylose determination methods and the development of a dual wavelength iodine binding technique[J]. Cereal Chemistry,2008,85(1):51−58. doi: 10.1094/CCHEM-85-1-0051
[32] ZHU F. Structure, physicochemical properties, modifications, and uses of sorghum starch[J]. Comprehensive Reviews in Food Science and Food Safety,2014,13(4):597−610. doi: 10.1111/1541-4337.12070
[33] 何洁, 闫飞燕, 黄芳, 等. 双波长法测定薯芋类农产品中直链淀粉和支链淀粉的含量[J]. 食品工业科技,2022,43(7):303−309. [HE J, YAN F, HUANG F, et al. Determination of amylose and amylopectin contents in yam and taros by dual-wavelength spectrophotometry[J]. Science and Technology of Food Industry,2022,43(7):303−309. doi: 10.13386/j.issn1002-0306.2021070119 HE J, YAN F, HUANG F, et al. Determination of amylose and amylopectin contents in yam and taros by dual-wavelength spectrophotometry[J]. Science and Technology of Food Industry, 2022, 43(7): 303-309. doi: 10.13386/j.issn1002-0306.2021070119
[34] VAINIO K A. Determination of starch by iodine colorimetry[J]. Agricultural and Food Science,1968,40(2):60−66. doi: 10.23986/afsci.71700
[35] JARVIS C E, WALKER J R L. Simultaneous, rapid, spectrophotometric determination of total starch, amylose and amylopectin[J]. Journal of the Science of Food and Agriculture,1993,63(1):53−57. doi: 10.1002/jsfa.2740630109
[36] BATES F L, FRENCH D, RUNDLE R E. Amylose and amylopectin content of starches determined by their iodine complex formation[J]. Journal of the American Chemical Society,1943,65(2):142−148. doi: 10.1021/ja01242a003
[37] 蒋兰. 酿酒高粱淀粉含量测定及性质研究[D]. 重庆: 重庆大学, 2013. JIANG L. Determination of starch content and properties of brewing sorghum[D]. Chongqing: Chongqing University, 2013.
[38] 项丰娟, 苏磊, 张秀南, 等. 小麦淀粉的研究现状[J]. 食品研究与开发,2021,42(16):212−219. [XIANG F J, SU L, ZHANG X N, et al. Research status of wheat starch[J]. Food Research and Development,2021,42(16):212−219. doi: 10.12161/j.issn.1005-6521.2021.16.031 XIANG F J, SU L, ZHANG X N, et al. Research status of wheat starch[J]. Food Research and Development, 2021, 42(16): 212-219. doi: 10.12161/j.issn.1005-6521.2021.16.031
[39] 翟佳丽, 何睿. 大米中直链淀粉含量测定方法的比较[J]. 粮食加工,2017,42(3):24−26. [ZHAI J L, HE R. Comparison of methods for determination of amylose content in rice[J]. Grain Processing,2017,42(3):24−26. ZHAI J L, HE R. Comparison of methods for determination of amylose content in rice [J]. Grain Processing, 2017, 42(3): 24-26.





 下载:
下载:







 下载:
下载:
