Hypoglycemic Activity of Ramulus mori Oligosaccharides on High-fat Diet/Streptozotocin-Induced Diabetic Mice
-
摘要: 本研究以桑枝低聚糖为原料,通过体内实验评价其对糖尿病小鼠降血糖功效。通过高脂饲料结合注射链脲佐菌素建立糖尿病小鼠模型,采用低剂量(200.00 mg/(kg·bw))、中剂量(400.00 mg/(kg·bw))、高剂量(800.00 mg/(kg·bw))桑枝低聚糖对模型小鼠灌胃干预。定期测定小鼠体质量、空腹血糖值,40 d后测定小鼠口服糖耐量、胰岛素水平、氧化应激水平、肾脏相关酶、肠道菌群组成的变化,观察小鼠结肠的病理形态,评估桑枝低聚糖对糖尿病小鼠血糖等生化指标的影响,及其对肠道菌群的作用。结果表明,与模型组相较,桑枝低聚糖延缓了糖尿病小鼠的体重下降,对空腹血糖和糖耐量均有一定程度降低。经桑枝低聚糖治疗后,糖尿病小鼠的胰岛素水平显著降低(P<0.05),SOD、GSH水平显著提高(P<0.05),MDA含量显著降低(P<0.05),CRE、BUN水平有效降低。通过对糖尿病小鼠的肠道菌群进行16S rDNA分析,发现桑枝低聚糖有效增加了肠道微生物的丰富度,在门的水平上,减少厚壁菌门丰度,增加拟杆菌门丰度;在科的水平上,提高乳杆菌科的比例;在属的水平上,提高乳酸杆菌属的比例,并且降低毛螺菌属的比例。证实桑枝低聚糖能够通过改善胰岛素抵抗、改善氧化应激水平,调节肠道菌群等途径降低糖尿病小鼠血糖、缓解糖尿病小鼠消瘦的状况,修复结肠与肾脏损伤,从而起到降血糖作用,在低剂量(200.00 mg/(kg·bw))下就能够发挥较好的降血糖功效,作用效果与剂量无明显线性关系。Abstract: Ramulus mori oligosaccharides were used as the raw material to evaluate its hypoglycemic effect on high-fat diet/streptozotocin-induced diabetic mice through in vivo experiments. The diabetic mice model was established by high-fat diet combined with injection of streptozotocin, and it was given low-dose (200.00 mg/(kg·bw)), medium-dose (400.00 mg/(kg·bw)) and high-dose (800.00 mg/(kg·bw)) of Ramulus mori oligosaccharides by gavage intervention. In order to evaluate the effects of Ramulus mori oligosaccharides on biochemical indicators and intestinal flora in diabetic mice, the body weight and fasting blood glucose value of the mice were regularly measured. After 40 days, the oral glucose tolerance, insulin level, oxidative stress level, intestinal flora composition, kidney-related enzymes of the mice were measured, and the pathological morphology of the mice colon was observed. The results showed that Ramulus mori oligosaccharides alleviated the weight loss of the diabetic mice, decreased fasting blood glucose and glucose tolerance to a certain extent compared with the model group. After treatment with Ramulus mori oligosaccharides, the insulin level of diabetic mice was significantly decreased (P<0.05), the SOD and GSH activity were significantly increased (P<0.05), the MDA content was significantly decreased (P<0.05), and the CRE and BUN levels were effective reduced. By 16S rDNA analysis of the intestinal flora of the diabetic mice, it was found that Ramulus mori oligosaccharides effectively increased the abundance of intestinal microorganisms. It reduced the abundance of Firmicutes and increased the abundance of Bacteroidetes at the phylum level, increased the proportion of Lactobacillus at the family level, increased the proportion of Lactobacillus and decreases the proportion of Lachnospira at the genus level. It was confirmed that Ramulus mori oligosaccharides could reduce blood sugar, relieve weight loss in the diabetic mice, and repair colon and kidney damage by improving insulin resistance, improving oxidative stress levels, and regulating intestinal flora, thereby reducing blood glucose. It could exert a good hypoglycemic effect at a low dose (200.00 mg/(kg·bw)), but there was no obvious linear relationship between the hypoglycemic effect and the dose.
-
糖尿病(Diabetes mellitus)是一种由于机体分泌胰岛素不足或胰岛素利用效率低下引起的慢性代谢性疾病[1],表现为血糖升高及血脂异常。糖尿病通常被分为1型、2型和妊娠期糖尿病,其中2型糖尿病(Type 2 diabetes mellitus,T2DM)占糖尿病的90%以上[2]。糖尿病患者可能会进一步发展严重的心血管并发症,如慢性肾功能衰竭、糖尿病足部溃疡和其他慢性代谢性疾病[3]。当前对糖尿病的治疗方法主要有控制饮食、注射胰岛素、服用降糖药物等。但是降糖药物具有副作用且长期使用会产生抗药性,寻找无毒副作用又具备降糖功能的天然药物已经成为近年来的研究热点。研究发现天然植物低聚糖及多糖在糖尿病治疗中具有多靶点多途径的特点,对糖尿病并发症也具有一定的防治作用[4]。
桑枝是桑树的枝条,是我国传统中药,富含多酚、多糖、白藜芦醇、生物碱等活性成分[5]。其中多糖是桑枝的主要活性物质,由甘露糖、鼠李糖、阿拉伯糖、葡萄糖、半乳糖等单糖组成[6]。当前对于桑枝多糖的降血糖活性已有大量研究,证实桑枝多糖能够通过提高机体抗氧化能力[7],增加胰岛素的敏感性[8],促进胰岛β细胞数目增多[9],调节机体免疫力[10],调节肠道菌群等途径[11],进而降低血糖。但桑枝多糖作为大分子物质,结构复杂,不利于机体的吸收利用,极大地限制了其应用。采用生物酶解手段将大分子的多糖降解为小分子的低聚糖,可以进一步提高多糖的生理活性[12]。陈春娟等[13]发现低分子量蛹虫草多糖具有较好的降血糖功效,灌胃(200 mg/kg)4 周后FBG降至13.7±2.4 mmol/L。Nuntawat等[14]的研究结果表明稻壳低聚糖通过调节小鼠的肠道菌群降低血糖。目前对桑枝低聚糖的降血糖活性研究鲜见报道。课题组前期将桑枝多糖经β-甘露聚糖酶酶解,得到一种具有促乳酸杆菌增殖活性的桑枝低聚糖(Ramulus mori oligosaccharides, RMOS)[15],Larsen等[16]发现提高乳酸杆菌比例有助于血糖的调节,因此,本实验通过高脂饲料结合链脲佐菌素(Streptozotocin,STZ)注射建立糖尿病小鼠模型,研究桑枝低聚糖对糖尿病小鼠胰岛素抵抗、氧化应激、肠道菌群丰度、物种组成的影响,从肠道菌群角度探究其降糖机制,以期为桑枝低聚糖类益生元保健食品及降血糖药物佐剂的研发提供理论依据。
1. 材料与方法
1.1 材料与仪器
SPF级昆明种小白鼠 雄性,8周龄,72只,体重为(20±2)g,合格证号:SCXK(粤)2018-0034,实验动物使用许可证号:SYXK(粤)2015-0149,广东省广州市实验动物中心;桑枝多糖(Ramulus mori polysaccharides) 质量分数为70%,实验室自制;β-甘露聚糖酶(50 U/mg)、链脲佐菌素(streptozotocin,STZ) 广州市齐云生物技术有限公司;阿卡波糖 北京拜耳医药保健有限公司;普通饲料、高脂饲料 广东省医学实验动物中心;欧姆龙AS-1血糖试纸 达尔泰(天津)实业有限公司;胰岛素试剂盒 巧伊生物技术公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、肌酐(creatinine,CRE)试剂盒、尿素氮(urea nitrogen,BUN)试剂盒 南京建成科技有限公司;其他试剂 均为分析纯。
欧姆龙HGM-112型电子血糖仪 达尔泰(天津)实业有限公司;SynergyH1型酶标仪 美国Biotek公司;ALC-210.4型分析天平 赛多利斯科学仪器有限公司;CR22G III型高速冷冻离心机 广东广州日立工机有限公司;VORTEX 3型旋涡振荡器 德国IKA公司。
1.2 实验方法
1.2.1 桑枝低聚糖的制备
根据本课题组前期实验数据及方法[15],称取干燥的桑枝粉末,按料液比1:4加入去离子水,80 ℃水浴4 h,离心(4 ℃,10000 r/min,5 min)收集上清液。旋蒸浓缩至体积的1/4,加入四倍体积的95%乙醇溶液,4 ℃静置过夜,离心(4 ℃,10000 r/min,10 min),收集沉淀得到桑枝多糖。利用β-甘露聚糖酶制得桑枝低聚糖(Ramulus mori oligosaccharides,RMOS),冻干备用。
1.2.2 糖尿病小鼠模型建立
取健康昆明种小鼠72只,适应性喂养5 d,饲养室温度22 ℃,相对湿度50%~60%,期间提供充足的无菌水和普通饲料。5 d后,随机分出正常组12只和造模组60只,正常组小鼠给予普通饲料喂养,造模组小鼠给予高脂饲料喂养;10 d后,造模组小鼠腹腔注射100.00 mg/(kg·bw)STZ注射液(溶解于0.1 mol/L柠檬酸-柠檬酸钠缓冲溶液),正常组小鼠注射同等剂量柠檬酸-柠檬酸钠缓冲溶液。造模组小鼠经注射STZ后,20 d内3次空腹血糖测量,若空腹血糖值(Fasting blood-glucose,FBG)≥11.10 mmol·L−1,即造模成功[17]。
1.2.3 实验动物的分组和处理
正常组(NC组)灌胃生理盐水。造模成功的小鼠,随机分为模型组(DM,生理盐水)、阳性组(PC组,阿卡波糖150 mg/(kg·bw))、桑枝低聚糖低剂量组(L-R组,桑枝低聚糖200 mg/(kg·bw))、中剂量组(M-R组,桑枝低聚糖400 mg/(kg·bw))、高剂量组(H-R组,桑枝低聚糖 800 mg/(kg·bw)),每组12只。实验过程中,正常组小鼠给予普通饲料,模型组、阳性组、桑枝低聚糖低、中、高组给予高脂饲料,每日灌胃1次。连续灌胃39 d后,禁食不禁水12 h,采用摘眼球法取血,处死、解剖,收集结肠等组织备用[18]。
1.2.4 体质量、FBG 、OGTT测定
实验过程中,定期记录小鼠的体质量和FBG。实验最后一天测定口服葡萄糖耐量(oral glucose tolerance test,OGTT)。口服葡萄糖耐量的测定:小鼠经灌胃2 g/(kg·bw)葡萄糖,采用剪尾法取血,使用血糖仪分别测定0、30、60、120 min时的血糖值,并计算各组小鼠血糖曲线下面积(area under curve of glucose,AUCG),计算见式(1)[19]。
(1) 式中:AUCG为血糖曲线下面积,mmol/(L·h);A为0 min时血糖值;B为30 min时血糖值;C为60 min时血糖值;D为120 min时血糖值。
1.2.5 结肠HE染色
结肠保存于10.0 %福尔马林固定液中,固定24 h后采用常规脱水石蜡包埋,取蜡块作5.00 μm厚度的切片,常规HE染色,封片后光镜观察组织形态[20]。
1.2.6 血清各项指标的测定
全血经室温静置1 h后,4 ℃、4000 r/min离心10 min,分离血清并于−80 ℃保存待用。CRE、BUN、SOD、MDA、GSH等指标按照试剂盒说明书操作。
1.2.7 肠道菌群测定
提取粪便样本的DNA,以稀释后的基因组DNA模板,根据测序区域的选择,使用带Barcode的特异引物,New England Biolabs公司的Phusion R High -Fidelity PCR Master Mix with GC Buffer和高效高保真酶进行PCR,确保扩增效率和准确性。使用TruSeqR DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经过Qubit和qPCR定量。文库合格后,使用HiSeq 2500 PE 250进行测序[21]。
1.3 数据处理
所有实验数据均为3次重复,以平均数±标准差表示。采用SPSS19.0统计软件进行单因素方差分析,采用GraphPad Prism7进行绘图。
2. 结果与分析
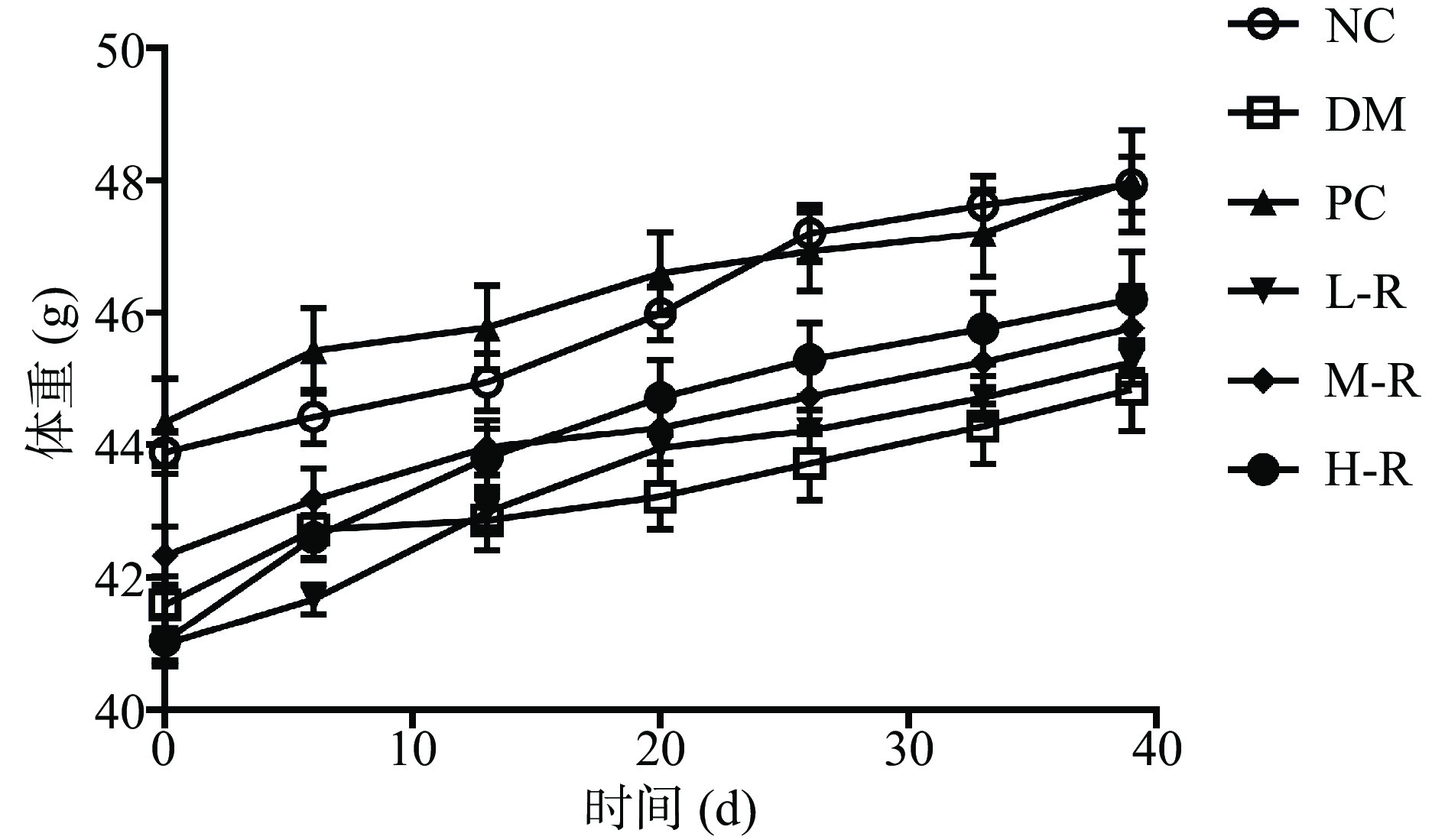
2.1 RMOS对糖尿病小鼠体质量的影响
糖尿病主要表现为多饮、多食、多尿以及体质量的降低。由图1可知,在整个实验期间,各组小鼠的体质量均有一定增长,但增幅差异较大,模型组和RMOS低剂量组小鼠体质量基本保持不变。在第39 d时,正常组小鼠体质量接近50.00 g,增幅达到了10.35 %,阳性组、RMOS中剂量组和高剂量组体质量增长率分别为4.82%、7.73%、8.36%,说明中剂量和高剂量的RMOS能改善糖尿病小鼠体重下降的状况。
2.2 RMOS对糖尿病小鼠血糖的影响
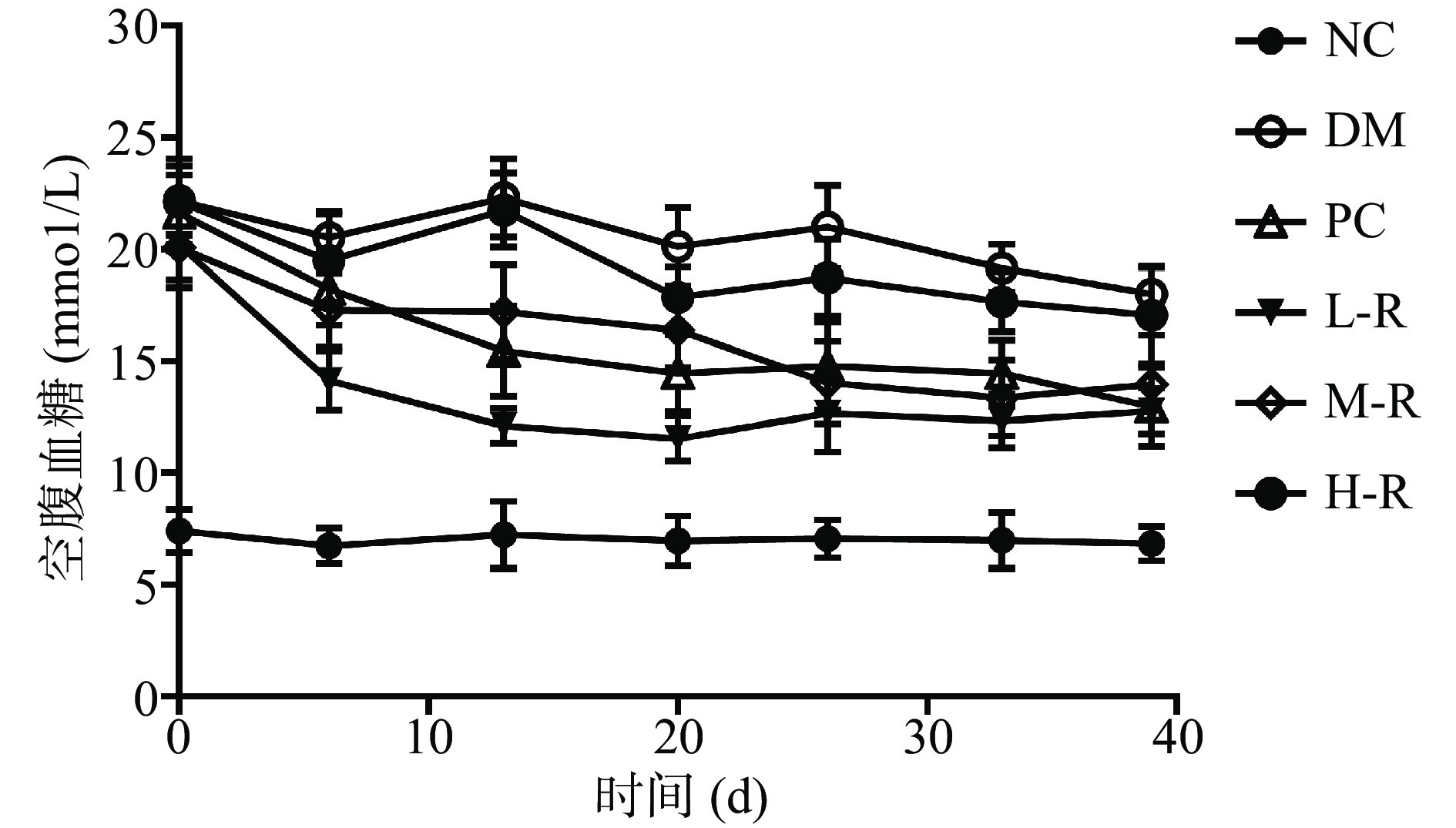
2.2.1 RMOS对糖尿病小鼠空腹血糖的影响
糖尿病最直接表现为机体血糖值的升高,通过监测血糖值变化情况,可以初步反映药物降血糖效果。图2为实验期间小鼠FBG变化的情况。由图2可知,在灌胃前,除正常组小鼠外,其余各组小鼠的FBG均大于11.10 mmol/L,说明糖尿病小鼠模型建模成功。在实验周期内,正常组小鼠FBG均小于8.00 mmol/L;阳性组和RMOS组小鼠FBG值始终低于模型组小鼠,说明阳性药物和RMOS均能降低糖尿病小鼠的血糖。在第40 d时,与模型组相比,阳性组、RMOS低、中剂量组小鼠的FBG明显降低,证明低剂量和中剂量RMOS能明显降低糖尿病小鼠的FBG。实验结果与Guo等[22]对桑枝多糖降血糖研究结果一致,提供了RMOS降低糖尿病小鼠血糖的直接证据。
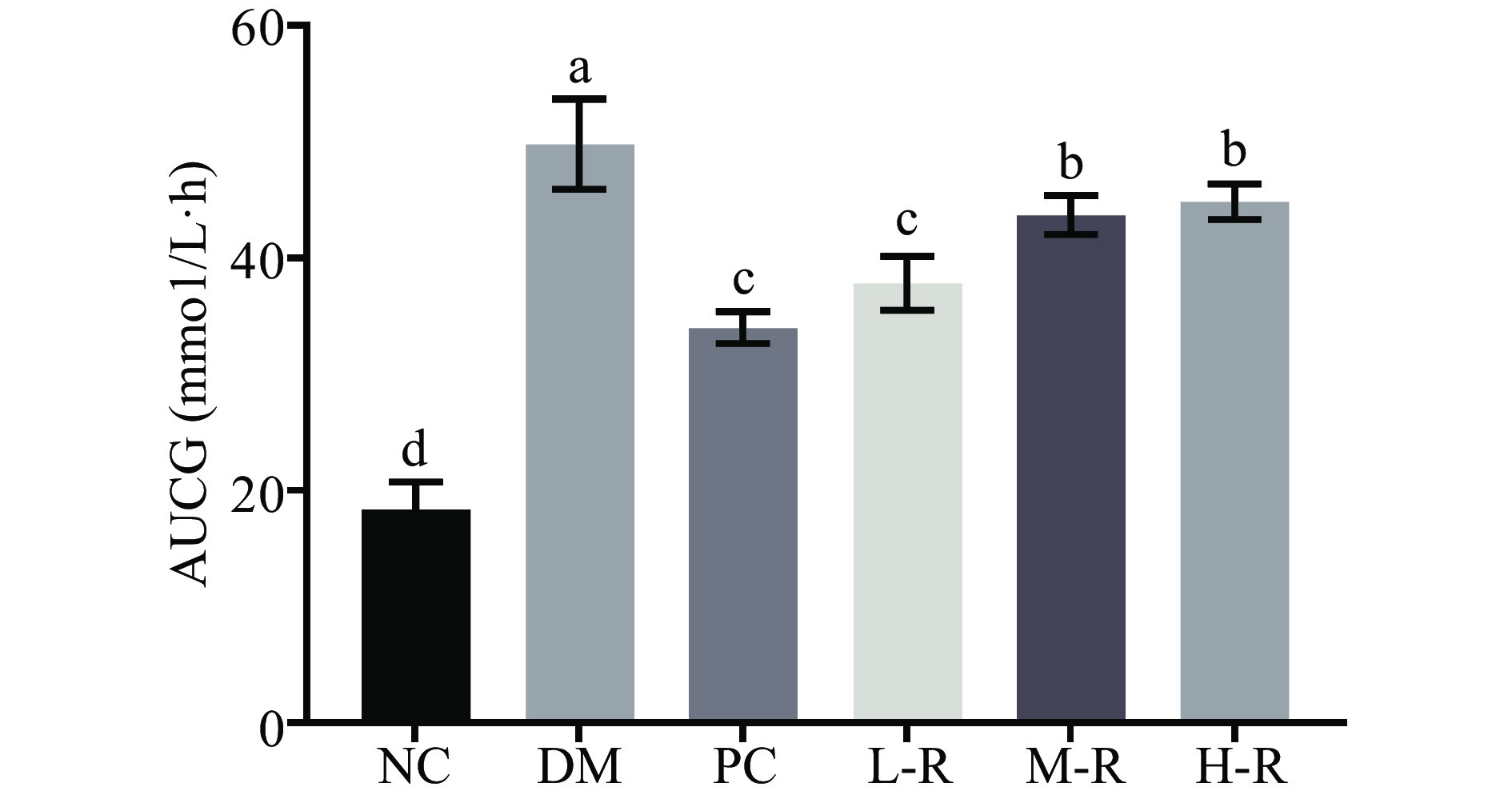
2.2.2 RMOS对糖尿病小鼠口服葡萄糖耐量的影响
糖耐量测试可以检测机体对血糖浓度的调控能力[23],反映胰岛细胞的功能状态,AUGG越小,表示血糖水平恢复能力越快。研究发现褐藻多糖极显著降低糖尿病小鼠的血糖水平,120 min内糖耐量曲线下面积AUCG降低39.4%(P<0.01)[24]。图3是各组小鼠糖耐量测试结果。与模型组相比,RMOS低、中、高剂量组血糖AUCG均显著降低(P<0.05),且低剂量组的RMOS治疗效果与阳性药物组相当(P>0.05)。说明RMOS能有效改善糖尿病小鼠改善糖耐量状况,稳定血糖水平。
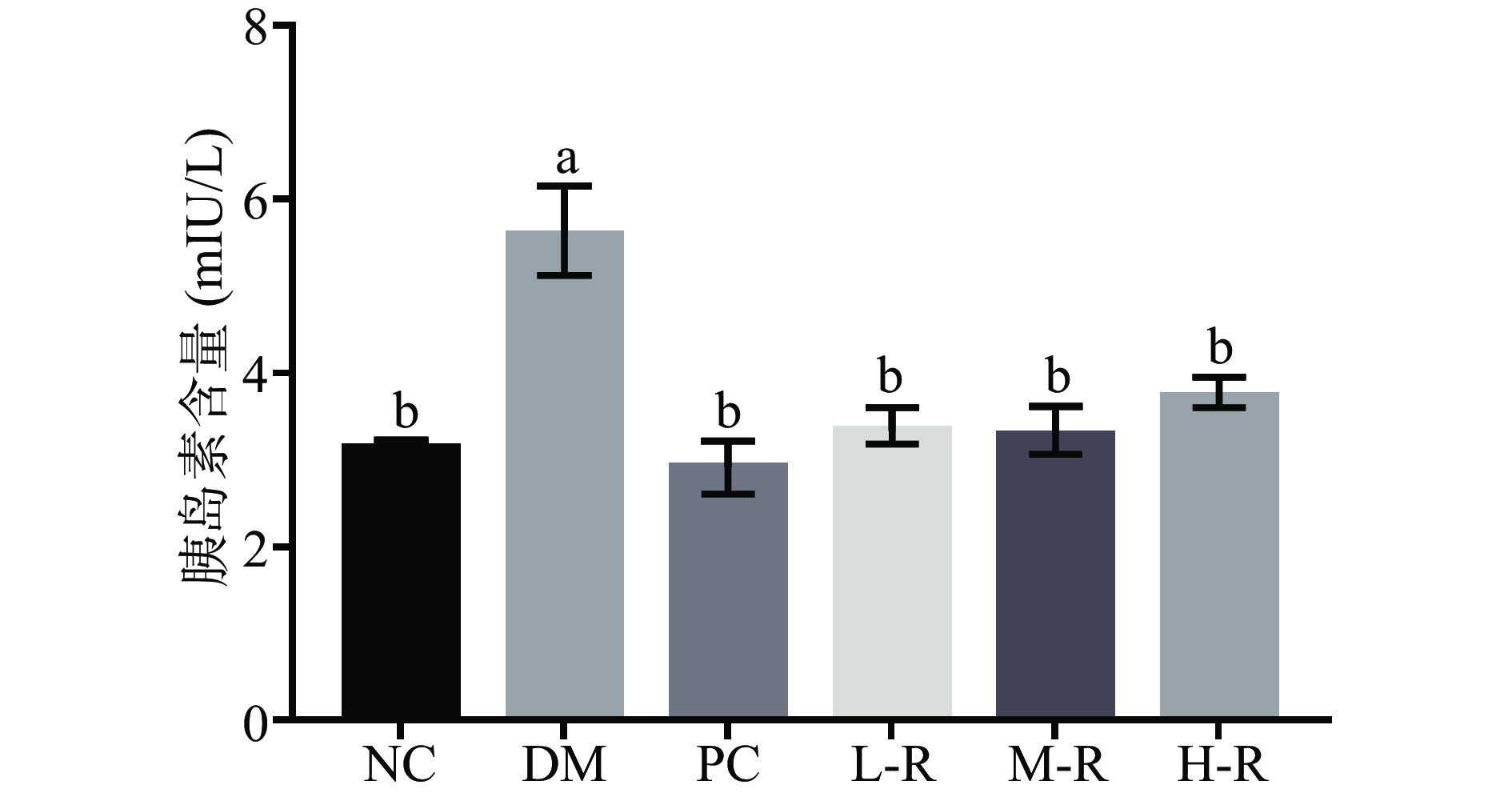
2.3 RMOS对糖尿病小鼠胰岛素的影响
在正常生理状态下,机体的血糖升高会刺激胰岛β细胞分泌胰岛素,胰岛素与特异性受体结合,从而加速对葡萄糖的吸收和代谢。而糖尿病患者会产生胰岛素抵抗,胰岛素生物效应较低,需要分泌更多的胰岛素才能维持血糖稳态。付王威等[25]对糖尿病大鼠灌胃白扁豆非淀粉多糖(100 mg/(kg·bw)),能极显著降低血清胰岛素(P<0.01),改善胰岛素抵抗程度。图4为RMOS对糖尿病小鼠体内胰岛素含量的影响。由图4可知,与正常组相比,模型组小鼠的胰岛素水平升高,说明模型组小鼠发生胰岛素抵抗,机体无法主动调节体内血糖水平。与模型组(5.58±0.57 mIU/L)相比,阳性组(2.91±0.31 mIU/L)和RMOS各剂量组小鼠血清胰岛素含量均显著降低(P<0.05)。正常组、阳性组、RMOS各剂量组无显著性差异(P>0.05),阳性药物和RMOS使得小鼠胰岛素含量恢复至正常水平,对胰岛细胞起到一定的修复作用,中、低剂量的RMOS效果更佳。上述结果表明,RMOS可降低糖尿病小鼠血清胰岛素含量,提高机体的胰岛素敏感性,改善胰岛素抵抗程度,提高胰岛素对葡萄糖的吸收利用。因为RMOS作为低聚糖易被肠道吸收利用,推测其可能通过促进肠道黏膜分泌胰高血糖素样肽-1,从而保护胰岛β细胞,减少β胰高血糖素分泌,最终改善胰岛素抵抗。
2.4 RMOS对糖尿病小鼠氧化应激水平的影响
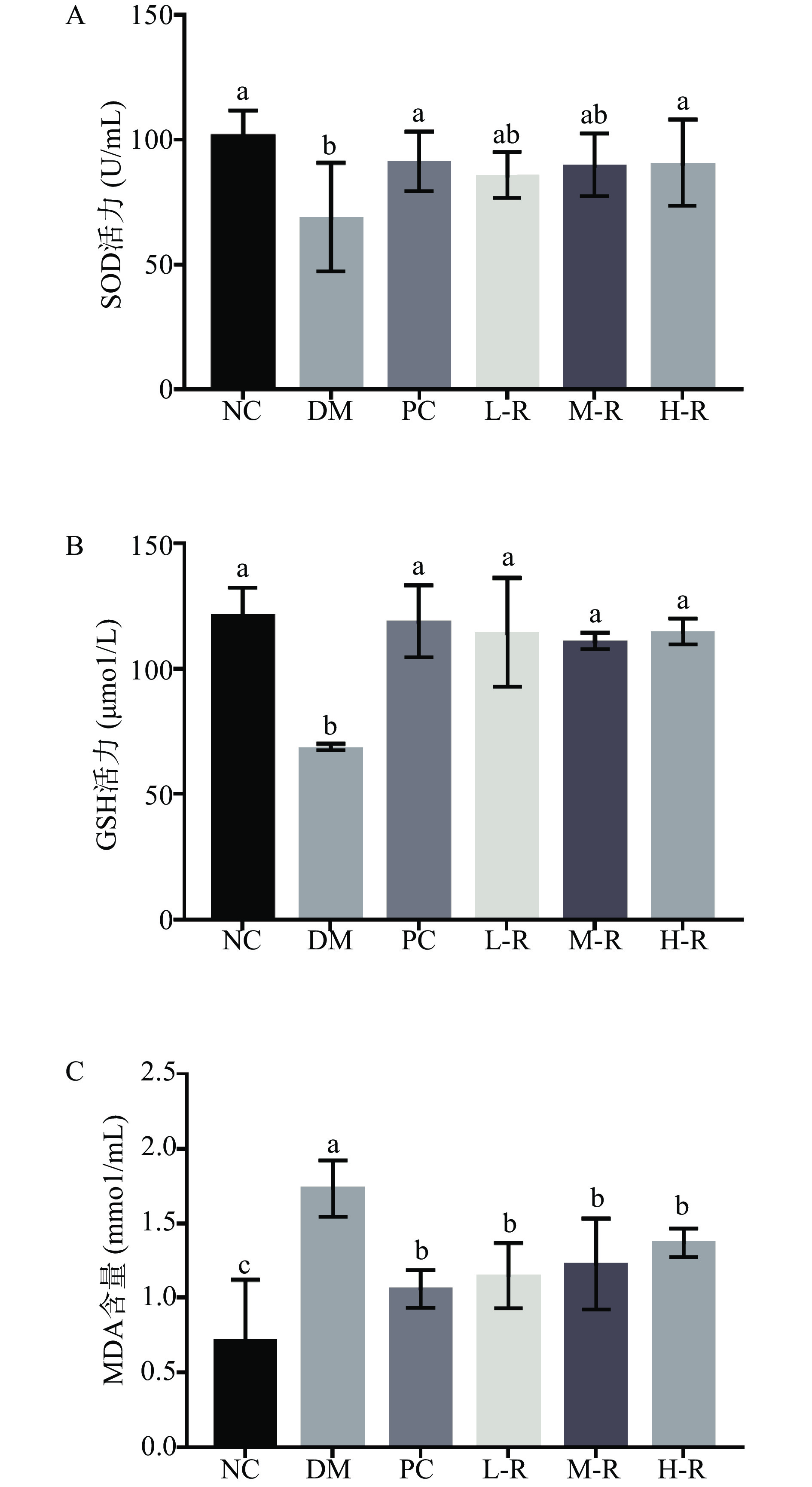
大量研究表明,血糖和游离脂肪酸升高会导致活性氧的产生和抗氧化剂与活性氧之间的失衡,最终导致各种组织中氧化应激的增加。氧化应激可能加剧糖尿病患者胰岛β细胞和胰岛素抗体损伤[26]。SOD、GSH是清除超氧产物的关键酶,可调控机体氧化损伤水平,MDA可以直接反映机体脂质过氧化反应的程度。Xia等[27]研究报道,经青钱柳多糖干预治疗,糖尿病大鼠的SOD、GSH水平分别升高78.63%、2.95倍,证实青钱柳多糖通过增强抗氧化能力对糖尿病大鼠的脾脏损伤起到保护作用。Ren等[28]同样发现桑叶多糖减轻2型糖尿病大鼠肝脏的氧化应激,有效改善肝脏的葡萄糖代谢和胰岛素信号转导。本实验探究RMOS对糖尿病小鼠氧化应激水平的影响,得到类似的结果。图5为RMOS对糖尿病小鼠氧化应激水平的影响。由图5A可见,RMOS高剂量组的SOD活力(89.53±18.46 U/mL)较模型组(70.89±16.75 U/mL)显著提高(P<0.05),与正常组(101.09±10.55 U/mL)的差异较小;由图5B可知,阳性组的GSH活力(118.00±15.25 μmol/L)恢复至接近正常组(120.75±11.65 μmol/L),RMOS组GSH水平与阳性组、正常组相当(P>0.05);由图5C可知,与模型组(1.73±0.19 mmol/mL)相比较,阳性组、RMOS各剂量组MDA含量均降低,且各剂量组间无显著性差异(P>0.05)。上述结果表明,RMOS可显著提高机体的SOD、GSH活力,降低MDA含量,提高了糖尿病小鼠抗氧化酶系统的活力,提高抗氧化能力,降低脂质过氧化损伤水平,从而有效减缓了糖尿病的发展。
2.5 RMOS对糖尿病小鼠结肠组织形态的影响
研究证实,糖尿病导致的糖脂紊乱会引起小鼠体内炎症的发生,破坏肠黏膜屏障,而肠黏膜屏障受损导致代谢性内毒素血症与糖尿病的发生发展密切相关。图6表现了RMOS对糖尿病小鼠结肠组织形态的影响,由图6可见,正常组小鼠结肠黏膜完整无损,绒毛致密、隐窝正常,肠腺排列整齐且较深;而模型组小鼠结肠黏膜褶皱减少,肠腺深度变浅且分布趋于网格状;与模型组相比,RMOS组小鼠结肠病变得到改善,表面黏膜层完整、褶皱增多,肠腺加深、网格状分布减少,但3个剂量RMOS的效果有所差异,低、中剂量组结肠形态较好,高剂量组小鼠结肠出现部分肠腺组织胀大的情况,修复效果不佳。结果表明,低、中剂量的RMOS有效改善糖尿病小鼠的结肠组织病变,较好地维持肠黏膜完整,缓解机体的慢性炎症状态。
2.6 RMOS对糖尿病小鼠肾功能的影响
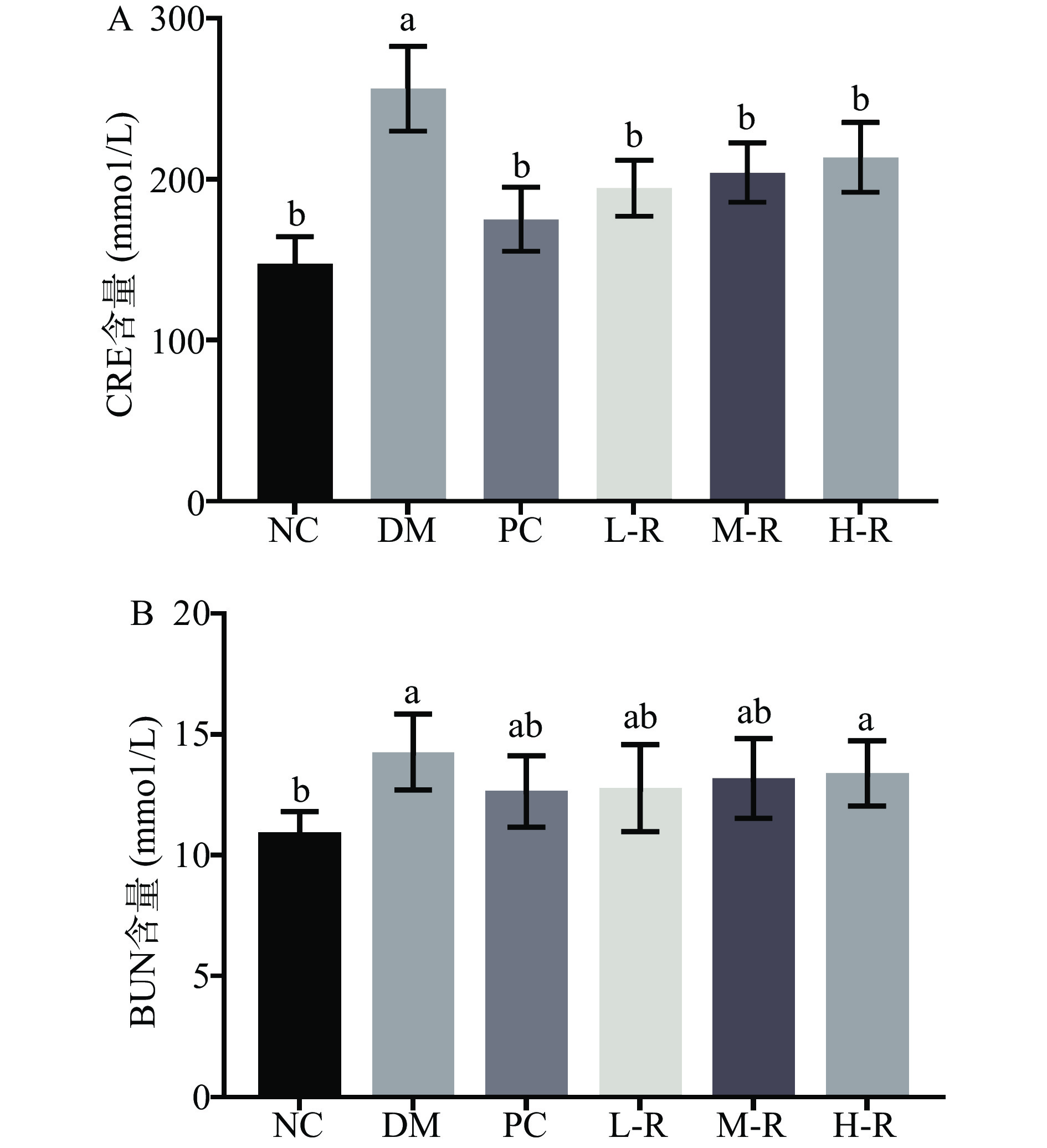
糖尿病患者常伴随肾脏功能降低,长期发展可引起糖尿病肾病,对机体健康造成极大伤害。BUN是肝脏中蛋白质分解产生的第一种内源性物质,经肾小球滤过排出体外。CRE是肌酸和磷酸肌酸分解代谢的副产品。通过测定血清中CRE、BUN水平,能够反映机体肾脏的健康[29]。Guo等[30]研究发现600 mg/kg的桑枝多糖能使得糖尿病小鼠的BUN和CRE分别降低40.70%和67.32%。图7为RMOS对糖尿病小鼠肾脏功能的影响。与正常组相比,模型组小鼠血清中BUN和CRE含量有一定程度的提高,说明本试验建模方法造成了小鼠肾脏功能的损伤。由图7A可见,模型组小鼠的CRE含量为256.34±21.32 mmol/L,相较之下阳性组(175.15±19.92 mmol/L)、RMOS低剂量组(194.65±17.12 mmol/L)、中剂量组(204.18±18.32 mmol/L)、高剂量组(213.67±21.63 mmol/L)均显著降低(P<0.05)。由图7B可知,与模型组(13.17±1.80 mmol/L)相比,阳性组的BUN水平(11.53±2.57 mmol/L)与正常组(11.20±2.01 mmol/L)相近,RMOS组小鼠BUN水平均有一定程度的降低。结果表明,RMOS能有效修复糖尿病小鼠肾脏的功能活性和代谢功能,促进了糖尿病小鼠的营养利用,改善糖尿病并发症。糖尿病肾病患者的SOD活性明显高于无肾病的糖尿病患者和健康人,糖尿病肾病大鼠体内MDA含量异常升高,GSH活性降低[30]。RMOS对糖尿病小鼠的肾脏修复作用可能与其改善氧化应激有关,通过抑制NF-κB/β-1途径的表达,抑制过氧化反应,从而保护肾功能。
2.7 RMOS对糖尿病小鼠肠道菌群的影响
近年来研究表明,糖尿病、肥胖等代谢性疾病的发生发展与肠道菌群特别是双歧杆菌、乳酸杆菌等密切相关,调节肠道菌群的分布能够抑制糖尿病患者的炎症表达,降低血糖。为了研究RMOS对糖尿病小鼠肠道菌群多样性及物种组成的影响,对肠道菌群在门、科和属水平上差异进行比较分析,结果如图8A~图8D所示。本研究采用稀释性曲线来比较测序数据量不同样本中物种的丰富度,如图8A所示,物种稀释性曲线最后趋于平滑。与正常组相比,模型组小鼠的物种丰富度最低;摄入不同剂量RMOS和药物治疗后,小鼠肠道微生物丰度得以提高,这说明RMOS能提高高脂饮食/链脲佐菌素诱导的糖尿病小鼠肠道微生物丰富度。可能是因为低聚糖易被肠道微生物利用、发酵,使得肠道内环境pH改变,改善肠道菌群紊乱,从而提高肠道微生物丰富度。
在门水平(图8B),优势菌群是拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)。有研究表明,粪便中拟杆菌门和厚壁菌门的比例关系到人体健康,其与糖耐量减低呈正相关。因此,在糖尿病患者和肥胖人群中,拟杆菌门与厚壁菌门的比例越大越好[31]。正常组拟杆菌门和厚壁菌门的比例分别为60.5%和37.1%,拟杆菌门与厚壁菌门的比例为1.63。模型组、阳性组和RMOS中剂量组小鼠肠道菌群中,拟杆菌门和厚壁菌门的比例分别为0.59、1.24和1.38。与正常组相比较,模型组小鼠粪便中拟杆菌门比例明显减少,拟杆菌门与厚壁菌门的比例大幅度降低。摄入RMOS后,糖尿病小鼠的肠道微生物结构发生了变化。粪便中拟杆菌门和厚壁菌门的组成被认为是肥胖和糖尿病等人类疾病的生物学指标,影响机体代谢从而控制体重。研究证实,摄入RMOS对改善糖尿病小鼠的菌群结构有积极影响[32],这也解释了其减少糖尿病小鼠体重下降的原因。
由图8C可知,摄入RMOS后,糖尿病小鼠粪便中乳杆菌科(Lactobacillaceae)的比例得到提高(图8C)。正常组比例为12.8%,经造模后的模型组比例降低至1.8%,药物治疗后达到2.3%,而摄入中、低剂量的RMOS后分别达到15.3%和10.6%。有研究发现2型糖尿病患者肠道菌群内乳杆菌能调节血糖,提高乳杆菌比例调节血糖效果越明显[16]。
由图8D可知,毛螺菌属(Lachnospiraceae)在模型组小鼠中的比例为21.98%,而在正常组、阳性组和RMOS低、中剂量组小鼠中分别为6.31%、4.78%、6.96%和6.10%。研究表明,毛螺菌属在糖尿病伴随非酒精性脂肪肝患者中含量更高[33]。与模型组小鼠相比,RMOS摄入后毛螺菌属的比例降低。糖尿病小鼠粪便中,乳酸杆菌属(Lactobacillus)模型组比例为1.81%,药物治疗后为2.33%,摄入低、中剂量后达到15.32%和10.57%,乳酸杆菌能抑制肠道致病菌生长,调节肠道菌群结构。乳酸杆菌可以在肠道中与致病菌竞争利用养分和定植位点,竞争性抑制大肠杆菌、沙门氏菌、产气荚膜梭菌等致病菌的定植和增殖[34-35]。本课题组也在前期研究发现,RMOS对不同的乳杆菌均具有增殖作用[15]。这可能是RMOS增殖小鼠体内乳杆菌,对糖尿病小鼠血糖有所改善的原因之一。治疗糖尿病常用药物如阿卡波糖和二甲双胍同样通过调节肠道菌群,增加益生菌的比例,特别是乳酸杆菌和双歧杆菌的含量,从而改善慢性低度炎症、减轻胰岛素抵抗[36]。实验证实,RMOS可以被肠道内的有益菌发酵利用,提高有益菌的数量,调节肠道内部pH,并且抑制致病菌的增殖,从而维持肠道平衡稳态。
3. 结论
本研究在桑枝低聚糖对乳杆菌具有促增殖作用的基础上,通过饮食和药物诱导建立糖尿病模型,对桑枝低聚糖的降血糖活性进行探究。结果发现,经40 d灌胃,低、中、高剂量组桑枝低聚糖均能在一定程度上缓解糖尿病小鼠消瘦的症状,改善糖耐量,降低体内胰岛素水平,提高SOD活力、GSH活力,降低MDA含量,修复结肠病变。中剂量(400.00 mg/(kg·bw))桑枝低聚糖治疗使得糖尿病小鼠肠道菌群中拟杆菌门与厚壁菌门的比例由0.59提高至1.3,乳杆菌科比例提高至15.3%,乳杆菌属比例提高至10.57%,毛螺菌属比例降低至6.10%。证实其通过改善胰岛素抵抗、改善氧化应激、调节肠道菌群结构来实现降血糖功效。此外,桑枝低聚糖降低血液中CRE、BUN水平,改善糖尿病小鼠肾脏的损伤,对治疗糖尿病并发症具有较好的功效。但桑枝低聚糖发挥降血糖功效的具体活性成分及相关信号通路、代谢组学尚需进一步探究,以明确其内在作用机制,为进一步开发桑枝低聚糖类降血糖功能食品提供技术参考。
-
-
[1] SAJADIMAJD S, BAHRAMI G, DAGLIA M, et al. Plant-derived supplementary carbohydrates, polysaccharides and oligosaccharides in management of diabetes mellitus: A comprehensive review[J]. Food Reviews International,2019,35(6):563−586. doi: 10.1080/87559129.2019.1584818
[2] ABBASSIOUN K, AMIRJAMSHIDI M, MEHRAZIN A, et al. A prospective analysis of 151 cases of patients with acromegaly operated by one neurosurgeon: A follow-up of more than 23 years[J]. Surgical Neurology,2006,66(1):26−31. doi: 10.1016/j.surneu.2005.11.063
[3] GREGG E W, SATTAR N, ALI M K. The changing face of diabetes complications[J]. Lancet Diabetes Endocrinol,2016,4(6):537−547. doi: 10.1016/S2213-8587(16)30010-9
[4] 陈培琳, 游卿翔, 常青, 等. 植物多糖消化酵解特性的研究进展[J]. 食品工业科技,2019,40(1):299−304,310. [CHEN P L, YOU Q X, CHANG Q, et al. Research progress of digestive and fermentation characteristics of plant polysaccharides[J]. Science and Technology of Food Industry,2019,40(1):299−304,310. doi: 10.13386/j.issn1002-0306.2019.01.053 [5] WEN P, HU T, LINHARDT R J, et al. Mulberry: A review of bioactive compounds and advanced processing technology[J]. Trends in Food Science & Technology,2019,83:138−158.
[6] YU W S, CHEN H, XIANG Z, et al. Preparation of polysaccharides from Ramulus mori, and their antioxidant, anti-inflammatory and antibacterial activities[J]. Molecules,2019,24(5):856. doi: 10.3390/molecules24050856
[7] 郭福团, 许雄伟, 潘建峰, 等. 桑枝多糖对糖尿病肾病大鼠肾脏组织抗氧化作用的影响[J]. 中国医院药学杂志,2016,36(23):2058−2061. [GUO F T, XU X W, PAN J F, et al. Anti-oxidative effects of Ramulus mori polysaccharides on diabetic nephropathy rats[J]. Chinese Journal of Hospital Pharmacy,2016,36(23):2058−2061. doi: 10.13286/j.cnki.chinhosppharmacyj.2016.23.05 [8] CHEN C, HUANG Q, YU L J, et al. Chemical property and impacts of different polysaccharide fractions from Fructus mori. on lipolysis with digestion model in vitro[J]. Carbohydrate Polymers,2017,178:360−367. doi: 10.1016/j.carbpol.2017.09.015
[9] 王晶洁. 桑枝多糖对2型糖尿病大鼠心肌及肾功能的保护作用[J]. 中西医结合心脑血管病杂志,2019,17(19):2936−2938. [WANG J J. Protective effect of Ramulus mori polysaccharides on myocardial and renal function in type 2 diabetic rats[J]. Chinese Journal of Integrative Medicine on Cardio-Cerebrovascular Disease,2019,17(19):2936−2938. doi: 10.12102/j.issn.1672-1349.2019.19.016 [10] XU L, YANG F, WANG J, et al. Anti-diabetic effect mediated by Ramulus mori polysaccharides[J]. Carbohydr Polym,2015,117:63−69. doi: 10.1016/j.carbpol.2014.09.052
[11] 潘勇, 黄永毅, 徐灵源, 等. 桑枝多糖通过调节肠道菌群降血糖的作用研究[J]. 右江民族医学院学报,2020,42(1):7−10. [PAN Y, HUANG Y Y, XU L Y, et al. The effect of Ramulus mori polysaccharides on down-regulation of blood glucose by mediating intestinal flora[J]. Journal of Youjiang Medical University for Nationalities,2020,42(1):7−10. doi: 10.3969/j.issn.1001-5817.2020.01.002 [12] LI E N, YANG S Y, ZOU Y X, et al. Purification, characterization, prebiotic preparations and antioxidant activity of oligosaccharides from mulberries[J]. Molecules,2019,24(12):23−29.
[13] 陈春娟, 朱振元, 陈璐. 低分子量蛹虫草多糖降血糖活性的研究[J]. 现代食品科技,2017,33(4):25−30. [CHEN C J, ZHU Z Y, CHEN L. Study of the hypoglycemic activity of low molecular weight polysaccharides from Cordyceps militaris[J]. Modern Food Science and Technology,2017,33(4):25−30. doi: 10.13982/j.mfst.1673-9078.2017.4.005 [14] NUNTAWAT K U, PARICHART T J, SASITHORN S, et al. Antihyperglycemic effect of rice husk derived xylooligosaccharides in high-fat diet and low-dose streptozotocin-induced type 2 diabetic rat model[J]. Food Science and Nutrition,2020,8(1):428−444. doi: 10.1002/fsn3.1327
[15] 杨诗沅, 邹宇晓, 胡腾根, 等. 桑枝低聚糖促乳酸菌生长活性优化研究[J]. 食品科学技术学报,2020,38(2):66−72. [YANG S Y, ZOU Y X, HU T G, et al. Optimization of growth promotingactivity of Ramulus mori oligosaccharides on lactic acid bacteria[J]. Journal of Food Science and Technology,2020,38(2):66−72. doi: 10.3969/j.issn.2095-6002.2020.02.009 [16] LARSEN N, VOGENSEN F K, VAN D B F W J, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One,2010,5(2):e9085. doi: 10.1371/journal.pone.0009085
[17] GUO X X, WANG Y, WANG K, et al. Stability of a type 2 diabetes rat model induced by high-fat diet feeding with low-dose streptozotocin injection[J]. Journal of Zhejiang University Science B,2018,19(7):559−569. doi: 10.1631/jzus.B1700254
[18] 王秋丹, 赵凯迪, 林长青. 葛根多糖抗氧化性及其降血糖作用研究[J]. 食品工业科技,2022,43(5):381−388. [WANG Q D, ZHAO K D, LIN C Q. Study on antioxidant properties of Pueraria lobata polysaccharides and its hypoglycemic effect[J]. Science and Technology of Food Industry,2022,43(5):381−388. doi: 10.13386/j.issn1002-0306.2021070357 [19] 高伟华, 刘鹭, 王芬, 等. 乳酸菌对高糖高脂2型糖尿病小鼠血脂的影响[J]. 食品科学,2019,40(9):179−187. [GAO W H, LIU L, WANG F, et al. Effect of Lactobacillus on blood lipids in type 2 diabetic mice fed high-glucose and high-fat diet[J]. Food Science,2019,40(9):179−187. [20] 李孔会, 廖森泰, 李倩, 等. 山药多酚对结肠炎小鼠肠黏膜损伤预防作用研究[J]. 食品科学技术学报,2021,39(4):46−54. [LI K H, LIAO S T, LI Q, et al. Study on preventive effect of chinese yam peel polyphenols on intestinal mucosal injury in colitis mice[J]. Journal of Food Science and Technology,2021,39(4):46−54. [21] 魏奇, 钟鑫荣, 陈炳智, 等. 姬松茸提取物的降血糖作用及对糖尿病大鼠肠道菌群的影响[J]. 中国食品学报,2021,21(6):131−137. [WEI Q, ZHONG X R, CHEN B Z, et al. Effect of agaricus blazei murrill extracts on gut microbiota in diabetic rats and its hypoglycemic activity[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(6):131−137. doi: 10.16429/j.1009-7848.2021.06.016 [22] GUO C, LI R, ZHENG N, et al. Anti-diabetic effect of Ramulus mori polysaccharides, isolated from Morus alba L., on STZ-diabetic mice through blocking inflammatory response and attenuating oxidative stress[J]. International Immunopharmacology,2013,16(1):93−99. doi: 10.1016/j.intimp.2013.03.029
[23] ZHOU W T, CHEN G J, CHEN D, et al. The antidiabetic effect and potential mechanisms of natural polysaccharides based on the regulation of gut microbiota[J]. Journal of Functional Foods,2020,75:104222. doi: 10.1016/j.jff.2020.104222
[24] ZHONG Q W, ZHOU T S, QIU W H, et al. Characterization and hypoglycemic effects of sulfated polysaccharides derived from brown seaweed Undaria pinnatifida[J]. Food Chemistry,2021,34(1):128148.
[25] 付王威, 吴睿婷, 万敏, 等. 白扁豆非淀粉多糖对Ⅱ型糖尿病大鼠的降血糖降血脂作用[J]. 现代食品科技,2021,37(8):1−7. [FU W W, WU R T, WAN M, et al. Hypoglycemic and hypolipidemic effects of non-starch polysaccharide from dolichos lablab l in Type Ⅱ diabetic rats[J]. Modern Food Science and Technology,2021,37(8):1−7. doi: 10.13982/j.mfst.1673-9078.2021.8.1201 [26] LI X, WU Q, SUI Y, et al. Dietary supplementation of a type procyanidins from litchi pericarp improves glucose homeostasis by modulating mTOR signaling and oxidative stress in diabetic ICR mice[J]. Journal of Functional Foods,2018,44:155−165. doi: 10.1016/j.jff.2017.12.024
[27] XIA X, LI B, QIU J, et al. Antioxidative and immunological effects of Cyclocarya paliurus polysaccharides on the spleen injury of diabetic rats[J]. Journal of Traditional Chinese Medicine,2021,41(5):739−746.
[28] REN C J, ZHANG Y, CUI W Z, et al. A polysaccharide extract of mulberry leaf ameliorates hepatic glucose metabolism and insulin signaling in rats with type 2 diabetes induced by high fat-diet and streptozotocin[J]. International Journal of Biological Macromolecules,2015,72:951−959. doi: 10.1016/j.ijbiomac.2014.09.060
[29] LI X, WANG L, GAO X, et al. Mechanisms of protective effect of Ramulus mori polysaccharides on renal injury in high-fat diet/streptozotocin-induced diabetic rats[J]. Cellular Physiology and Biochemistry,2015,37(6):2125−2134. doi: 10.1159/000438570
[30] GUO C, LIANG T, HE Q, et al. Renoprotective effect of Ramulus mori polysaccharides on renal injury in STZ-diabetic mice[J]. International Journal of Biological Macromolecules,2013,62:720−725.
[31] LEY R E, TURNBAUGH P J, KLEIN S, et al. Microbial ecology: Human gut microbes associated with obesity[J]. Nature,2006,444(7122):1022−1023. doi: 10.1038/4441022a
[32] KARLSSON F, TREMAROLI V, NIELSEN J, et al. Assessing the human gut microbiota in metabolic diseases[J]. Diabetes,2013,62(10):3341−3349. doi: 10.2337/db13-0844
[33] IBRAHIM A, HUGERTH L W, HASES L, et al. Colitis-induced colorectal cancer and intestinal epithelial estrogen receptor beta impact gut microbiota diversity[J]. International Journal of Cancer,2018,144(12):3086−3098.
[34] PAMER E G. Resurrecting the intestinal microbiota to combat antibiotic-resistant pathogens[J]. Science,2016,352(6285):535−538. doi: 10.1126/science.aad9382
[35] ZHANG Q, WU Y, FEI X. Effect of probiotics on glucose metabolism in patients with type 2 diabetes mellitus: A meta-analysis of randomized controlled trials[J]. Medicina,2016,52(1):28−34. doi: 10.1016/j.medici.2015.11.008
[36] 杨玉洁, 刘静宜, 谭艳, 等. 多糖降血糖活性构效关系及作用机制研究进展[J]. 食品科学,2021,42(23):355−363. [YANG Y J, LIU J Y, TAN Y, et al. Progress in understanding the structure-activity relationship and hypoglycemic mechanism of polysaccharides[J]. Food Science,2021,42(23):355−363. doi: 10.7506/spkx1002-6630-20200818-244






 下载:
下载:


 下载:
下载:
