Optimization of Fermentation Condition on Furanone Production by Zygsoaccharomyces rouxii QOR6 and Its Metabolic Characteristics
-
摘要: 为明确鲁氏酵母菌代谢合成呋喃酮工艺条件与代谢情况,以鲁氏酵母(Zygsoaccharomyces rouxii)QOR6为出发菌株,通过单因素实验和正交试验优化QOR6代谢合成呋喃酮的发酵条件,并采用气相色谱-质谱联用技术测定其挥发性香气物质的种类和相对含量。结果表明,当QOR6发酵温度28 ℃、发酵初始pH4.2、培养转速为180 r/min和接种量为20×107 CFU/mL时,呋喃酮的产量为2.90 mg/L,比优化前提高了1.09倍。发酵液中挥发性成分共有41种,主要包括醇类、醛类、酯类、芳香族和烃类等。其中,醇类含量最高,占总挥发物的81.13%。其他相对含量较高的为乙酸苯乙酯(3.48%)、甲醛(0.34%)、2,6-二叔丁基苯酚(8.77%)、氯甲氧基甲烷(0.20%)和3-乙基-2,5-甲基吡嗪(0.70%)。本文旨在为鲁氏酵母菌在食品中的应用提供了技术支持。Abstract: To clarify the conditions and furanone production by Zygsoaccharomyces rouxii, the fermentation conditions by Z. rouxii QOR6 were optimized through single factor and orthogonal experiments. Then the types and relative contents of volatile aroma substances were determined by gas chromatography-mass spectrometry (GC-MS). The results showed that the fermentation temperature of 28 ℃, the initial pH of 4.2, the incubation speed of 180 r/min and the inoculation amount of 20×107 CFU/mL were the optimal conditions, in which the yield of HDMF reached 2.90 mg/L, 1.09 times higher than that of before optimization. There were 41 volatiles components in the fermentation broth, mainly including alcohols, aldehydes, esters, aromatics and hydrocarbons. Among them, alcohols indicated the highest content, accounting for 81.13% of the total volatiles. Other metabolites with higher relative contents were phenethylacetate (3.48%), formaldehyde (0.34%), 2,6-di-tert-butylphenol (8.77%), chloromethoxymethane (0.20%) and 3-ethyl-2,5-methylpyrazine (0.70%). This study might provide technical support for the application of the Z. rouxii in food.
-
鲁氏酵母菌(Zygsoaccharomyces rouxii)是嗜高渗透的产香菌株,可将糖类代谢转化为高级醇、芳香族化合物以及具有焦香气味呋喃酮(4-hydroxy-2,5-dimethyl-3(2H) furanone,HDMF)等,这些物质常被作为增香剂,对食品风味具有很大的影响[1-2]。常见代谢合成HDMF菌株有鲁氏酵母、毕赤酵母、乳酸菌等[3]。鲁氏酵母菌是目前报道中生物合成HDMF最主要的菌株,在添加D-果糖和NaCl的培养基中发酵5 d,鲁氏酵母菌合成HDMF产量可达到6.77 mg/L[4]。毕赤酵母在培养4 d时HDMF产量最高约为2 mg/L,乳酸菌在培养3 d时HDMF产量达到1.17 mg/L[5]。研究表明,鲁氏酵母菌在食品加工中具有安全性高、无毒副作用等优点。其在酱油、香醋和豆酱中均起到重要的呈味效果[6-7]。鲁氏酵母菌也可提高香肠的口感与风味[8]。国内外对于鲁氏酵母菌产香的研究多集中在传统高盐发酵食品中,关于其他食品产业的应用报道相对较少。利用气相色谱-质谱联用(GC-MS)技术评价了鲁氏酵母菌参与的发酵葡萄酒样品,检测了葡萄酒中的高级醇、果香和花香气味等风味物[9-10]。
本实验室采用基因工程技术,利用醌氧化还原酶(Quinone oxidoreductase,QOR)构建Z. rouxii QOR过表达工程菌,QOR是酵母菌利用果糖-1,6-二磷酸(Fructose-1,6-bisphosphate, FBP)代谢合成HDMF的重要催化酶[11]。筛选得到的高产HDMF菌株QOR6,QOR基因表达量相比于出发菌株提高了4.8倍(未发表结果)。但其代谢合成HDMF发酵条件及代谢特征未见报道。因此,本文深入研究鲁氏酵母菌QOR6发酵合成HDMF条件,有利于鲁氏酵母菌改善食品风味,推动其在食品增香中的应用。
1. 材料与方法
1.1 材料与仪器
鲁氏酵母菌QOR6 本实验室构建;YPD液体培养基:20 g/L蛋白胨,20 g/L葡萄糖,10 g/L酵母提取物;YPD固体培养基:20 g/L蛋白胨,20 g/L葡萄糖,10 g/L酵母提取物,琼脂;HDMF标品 美国Sigma公司;甲醇、乙腈和甲酸(色谱级) 百灵威科技有限公司。
MLS-830L立式压力蒸汽灭菌锅 普和希健康医疗器械(上海)有限公司;Opti-Clean 1300垂直流洁超净工作台 立新仪器(上海)有限公司;SB25-12DTD超声波清洗机 宁波新芝生物科技股份有限公司;H1850R台式高速离心机 湘仪离心机仪器有限公司;显微镜 上海永科光学仪器有限公司;ZQLY-300V立式双层振荡器 上海知楚仪器有限公司;ZXSP-B0270生化培养箱 上海智城分析仪器制造有限公司;PB-10/C酸度计 北京赛多利斯仪器系统有限公司;1290 UHPLC型超高效液相色谱仪 安捷伦科技有限公司;ITQ 1100型气相色谱质谱联用仪 赛默飞世尔科技有限公司。
1.2 实验方法
1.2.1 菌株的活化与培养
参考Liu等[12]方法并稍作改动。取冻存的鲁氏酵母菌QOR6,在灭菌后的YPD固体培养基中划线,于恒温培养箱中在28 ℃的条件下培养3 d。挑取单菌落移至装有100 mL YPD液体培养基的250 mL三角瓶中,于全温振荡器中在28 ℃、180 r/min条件下培养3 d,当细胞总数达到2.5×108~3.0×108 CFU/mL时备用。取5 mL已活化好的菌液接种到100 mL YPD培养基中,在全温振荡器中28 ℃、180 r/min条件下培养27 h作为种子液用于后续试验。
1.2.2 HDMF的测定
根据Li等[13]的研究方法并稍作修改。取培养后的发酵液在4 ℃条件下8000 r/min离心10 min,移液枪精准吸取2 mL上清液,经0.22 μm滤膜过滤后采用HPLC测定HDMF含量。液相色谱条件:UPLC BEH-Amide(1.7 µm, 2.1 mm×100 mm),流动相为0.1%甲酸(A)和乙腈(B),洗脱梯度为:0~10 min,5%B;10~15 min,20%B;15~20 min,100%B。流速1 mL/min,柱温25 ℃,进样量10 µL,检测波长287 nm,使用外标法定量。
1.2.3 鲁氏酵母菌QOR6合成HDMF产量的发酵条件优化
将不同浓度的种子液接种到YPD培养基中,采用控制变量法进行单因素实验,以发酵温度28 ℃、pH4.7、转速180 r/min、接种量20×107 CFU/mL、发酵时间3 d作为基础培养工艺参数[13],分别考察温度(24、28、32和36 ℃)、初始pH(5.7、5.2、4.7、4.2和3.7)、转速(160、180、200和220 r/min)、接种量(2×107、5×107、20×107和50×107 CFU/mL)等因素对QOR6合成HDMF产量的影响。
根据单因素实验结果,设计4因素3水平的正交试验,确定QOR6的最佳发酵参数。正交试验因素水平见表1。
表 1 正交试验L9(34)因素水平表Table 1. Factors and levels of L9(34) orthogonal test水平 因素 温度(℃) 初始pH 转速(r/min) 接种量(×107 CFU/mL) 1 24 4.7 160 5 2 28 4.2 180 20 3 32 3.7 200 50 1.2.4 挥发性物质测定
1.2.4.1 待测样品制备
离心后的发酵液中加入液氮迅速冷冻研磨粉碎,称取适量粉碎样品,于顶空瓶中,加入2 g饱和氯化钠,压盖,置于80 ℃水浴中平衡20 min,再将固相微萃取针扎进顶空中,继续放入80 ℃水浴中20 min,上机检测。
1.2.4.2 GC-MS测定条件
GC条件:TG-5 MS毛细管柱(30 m×0.25 mm×0.25 µm);程序升温:初始温度50 °C,保持3 min以后,6 ℃/min的升温速度升至250 ℃,保持5 min。载气为高纯氦气,流速1.0 mL/min;进样量1.0 µL。
MS条件:电离方式为EI,电子能量为70 eV,接口温度为250 ℃,离子源温为230 ℃,四级杆温度为200 ℃,无溶剂延迟,全扫描方式,质量扫描范围40~650 m/z。
挥发性物质定性定量分析:采集到的质谱图利用NIST谱库进行检索,鉴定样品中的挥发性成分,并利用面积归一化法分析各成分的相对含量。
1.3 数据处理
实验每组3个平行样品,结果用平均值±标准差来表示。利用SPSS 25.0进行数据分析和Prism 8.0制图。采用单因素方差分析及Duncan检验比较各组数据,P<0.05表示样品间具有统计学意义。
2. 结果与分析
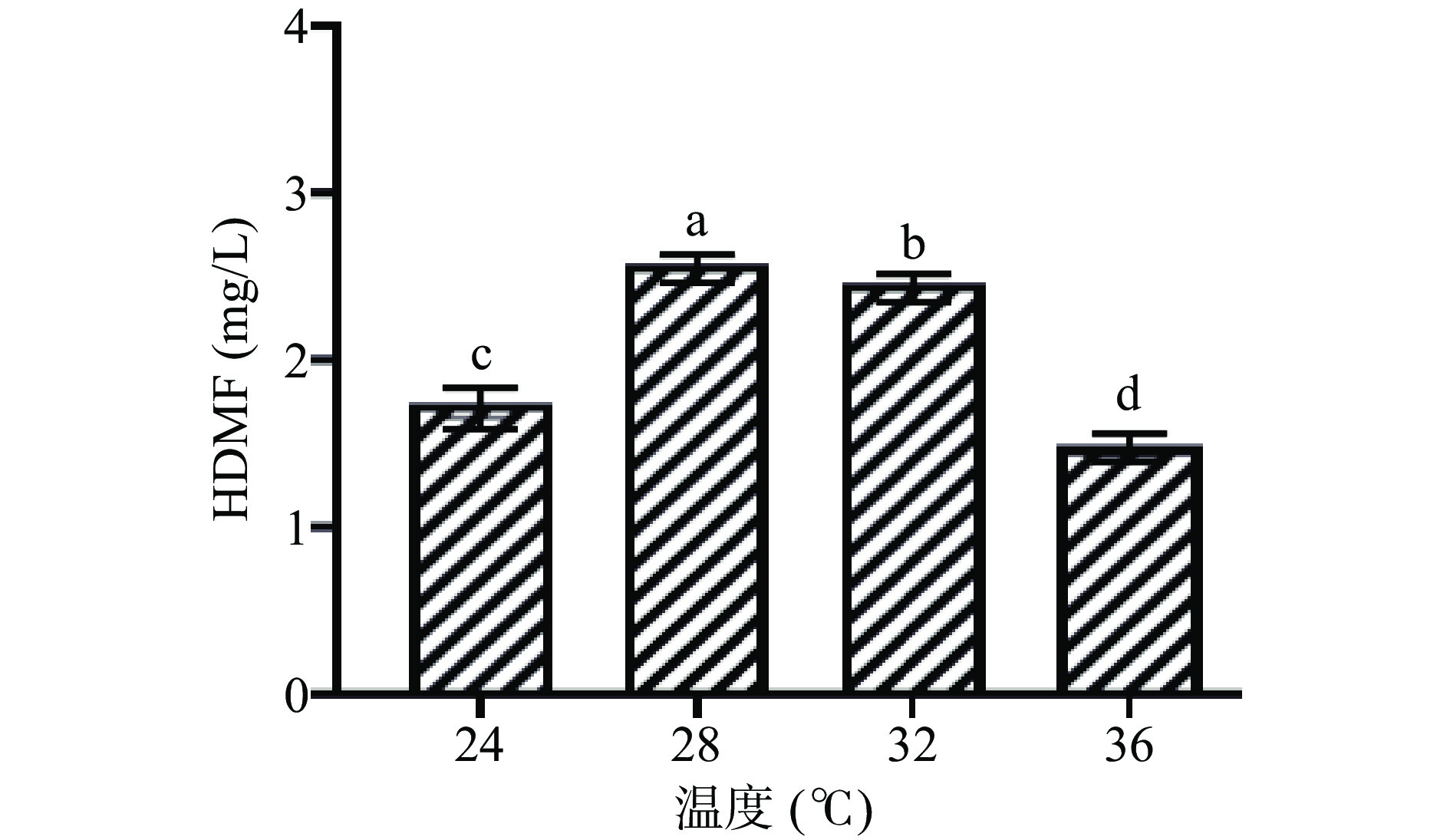
2.1 发酵温度对鲁氏酵母菌QOR6合成HDMF产量的影响
随着发酵温度的增加,发酵液中的HDMF产量呈现出先升高后降低的趋势(图1)。当发酵温度为36 ℃时,发酵液中的HDMF含量最低为1.56 mg/L;当发酵温度为28 ℃时,HDMF含量达到最高为2.65 mg/L,显著高于其他样品(P<0.05)。因此,当发酵温度在28~32 ℃时适宜鲁氏酵母菌QOR6生长,这与康远军等[14]研究结果相一致。研究表明,在发酵过程中,发酵温度主要通过影响酵母体内生物酶活性来调控生长和代谢活性[15],当发酵温度过高时,细胞内酶的催化活性受到抑制导致代谢产物降低。因此,鲁氏酵母菌QOR6产HDMF的最佳发酵温度为28 ℃,并在此温度下用于研究后续实验。
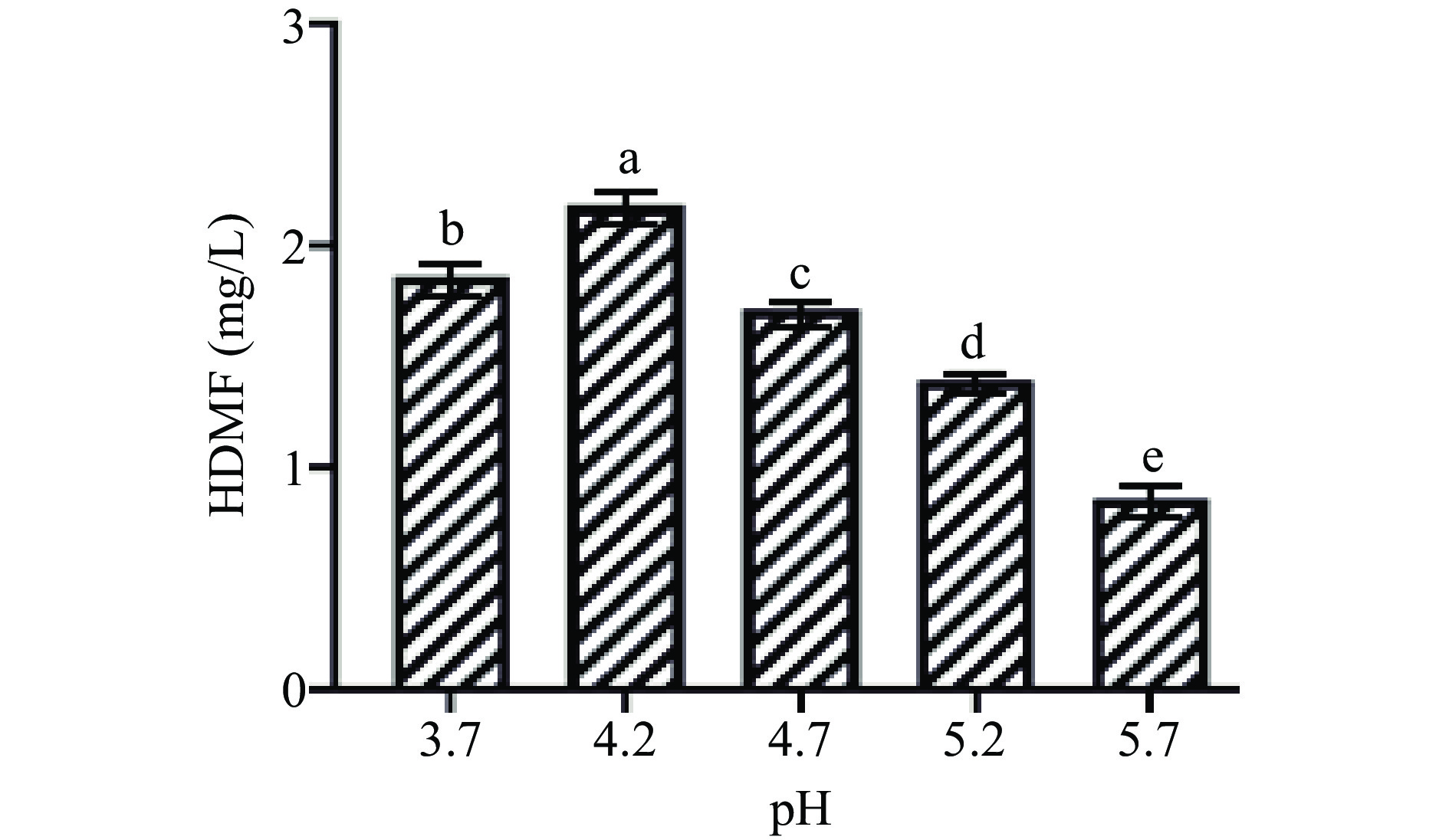
2.2 初始pH对鲁氏酵母菌QOR6合成HDMF产量的影响
初始pH对鲁氏酵母菌QOR6产HDMF含量的影响如图2所示。随着发酵液初始pH的增加,发酵液中的HDMF含量呈现出先升高后降低的趋势。在初始pH为4.2时,发酵液中的HDMF含量最高为2.18 mg/L,显著高于其他实验组(P<0.05)。当初始pH为5.7时,发酵液中的HDMF含量最低。因此,鲁氏酵母菌适合在较低酸性的条件下生长代谢,当初始pH为4.2时有利于鲁氏酵母菌QOR6生长和代谢。
研究表明,在发酵过程中,适宜的初始pH有利于提高发酵过程中微生物中酶的活性,从而促进其生长代谢[16]。鲁氏酵母菌可在pH1.5~10.5的范围内生长,且最适生长范围在3.5~5.0[3],这与本文的研究结果相类似。因此,将培养基pH调至4.2作为初始pH用于后续研究。
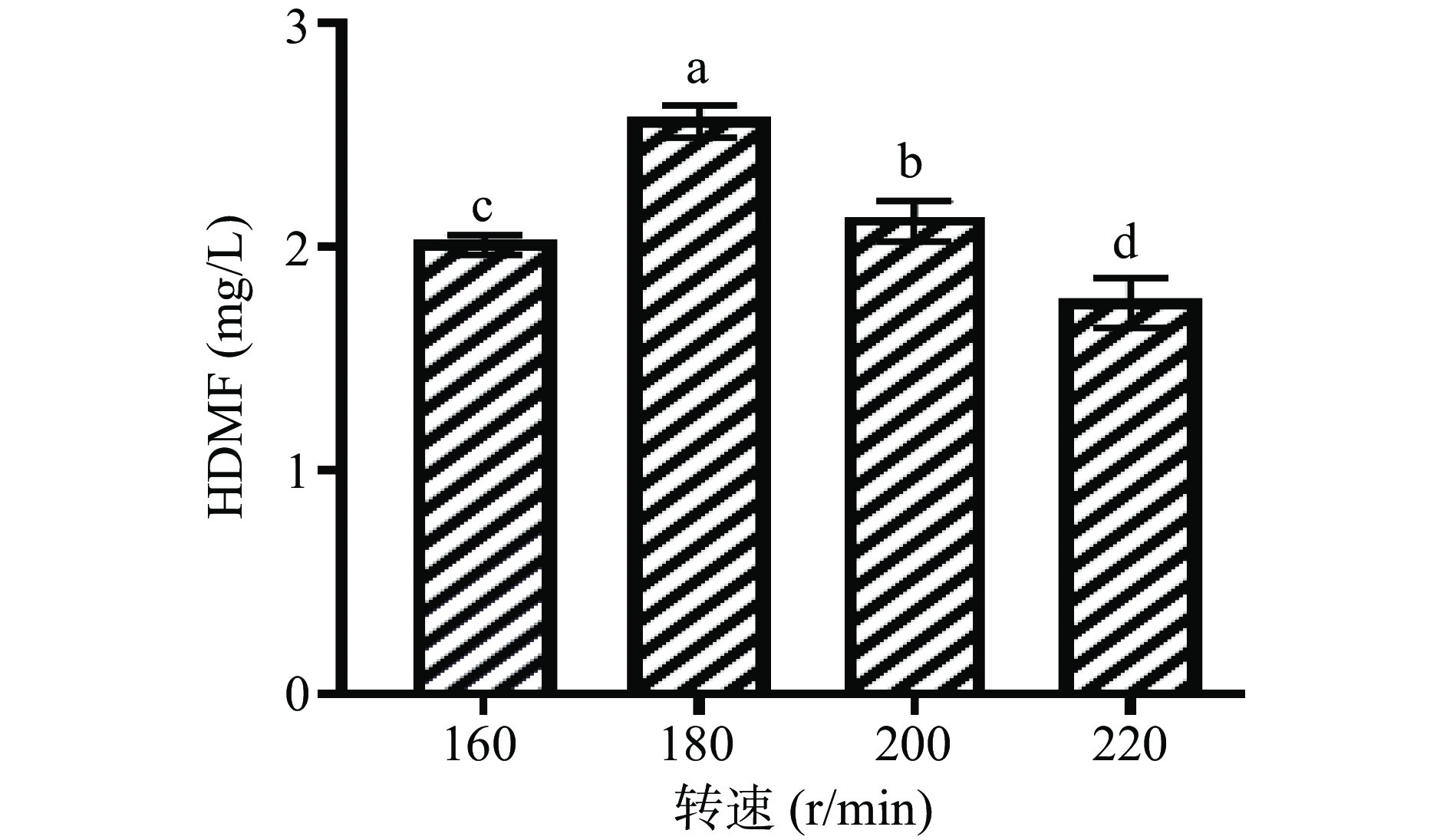
2.3 转速对鲁氏酵母菌QOR6合成HDMF产量的影响
培养转速对鲁氏酵母菌QOR6产HDMF产量的影响如图3所示。随着转速的增加,发酵液中的HDMF含量呈现出先升高后降低的趋势。在培养转速为180 r/min时,发酵液中的HDMF含量最高为2.6 mg/L(P<0.05)。而当培养转速为220 r/min时,发酵液中的HDMF含量最低为1.76 mg/mL。
鲁氏酵母属于兼性厌氧菌,在有氧环境更适宜生长,适当的摇瓶培养可以为酵母生长提供充足的氧气,利于前期细胞数目的积累[17]。转速过高导致发酵液中HDMF含量降低的原因可能是由于供氧充足时,导致细胞数目增加,耗氧量高,酵母快速生长而代谢产物减少[18]。因此,后续实验培养转速为180 r/min。
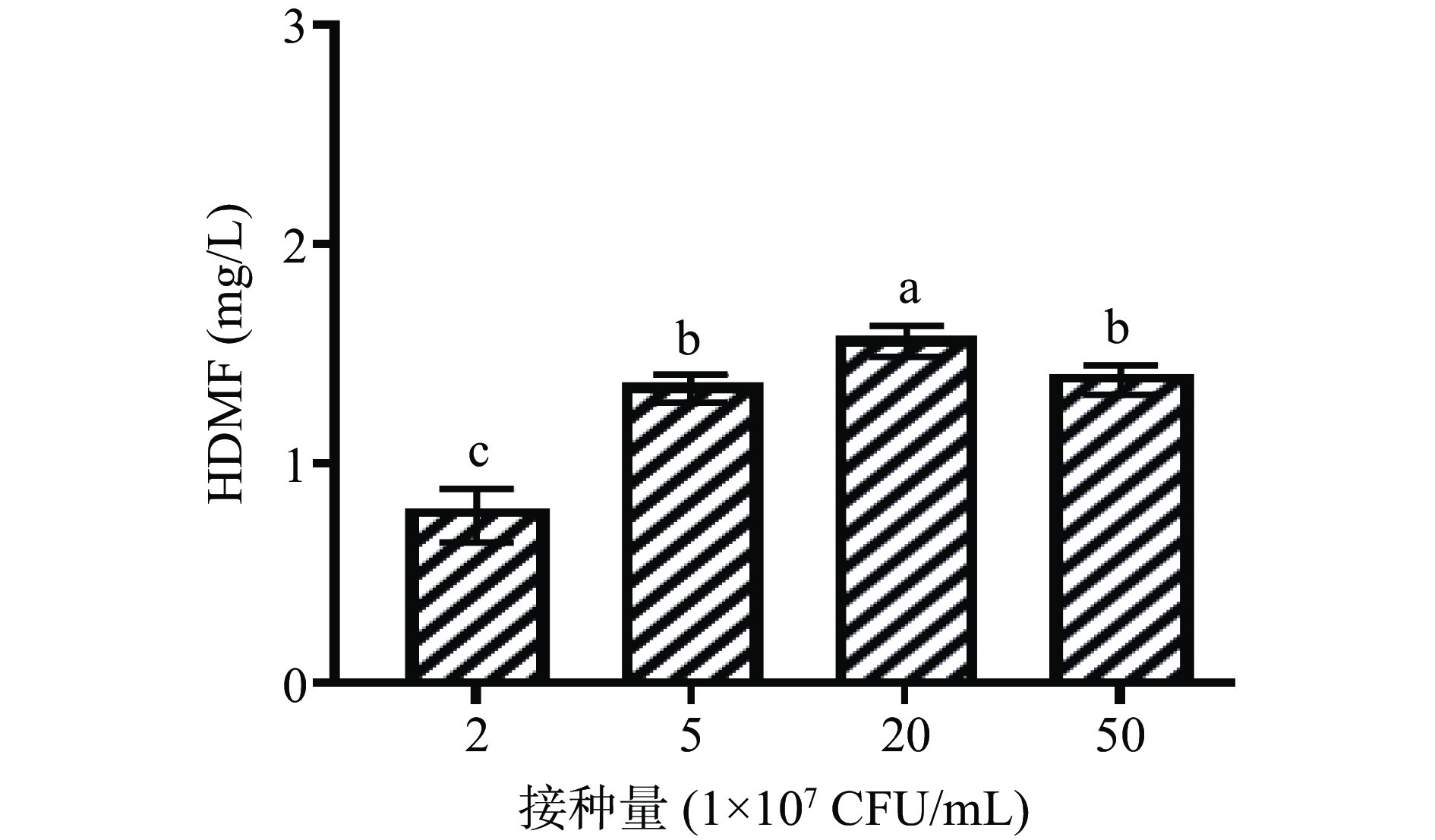
2.4 接种量对鲁氏酵母菌QOR6产HDMF产量的影响
接种量对鲁氏酵母菌QOR6产HDMF含量的影响如图4所示。随着接种量的增加,发酵液中的HDMF含量呈现出先升高后降低的趋势。在接种量为20×107 CFU/mL时,发酵液中的HDMF含量最高为1.54 mg/L,显著高于其他实验组(P<0.05);当接种量为2×107 CFU/mL时,发酵液中的HDMF含量最低。因此,当接种量为20×107 CFU/mL时,有利于鲁氏酵母菌QOR6代谢。研究表明,酵母接种量对细胞的生长代谢具有显著的调节作用[19]。随着发酵接种量的增加,发酵液中的HDMF含量呈现出先升高后降低,可能是由于接种量过低,酵母细胞数量少,代谢出的目标产物少。而接种量较高,细胞间竞争加剧,营养物质或氧气不足导致酵母细胞生长缓慢[18]。
2.5 正交试验结果
正交试验结果表明(表2),影响QOR6合成HDMF的因素顺序为:温度(A)>转速(C)>初始pH(B)>接种量(D)。方差分析结果表明(表3),温度、转速和初始pH对QOR6发酵生产HDMF具有显著影响(P<0.05),而接种量对HDMF产量无显著影响(P>0.05)。正交试验优化得到的条件为:发酵温度28 ℃、初始pH4.2、转速180 r/min、接种量20×107 CFU/mL。此条件下,测得HDMF产量高达2.90 mg/L。由于外源D-果糖和NaCl对鲁氏酵母产HDMF具有促进作用,因此与前人研究结果6.77 mg/L存在差异[4]。
表 2 正交试验结果Table 2. Result of orthogonal test实验号 A温度 B初始pH C转速 D接种量 HDMF产量
(mg/L)1 1 1 1 1 2.18±0.26 2 1 2 2 2 2.31±0.41 3 1 3 3 3 2.15±0.24 4 2 1 2 3 2.78±0.54 5 2 2 3 1 2.65±0.36 6 2 3 1 2 2.61±0.29 7 3 1 3 2 2.43±0.22 8 3 2 1 3 2.37±0.39 9 3 3 2 1 2.39±0.25 k1 2.19 2.44 2.36 2.41 k2 2.68 2.46 2.49 2.45 k3 2.39 2.38 2.41 2.43 R 0.49 0.08 0.13 0.04 A>C>B>D A2B2C2D2 表 3 方差分析结果Table 3. Analysis of variance因素 偏差平方和 自由度 均方 F值 显著性 温度 1.078 2 0.539 89.391 * 初始pH 0.031 2 0.015 16.838 * 转速 0.112 2 0.056 61.470 * 接种量 0.019 2 0.009 10.202 误差 0.016 18 0.003 注:*差异显著(P<0.05)。 2.6 挥发性物质分析
在最优发酵条件下,利用GC-MS技术测定鲁氏酵母菌QOR6代谢合成的挥发性物质,结果如表4所示。
表 4 挥发性化合物GC-MS测定结果Table 4. Results of volatile compounds by GC-MS detection分类 序号 化合物名称 保留时间(min) 分子量(Da) 相对含量(%) 醇类
(7种)1 异丁醇 Isobutanol 2.30 74.07 1.69 2 异戊醇Isoamylol 3.86 88.09 16.64 3 叔戊醇 2-Methyl-1-butanol 3.93 88.00 5.77 4 2,2-二氯乙醇 2,2-Dichloro-ethanol 13.59 113.96 0.06 5 苯乙醇 Phenylethyl alcohol 15.32 122.07 56.58 6 (R)-3,7-二甲基-6-辛烯醇 (R)-3,7-Dimethyl-6-octen-1-ol 18.37 156.11 0.31 7 全氟己基乙基醇1H,1H,2H,2H-Perfluorooctan-1-ol 30.71 364.01 0.08 合计 81.13 酯类
(10种)8 胆甾烷-3,22,26-三醇-16-[2-硫代羟乙基]-3,26-二乙酸酯3,22,26-Triol-cholestan- 16-[2-thiohydroxyethyl]- 3,26-diacetate 2.17 564.39 0.05 9 1,2-丙二醇二甲酸酯1,2-Propanediol diformate 5.04 132.04 0.06 10 苯乙酸乙酯Benzeneacetic acid ethyl ester 18.87 164.08 0.49 11 乙酸苯乙酯Acetic acid 2-phenylethyl ester 19.21 164.08 3.48 12 2-甲基丁酸, 2-苯乙酯 2-Methyl-butanoic acid,2-phenylethyl ester 21.93 206.13 1.52 13 2-苯基乙基丁酸戊酯 Pentyl 2-phenylethyl butylphosphonate 23.12 312.19 0.27 14 二(2-苯乙基)草酸酯 Bis(2-phenylethyl) oxalate 25.55 298.12 0.14 15 邻苯二甲酸戊酯 Pentyl 2-phenylethyl phthalate 25.68 340.17 0.27 16 邻苯二甲酸二甲酯 Dimethyl phthalate 36.06 194.19 0.08 17 邻苯二甲酸二辛酯 Dioctyl phthalate 37.85 390.56 0.13 合计 6.49 醛类
(8种)18 巴豆醛2-Butenal 2.58 70.04 0.07 19 异戊醛3-Methyl-butanal 2.64 86.07 0.10 20 苯甲醛Benzaldehyde 10.20 106.04 0.34 21 苯乙醛Benzeneacetaldehyde 12.82 120.06 0.19 22 壬醛Nonanal 14.71 142.14 0.20 23 4-戊烯醛4-Pentenal 16.71 84.06 0.06 24 3,4-二甲基苯甲醛 3,4-Dimethyl-benzaldehyde 18.19 134.07 0.19 25 甲基乙基腙丙醛 Propanal, (1-methylethyl) hydrazone 31.40 114.12 0.17 合计 1.32 芳香类
(5种)26 2-氨基吡啶 2-Aminopyridine 5.97 94.05 0.07 27 2,5-二甲基吡嗪2,5-Dimethyl-pyrazine 8.55 108.07 0.27 28 3-乙基-2,5-甲基吡嗪 3-Ethyl-2,5-dimethyl-pyrazine 13.79 136.10 0.70 29 环戊基苯Cyclopentyl-benzene 19.67 146.11 0.06 30 2,6-二甲基-4-氨基吡啶 2,6-Dimethyl-4-pyridinamine 20.87 122.08 0.09 合计 1.19 烃类
(4种)31 氯甲氧基甲烷Chloromethoxy-methane 3.35 80.00 0.20 32 二甲基癸烷 Decane,2-methyl 27.36 155.30 0.06 33 1,1-二甲基锗酰氯-3-烯1,1-Dimethyl-germacyclopent-3-ene 17.92 158.02 0.07 34 4-苯基-1-环己烯4-Phenyl-1-cyclohexene 24.35 158.11 0.17 合计 0.50 其他
(7种)35 2,6-二叔丁基苯酚2,6-Di-tert-butylphenol 25.96 206.33 8.77 36 氯甲氧甲基醚 Chloromethoxy-methane 3.35 80.00 0.20 37 3,5-二硝基苯甲酸 3,5-Dinitrobenzoic acid 31.68 212.12 0.07 38 N-(2-甲基双环[2.2.1]庚-2-基)乙酰胺Exo-2-methyl-endo-2-(acetylamino)norbornane 17.18 167.13 0.1 39 (2E)-2-氰基-N-羟基-2-(羟基亚氨基)乙酰胺 (2E)-2-Cyano-N-hydroxy-2-(hydroxyimino)ethanimidamide 17.37 128.03 0.07 40 2,2,3,3,4,4,4-七氟-N-(2-苯基乙基)-丁酰胺2,2,3,3,4,4,4-Heptafluoro-N-(2-phenylethyl)-butanamide 37.22 213.05 0.09 41 6,7,8,9-Tetrahydro-2-amino-4-(2-fluorophenyl)-5H-cyclohepta[b]pyridine-3-carbonitrile 10.67 281.13 0.12 合计 9.42 2.6.1 醇类挥发物质分析
醇类物质主要是鲁氏酵母菌通过糖酵解途径产生,表现为甜香和花果香[20-21]。样品中共检测出7种醇类(表4),占总挥发物的81.13%。主要有异丁醇(酒精气味)、异戊醇(花香,水果香)、叔戊醇(焦灼味)和苯乙醇(清甜的玫瑰样花香)等[22]。其中含量最多的是苯乙醇,占总挥发物的56.58%,是由苯丙氨酸代谢出的一种具有玫瑰香味的芳香醇,因其嗅闻强度较高,是果酒中常见的香气活性物质[23]。赵培城等[24]在研究绍兴黄酒的香气物质时发现,醇香的主要贡献来源是苯乙醇和异戊醇。因此,鲁氏酵母菌QOR6也能够增加食品的甜果香,可应用于食品发酵。
2.6.2 酯类挥发物质分析
酯类物质通常由发酵期间微生物代谢作用及醇类和有机酸的酯化反应生成[25]。样品共检测出10种酯类(表4),占总挥发物的6.49%。主要有苯乙酸乙酯(花香,蜂蜜香)、乙酸苯乙酯(花香和水果香)、2-甲基丁酸,2-苯乙酯(月季花香、甜果香和蜡烛气味)等[26]。其中乙酸苯乙酯的占比最大为3.48%,是风味物质中花果香气的主要来源。酯类物质对白酒风格形成具有重大意义,不同香型的白酒中,酯类的种类及含量不同[27]。酯类物质也是酱类发酵食品中主要香气贡献成分,酱油中的酯类化合物是已报道物质中品种最多的[28]。因此,在发酵过程中添加鲁氏酵母菌QOR6,可以增加食品的花果香气。
2.6.3 醛类挥发物质分析
醛类化合物主要来源于糖类与氨基酸作用,阈值较低,具有脂肪香气[29]。样品中共检测到8种醛类(表4),占总挥发物的1.32%。主要有巴豆醛(臭味)、异戊醛(青草香、巧克力香味)、苯甲醛(苦杏仁、樱桃及坚果香)、苯乙醛(风信子花香和甜果香)、壬醛(玫瑰、柑橘和油脂气味)、3,4-二甲基苯甲醛(杏仁味)和4-戊烯醛[30]等,其中苯甲醛的占比最大为0.34%。发酵过程中醛类的生成量虽少,但对香气成分的贡献很大。醛类物质在肉制品加工中对风味的影响突出,含有小分子量的醛时,可使产品整体的风味更醇厚。李永杰等[31]在风干肠中检测到壬醛,由不饱和脂肪酸的自动氧化而成,有较强的油脂味,对发酵肉制品的香味有重要贡献。刘丹丹等[32]在对酱牛肉风味物质测定时,发现醛类是最主要的风味来源,其中苯甲醛含量最高。因此,鲁氏酵母菌QOR6的添加,能增强食品的油脂香,可在肉制品中进行应用。
2.6.4 芳香族化合物及烃类挥发性物质分析
发酵液中共检测到5种芳香族化合物(表4),占总挥发物的1.19%,其中3-乙基-2,5-甲基吡嗪含量最高为0.70%。芳香族化合物的产生主要由醛和烯醇进一步环化生成的吡嗪和吡啶。发酵液中共检测到4种烃类化合物(表4),占总挥发物的0.50%,其中氯甲氧基甲烷含量最高为0.20%。烃主要来源于脂肪酸醇氧自由基的均质化和脂肪降解,一般会有所谓的烷烃气味,其中阈值较低的不饱和烃对香气贡献较大[33-34]。烯烃和烷烃类大多属于小分子物质,在发酵前期,可作为营养物质,经酵母发酵进一步合成酯类物质[35]。
2.6.5 其他挥发性物质分析
发酵液中产生的其他挥发性物质,主要有酰胺类、酚类、酸类和醚类,占总挥发物的9.42%。酰胺类物质对风味没有显著贡献,具有一定刺激性气味。酸类物质是醇和醛氧化产生,多作为非挥发性香气物质存在于发酵液。醚类可能是在高温下,由醇脱水化合而成。样品中只检测到1种酚类为2,6-二叔丁基苯酚,其相对含量为8.77%,也有学者在糯米酒、熟制香菇和软儿梨果酒等食品挥发性成分中检测到该物质[36-37]。上述各种物质间的相互作用,使得鲁氏酵母菌QOR6代谢出的挥发性香气成分更为丰富。
3. 结论
本研究对鲁氏酵母菌QOR6代谢合成HDMF培养条件进行了优化,并对其代谢出的挥发成分进行分析,为酵母因酿造方式带来的环境改变提供适宜的发酵参数。最终确定该菌株产HDMF最优培养条件:发酵温度28 ℃、初始pH4.2、转速为180 r/min、接种量为20×107 CFU/mL。在此条件下,合成的HDMF产量为2.90 mg/L。此外,代谢得到的醇、酯、醛类化合物种类丰富,检测到有苯乙醇、异戊醇、乙酸苯乙酯、苯甲醛等关键香气成分,他们的呈味效果将更突出,使发酵液整体呈现出甜果香及坚果的香气。由此可见,鲁氏酵母菌不仅可以提高HDMF的含量,还能显著改善发酵液风味。后续可在此研究基础上,对风味物质形成的特定代谢途径以及相关的调控基因进行挖掘。研究结果可为鲁氏酵母菌基因改造菌株进一步研究,以及利用其呈味特征在食品工业中的应用提供技术参考。
-
表 1 正交试验L9(34)因素水平表
Table 1 Factors and levels of L9(34) orthogonal test
水平 因素 温度(℃) 初始pH 转速(r/min) 接种量(×107 CFU/mL) 1 24 4.7 160 5 2 28 4.2 180 20 3 32 3.7 200 50 表 2 正交试验结果
Table 2 Result of orthogonal test
实验号 A温度 B初始pH C转速 D接种量 HDMF产量
(mg/L)1 1 1 1 1 2.18±0.26 2 1 2 2 2 2.31±0.41 3 1 3 3 3 2.15±0.24 4 2 1 2 3 2.78±0.54 5 2 2 3 1 2.65±0.36 6 2 3 1 2 2.61±0.29 7 3 1 3 2 2.43±0.22 8 3 2 1 3 2.37±0.39 9 3 3 2 1 2.39±0.25 k1 2.19 2.44 2.36 2.41 k2 2.68 2.46 2.49 2.45 k3 2.39 2.38 2.41 2.43 R 0.49 0.08 0.13 0.04 A>C>B>D A2B2C2D2 表 3 方差分析结果
Table 3 Analysis of variance
因素 偏差平方和 自由度 均方 F值 显著性 温度 1.078 2 0.539 89.391 * 初始pH 0.031 2 0.015 16.838 * 转速 0.112 2 0.056 61.470 * 接种量 0.019 2 0.009 10.202 误差 0.016 18 0.003 注:*差异显著(P<0.05)。 表 4 挥发性化合物GC-MS测定结果
Table 4 Results of volatile compounds by GC-MS detection
分类 序号 化合物名称 保留时间(min) 分子量(Da) 相对含量(%) 醇类
(7种)1 异丁醇 Isobutanol 2.30 74.07 1.69 2 异戊醇Isoamylol 3.86 88.09 16.64 3 叔戊醇 2-Methyl-1-butanol 3.93 88.00 5.77 4 2,2-二氯乙醇 2,2-Dichloro-ethanol 13.59 113.96 0.06 5 苯乙醇 Phenylethyl alcohol 15.32 122.07 56.58 6 (R)-3,7-二甲基-6-辛烯醇 (R)-3,7-Dimethyl-6-octen-1-ol 18.37 156.11 0.31 7 全氟己基乙基醇1H,1H,2H,2H-Perfluorooctan-1-ol 30.71 364.01 0.08 合计 81.13 酯类
(10种)8 胆甾烷-3,22,26-三醇-16-[2-硫代羟乙基]-3,26-二乙酸酯3,22,26-Triol-cholestan- 16-[2-thiohydroxyethyl]- 3,26-diacetate 2.17 564.39 0.05 9 1,2-丙二醇二甲酸酯1,2-Propanediol diformate 5.04 132.04 0.06 10 苯乙酸乙酯Benzeneacetic acid ethyl ester 18.87 164.08 0.49 11 乙酸苯乙酯Acetic acid 2-phenylethyl ester 19.21 164.08 3.48 12 2-甲基丁酸, 2-苯乙酯 2-Methyl-butanoic acid,2-phenylethyl ester 21.93 206.13 1.52 13 2-苯基乙基丁酸戊酯 Pentyl 2-phenylethyl butylphosphonate 23.12 312.19 0.27 14 二(2-苯乙基)草酸酯 Bis(2-phenylethyl) oxalate 25.55 298.12 0.14 15 邻苯二甲酸戊酯 Pentyl 2-phenylethyl phthalate 25.68 340.17 0.27 16 邻苯二甲酸二甲酯 Dimethyl phthalate 36.06 194.19 0.08 17 邻苯二甲酸二辛酯 Dioctyl phthalate 37.85 390.56 0.13 合计 6.49 醛类
(8种)18 巴豆醛2-Butenal 2.58 70.04 0.07 19 异戊醛3-Methyl-butanal 2.64 86.07 0.10 20 苯甲醛Benzaldehyde 10.20 106.04 0.34 21 苯乙醛Benzeneacetaldehyde 12.82 120.06 0.19 22 壬醛Nonanal 14.71 142.14 0.20 23 4-戊烯醛4-Pentenal 16.71 84.06 0.06 24 3,4-二甲基苯甲醛 3,4-Dimethyl-benzaldehyde 18.19 134.07 0.19 25 甲基乙基腙丙醛 Propanal, (1-methylethyl) hydrazone 31.40 114.12 0.17 合计 1.32 芳香类
(5种)26 2-氨基吡啶 2-Aminopyridine 5.97 94.05 0.07 27 2,5-二甲基吡嗪2,5-Dimethyl-pyrazine 8.55 108.07 0.27 28 3-乙基-2,5-甲基吡嗪 3-Ethyl-2,5-dimethyl-pyrazine 13.79 136.10 0.70 29 环戊基苯Cyclopentyl-benzene 19.67 146.11 0.06 30 2,6-二甲基-4-氨基吡啶 2,6-Dimethyl-4-pyridinamine 20.87 122.08 0.09 合计 1.19 烃类
(4种)31 氯甲氧基甲烷Chloromethoxy-methane 3.35 80.00 0.20 32 二甲基癸烷 Decane,2-methyl 27.36 155.30 0.06 33 1,1-二甲基锗酰氯-3-烯1,1-Dimethyl-germacyclopent-3-ene 17.92 158.02 0.07 34 4-苯基-1-环己烯4-Phenyl-1-cyclohexene 24.35 158.11 0.17 合计 0.50 其他
(7种)35 2,6-二叔丁基苯酚2,6-Di-tert-butylphenol 25.96 206.33 8.77 36 氯甲氧甲基醚 Chloromethoxy-methane 3.35 80.00 0.20 37 3,5-二硝基苯甲酸 3,5-Dinitrobenzoic acid 31.68 212.12 0.07 38 N-(2-甲基双环[2.2.1]庚-2-基)乙酰胺Exo-2-methyl-endo-2-(acetylamino)norbornane 17.18 167.13 0.1 39 (2E)-2-氰基-N-羟基-2-(羟基亚氨基)乙酰胺 (2E)-2-Cyano-N-hydroxy-2-(hydroxyimino)ethanimidamide 17.37 128.03 0.07 40 2,2,3,3,4,4,4-七氟-N-(2-苯基乙基)-丁酰胺2,2,3,3,4,4,4-Heptafluoro-N-(2-phenylethyl)-butanamide 37.22 213.05 0.09 41 6,7,8,9-Tetrahydro-2-amino-4-(2-fluorophenyl)-5H-cyclohepta[b]pyridine-3-carbonitrile 10.67 281.13 0.12 合计 9.42 -
[1] SINGRACGA P, NIAMSIRI N, VISESSANGUAN W, et al. Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J]. LWT-Food Science and Technology,2016,78:181−188.
[2] DAKAL T C, SOLIERI L, GIUDICI P. Adaptive response and tolerance to sugar and salt stress in the food yeast Zygosaccharomyces rouxii[J]. International Journal of Food Microbiology,2014,185:140−157. doi: 10.1016/j.ijfoodmicro.2014.05.015
[3] 潘百玲, 戴凌燕, 刘微, 等. 微生物代谢合成呋喃酮的培养条件和酶学调控研究进展[J]. 黑龙江八一农垦大学学报,2021,33(5):67−73. [PAN B L, DAI L Y, LIU W, et al. Research progress of culture condition and enzyme regulation about microbial metabolism and synthesis of furanone[J]. Journal of Heilongjiang Bayi Agricultural University,2021,33(5):67−73. [4] 周亚男. 鲁氏酵母高密度培养制备及产呋喃酮条件优化研究[D]. 大庆: 黑龙江八一农垦大学, 2018 ZHOU Y N. Optimization of high density culture and preparation of DMHF from Zygosaccharomyces rouxii[D]. Daqing: Heilongjiang Bayi Agricultural University, 2018.
[5] 王鹏霄, 宋焕禄, 陈存社. 微生物发酵法制备4-羟基-2, 5-二甲基-3[2H]-呋喃酮的研究进展[J]. 中国酿造,2009,10:4−6. [WANG X P, SONG H L, CHEN C S. Research progress of producing 4-hydroxy-2, 5-dimethyl-3(2H)-furanone by microbial fermentation[J]. China Brewing,2009,10:4−6. [6] 廉瑞, 刘爽, 李敬尧, 等. 酱油中鲁氏接合酵母的安全性初步评价[J]. 中国酿造,2022,41(1):70−74. [LIAN R, LIU S, LI J R, et al. Preliminary safety evaluation of Zygosaccharomyces rouxii in soy sauce[J]. China Brewing,2022,41(1):70−74. [7] 李梦琦, 赵一凡, 郑飞云, 等. 耐高糖产香酵母菌的分离鉴定及其应用[J]. 食品与发酵工业,2019,45(24):45−51. [LI M Q, ZHAO Y F, ZHENG F Y, et al. Isolation identification and application of sugar-tolerant and aroma-producing yeast[J]. Food and Fermentation Industries,2019,45(24):45−51. [8] 王鹤霖, 范茁艺, 李昕, 等. 鲁氏酵母发酵香肠加工工艺的研究[J]. 肉类工业,2018(5):25−28. [WANG H L, FAN Z Y, LI X, et al. Study on the processing technology of the fermented sausage of Zygosaccharomyces rouxii[J]. Meat Industry,2018(5):25−28. doi: 10.3969/j.issn.1008-5467.2018.05.008 [9] CHENG H, CHEN J, LI X, et al. Differentiation of the volatile profiles of Chinese bayberry cultivars during storage by HS-SPME–GC/MS combined with principal component analysis[J]. Postharvest Biology & Technology,2015,100:59−72.
[10] 战吉宬, 曹梦竹, 游义琳, 等. 非酿酒酵母在葡萄酒酿造中的应用[J]. 中国农业科学,2020,53(19):4057−4069. [ZHAN J S, CAO M Z, YOU Y L, et al. Research advance on the application of non-saccharomyces in winemaking[J]. Scientia Agricultura Sinica,2020,53(19):4057−4069. [11] HECQUETL, SACELME M, BOLTE J, et al. Biosynthesis of 4-Hydroxy-2,5-dimethyl-3(2H)-furanone by Zygosaccharomyces rouxii[J]. Journal of Agricultural Food Chemistry,1996,44:1357−1360. doi: 10.1021/jf950435j
[12] LIU H, DAI L Y, WANG F Y, et al. A new understanding: Gene expression, cell characteristic and antioxidant enzymes of Zygosaccharomyces rouxii under the D-fructose regulation[J]. Enzyme and Microbial Technology,2020,132:109409. doi: 10.1016/j.enzmictec.2019.109409
[13] LI X, DAI L Y, LIU H, et al. Molecular mechanisms of furanone production through the EMP and PP pathways in Zygosaccharomyces rouxii with D-fructose addition[J]. Food Research International,2020,133:109137. doi: 10.1016/j.foodres.2020.109137
[14] 康远军, 李欣, 陈雄, 等. 鲁氏酵母发酵培养基及发酵条件的优化[J]. 中国调味品,2015,40(7):61−65. [KANG Y J, LI X, CHEN X, et al. Optimization of medium components and fermentation conditions of Zygosaccharomyces rouxii[J]. China Condiment,2015,40(7):61−65. doi: 10.3969/j.issn.1000-9973.2015.07.012 [15] FAN G S, LIU P X, CHANG X, et al. Isolation and identification of a high-yield ethyl caproate-producing yeast from daqu and optimization of its fermentation[J]. Frontiers in Microbiology,2021,12(5):663744.
[16] HAUCK T, BRUHLMANN F, SCHWAB W. 4-hydroxy-2,5-dimethyl-3(2H)-furanone formation by Zygosaccharomyces rouxii: effect of the medium[J]. Journal of Agricultural & Food Chemistry,2003,51(16):4753.
[17] 刘朋肖, 常煦, 成柳洁, 等. 酿酒酵母Y3401产己酸乙酯发酵条件的优化[J]. 中国食品学报,2022,22(2):178−189. [LIU P X, CHANG X, CHENG L J, et al. Optimization of fermentation conditions for ethyl caproate production from Saccharomyces cerevisiae Y3401[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(2):178−189. doi: 10.16429/j.1009-7848.2022.02.020 [18] 刘朋肖, 刘玉春, 李晨语, 等. 酿酒酵母Y3401产乙醇条件优化及其产香特性[J]. 中国食品学报,2021,21(4):168−178. [LIU P X, LIU Y C, LI C Y, et al. Optimization of cultural conditions for ethyl alcohol production by Saccharomyces cerevisiae Y3401 and its aroma-producing characteristics[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(4):168−178. [19] LI W Z, SHI C, GUANG J, et al. Development of Chinese chestnut whiskey: Yeast strains isolation, fermentation system optimization, and scale-up fermentation[J]. AMB Express,2021,11:7. doi: 10.1186/s13568-020-01167-4
[20] PUTU V, ROBERT L, HELEN O, et al. Effects of co-inoculation and sequential inoculation of Tetragenococcus halophilus and Zygosaccharomyces rouxii on soy sauce fermentation[J]. Food Chemistry,2018,240:1−8. doi: 10.1016/j.foodchem.2017.07.094
[21] SOMKUWAR R G, SHARMA A K, KAMBALE N, et al. Volatome finger printing of red wines made from grapes grown under tropical conditions of India using thermal-desorption gas chromatography-mass spectrometry (TD-GC/MS)[J]. Journal of Food Science and Technology,2020,57(3):1119−1130. doi: 10.1007/s13197-019-04147-0
[22] 王梦琪, 朱荫, 张悦, 等. “清香”绿茶的挥发性成分及其关键香气成分分析[J]. 食品科学,2019,40(22):219−228. [WANG M Q, ZHU Y, ZHANG Y, et al. Analysis of volatile composition and key aroma compounds of green teas with fresh scent flavor[J]. Food Science,2019,40(22):219−228. doi: 10.7506/spkx1002-6630-20181229-349 [23] 李艳, 康俊杰, 成晓玲, 等. 3种酿酒酵母酿造赤霞珠干红葡萄酒的香气成分分析[J]. 食品科学,2010,31(22):378−382. [LI Y, KANG J J, CHENG X L, et al. Aroma components in cabernet sauvignon dry red wine fermented with three species of yeast strains[J]. Food Science,2010,31(22):378−382. [24] 赵培城, 蔡际豪, 顾赛麒, 等. 不同酒龄传统绍兴黄酒的特征风味物质分析[J]. 食品科学,2020,41(22):231−237. [ZHAO P C, CAI J H, GU S Q, et al. Analysis of characteristic flavor substances of traditional Shaoxing rice wines of different ages[J]. Food Science,2020,41(22):231−237. [25] GAO X, FENG T, SHENG M, et al. Characterization of the aroma-active compounds in black soybean sauce, a distinctive soy sauce[J]. Food Chemistry,2021,298:130334.
[26] BELLEGGIA L, FERROCINO I, REALE A, et al. Unfolding microbiota and volatile organic compounds of Portuguese Painho de Porco Preto fermented sausages[J]. Food Research International,2022,155(5):111063.
[27] LI H, QIN D, WU Z, et al. Characterization of key aroma compounds in Chinese guojing sesame-flavor Baijiu by means of molecular sensory science[J]. Food Chemistry,2019,284(6):100−107.
[28] 李杨, 李明达, 刘军, 等. 酱油酿造过程中风味物质的形成与鉴定[J]. 食品工业科技,2019,40(4):251−256. [LI Y, LI M D, LIU J, et al. Formation and identification of flavor substances during soy sauce brewing[J]. Science and Technology of Food Industry,2019,40(4):251−256. [29] PANG X N, HAN B Z, HUANG X N, et al. Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J]. Scientific Reports,2018,8(1):3396. doi: 10.1038/s41598-018-21814-y
[30] 高熳熳, 张旭普, 白俊岩, 等. 不同发酵工艺糙米酵素中游离氨基酸、γ-氨基丁酸及挥发性香气成分分析[J]. 食品工业科技,2019,40(23):36−41. [GAO M M, ZHANG X P, BAI J Y, et al. Component analysis of free amino acids, GABA and volatile aroma in brown rice enzymes with different fermentation processes[J]. Science and Technology of Food Industry,2019,40(23):36−41. [31] 李永杰, 唐月, 李慧瑶, 等. 基于智能感官和气相色谱-质谱联用技术研究食盐添加量对风干肠风味特征的影响[J]. 食品科学,2022,43(4):1−7. [LIU Y J, TANG Y, LI H Y, et al. Effect of salt content on the flavor profile of air-dried sausages as determined by instrumental sensory technologies and gas chromatography-mass spectrometry[J]. Food Science,2022,43(4):1−7. [32] 刘丹丹, 赵培, 陈金玉, 等. 呼吸式滚揉腌制对中式酱牛肉挥发性物质的影响[J]. 食品与机械,2022,38(2):21−26. [LIU D D, ZHAO P, CHEN J Y, et al. Effects of breathing tumbling on volatile substances of Chinese soy-sauced beef[J]. Food & Machinery,2022,38(2):21−26. [33] WATANABE A, KAMADA G, IMANARI M, et al. Effect of aging on volatile compounds in cooked beef[J]. Meat Science,2015,107(9):12−19.
[34] 王勇勤, 郭新, 黄笠原, 等. 基于电子鼻和气相色谱-质谱联用技术分析不同贮藏时间羊肉火腿香气成分[J]. 食品科学,2019,40(2):215−221. [WANG Y Q, GUO X, HUANG L Y, et al. Analysis of volatile compounds of mutton ham with different storage times based on electronic nose and gas chromatography-mass spectrometry[J]. Food Science,2019,40(2):215−221. [35] 田亚, 王晓宇, 杨欣, 等. 贵州米酸汤发酵过程中风味品质的研究[J]. 中国调味品,2020,45(5):94−99. [TIAN Y, WANG X Y, YANG X, et al. Research on flavor quality of Guizhou rice sour soup during fermentation[J]. China Condiment,2020,45(5):94−99. [36] 闫晓雪, 伍时华, 吴军, 等. 糯米酒的液态发酵工艺优化[J]. 中国酿造,2022,41(3):168−173. [YAN X X, WU S H, WU J, et al. Optimization of liquid-state fermentation technology of glutinous rice wine[J]. China Brewing,2022,41(3):168−173. [37] 张韵, 李蕙蕙, 王菁, 等. 不同烹制工艺对香菇挥发性成分和感官特性的影响[J]. 食品研究与开发,2022,43(6):75−84. [ZHANG Y, LI H H, WANG J, et al. Effects of cooking techniques on volatile components sensory characteristics of shiitake mushroom[J]. Food Research and Development,2022,43(6):75−84.





 下载:
下载:
 下载:
下载:
