Isolation and Identification of the Pathogens of 'East Red' Kiwifruit Soft Rot and Its Control Effect by Melatonin
-
摘要: 为明确‘东红’猕猴桃软腐病病原菌的种类及褪黑素对其的控制效果。以自然发病的‘东红’猕猴桃果实为试材,采用组织分离法对软腐病病原菌进行分离培养。对所分离得到的病原菌根据柯赫氏法则进行致病性检测,依据真菌形态学鉴定和rDNA-ITS序列分析对其进行鉴定,并研究不同浓度(0、100、300和500 μmol/L)褪黑素对分离得到的两株病原菌的控制效果。结果表明,引起‘东红’猕猴桃贮藏期果实软腐病的主要致病菌为间座壳菌(Diaporthe phaseolorum)和葡萄座腔菌(Botryosphaeria dothidea);褪黑素体外抑菌试验表明,其均能显著抑制这两种病原菌菌丝生长(P<0.05)。在培养5 d时,500 μmol/L褪黑素对间座壳菌和葡萄座腔菌的抑制率分别为71.22%和63.34%;同时,褪黑素对损伤接种下软腐病病斑的扩展具有一定的控制效果。在损伤接种5 d时,500 μmol/L褪黑素处理后接种间座壳菌和葡萄座腔菌的果实病斑直径分别仅为对照组的37.40%、45.50%。由此可见,褪黑素对‘东红’猕猴桃软腐病病原菌的控制具有潜在的应用价值。Abstract: To clarify the species of the pathogens of soft rot of 'East Red' kiwifruit and the effect of melatonin on its control, using naturally disease 'East Red' kiwifruit as test material, the pathogenic bacteria of soft rot were isolated and cultured using a tissue isolation method. The pathogenic bacteria isolated were tested for pathogenicity according to Koch's rule, and identified based on fungal morphological identification and rDNA-ITS sequence analysis. The effect of melatonin at different concentrations (0, 100, 300 and 500 μmol/L) on the control of the two pathogenic strains isolated was also investigated. The results showed that Diaporthe phaseolorum and Botryosphaeria dothidea were the main pathogenic bacteria causing soft rot of 'East Red' kiwifruit during storage. The in vitro inhibition test showed that melatonin significantly inhibited the mycelial growth of both pathogens (P<0.05). At 5 d of incubation, the inhibition rates of 500 μmol/L melatonin were 71.22% and 63.34% for Diaporthe phaseolorum and Botryosphaeria dothidea, respectively. At the meanwhile, melatonin was effective in controlling the expansion of soft rot lesions under damage inoculation. At 5 d of damage inoculation, the diameter of fruit spots after the inoculation of Diaporthe phaseolorum and Botryosphaeria dothidea with 500 μmol/L melatonin treatment was only 37.40% and 45.50% of the control group, respectively. It showed that melatonin had potential application value for the control of soft rot pathogens of 'East Red' kiwifruit.
-
Keywords:
- 'East Red' kiwi fruit /
- soft rot /
- isolation and identification /
- melatonin
-
“东红”猕猴桃('East Red' Actinidia chinensis)是由中国科学院武汉植物园选育出的新品种,因其富含丰富维生素C、黄酮等营养物质,深受消费者的喜爱[1-2]。但是‘东红’猕猴桃感染软腐病的情况逐年上升。从目前研究来看,引起猕猴桃软腐病病原菌主要有葡萄座腔菌(Botryosphaeria dothidea)[3]、间座壳菌(Diaporthe phaseolorum)(拟茎点霉菌的有性态)[4]和盘多毛孢菌(Pestalotiopsis microspora)[5]等。研究还发现灰葡萄孢菌(Botrytis cinerea)、层出镰刀菌(Fusarium proliferatum)和链格孢菌(Alternaria sp.)也可引起猕猴桃软腐病[6]。近年来,对于猕猴桃软腐病的防治主要集于化学杀菌剂方面。例如研究表明50%多菌灵可湿性粉剂1000倍液对葡萄座腔菌(Botryosphaeria dothidea)抑制率为91.97%[7];肟菌酯戊唑醇、异菌脲和苯醚甲环唑也能有效抑制葡萄座腔菌(Botryosphaeria dothidea)和拟茎点霉菌(Phomopsis sp.)生长[8]。然而,化学杀菌剂存在化学残留及病原菌耐药问题仍需解决。
褪黑素(Melatonin,MT)是一种内源性具有多种调节功能的生物活性分子,参与果蔬的生长、分化、成熟、衰老和防御等多种生理活动[9-11]。孙子荀等[12]研究发现,0.5 mmol/L褪黑素能够显著抑制链格孢菌菌丝生长,诱导提高草莓抗病性相关基因表达量,从而提高草莓对黑斑病的抗性。曹晶晶等[13]研究结果显示,褪黑素处理有效抑制苹果灰霉病病斑扩展及诱导提高果实过氧化物酶(POD)、过氧化氢酶(CAT)和苯丙氨酸解氨酶(PAL)活性,增强苹果采后抗病能力。此外,褪黑素处理还可提高荔枝[14]、番茄[15]、梨[16]、枣[17]采后抗病性。然而,褪黑素在猕猴桃采后病害的防控研究未见报道。因此,本研究对‘东红’猕猴桃贮藏期软腐病进行分离鉴定,并探究褪黑素对其控制效果,以期为‘东红’猕猴桃软腐病的绿色防控提供理论依据。
1. 材料与方法
1.1 材料与仪器
‘东红’猕猴桃鲜果 于2020年9月在贵州省水城县宏兴绿色农业种植园采摘,猕猴桃果实当天运回贵阳学院果品加工工程技术研究中心实验室,挑选无机械损伤、无病虫害的果实进行后续试验;植物基因组DNA提取试剂盒 北京索莱宝科技有限公司;引物ITS1(5'-TCCGTAGGTGAAC CTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3') 生工生物工程(上海)股份有限公司;褪黑素 上海源叶生物科技有限公司;马铃薯葡萄糖琼脂 上海博微生物科技有限公司;PE20袋 国家农产品保鲜工程技术研究中心(天津)。
ChemiDoc免染型蛋白印迹成像系统 成都百乐科技有限公司;CX21光学显微镜 日本奥林巴斯有限公司;超净工作台 上海苏净实业有限公司;电热恒温培养箱 天津市泰斯特仪器有限公司。
1.2 实验方法
1.2.1 ‘东红’猕猴桃软腐病的分离鉴定
1.2.1.1 病原菌的分离纯化
采用组织块分离法对‘东红’猕猴桃病原菌进行分离[18]。选取发病的‘东红’猕猴桃果实,用75%酒精浸泡消毒、无菌水清洗、无菌纸吸干水分后置于超净工作台中自然晾干。用无菌手术刀取病果病健交界处约4 mm果肉组织放于PDA培养基上,28 ℃恒温培养2~4 d,观察菌丝生长及菌落情况,待菌落形成后用接种环挑取菌落边缘不同形态的菌丝于新的马铃薯葡萄糖琼脂培养基上进行单孢培养,直至获得纯化菌株,并斜面保存于4 ℃冰箱。
1.2.1.2 病原菌的形态观察
将纯化的病原菌接种于PDA培养基上,置于28 ℃恒温培养箱培养7 d,观察并记录菌落的生长情况,利用光学显微镜观察记录菌丝与分生孢子的形态和结构。
1.2.1.3 病原菌致病性试验
选取健康、无病害的猕猴桃果实,利用2%次氯酸钠浸泡消毒1 min、无菌水清洗、75%酒精擦拭消毒,再用无菌水清洗2次后置于超净工作台中自然晾干,备用。将从患病猕猴桃果实分离纯化后的菌株接种于马铃薯葡萄糖琼脂平板中,置于28 ℃恒温培养箱培养5 d,用灭菌的打孔器取菌饼(4 mm)损伤接种于‘东红’猕猴桃果实,每个病原菌接种3个果。损伤接种的‘东红’猕猴桃果实放于灭菌的保鲜盒中并用PE20袋装,25 ℃,85%的条件下恒温培养7 d。定期观察果实发病情况,待果实发病后,从发病果实中分离病原菌进行培养,将损伤接种发病果的病原菌与原菌株进行比较,形态一致则确定为致病菌。
1.2.1.4 病原菌rDNA-ITS序列与系统发育分析
取一定量纯化后培养5~7 d病原菌菌丝,用液氮研磨粉末状后,参照植物基因组DNA提取试剂盒提取病原菌基因组DNA,选用真菌ITS1和ITS4为引物对病原菌进行PCR扩增。扩增程序:94 ℃预变性3 min;94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃终延伸10 min[12]。50 μL反应体系:Taq Master Mix 25 μL、ITS1和ITS4各2 μL、模板DNA 1 μL、ddH2O2 20 μL。PCR产物通过琼脂糖凝胶电泳及成像后,其产物送生工生物工程(上海)股份有限公司进行测序。测序结果在NCBI数据库中进行BLAST比对分析,选择并下载同源性较高的序列,采用MEGA7软件构建病原菌系统发育树[19]。
1.2.2 褪黑素对病原菌的抑制效果
1.2.2.1 褪黑素对病原菌体外抑菌试验
采用菌丝生长速率法[20]测定褪黑素对‘东红’猕猴桃果实贮藏期病原菌体外抑制效果。在前期的预实验中,选用50、100、300、500和700 μmol/L MT进行试验。预实验结果得知,50 μmol/L MT对菌丝及病斑扩展无显著抑制,700 μmol/L MT处理显著抑制菌丝生长,但对果实病斑扩展的控制与500 μmol/L MT处理无显著性。因此,本实验选取100、300和500 μmol/L MT进行试验。分别称取不同质量的褪黑素添加至已灭菌的PDA培养基中,摇匀,使其PDA培养基中褪黑素浓度分别为100、300和500 μmol/L,以不加褪黑素PDA培养基作为对照组;用无菌打孔器从纯化后培养5 d的病原菌菌落边缘打取4 mm菌饼放于培养皿中央,每个病原菌3个平行。28 ℃恒温培养5~7 d,每天采用十字交叉法测量菌落直径,并参照王丹等[21]方法计算抑菌率。
W(%)=A−BA−C×100 式中:W:抑菌率,%;A:对照组菌落直径,mm;B:处理组菌落直径,mm;C:菌饼直径,mm。
1.2.2.2 褪黑素对病原菌活体抑菌试验
选取健康的猕猴桃果实,用75%酒精浸泡30 s,后用无菌水清洗3次,置于超净工作台中自然晾干。用无菌铁钉在果实赤道处打1个孔(深2 mm,直径4 mm),1 h后在每个果实伤口处分别注射20 μL的0(无菌水,对照组)、100、300和500 μmol/L褪黑素溶液,6 h后取纯化后培养5 d的菌落边缘的菌饼(4 mm)接种于果实伤口处,每个处理组6个果。接种后的果实放于灭菌的保鲜盒中并用PE20袋包装,20 ℃,90%的条件下培养5 d,每天观察果实发病情况并测量果实病斑直径。
1.3 数据处理
实验基础数据采用Excel 2016软件进行统计分析,每个处理重复3次,采用SPSS19.0软件的Duncan法对数据进行差异显著性分析(P<0.05表示显著性差异),采用Origin 2018对数据进行作图。
2. 结果与分析
2.1 ‘东红’猕猴桃软腐病菌分离鉴定
2.1.1 病原菌形态学鉴定
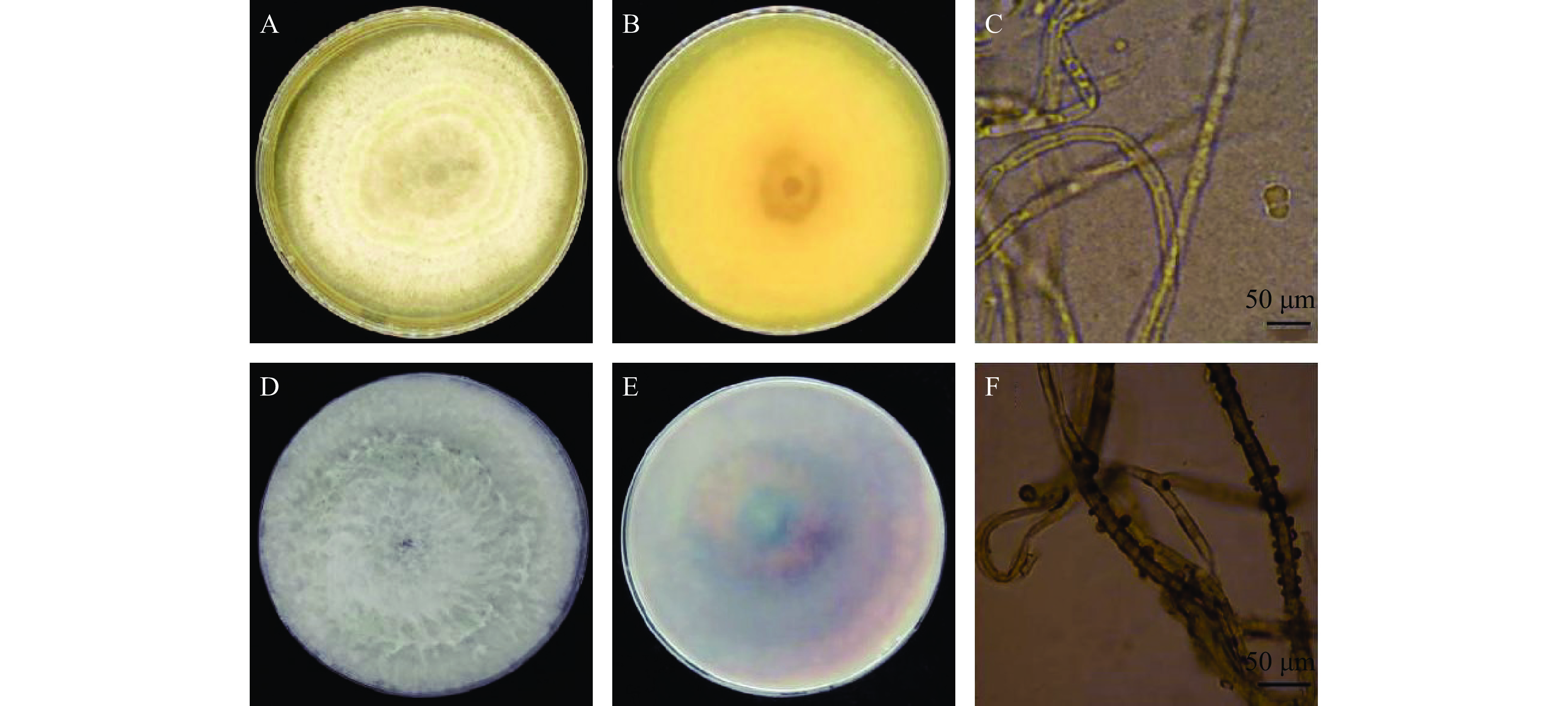
将贮藏期感染软腐病的‘东红’猕猴桃果实进行组织分离、单孢培养后获得2株病原菌(见图1)。第1株菌丝初期白色茸毛状,后期呈灰白色(图1A),基质初期米黄色后为棕色(图1B);显微镜下菌丝白色,有隔膜和分枝,培养10 d后产生圆形或椭圆形分生孢子,无色透明,有隔膜(图1C)。其初步鉴定为间座壳属(Diaporthe sp)。第2株菌丝稠密,初期为白色棉絮状,后期变为黑色或灰黑色(图1D),基质初为暗灰色后变为褐色或黑色(图1F);显微镜下菌丝有隔膜、较多分枝,菌落生长14 d后产生不成熟的孢子,椭圆形或球形(图1E);根据其培养特性及形态特征初步鉴定为葡萄座腔菌(Botryosphaeria dothidea)。
2.1.2 病原菌的致病性
将纯化的2株病原菌回接到健康的‘东红’猕猴桃果实上,25 ℃、85% RH恒温培养5~7 d。损伤接种5 d后,菌株DH1、DH2(见图2A~图2B)损伤接种部位液体渗出,果面出现明显的软腐病病斑,呈圆形或椭圆形,病斑处果皮呈现暗黄色,果肉软化,横切果实可见病斑扩展至果心,果肉穿孔性腐烂并产生臭味,失去食用价值;而CK组(对照)均无发病症状。将接种7 d后发病果实再次进行组织分离培养,并将其与回接前菌株形态特征和培养性状进行比对,其结果一致则确定为致病菌。
2.1.3 病原菌分子生物学鉴定
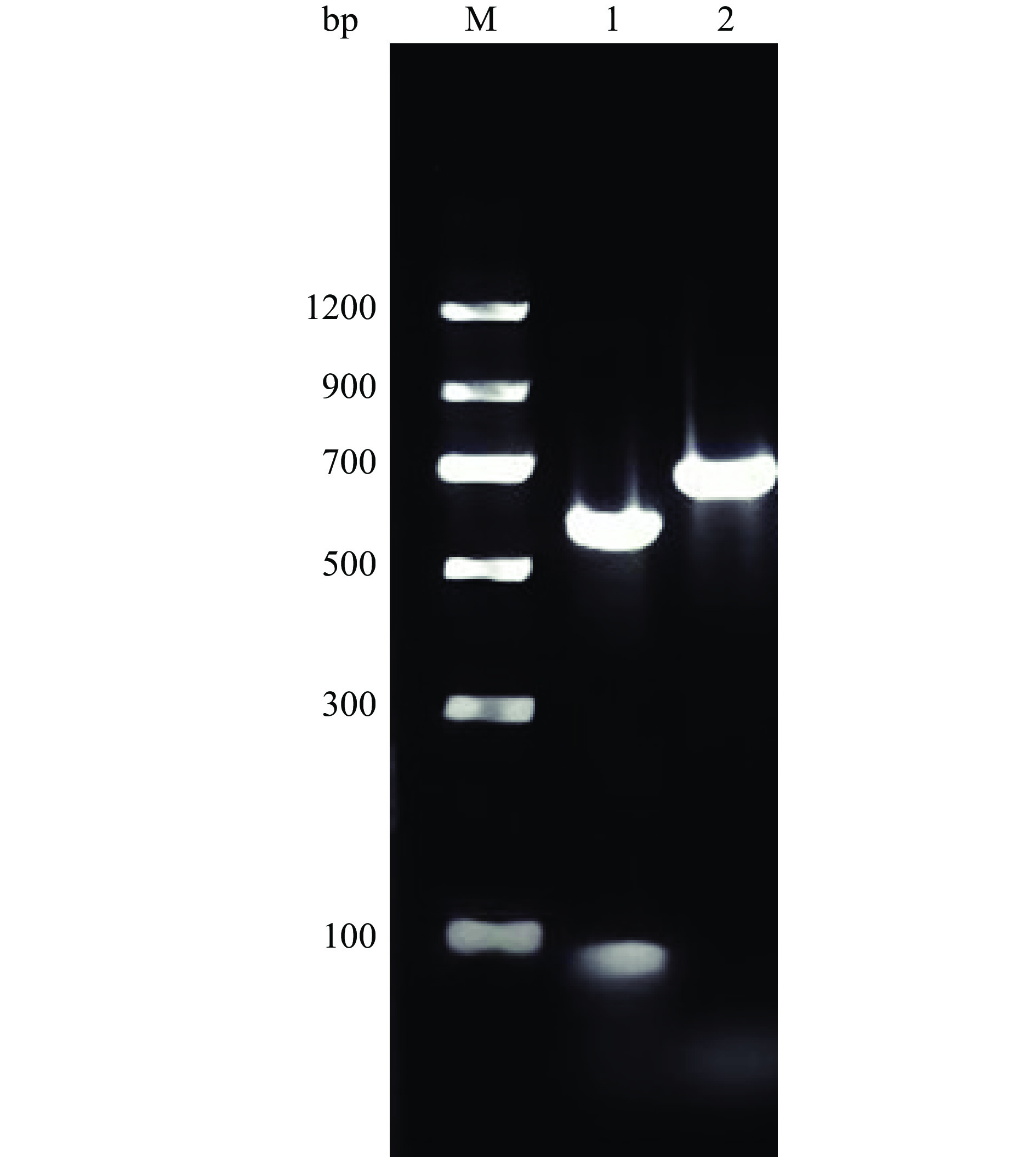
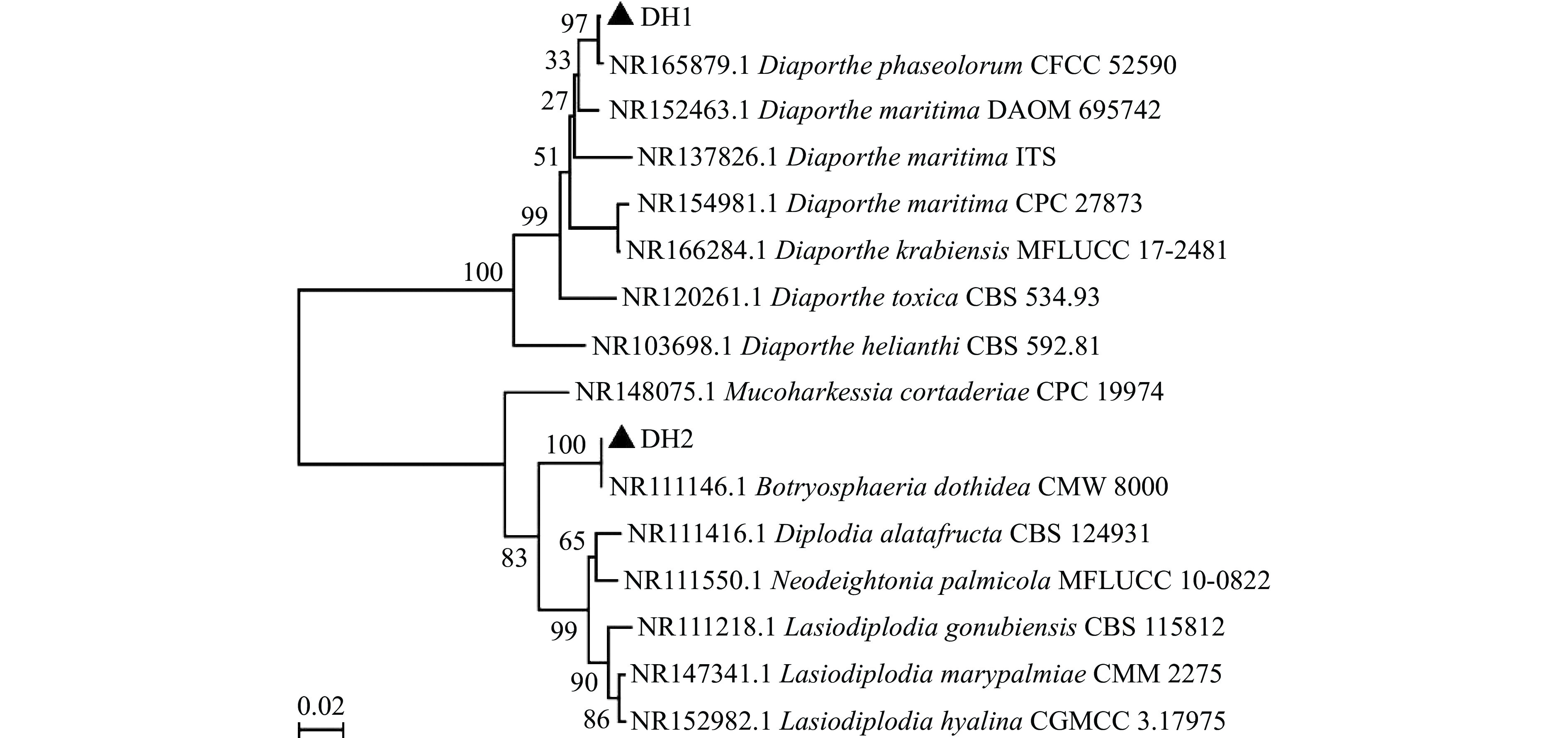
以分离得到的2株病原菌的DNA为模板、ITS1和ITS4为引物进行PCR扩增,PCR产物通过琼脂糖凝胶电泳检测得到500~700 bp片段(图3)。将2株病原菌rDNA-ITS序列提交到GenBank数据库中进行BLAST 同源性比对,搜索并下载同源性较高的序列,采用MEGA 7软件构建病原菌系统发育树(图4);由系统发育树分析结果发现,DH1、DH2菌株分别与Diaporthe phaseolorum(NR165879.1)、Botryosphaeria dothidea(NR111146.1)处于同一分支,同源性较高,并且相似度高达97%、100%;并结合其培养性状和形态学鉴定结果,确定‘东红’猕猴桃软腐病病原菌为间座壳菌(Diaporthe phaseolorum)、葡萄座腔菌(Botryosphaeria dothidea)。
2.2 褪黑素对病原菌的抑制效果
2.2.1 褪黑素对病原菌体外抑制效果
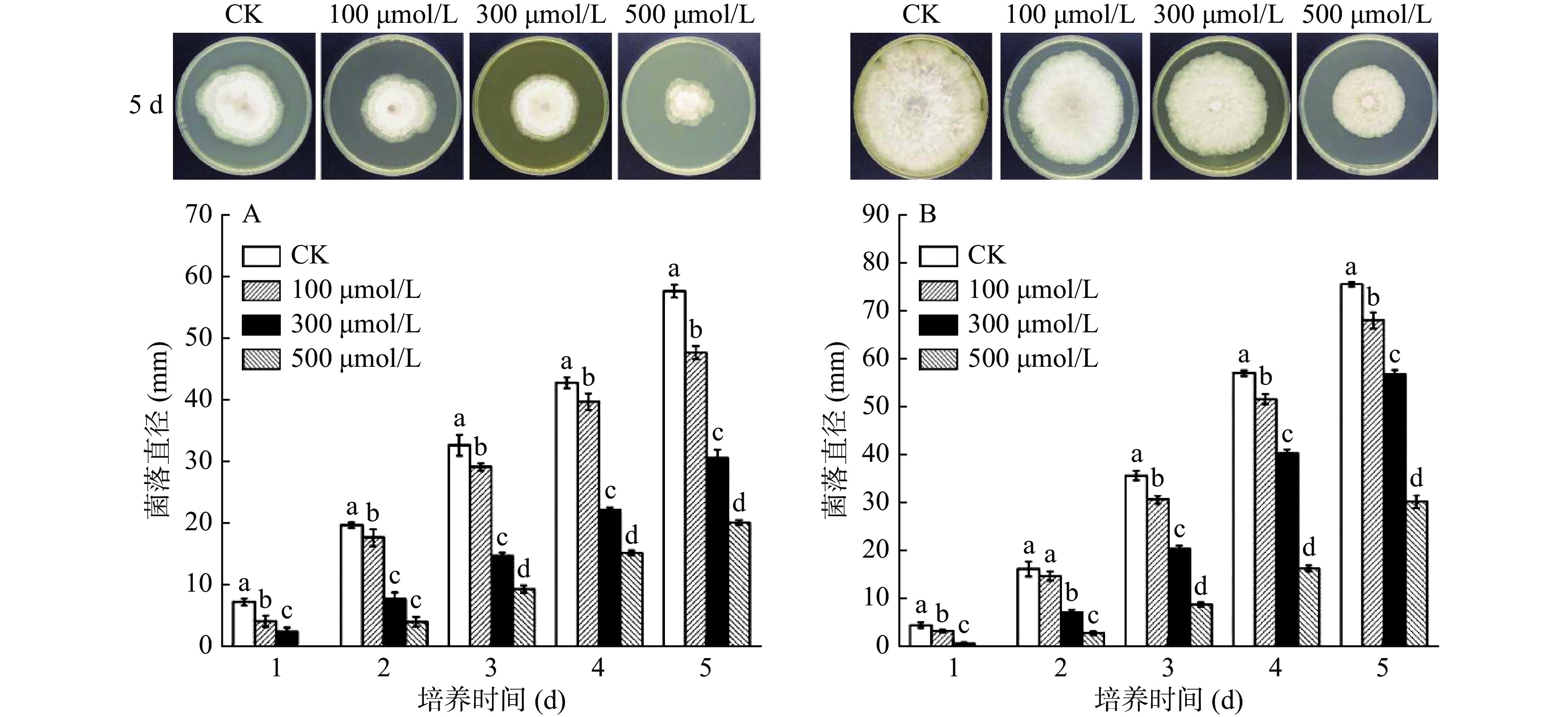
由图5可知,两种病原菌的菌落直径随着培养时间的延长而增加,但褪黑素对间座壳菌(图5A)、葡萄座腔菌(图5B)菌丝有一定的抑制作用,并且2株病原菌对褪黑素的敏感性不同。在培养3 d后,不同浓度褪黑素均能显著地抑制2株病原菌生长(P<0.05),其中,500 μmol/L抑制效果最好。由表1可知,在培养5 d时,500 μmol/L褪黑素对间座壳菌、葡萄座腔菌的抑制率分别为71.22%和63.34%。
![]() 图 5 褪黑素对间座壳菌(A)和葡萄座腔菌(B)菌落生长的影响注:不同字母表示同一时间下组间具有显著性差异(P<0.05);图6同。Figure 5. Effect of melatonin on colony growth of Diaporthe phaseolorum (A) and Botryosphaeria dothidea (B)表 1 褪黑素对间座壳菌和葡萄座腔菌的抑菌率Table 1. Antibacterial rate of melatonin on Diaporthe phaseolorum and Botryosphaeria dothidea
图 5 褪黑素对间座壳菌(A)和葡萄座腔菌(B)菌落生长的影响注:不同字母表示同一时间下组间具有显著性差异(P<0.05);图6同。Figure 5. Effect of melatonin on colony growth of Diaporthe phaseolorum (A) and Botryosphaeria dothidea (B)表 1 褪黑素对间座壳菌和葡萄座腔菌的抑菌率Table 1. Antibacterial rate of melatonin on Diaporthe phaseolorum and Botryosphaeria dothidea
时间(d)
浓度
(μmol/L)抑菌率(%) 间座壳菌
Diaporthe phaseolorum葡萄座腔菌
Botryosphaeria dothidea
1100 43.96±0.94a 28.29±0.30a 300 88.35±0.72b 79.13±0.69b 500 100.00±0.00c 100.00±0.00c
2100 12.87±1.36a 12.36±1.00a 300 79.56±1.05b 70.35±0.58b 500 86.50±0.79b 83.79±0.37c
3100 10.76±0.61a 15.87±0.83a 300 55.08±0.50b 44.85±0.59b 500 81.79±0.61c 80.45±0.45c
4100 7.17±0.03a 10.21±0.08a 300 48.34±0.43b 28.76±0.74b 500 77.49±0.40c 76.79±0.59c
5100 17.37±1.07a 10.51±0.13a 300 47.13±1.39b 26.16±0.79b 500 71.22±0.41c 63.34±1.29c 注:不同字母表示同一时间不同浓度下具有显著性差异,P<0.05。 2.2.2 褪黑素对病原菌的体内抑制效果
由图6可知,褪黑素处理对‘东红’猕猴桃软腐病病斑的扩展具体一定的控制效果,在接种贮藏1 d时果实开始出现病症,其中,500 μmol/L褪黑素完全抑制2株病原菌病斑的扩展。在3 d时,接种间座壳菌CK组果实病斑直径显著大于100、300和500 μmol/L褪黑素处理(P<0.05),其病斑直径为18.52 mm,分别是褪黑素处理组的1.74、2.90和4.04倍;而接种葡萄座腔菌CK组果实病斑直径为20.84 mm,分别是褪黑素处理组的1.67、1.93和2.89倍。在接种贮藏5 d时,500 μmol/L褪黑素处理的病斑直径分别仅为对照组的37.40%和45.50%。
猕猴桃软腐病也称熟腐病,在花期形成幼果时侵染于幼果中并长期潜伏在果实组织内,在果实贮藏和销售过程中爆发,果实发病初期果肉局部软化,果面出现病斑且渗出组织液,病斑内部果肉呈现乳白色,果实发病后期病斑大面积扩展,果肉腐烂并产生臭味,果实失去商品价值[22-23]。石浩等[22]研究发现引起‘红阳’猕猴桃软腐病病原菌为葡萄座腔菌(Botryosphaeria dothidea)和间座壳菌(Diaporthe phaseolorum)。葡萄座腔菌不仅能使猕猴桃果实致腐,在叶片上产生大量的分生孢子致叶片产生斑点,同时还能侵染黄桃[24]、柑橘[25]等果实致腐。而间座壳菌是一种导致多种果蔬致病的病原性真菌,能引起柑橘黑点病和葡萄柚蒂腐病的发生[26]。本研究发现,引起‘东红’猕猴桃采后软腐病的致病菌为葡萄座腔菌(Botryosphaeria dothidea)和间座壳菌(Diaporthe phaseolorum),并在果实体内研究发现,果实在发病初期,果实局部果肉变软,果面周围出现病斑,发病后期果实发病部位组织液流出,产生异味(图6),此结果与前人研究的结果一致。吴文能等[8]报道‘贵长’猕猴桃软腐病主要病原菌为葡萄座腔菌(Botryosphaeria sp.)、拟茎点霉菌(Phomopsis sp.)和链格孢菌(Alternaria alternata),其中链格孢菌检出率较低 。雷霁卿等[27]发现‘红阳’猕猴桃软腐病主要致病菌为葡萄座腔菌(Botryosphaeria sp.)、拟茎点霉菌(Phomopsts sp.)、交链孢菌(Alternaria sp.)、小新壳梭孢菌(Neofusicoccum sp.)和间座壳菌(Diaporthe sp.),并发现间座壳菌的检出率和致病力较弱。王小洁等[7]研究结果显示,引起‘海沃德’猕猴桃采后软腐病的主要致病菌为葡萄座腔菌(Botryosphaeria dothidea)。以上研究表明,引起猕猴桃软腐病的病原菌种类较多,且致病力及发病规律比较复杂。
果实在采后贮藏期间遭受生物或非生物胁迫时,植物体内自发一系列防御反应[28]。Li等[29]研究表明,MT处理诱导提高番茄果实中苯丙烷代谢相关酶活性,促进果实中总酚、类黄酮和木质素含量的积累,增强番茄果实对灰霉(Botrytis cinerea)的抵抗力;Zhang等[30]研究发现,MT处理降低了枣果相对电解渗漏率、过氧化氢含量和超氧阴离子产生速率,维持了抗坏血酸和还原型谷胱甘肽含量,从而增强枣果链格孢菌(Alternaria alternata)对的抗性;以上研究说明MT对病原菌不具有体外抑菌活性,但MT可以通过诱导果实采后果实苯丙烷代谢产物合成及提升果实病程相关蛋白活性,维持果实ROS代谢平衡,从而提高果实采后抗病能力。然而,研究还发现,褪黑素能够显著抑制草莓链格孢菌(Alternaria alternata)[12]、大枣青霉(Penicillium polonicum)[31]和荔枝霜疫霉(Peronophythora litchii)[32]菌丝生长。说明褪黑素对病原菌菌丝的抑菌活性其可能与褪黑素的浓度、病原菌的敏感性和种属有关。本研究发现,褪黑素对葡萄座腔菌和间座壳菌菌丝生长具有一定的抑制作用(图5),并能有效控制软腐病病斑的扩展(图6)。然而,对于‘东红’猕猴桃软腐病的发病规律、致病力以及褪黑素对其的抑制机理还需进一步研究。
3. 结论
本研究鉴定出引起‘东红’猕猴桃贮藏期软腐病的病原菌为葡萄座腔菌(Botryosphaeria dothidea)和间座壳菌(Diaporthe phaseolorum),并探究不同浓度(100、300和500 μmol/L)褪黑素对其控制效果。结果表明,褪黑素体对两株病原菌具有一定抑制作用,并能有效控制果实病斑的扩展,其中500 μmol/L褪黑素控制效果最佳。因此,褪黑素可作为‘东红’猕猴桃采后保鲜的一种有效策略。
-
图 5 褪黑素对间座壳菌(A)和葡萄座腔菌(B)菌落生长的影响
注:不同字母表示同一时间下组间具有显著性差异(P<0.05);图6同。
Figure 5. Effect of melatonin on colony growth of Diaporthe phaseolorum (A) and Botryosphaeria dothidea (B)
表 1 褪黑素对间座壳菌和葡萄座腔菌的抑菌率
Table 1 Antibacterial rate of melatonin on Diaporthe phaseolorum and Botryosphaeria dothidea
时间(d)
浓度
(μmol/L)抑菌率(%) 间座壳菌
Diaporthe phaseolorum葡萄座腔菌
Botryosphaeria dothidea
1100 43.96±0.94a 28.29±0.30a 300 88.35±0.72b 79.13±0.69b 500 100.00±0.00c 100.00±0.00c
2100 12.87±1.36a 12.36±1.00a 300 79.56±1.05b 70.35±0.58b 500 86.50±0.79b 83.79±0.37c
3100 10.76±0.61a 15.87±0.83a 300 55.08±0.50b 44.85±0.59b 500 81.79±0.61c 80.45±0.45c
4100 7.17±0.03a 10.21±0.08a 300 48.34±0.43b 28.76±0.74b 500 77.49±0.40c 76.79±0.59c
5100 17.37±1.07a 10.51±0.13a 300 47.13±1.39b 26.16±0.79b 500 71.22±0.41c 63.34±1.29c 注:不同字母表示同一时间不同浓度下具有显著性差异,P<0.05。 -
[1] 黄文俊, 刘小莉, 张琦, 等. 黄肉红心猕猴桃‘东红’果实在不同贮藏方式下的生理和品质变化研究[J]. 植物科学学报,2019,37(3):382−388. [HUANG W J, LIU X L, ZHANG Q, et al. Physiological and quality changes of yellow flesh red heart kiwifruit 'Donghong' under different storage methods[J]. Journal of Plant Science,2019,37(3):382−388. [2] HU H, L P, WANG Y, et al. Hydrogen-rich water delays postharvest ripening and senescence of kiwifruit[J]. Food Chem,2014,156:100−109. doi: 10.1016/j.foodchem.2014.01.067
[3] ZHOU Y, GONG G S, CUI Y L, et al. Identification of botryosphaeriaceae species causing kiwifruit rot in Sichuan Province, China[J]. Plant Disease,2015,99(5):699−708. doi: 10.1094/PDIS-07-14-0727-RE
[4] THOMIDIS T, EXADAKTYLOU E, CHEN S F. Diaporthe neotheicola, a new threat for kiwifruit in Greece[J]. Crop Protection,2013,47(5):35−40.
[5] LI L, PAN H, CHEN M Y, et al. First report of Pestalotiopsis microspore causing postharvest rot of kiwifruit in Hubei Province, China[J]. Plant Disease,2016,100(10):21−61.
[6] 左盼盼, 付苏, 彭丽桃, 等. 猕猴桃采后软腐病病原菌鉴定及香芹酚对其控制效果[J]. 华中农业大学学报,2020,39(6):15−22. [ZUO P P, FU F, PENG L T, et al. Identification of pathogen of postharvest soft rot of kiwifruit and control effect of carvacrol[J]. Journal of Huazhong Agricultural University,2020,39(6):15−22. [7] 王小洁, 李士谣, 李亚巍, 等. 猕猴桃软腐病病原菌的分离鉴定及其防治药剂筛选[J]. 植物保护学报,2017,44(5):826−832. [WANG X J, LI S Y, LI Y W, et al. Isolation and identification of pathogen of kiwifruit soft rot and screening of its control agents[J]. Journal of Plant Protection,2017,44(5):826−832. [8] 吴文能, 张起, 雷霁卿, 等. “贵长”猕猴桃软腐病病原菌分离鉴定及抑菌药剂筛选[J]. 北方园艺,2018(16):47−54. [WU W N, ZHANG Q, LEI J Q, et al. Isolation and identification of pathogen of "Guichang" kiwifruit soft rot and screening of antimicrobial agents[J]. Northern Horticulture,2018(16):47−54. [9] REITER R J, TAN D X, ZHOU Z. Phytomelatonin: assisting plants to survive and thrive[J]. Molecules,2015,20(4):7396−7437. doi: 10.3390/molecules20047396
[10] GAO H, LU Z M, YANG Y, et al. Melatonin treatment reduces chilling injury in peach fruit through its regulation of membrane fatty acid contents and phenolic metabolism[J]. Food Chemistry,2018,245:87−93.
[11] WANG F, ZHANG X P, YANG Q Z, et al. Exogenous melatonin delays postharvest fruit senescence and maintains the quality of sweet cherries[J]. Food Chemistry,2019,301:1−10.
[12] 孙子荀, 倪照君, 高志红, 等. 外源褪黑素提高草莓黑斑病抗性的效果和作用机制初探[J]. 西北植物学报,2020,40(10):1679−1687. [SUN Z X, NI Z J, GAO Z H, et al. Preliminary study on the effect and mechanism of exogenous melatonin on increasing strawberry black spot disease resistance[J]. Northwest Botanical Journal,2020,40(10):1679−1687. doi: 10.7606/j.issn.1000-4025.2020.10.1679 [13] 曹晶晶, 于子超, 张颖, 等. 外源褪黑素对苹果采后灰霉病的防效及防御酶活性的影响[J]. 植物生理学报,2017,53(9):1753−1760. [CAO J J, YU Z C, ZHANG Y, et al. The effect of exogenous melatonin on the control effect of postharvest apple gray mold and the activity of defensive enzymes[J]. Acta Plant Physiology,2017,53(9):1753−1760. [14] ZHANG Z K, WANG T, LIU G S. Inhibition of downy blight and enhancement of resistance in litchi fruit by postharvest application of melatonin[J]. Food Chemistry,2021,347:2−8.
[15] 生吉萍, 赵瑞瑞, 陈玲玲, 等. 褪黑素采前喷施对采后番茄果实抗病性和贮藏品质的影响[J]. 食品科学,2020,41(9):188−193. [SHENG J P, ZHAO R R, CHEN L L, et al. Effect of spraying melatonin before harvest on disease resistance and storage quality of tomato fruits after harvest[J]. Food Science,2020,41(9):188−193. [16] 向妙莲, 吴帆, 李树成, 等. 褪黑素处理对梨果实采后黑斑病及贮藏品质的影响[J]. 中国农业科学,2022,55(4):785−795. [XIANG M L, WU F, LI S C, et al. Effects of melatonin treatment on postharvest black spot and storage quality of pear fruit[J]. Chinese Agricultural Science,2022,55(4):785−795. doi: 10.3864/j.issn.0578-1752.2022.04.013 [17] 唐琦. 采后褪黑素处理对大枣青霉病和贮藏品质的影响[D]. 锦州: 渤海大学, 2019 TANG Q. Effects of postharvest melatonin treatment on penicilliosis and storage quality of jujube [D]. Jinzhou: Bohai University, 2019.
[18] 王荣波, 陈姝樽, 李本金, 等. 福建省彩叶草叶斑病病原菌的分离鉴定与室内药剂筛选[J]. 福建农业学报,2021,36(12):1471−1477. [WANG R B, CHEN S Z, LI B J, et al. Isolation and identification of pathogen of leaf spot of color leafgrass in Fujian Province and screening of indoor fungicides[J]. Fujian Agricultural Journal,2021,36(12):1471−1477. [19] SUDHIR K, GLEN S, KOICHIRO T. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Molecular Biology & Evolution,2016,33(7):1870.
[20] EDWARDS S G, SEDDON B. Mode of antagonism of Brevibacillus brevis against Botrytis cinerea in vitro[J]. Journal of Applied Microbiology,2010,91(4):652−659.
[21] 王丹, 张静, 贾晓曼, 等. 蓝莓采后主要病原菌的分离鉴定及肉桂精油抑菌效果[J]. 食品科学,2019,40(24):167−172. [WANG D, ZHANG J, JIA Z M, et al. Isolation and identification of main postharvest pathogens of blueberry and antibacterial effect of cinnamon essential oil[J]. Food Science,2019,40(24):167−172. doi: 10.7506/spkx1002-6630-20181029-338 [22] 石浩, 王仁才, 王芳芳, 等. 猕猴桃软腐病主要病原菌的分离、鉴定及其生长特性研究[J]. 核农学报,2020,34(11):2425−2434. [SHI H, WANG R C, WANG F F, et al. Isolation, identification and growth characteristics of main pathogens of kiwifruit soft rot[J]. Journal of Nuclear Agriculture,2020,34(11):2425−2434. doi: 10.11869/j.issn.100-8551.2020.11.2425 [23] 李爱华, 郭小成. 秦美猕猴桃软腐病的发生规律与防治初探[J]. 陕西农业科学,1994(3):44. [LI A H, GUO X C. Occurrence and control of soft rot of kiwifruit in Qinmei[J]. Shaanxi Agricultural Science,1994(3):44. [24] 虞凡霜, 强遥, 秦双林, 等. 一株侵染黄桃果实的葡萄座腔菌菌株鉴定[J]. 江西农业大学学报,2021,43(3):566−573. [YU F S, QIANG Y, QING S L, et al. Identification of a strain of Botryosphaeria dothidea infecting yellow peach fruit[J]. Acta Agriculturae Universitatis Jiangxiensis,2021,43(3):566−573. doi: 10.13836/j.jjau.2021063 [25] 朱琪丽, 赵会长, 谢甲涛, 等. 葡萄座腔菌侵染柑橘果实的报道[J]. 植物病理学报,2018,48(2):154−158. [ZHU Q L, ZHAO H C, XIE J T, et al. A report on the infection of citrus fruit by Botryosphaeria dothidea[J]. Journal of Plant Pathology,2018,48(2):154−158. doi: 10.13926/j.cnki.apps.000126 [26] 熊桃. 柑橘间座壳菌的群体遗传结构和有性生殖研究[D]. 杭州: 浙江大学, 2021 XIONG T. Study on population genetic structure and sexual reproduction of citrus Diaporthe phaseolorum[D]. Hangzhou: Zhejiang University, 2021.
[27] 雷霁卿, 吴文能, 刘颖, 等. 贵州六盘水地区“红阳”猕猴桃软腐病病原菌分离鉴定及致病力差异测定[J]. 北方园艺,2019(4):31−38. [LEI J Q, WU W N, LIU Y, et al. Isolation and identification of the pathogen of “Hongyang” kiwifruit soft rot in Liupanshui area of guizhou and determination of pathogenicity difference[J]. Northern Horticulture,2019(4):31−38. [28] HE J G, CHENG Y D, GUAN J F, et al. Changes of chlorogenic acid content and its synthesis-associated genes expression in Xuehua pear fruit during development[J]. Journal of Integrative Agriculture,2017,16(2):471−477. doi: 10.1016/S2095-3119(16)61496-X
[29] LI S G, XU Y H, YANG B, et al. Melatonin treatment inhibits gray mold and induces disease resistance in cherry tomato fruit during postharvest[J]. Postharvest Biology and Technology,2019,157(C):110962.
[30] ZHANG L L, YU Y W, CHANG L L, et al. Melatonin enhanced the disease resistance by regulating reactive oxygen species metabolism in postharvest jujube fruit[J]. Journal of Food Processing and Preservation,2022,182:111706.
[31] 唐琦. 采后褪黑素处理对大枣青霉病和贮藏品质的影响[D]. 锦州: 渤海大学, 2019 TANG Q. Effects of melatonin treatment on penicilliosis and storage quality of jujube[D]. Jinzhou: Bohai Universityy, 2019.
[32] 王甜. 外源褪黑素对荔枝采后褐变和病害的控制作用[D]. 海口: 海南大学, 2020 WANG T. Control effect of exogenous melatonin on postharvest browning and disease of litchi[D]. Haikou: Hainan University, 2020.






 下载:
下载:


 下载:
下载:
