Research Progress of the Antibacterial Active Substances from Honey and Their Antibacterial Mechanisms
-
摘要: 蜂蜜是由工蜂采集的花蜜及其自身分泌物混合而成的一种天然甜味物质,具有良好的抗菌活性,含有多种天然抗菌活性物质。近年来,已有大量研究报道了蜂蜜中抗菌活性物质的研究进展,包括甲基乙二醛、过氧化氢、多酚、抗菌肽和王浆主蛋白等。大量研究表明,过氧化氢是蜂蜜中最重要的抗菌活性物质之一。本文着重综述了各抗菌有效活性物质在蜂蜜抑菌过程中所发挥的重要作用,进一步以蜂蜜中的过氧化氢为例,总结了葡萄糖氧化酶催化葡萄糖生成过氧化氢的过程,并对产生和降解过氧化氢的其他途径以及影响过氧化氢产生的理化因素进行了综述。合理调控蜂蜜中过氧化氢的产生,对蜂蜜抑菌乃至其他生物活性发挥起着重要的作用。本综述也为蜂蜜的临床安全用药及相关功能食品研发提供参考依据。Abstract: Honey is a natural sweet substance made from a mixture of nectar collected by worker bees and their own secretions, which has good antibacterial activity and contains a variety of natural antibacterial active substances. In recent years, a large number of studies have been reported on the progress of antimicrobial active substances in honey, including methylglyoxal, hydrogen peroxide, polyphenols, antimicrobial peptides and Major royal jelly proteins. Numerous studies have shown that hydrogen peroxide is one of the most important antibacterial substances in honey. This paper highlights the important roles by each antimicrobial effective active substance for the anti-bacterial by honey. It also further summarizes the process of glucose oxidase catalyzing the production of hydrogen peroxide from glucose. The process of glucose oxidase catalyzing the production of hydrogen peroxide from glucose is summarized using hydrogen peroxide in honey as an example. Other pathways for the production and degradation of hydrogen peroxide and the physicochemical factors affecting the production of hydrogen peroxide are also reviewed. Rational regulation of hydrogen peroxide production in honey plays an important role in its antibacterial and even other biological activities. This review would also provide a reference for the safe clinical use of honey and the development of functional foods.
-
Keywords:
- honey /
- antibacterial activity /
- glucose oxidase /
- hydrogen peroxide /
- colloidal structure
-
蜂蜜是重要的药食同源的天然产物,有着悠久的使用历史。在食品领域,古人曾用蜂蜜腌制肉类,不仅能防腐变质且风味独特,至今市场上仍存在形形色色的天然蜂蜜和蜂蜜制品[1]。蜂蜜可用于创伤和烧伤等外伤的愈合剂,既能起到抑菌杀菌的作用,又能促进创面的愈合[2],同时能缓解疼痛且价廉易得[3-4]。目前,蜂蜜能够辅助治疗外伤和消化道系统等疾病,在食品和医药应用领域具有巨大的潜力[5]。
近年来,由于抗生素的广泛使用甚至滥用,病原微生物已经出现多重耐药的现象,这对人类健康构成重大威胁[6]。因此,天然抗菌药物的研究与开发对抑制病原微生物的感染与传播意义重大。蜂蜜作为一种天然抗菌剂,含有多种抗菌活性物质,如甲基乙二醛、过氧化氢、多酚、抗菌肽和王浆主蛋白等[7-8]。研究表明,过氧化氢的产生是蜂蜜发挥抑菌和杀菌活性的主要机制,过氧化氢含量与蜂蜜的最低抑菌浓度(Minimum inhibitory concentration,MIC)和最低杀菌浓度(Minimum bactericidal concentration,MBC)紧密相关[9]。在蜂蜜的稀释过程中,葡萄糖氧化酶(Glucose oxidase,GOx)被激活,将葡萄糖氧化成葡萄糖酸,并将氧气还原成过氧化氢。1941年,德国科学家Gauhe首次提出葡萄糖氧化酶在工蜂咽下腺合成。就蜜蜂而言,由于蜂种、发育阶段、分工以及饮食不同,其咽下腺的葡萄糖氧化酶水平有所差异[10],因而不同蜂蜜中所含过氧化氢浓度不同,抗菌活性亦有所区别。一般而言,蜂蜜产生的过氧化氢仅为通用杀菌剂(如3%双氧水)浓度的千分之一,这一低浓度的过氧化氢既能有效杀死细菌,又不损害正常细胞[11],使得蜂蜜可作为良好的创伤敷料加以应用[12]。蜂蜜中过氧化氢释放的氧原子可与致病菌所含酶蛋白的巯基(-SH)相结合,由此改变了酶的结构,进而使酶失活,使细菌的生长代谢受到抑制,从而达到抑菌杀菌的效果[13]。研究发现,当蜂蜜用过氧化氢酶处理后,其抗菌活性大大降低,从而确定过氧化氢是蜂蜜中最重要的抗菌活性物质。因此,过氧化氢的产生和降解途径对蜂蜜的抗菌活性具有重要意义。
本文综述了蜂蜜中主要抗菌活性物质的研究进展,并重点围绕蜂蜜中过氧化氢以及葡萄糖氧化酶产生过氧化氢的过程进行了归纳总结,阐明了蜂蜜中影响葡萄糖氧化酶活性的物理或化学因素、过氧化氢合成(除了蜜蜂来源的葡萄糖氧化酶)和分解(除了植物来源的过氧化氢酶)的其他途径,同时,围绕蜂蜜胶体结构和过氧化氢产生之间的因果关系,以加深我们对过氧化氢产生和分解途径的理解,同时为蜂蜜抗菌活性的应用研究提供理论依据。
1. 蜂蜜中的抗菌活性物质
近年来的研究表明,蜂蜜中含有多种天然抗菌活性成分,如甲基乙二醛、过氧化氢、多酚、抗菌肽及王浆主蛋白等[14],这些活性成分均赋予蜂蜜具有广谱的抗菌作用,为研发新的抗菌药物提供了一种途径。下文将详细阐述蜂蜜中主要抗菌活性物质的相关研究进展。
1.1 甲基乙二醛
甲基乙二醛(Methylglyoxal,MGO)普遍存在于所有的蜂蜜中,然而,其含量在麦卢卡蜂蜜中最高,约为普通蜂蜜的100倍,视为麦卢卡蜂蜜最重要的抗菌物质基础[15],因此麦卢卡蜂蜜具有更强的抗菌效果。MGO是由麦卢卡花蜜中的二羟基丙酮(Dihydroxyacetone, DHA)转化而来,这一过程不需要酶的参与。据报道,麦卢卡花蜜中只能检测到DHA,随着蜂蜜成熟度的增加,新鲜蜂蜜中高含量的DHA将慢慢转化成MGO,DHA的含量逐渐降低,而MGO的含量缓慢上升[16]。研究表明,不同类型和不同地区的麦卢卡蜂蜜其抗菌特性有所差异,对革兰氏阳性菌和革兰氏阴性菌具有广谱的抗菌作用,但对革兰氏阳性菌的抑制效果更好,同时,麦卢卡蜂蜜在非过氧化物抗菌活性上居于首位[17]。总而言之,甲基乙二醛是麦卢卡蜂蜜中特有的重要抗菌活性物质。
1.2 多酚类物质
多酚类物质主要来源于蜜蜂采集的开花植物,包括酚酸和黄酮类化合物,因此不同蜂蜜中所含酚类化合物的种类和数量差异显著[18]。黄酮类化合物具有清除自由基、抗菌、抗肿瘤、抗病毒及免疫调节等多种生物学活性[19]。2017年,王笑笑等[20]利用UPLC-MS/MS技术测定蜂蜜中黄酮的组分及含量,研究表明,所有供试蜂蜜均具有抗菌活性,不同蜂蜜所含黄酮浓度具有显著差异,黄酮含量越高的蜂蜜其抗菌活性越强,说明黄酮在蜂蜜的抗菌活性中具有重要贡献。相关研究表明,黄酮类物质可增强致病菌的细胞壁通透性,破坏其细胞膜结构,提高胞内活性氧水平,从而达到抑菌的作用[21]。其次,酚酸化合物是含有酚羟基和羧基的一种有机酸,其结构特点为蜂蜜创造了酸性环境,因而对蜂蜜的抗菌活性具有重要作用。另外,有研究表明,酚酸可下调多重耐药大肠杆菌脂质代谢通路上部分关键酶的表达,致其鞭毛脱落,细胞膜破损,抑制了其生长发育,从而起到抑菌的效果[22]。
1.3 抗菌肽和王浆主蛋白
除了葡萄糖和果糖外,蜂蜜中还含有少量蛋白质,这些蛋白成分主要来自采集蜂自身腺体的分泌物,其次来源于花粉粒或蜜蜂身体残留[23]。其中,具有抑菌或杀菌活性的蛋白质主要是抗菌肽和王浆主蛋白。目前,在医用级蜂蜜中发现了由工蜂咽下腺分泌的防御素-1蛋白(Defensin-1),其抗菌谱较为广泛,如铜绿假单胞菌、金黄色葡萄球菌和屎肠球菌等,防御素-1亦可抑制肿瘤细胞的生长,对正常动物细胞没有杀伤作用[24]。不同蜂蜜中抗菌肽的含量有所差异。王浆主蛋白(Major royal jelly proteins,MRJPs)是蜂蜜中含量最多的蛋白质,占总蛋白的90%[25]。2015年,Brudzynski等发现蜂蜜中含有王浆主蛋白,并证明其对枯草芽孢杆菌、大肠杆菌、耐甲氧西林金黄色葡萄球菌和铜绿假单胞菌等具有广谱的抗菌活性[26]。2021年,Feng等[27]探究蜂王浆中N糖基化的王浆主蛋白2可通过扰乱幼虫芽孢杆菌的细胞壁生物合成,增加细胞膜通透性,阻碍有氧呼吸,抑制细胞分裂和诱导细胞死亡而起到抑菌的效果。因此,蜜蜂来源的抗菌肽和王浆主蛋白成分对蜂蜜的抗菌活性具有一定影响。
1.4 过氧化氢
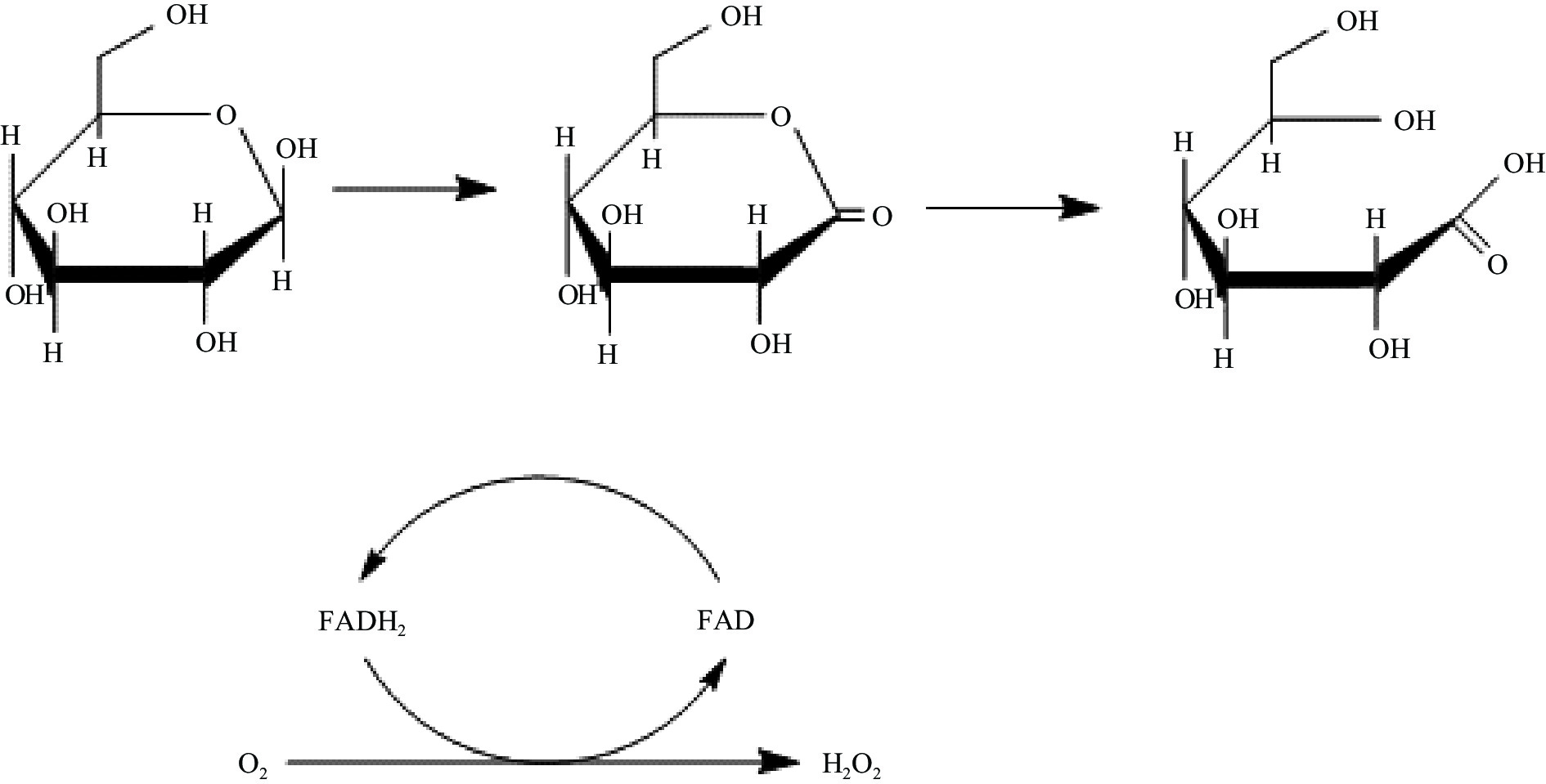
成熟蜂蜜是蜜蜂采集花蜜并混入自身分泌物,经过发酵形成的过饱和糖溶液,其中糖类含量最高,以葡萄糖和果糖为主,两者占蜂蜜总糖含量的85%~95%[28]。除此之外,蜂蜜中还含有蜜蜂分泌的酶类化合物,包括葡萄糖氧化酶、淀粉酶、过氧化酶及磷酸酯酶等[29]。而蜂蜜中过氧化氢主要是由葡萄糖氧化酶催化葡萄糖形成。体外实验表明,葡萄糖氧化酶将葡萄糖和氧气经过两步氧化还原反应生成过氧化氢,在此过程中,黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide,FAD)辅因子对葡萄糖氧化酶的氧化还原活性至关重要[30]。第一步是还原反应,葡萄糖氧化酶将β-D-葡萄糖第一个羟基上的2个电子和1个质子转移给FAD辅因子,从而催化葡萄糖氧化成葡萄糖酸内酯。在水溶液中,葡萄糖酸内酯从葡萄糖氧化酶上脱落并通过自发水解生成葡萄糖酸。第二步是氧化反应,氧气将还原型GOx-FADH2再次氧化,FADH2将2个电子转移给氧气,同时生成过氧化氢(如图1所示)。该反应遵循“乒乓”动力学(Ping pong kinetics),即只有当葡萄糖从葡萄糖氧化酶上脱落且GOx-FADH2被氧化后,葡萄糖氧化酶才能结合氧气[32]。
过氧化氢的形成依赖于FAD辅酶因子顺利完成氧化还原循环[33]。葡萄糖氧化酶氧化葡萄糖的总速率取决于两个半反应的动力学,即葡萄糖氧化酶与葡萄糖的动力学以及依赖氧分子的FAD再氧化动力学。随后,生成的过氧化氢在过氧化氢酶的作用下生成水和氧气。过氧化氢和中间物葡萄糖酸内酯的有效去除可使反应单向进行,并防止葡萄糖氧化酶被氧化。
2. 影响蜂蜜中葡萄糖氧化酶活性和过氧化氢生成的因素
葡萄糖氧化酶反应中过氧化氢的生成速率取决于三种反应物的浓度,即葡萄糖氧化酶、葡萄糖和氧气。在体外条件下,当葡萄糖氧化酶的浓度恒定时,葡萄糖氧化的初始速率与单位时间内葡萄糖的浓度成线性关系[31,34]。随着葡萄糖浓度的增加和葡萄糖氧化酶结合位点饱和度的增加,反应速率逐渐减慢并达到最大速率。在高浓度葡萄糖的条件下,葡萄糖氧化酶处于完全饱和状态且无活性,此时不产生过氧化氢[29]。然而,未稀释蜂蜜中酶反应动力学与体外条件的葡萄糖氧化酶反应动力学之间具有显著差异。由于蜂蜜的理化环境极其复杂,葡萄糖氧化酶活性不仅与葡萄糖浓度相关,还受到多种因素的影响,如水分活度、氧气以及过氧化氢浓度等。下文将简要介绍影响蜂蜜中葡萄糖氧化酶活性与过氧化氢生成的相关因素。
2.1 水分活度
成熟蜂蜜是一种葡萄糖和果糖约占80%、含水量约占17%的过饱和糖溶液[14],粘度较大。因而,蜂蜜中高浓度葡萄糖、低水分活度和高粘度的物理状态会抑制反应物和产物在基质中的扩散,进而影响蜂蜜中过氧化氢的产生,主要表现在以下几个方面。
首先,天然未稀释蜂蜜的水分活度低,大部分水分子化学结合在糖和大分子上,只有少量游离水可用于化学反应[35]。葡萄糖氧化酶是一种糖蛋白,含有11%~13%的高甘露糖型碳水化合物成分,这一成分有利于结合水分子,使葡萄糖氧化酶保持酶活性所需的天然构象[36]。然而,除了溶解分子之外,游离水还可作为生成过氧化氢的许多相关反应的溶剂,比如葡萄糖氧化酶催化葡萄糖氧化、过氧化氢酶水解过氧化氢以及葡萄糖酸内酯自发水解为葡萄糖酸等反应。然而,由于未稀释蜂蜜的水分活度低,这些反应均受到抑制[29],因此其过氧化氢含量可忽略不计[37]。
其次,低含量的游离水显著降低了反应物和过氧化氢在高粘度基质中的扩散速率,分子流动性降低会导致底物、中间体和产物的积累。随着反应物流动性的降低,葡萄糖酸内酯成为氧气的竞争性抑制剂,二者竞争进入葡萄糖氧化酶结合位点,进而成为葡萄糖的非竞争性抑制剂[38]。此外,在未稀释蜂蜜中,当游离水含量较低时,葡萄糖酸内酯分解生成葡萄糖酸的反应受到阻碍。
最后,分子迁移率降低也会影响过氧化氢的扩散速率。如果过氧化氢未从反应中去除,可能会引发反馈反应,造成葡萄糖酸内酯的大量积累。此时,过氧化氢成为葡萄糖的竞争性抑制剂和氧气的非竞争性抑制剂。
2.2 葡萄糖和氧气浓度
β-脱氧-D-葡萄糖是葡萄糖氧化酶反应生成过氧化氢的第一底物,其在蜂蜜中含量较高。一般来说,蜂蜜中含有31%左右的葡萄糖,与果糖一起形成过饱和溶液。体外实验表明,高浓度葡萄糖使葡萄糖氧化酶的结合位点达到饱和状态,并阻断了与第二底物氧气的结合[34,39]。当浓度高于100 mmol/L时,葡萄糖会成为氧气的竞争性抑制剂,阻止氧化型FAD的再生,从而使过氧化氢的产生受到抑制[31]。在未稀释蜂蜜中,底物抑制可能是葡萄糖氧化酶活性低和过氧化氢产量较低的原因之一。
在葡萄糖氧化反应中,葡萄糖氧化酶需要氧气作为第二底物,水作为溶剂。在初期,葡萄糖氧化酶反应所需氧气是由花蜜中空气的饱和水提供的。然而,在蜂蜜成熟过程中,水分蒸发将会降低氧气浓度,会阻碍FADH2-GOx的再氧化。在稀释蜂蜜中,氧气是由过氧化氢酶分解过氧化氢提供的。然而,在未稀释的蜂蜜中,由于氧气供应不足,所以产生的过氧化氢可忽略不计。
2.3 过氧化氢浓度
如果反应中过氧化氢未去除,那么葡萄糖氧化酶的活性还会受到产物抑制。为了防止过氧化氢大量积累逆转反应方向,去除终产物是很有必要的。过氧化氢与氧气竞争结合FADH2-GOx,因而阻碍了还原型FADH2再生成FAD[40]。除了阻断FAD氧化还原循环,过氧化氢还参与葡萄糖氧化酶活性位点的甲硫氨酸的直接氧化,形成的甲硫氨酸亚砜降低了酶对底物的识别,使酶对葡萄糖识别的特异性受到影响[39]。
因此,蜂蜜中葡萄糖氧化酶与体外条件的酶反应动力学有所不同。在未稀释蜂蜜中,葡萄糖氧化酶的催化速率受到过饱和糖溶液中反应物扩散速率降低、高浓度葡萄糖的底物抑制和产物抑制的影响。低水分活度也会影响过氧化氢酶对过氧化氢的水解以及葡萄糖酸内酯自发水解成葡萄糖酸等反应[31]。综上所述,过氧化氢的产生受到许多因素的影响。
3. 蜂蜜稀释过程中葡萄糖氧化酶酶促反应系统的激活
在未稀释蜂蜜中,低水分活度是抑制葡萄糖氧化酶生成过氧化氢的基本要素。当蜂蜜加水被稀释后,葡萄糖氧化酶系统被激活[41]。研究表明,过氧化氢浓度随着蜂蜜稀释度的增加而增大,达到最大值后,再进行稀释时其过氧化氢浓度会迅速下降[41-42]。而不同蜂蜜过氧化氢浓度最大时其稀释度不同,但在大多数蜂蜜中,最大值出现在15%~50%的蜂蜜浓度范围内[37]。研究表明,荞麦、石南、麦卢卡等深色蜂蜜的过氧化氢含量通常高于浅色蜂蜜,当蜂蜜浓度低于12.5%时,过氧化氢产量会下降[37]。过氧化氢浓度和蜂蜜稀释度之间的关系呈倒U型曲线,其转折点为过氧化氢浓度最大值所对应的稀释度,但倒U型关系的详细机制尚不清楚[41]。
另一方面,过氧化氢浓度的测定应在倒U型曲线的上升部分进行,最好在蜂蜜稀释时过氧化氢产量最大点进行测定。由于不同蜂蜜的倒U型曲线模式存在差异,所以在测量过氧化氢浓度之前,首先确定每种蜂蜜倒U型曲线的线性和非线性部分,这对不同蜂蜜中过氧化氢产量的比较研究尤为重要[31]。
4. 蜂蜜稀释过程中影响过氧化氢生成的主要因素
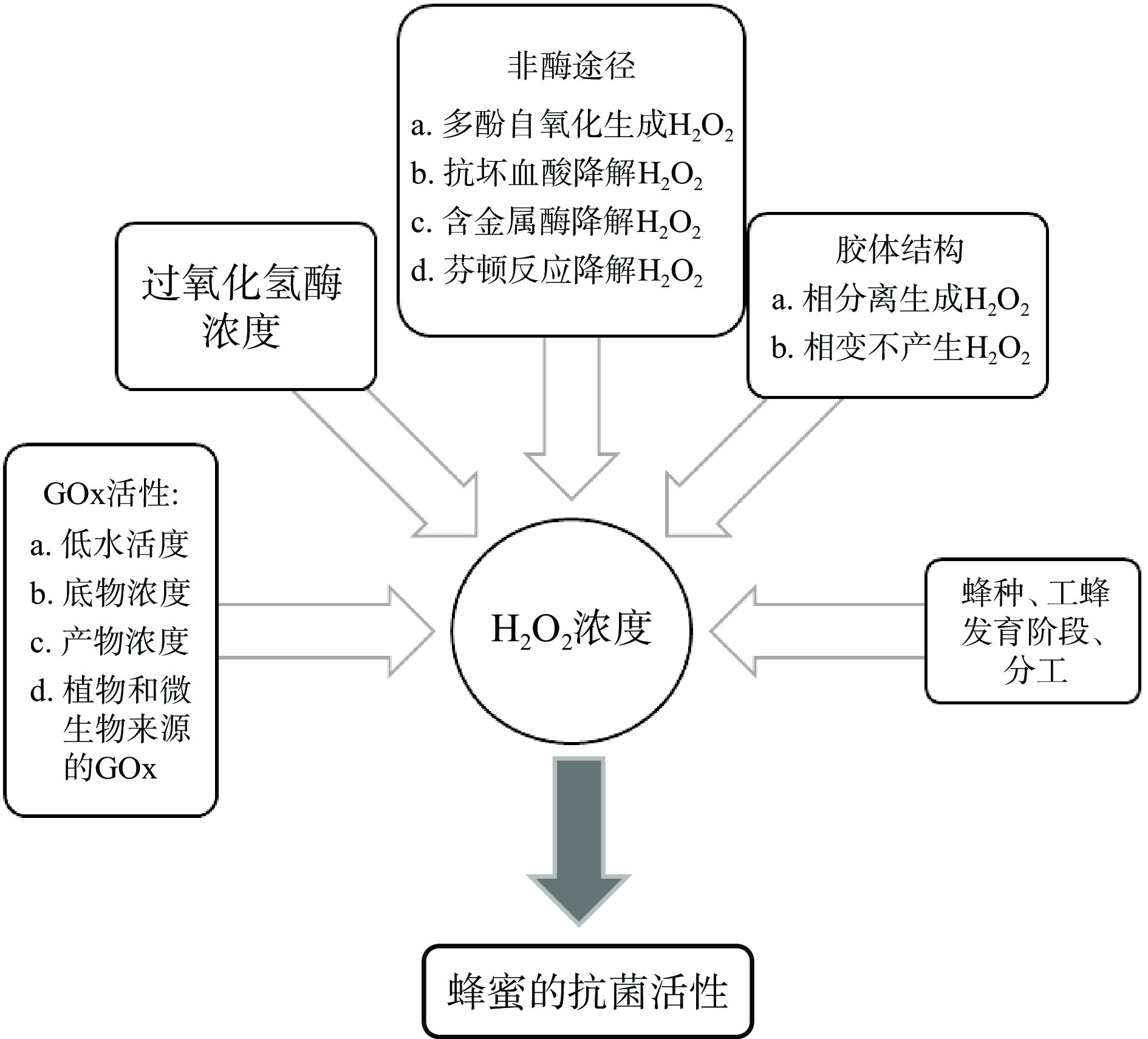
在体外模型系统中,葡萄糖氧化酶的浓度及其活性与过氧化氢形成速率之间存在简单的线性关系,而在复杂的蜂蜜环境中不存在这种相关性[34]。尽管过氧化氢的浓度取决于葡萄糖氧化酶含量,但同时也受到蜂蜜中与酶或产物相互作用的其他生物活性成分(源于花蜜、花粉、酵母)的影响[43]。鉴于“各种小分子”的调节作用,最近的研究提出了一个新观点,即蜂蜜中过氧化氢浓度是由葡萄糖氧化酶的产生水平与过氧化氢酶和蜂蜜其他成分的分解水平之间的差异决定[31]。许多小分子和影响过氧化氢生成的因素随着花源而变化,因此可预测,不同蜂蜜中过氧化氢的最终浓度会有所不同。可见,蜂蜜中过氧化氢的产生和分解是由多因素调节的结果。产生和分解过氧化氢的酶促和非酶促反应途径的一些机制在生物化学中是常见的。
4.1 过氧化氢酶分解
过氧化氢的分解途径主要包括花粉来源的过氧化氢酶将其水解为水和氧气。过氧化氢酶催化反应包括2分子过氧化氢和铁(Ⅲ)。首先,过氧化氢作为氧化剂,将铁(Ⅲ)氧化为铁(Ⅳ)氧铁中间体。将铁(Ⅲ)的一个电子转移给过氧化氢分子,破坏了过氧化氢分子中的O-O键,将其还原成水和氧气。其次,另一分子过氧化氢作为还原剂,将铁(Ⅳ)氧铁中间体还原为原始的铁过氧化氢酶,同时生成氧气和一分子水。一般认为,不同蜂蜜中过氧化氢酶的含量和活性决定了过氧化氢的最终水平[44],然而,过氧化氢酶和过氧化氢浓度之间的定量关系尚存在一定争议[45],这表明存在其他机制影响着蜂蜜中过氧化氢的含量。
4.2 金属酶分解
除了过氧化氢酶,蜂蜜中含有铁或过渡金属的酶与过氧化氢酶具有相似的金属诱导氧化还原反应机理,其中金属离子是电子的来源[46]。例如,蜂蜜中含有延缓衰老的超氧化物歧化酶,它是一种富含金属离子且具有生物活性的蛋白质,可清除活性氧自由基[47]。因此,其他含金属酶也可以分解过氧化氢,使其浓度发生改变,从而对蜂蜜抗菌活性产生影响。
4.3 抗坏血酸分解
过氧化氢也可以通过非酶促反应途径分解。在有氧条件下,一些抗氧化剂(如抗坏血酸)可以被过氧化氢(而不是氧气)氧化,通过将两个电子和两个质子转移给过氧化氢,使过氧化氢还原成水和氧气,同时生成脱氢抗坏血酸。来自花蜜的抗坏血酸在蜂蜜中广泛存在[48]。研究发现,向蜂蜜中加入抗坏血酸能使过氧化氢的去除率增加5倍。在蜂蜜中,抗坏血酸的浓度决定了其具有不同的活性—抗氧化或促氧化,当抗坏血酸表现为抗氧化活性时,蜂蜜中过氧化氢分子被分解,使其无法参与活性氧的生成;当抗坏血酸表现为促氧化活性时,则有利于过氧化氢的生成[49]。
4.4 多酚自氧化产生
过氧化氢还可通过多酚的促氧化活性产生。众所周知,多酚是一类强抗氧化剂,但在有氧条件下,当过渡金属离子尤其是铁(Ⅱ)和铜(Ⅰ)存在时,它们易被氧化成醌类化合物,并产生过氧化氢作为自氧化的副产物[50-51]。过氧化氢的产量取决于多酚结构、多酚浓度、过渡金属离子和氧气的存在。自氧化过程是将多酚羟基的一个电子转移给氧气,形成邻半醌阴离子自由基,邻半醌自由基与氧气反应生成超氧阴离子自由基,最后歧化成过氧化氢[31]。
由于氧气不能直接与儿茶酚或没食子酰基团反应,因此过渡金属的存在对多酚自氧化至关重要。在蜂蜜中,铁(Ⅱ)、铜(Ⅰ)和锰(Ⅱ)等过渡金属的浓度差异决定了过氧化氢的生成量。多酚自氧化依赖于酸碱度,碱性条件下会加快自氧化反应。当pH低于7时,则不会产生过氧化氢[52]。
在蜂蜜中,许多酚类化合物具有抗氧化和促氧化活性所需的结构成分,例如槲皮素、芹菜素、芦丁、咖啡酸及阿魏酸等。一般而言,能够自氧化或具有自由基清除和金属螯合活性的抗氧化剂都存在两种活性化学基团的参与,主要是儿茶酚基团和一些羟基结构[53]。从抗氧化到促氧化活性的转变取决于多酚浓度、金属离子的存在和酸碱度[54]。蜂蜜的抗氧化活性与多酚浓度紧密相关[55-56]。研究发现,与浅色蜂蜜相比,深色蜂蜜的总酚含量更高,因而具有更高的抗氧化能力[57]。
多酚自氧化是蜂蜜产生过氧化氢的非酶促反应途径。过氧化氢浓度增加和过氧化氢分解产生的羟自由基增加均有利于增强蜂蜜的抗菌活性[58-61]。
4.5 芬顿反应(Fenton reaction)降解
在铁(Ⅱ)或其他过渡金属存在的条件下,由酶或多酚自氧化产生的过氧化氢通过芬顿反应立即转化为活性氧。当氧化型三价铁离子存在时,氧气还原为超氧自由基(O2−·),然后进入芬顿反应。如上所述,超氧自由基是在多酚或抗坏血酸自氧化过程中形成的。超氧自由基进入芬顿反应,将三价铁还原为二价铁,并产生氧气。二价铁与过氧化氢反应生成三价铁、羟自由基(·OH)和羟基阴离子(OH—)。然后,超氧自由基再与过氧化氢反应生成羟自由基(·OH)、羟基阴离子(OH—)和氧气(O2)[62]。
天然蜂蜜具有芬顿反应所需的全部底物(过氧化氢、多酚和铁等过渡金属离子),因此它们能够产生超氧自由基和羟自由基,这两种自由基对细菌的伤害最大,能够产生抑制其生长和降解DNA等不利影响。Brudzynski和Lannigan(2012b)发现,在含有高浓度多酚的荞麦蜂蜜中添加Cu(Ⅱ)或过氧化氢,由于羟自由基的形成,对耐甲氧西林金黄色葡萄球菌(Methicillin-resistant staphylococcus aureus,MRSA)和耐万古霉素肠球菌(Vancomycin-resistant enterococcus,VRE)的抑菌活性增加了30倍[59]。利用能捕获羟自由基的对氨基苯荧光素,证明羟自由基的产生与抑菌之间存在直接关系。在添加铜离子之前,用过氧化氢酶预处理蜂蜜则完全恢复了细菌的生长,这表明羟自由基是由过氧化氢通过芬顿反应产生的[59]。当反应物中没有过氧化氢或铜离子时,则对细菌DNA没有损伤。
4.6 开花植物的花蜜氧化还原循环
目前,蜜蜂来源的葡萄糖氧化酶被认为是蜂蜜中过氧化氢生成的主要机制。最初,在烟草花蜜中发现了具有葡萄氧化酶活性的花蜜氧化还原蛋白,这些蛋白组成了花蜜氧化还原循环。花蜜氧化还原循环由5种酶组成,其中NEC1(Nectarin Ⅰ)和NEC5(Nectarin V)均具有葡萄糖氧化酶活性,可将葡萄糖和氧气转化成葡萄糖酸和过氧化氢[63],因而对蜂蜜的抗菌活性具有重要影响。因此,植物花蜜氧化还原循环酶的发现为蜂蜜中过氧化氢的产生途径提供了新的见解。
4.7 微生物产生
事实上,蜂蜜中的微生物可以产生葡萄糖氧化酶,因而它们对过氧化氢的产生也具有一定贡献。研究发现,蜂蜜中存在许多能产生过氧化氢的微生物[64],包括真菌(如曲霉和青霉)、酵母(如酵母属、裂殖酵母属、子囊菌属等)以及细菌(如乳酸菌、芽孢杆菌属和大肠杆菌)等,这些微生物在糖溶液中生长良好,能耐受蜂蜜的高渗透压[65],因此可以产生大量的过氧化氢,但它们对蜂蜜中过氧化氢的影响尚待深入研究。
5. 蜂蜜的胶体结构对过氧化氢生成的影响
蜂蜜是植物、蜜蜂和微生物来源的不同成分的混合物,这些成分在糖溶液中均匀分布并自由扩散(见图2)。然而,最近的证据表明,蜂蜜大分子在低水分活度和高糖浓度条件下聚集形成胶体颗粒[41]。利用扫描电子显微镜可观察到,蜂蜜的胶体结构是分散在糖溶液中的相分离粒子。研究发现,胶体结构在蜂蜜产生过氧化氢中具有重要作用[41]。利用动态光散射仪观察到,当蜂蜜未被稀释时,高浓度的大分子可形成微米级颗粒,当蜂蜜稀释时,随着稀释度的增加,蜂蜜大分子葡萄糖和果糖的浓度降低,导致分子间相互作用降低,胶体结构由微米级转变成纳米级颗粒,此时体系由两相胶体状态转变为单相分散状态,即发生了相变[66]。研究表明,蜂蜜胶体结构和相变点对过氧化氢的产生具有重要意义,因而对蜂蜜的抗菌活性具有重大影响[41]。
5.1 蜂蜜胶体结构与过氧化氢产生之间的关系
研究发现,形成胶体颗粒的蜂蜜能够有效产生过氧化氢[66]。相反,从胶体状态到单分散状态的相变则导致过氧化氢产量大大降低,这两种状态下过氧化氢的产量明显不同[67]。当研究蜂蜜稀释后其构象变化与过氧化氢产生的关系时(分别使用动态光散射仪和安普尔克斯红法),发现相变点与过氧化氢浓度最大值的稀释度是一致的。深色蜂蜜和中度蜂蜜其过氧化氢最大产量和相变点都恰好出现在16倍和8倍稀释度(蜂蜜浓度分别为6.25%和12.5%);相反,在稀释过程中,浅色蜂蜜出现过氧化氢产量下降的现象。因此,过氧化氢的生成与蜂蜜胶体构象有关,当蜂蜜由两相胶体状态转变为单相分散状态时,则不再产生过氧化氢[41]。
5.2 蜂蜜胶体结构对其抗菌活性的影响
蜂蜜的胶体结构影响其理化和功能性质。胶体结构促进了过氧化氢的产生,因此提高了蜂蜜的抗菌活性[41]。由于高糖浓度、低水分活度和酸性环境均不利于细菌生长,因此这些因素对蜂蜜的抗菌活性起到重要作用。从蜂蜜功能的角度来看,由多种活性成分组成的胶体结构,如多酚、蛋白质、酶、肽、蛋白复合物及美拉德反应产物等,发现它们均与蜂蜜的抗菌活性相关。研究发现,随着蜂蜜稀释度的增加,其抗菌活性显著降低,但与浅色蜂蜜相比,深色蜂蜜和中度蜂蜜的抗菌活性较强[66]。总之,蜂蜜成分形成胶体颗粒并结合与其抗菌活性相关的因素和化合物,因此,胶体结构为其抗菌活性的结构−功能关系提供了新的见解[31]。
5.3 稀释蜂蜜中过氧化氢分子的稳定性
当蜂蜜未稀释时,两相构象中形成微米级胶体颗粒的活性大分子可能通过协同作用产生过氧化氢,粒子间的紧密距离会影响过氧化氢的空间分布。由于过氧化氢的扩散范围较小,其在颗粒周围区域的局部积累会增加。然而,当蜂蜜稀释时,根据动态光散射仪的数据发现,相变改变了颗粒大小,增加了颗粒在粘性较小介质中的分散性和流动性[41]。这些变化可能会影响粒子之间的相互作用,增加排斥力,改变粒子之间的距离。经过相变点后,稀释状态的构象会影响过氧化氢分子的完整性,使其被过氧化氢酶和其他小分子降解。此外,稀释蜂蜜从酸性到中性的pH变化也可能是其不稳定的因素之一。对于商品化的过氧化氢溶液,当pH低于4.5时,其处于最稳定状态,当pH高于5时,过氧化氢降解会大大增加。因此,蜂蜜加水稀释不利于过氧化氢的产生和释放。
6. 总结与展望
近年来,天然产物的抗菌活性受到人们的广泛关注。蜂蜜中存在的多种活性物质对其抗菌活性均有一定影响,如甲基乙二醛、过氧化氢、多酚、抗菌肽及王浆主蛋白等。除麦卢卡蜂蜜以外,过氧化氢是绝大多数蜂蜜中最重要的抗菌物质。尽管有研究表明,过氧化氢水平是由葡萄糖氧化酶的合成速率和过氧化氢酶的分解速率决定,但最近也有大量研究质疑了该观点。过氧化氢水平受到众多因素的影响,没有一种化合物或因素可以直接控制和预测过氧化氢的最终浓度。尽管蜜蜂来源的葡萄糖氧化酶通过酶促反应产生过氧化氢是主要途径,但依旧不能排除花蜜和微生物中葡萄糖氧化酶的潜在影响。其次,在未稀释蜂蜜中,任何酶反应速率都受到低水分活度的抑制;当蜂蜜稀释后,则会引发酶促和非酶促反应,比如通过多酚自氧化生成过氧化氢以及通过芬顿反应(Fenton reaction)分解过氧化氢等,这些反应对蜂蜜中过氧化氢的水平具有重要影响,因而也影响着蜂蜜的抗菌活性。迄今为止,研究取得的重要进展是发现了蜂蜜胶体结构和过氧化氢产生之间的密切联系,这可以解释研究人员观察到的过氧化氢产生和蜂蜜稀释度之间的倒U型关系。胶体构象有利于过氧化氢水平的提高,确保其稳定性,进而保持蜂蜜的抗菌活性。在蜂蜜中,众多化合物或因素调控着其抗菌活性,但这些化合物的抗菌效能、杀菌机制以及如何利用这些化合物或因素提高蜂蜜的抗菌活性仍是待探究的问题,且目前对影响过氧化氢生成因素的了解仍处于初始阶段,如何合理控制蜂蜜中过氧化氢的合成与分解是其开发利用的难点之一,因此,后续研究需要进一步探索蜂蜜中过氧化氢的生成途径和机制,以期为蜂蜜在食品和医药领域的应用提供更全面的理论基础。
-
[1] 郝博, 鹿扩建, 笔雪艳. 蜂蜜作为药用辅料应用及质量控制的研究概述[J]. 中医药学报,2020,48(10):69−74. [HAO B, LU K J, BI X Y. Research overview on applications as pharmaceutical excipient and quality control of honey[J]. Acta Chinese Medicine and Pharmacology,2020,48(10):69−74. [2] TASHKANDI H. Honey in wound healing: An updated review[J]. Open Life Sci,2021,16(1):1091−100. doi: 10.1515/biol-2021-0084
[3] 周帆, 陈碧霄, 杨淼, 等. 蜂蜜中抗菌活性成分研究进展[J]. 现代食品,2020(11):6−7. [ZHOU F, CHEN B X, YANG M, et al. Research progress on antibacterial active ingredients in honey[J]. Modern Food,2020(11):6−7. [4] SCEPANKOVA H, PINTO C A, PAULA V, et al. Conventional and emergent technologies for honey processing: A perspective on microbiological safety, bioactivity, and quality[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(6):5393−5420. doi: 10.1111/1541-4337.12848
[5] SERAGLIO S K T, SILVA B, BERGAMO G, et al. An overview of physicochemical characteristics and health-promoting properties of honeydew honey[J]. Food Research International,2019,119:44−66. doi: 10.1016/j.foodres.2019.01.028
[6] HU F L. Chemical analyses and antimicrobial activity of nine kinds of unifloral Chinese honeys compared to Manuka honey (12+and 20+)[J]. Molecules,2021,26(9):2778. doi: 10.3390/molecules26092778
[7] FARKASOVSKA J, BUGAROVA V, GODOCIKOVA J, et al. The role of hydrogen peroxide in the antibacterial activity of different floral honeys[J]. European Food Research and Technology,2019,245(12):2739−2744. doi: 10.1007/s00217-019-03393-y
[8] MCLOONE P, WARNOCK M, FYFE L. Honey: A realistic antimicrobial for disorders of the skin[J]. Journal of Microbiology, Immunology and Infection,2016,49(2):161−167. doi: 10.1016/j.jmii.2015.01.009
[9] BRUDZYNSKI K. Effect of hydrogen peroxide on antibacterial activities of Canadian honeys[J]. Canadian Journal of Microbiology,2006,52(12):1228−1237. doi: 10.1139/w06-086
[10] 苏睿, 秦加敏, 董坤, 等. 弗里熊蜂蜜罐中糖液成分分析[J]. 昆虫学报,2021,64(1):90−98. [SU R, QIN J M, DONG K, et al. Component analysis of the sugar solution stored in wax cells by Bombus friseanus (Hymenoptera: Apidae)[J]. Acta Entomologica Sinica,2021,64(1):90−98. [11] 汪思凡, 曹振辉, 潘洪彬, 等. 蜂蜜化学成分及其主要生物学功能研究进展[J]. 食品研究与开发,2018,39(1):176−181. [WANG S F, CAO Z H, PAN H B, et al. Research progress on chemical composition and major biological function of honey[J]. Food Research and Development,2018,39(1):176−181. [12] 郭娜娜, 赵亚周, 王凯, 等. 蜂蜜对创伤愈合的作用及临床治疗研究进展[J]. 中国农业科技导报,2021,23(2):123−133. [GUO N N, ZHAO Y Z, WANG K, et al. Research progress on the effects of honey on wound healing and its mechanism[J]. Journal of Agricultural Science and Technology,2021,23(2):123−133. [13] 张飞龙. 米林县不同蜜源蜂蜜抗菌活性和过氧化氢含量的测定[J]. 食品安全导刊,2021(12):116−118. [ZHANG F L. Determination of antibacterial activity and hydrogen peroxide content of honey from different sources in Millin County[J]. China Food Safety Magazine,2021(12):116−118. [14] 吴雨祺, 郑宇斐, 张言政, 等. 蜂蜜中抗菌活性物质的研究进展[J]. 中国蜂业,2017,68(1):17−20. [WU Y Q, ZHENG Y F, ZHANG Y Z, et al. Research progress on antibacterial substances in honey[J]. Apiculture of China,2017,68(1):17−20. [15] MAJTAN J, BUCEKOVA M, KAFANTARIS I, et al. Honey antibacterial activity: A neglected aspect of honey quality assurance as functional food[J]. Trends in Food Science & Technology,2021,118:870−886.
[16] 张言政, 胡福良. 麦卢卡蜂蜜的抗菌活性及其机理[J]. 蜜蜂杂志,2015,35(7):1−5. [ZHANG Y Z, HU F L. Antibacterial activity of Manuka honey and its mechanism[J]. Journal of Bee,2015,35(7):1−5. [17] JOHNSTON M, MCBRIDE M, DAHIYA D, et al. Antibacterial activity of Manuka honey and its components: An overview[J]. AIMS Microbiology,2018,4(4):655−664. doi: 10.3934/microbiol.2018.4.655
[18] 王玉涵, 王欣然, 李熠, 等. 蜂蜜中功能营养成分及特征研究进展[J]. 农产品质量与安全,2020(4):85−92. [WANG Y H, WANG X R, LI Y, et al. Research progress on functional nutrition components and characteristics of honey[J]. Quality and Safety of Agro-Products,2020(4):85−92. [19] 杨二林, 赵浩安, 徐元元, 等. 枣花蜜酚类化合物组成及其抗氧化活性分析[J]. 食品科学,2021,42(3):150−157. [YANG E L, ZHAO H A, XU Y Y, et al. Phenolic compounds and antioxidant activity of jujube honey[J]. Food Science,2021,42(3):150−157. doi: 10.7506/spkx1002-6630-20200221-227 [20] 王笑笑, 周勇, 徐国群, 等. 黄酮类成分在蜂蜜抗菌性中的效能研究[J]. 中国现代应用药学,2017,34(3):363−369. [WANG X X, ZHOU Y, XU G Q, et al. Study on the efficacy of flavonoids in the antibacterial properties of honey[J]. Chinese Journal of Modern Applied Pharmacy,2017,34(3):363−369. [21] 阚玉红, 谢笔钧, 孙智达. 胭脂红番石榴叶黄酮提取物的抑菌活性及其机理[J]. 中国调味品,2021,46(12):159−166, 188. [KAN Y H, XIE B D, SUN Z D. Antibacterial activity and mechanism of flavonoids extracted from leaves of Psidium guajava L [J]. China Condiment,2021,46(12):159−166, 188. doi: 10.3969/j.issn.1000-9973.2021.12.030 [22] ZHANG G, YANG Y, MEMON F U, et al. A natural antimicrobial agent: Analysis of antibacterial effect and mechanism of compound phenolic acid on Escherichia coli based on tandem mass tag proteomics[J]. Frontiers in Microbiology,2021,12:738896. doi: 10.3389/fmicb.2021.738896
[23] DA SILVA P M, GAUCHE C, GONZAGA L V, et al. Honey: Chemical composition, stability and authenticity[J]. Food Chemistry,2016,196:309−323. doi: 10.1016/j.foodchem.2015.09.051
[24] 张爱静, 张爱提, 陈俊丽, 等. 中华蜜蜂防御素基因克隆及生物信息学分析[J]. 特产研究,2011,33(2):13−16. [ZHANG A J, ZHANG A T, CHEN J L, et al. Gene clone and bioinformatics analysis of bee defensins[J]. Special Wild Economic Animal and Plant Research,2011,33(2):13−16. doi: 10.3969/j.issn.1001-4721.2011.02.004 [25] HELBING S, LATTORFF H M G, MORITZ R F A, et al. Comparative analyses of the major royal jelly protein gene cluster in three Apis species with long amplicon sequencing[J]. DNA Research,2017,24(3):279−287. doi: 10.1093/dnares/dsw064
[26] KATRINA B, CALVIN S, ROBERT L. MRJP1-containing glycoproteins isolated from honey, a novel antibacterial drug candidate with broad spectrum activity against multi-drug resistant clinical isolates[J]. Frontiers in Microbiology,2015(6):711.
[27] FENG M, FANG Y, MA C, et al. Mechanistic insight into royal protein inhibiting the gram-positive bacteria[J]. Biomolecules,2021,11(1):64. doi: 10.3390/biom11010064
[28] 伊作林, 杨柳, 席芳贵, 等. 蜂蜜成分及功能活性的研究进展[J]. 中国养蜂,2018,69(4):51−54. [YI Z L, YANG L, XI F G, et al. Advances in the study of components and functional activities of honey[J]. Apiculture of China,2018,69(4):51−54. [29] 张国志, 张言政, 李珊珊, 等. 蜂蜜中的酶及其在蜂蜜质量控制中的应用[J]. 食品安全质量检测学报,2021,12(21):8313−8320. [ZHANG G Z, ZHANG Y Z, LI S S, et al. Enzymes in honey and their application in honey quality control[J]. Journal of Food Safety & Quality,2021,12(21):8313−8320. doi: 10.3969/j.issn.2095-0381.2021.21.spaqzljcjs202121002 [30] WOHLFAHRT G, WITT S, HENDLE J, et al. 1.8 and 1.9 A resolution structures of the Penicillium amagasakiense and Aspergillus niger glucose oxidases as a basis for modelling substrate complexes[J]. Acta Crystallographica Section D Biological Crystallography, 1999, 55(Pt 5): 969-977.
[31] LESKOVAC V, TRIVIC S, WOHLFAHRT G, et al. Glucose oxidase from Aspergillus niger: The mechanism of action with molecular oxygen, quinones, and one-electron acceptors[J]. International Journal of Biochemistry and Cell Biology,2005,37(4):731−750. doi: 10.1016/j.biocel.2004.10.014
[32] GIBSON Q H, SWOBODA B E, MASSEY V. Kinetics and mechanism of action of glucose oxidase[J]. J Biol Chem,1964,239:3927−3934. doi: 10.1016/S0021-9258(18)91224-X
[33] BRUDZYNSKI K. A current perspective on hydrogen peroxide production in honey. A review[J]. Food Chemistry,2020,332:127229. doi: 10.1016/j.foodchem.2020.127229
[34] SCHEPARTZ A I, SUBERS M H. The glucose oxidase of honey I. Purification and some general properties of the enzyme[J]. Biochimica et Biophysica Acta (BBA)-Specialized Section on Enzymological Subjects,1964,85(2):228−237. doi: 10.1016/0926-6569(64)90243-3
[35] ABRAMOVI H, JAMNIK M, BURKAN L, et al. Water activity and water content in Slovenian honeys[J]. Food Control,2008,19(11):1086−1090. doi: 10.1016/j.foodcont.2007.11.008
[36] KALISZ H M, HENDLE J, SCHMID R D. Structural and biochemical properties of glycosylated and deglycosylated glucose oxidase from Penicillium amagasakiense[J]. Applied Microbiology and Biotechnology,1997,47(5):502−507. doi: 10.1007/s002530050963
[37] STRELEC, IVICA, CREVAR, et al. Glucose oxidase activity and hydrogen peroxide accumulation in Croatian honeys[J]. Croatian Journal of Food Science and Technology,2018,10(1):33−41. doi: 10.17508/CJFST.2018.10.1.06
[38] NAKAMURA S, OGURA Y. Mode of inhibition of glucose oxidase by metal ions[J]. Journal of Biochemistry,1968,64(4):439. doi: 10.1093/oxfordjournals.jbchem.a128915
[39] TOMOTANI E J, NEVES L, VITOLO M. Oxidation of glucose to gluconic acid by glucose oxidase in a membrane bioreactor[J]. Applied Biochemistry & Biotechnology Part A Enzyme Engineering & Biotechnology,2005,124(1−3):149−162.
[40] JIE B, FURUMOTO K, YOSHIMOTO M, et al. Competitive inhibition by hydrogen peroxide produced in glucose oxidation catalyzed by glucose oxidase[J]. Biochemical Engineering Journal,2003,13(1):69−72. doi: 10.1016/S1369-703X(02)00120-1
[41] BRUDZYNSKI K, MIOTTO D, KIM L, et al. Active macromolecules of honey form colloidal particles essential for honey antibacterial activity and hydrogen peroxide production[J]. Scientific Reports,2017,7(1):7637. doi: 10.1038/s41598-017-08072-0
[42] BANG L M, BUNTTING C, MOLAN P. The effect of dilution on the rate of hydrogen peroxide production in honey and its implications for wound healing[J]. J Altern Complement Med,2003,9(2):267−273. doi: 10.1089/10755530360623383
[43] WHITE J W, SUBERS M H, SCHEPARTZ A I. The identification of inhibine, the antibacterial factor in honey, as hydrogen peroxide and its origin in a honey glucose-oxidase system[J]. Biochim Biophys Acta,1963,73(1):57−70. doi: 10.1016/0926-6569(63)90108-1
[44] SCHEPARTZ A I. The glucose oxidase of honey. IV. Some addition observations[J]. Biochimica et Biophysica Acta (BBA)-Enzymology and Biological Oxidation, 1966, 118(3): 637-640.
[45] DUSTMANN J H. Über die katalaseaktivität in bienenhonig aus der tracht der heidekrautgewächse (Ericaceae)[J]. Zeitschrift für Lebensmittel-Untersuchung und Forschung,1971,145(5):294−295.
[46] ZáMOCKY M, GASSELHUBER B, FURTMüLLER P, et al. Molecular evolution of hydrogen peroxide degrading enzymes[J]. Archives of Biochemistry and Biophysics,2012,525(2):131−144. doi: 10.1016/j.abb.2012.01.017
[47] 樊永华, 许辉. 蜂蜜的营养及药用价值[J]. 科技经济市场,2015(10):113−114. [FAN Y H, XU H. Nutrition and medicinal value of honey[J]. Science & Technology Ecnony Market,2015(10):113−114. doi: 10.3969/j.issn.1009-3788.2015.10.086 [48] KERKVLIET D J. Screening method for the determination of peroxide acumulation in honey and relation with HMF content[J]. Journal of Apicultural Research,1996,35(3-4):110−117. doi: 10.1080/00218839.1996.11100920
[49] ALSCHER R G, HESS J L. Antioxidants in higher plants[M]. CRC Press, 1993.
[50] AKAGAWA M, SHIGEMITSU T, SUYAMA K. Production of hydrogen peroxide by polyphenols and polyphenol-rich beverages under quasi-physiological conditions[J]. Bioscience, Biotechnology, and Biochemistry,2003,67(12):2632−2640. doi: 10.1271/bbb.67.2632
[51] ATANASOVA V, FULCRAND H, CHEYNIER V, et al. Effect of oxygenation on polyphenol changes occurring in the course of wine-making[J]. Analytica Chimica Acta,2002,458(1):15−27. doi: 10.1016/S0003-2670(01)01617-8
[52] GRZESIK M, BARTOSZ G, STEFANIUK I, et al. Dietary antioxidants as a source of hydrogen peroxide[J]. Food Chemistry,2019,278:692−699. doi: 10.1016/j.foodchem.2018.11.109
[53] FUKUMOTO L, MAZZA G. Assessing antioxidant and prooxidant activities of phenolic compounds[J]. Journal of Agricultural and Food Chemistry,2000,48(8):3597−3604. doi: 10.1021/jf000220w
[54] CAO G, SOFIC E, PRIOR R L. Antioxidant and prooxidant behavior of flavonoids: Structure-activity relationships[J]. Free Radic Biol Med,1997,22(5):749−760. doi: 10.1016/S0891-5849(96)00351-6
[55] BERTONCELJ J, DOBERSEK U, JAMNIK M, et al. Evaluation of the phenolic content, antioxidant activity and colour of Slovenian honey[J]. Food Chemistry,2007,105(2):822−828. doi: 10.1016/j.foodchem.2007.01.060
[56] ESTEVINHO L, PEREIRA A P, MOREIRA L, et al. Antioxidant and antimicrobial effects of phenolic compounds extracts of Northeast Portugal honey[J]. Food and Chemical Toxicology,2008,46(12):3774−3779. doi: 10.1016/j.fct.2008.09.062
[57] VELA L, DE LORENZO C, PéREZ R A. Antioxidant capacity of Spanish honeys and its correlation with polyphenol content and other physicochemical properties[J]. Journal of the Science of Food and Agriculture,2007,87(6):1069−1075. doi: 10.1002/jsfa.2813
[58] BRUDZYNSKI K, ABUBAKER K, WANG T. Powerful bacterial killing by buckwheat honeys is concentration-dependent, involves complete DNA degradation and requires hydrogen peroxide[J]. Frontiers in Microbiology,2012,3:242.
[59] BRUDZYNSKI K, LANNIGAN R. Mechanism of honey bacteriostatic action against MRSA and VRE involves hydroxyl radicals generated from honey's hydrogen peroxide[J]. Frontiers in Microbiology,2012,3:36.
[60] BUCEKOVA M, BURIOVA M, PEKARIK L, et al. Phytochemicals-mediated production of hydrogen peroxide is crucial for high antibacterial activity of honeydew honey[J]. Scientific Reports,2018,8(1):1−9.
[61] BRUDZYNSKI K, ABUBAKER K, MIOTTO D. Unraveling a mechanism of honey antibacterial action: Polyphenol/H2O2-induced oxidative effect on bacterial cell growth and on DNA degradation[J]. Food Chemistry,2012,133(2):329−336. doi: 10.1016/j.foodchem.2012.01.035
[62] 黎俏文, 秦俊豪, 陈桂葵, 等. H2O2介导的Fenton反应对砷镉污染下水稻生物量的影响[J]. 农业环境科学学报,2015,34(7):1233−1238. [LI Q W, QIN J H, CHEN G K, et al. Effect of hydrogen peroxide induced Fenton Reaction on biomass of rice in soil contaminated by Cd and As[J]. Journal of Agro-Environment Science,2015,34(7):1233−1238. [63] HARPER A D, STALNAKER S H, WELLS L, et al. Interaction of nectarin 4 with a fungal protein triggers a microbial surveillance and defense mechanism in nectar[J]. Phytochemistry,2010,71(17-18):1963−1969. doi: 10.1016/j.phytochem.2010.09.009
[64] KAČÁNIOVÁ M, KŇAZOVICKÁ V, FELŠÖCIOVÁ S, et al. Microscopic fungi recovered from honey and their toxinogenity[J]. Journal of Environmental Science and Health, Part A,2012,47(11):1659−1664. doi: 10.1080/10934529.2012.687242
[65] BRUDZYNSKI K. Honey as an ecological reservoir of antibacterial compounds produced by antagonistic microbial interactions in plant nectars, honey and honey bee[J]. Antibiotics,2021,10(5):551.
[66] BRUDZYNSKI K, SJAARDA C P. Colloidal structure of honey and its influence on antibacterial activity[J]. Compr Rev Food Sci Food Saf,2021,20(2):2063−2080. doi: 10.1111/1541-4337.12720
[67] JOHNSON B J, ALGAR W R, MALANOSKI A P, et al. Understanding enzymatic acceleration at nanoparticle interfaces: Approaches and challenges[J]. Nano Today,2014,9(1):102−131. doi: 10.1016/j.nantod.2014.02.005





 下载:
下载:
 下载:
下载:
