Protective Effects and Mechanism of Polysaccharide from Polygonati Rhizoma on the Cognitive Impairments Induced by Sleep Interruption in Mice
-
摘要: 目的:研究黄精多糖对睡眠干扰(sleep interruption,SI)诱导小鼠认知功能损伤的防治作用,并探讨其作用机制。方法:雄性ICR小鼠72只随机分为空白组、模型组、阳性对照(银杏叶提取物)组,黄精多糖低、中、高(100、200、400 mg/kg)组。预防给药14 d后,除空白组外,其它各组开始为期14 d的睡眠干扰。造模结束后依次进行旷场实验、物体认知实验、避暗实验、Morris水迷宫等行为学检测,并测定血清和海马组织中促炎细胞因子白介素-1β、白介素-6(IL-1β、IL-6)水平;海马组织中神经递质γ-氨基丁酸(GABA)、乙酰胆碱(Ach)水平。结果:旷场实验结果表明各组小鼠运动能力处于同一水平(P>0.05);与模型组相比,黄精多糖(100、200、400 mg∙kg−1)给药后可以显著改善模型组小鼠在物体认知实验中相对辨别指数(DI)(P<0.05),延长避暗实验中入暗潜伏期(P<0.05)、减少错误次数(P<0.05),缩短水迷宫定位航行阶段的寻台潜伏期(P<0.05);黄精多糖给药组血清和海马中IL-6、IL-1β显著降低(P<0.05),海马中GABA含量显著降低(P<0.01)、Ach显著增加(P<0.05)。结论:黄精多糖可有效预防睡眠干扰所致小鼠认知功能损伤,其机制可能是与调节血清和海马中促炎细胞因子和神经递质水平有关。Abstract: Objective: To study the preventive effect and the related mechanisms of polysaccharide of Polygonati Rhizoma (PSP) on cognitive impairments induced by sleep interruption (SI) in mice. Methods: The 72 ICR mice were randomly divided into the control group, the SI model group, the positive control (ginkgo biloba extract) group and the PSP (100, 200, 400 mg/kg) groups. After 14 days of pretreatment, all groups except the control group received sleep interruption which lasted for 14 days. Thereafter, the behavioral tests were performed by using the open field test, the object recognition experiment, the Morris water maze task and the passive avoidance test. Following the behavioral tests, the biochemical analysis was conducted by measuring the levels of IL-1β and IL-6 in the serum and the hippocampus, the contents of GABA and Ach in the hippocampus. Results: The open field test result showed, there were no significant changes in the locomotor activities of mice among all groups (P>0.05). Compared with the SI model group, SPS (100, 200, 400 mg∙kg−1) treatment markedly elevating discrimination index (DI) in object recognition experiment (P<0.05, P<0.01), decreased the error times in entering the dark chamber (P<0.05) and prolonged the latency time in passive avoidance test (P<0.05), as well as decreased the latency period of searching for stations in the navigation stage of water maze positioning (P<0.05). Moreover, PSP administration significantly decreased the levels of IL-1β and IL-6 in the serum and the hippocampus (P<0.05), the content of GABA was significantly decreased (P<0.01), while the level of Ach in the hippocampus was significantly raised (P<0.05). Conclusion: The results reveal that PSP treatment could effectively improve the cognitive impairments induced by SI and its cognition-improving effects might be related to regulate the levels of the proinflammatory cytokines and neurotransmitter in the serum and hippocampus of mice.
-
快节奏、高压的生活方式往往会产生失眠、睡眠质量下降、昼夜节律颠倒等问题,长期的睡眠不足会造成认知功能损伤[1-2]。认知功能损伤是中枢神经退行性疾病的前驱症状,认知功能下降会导致轻度认知障碍,进而发展成为痴呆。而与其它疾病相比,功能性损伤无明确的病变部位,靶点不明确,现代医学难以作用。传统中医药讲究整体观念、天人合一、辩证论治,多成分、多靶点、多途径整体协调在防治功能性损伤方面发挥着独特的优势。同时随着我国“健康中国2030”国家战略需求的提出,那么通过中医药与日常饮食相结合进行食养食疗来预防及干预此类功能性损伤意义重大,因此对具备改善认知功效食品功能因子进行挖掘并利用研究具有重要现实意义。
黄精为百合科黄精属( Liliaceae)多年生草本植物的干燥根茎,中国药典将其分为黄精(Polygonatum sibiricum Red.)、多花黄精(Polygonatumcyrtonema Hua.)、滇黄精(Polygonatum kingianum Coll.et Hemsl.)3种[3]。黄精作为传统食药同源物质,具有防治抑郁[4]、改善睡眠障碍[5-7]、改善认知障碍[8-9]等多种神经精神类疾病的作用[10]。现代研究表明,黄精粉末[11]、黄精水/醇提取物[12]、黄精多糖[13]等均可改善认知功能损伤。其中黄精多糖(Polysaccharide of Polygonati Rhizoma,PSP)被认为是黄精的主要活性成分[14],研究发现黄精多糖是黄精降低氧化应激水平、增强免疫、缓解炎症反应、促进神经递质释放等多重生物活性的活性组分,同时具有改善血管性痴呆[15]、东莨菪碱诱导认知障碍[16]、D-半乳糖诱导衰老模型[17]、自然衰老记忆损伤模型[11]等多种认知损伤的作用。
目前有关黄精多糖改善认知功能相关研究主要集中于化学因素引起的认知障碍模型,而对于模拟长期暴露于慢性应激因素如长期睡眠剥夺下所诱导的认知功能损伤,黄精多糖是否具备改善作用及其可能的作用机制研究未见报道。睡眠干扰模型是一种通过模拟人类睡眠缺乏而导致认知损伤的慢性应激模型,造模方式包括化学造模和物理造模,化学造模为药物睡眠剥夺,物理造模包括轻柔刺激、滚筒法和水平台法等,滚筒法睡眠干扰是模拟现代亚健康人群建立认知功能性损伤模型的重要的手段,因此本实验采用滚筒式睡眠干扰仪建立睡眠干扰诱导认知功能损伤小鼠模型,研究黄精多糖干预对慢性应激诱导认知功能损伤的防护作用和分子机制,以期为黄精的精深加工利用奠定理论基础。
1. 材料与方法
1.1 材料与仪器
SPF级雄性ICR小鼠 18~22 g,72只,购自北京维通利华实验动物有限公司,许可证号 SCXK(京)2021-0006。本实验方案开展前已获得中国医学科学院药用植物研究所实验动物管理与动物福利委员会(IACUC)的审查许可;小鼠饲养于SPF级动物房,饲养条件:温度(22±2)℃,湿度55%±10%,光照12 h 黑暗交替,每笼6只,自由摄食饮水,常规饲养3 d后进行实验;银杏叶提取物 (金纳多,生产企业:Dr.Willmar Schwabe GmbH & Co. KG,批准文号:国药准字HJ20140768;每片含银杏叶提取物(GBE)40 mg,其中银杏黄酮苷9.6 mg,萜类内酯2.4 mg);黄精多糖 购自上海源叶生物科技有限公司(纯度70% 批号S27804);白介素-6(IL-6)、白介素-1β(IL-1β)、γ-氨基丁酸(GABA)、乙酰胆碱(Ach)试剂盒 均购自南京建成生物工程研究所。
5810R 高速冷冻离心机 德国 Eppendorf 公司;M1000 多功能酶标仪 瑞士 Tecan 公司;KSYY-I18S418M1滚筒式睡眠干扰仪、KSYY-OP- V4.0小鼠旷场实时检测分析系统、物体认知实验装置、KSYY -MWM- 4.0小鼠 Morris水迷宫实时在线检测系统、KSYY-AD-V4.0小鼠避暗实时检测分析系统 均由中国医学科学院药用植物研究所、中国航天员中心和北京康森益友科技有限公司联合研发。
1.2 实验方法
1.2.1 动物分组及给药
小鼠随机分成6组,空白组(蒸馏水)、模型组(蒸馏水)、阳性对照组(银杏叶提取物40 mg·kg−1)、黄精多糖低剂量组(100 mg·kg−1)、黄精多糖中剂量组(200 mg·kg−1)、黄精多糖高剂量组(400 mg·kg−1),每组12只;按小鼠体重给药,给药体积为0.1 ml·10 g−1,每天1次,共计46 d。
1.2.2 模型建立
本实验采用滚筒睡眠干扰仪[18]进行造模。动物采购后随机分组,动物房适应3 d,预防给药14 d,取隔音并且稳定的动物房和睡眠干扰室环境(温度:23~25℃,湿度:55%。12 h/12 h明暗周期),在睡眠干扰仪内水瓶装满饮用水、食物后,将除去空白对照组之外的动物放入睡眠干扰仪中,设置干扰参数:转速(1 r/min),旋转1圈休息2 min,随机方向转动。动物放入睡眠干扰仪内, 15~17 d每天3 h(每天固定相同时间段)适应3 d。适应期结束后,18~31 d按此前参数进行睡眠干扰14 d,适应及造模期间持续给药。
造模结束后,32 d起开始行为学检测,每日检测结束后立即将小鼠放回睡眠干扰仪内,直至46 d所有行为学检测结束后取材完成。
1.2.3 行为学检测
1.2.3.1 旷场实验
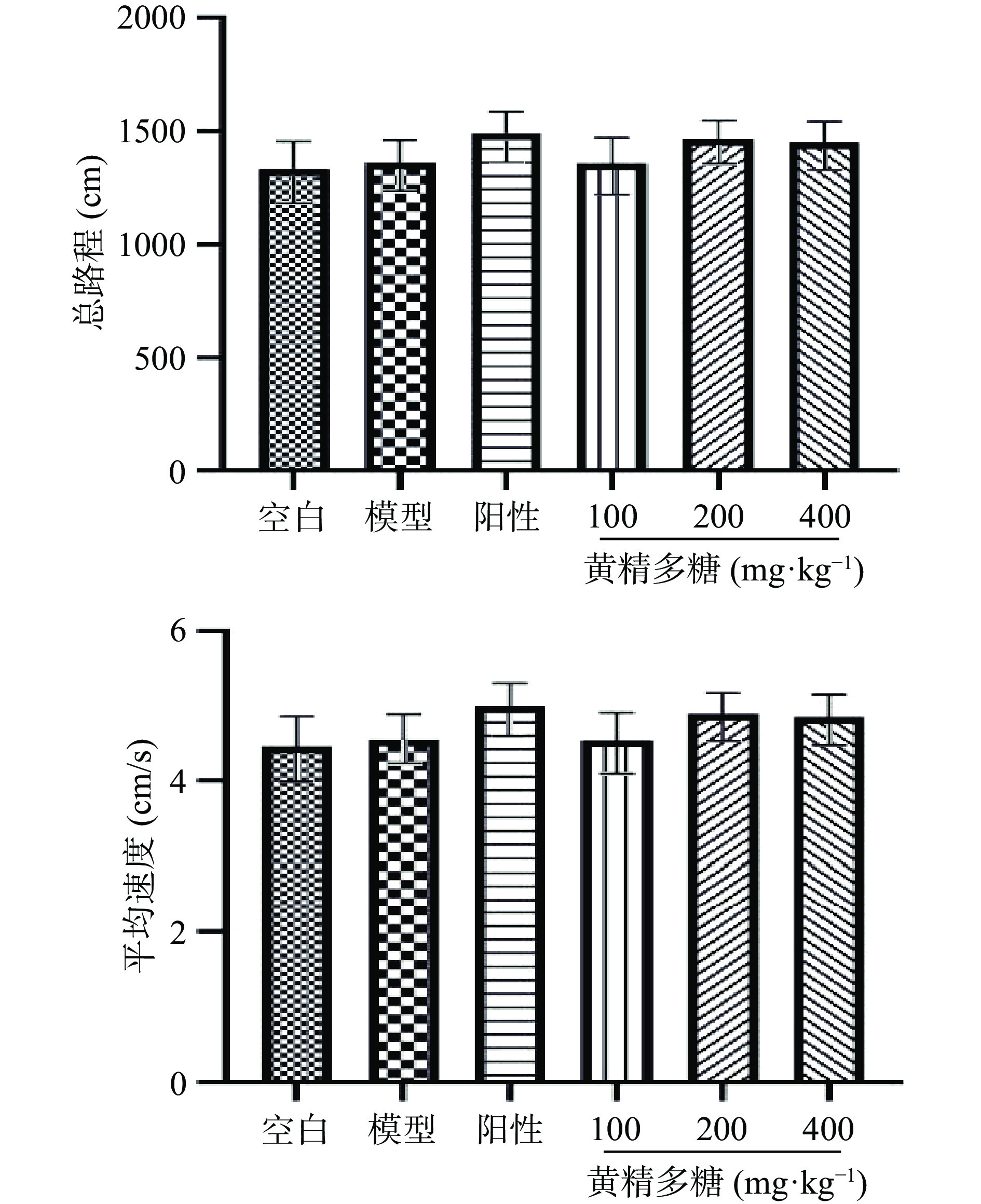
32 d进行旷场实验检测小鼠自主活动,查看造模方式和药物是否影响小鼠自主活动。给药30 min后,将小鼠至于旷场箱(40×40×35 cm)中央区,适应3 min后点击开始,记录小鼠5 min内的自主活动情况[19];检测结束后取总路程和平均速度作为主要评价指标。
1.2.3.2 物体认知实验
物体认知实验分为新物体识别和物体新位置识别两种实验模式,操作参照本实验室前期研究方法[20]。给药30 min后进行实验,33~35 d将小鼠背朝入口放入箱体内使其自由探索10 min以适应箱体环境,该过程历时3 d(适应期)。36 d进行新物体识别模式检测,将两个完全相同的物体放入测试箱内的固定位置,小鼠自由探索两物体5 min,然后将小鼠取出(熟悉期),使用酒精擦拭箱体及两物体以消除小鼠遗留的气味,30 min后将两物体中其中一个物体更换成新物体让小鼠再次探索5 min(测试期),分别记录熟悉期和测试期5 min内小鼠对各物体探索时长;37 d进行物体新位置识别模式检测(熟悉期相同,测试期更换其中一个物体位置,另一个物体保持不变)。评价指标采用相对辨别指数(DI):DI=(Tn−Tf)/(Tn+Tf)
Tn 和Tf 分别表示 5 min 内小鼠对“新旧”物体(或位置)的探索时间
1.2.3.3 避暗实验
38~39 d避暗实验流程参照文献进行[21]。避暗实验分为获得和巩固两个阶段,检测小鼠短时学习记忆能力;获得阶段于38 d给药30 min后小鼠足部沾取生理盐水,背朝入口,由明室放入,适应3 min后,在小鼠进入暗室时给予0.5 mA(5 s)电击,学习5 min后取出。巩固阶段于39 d 给药30 min后小鼠足部沾取生理盐水,同样方式放入后立即点击开始,激活暗室电流,记录小鼠从放入到第一次进入暗室时间以及错误次数。
1.2.3.4 Morris水迷宫实验
40~45 d实验流程参照文献进行[22],检测小鼠长时空间记忆能力。实验分为定位航行(5 d)和空间探索阶段(1 d)。定位航行实验,每只每日以不同象限为入水点学习2次,给药30 min后进行实验,圆柱形平台固定一位置放入,水面没过其1~1.5 cm,入水前后均放在平台停留10 s,给予其90 s寻找平台。系统记录小鼠寻台时间作为评价指标。空间探索阶段,将平台撤去,系统记录小鼠90 s内穿台次数。
1.2.4 小鼠血液与海马组织样本的采集
行为学检测结束后,46 d给药30 min后小鼠进行眼眶取血,脱颈处死后,低温剥离小鼠海马组织;全血4 ℃静置2 h后,4 ℃离心,分离血清备用;血清和海马均至于−80 ℃冰箱。
1.2.5 促炎因子及神经递质水平检测
采用ELISA试剂盒检测血清和海马中促炎细胞因子白介素IL-6、IL-1β含量,海马内神经递质γ-氨基丁酸(GABA)和乙酰胆碱(Ach)水平,按照说明书进行。
1.3 数据处理
采用SPSS24.0软件进行统计分析,实验结果用平均值±标准误(Mean±SEM)表示。数据采用单因素方差分析(One-way ANOVA),不满足正态分布的数据采用非参数检验,组间差异进行LSD分析比较。分析结果用GraphPad Prism software8.01软件绘制图表,P<0.05时表示有显著性差异。
2. 结果与分析
2.1 黄精多糖对睡眠干扰模型小鼠自主活动的影响
如图1旷场实验结果所示,与空白组相比,模型组小鼠总路程和平均速度未出现显著性(P>0.05),表明此睡眠干扰造模方式并不影响小鼠自主活动。与模型组相比,阳性对照组及黄精多糖各剂量组总路程及平均速度虽增加但未出现显著性差异(P>0.05),表明各给药组无异常兴奋或抑制等神经毒副作用。
2.2 黄精多糖对睡眠干扰模型小鼠物体认知的影响
2.2.1 黄精多糖对睡眠干扰模型小鼠新物体识别能力的影响
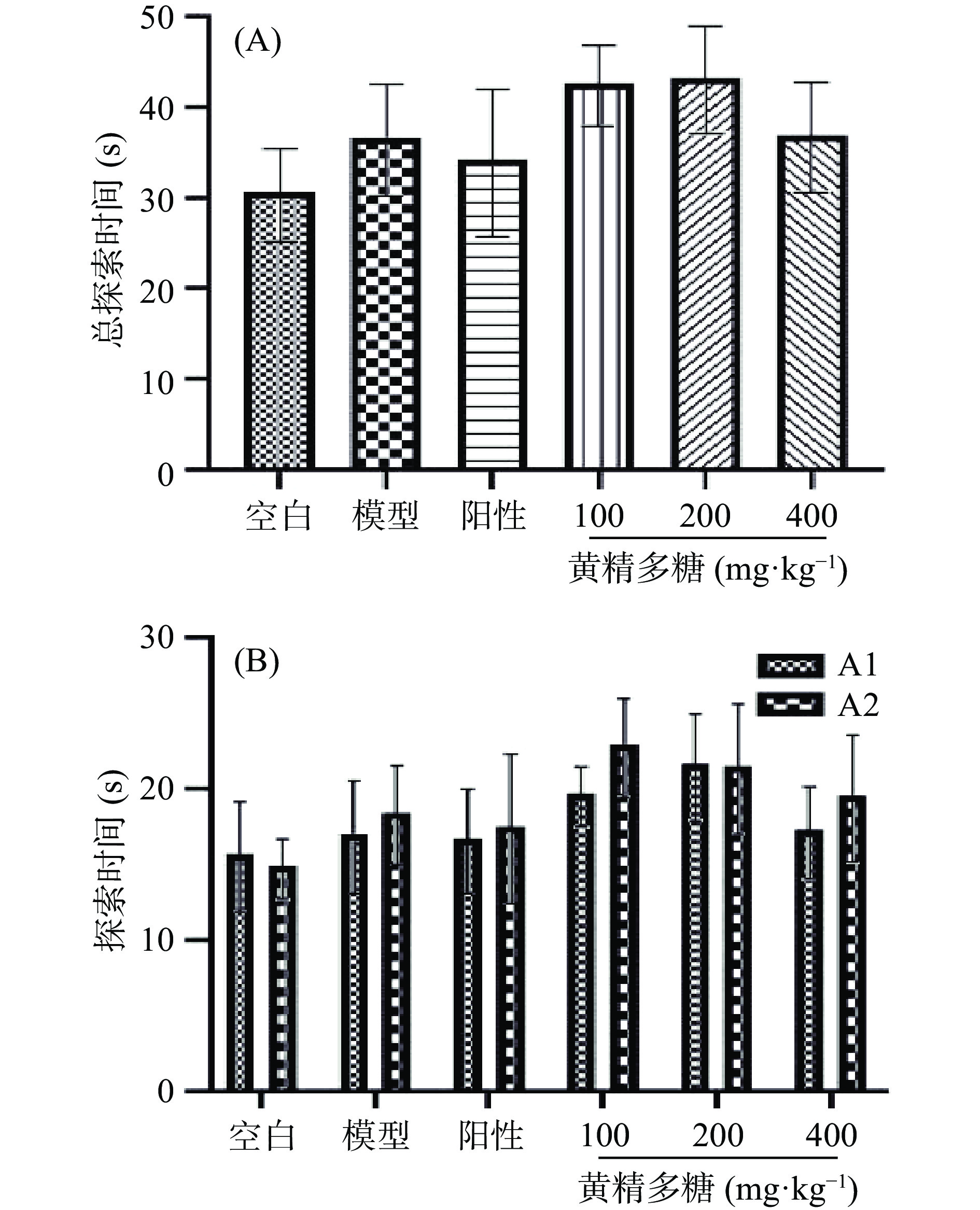
如图2(A)所示,各组小鼠熟悉期总探索时间未出现显著性差异(P>0.05),说明各组小鼠的探索能力处于同一水平。图2(B)显示,各组小鼠对于实验中相同的两个物体(分别标记为A1、A2)分别探索时间也无显著差异(P>0.05),说明小鼠未对任何一方有偏好。
![]() 图 2 黄精多糖对睡眠干扰模型小鼠新物体识别实验中熟悉期探索时间的影响注:Mean±SEM,n=10~12;(A)表示总探索时间;(B)表示对A1、A2两物体分别探索时间;图4同。Figure 2. Effects of PSP on the exploration ability of SI mice in the familiarization phase of the novel object recognition task
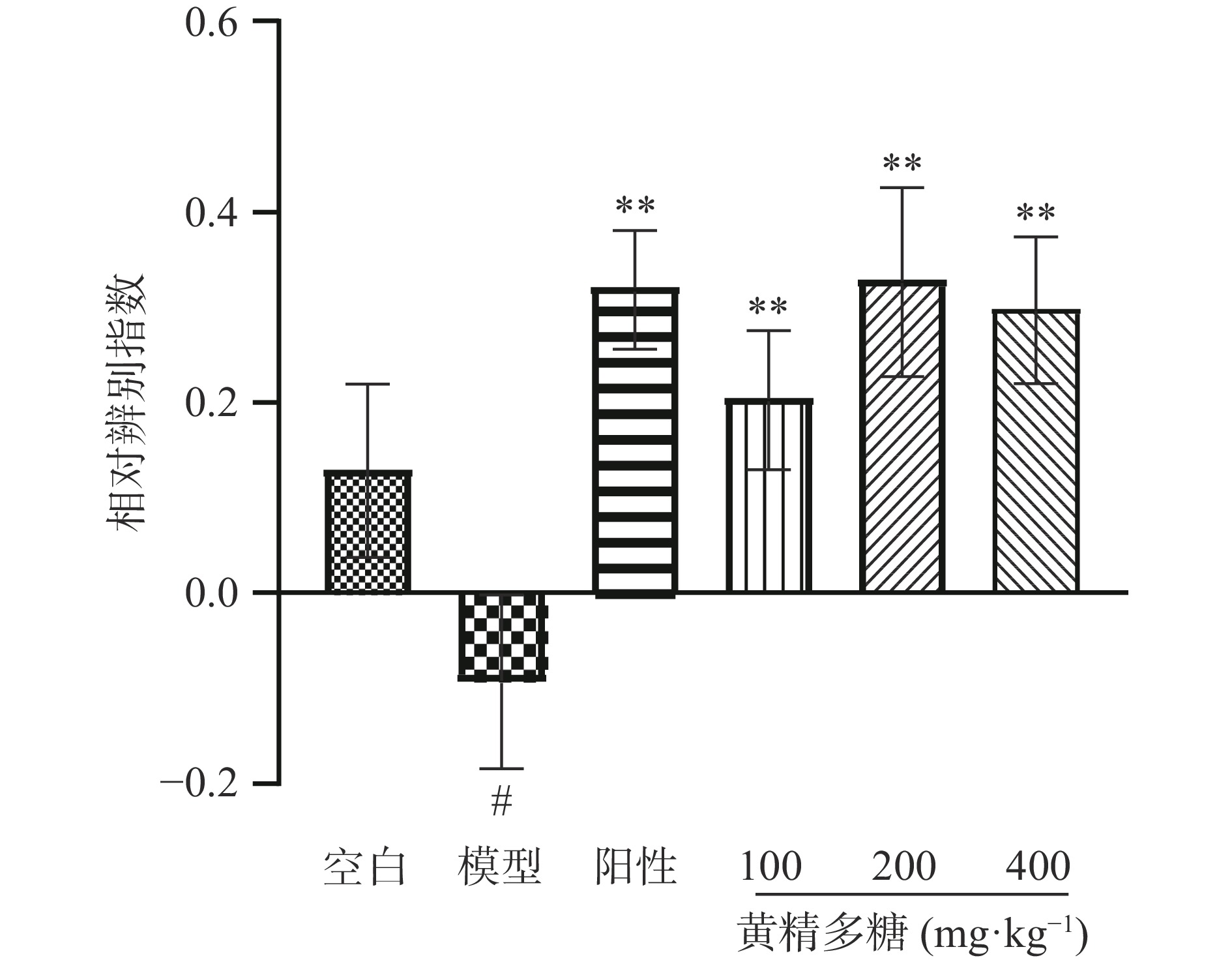
图 2 黄精多糖对睡眠干扰模型小鼠新物体识别实验中熟悉期探索时间的影响注:Mean±SEM,n=10~12;(A)表示总探索时间;(B)表示对A1、A2两物体分别探索时间;图4同。Figure 2. Effects of PSP on the exploration ability of SI mice in the familiarization phase of the novel object recognition task图3给出了黄精多糖对睡眠干扰小鼠新物体识别相对辨别指数(DI)的影响。与空白组相比,模型组DI显著降低(P<0.05),说明模型组小鼠已无法正确辨别新旧物体;与模型组相比,黄精多糖各剂量组小鼠DI均显著增加(P<0.05,P<0.01),说明各给药组均能识别出新物体,且对新物体更具探索兴趣。
2.2.2 黄精多糖对睡眠干扰模型小鼠物体位置识别能力的影响
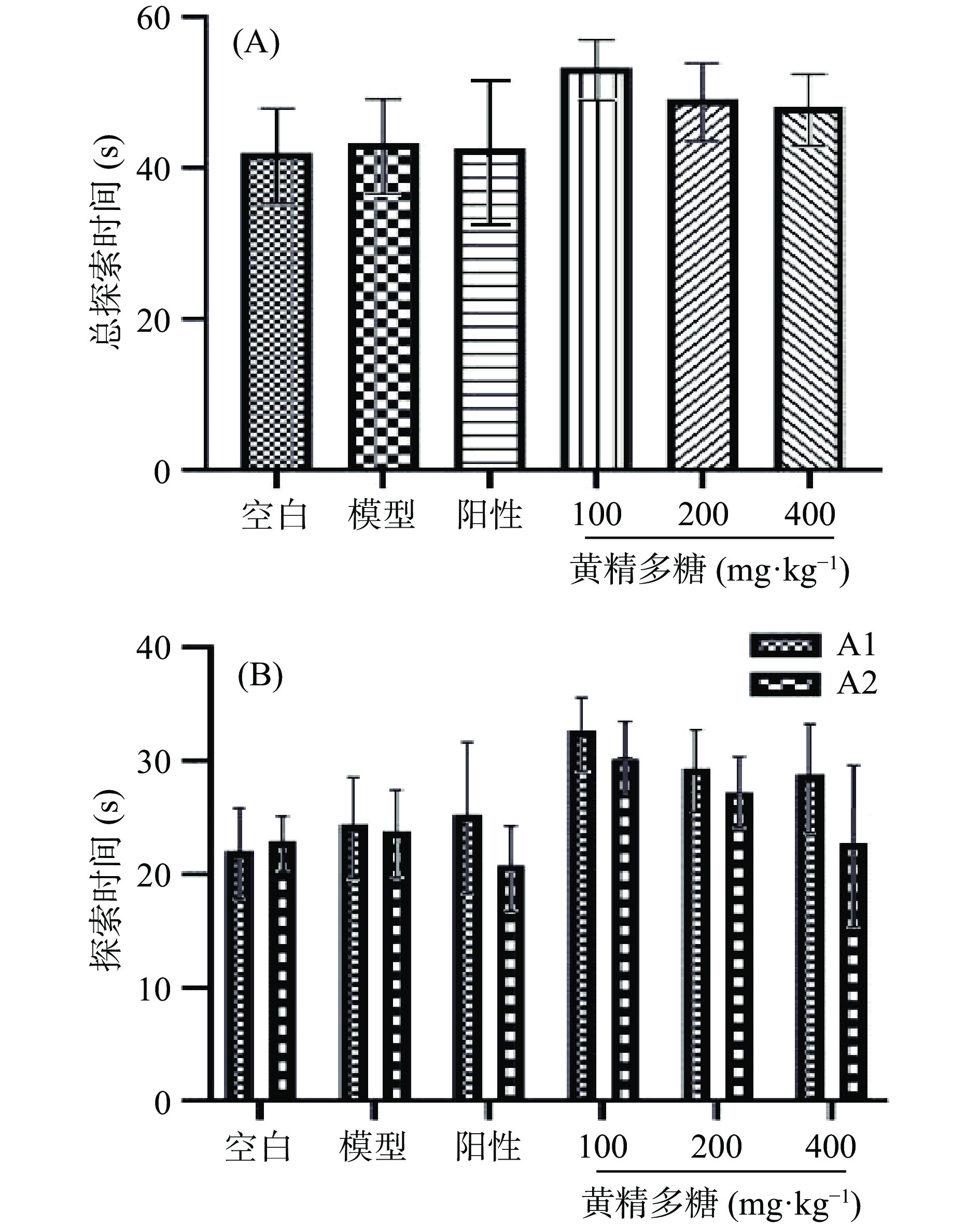
如图4所示,与新物体识别熟悉期相同,熟悉期各组小鼠对两物体的总探索时间及两物体分别探索时间均未出现显著性差异(P>0.05),说明各组小鼠的探索能力处于同一水平,且无位置偏好。
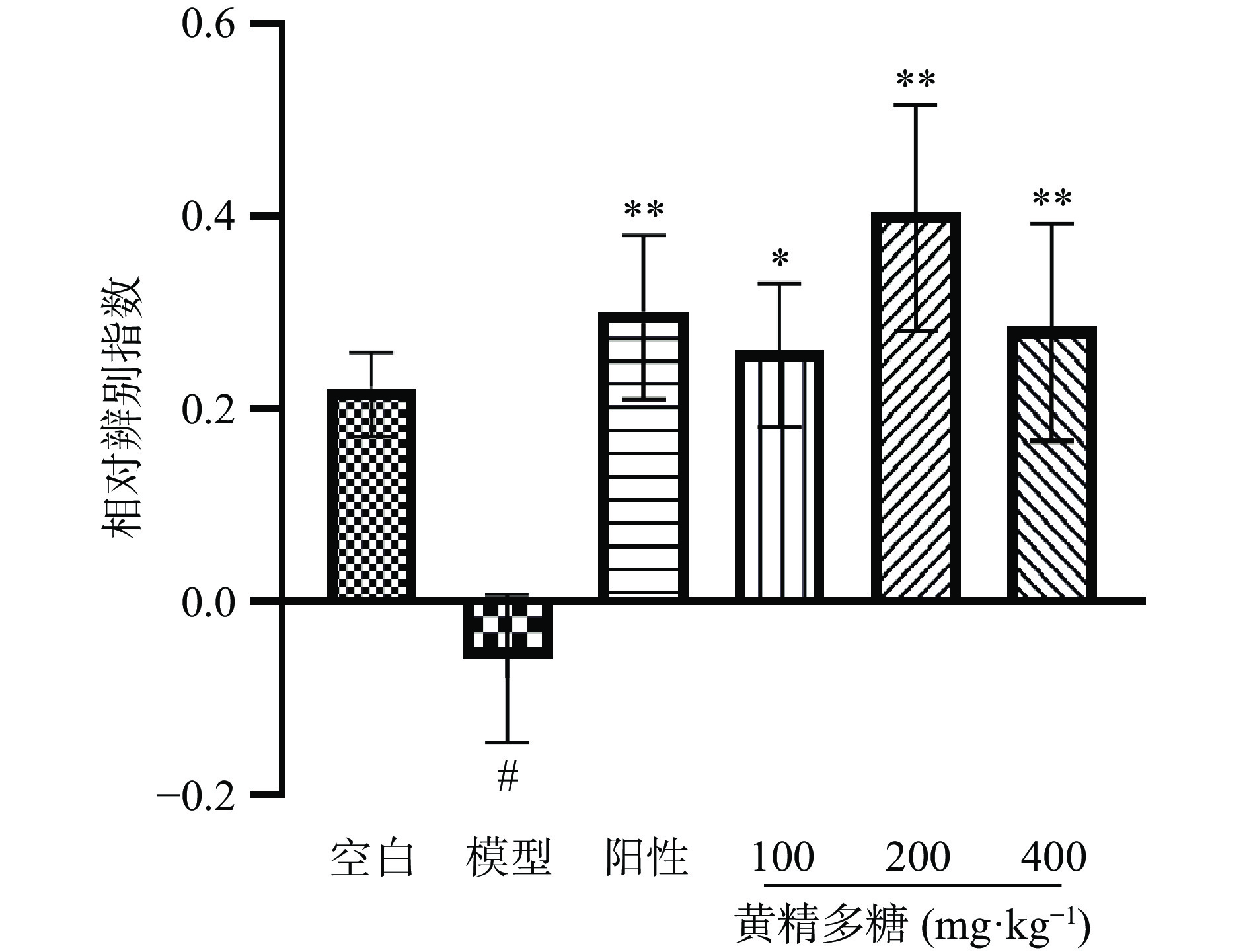
图5给出了黄精多糖对睡眠干扰小鼠物体位置识别相对辨别指数(DI)的影响。与空白组相比,模型组DI显著性降低(P<0.05);与模型组相比,阳性对照组及黄精多糖各剂量组小鼠的DI显著升高(P<0.01),表明黄精多糖能提高小鼠短时空间记忆能力。
2.3 黄精多糖对睡眠干扰模型小鼠避暗实验的影响
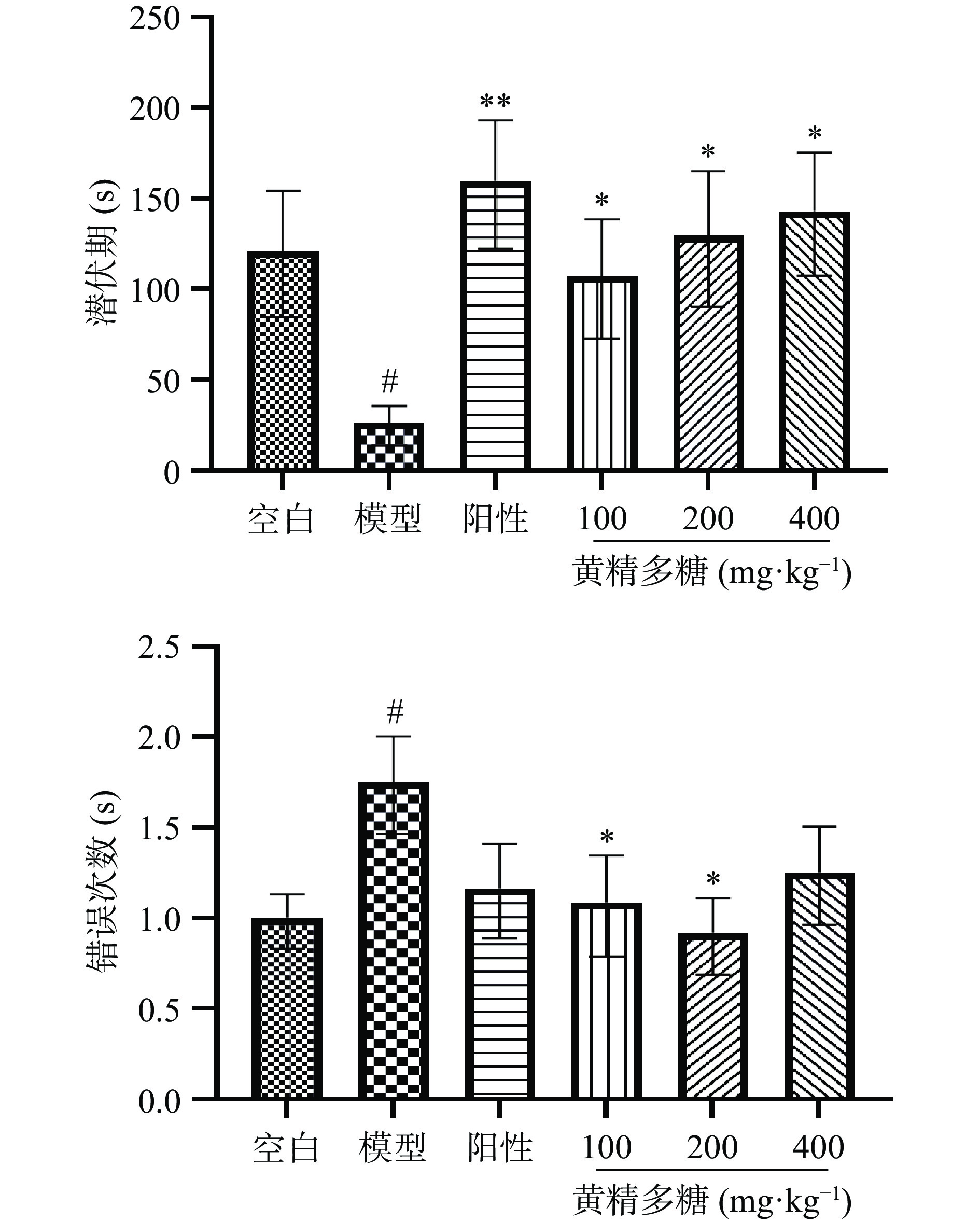
如图6避暗实验结果所示,与空白组相比,模型组错误次数显著升高,入暗潜伏期显著降低(P<0.05),说明睡眠干扰模型组小鼠记忆受到损伤。与模型组相比,黄精多糖(100、200 mg∙kg−1)组错误次数显著降低(P<0.05),入暗潜伏期显著增加(P<0.05,P<0.01),说明给药后模型小鼠记忆能力得到改善。
2.4 黄精多糖对睡眠干扰模型小鼠水迷宫实验的影响
如表1所示,小鼠在水迷宫定位航行阶段寻台潜伏期结果显示,与空白组相比,模型组小鼠寻台潜伏期逐渐增加,并在4、5 d时寻台潜伏期呈现显著差异(P<0.05);与模型组相比,4、5 d阳性对照组潜伏期显著下降(P<0.05,P<0.01),黄精多糖(100、200 mg∙kg−1)组的潜伏期也显著下降(P<0.01,P<0.001);说明睡眠干扰对小鼠空间记忆造成了损伤,而各给药组可不同程度改善此造模方式带来的记忆伤害。
表 1 黄精多糖对睡眠干扰模型小鼠水迷宫定位航行寻台潜伏期的影响Table 1. Effects of PSP on escape latency in Morris water maze task of mice induced by SI组别 潜伏期(s) D1 D2 D3 D4 D5 空白组 89.53±0.07 84.17±3.78 77.74±5.50 64.23±6.99 50.82±7.07 模型组 89.54±0.05 85.57±2.81 80.91±4.79 83.39±4.19# 72.79±6.59# 阳性对照组 40 mg·kg−1 88.97±0.37 88.00±1.11 69.95±6.21 50.91±7.59** 47.76±6.55* 黄精多糖 100 mg·kg−1 86.27±3.16 82.23±4.23 77.56±5.27 62.24±7.25* 42.04±6.95** 黄精多糖 200 mg·kg−1 89.46±0.04 80.47±5.08 69.75±6.39 46.79±7.15*** 26.22±5.96*** 黄精多糖 400 mg·kg−1 89.58±0.06 83.94±3.96 80.76±4.17 67.79±6.81 55.03±7.39 注:Mean±SEM,n=10~12;与空白组比较,#表示具有显著性差异,P<0.05;与模型组比较,*表示具有显著性差异,P<0.05,**表示具有极显著差异,P<0.01;***表示具有极显著性差异,P<0.001。 2.5 黄精多糖对睡眠干扰模型小鼠血清、海马炎性细胞因子的影响
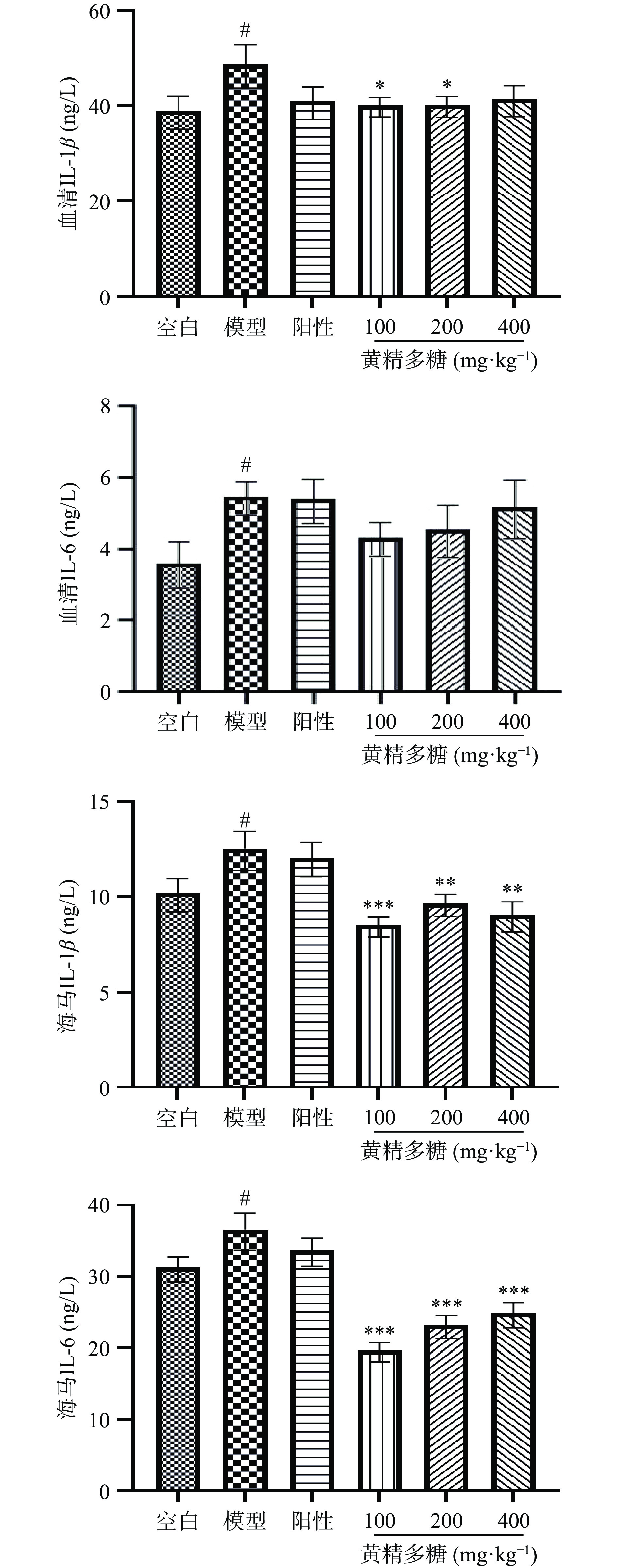
如图7所示,与空白组相比,模型小鼠血清和海马中促炎细胞因子IL-Iβ、IL-6水平均显著升高;与模型组相比,黄精多糖(100、200 mg·kg−1)给药组小鼠血清中促炎因子IL-β含量降低(P<0.05),而血清中IL-6含量呈降低趋势;海马内促炎因子IL-1β,IL-6均显著降低(P<0.01,P<0.001)。黄精多糖对小鼠血清与海马中促炎因子的改善作用存在差异,可能是药物作用部位的强度不同。
2.6 黄精多糖对睡眠干扰模型小鼠海马神经递质的影响
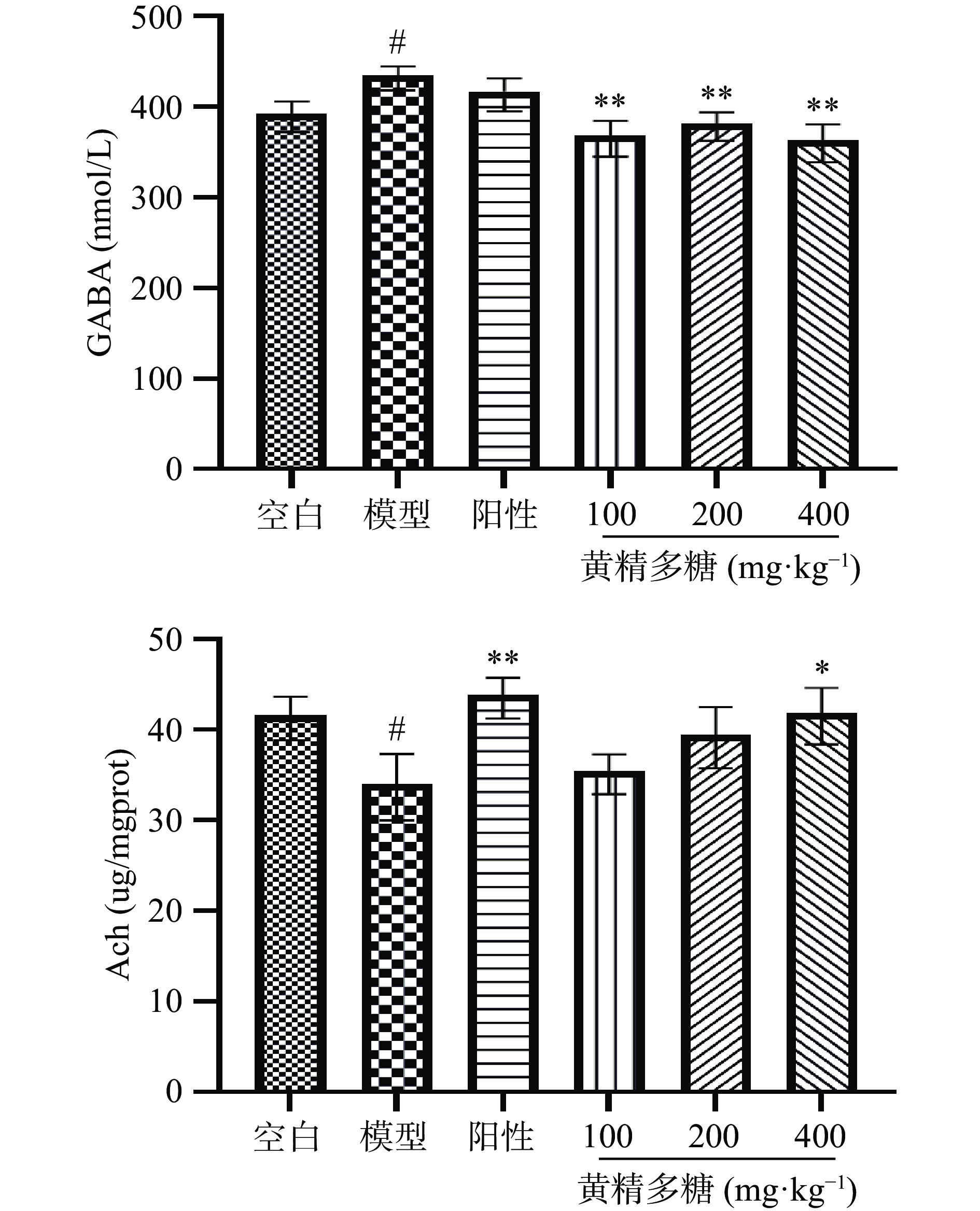
如图8所示,与空白组相比,模型组小鼠海马组织内GABA水平显著增加(P<0.05),Ach水平显著降低(P<0.05);与模型组相比,黄精多糖各剂量组给药后小鼠海马内GABA呈显著降低(P<0.01),Ach呈增加趋势,其中黄精多糖(400 mg·kg−1)出现显著性差异(P<0.05)。
3. 结论与讨论
本实验通过旷场、物体认知、避暗、水迷宫四个行为学实验来评价睡眠干扰和黄精多糖干预对小鼠认知功能的影响。本实验中旷场实验结果显示,各组小鼠自主活动处于同一水平,表明造模及给药并未影响小鼠正常活动,这与黄红等[23]探讨睡眠干扰诱导的学习记忆障碍研究中的旷场实验结果一致;物体认知实验结果表明,与模型组相比,黄精多糖各剂量组对物体认知实验中小鼠新旧物体、物体位置的识别能力有明显提高作用,这与Lueptow等[24]探讨的小鼠学习记忆功能在新物体识别检测中的表现结果类似,同时与陈耀辉等[25]在探讨黄精相关复方对AD大鼠学习记忆损伤时的新物体识别检测结果一致;在小鼠短时(避暗)、长时(水迷宫)记忆检测实验中,黄精多糖各剂量组能明显增加小鼠避暗潜伏期、降低错误次数,降低水迷宫寻台潜伏期,这与刘露露等[17]探讨黄精多糖对D-半乳糖致小鼠学习记忆损伤的研究中避暗、水迷宫结果类似。以上结果说明,黄精多糖干预可有效改善睡眠干扰致认知功能损伤。
睡眠不足引起的认知障碍和炎症因子、神经递质密切相关,炎症被认为是学习记忆损伤潜在的机制[26],睡眠不足会激活促炎因子IL-1β、IL-6的表达引起炎症反应,导致细胞凋亡与免疫损伤进而影响认知功能[27-28]。Ach是中枢神经系统功能、调节睡眠和多种认知过程所必需的递质[29-30],GABA为脑内重要的神经递质,与记忆、睡眠等息息相关[31-32],脑内Ach的异常下降和GABA的异常增高会导致学习记忆下降[33-34]。本实验结果中,与模型组相比,黄精多糖各剂量组干预后能够显著降低模型小鼠血清和海马内促炎细胞因子IL-1β、IL-6水平,降低海马组织内神经递质GABA水平,升高Ach水平。由此推测黄精多糖改善睡眠干扰小鼠认知功能损伤作用可能是通过抑制促炎性因子水平和调节脑内神经递质发挥作用。
综上所述,黄精多糖可防治睡眠干扰所致认知功能损伤,主要表现在黄精多糖可提高认知功能损伤小鼠的短时非空间记忆能力(新物体识别)、短时空间记忆能力(物体位置识别)、长时空间学习能力(水迷宫)以及被动逃避记忆能力(避暗),其机制可能是通过调节血清和海马内促炎细胞因子水平和海马内神经递质水平。本研究结果可为黄精多糖神经保护作用的深入挖掘提、为黄精的精深加工利用提供一定的参考。
-
图 2 黄精多糖对睡眠干扰模型小鼠新物体识别实验中熟悉期探索时间的影响
注:Mean±SEM,n=10~12;(A)表示总探索时间;(B)表示对A1、A2两物体分别探索时间;图4同。
Figure 2. Effects of PSP on the exploration ability of SI mice in the familiarization phase of the novel object recognition task
表 1 黄精多糖对睡眠干扰模型小鼠水迷宫定位航行寻台潜伏期的影响
Table 1 Effects of PSP on escape latency in Morris water maze task of mice induced by SI
组别 潜伏期(s) D1 D2 D3 D4 D5 空白组 89.53±0.07 84.17±3.78 77.74±5.50 64.23±6.99 50.82±7.07 模型组 89.54±0.05 85.57±2.81 80.91±4.79 83.39±4.19# 72.79±6.59# 阳性对照组 40 mg·kg−1 88.97±0.37 88.00±1.11 69.95±6.21 50.91±7.59** 47.76±6.55* 黄精多糖 100 mg·kg−1 86.27±3.16 82.23±4.23 77.56±5.27 62.24±7.25* 42.04±6.95** 黄精多糖 200 mg·kg−1 89.46±0.04 80.47±5.08 69.75±6.39 46.79±7.15*** 26.22±5.96*** 黄精多糖 400 mg·kg−1 89.58±0.06 83.94±3.96 80.76±4.17 67.79±6.81 55.03±7.39 注:Mean±SEM,n=10~12;与空白组比较,#表示具有显著性差异,P<0.05;与模型组比较,*表示具有显著性差异,P<0.05,**表示具有极显著差异,P<0.01;***表示具有极显著性差异,P<0.001。 -
[1] WU H, DUNNETT S, HO Y S, et al. The role of sleep deprivation and circadian rhythm disruption as risk factors of Alzheimer's disease[J]. Front Neuroendocrinol,2019,54:100764. doi: 10.1016/j.yfrne.2019.100764
[2] XUE R, WAN Y, SUN X, et al. Nicotinic mitigation of neuroinflammation and oxidative stress after chronic sleep deprivation[J]. Front Immunol,2019,10:2546. doi: 10.3389/fimmu.2019.02546
[3] 陈辉, 冯珊珊, 孙彦君, 等. 3种药用黄精的化学成分及药理活性研究进展[J]. 中草药,2015,46(15):2329−2338. [CHEN H, FEN S S, SUN Y J, et al. Advances in studies on chemical constituents of three medicinal plants from Polygonatum Mill. and their pharmacological activities[J]. Chin Tradit Herbal Drugs,2015,46(15):2329−2338. doi: 10.7501/j.issn.0253-2670.2015.15.025 [4] 韦震, 宋洪波, 安凤平, 等. 黄精多糖对急性抑郁小鼠模型的改善作用及机制[J]. 食品工业科技,2022,43(6):351−357. [WEI Z, SONG H B, AN F P, et al. Protective effects and mechanism of polysaccharide from Polygonati rhizoma on behavioral despair mice[J]. Science and Technology of Food Industry,2022,43(6):351−357. [5] LONG T, LIU Z, SHANG J, et al. Polygonatum sibiricum polysaccharides play anti-cancer effect through TLR4-MAPK/NF-κB signaling pathways[J]. Int J Biol Macromol,2018,111:813−821. doi: 10.1016/j.ijbiomac.2018.01.070
[6] 陈毅飞, 刘凯菲, 吴世敏, 等. 黄精多糖对阿尔茨海默病模型斑马鱼p38MAPK/N-cadherin的影响[J]. 中国药理学与毒理学杂志,2021,35(9):659−660. [CHEN Y F, LIU K F, WU S M, et, al. Effect of polysaccharide from Polygonati rhizoma on p38MAPK/N-cadherin in zebrafish model of Alzheimer's disease[J]. Chin J Pharmacol Toxicol,2021,35(9):659−660. [7] ZHANG Z, YANG B, HUANG J, et al. Identification of the protective effect of Polygonatum sibiricum polysaccharide on d-galactose-induced brain ageing in mice by the systematic characterization of a circular RNA-associated ceRNA network[J]. Pharm Biol,2021,59(1):347−366.
[8] 易玉新, 吴石星, 叶茂盛, 等. Aβ_(1~42)海马注射致大鼠海马细胞凋亡作用及黄精多糖干预的作用[J]. 中国老年学杂志,2015,35(4):1044−1045. [YI Y X, WU X S, YE M S, et al. Effect of polygonatum polysaccharide on hippocampal cell apoptosis induced by Aβ_(1-42) hippocampal injection in rats[J]. Chinese Journal of Gerontology,2015,35(4):1044−1045. [9] 王威, 刘文博, 唐伟, 等. 黄精多糖对慢性脑缺血大鼠学习记忆及脑组织β-淀粉样蛋白表达的影响[J]. 中医药导报,2016,22(16):26−29. [WANG W, LIU W B, TANG W, et al. Effects of polygonatum polysaccharides onlearning and memory and β-amyloid in brain of rats with chronic cerebral ischemia[J]. Guiding J Tradit Chin Med Pharma,2016,22(16):26−29. doi: 10.13862/j.cnki.cn43-1446/r.2016.16.010 [10] 钱红月, 肖移生. 黄精防治神经系统类疾病的研究进展[J]. 中药药理与临床,2021,37(6):236−240. [QIAN J Y, XIAO Y S. Research progress on anti-lung cancer mechanism of quercetin and its derivatives[J]. Pharmacology and Clinics of Chinese Materia Medica,2021,37(6):236−240. [11] 张续蓝. 基于BDNF-TrkB信号途径探讨黄精改善自然衰老大鼠认知功能障碍的作用[D] 宜昌: 三峡大学, 2021. ZHANG X L. Polygonatum sibiricum improved cognitive impariment of natural aging rats through BDNF-TrkB signaling pathway[J]. Yichang: China three goroes University, 2021.
[12] 未小明. 黄精对血管痴呆模型大鼠认知功能的保护作用及机制的研究[J]. 中医临床研究,2020,12(19):1−4. [WEI X M. Protective effects and mechanism of Polygonatum sibiricum on the cognitive function in VD model rats[J]. Clinical Journal of Chinese Medicine,2020,12(19):1−4. [13] 陆连第, 段伟松, 赵玉, 等. 黄精多糖对血管性痴呆模型大鼠干预作用的实验研究[J]. 中药材,2018,41(9):2212−2215. [LU L D, DUAN W S, ZHAO Y, et al. Intervention effect of Polygonatum sibiricum on a rat model of vascular dementia: An experimental study[J]. Journal of Chinese Medicinal Materials,2018,41(9):2212−2215. [14] 焦劼, 陈黎明, 孙瑞泽, 等. 不同产地黄精主要化学成分比较及主成分分析[J]. 中药材,2016,39(3):519−522. [JIAO J, CHEN L M, SUN R Z, et al. The main chemical constituents comparison and analysis of polygonatum from different producing areas[J]. Journal of Chinese Medicinal Materials,2016,39(3):519−522. [15] 唐伟, 王威, 谭丽阳, 等. 黄精多糖对慢性脑缺血大鼠学习记忆能力及脑组织超微结构影响[J]. 中国中医药科技,2017,24(2):173−176. [TANG W, WANG W, TANG L Y, et al. Effects of polygonatum polysaccharides on learning and memory and ultrastructure changes of brain tissue in rats with chroniccerebral ischemia[J]. Chin J Tradit Medl Sci Technol,2017,24(2):173−176. [16] 张峰, 张继国, 王丽华, 等. 黄精多糖对东莨菪碱致小鼠记忆获得障碍的改善作用[J]. 现代中西医结合杂志,2007(36):5410−5412. [ZHANG F, ZHANG J G, WANG L H, et al. Effects of Polygonatum sibiricum polysaccharide on mice with learning and memory acquisition impairment induced by scopolamine[J]. Modern Journal of Integ rated Traditional Chinese and Western Medicine,2007(36):5410−5412. doi: 10.3969/j.issn.1008-8849.2007.36.007 [17] 刘露露, 李洪宇, 苑广信. 黄精多糖对D-半乳糖诱导衰老小鼠学习和记忆水平的影响[J]. 北华大学学报(自然科学版),2021,22(2):192−197. [LIU L L, LI H Y, YUAN G X. Effect of polygonatum sibiricum polysaccharides on learning and memory in D-galactose-induced aging mice[J]. J Beihua Univ (Nat Sci),2021,22(2):192−197. [18] LU C, WANG Y, LÜ J, et al. Ginsenoside Rh2 reverses sleep deprivation-induced cognitive deficit in mice[J]. Behav Brain Res,2018,349:109−115. doi: 10.1016/j.bbr.2018.03.005
[19] 王琼, 买文丽, 李翊华, 等. 自主活动实时测试分析处理系统的建立与开心散安神镇静作用验证[J]. 中草药,2009,40(11):1773−1779. [WANG Q, MAI W L, LI X H, et al. Establishment of compute-based image-processing system for animals locomotor activity and verification by Kaixin powder[J]. Chin Tradit Herbal Drugs,2009,40(11):1773−1779. doi: 10.3321/j.issn:0253-2670.2009.11.027 [20] 吕静薇, 宋广青, 董黎明, 等. 物体认知——基于动物自发行为的一种学习记忆评价方法的研究[J]. 中国比较医学杂志,2018,28(3):21−27. [LÜ J W, SONG G Q, DONG L M, et al. Object recognition test—a method to assess the learning and memory in mice based on their spontaneous behavior[J]. Chin J Comp Med,2018,28(3):21−27. doi: 10.3969/j.issn.1671-7856.2018.03.004 [21] LU C, GAO R, LV J, et al. Neuroprotective effects of soy isoflavones on chronic ethanol-induced dementia in male ICR mice[J]. Food Funct,2020,11(11):10011−10021. doi: 10.1039/D0FO02042G
[22] VORHEES C V, WILLIAMS M T. Morris water maze: Procedures for assessing spatial and related forms of learning and memory[J]. Nat Protoc,2006,1(2):848−858. doi: 10.1038/nprot.2006.116
[23] 黄红, 陈碧清, 姜宁, 等. 鲜天麻对睡眠干扰诱导小鼠学习记忆障碍的改善作用[J]. 中草药,2020,51(9):2509−2516. [HUANG H, CHEN B Q, JIANG N, et al. Fresh Gastrodia elata ameliorates learning and memory impairments in sleep interruption induced mice[J]. Chin Tradit Herbal Drugs,2020,51(9):2509−2516. [24] LUEPTOW L M. Novel object recognition test for the investigation of learning and memory in mice[J]. J Vis Exp,2017(126).
[25] 陈耀辉, 燕波, 官扬, 等. 二精丸对去卵巢+D-半乳糖联合Aβ_(1-40)致肾阴虚AD大鼠学习记忆能力的影响[J]. 中药新药与临床药理,2019,30(12):1421−1427. [CHEN Y H, YAN B, GUAN Y, et al. Effect of erjing pills on learning and memory abilities of AD rats with kidney yin deficiency induced by ovariectomy+D-galactose combined with Aβ1-40[J]. Traditional Chinese Drug Research & Clinical Pharmacology,2019,30(12):1421−1427. doi: 10.19378/j.issn.1003-9783.2019.12.003 [26] ATROOZ F, LIU H, KOCHI C, et al. Early life sleep deprivation: Role of oxido-inflammatory processes[J]. Neuroscience,2019,406:22−37. doi: 10.1016/j.neuroscience.2019.02.021
[27] TARKOWSKI E, BLENNOW K, WALLIN A, et al. Intracerebral production of tumor necrosis factor-alpha, a local neuroprotective agent, in Alzheimer disease and vascular dementia[J]. J Clin Immunol,1999,19(4):223−230. doi: 10.1023/A:1020568013953
[28] CHEN YG. Research progress in the pathogenesis of Alzheimer's disease[J]. Chin Med J (Engl),2018,131(13):1618−1624. doi: 10.4103/0366-6999.235112
[29] IKONOMOVIC M D, WECKER L, ABRAHAMSON E E, et al. Cortical alpha7 nicotinic acetylcholine receptor and beta-amyloid levels in early Alzheimer disease[J]. Arch Neurol,2009,66(5):646−651.
[30] EHRET M J, CHAMBERLIN K W. Current practices in the treatment of Alzheimer disease: Where is the evidence after the phase III trials?[J]. Clin Ther,2015,37(8):1604−1616. doi: 10.1016/j.clinthera.2015.05.510
[31] KIM S, JO K, HONG K B, et al. GABA and l-theanine mixture decreases sleep latency and improves NREM sleep[J]. Pharm Biol,2019,57(1):65−73.
[32] ZHU S, NOVIELLO C M, TENG J, et al. Structure of a human synaptic GABA(A) receptor[J]. Nature,2018,559(7712):67−72. doi: 10.1038/s41586-018-0255-3
[33] ODA Y. Choline acetyltransferase: The structure, distribution and pathologic changes in the central nervous system[J]. Pathol Int,1999,49(11):921−937. doi: 10.1046/j.1440-1827.1999.00977.x
[34] 李连娥, 唐涛, 李亚国, 等. 阿尔茨海默病和衰老中γ-氨基丁酸系统与学习记忆关系的研究进展[J]. 昆明理工大学学报(自然科学版),2017,42(6):81−85. [LI L E, TSNG T, LI Y G, et al. Research progress of the relationship between γ-aminobutyric acid system and learning memory in Alzheimer's disease and aging[J]. Journal of Kunming University of Science and Technology (Natural Science Edition),2017,42(6):81−85. doi: 10.16112/j.cnki.53-1223/n.2017.06.013





 下载:
下载:
 下载:
下载:
