Study on the Preparation of W/O/W Emulsion Based on Three Polysaccharides Mixed with Casein and Its Encapsulation Effect of Salidroside
-
摘要: 为提高红景天苷稳定性及口服吸收效果,本研究以红景天苷为内水相,含聚甘油蓖麻醇酯的菜籽油为油相,分别采用葡聚糖、壳聚糖和大豆多糖混合酪蛋白作为外水相,制备W/O/W型多重乳液。研究了不同浓度的三种多糖对多重乳液的微观结构、粒径、电位、贮藏稳定性、乳化性、包埋率、载药量和体外消化过程的影响。结果显示,相比于酪蛋白对照组、壳聚糖-酪蛋白组和大豆多糖-酪蛋白组,葡聚糖-酪蛋白W/O/W型多重乳液稳定性最好。高浓度的葡聚糖能够明显提升葡聚糖-酪蛋白多重乳液的贮藏稳定性,当葡聚糖添加量为1.2%时,多重乳液平均粒径最小,可达623.03±5.21 nm(P<0.05);电位绝对值最高(P<0.05),平均电位为−37.3±0.46 mV;对酪蛋白乳化性质提升最大(P<0.05);对红景天苷的包埋率最高(P<0.05),可达92.8%,载药量为162.89±4.21 μg/g。模拟消化研究发现葡聚糖-酪蛋白多重乳液不仅能有效地保护红景天苷,还能够靶向地在模拟肠道内传递和释放,葡聚糖添加量为1.2%的葡聚糖-酪蛋白负载体系的稳定性和控释效果最佳。该研究结果可为红景天苷在食品和医药中的应用提供理论支撑。
-
关键词:
- 红景天苷 /
- W/O/W型多重乳液 /
- 稳定性 /
- 控制释放 /
- 体外消化
Abstract: To improve the stability and oral absorption effect of salidroside, W/O/W multiple emulsion was prepared with salidroside as the internal aqueous phase and rapeseed oil containing polyglycerol polyricinoleate as the oil phase, and dextran, chitosan and soybean polysaccharide mixed casein as the external aqueous phase. The effects of three polysaccharides with different concentrations on the microstructure, particle size, potential, storage stability, surface hydrophobicity, emulsifying property, embedding rate, drug loading, and in vitro digestion of multiple emulsions were studied. The results showed that compared with the casein control group, chitosan-casein group, and soybean polysaccharide-casein group, dextran-casein W/O/W multiple emulsion had the best stability. A high concentration of dextran could significantly improve the storage stability of dextran-casein multiple emulsions. When the addition of dextran was 1.2%, the average particle size of the multiple emulsions was the smallest, up to 623.03±5.21 nm (P<0.05). The absolute value of potential was the highest (P<0.05), and the average potential was −37.3±0.46 mV. The emulsifying property of casein was improved the most (P<0.05). The embedding rate of salidroside was the highest (P<0.05), up to 92.8%, and the drug loading was 162.89±4.21 μg/g. The study of simulated digestion showed that the dextran-casein multiple emulsion could not only effectively protect the salidroside, but also target the delivery and release in the simulated intestine. The dextran-casein loading system with the addition of 1.2% dextran had the best stability and controlled release effect. The research results can provide theoretical support for the application of salidroside in both food and medicine.-
Keywords:
- salidroside /
- W/O/W multiple emulsion /
- stability /
- controlled release /
- in vitro digestion
-
红景天苷(salidroside,SAL)是红景天中主要的生物活性物质[1],具有抗氧化、抗疲劳、抗癌、抗微波辐射和预防急性高原病等多种药理性质[2],是目前极具前景的功能性食品成分。然而SAL在加工、贮藏及机体消化吸收过程中,易受到温度、pH等因素的影响,使其生物活性很难保持[3]。此外,SAL的高溶解度与低渗透性,容易引起P-糖蛋白在肠粘膜中的外排效应,导致生物利用度下降[2-4],极大地限制了SAL在食品与医药中的应用。因此需要根据红景天苷的这些理化特点,设计出有效的递送载体,以提升红景天苷的稳定性,延缓其释放,提高生物利用度,确保功效。
多重乳液是乳液进一步乳化成的复杂乳液体系,有水包油包水(W/O/W)和油包水包油(O/W/O)两种类型[5],具有“两膜三相”结构,即内油/水界面膜、外水/油界面膜以及内相、中间相和外相。目前,W/O/W型多重乳液已被证明是保护亲水性生物活性物质稳定性及控制释放的最佳体系[6-7],它将药物溶于内水相并包裹在油相中,增强跨膜能力,提高缓释效果,保持药物在体内保留时间[8-9]。尽管W/O/W型多重乳液是动力学稳定系统,但加工过程中,液滴外层会发生氧化,降解为单相乳液[10]。因此,需使用生物聚合物定制技术,设计有特殊性质的纳米颗粒,改变其稳定性和加工能力[11]。例如引入蛋白质和多糖,能够提高乳液在环境应力与加工条件下的稳定性。酪蛋白是亲水性乳化剂,可用于稳定W/O/W型多重乳液中油滴的外表面[12]。但蛋白质稳定的多重乳液对pH和离子强度高度敏感,当pH接近蛋白等电点或离子强度超过一定水平时,多重乳液不稳定[13]。此时添加适量多糖可以在一定程度上克服该缺点[14],常见的多糖壁材有葡聚糖、壳聚糖和大豆多糖等。Esfanjani等[15]研究发现当蛋白质和多糖组合应用时会使乳液的化学与胶体稳定性显著增加,且多糖会增加乳液粘度,表现出更优异的乳化性能。Li等[16]发现乳清分离蛋白与羧甲基纤维素形成的混合物会吸附在油水界面处,提高膜的厚度及韧性,避免内外水相转移和渗透以及絮凝现象的发生,进而提高多重乳液的稳定性。在乳制品中,目前采用多重乳液包埋SAL的研究鲜有报道。
本研究分别以葡聚糖、水溶性壳聚糖和大豆多糖混合酪蛋白作为外水相对SAL进行包埋,考察W/O/W型多重乳液稳定性的变化、SAL包埋率和载药量,并测定包埋后的SAL在模拟消化过程中的释放率。旨在确定一种W/O/W型微载体系统,增加SAL在贮藏和加工过程中的稳定性,提升缓释效果及生物利用率,为功能性产品的开发利用提供科学理论。
1. 材料与方法
1.1 材料与仪器
红景天苷(98%)、葡聚糖(98%) 上海麦克林生化科技有限公司;聚甘油蓖麻醇酯(polyglycerol polyricinoleate,PGPR) 郑州明瑞化工产品有限公司;菜籽油 超市购买;酪蛋白(≥90%)、水溶性壳聚糖(98%) 北京博奥拓达科技有限公司;水溶性大豆多糖(98%) 上海谱科生物技术有限公司;十二烷基硫酸钠(≥98.5%)、色谱级甲醇 Sigma公司;α-淀粉酶(酶活力≥5 U/mg)、尿素(分析纯)、粘液素(BR)、胃蛋白酶(酶活力30000 U/g)、脂肪酶(酶活力30000 U/g)、胰酶(酶活力4000 U/g)、胆汁盐(BR) 上海源叶生物科技有限公司;溴酚蓝、氯化钠、氢氧化钠、盐酸、碳酸氢钠、氯化钾、磷酸二氢钠、氯化钙、氯化铵、磷酸二氢钾、氯化镁 以上试剂均为分析纯,西陇化工股份有限公司。
1260Ⅱ Prime高效液相色谱仪 美国安捷伦公司;HJ-4B恒温磁力搅拌器 江苏金坛市中大仪器厂;LE438-pH计 梅特勒-托利多仪器(上海)有限公司;GLH-220型高速乳化均质机 美国Omni 公司;Nano-ZS90粒度及电位分析仪 英国Malvern公司;SpectraMax reg iD3酶标仪 美谷仪器(上海)有限公司;BA300型数码显微镜 Motic公司;ZQPW-70恒温振荡培养箱 天津市莱玻特瑞仪器设备有限公司;GL-20G Ⅱ型高速离心机 上海安亭科学仪器厂。
1.2 实验方法
1.2.1 W/O/W型多重乳液的制备
将SAL添加到0.6%(w/v)NaCl溶液中搅拌至溶解,制得1%(w/v)SAL内水相溶液。将8%(w/v)PGPR添加到菜籽油中搅拌溶解,制得油相溶液。在室温条件下分别将不同浓度(0、0.3%、0.6%、0.9%、1.2%、1.5%,w/v)的葡聚糖、水溶性壳聚糖和大豆多糖与3%(w/v)酪蛋白溶解于去离子水中,用恒温磁力搅拌器搅拌至完全溶解,通过1 mol/L的氢氧化钠或盐酸调至pH=7,放置过夜以确保水合完全。参考Li等[16]的方法,采用两步乳化法制备多重乳液:首先将30%的内水相逐滴加入到70%的油相中,用高速乳化均质机在10000 r/min条件下剪切5 min。再将30%的W/O乳状液加入到70%的外水相中,用高速乳化均质机在5000 r/min条件下剪切3 min,制得W/O/W型多重乳液。
1.2.2 W/O/W型多重乳液的微观结构
取适量多重乳液滴在载玻片上,盖上盖玻片,使用显微镜以100倍油镜观察多重乳液的微观结构。
1.2.3 粒径和电位的测定
参考Yuan等[17]的测定方法,用去离子水将多重乳液稀释1000倍后立即测定粒径和电位,参数设置为:He-Ne光源,功率5 mW,波长为640 nm,散射角90°,测试时间3 min,测定温度25 ℃。
1.2.4 贮藏稳定性的测定
参考Xu等[18]的方法,将制备的多重乳液转移到试管中,用盖密封并在25 ℃条件下贮藏0、7、14 d,观察多重乳液是否存在分层现象。
1.2.5 乳化性质的测定
参考Li等[19]的方法并做修改,取100 μL多重乳液加入2.4 mL十二烷基硫酸钠溶液(0.1%,w/v),用酶标仪在500 nm处测定吸光度A0,计算乳化活性指数(emulsifying activity index,EAI)。静置30 min后取下清液测定吸光度A30,计算乳化活性稳定性指数(emulsifying stability index,ESI)。计算公式:
(1) (2) 式中,N为稀释倍数;C为乳状液形成前水溶液中蛋白质浓度,g/L;
1.2.6 SAL包埋率与载药量的测定
取4 g多重乳液于5 mL离心管中,以4000 r/min离心15 min后,取1.5 g外水相用0.45 μm水系膜过滤。参考Liang等[2]的方法并改进,采用高效液相色谱法测定样品中SAL含量,色谱条件:C18 BEH色谱柱(50 mm×2.1 mm,1.7 μm),流动相为甲醇-水(15:85),体积流量为0.6 mL/min,柱温30 ℃,通过紫外检测器测定,检测波长为275 nm,自动进样温度4 ℃,进样量10 μL。将SAL标准品配制成1.43 mg/mL的标品储备液,使用时依次配制为梯度浓度的溶液,在上述色谱条件下测定峰面积值。将峰面积值(Y)对质量浓度(X)进行线性回归,得到回归方程Y=7238.8X+798.38,R2=0.9997,表明SAL线性关系良好。SAL的包封率(embedding rate,EE)和载药量(drug loading,L)公式如下:
(3) (4) 式中,G0为制备时加入的SAL总量(μg);G1为多重乳液中游离SAL含量(μg);M为多重乳液的质量(g)。
1.2.7 模拟体外消化
1.2.7.1 模拟消化液的配制
参考Flores等[20]的方法。模拟唾液:0.117 g/L氯化钠、2.1 g/L碳酸氢钠、0.149 g/L氯化钾、0.4 g/L尿素、1 g/L粘液素、2 g/L α-淀粉酶,调节pH6.8±0.2;模拟胃液:5.504 g/L氯化钠、0.532 g/L磷酸二氢钠、1.648 g/L氯化钾、0.798 g/L氯化钙、0.612 g/L氯化铵、0.17 g/L尿素、5 g/L胃蛋白酶、6 g/L粘液素、13 mL浓盐酸,调节pH1.3±0.02;模拟肠液:14.024 g/L氯化钠、1.128 g/L氯化钾、6.776 g/L碳酸氢钠、0.16 g/L磷酸二氢钾、0.1 g/L氯化镁、0.2 g/L尿素、3 g/L脂肪酶、18 g/L胰酶、0.36 mL浓盐酸,调节pH8.1±0.2;模拟胆汁:10.518 g/L氯化钠、0.752 g/L氯化钾、11.57 g/L碳酸氢钠、0.5 g/L尿素、60 g/L胆汁盐、0.3 mL浓盐酸,调节pH8.2±0.2。
1.2.7.2 模拟口腔消化
将多重乳液与模拟唾液1:1混合,37 ℃恒温振荡培养箱(100 r/min)消化5 min。
1.2.7.3 模拟胃消化
将上一步所得消化液与模拟胃液1:1混合,37 ℃恒温振荡培养箱(100 r/min)消化2 h。
1.2.7.4 模拟肠消化
将上一步所得消化液与模拟肠液和胆汁液2:2:1混合,37 ℃恒温振荡培养箱(100 r/min)消化2 h。
1.2.7.5 模拟体外消化各阶段SAL释放率的测定
将各阶段体外模拟消化液通过1.2.6中的方法进行SAL消化后的包封率的测定,再参考Xu等[21]的方法测定各阶段消化后的释放率,计算释放率(R)公式如下:
(5) 1.3 数据处理
所有处理组设置三个平行,采用Excel进行初步数据处理,通过SPSS Statistics 26软件进行统计分析,运用LSD方法对结果进行多重比较分析,P<0.05表示差异显著,P>0.05表示差异不显著;使用Origin95软件作图。
2. 结果与分析
2.1 多糖-酪蛋白对W/O/W型多重乳液形态和粒径的影响
乳液平均粒径的大小是判断乳液稳定性的重要指标[22]。结合图1与图2可以发现,不同浓度的葡聚糖、水溶性壳聚糖和大豆多糖混合酪蛋白均可形成完整的“两膜三相”结构,即外水界面膜、内油界面膜和外水相、油相、内水相,符合标准的W/O/W型多重乳液体系,且多糖的添加降低了多糖-酪蛋白多重乳液的平均粒径,随多糖浓度的增加,多重乳液平均粒径均呈先降低后升高的趋势。酪蛋白对照组的多重乳液平均粒径为871.3±19.48 nm,葡聚糖-酪蛋白多重乳液平均粒径显著降低(P<0.05),介于623.03±5.21 nm与648.9±2.35 nm之间,当葡聚糖浓度为1.2%时,葡聚糖-酪蛋白多重乳液的平均粒径达到最小值。与对照组相比,多糖浓度为0.3%~0.6%的壳聚糖-酪蛋白多重乳液平均粒径显著降低(P<0.05),但多糖浓度在0.9%~1.5%的壳聚糖-酪蛋白组与酪蛋白对照组多重乳液平均粒径相比无显著差异(P>0.05)。大豆多糖-酪蛋白多重乳液平均粒径介于694.53±36.8 nm与770.07±21.92 nm之间,显著低于酪蛋白对照组多重乳液(P<0.05)。Assadpour等[23]研究表明当外水相中乳化剂浓度升高时,能够引起界面膜面积的增加,导致多重乳液粒径减小。当粒径达到最小后,浓度继续增加会使多余的乳化剂在界面堆积,多重乳液粒径增大,降低乳液的稳定性[24],这与本试验结果相一致。结果表明,葡聚糖、大豆多糖和较低浓度壳聚糖的添加能够显著降低多重乳液的平均粒径(P<0.05),在葡聚糖添加量为1.2%时,多重乳液的平均粒径最小。
2.2 多糖-酪蛋白对W/O/W型多重乳液电位的影响
越稳定的溶液体系拥有越高的电位绝对值,一般认为,体系中电位绝对值高于20 mV就可以提供足够的静电斥力维持体系的稳定[25]。由图3可知,添加不同浓度三种多糖的多重乳液电位绝对值均显著高于酪蛋白对照组多重乳液(P<0.05)。葡聚糖-酪蛋白多重乳液电位绝对值随葡聚糖浓度增加先上升后下降,在葡聚糖浓度为1.2%时,电位绝对值最高,平均为−37.3±0.46 mV。壳聚糖-酪蛋白和大豆多糖-酪蛋白多重乳液电位绝对值提升幅度弱于葡聚糖-酪蛋白,且大豆多糖-酪蛋白优于壳聚糖-酪蛋白,这可能与多糖种类有关。Jiang等[26]研究发现,添加多糖可以与某些带正电的氨基酸反应,导致负电荷增加,但是添加到一定浓度后,过量部分会与酪蛋白发生分子缠结等作用导致负电荷被屏蔽,电位绝对值降低。综上说明添加葡聚糖、壳聚糖和大豆多糖均能显著提高多重乳液电位绝对值,且提升幅度:葡聚糖>大豆多糖>壳聚糖。当葡聚糖的添加量为1.2%时,多重乳液的电位绝对值最高,多重乳液稳定性最好。
2.3 多糖-酪蛋白对W/O/W型多重乳液贮藏稳定性的影响
如图4为常温放置0、7、14 d的W/O/W型多重乳液的贮藏稳定性情况,新鲜制备的多重乳液未见明显分层。随贮藏时间的延长,壳聚糖-酪蛋白与大豆多糖-酪蛋白多重乳液均发生了不同程度的絮凝现象。而葡聚糖浓度为0.9%、1.2%及1.5%的葡聚糖-酪蛋白多重乳液在0~14 d内未发生明显的絮凝现象,由图2和图3可知,葡聚糖浓度为0.9%、1.2%及1.5%的葡聚糖-酪蛋白多重乳液平均粒径较小,电位绝对值较高。Yi等[27]认为,电位越高,乳液定性越高,抗絮凝力强。结果显示,添加高浓度的葡聚糖能够明显提升葡聚糖-酪蛋白多重乳液的贮藏稳定性,而酪蛋白对照组、壳聚糖-酪蛋白和大豆多糖-酪蛋白多重乳液会发生絮凝。
2.4 多糖-酪蛋白对W/O/W型多重乳液乳化性质的影响
乳化活性能够表征蛋白质吸附在油水界面并使其稳定的能力,乳化稳定性则是反映在一定时间内蛋白质维持乳液稳定的能力[28]。如图5和图6所示,三种多糖-酪蛋白均能不同程度地提高多重乳液的EAI和ESI,且添加三种多糖的多重乳液乳化性质的变化趋势与电位绝对值变化相似,均呈现先升高后降低的趋势。当葡聚糖的添加量为1.2%时,葡聚糖-酪蛋白多重乳液的乳化活性和乳化稳定性最高,显著大于其他实验组(P<0.05)。壳聚糖-酪蛋白和大豆多糖-酪蛋白对多重乳液乳化活性和乳化稳定性提升幅度弱于葡聚糖-酪蛋白,且大豆多糖-酪蛋白优于壳聚糖-酪蛋白,与2.2结果相似。Sun等[29]提出蛋白质和多糖形成的复合物可以改变界面层的厚度、电荷密度和粘弹性等,葡聚糖能与酪蛋白结合形成紧密的保护层,所以乳化活性也随之发生变化。Zhu等[30]试验结果表明乳液的粒径越小,则电位绝对值越大,乳化稳定性越高,与本试验结果相同。结果表明,三种多糖-酪蛋白均能够显著提升酪蛋白的乳化性质,使乳液更稳定,其中葡聚糖-酪蛋白的效果更好。
2.5 多糖-酪蛋白对W/O/W型多重乳液SAL包埋率及载药量的影响
包埋率和载药量是评价载体对活性物质包埋能力的重要指标,优异的包埋能力对活性物质的保护、靶向释放和生物利用度的提升具有重要意义[31]。由图7和图8可知,酪蛋白对照组多重乳液中SAL的平均包埋率为64.46%,载药量为116.02±0.12 μg/g,葡聚糖-酪蛋白多重乳液SAL包埋率及载药量随葡聚糖浓度呈先升高后降低的趋势,在葡聚糖浓度为1.2%时包埋率达到最大值92.8%,载药量为162.89±4.21 μg/g,显著高于其他多糖组与酪蛋白对照组(P<0.05)。Leong等[32]指出内水相渗透压是外水相10倍时多重乳液才能达到稳定。当葡聚糖浓度高于1.2%时渗透压较低,容易导致内水外渗,降低包埋率及载药量;浓度低于1.2%时,内水相渗透压过高,引起外水内渗,最终使多重乳液液滴破裂,降低包封率及载药量。壳聚糖-酪蛋白及大豆多糖-酪蛋白多重乳液SAL包埋率及载药量提升不明显,其中壳聚糖-酪蛋白组包埋率介于66.54%~69.58%之间(载药量介于119.78±3.47~125.25±3.92 μg/g之间),大豆多糖-酪蛋白包埋率介于65.35%~68.4%之间(载药量介于117.64±5.75~123.11±2.75 μg/g之间)。由上文可知,与葡聚糖-酪蛋白组相比,壳聚糖-酪蛋白与大豆多糖-酪蛋白多重乳液平均粒径较大,乳液稳定性弱于葡聚糖-酪蛋白组,易导致W/O液滴融合,致使部分SAL游离至外水相,包埋率降低。综上表明壳聚糖-酪蛋白与大豆多糖-酪蛋白不能明显提升多重乳液的包埋能力,而葡聚糖-酪蛋白显著增加了多重乳液对SAL的保护效果,加强了多重乳液的载药性能。
2.6 模拟消化中多糖-酪蛋白对W/O/W型多重乳液平均粒径的影响
图9显示,在模拟口腔消化中,葡聚糖-酪蛋白多重乳液平均粒径随葡聚糖浓度增加呈先降低后升高的趋势,葡聚糖浓度为1.2%时平均粒径达到最小值621.93±3.58 nm(P<0.05),壳聚糖-酪蛋白与大豆多糖-酪蛋白多重乳液平均粒径均与图2结果相近似,平均粒径与未参加消化时相差不大。表明此时多重乳液相对稳定,受α-淀粉酶的消化作用影响较小。
如图10所示,在模拟胃消化阶段中,酪蛋白对照组多重乳液在胃蛋白酶的消化下结构塌陷使液滴聚集到一起,平均粒径显著增加,与模拟口腔消化相比由875.2±2.76 nm增至1298.9±73.16 nm(P<0.05)。葡聚糖-酪蛋白多重乳液平均粒径与模拟口腔时的平均粒径相比未发生显著变化(P>0.05),且在模拟胃消化时平均粒径显著小于酪蛋白对照组(P<0.05),可知葡聚糖-酪蛋白多重乳液受胃蛋白酶影响较小。壳聚糖-酪蛋白组与大豆多糖-酪蛋白组在多糖浓度为0.6%~1.5%时,多重乳液平均粒径显著大于葡聚糖-酪蛋白组(P<0.05),说明与葡聚糖相比,壳聚糖与大豆多糖添加量较高时易导致内水外渗,受胃蛋白酶影响多重乳液稳定性下降,平均粒径增大。
由图11可得,多重乳液从模拟胃进入到模拟肠消化后,酪蛋白对照组、葡聚糖-酪蛋白、壳聚糖-酪蛋白和大豆多糖-酪蛋白多重乳液平均粒径与模拟口腔和胃消化时大幅度降低,介于350.3±23.65 nm和631.77±31.25 nm之间,各组多重乳液几乎被完全消化,三种多糖-酪蛋白对多重乳液的影响无法判断,产生的小分子多肽、释放的SAL与肠液环境中的胆盐等形成类似于胶束的小颗粒,从而使消化液的粒径变小[33],W/O液滴被完全破坏聚集成油滴并被消化成更小的油滴,这与Frank等[34]的结果一致。此时多重乳液中的SAL释放到肠道中,发挥其生理功能。
综上结果表明,口腔消化阶段的α-淀粉酶对多重乳液影响较小;在胃消化阶段,葡聚糖-酪蛋白多重乳液比壳聚糖-酪蛋白和大豆多糖-酪蛋白组更能够有效延缓胃蛋白酶对其的消化,减少此阶段对多重乳液平均粒径和稳定性的影响;在肠消化阶段,所有多重乳液受胰酶、脂肪酶及胆盐的影响均被消化,平均粒径变小。
2.7 模拟消化中多糖-酪蛋白对W/O/W型多重乳液SAL释放率的影响
如图12所示,经口腔消化后,酪蛋白对照组多重乳液SAL平均释放率为36.02%,1.2%葡聚糖-酪蛋白多重乳液SAL平均释放率为10.7%,多重乳液微观结构如图13所示,与未参与消化的多重乳液微观结构中液滴大小和分布无明显差异,表明α-淀粉酶对多重乳液的结构及包埋率影响较小,此时释放的均为未被包埋的游离态SAL。经胃消化后,酪蛋白对照组多重乳液SAL平均释放率为74.28%,多重乳液微观结构中液滴与模拟口腔消化时明显变大,这是由于胃蛋白酶对酪蛋白的消化,导致多重乳液结构塌陷使液滴聚集到一起,导致SAL部分释放[35]。但葡聚糖-酪蛋白多重乳液微观结构中液滴大小相对稳定,说明葡聚糖和酪蛋白形成的复合物能够有效延缓胃蛋白酶对其的消化,仍能够起到良好的SAL保护作用,Giroux等[36]也证明W/O/W型多重乳液能够在胃消化期间维持乳液微观形态稳定。在肠消化阶段,经胰酶和脂肪酶消化后所有多重乳液微观结构均被破坏,SAL被释放,其中葡聚糖添加量为1.2%的葡聚糖-酪蛋白多重乳液的SAL平均释放率从32.26%升高到92.4%,SAL在模拟肠消化阶段累计释放量达到60.14%。说明葡聚糖-酪蛋白多重乳液模拟体外消化时能有效保护SAL并控制释放,且随葡聚糖浓度的增加,对SAL的保护控释作用呈先升高后降低的趋势,在浓度为1.2%时达到最好效果。
图14和图15结果可知,在口腔消化和胃阶段,部分壳聚糖-酪蛋白和大豆多糖-酪蛋白多重乳液SAL释放率超过酪蛋白对照组多重乳液,其原因可能是W/O液滴聚集[34],导致部分SAL被释放,在肠消化阶段,壳聚糖-酪蛋白和大豆多糖-酪蛋白仍能够提供一定的保护作用,且大豆多糖-酪蛋白效果优于壳聚糖-酪蛋白,但两者效果明显弱于葡聚糖-酪蛋白,说明外水相乳化剂中的多糖种类和浓度对消化程度有着明显的影响。
本研究发现,壳聚糖-酪蛋白与大豆多糖-酪蛋白对SAL的保护效果较差,使其过早的在模拟口腔和胃消化过程中渗出,而葡聚糖-酪蛋白多重乳液中的SAL能被更多的靶向释放到肠道中,能够提高SAL的生物利用率,在葡聚糖添加量为1.2%时,保护和控释效果最佳,这与体外消化对乳液粒径影响结果相一致。
3. 结论
本研究采用三种多糖-酪蛋白制备W/O/W型多重乳液,其中葡聚糖-酪蛋白在提升多重乳液稳定性和保护SAL方面表现出更好的性能,并拥有较好的乳化性能。在葡聚糖添加量为1.2%时,葡聚糖-酪蛋白多重乳液的稳定性最好,SAL包埋率最高可达92.8%,载药量为162.89±4.21 μg/g,显著高于壳聚糖-酪蛋白和大豆多糖-酪蛋白(P<0.05)。模拟体外消化过程中,葡聚糖-酪蛋白能够减少多重乳液受口腔和胃消化的影响,并靶向地在肠道内传递和释放SAL,提高SAL的生物利用率,当葡聚糖添加量为1.2%时,对多重乳液的保护和控释效果最佳,使SAL在肠道内释放率高达60.14%;壳聚糖-酪蛋白和大豆多糖-酪蛋白多重乳液与葡聚糖-酪蛋白组相比乳液稳定性较差,导致部分SAL易游离至外水相,包埋率及载药量降低,在模拟胃肠消化阶段,多重乳液双层结构被破坏,SAL大量释放,对SAL的保护效果及生物利用度明显弱于葡聚糖。
本研究表明,葡聚糖-酪蛋白W/O/W型多重乳液可以有效保护并控释红景天苷,为红景天苷在食品与医药中的应用提供了理论基础和科学支撑。
-
-
[1] ZENG Q, NIE X, LI L, et al. Salidroside promotes sensitization to doxorubicin in human cancer cells by affecting the PI3K/Akt/HIF signal pathway and inhibiting the expression of tumor-resistance-related proteins[J]. Journal of Natural Products,2022,85(1):196−204. doi: 10.1021/acs.jnatprod.1c00950
[2] LIANG C X, QI D L, ZHANG L N, et al. Preparation and evaluation of a water-in-oil nanoemulsion drug delivery system loaded with salidroside[J]. Chinese Journal of Natural Medicines,2021,19(3):231−240. doi: 10.1016/S1875-5364(21)60025-0
[3] 刘永. 红景天苷口服给药后药代动力学及在体肠吸收特性研究[D]. 哈尔滨: 东北林业大学, 2017 LIU Y. Pharmacokinetics and in vivo intestinal absorption of salidroside after oral administration[D]. Harbin: Northeast Forestry University, 2017.
[4] 黄彪, 单晓菊, 赵鑫, 等. 红景天苷在比格犬体内绝对生物利用度研究[J]. 药学实践杂志,2021,39(1):62−67,96. [HUANG B, SHAN X J, ZHAO X, et al. Absolute bioavailability of salidroside in beagle dogs[J]. Journal of Pharmaceutical Practice,2021,39(1):62−67,96. doi: 10.12206/j.issn.1006-0111.202012001 HUANG B, SHAN X J, ZHAO X, et al. Absolute bioavailability of salidroside in beagle dogs[J]. Journal of Pharmaceutical Practice, 2021, 39(1): 62-67, 96. doi: 10.12206/j.issn.1006-0111.202012001
[5] FATHI M, MOZAFARI M R, MOHEBBI M. Nanoencapsulation of food ingredients using lipid based delivery systems[J]. Trends in Food Science & Technology,2014,23(1):13−27.
[6] GHAREHBEGLOU P, JAFARI S M, HOMAYOUNI A, et al. Fabrication of double W-1/O/W-2 nano-emulsions loaded with oleuropein in the internal phase (W-1) and evaluation of their release rate[J]. Food Hydrocolloids,2019,89:44−55. doi: 10.1016/j.foodhyd.2018.10.020
[7] ARTIGA-ARTIGAS M, MOLET-RODRIGUEZ A, SALVIA-TRUJILLO L, et al. Formation of double (W-1/O/W-2) emulsions as carriers of hydrophilic and lipophilic active compounds[J]. Food and Bioprocess Technology,2019,12(3):422−435. doi: 10.1007/s11947-018-2221-3
[8] SINGH Y, MEHER J G, RAVAL K, et al. Nanoemulsion: Concepts, development and applications in drug delivery[J]. Journal of Controlled Release,2017,252:28−49. doi: 10.1016/j.jconrel.2017.03.008
[9] CALLENDER S P, MATHEWS J A, KOBERNYK K, et al. Microemulsion utility in pharmaceuticals: Implications for multi-drug delivery[J]. International Journal of Pharmaceutics,2017,526(1−2):425−442. doi: 10.1016/j.ijpharm.2017.05.005
[10] ASSADPOUR E, JAFARI S-M, MAGHSOUDLOU Y. Evaluation of folic acid release from spray dried powder particles of pectin-whey protein nano-capsules[J]. International Journal of Biological Macromolecules,2017,95:238−247. doi: 10.1016/j.ijbiomac.2016.11.023
[11] JOYE I J, MCCLEMENTS D J. Biopolymer-based nanoparticles and microparticles: Fabrication, characterization, and application[J]. Current Opinion in Colloid & Interface Science,2014,19(5):417−427.
[12] NAKAMURA A, FURUTA H, MAEDA H, et al. Structural studies by stepwise enzymatic degradation of the main backbone of soybean soluble polysaccharides consisting of galacturonan and rhamnogalacturonan[J]. Bioscience, Biotechnology, and Biochemistry,2002,66(6):1301−1313. doi: 10.1271/bbb.66.1301
[13] LAM R S H, NICKERSON M T. Food proteins: A review on their emulsifying properties using a structure-function approach[J]. Food Chemistry,2013,141(2):975−984. doi: 10.1016/j.foodchem.2013.04.038
[14] TAMNAK S, MIRHOSSEINI H, TAN C P, et al. Encapsulation properties, release behavior and physicochemical characteristics of water-in-oil-in-water (W/O/W) emulsion stabilized with pectin-pea protein isolate conjugate and tween 80[J]. Food Hydrocolloids,2016,61:599−608. doi: 10.1016/j.foodhyd.2016.06.023
[15] ESFANJANI A F, JAFARI S M, ASSADPOUR E. Preparation of a multiple emulsion based on pectin-whey protein complex for encapsulation of saffron extract nanodroplets[J]. Food Chemistry,2017,221:1962−1969. doi: 10.1016/j.foodchem.2016.11.149
[16] LI C, ZHAO Y, CHEN X, et al. Effect of natural macromolecules of external aqueous phase on the properties of W/O/W type multiple emulsions[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(12):81−88.
[17] YUAN L, SUN C, DANG Q, et al. Optimization of preparation of W/O/W multiple emulsion and evaluation of its ability to encapsulate cyanidin-3-glucoside[J]. Food Science,2019,40(6):272−280.
[18] XU W, ZHANG Y, ZHU Y, et al. Digestion properties and controlled release of anthocyanins-loaded water-in-oil-in-water double emulsions stabilized by polyglycerol polyricinoleate and casein sodium[J]. Food Science,2020,41(10):1−7.
[19] LI C, HUANG X, PENG Q, et al. Physicochemical properties of peanut protein isolate-glucomannan conjugates prepared by ultrasonic treatment[J]. Ultrasonics Sonochemistry,2014,21(5):1722−1727. doi: 10.1016/j.ultsonch.2014.03.018
[20] FLORES F P, SINGH R K, KERR W L, et al. Total phenolics content and antioxidant capacities of microencapsulated blueberry anthocyanins during in vitro digestion[J]. Food Chemistry,2014,153:272−278. doi: 10.1016/j.foodchem.2013.12.063
[21] XU W, MU W, LU Z, et al. Formation and in vitro digestion of W/O/W emulsions loading anthocyanin extract from grape skin powder[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(2):213−220.
[22] LUAN H, WU Y, ZHENG H, et al. Preparation and physicochemical characterization of cinnamic acid based oleogels and oleogel emulsions[J]. Food Science,2021,42(8):60−66.
[23] ASSADPOUR E, MAGHSOUDLOU Y, JAFARI S-M, et al. Optimization of folic acid nano-emulsification and encapsulation by maltodextrin-whey protein double emulsions[J]. International Journal of Biological Macromolecules,2016,86:197−207. doi: 10.1016/j.ijbiomac.2016.01.064
[24] FRANK K, KOEHLER K, SCHUCHMANN H P. Formulation of labile hydrophilic ingredients in multiple emulsions: Influence of the formulation's composition on the emulsion's stability and on the stability of entrapped bioactives[J]. Journal of Dispersion Science and Technology,2011,32(12):1753−1758. doi: 10.1080/01932691.2011.616147
[25] 程昊. 基于酪蛋白/玉米醇溶蛋白不同载体的功能因子共包埋研究[D]. 无锡: 江南大学, 2020. CHENG H. Study on casein and zein-based carriers for the co-encapsulation of bioactive components[D]. Wuxi: Jiangnan University, 2020.
[26] JIANG J, XIONG Y L. Extreme pH treatments enhance the structure-reinforcement role of soy protein isolate and its emulsions in pork myofibrillar protein gels in the presence of microbial transglutaminase[J]. Meat Science,2013,93(3):469−476. doi: 10.1016/j.meatsci.2012.11.002
[27] YI J, ZHU Z, MCCLEMENTS D J, et al. Influence of aqueous phase emulsifiers on lipid oxidation in water-in-walnut oil emulsions[J]. Journal of Agricultural and Food Chemistry,2014,62(9):2104−2111. doi: 10.1021/jf404593f
[28] LIU C, WANG X, MA H, et al. Functional properties of protein isolates from soybeans stored under various conditions[J]. Food Chemistry,2008,111(1):29−37. doi: 10.1016/j.foodchem.2008.03.040
[29] SUN C, GUNASEKARAN S. Rheology and oxidative stability of whey protein isolate-stabilized menhaden oil-in-water emulsions as a function of heat treatment[J]. Journal of Food Science,2010,75(1):C1−C8. doi: 10.1111/j.1750-3841.2009.01387.x
[30] ZHU L, CHEN J, TANG X, et al. Reducing, radical scavenging, and chelation properties of in vitro digests of alcalase-treated zein hydrolysate[J]. Journal of Agricultural and Food Chemistry,2008,56(8):2714−2721. doi: 10.1021/jf703697e
[31] MOHAN A, MCCLEMENTS D J, UDENIGWE C C. Encapsulation of bioactive whey peptides in soy lecithin-derived nanoliposomes: Influence of peptide molecular weight[J]. Food Chemistry,2016,213:143−148. doi: 10.1016/j.foodchem.2016.06.075
[32] LEONG T S H, ZHOU M, KUKAN N, et al. Preparation of water-in-oil-in-water emulsions by low frequency ultrasound using skim milk and sunflower oil[J]. Food Hydrocolloids,2017,63:685−695. doi: 10.1016/j.foodhyd.2016.10.017
[33] LESMES U, MCCLEMENTS D J. Controlling lipid digestibility: Response of lipid droplets coated by beta-lactoglobulin-dextran Maillard conjugates to simulated gastrointestinal conditions[J]. Food Hydrocolloids,2012,26(1):221−230. doi: 10.1016/j.foodhyd.2011.05.011
[34] FRANK K, WALZ E, GRAEF V, et al. Stability of anthocyanin-rich W/O/W-emulsions designed for intestinal release in gastrointestinal environment[J]. Journal of Food Science,2012,77(12):N50−N57. doi: 10.1111/j.1750-3841.2012.02982.x
[35] XIAO J, LU X, HUANG Q. Double emulsion derived from kafirin nanoparticles stabilized pickering emulsion: Fabrication, microstructure, stability and in vitro digestion profile[J]. Food Hydrocolloids,2017,62:230−238. doi: 10.1016/j.foodhyd.2016.08.014
[36] GIROUX H J, ROBITAILLE G, BRITTEN M. Controlled release of casein-derived peptides in the gastrointestinal environment by encapsulation in water-in-oil-in-water double emulsions[J]. LWT-Food Science and Technology,2016,69:225−232. doi: 10.1016/j.lwt.2016.01.050





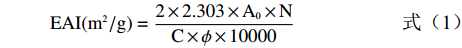
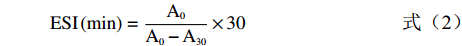
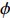
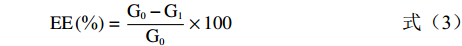



 下载:
下载:














 下载:
下载:
