Antioxidant and Bacteriostatic Activities of Essential Oil from Ligustrum robustum (Rxob.) Blume
-
摘要: 为研究粗壮女贞苦丁茶精油的抗氧化和抑菌作用,以粗壮女贞苦丁茶为原料,采用水蒸气蒸馏法制备精油,采用气相色谱-质谱技术鉴定其挥发性成分,通过体外化学分析法测定其抗氧化作用,利用细菌、真菌和酵母测定其抑菌作用,并进一步以花生油和橙汁为对象测定其在食品贮藏过程中的抗氧化和抑菌作用。结果表明,粗壮女贞苦丁茶精油中共鉴定出4-萜品醇、γ-萜品烯和4-蒈烯等22种挥发性成分。精油能够有效清除ABTS+自由基(EC50:395.9 μg/mL)、DPPH自由基(EC50:165.45 μg/mL),抑制脂质过氧化(IC50:420.1 μg/mL)并展现出较强的还原能力,可有效减缓花生油在贮藏过程中过氧化值的升高,抑制油脂的氧化变质。精油具有良好的广谱抑菌性(供试菌MIC:0.31~5.0 μg/mL;MBC:1.25~20.0 μg/mL),能明显抑制受试微生物对数生长期的生长,对细菌的抑制作用明显且对大肠杆菌较强(抑菌圈直径达29.85 mm),可有效抑制橙汁在贮藏过程中的腐败变质。研究结果表明粗壮女贞苦丁茶精油具有在食品工业高值开发利用的潜在价值。Abstract: Antioxidant and bacteriostatic effects of the essential oil from Ligustrum robustum (Rxob.) Blume (EOL) were investigated. L. robustum was used as the crude material to prepare EOL by steam distillation method. The volatile components of EOL were identified by gas chromatography mass spectrometry (GC-MS). Then, its antioxidant activity was analyzed by some chemical methods in vitro, and its bacteriostatic activity was evaluated by using bacteria, fungi and yeast. Furthermore, peanut oil and orange juice were selected as food models to determine its antioxidant and bacteriostatic effects during storage period. Results showed that 22 of volatile components were identified from EOL, such as 4-terpined, γ-terpinene, and 4-carene, etc.. In addition, EOL could scavenge ABTS+ free radical (EC50: 395.9 μg/mL), DPPH free radical (EC50: 165.45 μg/mL), inhibit lipid peroxidation (IC50: 420.1 μg/mL) and showed strong reduce power. Meanwhile, EOL could effectively slow down the increasing of peroxide value of peanut oil, and inhibit the oxidative deterioration of oil during storage. Moreover, EOL showed the favorable broad-spectrum bacteriostatic activities (MIC: 0.31~5.0 μg/mL, MBC: 1.25~20.0 μg/mL), and it inhibited the growth of all testing microorganisms during logarithmic growth period effectively. Specifically, the inhibition of bacteria was obvious, especially for Escherichia coli (the inhibition zone was 29.85 mm). EOL had remarkable abilities to restrain the spoilage and prolong the shelf life of orange juice during storage. All results suggested that the essential oil from L. robustum showed the high value and potential to be developed and utilized in food industry.
-
氧化变质及微生物污染是食品加工和贮藏过程中引发食品品质褪变的主要原因。基于自由基链式反应的氧化变质对油脂类食品的理化品质及色、香、味等感官品质有较大的负面影响,进而缩短产品的货架期[1]。此外,氧化变质产生和蓄积的部分氧化产物对人体健康有潜在危害,可进一步诱发相关的食品安全问题[2]。同时,由微生物污染引起的食品腐败显著降低食品的加工和食用品质,并引发相关的食源性疾病,不仅对食品工业生产有较大影响,还严重威胁人体生命健康[3]。为抑制食品的氧化变质和腐败,相关的食品添加剂在食品生产中开始使用。虽然化学合成的食品添加剂表现出较强的作用,但其对人体有潜在的毒性和危害,开始被逐渐限制使用[4]。因此,从可食用资源中寻找天然、高效的物质并将其应用于食品生产已成为食品及相关领域的研究热点。
粗壮女贞(Ligustrum robustum (Rxob.) Bume)为木犀科女贞属植物,其干燥的叶是我国西南地区一种传统的植物代用茶[5]并被批准为普通食品进行加工和食用。研究表明,粗壮女贞苦丁茶富含多种活性成分,具有清热解毒、镇痛抗炎、降压降脂等临床药理作用[6]。目前,对于粗壮女贞苦丁茶的研究多集中于其醇提物和水提物[7],有关粗壮女贞苦丁茶精油的研究鲜有报道。精油是植物的次生代谢产物,常温下为油状液体并具有芳香气味,主要由小分子量的萜类化合物、芳香族和脂肪族化合物组成[8]。植物精油具有抗病毒、抗寄生虫和杀虫等多种生物活性,在日用化工和生物医药等领域展现出良好的应用价值与前景。本文对粗壮女贞苦丁茶精油的抗氧化和抑菌作用进行研究,并进一步探究其在食品保鲜中的应用,为粗壮女贞苦丁茶资源在食品加工与贮藏领域的高值开发利用提供实验基础与理论指导。
1. 材料与方法
1.1 材料与仪器
粗壮女贞苦丁茶 四川省泸州市,样品(编号2021-0718),−20 ℃低温保藏;花生油 金龙鱼一级压榨花生油,成都沃尔玛超市;橙子 成都沃尔玛超市,4 ℃保存备用;ABTS(2,2'-azinobis-3-ethylbenzthiazoline-6-sulphonate,2,2'-联氮-二(-乙基苯并噻唑-6-磺酸)二铵盐)、DPPH(1,1-diphenyl-2-picrylhydrazine,1,1-二苯基-2-三硝基苯肼)、正己烷(色谱纯) 上海阿拉丁生化科技股份有限公司;庆大霉素 四川长威药品有限公司;其他试剂均为国产分析纯 成都金山试剂有限公司;实验用水 为蒸馏水;色谱分析用水为超纯水;牛肉膏蛋白胨培养基(牛肉膏3 g、蛋白胨10 g、氯化钠5 g、琼脂20 g、水1 L),121 ℃灭菌20 min备用;土豆培养基(去皮马铃薯200 g、葡萄糖20 g、琼脂20 g、水1 L),115 ℃灭菌30 min备用 成都蜀都试剂有限公司;大肠杆菌(Escherichia coli ATCC25922)、沙门氏菌(Salmonella typhimurium ATCC14028)、金黄色葡萄球菌(Staphylococcus aureus ATCC25923)、枯草芽孢杆菌(Bacillus subtilis ATCC21216)、蜡状芽孢杆菌(Bacillus cereus ATCC10231)、黄曲霉(Aspergillus flavus ATCC204304)、黑曲霉(Aspergillus niger ATCC16404)、青霉(Pencicillium citrinum ATCC14994)、啤酒酵母(Saccharomyces cerevisiae ATCC9763)等菌种 四川大学微生物实验室。
Thermo TRACE DSQII型气相色谱-质谱(Gas Chromatograph-Mass Spectrometer,GC-MS)联用仪 美国Thermo Fisher公司;UV-2000型紫外可见分光光度计 上海尤尼柯仪器有限公司;FA-2004型电子分析天平 上海舜宇恒平科学仪器有限公司;LDZH-150KBS型高压灭菌锅 上海申安医疗器械厂;SW-CJ-1D型超净工作台 上海舍岩仪器有限公司;YGP-9160型隔水式恒温培养箱 上海姚氏仪器设备厂。
1.2 实验方法
1.2.1 精油的提取
通过水蒸气蒸馏法制备粗壮女贞苦丁茶精油[9]:称取适量粗壮女贞苦丁茶置于圆底烧瓶内,按固液比1:10 g/mL添加蒸馏水,沸水回流提取4 h,收集产生的精油,后向精油样品中加入少量无水硫酸钠除去多余水分,4 ℃冷藏备用。
1.2.2 GC-MS分析
采用GC-MS技术分析精油样品的挥发性成分[9],以正己烷为溶剂配制精油样品(0.05%,v/v)进行测定,GC-MS的分析条件如下:
色谱条件:色谱柱为DB-5MS石英毛细柱(30 m×0.25 mm, 0.25 μm);升温程序为初始温度60 ℃保持4 min,以4 ℃/min升至240 ℃,保持15 min;进样口温度为250 ℃;分流比为20:1;进样体积为1.0 μL;检样器温度为280 ℃;载气为氦气,流速为1.0 mL/min。
质谱条件:采用电子轰击(EI)方式电离;电离能为70 eV;质量扫描范围为40~500 amu;离子源温度为200 ℃。通过检索和对比标准谱库(NIST,14.0 Gaithersburg,MD,USA)对目标化合物进行定性分析,采用归一化积分法对各物质进行定量分析。
1.2.3 ABTS+自由基清除能力的测定
按照文献[10]所述的详细步骤测定精油样品对ABTS+自由基的清除作用。以二甲基亚砜(DMSO)为溶剂,配制浓度为85、170、340、510、680 μg/mL的精油样品用于测定,测试波长为734 nm。DMSO作空白对照,丁基羟基茴香醚(BHA)作阳性对照,精油样品对ABTS自由基的清除能力按后式计算:ABTS自由基清除率(%)=(1−A1/A0)×100,A1为样品组的吸光度,A0为空白组的吸光度。
1.2.4 DPPH自由基清除能力的测定
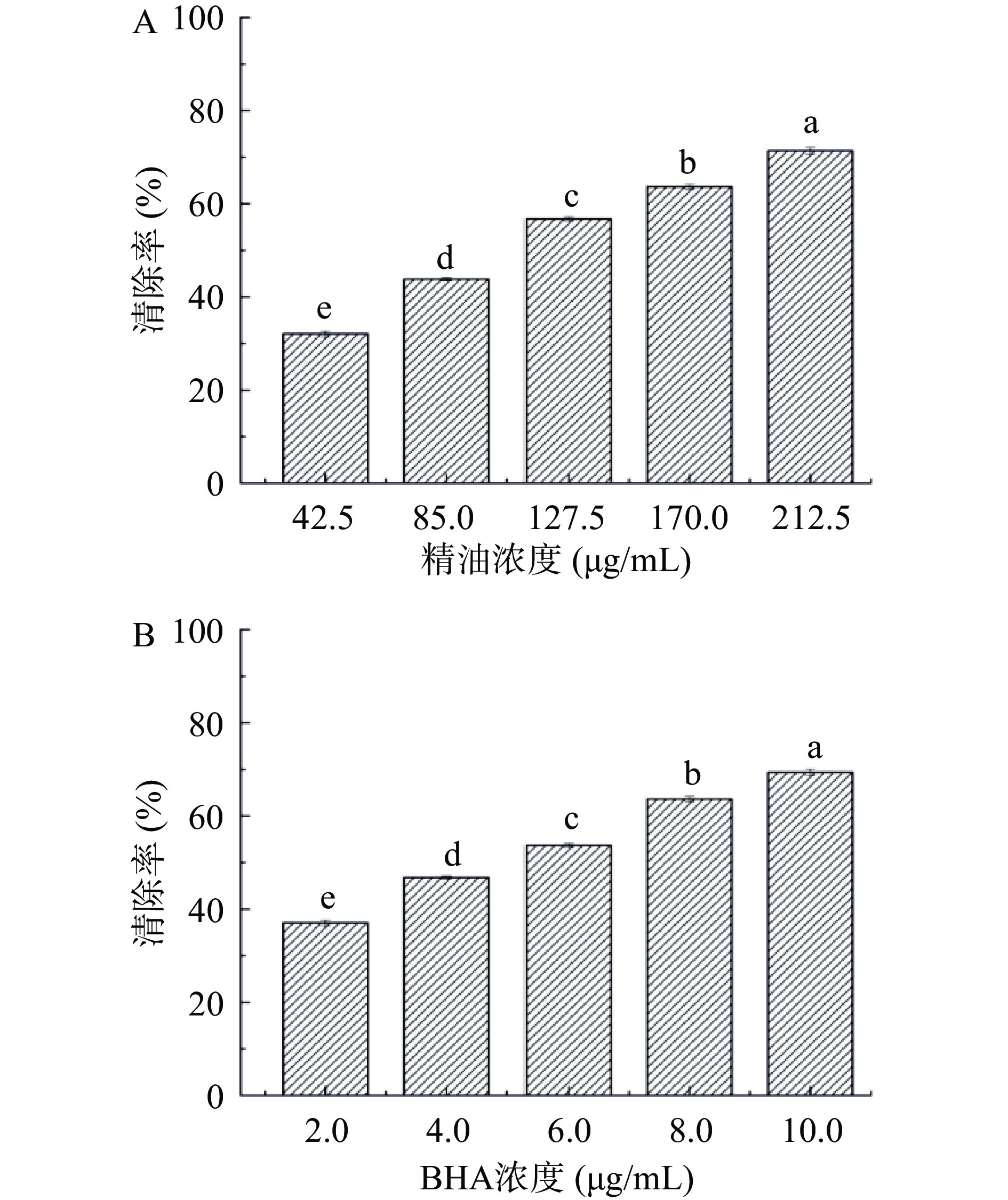
按照文献[10]所述的详细步骤测定精油样品对DPPH自由基的清除作用。以DMSO为溶剂,配制浓度为42.5、85.0、127.5、170.0、212.5 μg/mL的精油样品用于测定,测试波长为517 nm。DMSO作空白对照,BHA作阳性对照,精油样品对DPPH自由基的清除能力按后式计算:DPPH自由基清除率(%)=(1−A1/A0)×100,A1为样品组的吸光度,A0为空白组的吸光度。
1.2.5 脂质过氧化抑制能力的测定
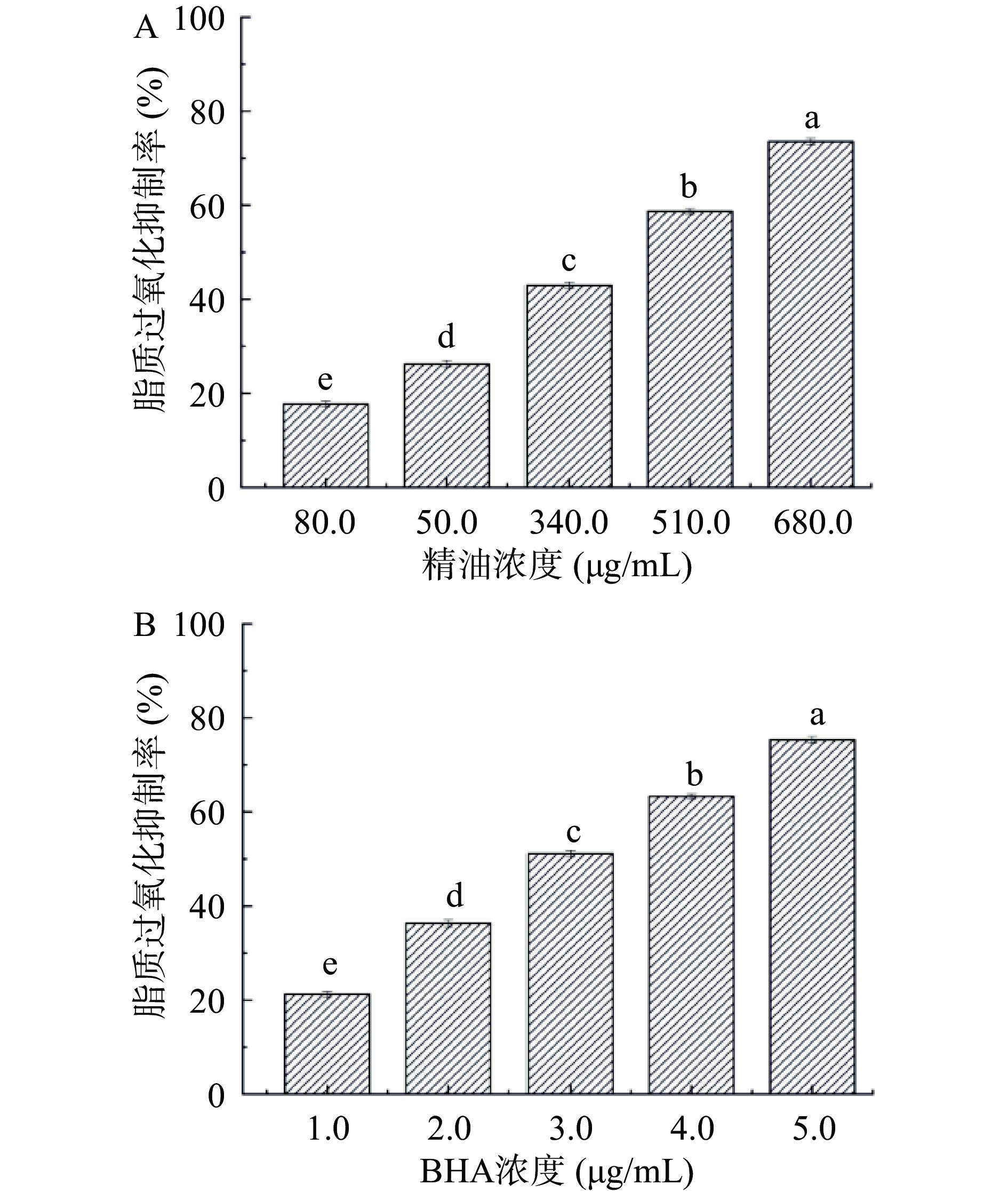
按照文献[10]所述的详细步骤测定精油样品的脂质过氧化抑制能力。以DMSO为溶剂,配制浓度为85、170、340、510、680 μg/mL的精油样品用于测定,测定波长为532 nm。DMSO作空白对照,BHA作阳性对照,精油样品的脂质过氧化抑制能力按后式计算:脂质过氧化抑制率(%)=(1−A1/A0)×100,A1为样品组的吸光度,A0为空白组的吸光度。
1.2.6 还原能力的测定
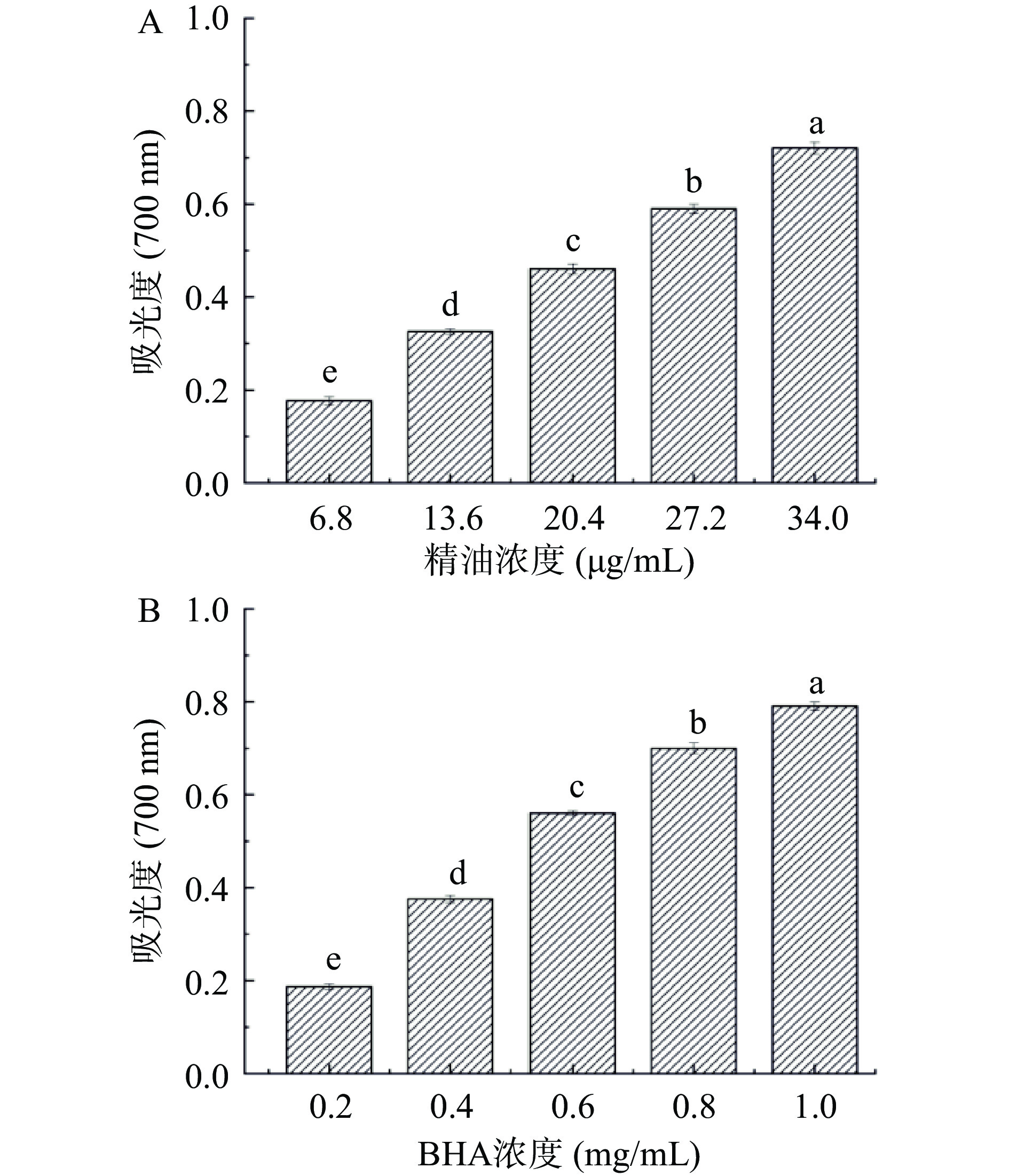
按照文献[10]所述的详细步骤测定精油样品的还原能力。以DMSO为溶剂,配制浓度为6.8、13.6、20.4、27.2、34 μg/mL的精油样品用于测定。记录反应溶液在波长700 nm处的吸光度,以吸光度值的大小表征样品的还原能力,吸光度值越大,样品的还原能力越强,DMSO作空白对照,BHA作阳性对照。
1.2.7 食用油脂贮藏过程中过氧化值的测定
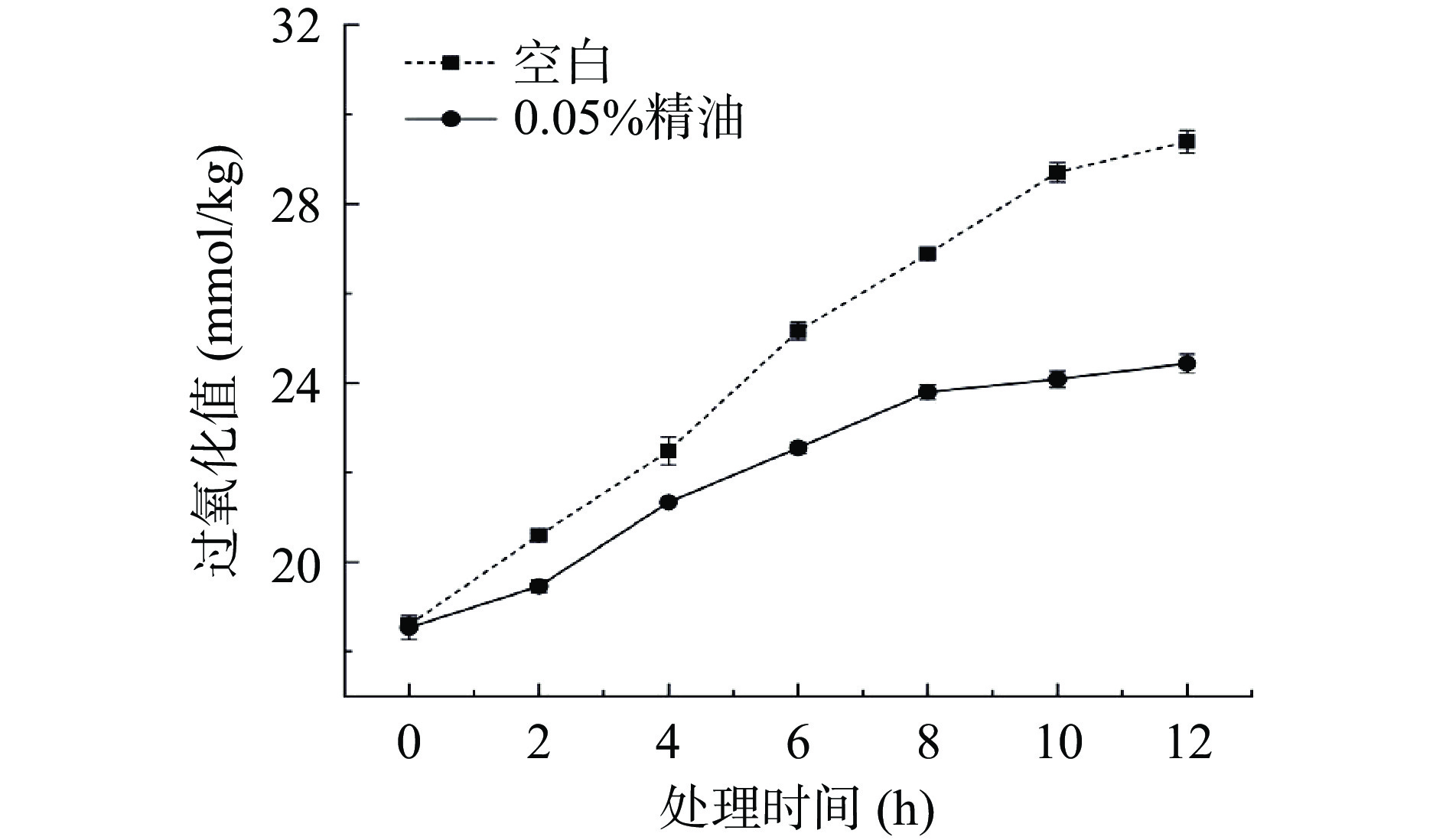
取500 g花生油,于60 ℃水浴中敞口孵育15 min,根据文献中抗氧化剂在食用油中的添加量,并结合实际情况稍作改动确定精油最佳浓度[6],向花生油中添加精油样品使其在油脂中的浓度为0.05%(w/w),通过搅拌使精油均匀分散在花生油中,并向花生油中通入氧气,于60 ℃水浴下恒温敞口孵育12 h,每隔2 h测定花生油的过氧化值(POV)。
油脂过氧化值测定的详细步骤按照国家标准GB 5009.227-2016《食品安全国家标准 食品中过氧化值的测定》规定的方法进行。油脂的过氧化值(mmol/kg)=500×c×(V−V0)/m,式中:V为实验组消耗硫代硫酸钠溶液的体积,mL;V0为空白组消耗硫代硫酸钠溶液的体积,mL;c为硫代硫酸钠溶液的浓度,mol/L;m为花生油样品的质量,g;500为换算系数。
1.2.8 抑菌作用的测定
采用抑菌圈实验测定精油样品的抑菌作用。
受试样品的制备:以50%的甲醇溶液为溶剂配制50 μg/mL的精油样品,以无菌水(蒸馏水121 ℃灭菌20 min)为溶剂配制50 μg/mL的庆大霉素溶液,受试样品均经0.22 μm细菌滤器过滤备用。
含菌双碟平板的制备:取含菌数为1×108 CFU/mL的各供试菌种的菌悬液倒入经高温灭菌(牛肉膏蛋白胨培养基:121 ℃,20 min;土豆培养基:115 ℃,30 min)的培养基中(菌悬液和培养基按体积比1:10),混匀,冷却备用[11]。
将经高温灭菌的牛津杯放置于含菌双碟平板表面,吸取精油样品溶液100 μL注入牛津杯杯体,后把平板放入各菌种适宜的温度下培养(细菌于37 ℃培养24 h,霉菌于37 ℃培养72 h,酵母菌于37 ℃培养24 h),记录抑菌圈的直径,庆大霉素作阳性对照,每组平行3个平板[11]。
1.2.9 最低抑菌浓度及最低杀菌浓度的测定
采用微量二倍稀释法在96孔平板中测定精油样品对受试微生物的最低抑菌浓度(MIC)。使用甲醇溶液(50%,v/v)稀释精油样品(0.15~80 μg/mL)并通过0.22 μm细菌滤器除菌后备用。每孔加入100 μL液体培养基,然后加入相应的精油样品进行对倍稀释,最后再加入100 μL菌悬液,每孔含菌量约为1×108 CFU/mL。将96孔板置于各菌种适宜的温度下培养,肉眼观测受试微生物的生长情况,以完全没有微生物生长的最低的精油样品浓度作为最MIC[12]。
在MIC值的基础上,分别将上述无微生物生长孔中的液体培养基划线接种于平板上,置于各菌种适宜的温度下培养,以平板上无菌落生长的最低的精油样品浓度作为最小杀菌浓度(MBC)[12]。
1.2.10 大肠杆菌生长曲线的测定
以大肠杆菌为对象菌,将其培养至对数期,按2%接种量加入到肉汤培养基中,精油样品的浓度为50 μg/mL。经37 ℃、100 r/min摇床培养,每隔4 h测定培养液在波长600 nm处的光密度(Optical density,OD)值[13]。以时间为横坐标,OD值为纵坐标,绘制大肠杆菌的生长曲线,观察精油对大肠杆菌生长期的影响。
1.2.11 橙汁贮藏过程中总菌数的测定
用50%甲醇溶液稀释精油样品,并将其加入到10 mL的橙汁(初始总菌落数为1×106 CFU/mL左右)中,使其在橙汁中的最终浓度为0.05%(w/v),将橙汁置于37 ℃培养72 h,每隔12 h测定橙汁的菌落总数[14]。不添加精油样品的橙汁作为空白对照,添加0.05%(w/v)苯甲酸钠的橙汁作为阳性对照,样品菌落总数测定的详细步骤按照国家标准GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》规定的方法进行。
1.3 数据处理
每组实验均进行3次重复实验,所有结果均以“平均值±标准差”的形式表示。实验结果用SPSS 25.0的单因素分析(analysis of variance,ANOVA)法进行统计分析,显著性差异P<0.05。
2. 结果与分析
2.1 精油挥发性成分的GC-MS分析
经GC-MS分析,通过数据库检索及质谱标准图谱比对,从粗壮女贞苦丁茶精油中鉴定出相对含量在0.3%以上的挥发性成分22种[15],具体结果如表1所示。
表 1 粗壮女贞苦丁茶精油的挥发性成分及相对含量Table 1. Composition and content of volatile compounds from L. robustum essential oil序号 保留时间(min) RI 化合物名称 化学式 相对含量(%) 实验值 参考值 1 6.68 965 969 α-水芹烯(α-Phellandrene) C10H16 1.46 2 6.96 947 948 α-蒎烯(α-Pinene) C10H16 2.16 3 8.39 966 964 β-水芹烯(β-Phellandrene) C10H16 0.53 4 8.58 942 943 β-蒎烯(β-Pinene) C10H16 0.66 5 9.00 959 958 β-月桂烯(β-Myrcene) C10H16 0.78 6 10.05 921 919 4-蒈烯(4-Carene) C10H16 11.54 7 10.32 1045 1042 邻伞花烃(o-Cymene) C10H14 3.42 8 10.56 967 968 3-蒈烯(3-Carene) C10H16 1.60 9 10.62 1057 1059 桉油精(Eucalyptol) C10H18O 1.94 10 11.65 996 998 γ-萜品烯(γ-Terpinene) C10H16 19.50 11 12.67 1053 1052 萜品油烯 (1-methyl-4-(1-methylethylidene)-Cyclohexene) C10H16 4.29 12 13.20 1081 1082 芳樟醇(3,7-Dimethyl-1,6-octadien-3-ol) C10H18O 1.04 13 16.33 1138 1137 4-萜品醇(4-Terpineol) C10H18O 31.91 14 16.78 1142 1143 α-松油醇(α-Terpineol) C10H18O 3.80 15 21.61 1432 1431 γ-榄香烯(γ-Elemene) C15H24 0.35 16 24.51 1492 1494 石竹烯(Caryophyllene) C15H24 0.46 17 25.12 1389 1386 香橙烯(Alloaromadendrene) C15H24 2.27 18 26.16 1441 1440 α-杜松烯(α-Cadinene) C15H24 3.58 19 26.78 1421 1419 喇叭烯(Ledene) C15H24 2.08 20 26.91 1432 1431 γ-榄香烯(γ-Elemene) C15H24 1.14 21 28.02 1445 1440 1,4-杜松-二烯(1,4-Cadinadiene) C15H24 0.30 22 30.83 1378 1375 α-雪松烯(α-Cedrene) C15H24 0.31 总计 95.12 由表1可知,精油中主要为醇类化合物和烯类化合物。其中醇类的相对含量为36.75%,而醇类化合物中4-萜品醇含量最高(31.91%),是精油中的主要挥发性成分。相关研究表明[16],4-萜品醇无色透明,具有良好的芳香味及抗氧化活性,可较好地改善产品的感官特征,展现出开发为香精香料及抗氧化剂的潜力。此外,精油中烯类的相对含量为53.01%,γ-萜品烯含量最高(19.50%),其次为4-蒈烯(11.54%)。萜品烯具有独特的香味,是一类生产食用香精香料的重要天然原料,主要用以配制人造柠檬和薄荷精油[17],在食品工业中展现出良好的应用前景。同时,精油的挥发性成分中多数为不饱和烯烃类物质,预示着精油样品可能具有淬灭自由基的效果。因此,实验进一步测定了精油的体外抗氧化活性。
2.2 精油对ABTS+自由基的清除作用
粗壮女贞苦丁茶精油对ABTS+自由基的清除作用如图1所示。由图1可知,随受试浓度的增加(85~680 μg/mL),精油对ABTS+自由基的清除作用逐渐增大(18.11%~81.34%),展现出良好的剂量-效应关系。精油的半数有效浓度(Half effective concentration,EC50)值为395.90 μg/mL,阳性对照BHA的EC50值为5.31 mg/mL。结合GC-MS的分析结果可知,粗壮女贞苦丁茶精油中含有大量的醇类及烯类化合物。陈潘等[18]研究发现,精油的挥发性成分中对精油总抗氧化能力影响较大的化合物主要为烯类和醇类,且烯类化合物的含量与精油的总抗氧化能力呈正相关。精油中的烯类和醇类化合物均具有较强的给氢能力,可发生电子转移反应,从而淬灭体系中的自由基,表现出良好的抗氧化活性。
2.3 精油对DPPH自由基的清除作用
DPPH是一种亲脂性的稳定自由基,灵敏度高,常用于天然产抗氧化活性的检测[10]。粗壮女贞苦丁茶精油对DPPH自由基的清除作用如图2所示。由图2可知,随着受试浓度的增加(42.5~212.5 μg/mL),精油对DPPH自由基的清除作用逐渐增大(32.06%~71.39%),展现出良好的剂量-效应关系,其EC50值为165.45 μg/mL,阳性对照BHA的EC50值为4.86 mg/mL。结合ABTS+自由基清除实验的结果可知,粗壮女贞苦丁茶精油能有效清除实验体系中不同的自由基。同其他水提物的DPPH自由基清除活性相比,由于精油具有良好的脂溶性,在以醇为溶剂的DPPH实验体系中,较低的受试浓度范围内仍然表现良好的清除效果,可对自由基引发的氧化反应展现出较强的抑制作用[19],是一种良好的自由基清除剂。因此,实验进一步测定了精油对脂质过氧化反应的抑制作用。
2.4 精油对脂质过氧化的抑制作用
脂质过氧化反应是一种典型的自由基链式反应,会产生丙二醛等有毒物质,引起细胞的氧化损伤,诱发组织器官的氧化病变[20]。同时,脂类食品中脂质过氧化反应的发生,不仅会使食品出现不愉悦的气味,还会严重影响食品的品质[21]。粗壮女贞苦丁茶精油对脂质过氧化的抑制作用如图3所示。
由图3可知,随着受试浓度的增加(85~680 μg/mL),精油对脂质过氧化的抑制作用逐渐增大(17.73%~73.55%),展现出良好的剂量-效应关系,其半数抑制浓度(Half maximal inhibitory concentration,IC50)值为420.1 μg/mL,阳性对照BHA的IC50值为2.98 mg/mL。结合前述实验结果分析可知,粗壮女贞苦丁茶精油在脂溶性反应体系中具有比BHA更为良好的溶解性,可均匀地分散在实验体系中,充分接触并有效清除反应体系中的自由基,从而阻断自由基链式反应,进而有效抑制脂质过氧化反应的发生与发展。
2.5 精油的还原能力
粗壮女贞苦丁茶精油的还原能力如图4所示。由图4可知,随着受试浓度的增大(6.8~34 μg/mL),反应混合物在700 nm下的吸光度逐渐增大,且精油组的吸光度始终强于阳性对照。结果表明,粗壮女贞苦丁茶精油具有良好的还原能力,能在氧化还原反应中发挥较强的给电子作用,淬灭不稳定的自由基,是其展现良好的自由基清除作用的重要原因。同时,精油中富含单萜类物质,它们可与反应体系中的金属离子发生强烈的螯合反应,从而更好地将三价铁离子还原为亚铁离子,进而展现出良好的抗氧化活性。
2.6 精油对油脂贮藏过程中氧化的抑制作用
粗壮女贞苦丁茶精油对花生油在贮藏过程中氧化的抑制作用如图5所示。由图5可知,随着贮藏时间的延长,各组花生油样品的POV值都有不同程度的增大,空白组从18.6 mmol/kg增加到29.4 mmol/kg;精油组从18.5 mmol/kg增加到24.4 mmol/kg。结果表明,在实验条件下,各组花生油均发生了不同程度的氧化变质。同空白组相比,在相同的贮藏时间内,添加精油的花生油展现出较低的POV值,说明粗壮女贞苦丁茶精油可有效抑制花生油在贮藏过程中的氧化酸败。油脂既是一种人体必须的营养素,又是一种食品工业的重要加工原料,还是一种食品热加工中重要的热量传递媒介[21]。由于油脂的结构中碳链较长且饱和度较高,在食品加工和贮藏过程中,油脂容易发生氧化反应,产生大量的醛、酮、酸等副产物[22]。研究表明,油脂的氧化不仅会显著降低其食用价值和油脂类食品的品质,也对油脂在食品加工中的特性有较大的负面影响,还会带来潜在的食品安全风险。从化学反应的本质上分析,油脂的氧化是一种典型的自由基链式反应,该过程的发生和发展既需要自由基推动,又会产生大量自由基[23-25]。若能淬灭反应中产生的自由基,则能有效阻断反应的进行。因此,有效清除反应体系中的自由基是一种抑制油脂氧化变质的重要途径[26-27]。结合前述实验结果,粗壮女贞苦丁茶精油具有良好的自由基清除作用,故能在油脂贮藏过程中清除体系中产生和蓄积的自由基,从而阻断油脂的自由基链式反应,抑制油脂的氧化变质。同时,基于相似相溶的特点,粗壮女贞苦丁茶精油在花生油中展现出良好的分散性,进一步提升其对花生油氧化变质的抑制作用。
2.7 精油的抑菌作用
腐败菌在食品中的生长繁殖是一类引发食品腐败变质的重要原因,且还会进一步引起相关的食源性疾病,进而危害人体健康[28]。因此,抑制食品加工和贮藏过程中腐败菌的生长是提升食品质量与安全和延长食品货架期的一种有效途径。粗壮女贞苦丁茶精油对微生物的抑制作用如表2所示。
表 2 精油的抑菌圈结果Table 2. Inhibition zone of essential oil供试菌类别 供试菌名称 精油样品(mm) 阳性对照(mm) 革兰氏阴性菌 大肠杆菌 29.85±1.26 25.75±1.35 沙门氏菌 25.33±1.59 22.36±1.21 革兰氏阳性菌 金黄色葡萄球菌 24.73±0.81 26.93±1.58 枯草芽孢杆菌 23.69±1.22 24.48±1.19 蜡状芽孢杆菌 22.84±1.62 25.72±1.37 真菌 黄曲霉 27.36±1.19 22.61±0.97 黑曲霉 26.83±1.37 23.51±1.65 青霉 28.77±1.33 26.35±1.52 啤酒酵母 23.15±1.47 24.81±1.49 由表2可知,精油对供试菌株的生长繁殖均展现出显著的抑制作用,在实验条件下表现出良好的广谱抑菌作用。其中,精油对细菌和真菌的抑制作用较强;对革兰阴性菌与真菌的抑制作用强于阳性对照;对大肠杆菌的抑菌效果最强,其次为青霉。实验进一步测定了精油对供试菌株的最小抑菌浓度(MIC)和最小杀菌浓度(MBC),结果如表3所示。
表 3 精油对供试菌株的MIC和MBC值Table 3. MIC and MBC values of essential oil against the strains供试菌类别 供试菌名称 MIC (μg/mL) MBC (μg/mL) 革兰氏阴性菌 大肠杆菌 0.31 1.25 沙门氏菌 0.62 2.50 革兰氏阳性菌 金黄色葡萄球菌 0.62 2.50 枯草芽孢杆菌 2.50 5.00 蜡状芽孢杆菌 5.00 20.00 真菌 黄曲霉 27.36 0.62 黑曲霉 26.83 1.25 青霉 28.77 0.62 啤酒酵母 23.15 1.25 由表3可知,精油对供试细菌的MIC和MBC值的范围分别是0.31~5.00 μg/mL及1.25~20.00 μg/mL;对供试真菌的MIC和MBC值的范围分别是0.62~1.25 μg/mL及1.25~2.50 μg/mL;精油对革兰氏阴性菌展现出较强的抑制作用;大肠杆菌对精油较为敏感。结果表明,粗壮女贞苦丁茶精油在较低浓度下即可杀灭供试菌株或抑制其生长繁殖,具有良好的抑菌作用。为进一步观察精油对微生物各生长期的影响,实验以大肠杆菌为对象绘制了生长曲线,结果如图6所示。
由图6可知,同空白组相比,粗壮女贞苦丁茶精油明显抑制了大肠杆菌的生长,且主要作用于大肠杆菌的对数生长期,从而使其无法正常生长繁殖,进而使得实验体系的OD值维持在较低的水平[29]。对数生长期是微生物生长的关键环节,微生物在对数生长期呈现出较大的生长和繁殖速度[30]。结果表明,粗壮女贞苦丁茶精油能有效抑制大肠杆菌在对数生长期的繁殖,并通过缩短菌体的对数生长期及减缓其生长速率起到抑菌的作用。相关研究指出,植物精油的抑菌活性主要由其中一些萜烯类化合物产生,它们可通过破坏微生物细胞壁和细胞膜的完整性,引起细胞内容物的外溢,从而抑制微生物的生长与繁殖[30]。粗壮女贞苦丁茶精油中含有的大量萜烯类化合物,因此精油在实验中展现出很好的抑菌效果。
2.8 精油对橙汁贮藏过程中总菌数的影响
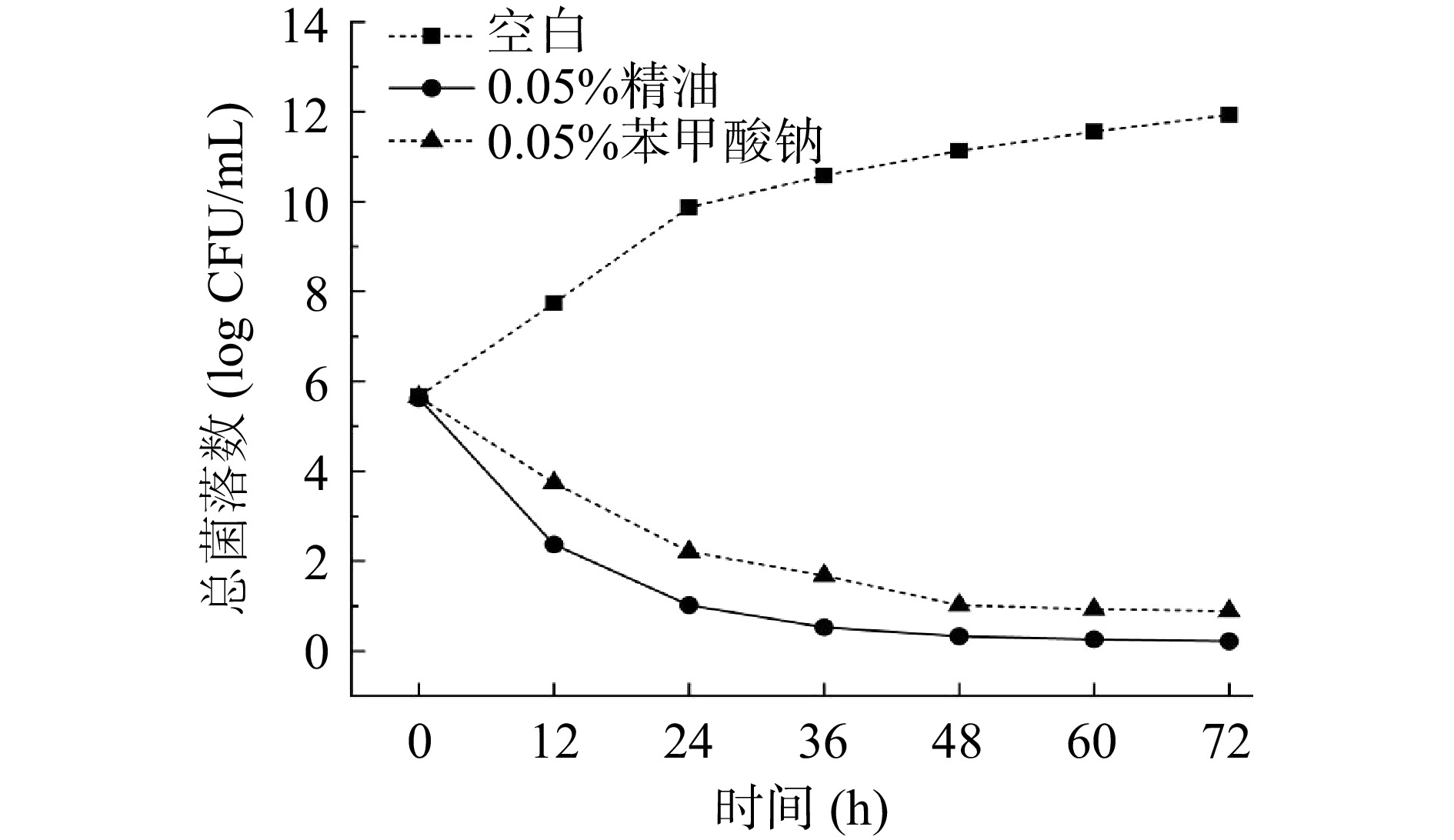
实验以橙汁为模型,观察了粗壮女贞苦丁茶精油在食品贮藏过程中对微生物生长的抑制作用,结果如图7所示。
由图7可知,随着贮藏期的延长,空白组橙汁中的微生物不断生长,总菌数逐渐增大。在36 h内,精油组橙汁中的总菌数显著低于空白组和阳性对照组;在36 h后,各试验组橙汁中总菌数逐渐趋于稳定,空白对照组总菌数为1×1012 CFU/mL,阳性对照组为1×101 CFU/mL,精油组基本没有微生物生长。橙汁中的主要优势腐败微生物为耐高酸的细菌和酿酒酵母等,结合前述实验可知,粗壮女贞苦丁茶精油具有良好的广谱抑菌性,在食品的贮藏过程中具有良好的抑菌防腐效果,可有效抑制橙汁中微生物的生长或杀死微生物,可能对延长橙汁的贮藏期有益。此外,橙汁中的萜烯烃类和醛类有助于橙汁呈现出橙子的新鲜、自然的风味,而粗壮女贞苦丁茶精油亦含有萜烯烃类及醛类,有益于维持橙汁特有的风味。同时,精油在橙汁中的添加量较低,其含有的其他成分对橙汁的风味基本没有影响。
3. 结论
粗壮女贞苦丁茶精油中主要含有4-萜品醇、γ-萜品烯和4-蒈烯等22种挥发性成分。精油具有良好的抗氧化作用和较强的还原能力,能够有效清除反应体系中的自由基(ABTS+自由基EC50:395.9 μg/mL、DPPH自由基EC50:165.45 μg/mL),抑制脂质过氧化反应(IC50:420.1 μg/mL),并显著抑制花生油在贮藏过程中的氧化变质。此外,粗壮女贞苦丁茶精油展现出良好的广谱抑菌作用(供试菌MIC:0.31~5.0 μg/mL;MBC:1.25~20.0 μg/mL),对大肠杆菌等革兰氏阴性菌具有明显的抑制效果,能显著抑制微生物在对数生长期的繁殖。同时,精油能有效抑制橙汁在贮藏过程中总菌数的增加。实验结果表明,粗壮女贞苦丁茶精油具有良好的抗氧化及抑菌作用,研究为粗壮女贞苦丁茶精油在食品加工与贮藏领域的应用提供了实验基础与支撑。后续还需要进一步优化和确定精油在相关食品中添加的工艺参数,并对其在抗氧化和抑菌活性中的构效关系和相关分子机理进行研究。
-
表 1 粗壮女贞苦丁茶精油的挥发性成分及相对含量
Table 1 Composition and content of volatile compounds from L. robustum essential oil
序号 保留时间(min) RI 化合物名称 化学式 相对含量(%) 实验值 参考值 1 6.68 965 969 α-水芹烯(α-Phellandrene) C10H16 1.46 2 6.96 947 948 α-蒎烯(α-Pinene) C10H16 2.16 3 8.39 966 964 β-水芹烯(β-Phellandrene) C10H16 0.53 4 8.58 942 943 β-蒎烯(β-Pinene) C10H16 0.66 5 9.00 959 958 β-月桂烯(β-Myrcene) C10H16 0.78 6 10.05 921 919 4-蒈烯(4-Carene) C10H16 11.54 7 10.32 1045 1042 邻伞花烃(o-Cymene) C10H14 3.42 8 10.56 967 968 3-蒈烯(3-Carene) C10H16 1.60 9 10.62 1057 1059 桉油精(Eucalyptol) C10H18O 1.94 10 11.65 996 998 γ-萜品烯(γ-Terpinene) C10H16 19.50 11 12.67 1053 1052 萜品油烯 (1-methyl-4-(1-methylethylidene)-Cyclohexene) C10H16 4.29 12 13.20 1081 1082 芳樟醇(3,7-Dimethyl-1,6-octadien-3-ol) C10H18O 1.04 13 16.33 1138 1137 4-萜品醇(4-Terpineol) C10H18O 31.91 14 16.78 1142 1143 α-松油醇(α-Terpineol) C10H18O 3.80 15 21.61 1432 1431 γ-榄香烯(γ-Elemene) C15H24 0.35 16 24.51 1492 1494 石竹烯(Caryophyllene) C15H24 0.46 17 25.12 1389 1386 香橙烯(Alloaromadendrene) C15H24 2.27 18 26.16 1441 1440 α-杜松烯(α-Cadinene) C15H24 3.58 19 26.78 1421 1419 喇叭烯(Ledene) C15H24 2.08 20 26.91 1432 1431 γ-榄香烯(γ-Elemene) C15H24 1.14 21 28.02 1445 1440 1,4-杜松-二烯(1,4-Cadinadiene) C15H24 0.30 22 30.83 1378 1375 α-雪松烯(α-Cedrene) C15H24 0.31 总计 95.12 表 2 精油的抑菌圈结果
Table 2 Inhibition zone of essential oil
供试菌类别 供试菌名称 精油样品(mm) 阳性对照(mm) 革兰氏阴性菌 大肠杆菌 29.85±1.26 25.75±1.35 沙门氏菌 25.33±1.59 22.36±1.21 革兰氏阳性菌 金黄色葡萄球菌 24.73±0.81 26.93±1.58 枯草芽孢杆菌 23.69±1.22 24.48±1.19 蜡状芽孢杆菌 22.84±1.62 25.72±1.37 真菌 黄曲霉 27.36±1.19 22.61±0.97 黑曲霉 26.83±1.37 23.51±1.65 青霉 28.77±1.33 26.35±1.52 啤酒酵母 23.15±1.47 24.81±1.49 表 3 精油对供试菌株的MIC和MBC值
Table 3 MIC and MBC values of essential oil against the strains
供试菌类别 供试菌名称 MIC (μg/mL) MBC (μg/mL) 革兰氏阴性菌 大肠杆菌 0.31 1.25 沙门氏菌 0.62 2.50 革兰氏阳性菌 金黄色葡萄球菌 0.62 2.50 枯草芽孢杆菌 2.50 5.00 蜡状芽孢杆菌 5.00 20.00 真菌 黄曲霉 27.36 0.62 黑曲霉 26.83 1.25 青霉 28.77 0.62 啤酒酵母 23.15 1.25 -
[1] 吕雯雯, 王文庆, 吴华, 等. 脂溶性迷迭香抗氧化剂对油脂的抗氧化作用和生鲜猪肉的保鲜效果[J]. 中国油脂,2021,46(3):142−148. [LÜ W W, WANG W Q, WU H, et al. Effects of fat-soluble rosemary antioxidant on the antioxidant effect of edible oil and preservation of fresh pork[J]. China Oils and Fats,2021,46(3):142−148. [2] YU C Y, ZHANG J F, WANG T. Star anise essential oil: Chemical compounds, antifungal and antioxidant activities: A review[J]. Journal of Essential Oil Research, 2021, 33(1): 1−22.
[3] 解久莹, 张翔宇, 吴永强, 等. 煎炸油使用安全及有害成分控制研究进展[J]. 食品工业科技,2019,40(15):333−338. [XIE J Y, ZHANG X Y, WU Y Q, et al. Research progress of safety and harmful component control in frying oil[J]. Science and Technology of Food Industry,2019,40(15):333−338. doi: 10.13386/j.issn1002-0306.2019.15.055 [4] 崔强, 赵治国, 李菁雯, 等. 微生物检验技术研究进展[J]. 食品研究与开发,2018,39(21):211−215. [CUI Q, ZHAO Z G, LI J W, et al. Research progress of microbiological inspection technology[J]. Food Research and Development,2018,39(21):211−215. doi: 10.3969/j.issn.1005-6521.2018.21.035 [5] 尹国利, 赵露, 邹成梅, 等. 超声波辅助提取苦丁茶多酚及其抗氧化与降糖活性研究[J]. 食品研究与开发, 2020, 41(17): 48−55 YIN G L, ZHAO L, ZOU C M, et al. Ultrasound-assisted extraction of polyphenols from llex latifolia Thunb. and its antioxidant and hypoglycemic activities[J]. Food Research and Development 2020, 41(17): 48−55.
[6] 梁恒宇, 高浩祥, 何强, 等. 粗壮女贞苦丁茶提取物对油脂氧化的抑制作用[J]. 食品安全质量检测学报,2021,12(15):6139−6145. [LIANG H Y, GAO H X, HE Q, et al. Inhibition effect of Ligustrum robustum (Rxob.) Blume extract on the oxidation of oil[J]. Food Safety and Quality Detection Technology,2021,12(15):6139−6145. [7] YU Z L, ZENG W C. Antioxidant, antibrowning, and cytoprotective activities of Ligustrum robustum (Rxob.)Blume extract[J]. Journal of Food Science,2013,78(9):234−240.
[8] CORNELIA V, MIHAELA B. Progresses in food packaging, food quality, and safety—controlled-release antioxidant and/or antimicrobial packaging[J]. Molecules,2021,26(5):1263. doi: 10.3390/molecules26051263
[9] 孟雨东, 董颖, 陈鑫沛, 等. 怀菊花精油提取工艺优化[J]. 食品工业科技,2020,41(24):157−161. [MENG Y D, DONG Y, CHEN X P, et al. Optimization of extraction conditions of essential oil from Huai Chrysanthemum[J]. Science and Technology of Food Industry,2020,41(24):157−161. [10] 曾维才, 石碧. 天然产物抗氧化活性的常见评价方法[J]. 化工进展,2013,32(6):1205−1213. [ZENG W C, SHI B. Common methods of antioxidant activity evaluation for natural products: A review[J]. Chemical Industry and Engineering Progress,2013,32(6):1205−1213. [11] 高永生, 金斐, 朱丽云, 等. 植物精油及其活性成分的抗菌机理[J]. 中国食品学报,2022,22(1):376−388. [GAO Y S, JIN F, ZHU L Y, et al. Antimicrobial mechanism of plant essential oils and its active ingredients[J]. Journal of Chinese Institute of Food Science and Technology,2022,22(1):376−388. [12] 黄晓英, 李启明, 吴华星, 等. 传统发酵食品中具有抑菌活性乳酸菌筛选及其代谢产物稳定性分析[J]. 现代食品科技,2021,37(11):68−78. [HUANG X Y, LI Q M, WU H X, et al. Screening of traditional fermented food products for lactic acid bacteria with antibacterial activity and stability analysis of their metabolites[J]. Modern Food Science and Technology,2021,37(11):68−78. [13] 金虹, 李海帅, 帖金凤, 等. 应用微量稀释法测定消毒剂最小抑菌浓度方法的建立[J]. 中国消毒学杂志,2018,35(11):801−804. [JIN H, LI H S, TIE J F, et al. Establishment of a broth microdilution MIC testing method for disinfectants[J]. Chinese Journal of Disinfection,2018,35(11):801−804. doi: 10.11726/j.issn.1001-7658.2018.11.001 [14] 阚玉红, 谢笔钧, 孙智达. 胭脂红番石榴叶黄酮提取物的抑菌活性及其机理[J]. 中国调味品,2021,46(12):159−166. [KAN Y H, XIE B J, SUN Z D. Antibacterial activity and mechanism of flavonoids extracted from leaves of Psidium guajava Linn doi: 10.3969/j.issn.1000-9973.2021.12.030 J]. China Condiment,2021,46(12):159−166. doi: 10.3969/j.issn.1000-9973.2021.12.030
[15] 王娟, 杜静怡, 贾雪颖, 等. 花椒精油及其水提物的香气活性成分分析[J]. 食品工业科技,2021,42(20):229−241. [WANG J, DU J Y, JIA X Y, et al. Characterization of the aroma-active compounds in essential oil and water extract of Zanthoxylum bungeanum pericarp[J]. Science and Technology of Food Industry,2021,42(20):229−241. [16] 甘芝霖, 倪元颖. γ-萜品烯的体内外抗氧化性研究[J]. 食品工业科技,2019,40(6):100−105. [GAN Z L, NI Y Y. Antioxidant capacity of γ-Terpinene in vitro andin vivo[J]. Science and Technology of Food Industry,2019,40(6):100−105. doi: 10.13386/j.issn1002-0306.2019.06.017 [17] YU Z L, ZHANG Z, ZENG W C. Investigation of antibrowning activity of pine needle (Cedrus deodara) extract with fresh-cut apple slice model and identification of the primary active components[J]. European Food Research and Technology,2014,239(4):669−678. doi: 10.1007/s00217-014-2263-3
[18] 陈潘, 席斌, 高雅琴, 等. 4种精油组成成分及总抗氧化活性分析研究[J]. 中国调味品,2020,45(11):60−66. [CHEN P, XI B, GAO Y Q, et al. Analysis of composition and total antioxidant activity of four essential oils[J]. China Condiment,2020,45(11):60−66. doi: 10.3969/j.issn.1000-9973.2020.11.013 [19] CHEN X, LIANG L, HAN C. Borate suppresses the scavenging activity of gallic acid and plant polyphenol extracts on DPPH radical: A potential interference to DPPH assay[J]. LWT-Food Science and Technology,2020,131(9):1−7.
[20] 王晓宇, 杜国荣, 李华. 抗氧化能力的体外测定方法研究进展[J]. 食品与生物技术学报,2012,31(3):247−252. [WANG X Y, DU G R, LI H. Research progress of plant-derived antimicrobial agents[J]. Journal of Food Science and Biotechnology,2012,31(3):247−252. doi: 10.3969/j.issn.1673-1689.2012.03.004 [21] SENANAYAKE S N. Green tea extract: Chemistry, antioxidant properties and food applications: A review[J]. Journal of Functional Foods,2013,5(4):1529−1541. doi: 10.1016/j.jff.2013.08.011
[22] 高浩祥, 陈南, 徐乾达, 等. 油炸过程中茶多酚对油脂品质的影响[J]. 食品科学,2021,42(4):1−7. [GAO H X, CHEN N, XU Q D, et al. Effect of tea polyphenols on the quality and storage stability of potato chips during frying[J]. Food Chemistry,2021,42(4):1−7. doi: 10.7506/spkx1002-6630-20191010-075 [23] 曹君, 李红艳, 邓泽元. 植物油氧化稳定性的研究进展[J]. 食品工业科技,2013,34(7):378−382. [CAO J, LI H Y, DENG Z Y. Research progress in oxidative stability of vegetable oil[J]. Science and Technology of Food Industry,2013,34(7):378−382. [24] WANG Z M, HE Z F, MARA A, et al. Effects of malondialdehyde as a byproduct of lipid oxidation on protein oxidation in rabbit meat[J]. Food Chemistry,2019,288:405−412. doi: 10.1016/j.foodchem.2019.02.126
[25] 王赛楠, 郭立净, 智文莉, 等. 食用油、油脂及其制品的质量安全风险分析与监管对策研究[J]. 中国油脂,2020,45(9):38−42. [WANG S N, GUO L J, ZHI W L, et al. Risk analysis and supervision countermeasure on quality safety of oils, oils and fats and their products[J]. China Oils and Fats,2020,45(9):38−42. [26] CHEMAT F, GRONDIN I, COSTES P, et al. High power ultrasound effects on lipid oxidation of refined sunflower oil[J]. Ultrasonics Sonochemistry,2004,11(5):281−285. doi: 10.1016/j.ultsonch.2003.07.004
[27] YIN J, ZHANG W J, RICHARDS M P. Attributes of lipid oxidation due to bovine myoglobin, hemoglobin and hemolysate[J]. Food Chemistry,2017,234:335−341.
[28] 朱丹实, 吴逗逗, 沈雨思, 等. 多菌种混合发酵果蔬汁的研究进展[J]. 中国食品学报,2021,21(10):343−352. [ZHU D S, WU D D, SHEN Y S, et al. Research progress on mixed fermentation of multiple strains for fruits and vegetables juice[J]. Journal of Chinese Institute of Food Science and Technology,2021,21(10):343−352. [29] YUE H Y, HAN Y Y, YIN B R, et al. Comparison of the antipathogenic effect toward Staphylococcus aureus of N-linked and free oligosaccharides derived from human, bovine, and goat milk[J]. Journal of Food Science,2020,85(8):2713−2721.
[30] 陈志迪, 王新宇, 李晴雯, 等. 植物源抑菌剂的研究进展[J]. 食品安全质量检测学报,2021,12(18):7433−7439. [CHEN Z D, WANG X Y, LI Q W, et al. Research progress of plant-derived antimicrobial agents[J]. Food Safety and Quality Detection Technology,2021,12(18):7433−7439.





 下载:
下载:


 下载:
下载:
