Comparison of Characterization Methods for Denaturation Degree of Shrimp Head Protein during Heating
-
摘要: 为选择适合虾头蛋白变性程度的表征方法,本研究以虾头中提取的混合蛋白为材料,在100 ℃下加热处理一定时间,通过溶解度法、SDS-PAGE法、圆二色谱法、荧光光谱法等定量表征蛋白质变性程度并比较。研究结果表明:溶解度法、SDS-PAGE法、圆二色谱法、荧光光谱法在表征加热过程中虾头蛋白变性程度上具有一致性,不同浓度的虾头蛋白在加热过程中变性程度都呈S型上升趋势,但在加热1~4 min之间变性速率存在差异,其中蛋白溶解度的变性程度对加热时间的灵敏度最为显著。这表明选择溶解度作为表征虾头蛋白变性程度的方法更加便捷。研究结果为食品加工过程中表征蛋白变性程度提供了方法参考。Abstract: In order to select the suitable characterization method for the denaturation degree of shrimp head protein, the mixed protein extracted from shrimp head was heated at 100 ℃ for a certain time. The denaturation degree of protein was characterized and compared by solubility method, SDS-PAGE method, circular dichroism and fluorescence spectrum. The results showed that solubility method, SDS-PAGE method, circular dichroism and fluorescence spectroscopy were consistent in characterizing the denaturation degree of shrimp head protein during heating. The denaturation degree of shrimp head protein with different concentrations showed an S-shaped upward trend during heating, but there was a difference in denaturation rate between heating 1~4 min. Among them, the denaturation degree of protein solubility was the most sensitive to heating time. This showed that solubility was more convenient to choose as a method to characterize the denaturation degree of shrimp head protein. The results provide a method reference for characterizing the degree of protein denaturation in food processing.
-
凡纳滨对虾(Litopenaeus vannamei),又称南美白对虾,是世界上最重要的经济虾类之一,多年来中国养殖产量居世界首位。凡纳滨对虾的加工主要以去头或去壳后冷冻为主,在加工过程中会产生40%~50%的副产物(虾头、虾壳和虾尾);虾头又是凡纳滨对虾加工副产物的主要组成部分,占副产物的70%~80%[1-2]。
蛋白质是虾头中含量最多的营养成分,约占虾头的12%~18%[3]。在食品工业中,常采用生物酶解法利用虾头蛋白质开发生物活性肽[4]和虾类调味品(虾酱、虾粉、虾呈味基料)[5-6]等,但在酶解过程中存在水解度低和蛋白质利用率低的问题。在实际生产中,通常选择特异性的蛋白酶和优化酶解条件来提高水解度和蛋白质利用率[7-8],然而改变酶解底物蛋白质结构也是提高水解度和蛋白质利用率的重要途径之一。已有研究表明:蛋白质在酶解处理之前进行预处理适度变性,促使蛋白质肽链逐渐伸展,能够暴露出更多的酶切位点,从而增加水解度和提高蛋白质利用率[9-11]。热处理是诱导蛋白质变性常用的处理方法。适度热处理,蛋白质发生适度变性有利于酶解反应;过度热处理,蛋白质过度变性反而会抑制酶解反应[12]。但是,如何表征蛋白质的变性程度以及蛋白质变性到什么程度最适于酶解反应,目前还尚不明晰。因此,探索蛋白质变性程度的定性和定量表征,有助于阐明蛋白变性程度对蛋白酶解特性影响的机理。为了获得高水解度、高蛋白质利用率的虾头酶解产品,可以通过控制加热过程以防止过度变性和质量劣化。
由于不同来源蛋白质的理化特性和分子结构有较大差异,蛋白变性情况也会存在较大差异。国内外蛋白质变性程度方法的研究:一是测定蛋白质的理化特性如溶解度[13]和热力学特性[14]等;二是测定分子结构包括二级结构[15]和三级结构[16]等;三是建立蛋白变性模型以预测蛋白的变性程度[17]。这些方法主要是定性地分析不同预处理后蛋白的变化趋势,但直观定量表征蛋白质具体变性程度的研究较少。本研究以虾头中提取的混合蛋白为材料,在100 ℃加热一定时间,分析蛋白质溶解度、SDS-PAGE、圆二色谱和荧光光谱特征的变化,创新性地选择部分特征数据指标对蛋白质变性程度进行定性和定量表征,探索适合于表征虾头蛋白质变性程度的快速直观方法,为合理控制酶解过程、提高水解度和蛋白质利用率提供技术参考。
1. 材料与方法
1.1 材料与仪器
鲜活凡纳滨对虾,规格50~60尾/kg 湛江霞山水产批发市场,利用海水充氧活运至实验室;考马斯亮蓝蛋白测定试剂盒 北京索莱宝科技有限公司;考马斯亮蓝染色液、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)预制胶、SDS-PAGE蛋白上样缓冲液(5×)、磷酸盐缓冲液(Phosphate buffer solution,10×PBS,pH7.4) 上海碧云天生物技术有限公司;本实验所用试剂均为分析纯。
Chirascan V100圆二色光谱仪 英国Applied Photophysics公司;Varioskan Flash型全自动酶标仪 美国Thermo Fisher Scientific公司;RF-5301PC型荧光色谱仪 日本岛津公司;DYY-11型电泳仪 北京市六一仪器厂;JYL-C022绞肉机 山东九阳股份有限公司;FDU551型冷冻干燥机 日本东京理化器械株式会社;JXH-200恒温混匀仪 上海净信实业有限公司;Sigma3-30KS台式高速冷冻离心机 德国sigma离心机有限公司;VOPADEST450型全自动凯式定氮仪 中国广州德资格哈特仪器有限公司。
1.2 实验方法
1.2.1 虾头粗蛋白的提取
凡纳滨对虾头粗蛋白的提取参考邵虎明[18]的方法并略作改动。在冰水中将凡纳滨对虾头沿头胸甲末端取下,控干水分,于4 ℃冰箱贮藏待用。取适量虾头用绞肉机绞碎(每绞15 s暂停10 s,防止温度过高使蛋白变性)。取100 g绞碎虾头,按质量体积比1:6加入0.1 mol/L pH7.4 PBS,在冰水浴中磁力搅拌6 h,离心20 min(4 ℃,10000 r/min)。将离心后的沉淀按质量体积比1:4重新溶于PBS溶液,搅拌4 h后再次离心,合并两次上清液,用纱布过滤除去杂质得到虾头粗蛋白溶液。将虾头粗蛋白溶液直接冷冻干燥成蛋白粉于−20 ℃保存备用。
1.2.2 虾头蛋白热处理
1.2.2.1 虾头粗蛋白浓度
凯式定氮法测定鲜虾头粗蛋白为16 g/100 g,提取的虾头粗蛋白溶液浓度约为12 g/100 g,其余为基质蛋白和非蛋白氮。因此,虾头粗蛋白含量以12 g/100 g计(折算为约120 mg/mL)。在虾头酶解开发活性肽或呈味基料时,通常按照料液质量体积比(1:1、1:2、1:3)加水进行酶解处理,加水后粗蛋白浓度分别约为60、40、30 mg/mL。为了与实际生产相一致,称取虾头蛋白粉,加入适量蒸馏水复溶,分别配制成蛋白含量为60、40、30 mg/mL的虾头粗蛋白溶液。
1.2.2.2 热处理方法
取虾头粗蛋白溶液2 mL于试管中,置于100 ℃恒温混匀仪分别加热1、2、3、4、5、6、7、8 min后立即放入碎冰中冷却平衡。将热处理后的虾头粗蛋白溶液冷冻离心15 min(4 ℃,10000 r/min),取上清液用于测试蛋白质的溶解度、SDS-PAGE、圆二色谱和荧光光谱。以未加热处理的虾头粗蛋白溶液作为对照组。
1.2.3 溶解度测定
参考刘书成等[19]的方法。用考马斯亮蓝法测热处理后经冷冻离心上清液中的蛋白质浓度,蛋白溶解度用公式(1)计算:
溶解度(%)=ρ 2ρ 1×100 (1) 式中:
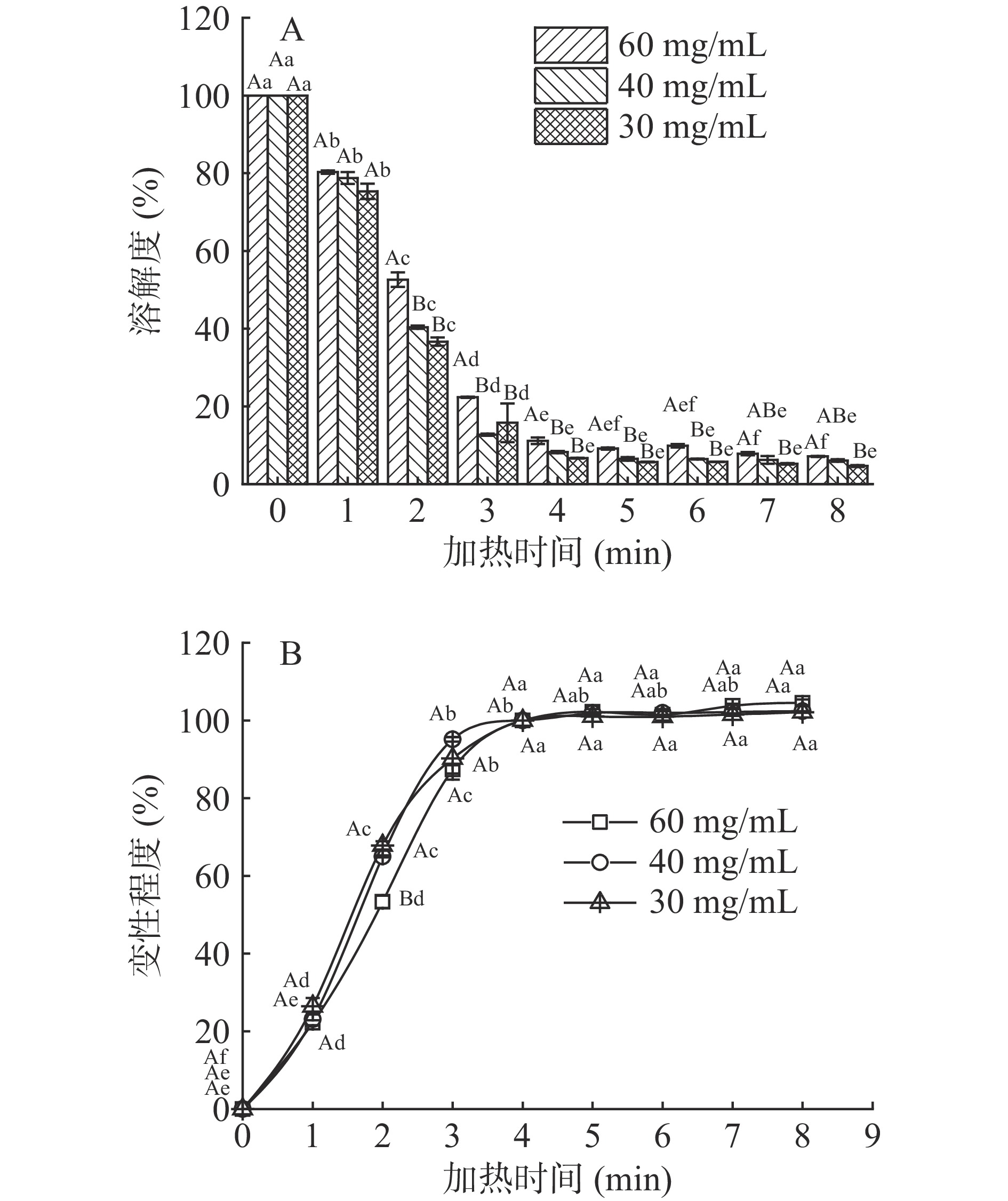
ρ 1 为离心前虾头蛋白质浓度(mg/mL);ρ2 为离心后上清液中蛋白质浓度(mg/mL)。由图1A结果,定义未经加热处理的虾头蛋白为未变性状态,蛋白溶解度为S0;在100 ℃加热4 min时(溶解度无显著变化)为完全变性状态,蛋白溶解度为Sz;100 ℃加热0~4 min的虾头蛋白溶解度为Sn。用公式(2)表征虾头蛋白的变性程度ΔS[20]:
ΔS=S0−SnS0−Sz×100 (2) 1.2.4 SDS-PAGE电泳分析
将1.2.2加热处理后的蛋白质溶液稀释至1 mg/mL。取10 μL SDS-PAGE蛋白上样缓冲液(5×)和40 μL样品混匀后沸水浴加热5 min,即为电泳样品,上样量为15 μL。SDS-PAGE:分离胶浓度12%,浓缩胶浓度4%,电极缓冲液(pH8.9)。电泳结束后,胶片用考马斯亮蓝染色液染色90 min,再用脱色液(醋酸:无水乙醇:水=1:4:5)脱至条带清晰。用10~180 kDa的分子量标记校准观察,分析胶片中蛋白质条带变化。
灰度分析:将凝胶成像的电泳图,用Image J软件进行灰度分析。蛋白质电泳条带的相对灰度用公式(3)计算:
相对灰度(%)=BA×100 (3) 式中:A为未加热处理蛋白质电泳条带的灰度值;B为加热处理后蛋白质电泳条带的灰度值。
1.2.5 圆二色谱(Circular dichroism,CD)分析
采用Chirascan V100圆二色光谱仪进行二级结构分析。用去离子水将蛋白质溶液的浓度调节至0.04 mg/mL,置于0.05 cm光径的石英样品池中,以100 nm/min在远紫外区(190~260 nm)进行扫描,测蛋白质的椭圆率。
1.2.6 内源荧光光谱测定
参考Sun等[21]的方法并略作修改。用去离子水将蛋白质溶液的浓度调节至0.04 mg/mL,用RF-5301PC型荧光色谱仪进行扫描,激发波长280 nm,扫描范围300~450 nm,狭缝宽度为5 nm。
1.3 数据处理
试验重复3批次,每批次3个平行处理,数据以平均值±标准差表示。采用JMP统计软件进行单因素方差和Tukey HSD多重比较分析,以95%置信水平确定差异显著性;用Image J分析SDS-PAGE电泳条带灰度;用Origin 2021软件作图。
2. 结果与分析
2.1 虾头蛋白溶解度与变性程度
溶解度在一定程度上可以代表总可溶性蛋白含量,也是蛋白质变性程度的一个重要表征指标[22]。图1A是不同浓度虾头蛋白在加热过程中的溶解度变化。加热前4 min,随着加热时间延长,虾头蛋白的溶解度逐渐下降。因为加热使蛋白质肽链展开,包埋在蛋白质内部的疏水性基团暴露,亲水性基团相对减少,蛋白质疏水性增加,导致部分蛋白质发生聚集沉淀,使蛋白溶解度降低[22-23]。也有研究发现在热处理过程中蛋白质容易发生氧化,使蛋白质交联增加,导致蛋白质溶解度降低[24]。与未加热虾头蛋白相比,加热处理4 min时,虾头蛋白溶解度降低了约90%;在加热时间4 min后,再延长加热时间,虾头蛋白的溶解度不再有显著变化(P>0.05)。这主要是由于虾头的可溶性蛋白在加热过程中逐渐变性沉淀,在加热到4 min时可溶性蛋白变性沉淀达到最大值。罗嫚[25]利用SDS-PAGE电泳图谱得出猪肉蛋白经过75 ℃水浴加热3~5 min时接近完全变性,与本研究结果相似。
以溶解度表征虾头蛋白的变性程度,按照公式(2)计算,结果见图1B。在加热0~4 min时,随着加热时间增加,虾头蛋白的变性程度显著增加(P<0.05),在4 min时变性程度达到最大值;在加热4 min以后,虾头蛋白的变性程度不再显著增加且趋于平稳(P>0.05),这说明虾头蛋白在加热4 min时已达到完全变性。
2.2 虾头蛋白SDS-PAGE电泳与变性程度
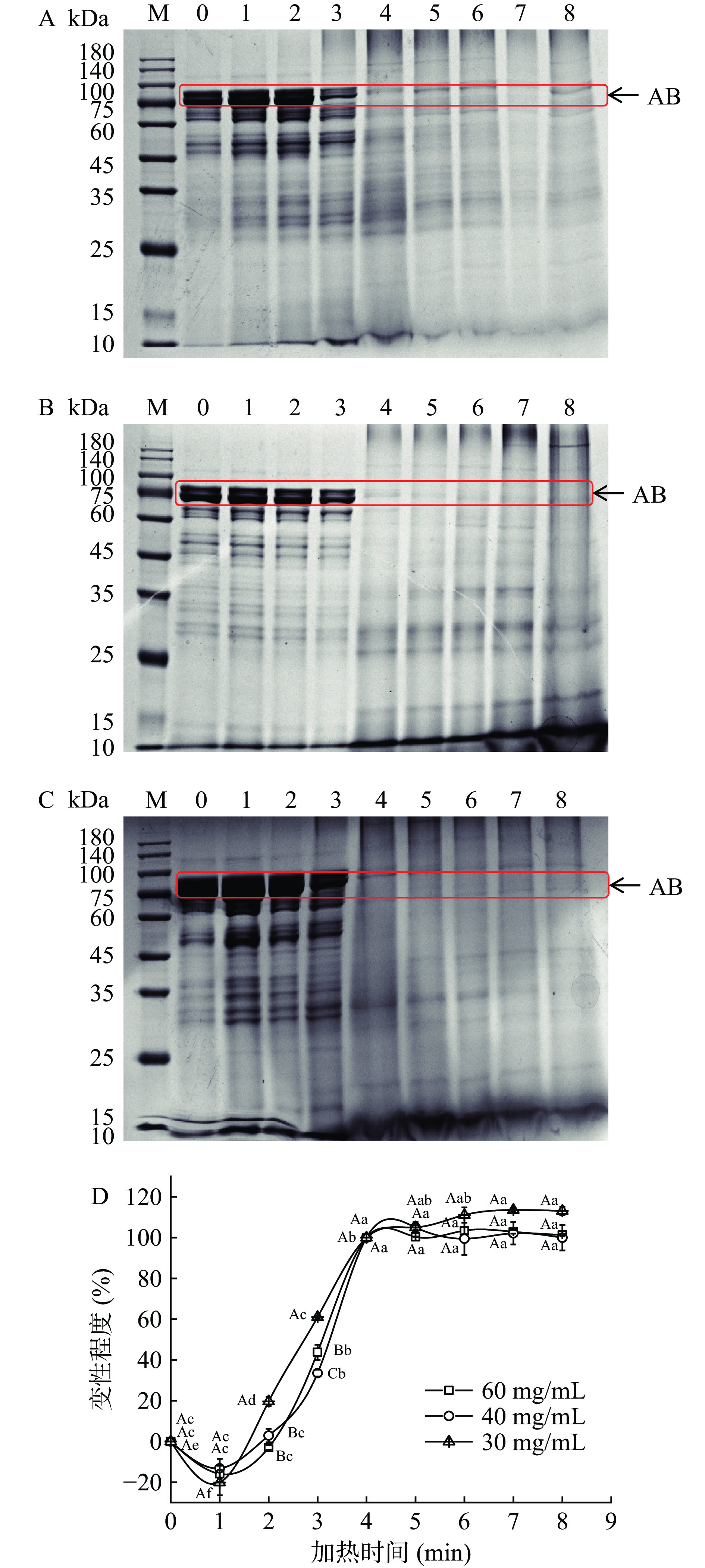
图2中A、B和C分别为60、40、30 mg/mL虾头蛋白热处理后的SDS-PAGE电泳图谱。由图2A、2B和2C可知,虾头蛋白的分子质量分布在25~100 kDa,但主要集中在75 kDa附近。这说明75 kDa附近的蛋白质是虾头的主要蛋白,记75 kDa附近的电泳条带区域为AB带。由图2A、2B和2C可知,随着加热时间的增加,三种浓度虾头蛋白的电泳图谱中AB带的灰度均逐渐变浅,尤其在4 min后,AB带的灰度不再有明显变化。这说明AB带的蛋白质在加热过程中逐渐变性,在加热4 min时达到完全变性。加热处理会使蛋白质变性聚集而沉淀,变性蛋白留在沉淀中,而电泳样品是加热处理后离心的上清液,因此变性蛋白的电泳条带灰度会随变性程度的增加而逐渐变浅,甚至消失[20]。在本实验的加热过程中,AB带的灰度变化最明显,因此可用AB带来指示虾头蛋白加热过程中的变性程度。
由图2A、2B和2C可知,加热过程中蛋白质在SDS-PAGE图谱中分子量约75 kDa附近的电泳条带变化最明显,将该区域条带表示为AB。定义未经加热处理的虾头蛋白为未变性状态,AB条带的相对灰度值为AB0;在100 ℃加热4 min时(AB条带完全消失)为完全变性状态,AB条带的相对灰度值为ABz;100 ℃加热0~4 min的虾头蛋白AB条带相对灰度值为ABn。用公式(4)表征虾头蛋白的变性程度ΔSDS-PAGE:
ΔSDS−PAGE=AB0−ABnAB0−ABz×100 (4) 以AB带相对灰度值变化表征虾头蛋白的变性程度,按照公式(4)计算,结果见图2D。同一浓度下,在加热1 min时,虾头蛋白变性程度出现负值,这是因为初始加热使部分小分子蛋白(小于75 kDa)发生聚集生成了约75 kDa的聚集体,从而使AB带相对灰度值增加[26]。加热1~4 min时,虾头蛋白的变性程度显著上升(P<0.05),在4 min时变性程度达到最大值,这是因为持续加热使蛋白质变性聚集而沉淀。加热4 min后,虾头蛋白的变性程度在最大值趋于平稳(P>0.05)。这也说明虾头蛋白在加热4 min时已达到完全变性。
2.3 虾头蛋白圆二色谱与变性程度
圆二色光谱常用来表征蛋白质的二级结构,紫外区段(190~240 nm)的生色基团主要是肽链。蛋白质的α-螺旋在190 nm出现正吸收峰,在208 nm和222 nm出现负吸收峰;β-折叠在195 nm出现强正吸收峰,在216 nm出现负吸收峰;β-转角在180~190 nm出现强负吸收峰,在205 nm出现正吸收峰,在220~230 nm出现弱负吸收峰;无规则卷曲在198 nm附近出现负吸收峰,在220 nm附近出现小而宽的正吸收峰[27]。
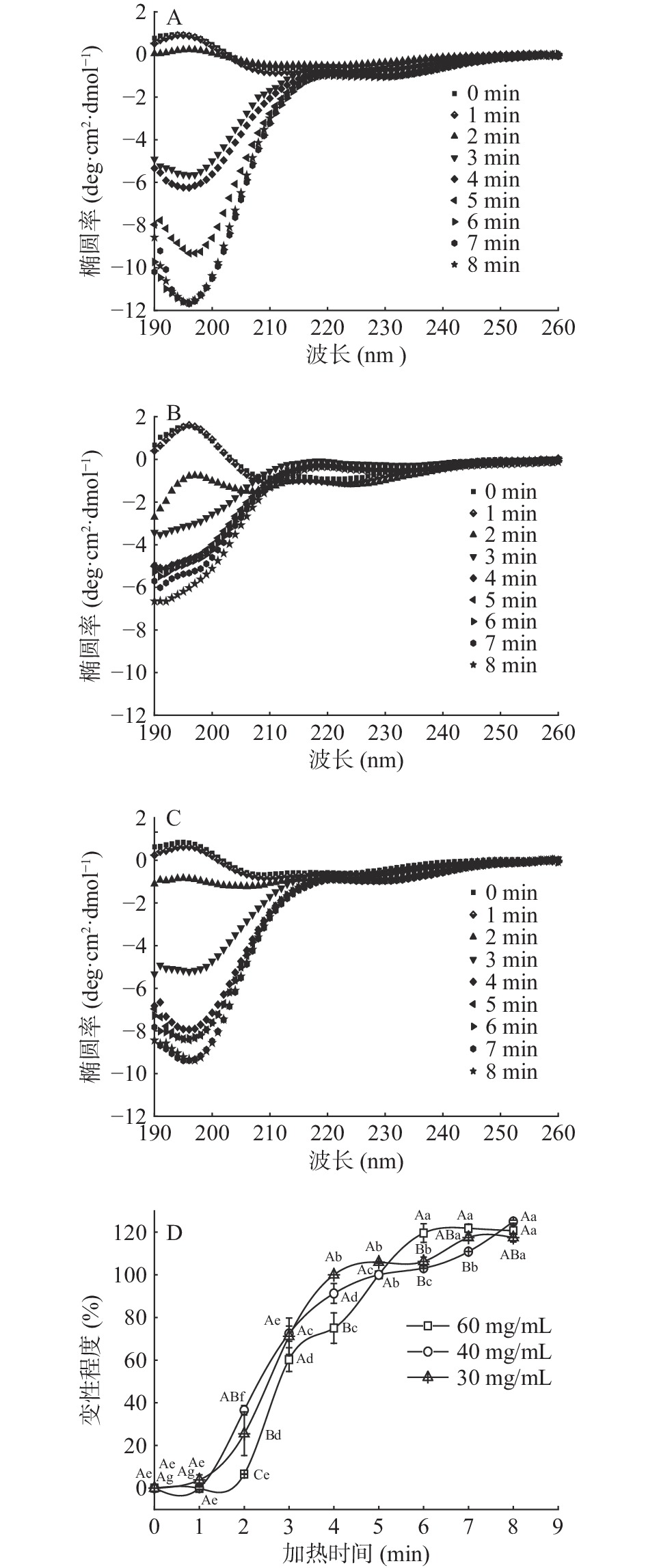
从未加热虾头蛋白的圆二色谱图(图3A、3B、3C)可以看出,在190 nm附近有正吸收峰,在222 nm和208 nm附近有两个弱的负吸收峰,这是α-螺旋的特征吸收峰;在196 nm有正吸收峰,在216 nm有负吸收峰,这是β-折叠的特征吸收峰。虾头蛋白二级结构主要以α-螺旋和β-折叠为主。随着加热时间的增加,190 nm的正吸收峰(α-螺旋)逐渐消失并转为190 nm负吸收峰(β-转角),196 nm的正吸收峰(β-折叠)也逐渐消失并转为强的负吸收峰(无规则卷曲)[28]。这是因为加热破坏了蛋白质分子内氢键,暴露出分子内的大量基团如巯基和疏水基团等,从而破坏了虾头蛋白原有的二级结构,使不同的二级结构间发生了转换,α-螺旋向β-转角转变,β-折叠向无规则卷曲转变[29]。
蛋白质二级结构椭圆率的变化与变性程度之间存在着一定的对应关系[20]。由图3A、3B和3C可知,定义未加热虾头蛋白为未变性状态,在196 nm的平均摩尔椭圆率为[θ]0;100 ℃加热5 min的虾头蛋白(椭圆率变化基本不显著)为完全变性状态,在196 nm的平均摩尔椭圆率为[θ]d;100 ℃加热0~5 min的虾头蛋白在196 nm的平均摩尔椭圆率为[θ]n,用公式(5)表征虾头蛋白的变性程度ΔCD:
ΔCD=[θ]0−[θ]n[θ]0−[θ]d×100 (5) 由于虾头蛋白圆二色谱中196 nm处椭圆率的变化比较显著,本实验用196 nm处椭圆率的变化来表征虾头蛋白的变性程度,按照公式(5)计算,结果见图3D。由图3D可知,加热前5 min,随着加热时间的增加,虾头蛋白变性程度显著增加(P<0.05),当加热到5 min时虾头蛋白变性程度缓慢增加,加热5~8 min虾头蛋白变性程度趋于平稳。圆二色谱的完全变性时间与其他方法不同,这可能是因为破坏蛋白质二级结构需要更多能量,所以完全变性时间发生滞后。
2.4 虾头蛋白内源荧光与变性程度
蛋白质分子中含有三种芳香族氨基酸残基:色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)[30]。在紫外光照射下芳香族氨基酸残基会发射荧光,348 nm为Trp荧光峰,303 nm为Tyr荧光峰,282 nm为Phe荧光峰,其中Trp荧光强度最强。Trp的荧光强度和峰位置与蛋白质构象密切相关,特别是与Trp残基所处的微环境有关。环境极性增加则发射峰红移,疏水性增加则发射峰蓝移,当λmax位于330~332 nm时表示Trp残基处于疏水腔中,当λmax位于342 nm时表明Trp残基部分处于疏水性环境中;当λmax位于350~352 nm时表示Trp残基完全暴露于极性环境中,疏水腔瓦解,蛋白质的结构松弛[31]。
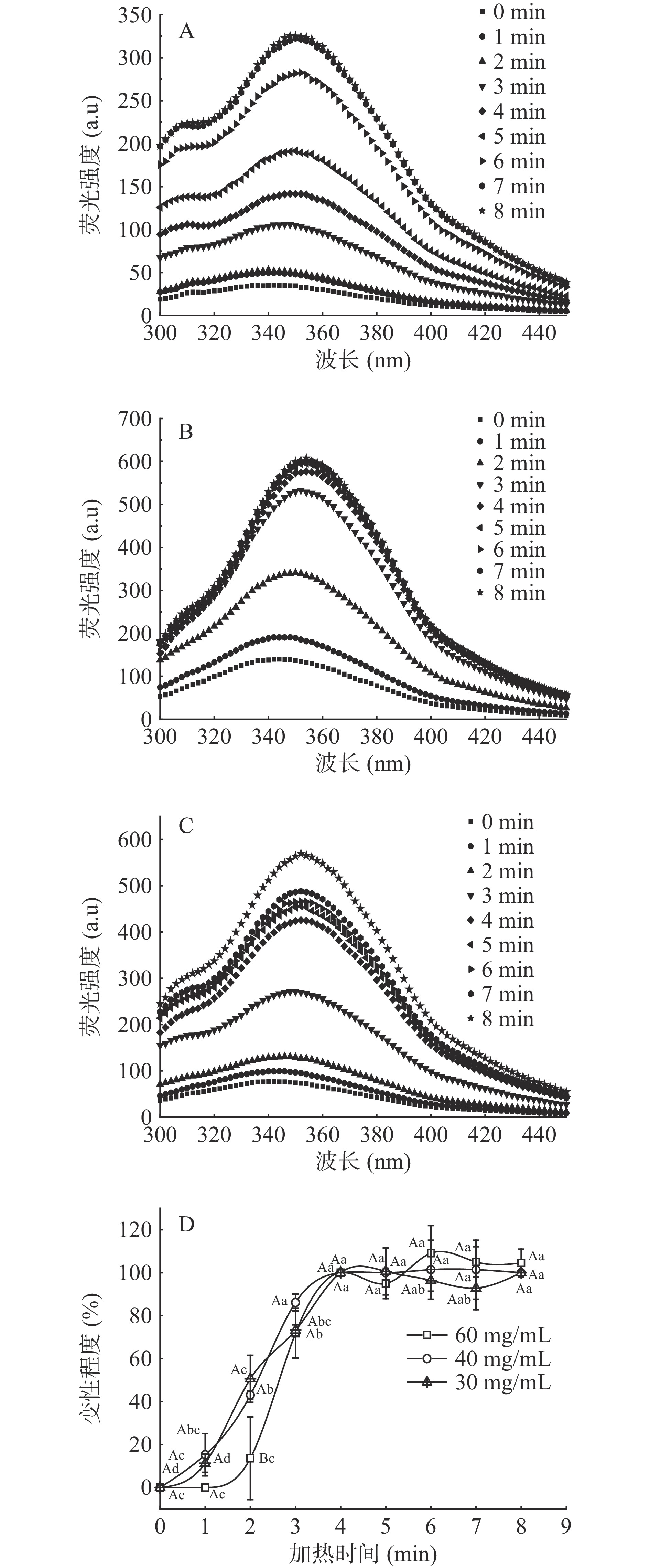
从图4A、4B和4C可以看出,未加热虾头蛋白的内源荧光λmax在340~350 nm,说明虾头蛋白的Trp残基部分处于疏水性环境中;随着加热时间的增加,虾头蛋白的内源荧光λmax逐渐从340~350 nm移动到了350~360 nm,发生了红移,且荧光强度显著增强[32]。这是因为加热过程会破坏虾头蛋白的空间结构,使肽链逐渐伸展,Trp残基逐渐暴露在分子外部的极性环境中[33]。
由图4A、4B和4C,定义未加热虾头蛋白为未变性状态,荧光最大吸收峰的波长为F0;100 ℃加热4 min时(相对红移距离变化不显著)为完全变性状态,荧光最大吸收峰的波长相对F0的相对红移距离为Fz;100 ℃加热0~4 min虾头蛋白的荧光最大吸收峰相对红移距离表征为Fn,用公式(6)表征虾头蛋白的变性程度ΔF:
ΔF=F0−FnF0−Fz×100 (6) 以波峰相对红移距离为参考,按照公式(6)计算,结果见图4D。从图4D中可以看出,在加热前4 min,随着加热时间的增加,虾头蛋白变性程度显著增大(P<0.05),在加热4 min时蛋白变性程度达到最大,再增加加热时间,蛋白变性程度也不再显著变化(P>0.05)。这同样说明加热4 min使虾头蛋白发生了完全变性。
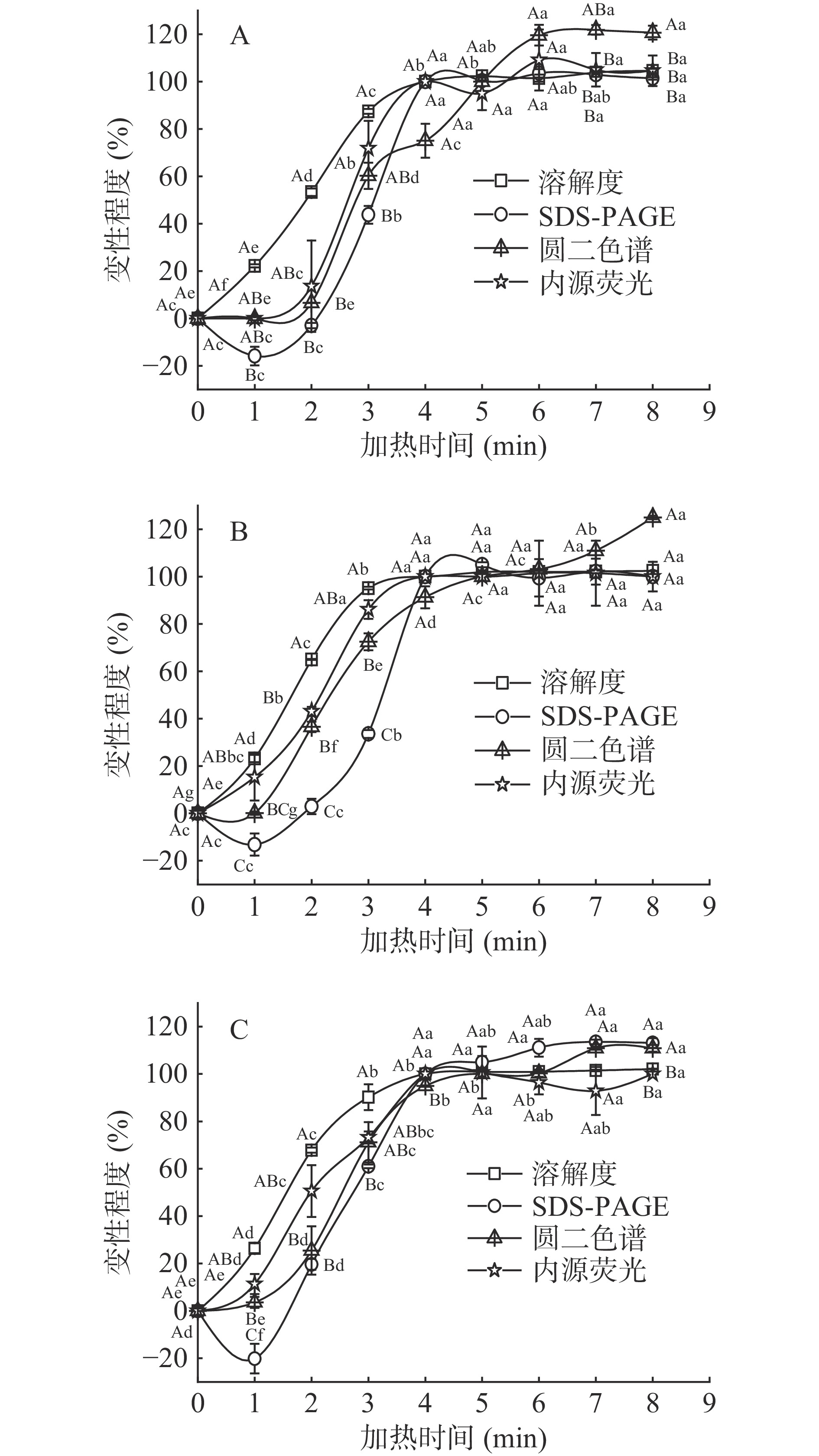
2.5 不同表征方法的比较分析
对表征虾头蛋白变性程度的不同方法进行比较,结果见图5。从图5可知,对相同浓度的虾头蛋白(图5A、5B和5C),随着加热时间的增加,4种方法表征的蛋白变性程度均呈逐渐增加趋势(P<0.05);在加热1~4 min之间时,蛋白变性程度都显著增加(P<0.05),随后再延长加热时间,蛋白变性程度均不再显著变化(P>0.05)。四种蛋白变性表征方法在加热1~4 min之间(即未达到完全变性之前),蛋白变性程度之间存在一些差异,溶解度法所表征的蛋白变性程度显著性大于SDS-PAGE法、圆二色谱法和荧光光谱法(P<0.05),这是因为四种蛋白变性表征方法采取的检测原理不同。溶解度法检测可溶性蛋白的变化,SDS-PAGE检测分子量的变化,圆二色谱检测二级结构的变化,荧光光谱检测空间结构的变化,且不同方法灵敏度不同,可以看出溶解度法的灵敏度高于其他方法。
以上结果表明,在同一表征方法中,不同浓度的虾头蛋白在加热过程中变性程度呈S型上升趋势,在加热1~4 min之间时变性速率存在显著差异(P<0.05)。在加热1~4 min时(即未达到完全变性之前),60 mg/mL虾头蛋白的变性速率显著慢于30 mg/mL和40 mg/mL虾头蛋白的(P<0.05),而30 mg/mL略高于40 mg/mL虾头蛋白的变性速率。这可能是因为在相同加热条件下,60 mg/mL溶液中蛋白含量较大,热诱导蛋白质分子聚集在一定程度上受到抑制,使蛋白质变性程度降低[34-35]。因此,蛋白质浓度对蛋白质完全变性时间无影响,但对蛋白变性速率有影响,选择虾头蛋白浓度为30 mg/mL即料液比1:3时虾头蛋白可能会更快达到变性条件。
同时比较四种虾头蛋白变性程度表征方法的可操作性,溶解度法只需测定蛋白质浓度,具有快速、直观、操作简单、测试廉价等优点,而SDS-PAGE法、圆二色谱法和荧光光谱法还需将浓度调至该方法适宜的范围再进行测定,且耗时长、样品使用量大,还需特定的仪器设备。
如上所述,在表征虾头蛋白变性程度时采用溶解度法更加方便快捷,并且考虑原料用量建议选择料液比为1:3可能会更快达到变性条件。
3. 结论
研究结果表明:溶解度法、SDS-PAGE法、圆二色谱法、荧光光谱法在定量直观地表征加热过程中虾头蛋白变性程度上具有一致性。在同一表征方法中,不同浓度的虾头蛋白在加热过程中变性程度都呈S型上升趋势,但在加热1~4 min之间变性速率存在差异,其中蛋白溶解度的变性程度对加热时间的灵敏度最为显著。因此溶解度作为测定虾头蛋白变性程度的方法更加方便快捷,并且建议选择料液比为1:3可能会更快达到变性条件。研究结果为食品加工过程中表征蛋白变性程度提供了方法参考。
-
-
[1] NIRMAL N P, SANTIVARANGKNA C, RAJPUT M S, et al. Trends in shrimp processing waste utilization: An industrial prospective[J]. Trends in Food Science & Technology,2020,103:20−35.
[2] LIU Z Y, LIU Q M, ZHANG D, et al. Comparison of the proximate composition and nutritional profile of byproducts and edible parts of five species of shrimp[J]. Foods,2021,10(11):2603. doi: 10.3390/foods10112603
[3] 李晓, 王颖, 李红艳, 等. 凡纳滨对虾虾头与肌肉营养成分分析与评价[J]. 水产科学,2018,37(1):66−72. [LI X, WANG Y, LI H Y, et al. Analysis and assessment of nutrient compositions in head and muscle of pacific white leg shrimp Litopenaeus vannamei[J]. Fisheries Science,2018,37(1):66−72. doi: 10.16378/j.cnki.1003-1111.2018.01.010 [4] LATORRES J M, RIOS D G, SAGGIOMO G, et al. Functional and antioxidant properties of protein hydrolysates obtained from white shrimp (Litopenaeus vannamei)[J]. Journal of Food Science and Technology-Mysore,2018,55(2):721−729. doi: 10.1007/s13197-017-2983-z
[5] GUO X X, HAN X X, HE Y F, et al. Optimization of enzymatic hydrolysis for preparation of shrimp flavor precursor using response methodology[J]. Journal of Food Quality,2014,37(4):229−236. doi: 10.1111/jfq.12091
[6] YAO Y, ZHOU X, HADIATULLAH H, et al. Determination of microbial diversities and aroma characteristics of Beitang shrimp paste[J]. Food Chemistry,2021,344:128695. doi: 10.1016/j.foodchem.2020.128695
[7] 吴书建, 张佳男, 高世珏, 等. 南美白对虾虾头制备鲜味水解物的研究[J]. 食品工业科技,2019,40(4):34−42,50. [WU S J, ZHANG J N, GAO S Y, et al. Preparation of hydrolysate with umami from white shrimp (Penaeus vannamei) head[J]. Science and Technology of Food Industry,2019,40(4):34−42,50. doi: 10.13386/j.issn1002-0306.2019.04.006 [8] 冯小敏, 杨锡洪, 解万翠, 等. 响应面分析法优化复合酶酶解南美白对虾虾头的工艺条件[J]. 食品科学,2009,30(22):66−70. [FENG X M, YANG X H, JIE W C, et al. Optimization of enzymatic hydrolysis of white shrimp (Penaeus vannamei) head using response surface methodology[J]. Food Science,2009,30(22):66−70. doi: 10.3321/j.issn:1002-6630.2009.22.011 [9] 董安迪, 罗帅, 刘书成, 等, 高密度CO2纵向溶解和扩散对虾肉糜凝胶强度的影响[J]. 广东海洋大学学报, 2018, 38(5): 57−63. DONG A D, LUO S, LIU S C, et al. Effect of longitudinal dissolution and diffusion of dense phase carbon dioxide on the gel strength of shrimp surimi[J]. Journal of Guangdong Ocean University, 2018, 38(5): 57−63.
[10] 任国艳, 宋娅, 康怀彬, 等. 高密度CO2处理提取鲵皮胶原蛋白的工艺优化[J]. 食品科学,2017,38(16):198−204. [REN G Y, SONG Y, KANG H B, et al. Optimization of processing parameters for collagen extraction from Chinese giant salamander (Andrias davidianus) skin after dense phase carbon dioxide pretreatment[J]. Food Science,2017,38(16):198−204. doi: 10.7506/spkx1002-6630-201716031 [11] 柴华, 赵谋明, 王金水. 食品蛋白质酶解改性提高功能特性的研究进展[J]. 食品工业科技,2008(1):286−288. [CHAI H, ZHAO M M, WANG J S. Research progress of enhancing the functionality of food proteins by enzymatic modification[J]. Science and Technology of Food Industry,2008(1):286−288. doi: 10.13386/j.issn1002-0306.2008.01.031 [12] 曹晓杰, 孙钦秀, 魏帅, 等. 加热过程中虾肌肉组织蛋白酶L的酶活力变化及其动力学[J]. 广东海洋大学学报,2020,40(3):108−113. [CAO X J, SUN Q X, WEI S, et al. Changes and kinetics activity of cathepsin-L from shrimp muscle during heating[J]. Journal of Guangdong Ocean University,2020,40(3):108−113. doi: 10.3969/j.issn.1673-9159.2020.03.014 [13] MAO W J, LI X L, FUKUOKA M, et al. Study of Ca2+-ATPase activity and solubility in the whole kuruma prawn (Marsupenaeus japonicus) meat during heating: Based on the kinetics analysis of myofibril protein thermal denaturation[J]. Food and Bioprocess Technology,2016,9(9):1511−1520. doi: 10.1007/s11947-016-1739-5
[14] 李媛, 刘通讯, 王永江, 等. 低值鱼蛋白的热变性与酶解特性关系研究[J]. 食品科学,2005(5):50−53. [LI Y, LIU T X, WANG Y J, et al. Study on the relationship between thermal denaturation and enzymatic hydrolysis characteristics of low-price fish protein[J]. Food Science,2005(5):50−53. doi: 10.3321/j.issn:1002-6630.2005.05.007 [15] 吴伟, 林亲录, 华欲飞. 丙二醛氧化修饰对大豆蛋白热变性影响[J]. 粮食与油脂,2012,25(10):9−11. [WU W, LIN Q L, HUA Y F. Effects of oxidative modification of malondialdehyde on thermal denaturation of soybean protein[J]. Grain and Oil,2012,25(10):9−11. doi: 10.3969/j.issn.1008-9578.2012.10.005 [16] NIKOLAIDIS A, MOSCHAKIS T. Studying the denaturation of bovine serum albumin by a novel approach of difference-UV analysis[J]. Food Chemistry,2017,215:235−244. doi: 10.1016/j.foodchem.2016.07.133
[17] QIAN F, SUN J Y, CAO D, et al. Experimental and modelling study of the denaturation of milk protein by heat treatment[J]. Food Science of Animal Resources,2017,37(1):44−51. doi: 10.5851/kosfa.2017.37.1.44
[18] 邵虎明. 日本沼虾原肌球蛋白的分离鉴定及致敏性分析[D]. 南昌: 南昌大学, 2019. SHAO H M. Preparation, identification and allergenicity assessment of tropomyosin from Macrobrachium japonicus[D]. Nanchang: Nanchang University, 2019.
[19] 刘书成, 陈亚励, 郭明慧, 等. 高密度CO2处理过程中虾肌球蛋白溶液浊度和溶解度的变化[J]. 食品科学,2017,38(19):42−48. [LIU S C, CHEN Y L, GUO M H, et al. Change in turbidity and solubility of myosin solution fromLitopenaeus vannamei treated by dense phase carbon dioxide[J]. Food Science,2017,38(19):42−48. [20] 陈力扬, 华欲飞, 孔祥珍, 等. 预热变性程度对大豆蛋白凝胶性质的影响[J]. 中国油脂,2019,44(11):56−62. [CHEN L Y, HUA Y F, KONG X Z, et al. Effect of pre-heating denaturation degree on gel properties of soy protein[J]. China Oils and Fats,2019,44(11):56−62. [21] SUN Q X, CHEN Q, XIA X F, et al. Effects of ultrasound-assisted freezing at different power levels on the structure and thermal stability of common carp (Cyprinus carpio) proteins[J]. Ultrasonics Sonochemistry,2019,54:311−320. doi: 10.1016/j.ultsonch.2019.01.026
[22] DONG X, WANG J, RAGHAVAN V. Impact of microwave processing on the secondary structure, in vitro protein digestibility and allergenicity of shrimp (Litopenaeus vannamei) proteins[J]. Food Chemistry,2021,337:127811. doi: 10.1016/j.foodchem.2020.127811
[23] WANG J M, XIA N, YANG X Q, et al. Adsorption and dilatational rheology of heat-treated soy protein at the oil-water interface: Relationship to structural properties[J]. Journal of Agricultural and Food Chemistry,2012,60(12):3302−3310. doi: 10.1021/jf205128v
[24] HALL A E, MORARU C I. Structure and function of pea, lentil and faba bean proteins treated by high pressure processing and heat treatment[J]. LWT,2021,152:112349. doi: 10.1016/j.lwt.2021.112349
[25] 罗嫚. 微波低温加热对猪肉特性影响的研究[D]. 广州:华南理工大学, 2015. LUO M. Study on the influence of microwave low temperature heating on pork properties[D]. Guangzhou: South China University of Technology, 2015.
[26] MIR N A, RIAR C S, SINGH S. Improvement in the functional properties of quinoa (Chenopodium quinoa) protein isolates after the application of controlled heat-treatment: Effect on structural properties[J]. Food Structure,2021,28:100189. doi: 10.1016/j.foostr.2021.100189
[27] MIZUTANI Y, SHIBATA M, YAMADA S, et al. Effects of heat treatment under low moisture conditions on the protein and oil in soybean seeds[J]. Food Chemistry,2019,275(1):577−584.
[28] ROGERS D M, JASIM S B, DYER N T, et al. Electronic circular dichroism spectroscopy of proteins[J]. Chem,2019,5(11):2751−2774. doi: 10.1016/j.chempr.2019.07.008
[29] NIVALA O, NORDLUND E, KRUUS K, et al. The effect of heat and transglutaminase treatment on emulsifying and gelling properties of faba bean protein isolate[J]. LWT,2021,139:110517. doi: 10.1016/j.lwt.2020.110517
[30] MALIK M A, SAINI C S. Heat treatment of sunflower protein isolates near isoelectric point: Effect on rheological and structural properties[J]. Food Chemistry,2019,276(15):554−561.
[31] 顾佳丽, 伊鲁东, 李东玲, 等. 光谱法研究小分子与蛋白质间相互作用的进展[J]. 科学技术与工程,2018,18(14):85−90. [GU J L, YI L D, LI D L, et al. Progress of study on interaction between small molecules and proteins by spectroscopy[J]. Science Technology and Engineering,2018,18(14):85−90. doi: 10.3969/j.issn.1671-1815.2018.14.014 [32] AYALA N, ZAMORA A, RINNAN Å, et al. The effect of heat treatment on the front-face fluorescence spectrum of tryptophan in skim milk[J]. Journal of Food Composition and Analysis,2020,92:103569. doi: 10.1016/j.jfca.2020.103569
[33] 徐永霞, 王瑞, 李学鹏, 等. 热处理对鱼肌原纤维蛋白结构及腥味物质结合能力的影响[J]. 中国食品学报,2020,20(9):131−138. [XU Y X, WANG R, LI X P, et al. Effects of heat treatment on the structure of myofibrillar protein and binding ability with fishy odor compounds[J]. Chinese Journal of Foodstuffs,2020,20(9):131−138. doi: 10.16429/j.1009-7848.2020.09.016 [34] 顾炜, 刘远洋, 杨晓泉, 等. 喷射蒸煮辅助提取对花生分离蛋白结构和功能的影响[J]. 食品与发酵工业,2011,37(9):151−156. [GU W, LIU Y Y, YANG X Q, et al. The effects of steam jet cooking assisted extraction on the structure and function of peanut protein isolate[J]. Food and Fermentation Industries,2011,37(9):151−156. doi: 10.13995/j.cnki.11-1802/ts.2011.09.035 [35] WAN Y, LI Y, GUO S. Characteristics of soy protein isolate gel induced by glucono-δ-lactone: Effects of the protein concentration during preheating[J]. Food Hydrocolloids,2021,113:106525. doi: 10.1016/j.foodhyd.2020.106525








 下载:
下载:





 下载:
下载:
