Effect of Exogenous γ-Aminobutyric Acid on the Quality and γ-Aminobutyric Acid Metabolism of Fresh-cut Pumpkins
-
摘要: 以贝贝南瓜为原料,研究了外源GABA (γ-Aminobutyric acid, GABA)和其合成抑制剂3-巯基丙酸(3-Mercaptopropionic acid,3-MP)处理对鲜切南瓜品质和GABA积累的影响以及可能的作用机制。结果表明,外源GABA可以诱导内源GABA的积累,并促进南瓜中谷氨酸在谷氨酸脱羧酶(Glutamate decarboxylase,GAD)催化下转换成GABA。3-MP处理后的南瓜,GABA含量低于对照组,且GAD和GABA转氨酶(GABA transaminase,GABA-T)活性受到抑制。在多胺降解途径中,GABA处理组的多胺含量(腐胺、精胺、亚精胺)显著低于对照组,而3-MP处理抑制了多胺氧化酶(Polyamine oxidase,PAO)、二胺氧化酶(Diamine oxidase,DAO)和4-氨基丁醛脱氢酶(Aminoaldehyde decarboxylase,AMADH)的活性。说明GABA处理可以激活多胺降解途径,促进GABA在南瓜体内富集。同时在贮藏期间,外源GABA处理对南瓜最大菌落总数、色泽、β-胡萝卜素含量和可溶性固形物含量等均影响不大。Abstract: The effect of exogenous γ-aminobutyric acid (GABA) and GABA synthesis inhibitor 3-mercaptopropionic acid (3-MP) on GABA metabolism and quality in fresh-cut pumpkin was investigated, and the possible mechanism was studied. The results indicated that exogenous GABA induced the accumulation of endogenous GABA and promoted the conversion of glutamic acid to GABA in fresh-cut pumpkin through the catalytic conversion of highly active glutamate decarboxylase (GAD). The 3-MP-treated pumpkin retained lower GABA content than the control, and the activities of GAD and GABA transaminase (GABA-T) were inhibited. The GABA-treated pumpkins possessed relatively lower polyamines (putrescine, spermine and spermidine) contents in comparison with the control during storage. 3-MP treatment restrained the activities of polyamine oxidase (PAO), diamine oxidase (DAO) and amino aldehyde decarboxylase (AMADH). These results demonstrated that GABA treatment could activate the polyamine degradation pathway and promote GABA enrichment in pumpkin. Meanwhile, no significant differences in maximum colony count, color, β-carotene content and soluble solids content were observed among treatments during storage, which suggested that exogenous GABA had little effect on the quality of fresh-cut pumpkin.
-
Keywords:
- γ-aminobutyric acid /
- fresh-cut /
- pumpkin /
- GABA shunt /
- polyamine degradation pathway
-
γ-氨基丁酸作为一种自由态的四碳非蛋白氨基酸,广泛分布在自然界的原核生物和真核生物中,是哺乳动物中枢系统抑制性神经递质,参与脑循环,具有降低神经元细胞活性、防止动脉硬化、改善肝功能和降低血压等作用[1]。在植物体内合成GABA有两条代谢途径,主要由谷氨酸在GAD的催化下生成GABA,由GABA-T催化GABA进入三羧酸循环中,这条代谢途径被称为GABA支路[2-3]。GABA在多胺降解途径中通过二胺氧化酶(Diamine oxidase,DAO)和多胺氧化酶(Polyamine oxidase,PAO)两种关键酶催化多胺(腐胺(Putrescine,Put)、精胺(Spermine,Spm)、亚精胺(Spermidine,Spd))后,再由4-氨基丁醛脱氢酶(Aminoaldehyde decarboxylase,AMADH)将其氧化生成GABA留在植物体内[4-5]。
研究发现,GABA参与植物C/N营养平衡、植物微生物相互作用、抵御虫害、响应生物和非生物胁迫以及作为细胞内信号分子调控传导等活动[6]。当生物体在处于钠盐、低氧、机械损伤等胁迫条件下时,会产生应激反应,富集大量GABA来提高自身的抗逆性,从而更好地适应环境[7-9]。机械损伤下猕猴桃和胡萝卜体内会迅速合成大量的GABA,响应非生物胁迫[9-11]。近年大量关于GABA外源应用的研究指出,GABA用于水果或蔬菜的采后处理,可以有效缓解生物或非生物胁迫的影响[12-13]。
南瓜富含多种氨基酸和维生素,具有预防糖尿病、溶解结石以及催化分解致癌物质等作用,且价格低廉,已然成为食品界的新宠[14]。近年来,由于快餐和方便食品行业的迅速发展,鲜切产品吸引了大量消费者的关注。鲜切南瓜因其营养高,味道好和便利性更是受到消费者的广泛青睐。然而,南瓜受到由加工处理(如去皮、修剪和切割)导致的组织分解引起的损伤,难免会发生表皮微生物侵染、营养损失、质地软化和颜色变化等情况,降低鲜切产品的潜在经济价值[15]。因此,需要研究一种方法来抑制鲜切南瓜品质变化,同时保证产品健康安全。以往对GABA的研究主要集中在代谢层面上,然而,GABA对鲜切南瓜品质的影响与否尚不清楚。本文通过外源GABA和GABA合成抑制剂(3-巯基丙酸,3-MP)处理研究其对鲜切南瓜中GABA代谢和品质的影响。主要测定不同处理下鲜切南瓜中谷氨酸、GABA和多胺含量,GAD、GABA-T、PAO、DAO、AMADH活性以及CmGAD相关基因表达水平和品质指标,以解决鲜切南瓜贮藏期间品质变化的相关问题,为鲜切南瓜GABA富集工艺转化提供重要的理论和实践依据。
1. 材料与方法
1.1 材料与仪器
本实验选用新鲜南瓜(贝贝南瓜)为供试材料,购买于京东商场,挑选大小均匀,表面无病虫害和机械损伤;GABA标准品(98%)、甲醇(色谱纯) Sigma-Aldrich公司;3-巯基丙酸(3-Mercaptopropionic acid,3-MP)、谷氨酸脱氢酶(1 U/mL) 分析级,麦克林;氯化镧、β-烟酰胺腺嘌呤二核苷酸(β-NAD+) 分析级,阿拉丁;Tris-HCl溶液 分析级,上海生工;腐胺、精胺、亚精胺标准品 分析纯(T≥98%),上海源叶生物科技有限公司;植物总RNA提取试剂盒 成都福际生物技术有限公司;RNA isolater Total RNA Extraction Reagent HiScript® Ⅱ QRT SuperMix for qPCR(+Gdna Wiper)试剂盒、ChamQTMSYBR®qPCR Master Mix试剂盒 南京诺唯赞生物科技有限公司;其他试剂均为国药分析纯。
AFX-2001-U超纯水机 上海纯浦实业有限公司;SYNAPT G2超高效液相色谱仪 美国Water公司;UV-3200型紫外分光光度计 上海普美达;Mastercycler nexus PCR仪 Eppendorf中国有限公司;A40426实时荧光PCR仪 赛默飞世尔科技(中国)有限公司;CR-400型色差仪 柯尼卡美能达办公系统(中国)有限公司;PAL-1型数显糖度计 日本爱宕ATAGO公司;JXDC-200型氮吹仪 拓赫机电科技(上海)有限公司。
1.2 实验方法
1.2.1 原料处理
南瓜在0.02%(v/v)的次氯酸钠溶液中浸泡2 min进行消毒,将其削皮去瓤后,切成长约5 cm,宽0.2 cm,高0.5 cm左右的丝状,并分别浸泡在80 mmol/L GABA和80 mmol/L 3-MP溶液中作为处理组(经过预实验得到最佳处理浓度),以浸泡在蒸馏水中的南瓜丝作为对照组。浸泡10 min后取出用滤纸擦去表面多余的液体并放置在塑料透明鲜切盒内,并置于4 ℃,相对湿度90%培养箱中贮藏,分别于0、3、6、9 h取样,用液氮快速冷冻,并置于−80 ℃冰箱中备用。在本实验中,每个处理至少使用12个南瓜。
1.2.2 品质指标测定
菌落总数测定参考食品安全国家标准食品微生物学检验菌落总数测定(GB 4789.2-2016),白度使用色差仪测定,随机选取若干点测定样品的颜色参数,得到白色系中的L*值,白度值(White index, WI)的计算公式为:WI=100−[(100−L*)2+a*2+b*2]1/2;可溶性固形物含量的测定采用郭丹等[16]的方法,取10 g的样品与20 mL的蒸馏水使用匀浆机混匀,取200 μL的溶液放置在糖度计上测定,记录数值;β-胡萝卜素含量的测定参考食品安全国家标准食品中胡萝卜素的测定(GB/T 5009.83-2003)。
1.2.3 谷氨酸与GABA含量的测定
谷氨酸含量的测定是在Al-Quraan等[17]的方法上稍作修改,将冷冻样品用冰浴在3 mL氯化镧(0.05 mol/L)中进行提取。在0.5 mL提取物中加入0.2 mL的0.1 mmol/L Tris-HCl,0.1 mL的7.5 mmol/L β-NAD+和1 U/mL谷氨酸脱氢酶后充分震荡混合,然后将混合液30 ℃水浴孵育60 min,读取波长为340 nm时的吸光度。结果用mmol·kg−1 来表示。计算公式如下:
谷氨酸含量=谷氨酸物质的量 × 样品提取液总体积测定样品提取液体积×样品质量×1000 GABA含量的测定参照Hu等[18]的方法,在氯化镧溶液中加入0.5 g样品进行萃取,在室温下震荡15 min后12000×g离心5 min。取2 mL上清液加入1 mol /L氢氧化钾溶液,振荡5 min后12000×g离心5 min。取0.4 mL上清液依次加入800 μL 1 mmol /L硼酸盐缓冲液(pH9.0)、1 mL体积分数为6%的苯酚和0.5 mL 5%的次氯酸钠,混合均匀后沸水浴10 min,拿出后立即冰浴5 min。加入1 mL体积分数为60%的乙醇,混匀后采用紫外分光光度法,在645 nm处测定吸光度。结果用mmol·10 g−1 FW来表示。计算公式如下:
GABA含量=GABA物质的量×样品提取液总体积测定样品提取液体积×样品质量 1.2.4 谷氨酸脱羧酶与GABA转氨酶活性的测定
GAD活性的测定参考Bartyzel等[19]的方法并稍加修改,称取1.0 g南瓜样品,在冰浴条件下通过含有β-巯基乙醇、PLP、EDTA和甘油的磷酸钾缓冲液研磨获得匀浆。最大转速离心10 min后,取0.5 mL粗酶液加入含有10 g/L谷氨酸缓冲液,40 ℃下水浴2 h后通过沸水浴5 min终止反应。用等量蒸馏水对照,在645 nm下比色,测吸光度。每分钟生成1 µmol的GABA为GAD活性为一个酶活力单位。
GABA-T活性的测定参照Deewatthanawong等[20]的方法并加以修改,取0.5 g南瓜果肉,加入Tris-HCl提取缓冲液研磨,离心获得上清液即为酶液。取0.5 mL酶液与缓冲液混合均匀后,放置30 ℃水浴中孵育1 h,加入磺基水杨酸后,再在25 ℃下孵育20 min终止反应。在340 nm处读取吸光值,每30 s记录1次,记录5 min。以1 min内OD340降低0.01为一个酶活力单位(U),活性表示为U·g−1。
1.2.5 多胺的测定
参照宋春波等[21]所述的方法,将南瓜样品在冰浴中加入3 mL 5%预冷的高氯酸进行均质研磨,12000×g离心收集上清液。取2 mL的上清液与2 mL的NaOH(2 mol/L)和10 μL的苯甲酰氯混合在37 ℃下孵育1 h,然后加入饱和NaCl溶液和乙醚,充分振荡混合均匀。通过2000×g低速离心后,将1 mL有机溶剂相转移至新管中,并用氮吹仪吹干。待乙醚蒸发后,加入500 μL甲醇,充分震荡得到待测定的多胺样品。通过配备反相Sun Fire C18色谱柱(150 mm×3.9 mm,4 μm)的高效液相色谱(HPLC)分析苯甲酰化后的多胺,色谱条件:柱温30 ℃;流动相为甲醇和水(比例为64:36,v/v);检测波长为230 nm;流速0.7 mL/min,进样量10 μL。
将Put、Spd和Spm 3种多胺分别配成1 mmol/L的标准贮备液,然后将这3种标准贮备液分别苯甲酰化。将衍生化的母液稀释形成不同浓度的多胺标准液(1、5、12.5、25、50 mmol/L)进样,根据标品进样量制作标准曲线,然后以峰面积计算多胺的含量。以鲜样中的mg/kg来表示。
1.2.6 胺氧化酶活性测定
参照Gao等[22]的方法测定DAO和PAO活性。 取1 g南瓜样品与磷酸钾缓冲液(pH6.5)冰浴研磨后,将样品在4 ℃下12000×g离心,收集上清液。取0.5 mL上清液加入磷酸钠缓冲液(含有0.2 mL显色液,250 U/mL辣根过氧化物酶溶液)。通过分别添加20 mmol/L腐胺溶液以及精胺和亚精胺混合溶液,启动反应来进行DAO和PAO测定,在555 nm处测定吸光值。每30 s记录1次,记录5 min。以1 min内OD555降低0.01为一个酶活力单位(U),活性表示为U·g−1。
AMADH活性测定参照Šebela等[23]的方法稍作修改,取1 g南瓜样品,加入100 mmol/L磷酸钾缓冲液(2 mmol/L二硫苏糖醇,乙二胺四乙酸,10%蔗糖),12000×g高速离心30 min,收集1 mL酶液加入1 mL Tris-HCl反应液和4-氨基丁醛溶液用以启动反应,37 ℃条件下孵育10 min后,在340 nm处测定吸光值。每1 min记录1次,记录10 min。以1 min内OD340降低0.01为一个酶活力单位(U),活性表示为U·g−1。
1.2.7 荧光实时定量
南瓜果实通过液氮研磨成粉末,总RNA提取参照植物总RNA提取试剂盒(成都福际,中国)说明书。提取出的总RNA进行凝胶电泳实验和RNA浓度测定,符合条件的总RNA使用Vazyme HiScript ᴨ Q RT SuperMix for qPCR 试剂盒(南京诺维赞,中国)反转录为cDNA,分装后置于−80 ℃的冰箱保存。每组样品做三次生物学重复。
荧光定量使用Vazyme ChamQ TM Universal SYBR qPCR Master Mix试剂盒,采用2−∆∆CT法来计算相对表达量。内参基因采用Cm18S(XM_023077371.1),5'-AAACCTTACCAGCCCTTGAC-3'(正向)和5'-CGCTCGTTATAGGACTTGACC-3'(反向),CmGAD(XM_023082806.1)为5'-CCGTCGAAGGCCGATATCAA-3'(正向)和5'-AGCTCATCTGCTCTCACTTCAC-3'(反向),实验重复3次。
1.3 数据处理
每次实验进行三次生物学重复,使用SPSS18.0(SPSS,Chicago,IL,USA)统计软件对试验数据进行方差分析,采用Duncan’s Range Test (P<0.05)分析数据之间的差异性,数值以平均值±标准误差表示。使用不同的字母表示同一贮藏时间处理方式之间存在显著性差异,并用Origin 10.0进行绘图。
2. 结果与分析
2.1 外源GABA和3-MP对鲜切南瓜品质的影响
在鲜切果蔬加工工艺中,切割过程容易导致呼吸强度增加,鲜切表面更容易受到微生物感染,保质期缩短,因此菌落总数是用来评价果蔬安全性和货架期的重要指标[24]。由图1A可知,在贮藏过程中,对照组和处理组中菌落总数无显著差异(P>0.05)。在贮藏9 h后,南瓜中的菌落总数均未超过106 CFU·g−1,说明南瓜符合可食用和商业标准。白度作为衡量鲜切南瓜贮藏期间新鲜程度的重要指标之一[25]。如图1B所示,鲜切和外源处理组WI值均无明显变化。另外,研究发现南瓜果实中含有丰富的β-胡萝卜素,使南瓜富含营养物质并呈现丰富鲜艳的颜色。胡萝卜素的含量差异也会导致果肉发生颜色变化[26]。由图1D可知,三组南瓜样品中的β-胡萝卜素含量不存在显著性差异(P>0.05)。根据WI和β-胡萝卜素的数据趋势可知,外源GABA不会影响果肉的色泽,从而影响消费者的购买欲。可溶性固形物是影响果实风味和营养的主要成分。对照组和GABA处理组的可溶性固形物含量在贮藏期间没有显著变化(P>0.05),而抑制剂组的含量显著低于对照组(P<0.05)。该结果表明GABA处理能较好地维持南瓜果实中可溶性固形物含量。综上所述,外源GABA条件下,鲜切南瓜在贮藏期内的品质并未受到影响,且符合国际标准。
2.2 外源GABA、3-MP对谷氨酸和GABA含量的影响
谷氨酸作为合成GABA的前体物质,植物体内GABA的富集受到谷氨酸浓度的影响[13]。由图2A可知,对照组和外源3-MP组的谷氨酸含量在贮藏期间不断下降,而外源GABA组中的谷氨酸含量则呈现先下降后上升的趋势。与对照组相比,GABA处理组谷氨酸含量显著低于对照组和抑制剂处理组(P<0.05),3-MP处理后的南瓜丝在整个贮藏期间都保持着较高的谷氨酸含量。这表明,外源GABA可以促进更多的谷氨酸向GABA合成和转化。为了进一步研究外源GABA对内源性GABA的影响,本文测定了鲜切南瓜中GABA的含量,由图2B所示,随着贮藏时间的延长,GABA处理鲜切南瓜中GABA含量呈现先上升后下降的趋势,而对照组中GABA含量整体无明显变化,经GABA处理组在6 h时的GABA含量达到最大值,约7 mmol·10 g−1 FW,且显著高于对照组中GABA含量57%(P<0.05)。而外源3-MP处理组的GABA含量显著低于对照组(P<0.05),这说明3-MP具有抑制内源GABA合成的作用。与本文结果相似的是,外源GABA降低了采后西葫芦果实和苹果中谷氨酸的含量,提高了GABA含量[13,27]。
2.3 外源GABA、3-MP对GAD和GABA-T活性的影响
GABA支路中,GAD是GABA支路中GABA合成的限速酶[28]。如图3A所示,对照组中的GAD呈现缓慢上升的趋势,外源GABA组在贮藏期间呈现先上升后下降的趋势,与对照组相比,维持较高的GAD活性。这表明GABA处理可以提高南瓜中GAD的活性,促进体内谷氨酸转化成GABA。而抑制剂处理后,南瓜中GAD活性显著(P<0.05)低于对照组和GABA处理组(图3A)。另外,GABA的积累不是GAD的单一作用,GABA-T能催化GABA和琥珀酸半醛的可逆转化,因此GABA-T活性的变化对GABA的富集也同样至关重要[27]。如图3B所示,GABA处理组和对照组中GABA-T活性在贮藏期间呈缓慢上升的趋势,与对照组相比,GABA处理组GABA-T活性无显著变化(P>0.05),而3-MP处理显著抑制了GABA-T活性(P<0.05),维持在较低水平。这种影响趋势与GABA处理对内源GABA含量变化趋势基本一致。在研究杨树、人参和烟草遭受胁迫时,都观察到了类似的结果[29-31]。因此,综合两个酶指标来看,GABA处理能促进GAD和GABA-T酶活性,激活GABA支路,从而一定程度上促进鲜切南瓜富集大量GABA以应对胁迫。因此,本文认为外源GABA处理诱导的内源性GABA积累是由GABA-T和GAD活性增加所引起的。
2.4 外源GABA、3-MP对多胺含量的影响
植物响应环境胁迫与多胺的分解代谢有关,在胁迫条件下,Put、Spd和Spm会氧化生成GABA[32-33]。如图4所示,外源GABA处理组中腐胺含量在前3 h急速下降,在后续6 h无明显变化,GABA处理组中腐胺含量显著低于对照组(P<0.05),对照组和3-MP处理组中腐胺含量均呈先上升后下降的趋势,6 h前两组无明显差异(P>0.05),在6和9 h出现显著性差异(P<0.05)(图4A)。如图4B所示,在整个贮藏过程中,对照组和两个处理组精胺含量呈先上升后下降趋势,除前3 h无显著差异外(P>0.05),在后6 h中对照组中精胺含量显著高于外源GABA组(P<0.05)。抑制剂处理提高了精胺含量,在贮藏期间保持了高于对照组的水平。GABA处理组中的亚精胺含量在整个贮藏过程中逐渐降低,对照组呈现先下降再上升,然后下降的变化趋势,而抑制剂处理组中的含量呈现先下降后上升的趋势,且与对照组相比,外源GABA组中亚精胺含量显著降低(P<0.05)。与本文结果相似的是,外源GABA可以通过激活多胺降解途径,改变多胺生物合成能力,调节了游离Spd和Spm与游离Put的比例,一定程度的促进甜瓜幼苗内GABA含量增加[18]。因此,本文认为外源应用GABA可能是通过刺激多胺代谢,降低内源多胺水平,促进GABA在南瓜体内富集,从而维持鲜切南瓜采后品质。
2.5 外源GABA、3-MP对DAO、PAO和AMADH活性的影响
当植物受到胁迫时,腐胺、精胺和亚精胺可直接或间接被DAO、PAO和AMADH等氧化酶氧化生成GABA[34]。胺氧化酶协同作用参与植物中多胺降解,可以维持植物中GABA的内源性水平[35]。如图5A所示,在贮藏期间,对照组中DAO活性呈缓慢下降趋势,而两处理组DAO活性先下降后升高。GABA处理组的DAO活性除第9 h外,其余与对照组无显著差异(P>0.05)。而3-MP处理组的DAO活性始终显著低于对照组(P<0.05)。对照组和外源GABA组中的PAO活性无显著差异(P>0.05)。和其他组相比,抑制剂组呈现较低的酶活性(图5B)。对照组和GABA处理组的AMADH活性在贮藏期间呈现先上升后下降的趋势。与对照组相比,GABA处理显著提高了AMADH活性(P<0.05),且AMADH活性始终高于对照组,而3-MP处理显著抑制了AMADH活性(P<0.05)。
虽然GABA处理对DAO和PAO的酶活性影响不大,但根据多胺含量和AMADH的变化趋势,推测外源GABA处理虽然可以激活多胺降解途径,增加GABA含量,但主要还是通过GABA支路富集内源GABA。与本文结果相似的是,在大豆发芽期间,虽然DAO和AMADH的活性无显著变化,通过促进多胺降解途径,仍提高了其GABA含量[36]。近期有研究指出,通过增强多胺降解途径催化酶活性,促进多胺的代谢能够迅速积累GABA并参与防御反应系统,但多胺降解途径合成GABA的能力远低于GABA支路[17,37]。综合以上结论,本文认为GABA的富集有多胺代谢途径的参与,只是对GABA积累的贡献率较低。
2.6 外源GABA、3-MP对CmGAD基因表达的影响
如图6所示,对照组和处理组南瓜中CmGAD表达量均呈现先上升后下降的趋势,在6 h到达峰值。在贮藏期间,GABA处理组CmGAD相对表达量显著高于对照组(P<0.05),而3-MP处理组其表达量显著低于对照组(P<0.05)。CmGAD基因表达量与GAD在贮藏期间活性变化趋势相似。同样也与上调西兰花芽菜中BoGAD1、BoGAD4以及杨树中PopGAD基因的表达量可以促进内源GABA含量的结果一致[38-39]。因此,本文认为外源GABA可以通过调控CmGAD表达量,促进内源GABA的作用。
3. 结论
结果表明,外源GABA条件下,促进GABA支路中谷氨酸含量显著上升,提高了GAD、GABA-T的活性和CmGAD的基因表达量,促使足够多的谷氨酸向GABA转化,增强GABA支路的合成效率。多胺降解途径中,多胺(Put、Spd、Spm)的转化率显著提高(P<0.05),虽然DAO和PAO的活性与对照组没有显示出较为明显的差异,但AMADH的活性在贮藏期间始终高于对照组,加速了多胺转化富集成GABA,说明多胺途径同样得到了激活。而3-MP抑制剂处理则出现了完全相反的效果,GABA的含量远不如对照组。综上所述,GABA支路和多胺代谢在外源GABA诱导鲜切南瓜内源GABA具有协同作用。此外,GABA处理是一种安全、健康、环保的果蔬处理方式,可以维持鲜切南瓜中可溶性固形物和颜色的变化,抑制菌落总数上升,防止鲜切南瓜受到微生物的侵染,减少β-胡萝卜素的流失,有助于保持南瓜的品质。本实验并未从多胺分子层面进行深入研究,这也可能是导致某些酶活性能并未表现出显著提高的原因之一,若能进一步研究,将为GABA处理采后果蔬投入市场应用提供更加可靠的理论依据。
-
-
[1] 王凯凯, 孙朦, 宋佳敏, 等. γ-氨基丁酸(GABA)形成机理及富集方法的研究进展[J]. 食品工业科技,2018,39(14):323−329. [WANG K K, SUN M, SONG J M, et al. Research progress on the mechanism of γ-aminobutyric acid (GABA) formation and enrichment methods[J]. Food Industry Science and Technology,2018,39(14):323−329. WANG K K, SUN M, SONG J M, et al. Research progress on the mechanism of γ-aminobutyric acid (GABA) formation and enrichment methods[J]. Food Industry Science and Technology, 2018, 39(14): 323-329.
[2] PIET R, KALIL B, MCLENNAN T, et al. Dominant neuropeptide cotransmission in kisspeptin-GABA regulation of GnRH neuron firing driving ovulation[J]. J Neurosci,2018,38(28):6310−6322. doi: 10.1523/JNEUROSCI.0658-18.2018
[3] YANG R, GUO Y, WANG S, et al. Ca2+ and aminoguanidine on γ-aminobutyric acid accumulation in germinating soybean under hypoxia–NaCl stress[J]. Journal of Food and Drug Analysis,2015,23(2):287−293. doi: 10.1016/j.jfda.2014.07.004
[4] STEWARD F C, THOMPSON J F, DENT C E. γ-Aminobutyric acid: A constituent of the potato tuber?[J]. Science,1949,110:439−440.
[5] KHAN M, JALIL S U, CHOPRA P, et al. Role of GABA in plant growth, development and senescence[J]. Plant Gene,2021(4):100283.
[6] 余光辉, 涂奕霏, 李承龙, 等. 植物GABA信号途径研究[J]. 中南民族大学学报:自然科学版,2021,40(5):427−477. [YU G H, TU Y F, LI C L, et al. Study on GABA signaling pathway in plants[J]. Journal of Central South University for Nationalities (Natural Science Edition),2021,40(5):427−477. YU G H, TU Y F, LI C L, et al. Study on GABA signaling pathway in plants[J]. Journal of Central South University for Nationalities (Natural Science Edition), 2021, 40(5): 6.
[7] 朱云辉, 郭元新, 杜传来, 等. 低氧联合NaCl胁迫下外源Ca2+对发芽苦荞γ-氨基丁酸富集的影响[J]. 中国粮油学报,2017,32(1):17−23. [ZHU Y H, GUO Y X, DU C L, et al. Effect of exogenous Ca2+ on γ-aminobutyric acid enrichment in germinating buckwheat under hypoxia combined with NaCl stress[J]. Chinese Journal of Cereals and Oils,2017,32(1):17−23. doi: 10.3969/j.issn.1003-0174.2017.01.002 ZHU Y H, GUO Y X, DU C L, et al. Effect of exogenous Ca2+ on γ-aminobutyric acid enrichment in germinating buckwheat under hypoxia combined with NaCl stress[J]. Chinese Journal of Cereals and Oils, 2017, 32(1): 7. doi: 10.3969/j.issn.1003-0174.2017.01.002
[8] 白青云, 曾波, 顾振新. 低氧通气对发芽粟谷中γ-氨基丁酸含量的影响[J]. 食品科学,2010(9):49−53. [BAI Q Y, ZENG B, GU Z X. Effect of hypoxic aeration on the content of γ-aminobutyric acid in germinated corn grains[J]. Food Science,2010(9):49−53. BAI Q Y, ZENG B, GU Z X. Effect of hypoxic aeration on the content of γ-aminobutyric acid in germinated corn grains[J]. Food Science, 2010(9): 5.
[9] 侯莹, 祁雪鹤, 任慧, 等. 鲜切处理对猕猴桃中γ-氨基丁酸富集的影响[J]. 食品工业科技,2020,41(20):58−63,84. [HOU Y, QI X H, REN H, et al. Effect of fresh-cutting treatment on the enrichment of γ-aminobutyric acid in kiwifruit[J]. Food Industry Science and Technology,2020,41(20):58−63,84. HOU Y, QI X H, REN H, et al. Effect of fresh-cutting treatment on the enrichment of γ-aminobutyric acid in kiwifruit[J]. Food Industry Science and Technology, 2020, 41(20): 7.
[10] WANG K K, XU F, CAO S F, et al. Effects of exogenous calcium chloride (CaCl2) and ascorbic acid (AsA) on the γ-aminobutyric acid (GABA) metabolism in shredded carrots[J]. Postharvest Biology and Technology,2019,152:111−117. doi: 10.1016/j.postharvbio.2019.03.005
[11] HOU Y, REN H, WANG K K, et al. Influence of fresh-cut process on γ-aminobutyric acid (GABA) metabolism and sensory properties in carrot[J]. Journal of Food Science and Technology,2021(9):1−10.
[12] MALEKZADEH P, KHARA J, HEYDARI R. Alleviating effects of exogenous Gamma-aminobutiric acid on tomato seedling under chilling stress[J]. Physiology and Molecular Biology of Plants,2014,20(1):133−137. doi: 10.1007/s12298-013-0203-5
[13] LIU B, LI Y, ZHANG X, et al. Exogenous GABA prevents Marssonina apple blotch damage in ‘Royal Gala’ apple seedlings[J]. Scientia Horticulturae,2022,299:111005. doi: 10.1016/j.scienta.2022.111005
[14] 马玮, 史玉滋, 段颖, 等. 南瓜果实淀粉和可溶性固形物研究进展[J]. 中国瓜菜,2018,31(11):1−5. [MA W, SHI Y Z, DUAN Y, et al. Research progress on starch and soluble solids in pumpkin fruits[J]. Chinese Squash,2018,31(11):1−5. doi: 10.3969/j.issn.1673-2871.2018.11.001 MA W, SHI Y Z, DUAN Y, et al. Research progress on starch and soluble solids in pumpkin fruits[J]. Chinese Squash, 2018, 31(11): 5. doi: 10.3969/j.issn.1673-2871.2018.11.001
[15] LIANG J Y, GUO F, CAO S F, et al. γ-Aminobutyric acid (GABA) alleviated oxidative damage and programmed cell death in fresh-cut pumpkins[J]. Plant Physiology and Biochemistry,2022,180:9−16. doi: 10.1016/j.plaphy.2022.03.029
[16] 郭丹, 韩英群, 郝义. 不同品种苹果冷藏期间品质与生理变化[J]. 食品科学,2016,37(22):289−294. [GUO D, HAN Y Q, HAO Y. Quality and physiological changes of different varieties of apples during refrigeration[J]. Food Science,2016,37(22):289−294. doi: 10.7506/spkx1002-6630-201622044 GUO D, HAN Y Q, HAO Y. Quality and physiological changes of different varieties of apples during refrigeration[J]. Food Science, 2016, 37(22): 289-294 doi: 10.7506/spkx1002-6630-201622044
[17] AL-QURAAN N A, LOCY R D, SINGH N K. Implications of paraquat and hydrogen peroxide-induced oxidative stress treatments on the GABA shunt pathway in Arabidopsis thaliana calmodulin mutants[J]. Plant Biotechnology Reports,2011,5(3):225−234. doi: 10.1007/s11816-011-0174-3
[18] HU X, XU Z, XU W, et al. Application of γ-aminobutyric acid demonstrates a protective role of polyamine and GABA metabolism in muskmelon seedlings under Ca(NO3)2 stress[J]. Plant Physiology and Biochemistry,2015,92:1−10. doi: 10.1016/j.plaphy.2015.04.006
[19] BARTYZEL I, PELCZAR K, PASZKOWSKI A. Functioning of the γ-aminobutyrate pathway in wheat seedlings affected by osmotic stress[J]. Biologia Plantarum,2003,47(2):221−225.
[20] DEEWATTHANAWONG R, ROWELL P, WATKINS C B. γ-Aminobutyric acid (GABA) metabolism in CO2 treated tomatoes[J]. Postharvest Biology and Technology,2010,57(2):97−105. doi: 10.1016/j.postharvbio.2010.03.007
[21] 宋春波, 方怡楠, 吴哲铭, 等. γ-氨基丁酸对低温胁迫下桃果实多胺代谢的影响[J]. 果树学报,2016,33(5):552−562. [SONG C B, FANG Y N, WU Z M, et al. Effect of γ-aminobutyric acid on polyamine metabolism in peach fruit under low temperature stress[J]. Journal of Fruit Trees,2016,33(5):552−562. SONG C B, FANG Y N, WU Z M, et al. Effect of γ-aminobutyric acid on polyamine metabolism in peach fruit under low temperature stress[J]. Journal of Fruit Trees, 2016, 33(5): 552-562.
[22] GAO H, JIA Y, GUO S, et al. Exogenous calcium affects nitrogen metabolism in root-zone hypoxia-stressed muskmelon roots and enhances short-term hypoxia tolerance[J]. Journal of Plant Physiology,2011,168(11):1217−1225. doi: 10.1016/j.jplph.2011.01.022
[23] ŠEBELA M, BRAUNER F, RADOVÁ A, et al. Characterisation of a homogeneous plant aminoaldehyde dehydrogenase[J]. Biochimica et Biophysica Acta (BBA)-Protein Structure and Molecular Enzymology,2000,1480(1−2):329−341. doi: 10.1016/S0167-4838(00)00086-8
[24] WANG M, LI J, FAN L. Quality changes in fresh-cut asparagus with ultrasonic-assisted washing combined with cinnamon essential oil fumigation[J]. Postharvest Biology and Technology,2022,187:111873. doi: 10.1016/j.postharvbio.2022.111873
[25] ZHA Z, TANG R, WANG C, et al. Riboflavin inhibits browning of fresh-cut apples by repressing phenolic metabolism and enhancing antioxidant system[J]. Postharvest Biology and Technology,2022,187:111867. doi: 10.1016/j.postharvbio.2022.111867
[26] GIORDANO L, BOITEUX L, QUEZADODUVAL A, et al. 'BRS Tospodoro': A high lycopene processing tomato cultivar adapted to organic cropping systems and with multiple resistance to pathogens[J]. Horticultura Brasileira,2010,28(2):241−245.
[27] PALMA F, CARVAJAL F, JIMÉNEZ-MUÑOZ R, et al. Exogenous γ-aminobutyric acid treatment improves the cold tolerance of zucchini fruit during postharvest storage[J]. Plant Physiology and Biochemistry,2019,136:188−195. doi: 10.1016/j.plaphy.2019.01.023
[28] LI Y, LIU B, PENG Y, et al. Exogenous GABA alleviates alkaline stress in Malus hupehensis by regulating the accumulation of organic acids[J]. Scientia Horticulturae,2020,261:108982. doi: 10.1016/j.scienta.2019.108982
[29] JI J, SHI Z, XIE T, et al. Responses of GABA shunt coupled with carbon and nitrogen metabolism in poplar under NaCl and CdCl2 stresses[J]. Ecotoxicology and Environmental Safety,2020,193:110322. doi: 10.1016/j.ecoenv.2020.110322
[30] LEE J H, KIM Y J, JEONG D Y, et al. Isolation and characterization of a Glutamate decarboxylase (GAD) gene and their differential expression in response to abiotic stresses from Panax ginseng C. A. Meyer[J]. Molecular Biology Reports,2010,37(7):3455−3463. doi: 10.1007/s11033-009-9937-0
[31] DAŞ Z A, DIMLIOĞLU G, BOR M, et al. Zinc induced activation of GABA-shunt in tobacco (Nicotiana tabaccum L.)[J]. Environmental and Experimental Botany,2016,122:78−84. doi: 10.1016/j.envexpbot.2015.09.006
[32] LI C, ZHU J, SUN L, et al. Exogenous γ-aminobutyric acid maintains fruit quality of apples through regulation of ethylene anabolism and polyamine metabolism[J]. Plant Physiology and Biochemistry,2021,169:92−101. doi: 10.1016/j.plaphy.2021.11.008
[33] TU J, LIU G, JIN Y, et al. Enrichment of γ-aminobutyric acid in mulberry leaves and the inhibitory effects of the water extract on ACE and α-glucosidase activity[J]. Industrial Crops and Products,2022,177:114485. doi: 10.1016/j.indcrop.2021.114485
[34] KUMAR N, GAUTAM A, DUBEY A K, et al. GABA mediated reduction of arsenite toxicity in rice seedling through modulation of fatty acids, stress responsive amino acids and polyamines biosynthesis[J]. Ecotoxicology and Environmental Safety,2019,173:15−27. doi: 10.1016/j.ecoenv.2019.02.017
[35] YIN Y, YANG R, GUO Q, et al. NaCl stress and supplemental CaCl2 regulating GABA metabolism pathways in germinating soybean[J]. European Food Research and Technology,2014,238(5):781−788. doi: 10.1007/s00217-014-2156-5
[36] GUO Y, YANG R, CHEN H, et al. Accumulation of γ-aminobutyric acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research and Technology,2012,234(4):679−687. doi: 10.1007/s00217-012-1678-y
[37] XING S, JUN Y, HUA Z, et al. Higher accumulation of gamma-aminobutyric acid induced by salt stress through stimulating the activity of diarnine oxidases in Glycine max L. Merr. roots[J]. Plant Physiol Biochem,2007,45(8):560−566. doi: 10.1016/j.plaphy.2007.05.007
[38] XIE K, WU C, CHI Z, et al. Enhancement of γ-aminobutyric acid (GABA) and other health-promoting metabolites in germinated broccoli by mannose treatment[J]. Scientia Horticulturae,2021,276:109706. doi: 10.1016/j.scienta.2020.109706
[39] 陈炜, 成铁龙, 纪敬, 等. 杨树GABA支路3个基因家族的鉴定和表达分析[J]. 南京林业大学学报(自然科学版),2020,44(5):67−77. [CHEN W, CHENG T L, JI J, et al. Identification and expression analysis of three gene families in the GABA branch of Populus tremula[J]. Journal of Nanjing Forestry University (Natural Science Edition),2020,44(5):67−77. CHEN W, CHENG T L, JI J, et al. Identification and expression analysis of three gene families in the GABA branch of Populus tremula[J]. Journal of Nanjing Forestry University (Natural Science Edition), 2020, 44(5): 67-77.





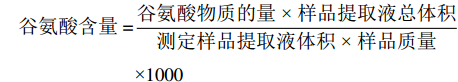
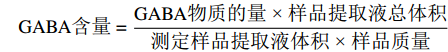

 下载:
下载:





 下载:
下载:
