Purification of Flavonoids from Eupatorium fortunei Turcz. and Its Anti-oxidant and Resisting Exercise Fatigue Effects
-
摘要: 研究大孔树脂纯化佩兰黄酮提取物的最佳条件及其抗氧化与抗运动疲劳活性。采用单因素实验确定该树脂纯化佩兰黄酮提取物的最佳条件,并通过体外抗氧化实验和动物实验研究不同产物的抗氧化与抗运动疲劳活性。结果表明,最佳纯化条件:上样浓度与流速分别为3.0 mg/L和1.0 mL/min,上样液pH与体积分别为4.0与60 mL,洗脱液乙醇体积分数与体积分别为70%与100 mL,洗脱流速为1.0 mL/min,产物的黄酮纯度由24.2%增大至69.4%。纯化后的佩兰黄酮对羟基自由基(∙OH)与超氧阴离子自由基(O2−∙)的半抑制浓度(IC50)分别为0.47、0.42 mg/mL,抗氧化能力增强,可明显延长小鼠的运动时间,降低其运动后乳酸与尿素氮浓度,并有助于增强SOD与GSH-Px的活力,从而减少丙二醛的生成,因此具有较好的抗运动疲劳活性,可为佩兰黄酮利用提供参考。Abstract: This work investigated the condition of macroporous resin purified of flavonoids extract from Eupatorium fortunei Turcz. and effects of anti-oxidation and resisting exercise fatigue. The optimum purification condition was confirmed by single factor experiment, meanwhile the activity of anti-oxidation and resisting exercise fatigue of different product were researched by free radical scavenging experiment and animal experiment, respectively. The results showed that the optimum purification conditions were as follows: The sample concentration was 3.0 mg/L, loading flow rate was 1.0 mL/min, the pH of sample solution was 4.0, and the volume of sample solution was 60 mL, and the 100 mL of 70% ethanol solution with 1.0 mL/min of desorption velocity. The purity of flavonoids in product increased from 24.2% to 69.4%. The anti-oxidation capacity of purified product was higher than crude extract, and the IC50 values for ∙OH and O2−∙were 0.47 and 0.42 mg/mL, respectively. Compared with blank control group and crude extract group, the purified product could evident prolonged exercise time of mice, decreased concentrations of lactic acid and blood urea nitrogen after exercise of mice, and possessed enhancement activities of SOD and GSH-Px, then decreased the concentration of malondialdehyde in vivo. Therefore, it had better resisting exercise fatigue effect, and the research could provide a reference for exploit of Eupatorium fortunei Turcz.
-
Keywords:
- Eupatorium fortunei Turcz. /
- flavonoids /
- purification /
- anti-oxidation /
- resisting exercise fatigue
-
社会发展节奏的加快,使得人们尝试各种运动以舒缓身心,但过度的运动量易使身体出现运动性疲劳,影响正常的生活与工作。有研究显示,运动性疲劳的产生与体内自由基的增多有关[1-2],若机体补充抗氧化剂,使其与内源性自由基相互作用,能有效减轻氧化损伤,预防运动性疲劳[3-4]。近年来,部分抗氧化性较好的天然物质,如:多糖、黄酮、多酚、生物碱、肽类、氨基酸等,已被发现具有良好的抗运动疲劳效果[5-7],而目前关于佩兰的抗运动效果的相关研究还较少。
佩兰(Eupatorium fortunei Turcz.)是菊科植物佩兰的干燥地上部分,具有醒脾开胃、发表解暑等功效,分布于南方各省,已被卫健委认定为保健食品的添加成分,属于药食两用植物,生物安全性较好,其化学成分主要为挥发油、黄酮、多糖、生物碱及其它酚酸类化合物等[8-9],目前,对其挥发油的活性研究较多,而对其黄酮类化合物的研究较少。许冰[10]研究发现,佩兰黄酮化合物的结构类型主要以黄酮类为主,如:芦丁、槲皮素等,存在较多的酚羟基,而该类化合物通常具有较好的抗氧化作用,但因其提取物的杂质较多,可能影响相关活性作用。因此,本研究利用大孔树脂具有机械筛分与分离纯化的特性,探讨其纯化佩兰黄酮提取物的最佳条件,比较纯化前、后产物的抗氧化能力,同时通过动物实验考察其抗运动疲劳活性,以期为佩兰黄酮的深入开发与利用提供参考。
1. 材料与方法
1.1 材料与仪器
佩兰 成都市天泰药房,经鉴定为菊科植物佩兰的茎;芦丁标准品 中国食品药品检定研究院(批号:100080-201811);西洋参颗粒 汤臣倍健股份有限公司;D101型大孔树脂 天津波鸿树脂科技有限公司;抗坏血酸、邻苯三酚、三羟基氨基甲烷(Tris)、硫酸亚铁等 均为分析纯,国药集团化学试剂有限公司;乳酸(lactic acid,LA)、血清尿素氮(blood urea nitrogen,BUN)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶试剂盒(glutathione peroxidase, GSH-Px) 南京建城科技有限公司;试验用水为纯化水。实验动物:SPF级健康雄性小鼠80只,体质量19~26 g 成都药康生物科技有限公司[动物使用许可证号:SYXK(川)2020-230]。
KJ-14B06型破壁机 深圳市康佳电器有限公司;ME203型电子天平 梅特勒-托利多有限公司;L5型紫外-可见分光光度计 上海精密科学仪器有限公司;RE-3000A型旋转蒸发仪 上海越众仪器设备有限公司;DHZ-C型恒温振荡器 苏州培英实验设备有限公司;SJIA-12N-50B型立式冷冻干燥机 宁波双嘉仪器有限公司;H3-18KR型离心机 湖南可成仪器设备有限公司;JA-500型超声波清洗器 济宁奥超电子设备有限公司。
1.2 实验方法
1.2.1 佩兰黄酮提取
佩兰经完全干燥后粉碎,过80目筛,准确称取2.0 g粉碎后样品置于60 mL体积分数为70%乙醇溶液中,在50 kHz超声功率下提取30 min,重复提取4次后,合并提取液离心,上清液经减压蒸发溶剂浓缩后,冷冻干燥即得佩兰黄酮粗提物[11]。
1.2.2 动态吸附与洗脱
1.2.2.1 吸附条件考察
根据预实验结果,固定上样液pH4.0、上样流速1.0 mL/min,分别考察60 mL不同质量浓度的上样液(1.0、2.0、3.0、4.0、5.0 mg/mL)在装有预处理后树脂的玻璃层析柱(2.6 cm×25 cm)的吸附率;固定上样液浓度3.0 mg/mL,上样流速1.0 mL/min,以盐酸或氢氧化钠调节溶液pH,分别考察60 mL不同pH上样液(2.0、3.0、4.0、5.0、6.0)的吸附率;不同体积的3.0 mg/mL上样液(pH4.0)分别于0.5、1.0、2.0 mL/min流速上样后,测定泄漏液中黄酮含量,绘制泄露曲线,确定最佳上样液体积与流速。
(1) 式中:m0为上样液中的黄酮质量,mg;me为吸附后流出液中的黄酮质量,mg;η为吸附率,%。
1.2.2.2 洗脱条件考察
根据预实验结果,上样完成后,经50 mL水洗后,采用100 mL不同体积分数(50%、60%、70%、80%、90%)乙醇溶液于2.0 mL/min流速对最佳吸附条件上样后的树脂柱进行洗脱,收集洗脱液,测定其黄酮含量,计算不同体积分数乙醇的洗脱率,考察洗脱液乙醇的最佳体积分数;采用体积分数为70%乙醇溶液分别于1.0、2.0、3.0 mL/min流速洗脱饱和吸附后的树脂柱,测定不同体积下洗脱液中黄酮含量,绘制洗脱曲线,确定最佳洗脱液体积与流速。
(2) 式中:m0为上样液中的黄酮质量,mg;me为饱和吸附后溶液中的黄酮质量,mg;cd为洗脱液中黄酮浓度,mg/mL;V2为洗脱液体积,mL;Dd为洗脱率,%。
1.2.3 黄酮纯度测定
以芦丁作为对照品,采用亚硝酸钠-硝酸铝-氢氧化钠法测定样品的黄酮含量[12],横坐标为不同质量浓度的芦丁溶液,纵坐标为相应溶液的吸光度值,得到标准曲线方程为:y=15.22x+0.014(R2=0.9998),可知在0.005~0.05 mg/L的浓度范围内线性关系良好。将样品溶液稀释后,采用上述分析方法测定其黄酮浓度后,根据下式计算样品的黄酮纯度(以芦丁计)。
(3) 式中:c为样品中的黄酮浓度,mg/mL;V为样品体积,mL;D为稀释倍数;m为样品的质量,mg;W为样品中黄酮纯度,%。
1.2.4 抗氧化试验
1.2.4.1 羟基自由基(∙OH)清除能力的测定
两支试管内均加入10 mmol/L硫酸亚铁溶液1 mL和10 mmol/L水杨酸-乙醇溶液1 mL,分别继续加入1 mL黄酮纯化物溶液和VC溶液(阳性对照)后,各加入8.8 mmol/L双氧水1 mL,置于37 ℃水浴中30 min后,于510 nm测定吸光度(As),另以纯化水作空白对照(A0),按式(4)计算黄酮纯化产物对羟基自由基的清除率,提取物溶液考察同上操作[13]。
(4) 1.2.4.2 超氧阴离子自由基(O2−∙)清除能力的测定
两支试管内均加入50 mmol/L Tris-HCl溶液(pH8.2)5 mL和5 mL纯化水,置于25 ℃水浴25 min,各加入1 mL黄酮纯化物溶液和VC溶液(阳性对照),分别加入25 mmol/L领苯三酚0.5 mL,混匀后继续置于25 ℃水浴5 min后,各添加8 mmol/L HCl溶液1 mL于510 nm测定吸光度(As),另以纯化水作空白对照(A0),按式(4)计算黄酮纯化产物对超氧阴离子自由基的清除率,提取物溶液考察同上操作[14]。
1.2.5 动物实验
1.2.5.1 实验准备
80只小鼠经适应性喂养5 d后,随机平均分为空白对照组、阳性对照组、提取组和纯化组。按照《保健食品功能评价要求》并结合相关文献研究方法[15-16],动物设置剂量应不超过人体推荐量30倍,根据预实验结果,各组给药剂量采用最低有效量的30倍,其中,阳性对照组给予0.3 mg/g(以体重计,下同)的西洋参颗粒;而提取物组和纯化物组分别给予0.3 mg/g佩兰黄酮提取物与纯化物,所有灌胃溶液体积2 mL,空白对照组则灌胃等体积生理盐水。所有给药通过灌胃方式,每天1次,连续30 d。
1.2.5.2 爬杆实验
末次灌胃结束后,各组随机选取10只小鼠置于玻璃棒上,记录其肌肉紧张抱紧爬杆至跌落的时间,反复实验3次后,将其累计时间记为爬杆时间[17]。
1.2.5.3 LA、BUN、MDA浓度与SOD、GSH-Px活力测定
各组其它小鼠置于水中游泳30 min取出,休息10 min后,采血离心,通过试剂盒检测血清中LA与BUN浓度,另切取肝脏,按照相关试剂盒使用说明检测MDA浓度与SOD、GSH-Px活力。
1.3 数据处理
所有试验平行测定5次,结果表示采用平均值±标准差,通过SPSS 19.0软件进行单因素方差(ANOVA)分析,比较组间差异,P<0.05认为具有显著性差异,P<0.01认为具有极显著性差异。
2. 结果与分析
2.1 动态吸附纯化条件
2.1.1 上样液浓度选择
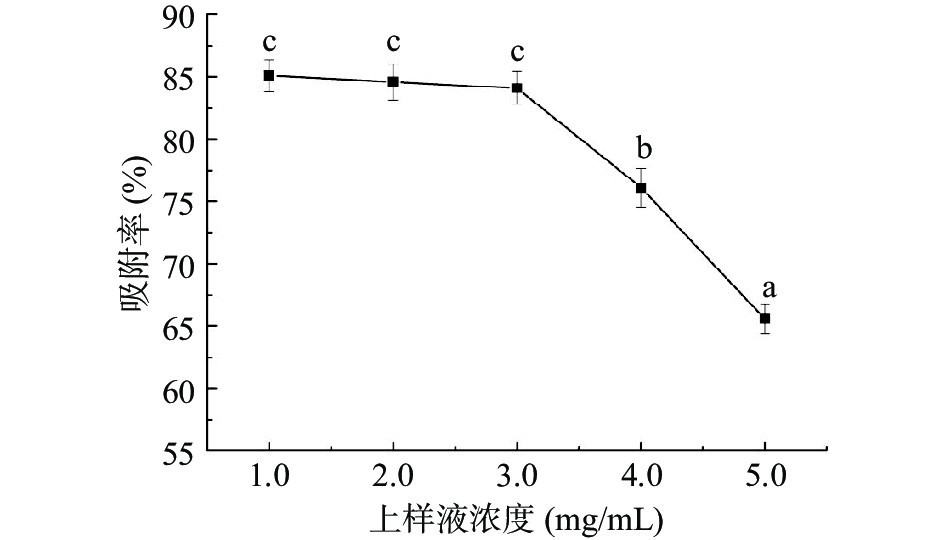
不同上样液浓度对D101大孔树脂吸附佩兰黄酮的影响,如图1所示,随着上样液浓度的增大,树脂对黄酮化合物的吸附率不断减小,其中,当上样液质量浓度大于3.0 mg/L时,吸附率开始急剧下降。上样液浓度过高,样品溶液中其它杂质可能与目标物竞争吸附,可使树脂提前饱和吸附,从而造成部分佩兰黄酮化合物的泄漏,降低吸附效率[18],因此确定最佳上样液浓度为3.0 mg/L。
2.1.2 上样液pH选择
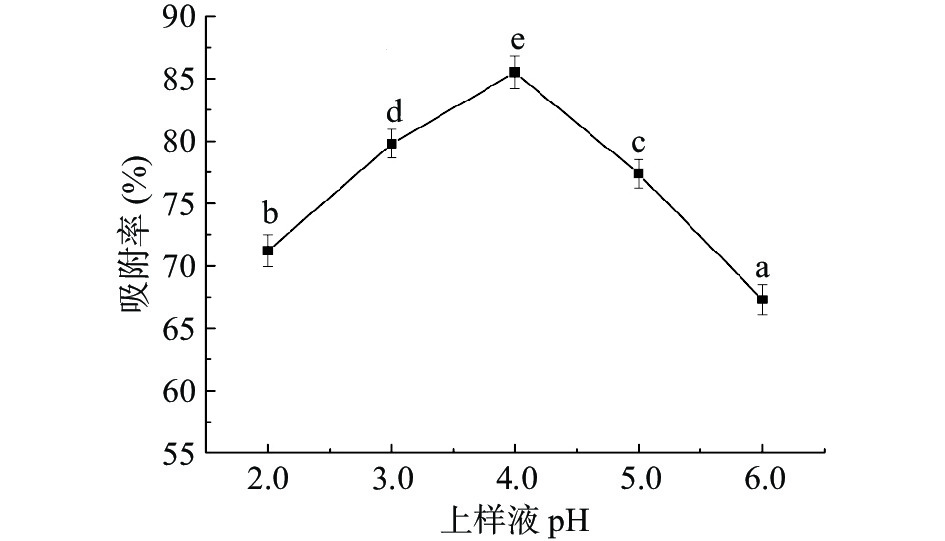
不同上样液pH对D101大孔树脂吸附佩兰黄酮的影响,如图2所示。从图2可知,树脂对黄酮化合物的吸附随上样液pH增大而先增大再减小,当溶液pH为4.0时,吸附率达到最大。由于佩兰黄酮化合物结构的基本母核为2-苯基色原酮,存在较多的酚羟基与羰基,因而在弱酸性环境下,易呈分子形态与树脂中吸附位点相互作用,致使吸附率升高[19],因此确定最佳上样液pH为4.0。
2.1.3 泄漏曲线
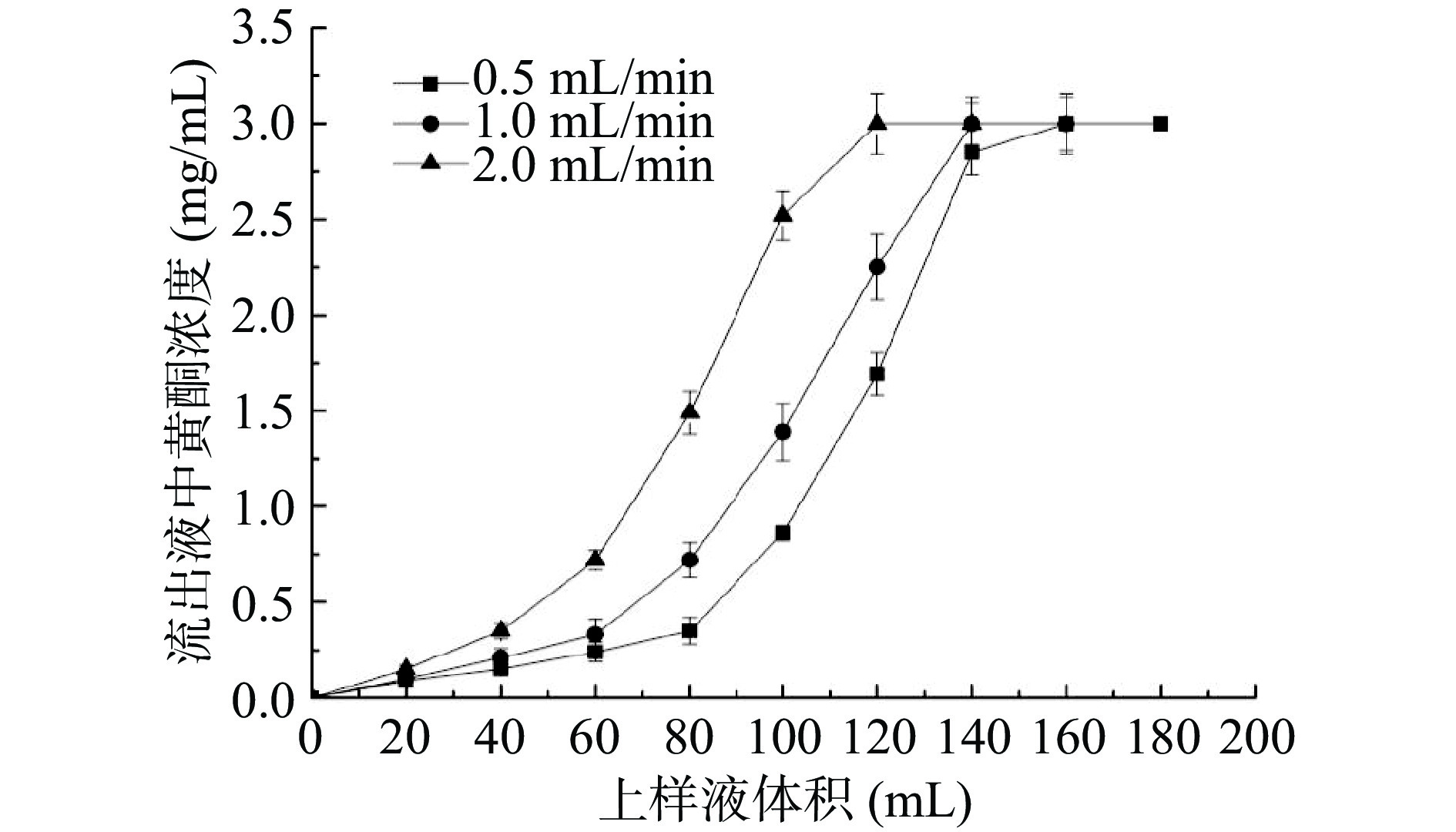
当吸附一段时间后,流出液中黄酮化合物的含量约为上样液浓度10%时,认为黄酮开始泄漏,绘制不同流速下D101大孔树脂的泄露曲线,结果见图3。从图3可知,当上样流速逐渐增大,泄漏点对应的上样液体积从约80 mL减小至40 mL。可能由于大孔树脂对黄酮化合物的吸附存在膜扩散与粒扩散过程,若流速过快,佩兰黄酮尚未与树脂充分相互作用,但上样流速过慢,使得纯化时间较长,不利于推广应用,综合考虑吸附效率与纯化效果,选择最佳上样流速为1.0 mL/min,上样液体积为60 mL。
2.2 动态洗脱纯化条件
2.2.1 洗脱液体积分数选择
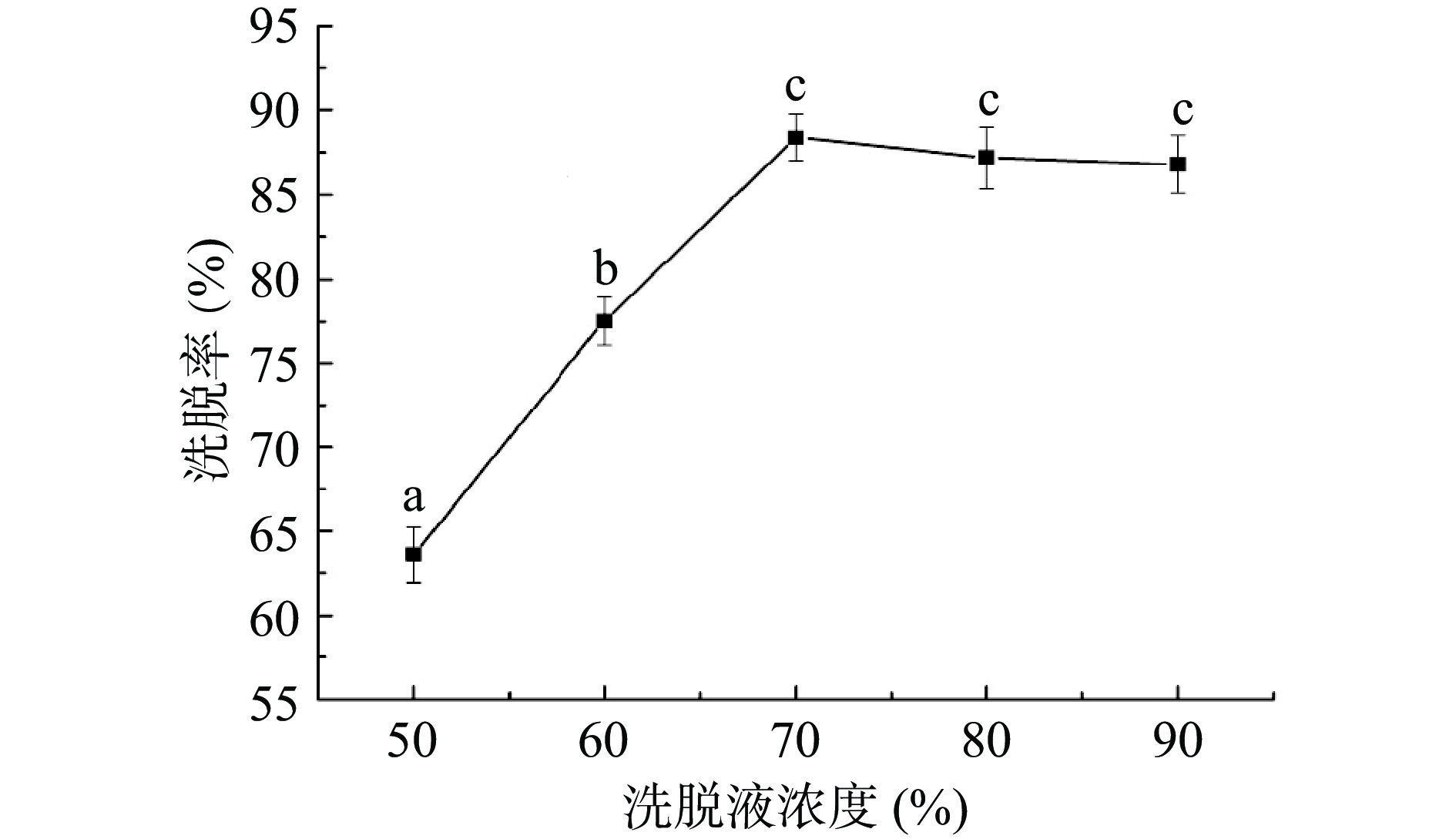
采用一定体积分数的乙醇溶液作为洗脱液,考察不同体积分数的乙醇溶液对佩兰黄酮化合物的洗脱率影响,结果见图4。从图4可知,随着乙醇体积分数的增大,黄酮化合物的洗脱率逐渐上升,当增大至70%后,开始出现下降。这是由于乙醇的体积分数越高,其对弱极性的黄酮化合物洗脱能力越强,但体积分数过高,吸附在树脂中醇溶性杂质也可能被洗脱,造成“竞争解吸”[20],导致洗脱率下降,因此选择乙醇溶液体积分数为70%。
2.2.2 洗脱曲线
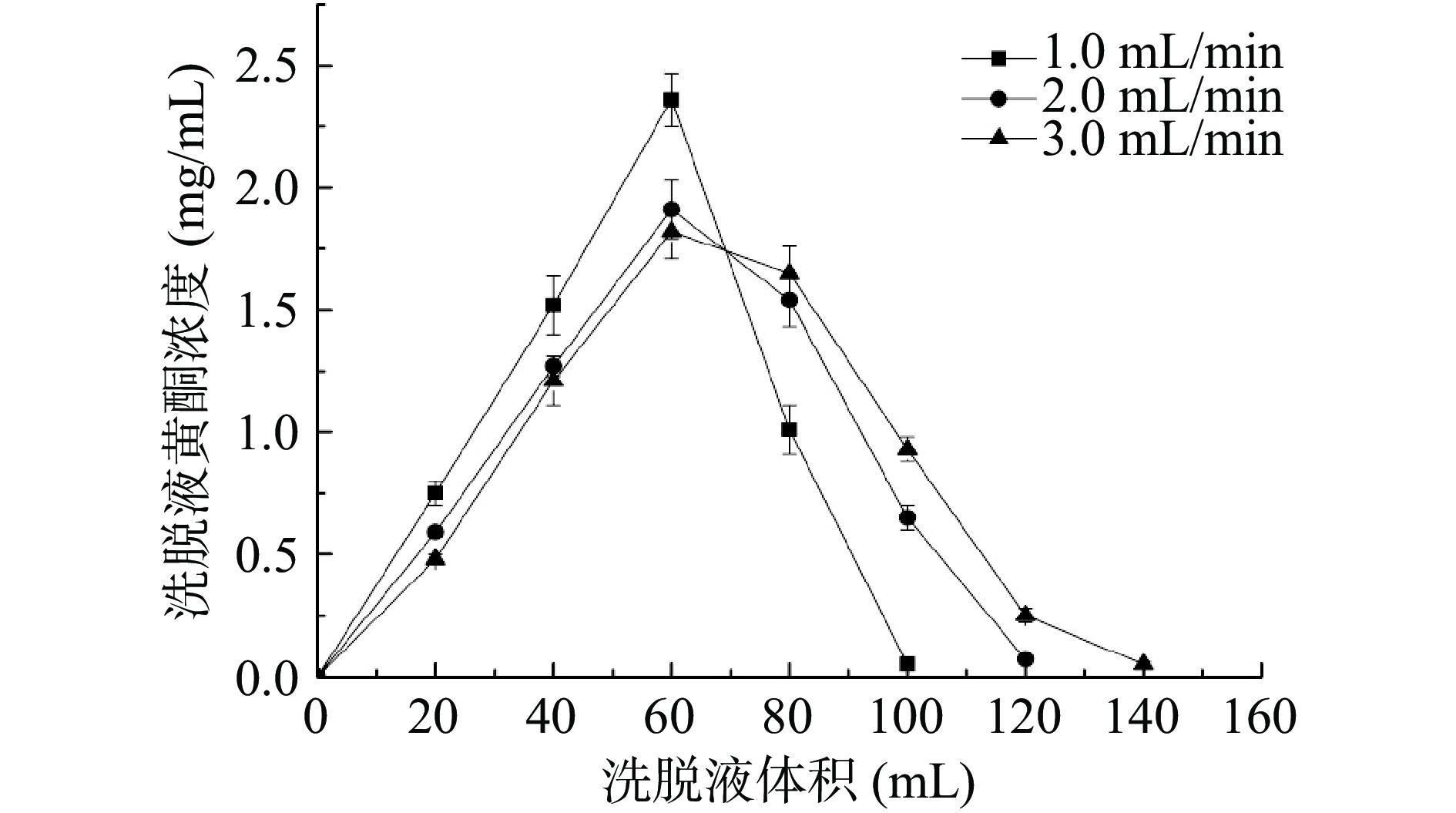
在不同流速下,采用体积分数70%乙醇溶液洗脱饱和吸附后的D101大孔树脂,收集洗脱液,测定黄酮化合物含量,绘制洗脱曲线,如图5所示。随着洗脱流速的增大,峰形逐渐变宽,且完全洗脱黄酮化合物的乙醇用量增多,而洗脱流速偏低洗脱曲线峰形尖锐且对称,因此选择最佳洗脱流速为1.0 mL/min,洗脱液体积100 mL。
2.3 最佳纯化工艺验证
综合上述结果,确定D101大孔树脂纯化佩兰黄酮化合物的最佳条件:上样浓度与流速分别为3.0 mg/L和1.0 mL/min,上样液pH与体积分别为4.0与60 mL,洗脱液体积分数与体积分别为70%与100 mL,洗脱流速为1.0 mL/min。在该最佳纯化条件下,佩兰黄酮化合物在产物中纯度由24.2%增大至69.4%,约提高了2.87倍,韩秋菊等[21]曾采用D101大孔树脂纯化藁本黄酮,纯度约为纯化前2.05倍;李倩[22]则采用D101大孔树脂纯化新疆圆柏黄酮,纯度约为纯化前2.79倍,表明采用D101大孔树脂纯化佩兰黄酮工艺可行。
2.4 纯化前后产物的抗氧化作用
2.4.1 ∙OH清除率的比较
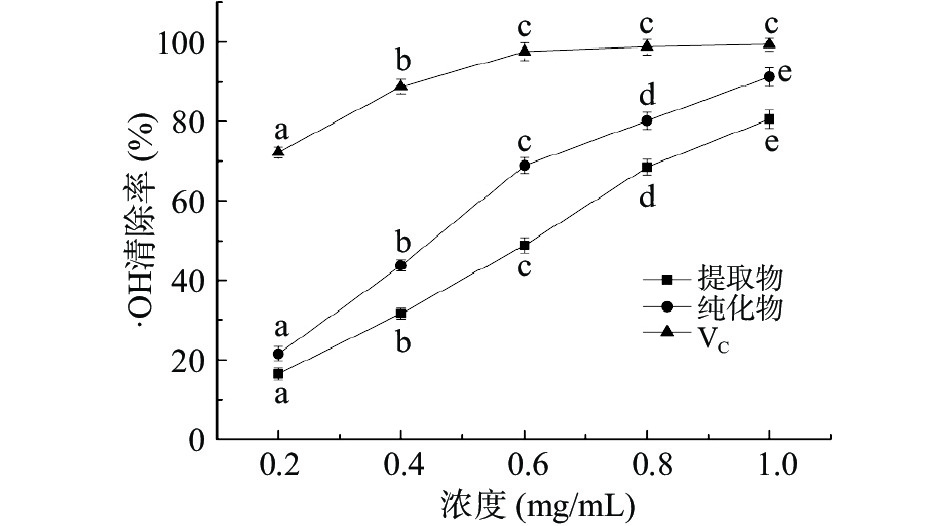
∙OH化学性质活泼,可与体内多数细胞相互作用,致使发生脂质过氧化、核酸断裂、蛋白质与多糖解聚等不良反应[23]。以VC作阳性对照,考察不同浓度的佩兰黄酮提取物与纯化物对∙OH清除率的影响,结果见图6。从图6可见,佩兰黄酮的提取物与纯化物对∙OH的清除能力均随浓度的提高而增大,佩兰黄酮纯化物的半抑制质量浓度(IC50)为0.47 mg/mL低于提取物(0.61 mg/mL),表明纯化工艺有利于提高其清除∙OH能力,但在相同浓度下其清除∙OH的作用低于VC。
2.4.2 O2−∙清除率的比较
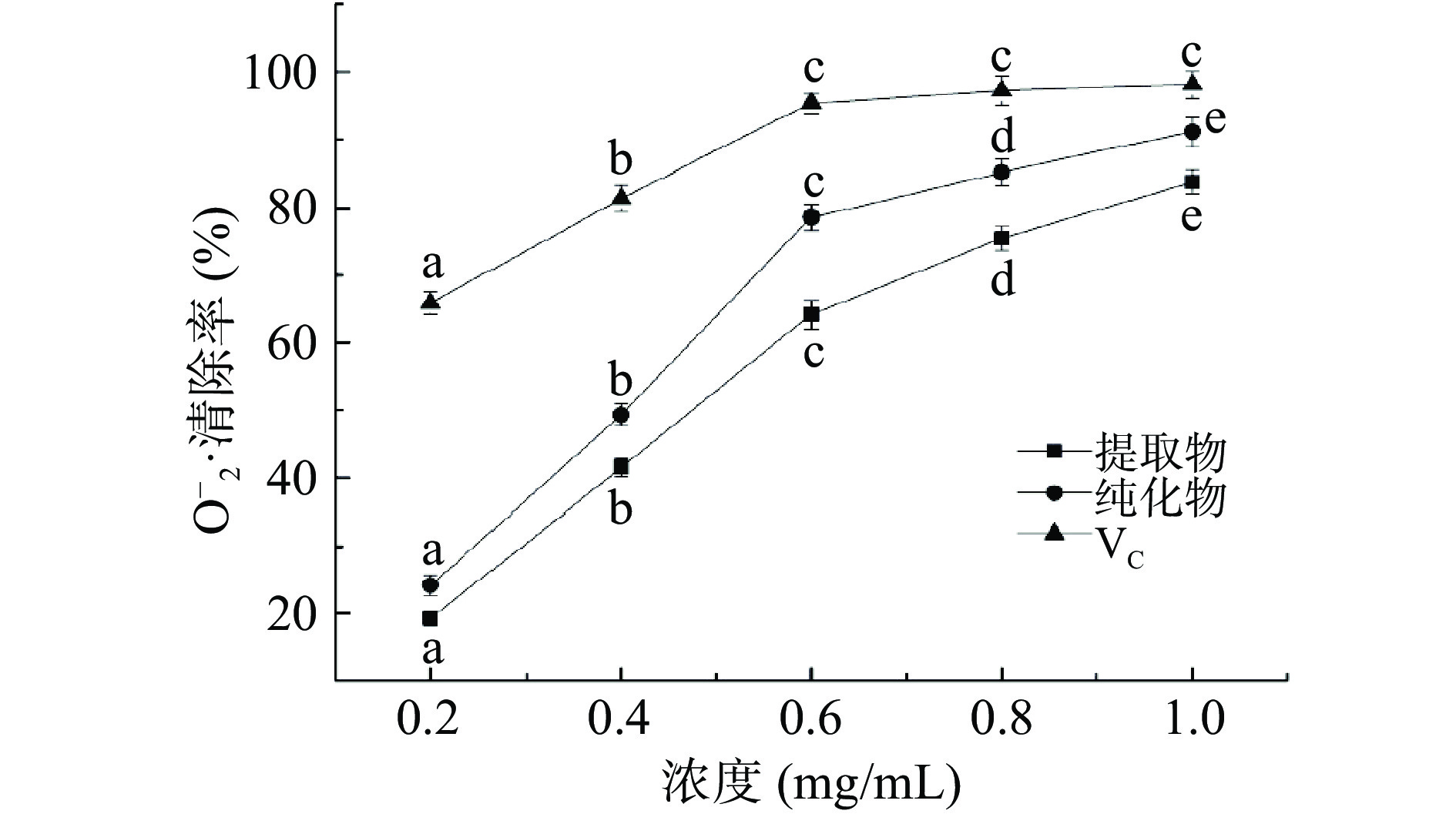
O2−∙与体内细胞化合物中羟基结合后的产物会破坏细胞的DNA,影响其正常功能。以VC作阳性对照,考察不同浓度的佩兰黄酮提取物与纯化物对O2−∙清除率的影响,结果见图7。从图7可见,两种物质对O2−∙的清除能力均随浓度的提高而增大,但纯化物的IC50值(0.42 mg/mL)低于提取物0.52 mg/mL,表明纯化后的佩兰黄酮对O2−∙的清除能力更强,但二者的清除作用均低于等浓度VC。
2.5 抗运动性疲劳作用
2.5.1 爬杆时间
小鼠爬杆是全身能量消耗性运动,因此可通过观察不同组别小鼠的爬杆时间,衡量其运动耐力,结果见表1。从表1可见,与空白对照组相比,提取组与纯化组小鼠的爬杆时间分别平均延长1.2 min和2.4 min,具有显著差异(P<0.05,P<0.01),表明佩兰黄酮有助于缓解机体运动疲劳,延长运动时间,而纯化组小鼠的爬杆时间较提取组延长,具有极显著差异(P<0.01),表明树脂纯化工艺有利于提高佩兰黄酮产物的活性,但二者爬杆时间均低于阳性对照组。
2.5.2 体内LA与BUN浓度
LA是在机体剧烈运动后,肌肉耗氧加剧体内供氧不足的条件下,血糖经糖酵解生成的产物。体内乳酸含量越高,生理环境pH下降越快,从而影响骨骼肌的收缩强度,产生疲劳感[24]。从表2结果可见,与空白对照组相比,提取组与纯化组小鼠的血清中LA平均浓度分别降低1.17、2.43 mmol/L,具有显著差异(P<0.05,P<0.01),且纯化组小鼠的LA平均浓度较提取组下降约1.26 mmol/L,具有显著性差异(P<0.05),表明纯化后的佩兰黄酮更有利于延缓体内LA的生成或加速其代谢,但其LA浓度仍高于阳性对照组。
BUN作为剧烈运动后,蛋白质的分解代谢产物,可用于评价机体的疲劳状态。从表2结果可知,与空白对照组相较,提取组与纯化组小鼠的血清中BUN平均浓度分别降低0.61、1.34 mmol/L,差异显著(P<0.05,P<0.01),同时纯化组小鼠的BUN平均浓度较提取组下降约0.73 mmol/L,差异具有统计学意义(P<0.05),表明纯化后的佩兰黄酮更有利于减少体内BUN的积累,但其BUN浓度仍高于阳性对照组。
表 2 不同组小鼠的LA与BUN浓度(n=10)Table 2. The contents of LA and BUN in mice of different groups (n=10)小组 LA(mmol/L) BUN(mmol/L) 空白对照组 13.15±1.04 8.37±0.45 阳性对照组 9.82±0.72**## 6.56±0.52**## 提取组 11.98±1.12* 7.76±0.59* 纯化组 10.72±0.93**# 7.03±0.71**# 2.5.3 MDA浓度与SOD、GSH-Px活性
运动性疲劳的产生主要源于剧烈运动下,体内产生大量的超氧阴离子自由基,同时血浆脂质过氧化物浓度上升,从而诱导体内蛋白质氧化,生成MDA。MDA浓度过高导致组织和细胞的氧化损伤,使得体内氧化与抗氧化系统失衡[25]。从表3可见,与空白对照组相较,提取组与纯化组小鼠的血清中MDA平均浓度分别降低0.31、0.74 mmol/L,具有显著性差异(P<0.05,P<0.01),而纯化组小鼠MDA平均浓度较提取组下降约0.43 mmol/L,表明纯化后的佩兰黄酮有助于减小体内氧化程度,避免MDA的生成,但与阳性对照组相较,仍明显偏高。
SOD与GSH-Px是重要的抗氧化酶,其中SOD可与超氧阴离子自由基发生歧化反应生成过氧化氢和氧气,而GSH-Px可将过氧化氢或其它有机过氧化物还原成水和醇,从而减缓体内脂质过氧化反应,实现阻断自由基的的氧化破坏过程[26]。从表3可知,与空白对照组相较,提取组小鼠的SOD与GSH-Px平均活力分别提高22.27、24.64 U/mL,具有显著性差异(P<0.05);而纯化组小鼠的SOD与GSH-Px平均活力分别提高42.21、54.45 U/mL,具有极显著性差异(P<0.01),表明纯化后的佩兰黄酮更有利于增强体内SOD与GSH-Px活性,但上述结果均低于阳性对照组。
表 3 不同组小鼠的MDA浓度和SOD、GSH-Px活性(n=10)Table 3. MDA content and SOD, GSH-Px activity in mice of different groups (n=10)小组 MDA(mmol/L) SOD(U/mL) GSH-Px(U/mL) 空白对照组 3.62±0.25 177.25±25.16 473.71±35.37 阳性对照组 2.46±0.29**## 236.15±29.28**## 555.71±33.68**## 提取组 3.31±0.37* 199.52±21.43* 498.35±27.44* 纯化组 2.88±0.22**## 219.46±18.69**# 528.16±23.69**## 3. 结论
本研究考察D101大孔树脂纯化佩兰黄酮的最佳条件,并比较了不同产物的抗氧化与抗运动疲劳活性。试验结果表明,当上样浓度与流速分别为3.0 mg/L和1.0 mL/min,上样液pH与体积分别为4.0与60 mL,洗脱液体积分数与体积分别为70%与100 mL,洗脱流速为1.0 mL/min时,佩兰黄酮化合物在产物中纯度由24.2%增大至69.4%,约为纯化前2.87倍。佩兰黄酮纯化物对∙OH与O2−∙的IC50值分别为0.47、0.42 mg/mL均高于提取物,表明采取大孔树脂纯化工艺有利于提高佩兰黄酮产物的抗氧化能力。纯化后的佩兰黄酮能够延长小鼠的运动时间,减少其体内LA与BUN的生成,并有助于增强体内SOD与GSH-Px的活力,进而降低MDA的生成,从而有利于提高动物的运动耐力。但纯化后佩兰黄酮化合物的种类仍有待进一步分离鉴定,以明确其具体抗运动疲劳机制。
-
表 1 不同组小鼠的爬杆时间 (n=10)
Table 1 The climbing time in mice of different groups (n=10)
表 2 不同组小鼠的LA与BUN浓度(n=10)
Table 2 The contents of LA and BUN in mice of different groups (n=10)
小组 LA(mmol/L) BUN(mmol/L) 空白对照组 13.15±1.04 8.37±0.45 阳性对照组 9.82±0.72**## 6.56±0.52**## 提取组 11.98±1.12* 7.76±0.59* 纯化组 10.72±0.93**# 7.03±0.71**# 表 3 不同组小鼠的MDA浓度和SOD、GSH-Px活性(n=10)
Table 3 MDA content and SOD, GSH-Px activity in mice of different groups (n=10)
小组 MDA(mmol/L) SOD(U/mL) GSH-Px(U/mL) 空白对照组 3.62±0.25 177.25±25.16 473.71±35.37 阳性对照组 2.46±0.29**## 236.15±29.28**## 555.71±33.68**## 提取组 3.31±0.37* 199.52±21.43* 498.35±27.44* 纯化组 2.88±0.22**## 219.46±18.69**# 528.16±23.69**## -
[1] 陈慧, 马璇, 曹丽行, 等. 运动疲劳机制及食源性抗疲劳活性成分研究进展[J]. 食品科学,2020,41(11):247−258. [CHEN H, MA X, CAO L X, et al. Recent progress in the mechanism behind exercise-induced fatigue and dietary bioactive components against fatigue[J]. Food Science,2020,41(11):247−258. doi: 10.7506/spkx1002-6630-20190620-235 CHEN H, MA X, CAO L X, et al. Recent progress in the mechanism behind exercise-induced fatigue and dietary bioactive components against fatigue[J]. Food Science, 2020, 41(11): 247-258. doi: 10.7506/spkx1002-6630-20190620-235
[2] BLOCH W, ZOPF E, ZIMMER P, et al. Role of physical activity in tumor patients and possible underlying mechanisms[J]. European Review of Aging and Physical Activity,2013,10(1):25−32. doi: 10.1007/s11556-012-0106-4
[3] BOSCÃ L, ARAGÃ N J J, SOLS A. Modulation of muscle phosphofructokinase at physiological concentration of enzyme[J]. Journal of Biological Chemistry,1985,260(4):2100−2107. doi: 10.1016/S0021-9258(18)89522-9
[4] MA S, SUZUKI K. Keto-adaptation and endurance exercise capacity, fatigue recovery, and exercise-induced muscle and organ damage prevention: A narrative review[J]. Sports,2019,7(2):40−49. doi: 10.3390/sports7020040
[5] 雷培培. 短梗五加多酚运动饮料制备及缓解疲劳作用[J]. 食品工业科技,2021,42(11):174−179. [LEI P P. Preparation of polyphenols of Acanthopanax sessiliflorus sports beverage and its fatigue relieving effect[J]. Science and Technology of Food Industry,2021,42(11):174−179. LEI P P. Preparation of polyphenols of Acanthopanax sessiliflorus sports beverage and its fatigue relieving effect[J]. Science and Technology of Food Industry, 2021, 42(11): 174-179.
[6] WANG J, SUN C, ZHENG Y, et al. The effective mechanism of the polysaccharides from Panax ginseng on chronic fatigue syndrome[J]. Archives of Pharmacal Research,2014,37(4):530−538. doi: 10.1007/s12272-013-0235-y
[7] 谢飞飞. 远志多糖对力竭运动小鼠体内抗疲劳和体外抗氧化作用研究[J]. 食品工业科技,2021,42(6):332−336. [XIE F F. Effects of anti-fatigue in vivo and anti-oxidant in vitro of polysaccharides from Polygala tenuifolia Willd. on exhaustive exercise mice[J]. Science and Technology of Food Industry,2021,42(6):332−336. XIE F F. Effects of anti-fatigue in vivo and anti-oxidant in vitro of polysaccharides from Polygala tenuifolia Willd. on exhaustive exercise mice[J]. Science and Technology of Food Industry, 2021, 42(6): 332-336.
[8] 刘飞, 徐佳馨, 颜娓娓, 等. 中药佩兰体外抗病毒有效部位筛选[J]. 暨南大学学报(自然科学与医学版),2018,39(1):80−86. [LIU F, XU J X, YAN W W, et al. Screen of effective antiviral parts of Chinese medicine Eupatorium fortunei Turcz. in vitro[J]. Journal of Jinan University (Natural Science & Medicine Edition),2018,39(1):80−86. LIU F, XU J X, YAN W W, et al. Screen of effective antiviral parts of Chinese medicine Eupatorium fortunei Turcz. in vitro[J]. Journal of Jinan University (Natural Science & Medicine Edition), 2018, 39(1): 80-86.
[9] 李旭冉, 王梦溪, 朱邵晴, 等. 不同干燥方式对佩兰药材挥发性成分的影响与评价[J]. 中药材,2016,39(12):2747−2752. [LI X R, WANG M X, ZHU S Q, et al. Effects of drying methods on volatile components in Eupatorium fortunei Aerial Part[J]. Journal of Chinese Medicinal Materials,2016,39(12):2747−2752. LI X R, WANG M X, ZHU S Q, et al. Effects of drying methods on volatile components in Eupatorium fortunei Aerial Part[J]. Journal of Chinese Medicinal Materials, 2016, 39(12): 2747-2752.
[10] 许冰. 泽兰与佩兰的化学成分研究[D]. 沈阳: 辽宁师范大学, 2016. XU Bing. Study on chemical constituents of Eupatorium adenophorum and Eupatorium fortunei Turez[D]. Shenyang: Liaoning Normal University, 2016.
[11] 刘杰, 金岩. 佩兰中黄酮类化合物的提取及抑菌活性研究[J]. 上海化工,2012,37(1):15−17. [LIU J, JIN Y. Study on extracting condition of flavonoids from Eupatorium fortunei Turez and its antibacterial activities[J]. Shanghai Chemical Industry,2012,37(1):15−17. doi: 10.3969/j.issn.1004-017X.2012.01.006 LIU J, JIN Y. Study on extracting condition of flavonoids from Eupatorium fortunei Turez and its antibacterial activities[J]. Shanghai Chemical Industry, 2012, 37(1): 15-17. doi: 10.3969/j.issn.1004-017X.2012.01.006
[12] 杨观兰, 钟朝玲, 卢连香, 等. 南酸枣叶总黄酮的纯化及其抗氧化活性研究[J]. 食品科技,2021,46(8):178−183. [YANG G L, ZHONG C L, LU L X, et al. Purifcation and antioxidant activity of flavonoids from Choerospondias axillaris leaves[J]. Food Science and Technology,2021,46(8):178−183. YANG G L, ZHONG C L, LU L X, et al. Purifcation and antioxidant activity of flavonoids from Choerospondias axillaris leaves[J]. Food Science And Technology, 2021, 46(8): 178-183.
[13] TANG X, YANG Z, ZHANG J, et al. Synthesis, structure, antioxidation and DNA-binding studies of a zinc(II) complex with tris (2-benzimidazylmethyl) amine and cinnamate[J]. Research on Chemical Intermediates,2015,41(7):4349−4360. doi: 10.1007/s11164-014-1534-8
[14] CHAE G Y, HA B J. The comparative evaluation of fermented and non-fermented soybean extract on antioxidation and whitening[J]. Toxicological Research,2011,27(4):205−209. doi: 10.5487/TR.2011.27.4.205
[15] TAN W, YU K Q, LIU Y Y, et al. Antifatigue activity of poly-saccharides extract from Radix Rehmanniae Preparat[J]. International Journal of Biological Macromolecules,2012,50(1):59−62. doi: 10.1016/j.ijbiomac.2011.09.019
[16] WANG J, LI S S, FAN Y Y, et al. Anti-fatigue activity of the water-soluble polysaccharides isolated from Panax ginseng C. A. Meyer[J]. J Ethnopharmacol,2010,130(2):421−423. doi: 10.1016/j.jep.2010.05.027
[17] 王书全, 李丽. 螺旋藻多糖抗疲劳作用研究[J]. 食品工业科技,2013,34(22):328−330. [WANG S Q, LI L. Study on anti-fatigue effect of Spirulina polysaccharide[J]. Science and Technology of Food Industry,2013,34(22):328−330. WANG S Q, LI L. Study on anti-fatigue effect of Spirulina polysaccharide[J]. Science and Technology of Food Industry, 2013, 34(22): 328-330.
[18] 邓云兵, 黄冬琴, 岳天翔. 淡竹叶多糖的大孔吸附树脂纯化工艺及对小鼠运动耐力的影响[J]. 食品工业科技,2021,42(14):169−174. [DENG Y B, HUANG D Q, YUE T X. Purification technology of polysaccharides from Lophatherum gracile Brongn. by macroporous resin adsorption and its effect on athletic endurance of mice[J]. Science and Technology of Food Industry,2021,42(14):169−174. DENG Y B, HUANG D Q, YUE T X. Purification technology of polysaccharides from Lophatherum gracile Brongn. by macroporous resin adsorption and its effect on athletic endurance of mice[J]. Science and Technology of Food Industry, 2021, 42(14): 169-174.
[19] 刘大伟. 黄芩多糖大孔树脂纯化工艺优化及其抑菌活性[J]. 食品工业科技,2021,42(15):183−188. [LIU D W. Optimization purification process of polysaccharides from Scutellaria baicalensis Georgi by macroporous resins and its antibacterial activity[J]. Science and Technology of Food Industry,2021,42(15):183−188. LIU D W. Optimization purification process of polysaccharides from Scutellaria baicalensis Georgi by macroporous resins and its antibacterial activity[J]. Science and Technology of Food Industry, 2021, 42(15): 183-188.
[20] 张沛, 吴楠, 宋志军, 等. 响应面法优化大孔树脂纯化黄芪毛蕊异黄酮工艺[J]. 食品工业科技,2021,42(10):209−214. [ZHANG P, WU N, SONG Z J, et al. Purification of calycosin from Astragalusme mbranceus with macroporous resins by response surface analysis[J]. Science and Technology of Food Industry,2021,42(10):209−214. ZHANG P, WU N, SONG Z J, et al. Purification of calycosin from Astragalusme mbranceus with macroporous resins by response surface analysis[J]. Science and Technology of Food Industry, 2021, 42(10): 209-214.
[21] 韩秋菊, 李薇, 冯雅郡, 等. 藁本黄酮的纯化及体外抗氧化活性研究[J]. 应用化工,2021,50(7):1863−1866. [HAN Q J, LI W, FENG Y J, et al. Purification and antioxidant activity of Ligusticum flavonoids in vitro[J]. Applied Chemical Industry,2021,50(7):1863−1866. doi: 10.3969/j.issn.1671-3206.2021.07.027 HAN Q J, LI W, FENG Y J, et al. Purification and antioxidant activity of Ligusticum flavonoids in vitro[J]. Applied Chemical Industry, 2021, 50(7): 1863-1866. doi: 10.3969/j.issn.1671-3206.2021.07.027
[22] 李倩, 奥斯曼江·麦提图尔荪, 李晨阳, 等. 大孔树脂纯化新疆圆柏总黄酮工艺研究[J]. 食品工业科技,2016,37(7):188−192. [LI Q, MAITITUERSUN A, LI C Y, et al. Purification of total flavonoids from Junipers sabina L. by macroporous resin[J]. Science and Technology of Food Industry,2016,37(7):188−192. LI Q, MAITITUERSUN A, LI C Y, et al. Purification of total flavonoids from Junipers sabina L. by macroporous resin[J]. Science and Technology of Food Industry, 2016, 37(7): 188-192.
[23] MASON S A, MORRISON D, MCCONELL G K, et al. Muscle redox signalling pathways in exercise. Role of antioxidants[J]. Free Radical Biology & Medicine,2016,98:29−45.
[24] YANG D S, LIAN J H, WANG L Y, et al. The anti-fatigue and anti-anoxia effects of Tremella extract[J]. Saudi Journal of Biological Sciences,2019,26(8):2052−2056. doi: 10.1016/j.sjbs.2019.08.014
[25] YOU L, ZHAO M, REGENSTEIN J M, et al. In vitro antioxidant activity and in vivo anti-fatigue effect of loach (Misgurnus anguillicaudatus) peptides prepared by papain digestion[J]. Food Chemistry,2011,124(1):188−194. doi: 10.1016/j.foodchem.2010.06.007
[26] TRINITY J D, BROXTERMAN R M, RICHARDSON R S. Regulation of exercise blood flow: Role of free radicals[J]. Free Radical Biology and Medicine,2016,98:90−102. doi: 10.1016/j.freeradbiomed.2016.01.017








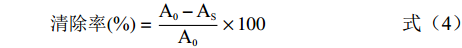
 下载:
下载:
 下载:
下载:
