Extraction and Purification of Intracellular Polysaccharide from Chlorella vulgaris and Its Antioxidant Activity
-
摘要: 为提高小球藻胞内粗多糖得率,并探究小球藻胞内多糖纯化组分的抗氧化作用。本研究采取超声波破碎和热水浸提相结合的方法提取小球藻胞内粗多糖,利用响应面法进行提取条件优化,在此基础上,采用阴离子交换柱和葡聚糖凝胶柱层析对提取得到的粗多糖进行分离纯化,并进行结构表征和抗氧化试验。响应面结果显示,小球藻胞内粗多糖最优提取条件为:NaOH质量分数为2.0%,料液比为1:25(g/mL),超声功率为200 W,超声时间为20 min,提取温度为80 ℃,提取时间为1.5 h,在此条件下,小球藻胞内粗多糖的得率为18.086%±0.143%。结构表征和体外抗氧化结果显示,纯化多糖(Purification of intracellular polysaccharide,SCIP),主要由葡萄糖、鼠李糖及半乳糖成分组成,是一种含有糖醛酸的吡喃糖。其在20 mg/mL时,对1,1-二苯基-2-苦基肼(1,1-Diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率最大,为75.64%±1.56%,在25 mg/mL时,对羟基自由基清除率最大,为71.08%±0.58%,IC50分别6.42 mg/mL和8.59 mg/mL。研究结果为深入了解小球藻胞内多糖理化性质及小球藻多糖的开发利用提供基础。Abstract: In order to improve the yield of crude polysaccharide from Chlorella vulgaris and explore the antioxidant effect of purified intracellular polysaccharide from Chlorella vulgaris, this study adopted the method of ultrasonic crushing and hot water extraction to extract intracellular crude polysaccharides from Chlorella vulgaris. Response surface method was used to optimize the extraction conditions. On this basis, anion exchange column and dextran gel column chromatography were used to separate and purify the extracted crude polysaccharides, and the characterization and antioxidant test were carried out. Response surface results showed that the optimal extraction conditions of intracellular crude polysaccharides from Chlorella vulgaris were as follows: The mass fraction of NaOH 2.0%, the material-liquid ratio 1:25 (g/mL), the ultrasonic power 200 W, the ultrasonic time 20 min, the extraction temperature 80 ℃, the extraction time 1.5 h. Under these conditions, the yield of intracellular crude polysaccharide was 18.086%±0.143%. The results of characterization and antioxidant activity in vitro showed that SCIP was a pyranose sugar containing uronic acid and was composed of glucose, rhamnose and galactose. At 20 mg/mL, the DPPH radical scavenging rate was the largest of 75.64%±1.56%, and at 25 mg/mL, the hydroxyl radical scavenging rate was the largest of 71.08%±0.58%. IC50 were 6.42 mg/mL and 8.59 mg/mL, respectively. The results provided a basis for further understanding of the physicochemical properties and biological activities of polysaccharides from Chlorella sp.
-
小球藻是一类普生性单细胞绿藻,生态类型多样,分布广泛。由于其生长速度快、饲养简单、有效成分含量高等特点,已发展成为微藻养殖最广泛的种类之一。多糖是小球藻活性提取物中重要的组成部分[1],小球藻多糖具有良好的抗氧化活性[2-3],并且在调节机体免疫[4-5]、抗病毒[6-7]、抗菌[8]、抗肿瘤[9]、抗炎[10]、抗糖尿病[11]等诸多方面表现优异。抗氧化能力作为多糖的重要活性之一,已经成为了国内外多糖研究的热点,在海藻中检测得到的抗氧化化合物具有广阔的应用前景,在人类健康和营养中发挥重要作用[12],而抗氧化研究大多集中在大型海藻中,对微藻多糖抗氧化的研究开展较少[13],故本试验针对小球藻多糖抗氧化性展开研究。
小球藻胞内粗多糖的得率较低,多糖种类多样,结构复杂,且水溶性较差,导致小球藻多糖的开发利用较为困难[14]。关于多糖的提取,目前常用的提取方法有酸碱溶液浸提法、热水浸提法、微波辅助法、超声波辅助法及酶法等。在高温、酸性、碱性提取条件下,可导致多糖降解,并且会使粗多糖的样品颜色变深[15];微波辅助法提高了得率,但是产热高,在试验前需要花费大量时间根据提取物的耐热性来确定最佳作用周期,导致试验过程繁琐且周期长[16-17] ;酶法提取杂质较多,不益于后期的分离纯化[18];超声波辅助法具有产热少、耗时短、抽提率高等优点[19]。通过两种或多种技术的联合应用,能够提高多糖得率,同时具有提取迅速、节能和简便等优点[16],故本试验采用超声波辅助热水浸提法提取小球藻胞内粗多糖。
本研究以小球藻为原料,采取超声波破碎和热水浸提相结合的方法提取小球藻胞内粗多糖,利用响应面法进行提取条件的优化,并对粗多糖进行分离纯化、表征分析和体外抗氧化试验,以期为小球藻多糖的开发利用提供理论依据。
1. 材料与方法
1.1 材料与仪器
小球藻(Chlorella vulgaris) 上海光语生物科技有限公司,由本实验室培育并保藏;1,1-二苯基-2-苦基肼(DPPH) 北京博奥拓达科技有限公司;羟自由基清除能力检测试剂盒 索莱宝生物科技有限公司;DEAE-52纤维素、葡聚糖凝胶Sephadex G-100 上海瑞永生物科技有限公司;葡聚糖系列标准品(分子量分别为5000、11600、23800、48600、80900、148000、273000、409800、667800 Da)与单糖标准品:岩藻糖(Fucose,Fuc)、盐酸氨基半乳糖(Galactosamine hydrochloride,GalN)、鼠李糖(Rhamnose,Rha)、阿拉伯糖(Arabinose,Ara)、盐酸氨基葡萄糖(Glucosamine hydrochloride,GlcN)、半乳糖(Galactose,Gal)、葡萄糖(Glucose,Glc)、N-乙酰-D氨基葡萄糖(N-acetyl-d-glucosamine,GlcNAc)、木糖(Xylose,Xyl)、甘露糖(Mannose,Man)、果糖(Fructose,Fru)、核糖(Ribose,Rib)、半乳糖醛酸(Galactouronic acid,GalA)、葡萄糖醛酸(Glucuronic acid,GlcA)、古罗糖醛酸(Guluronic acid,GulA)、甘露糖醛酸(Mannuronic acid,ManA) 分析纯,博睿糖生物技术有限公司;其他试剂均为国产分析纯。
60 L封闭式光生物反应器 上海光语生物科技有限公司;UV-1800紫外可见分光光度计 上海美谱达仪器有限公司;LGJ-10真空冷冻干燥机 北京松源华兴科技发展有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新芝生物科技股份有限公司;LC-10A高效液相色谱仪 日本Shimadzu公司;ICS5000离子色谱仪、Nicolet IS10傅里叶变换红外光谱仪 美国ThermoFisher公司;Epoch酶标仪 美国伯腾公司;TG1850-WS台式高速离心机 上海卢湘仪离心机仪器有限公司;HH-4数显恒温水浴锅 常州国华电器有限公司;C184322闪式层析柱、C195324球磨口闪式层析柱 重庆欣维尔玻璃有限公司。
1.2 实验方法
1.2.1 小球藻胞内粗多糖提取条件优化
1.2.1.1 小球藻培养及小球藻粉制备
将小球藻按照15%的接种量培养于含f/2培养基[20]的封闭式光生物反应器中,温度为24±1 ℃,光照强度3500 Lux,光暗周期12/12 h[21]。
取培养至生长稳定期[22]藻液,利用高速离心机8000 r/min离心10 min收集藻泥,冷冻干燥成小球藻粉备用。
1.2.1.2 小球藻胞内粗多糖提取及得率测定
精确称取干燥小球藻藻粉0.1 g,与一定质量分数的NaOH溶液以不同料液比混合,利用超声波细胞粉碎机进行超声破碎以破除小球藻细胞壁,不同水浴温度反应一定时间进行提取,8000 r/min离心10 min,取上清液加入4倍体积无水乙醇,4 ℃静置过夜[23]。次日8000 r/min离心10 min,舍弃上清液,将沉淀复溶于蒸馏水中,得多糖溶液。利用Sevage法[24]对多糖溶液进行脱蛋白处理,得到上清液后再加入4倍体积无水乙醇,4 ℃静置过夜,次日8000 r/min离心10 min,将离心得到的沉淀冷冻干燥即得小球藻胞内粗多糖。
采用蒽酮-硫酸比色法[25]测定小球藻粗多糖浓度,以葡萄糖浓度(μg/mL)为横坐标,以620 nm处的吸光值为纵坐标绘制葡萄糖标准曲线,得到葡萄糖浓度与吸光值关系的线性方程为:
y=0.00251x+0.05904,R2=0.99926 按照以下公式计算小球藻胞内粗多糖得率[26]:
得率(%)=C×V×N×10−3m×100 式中:C-标准葡萄糖浓度(μg/mL);V-粗提液体积(mL);N-稀释倍数;m-小球藻粉质量(mg)。
1.2.1.3 单因素实验设计
小球藻胞内粗多糖提取的基本条件固定为:NaOH质量分数2.5%,料液比1:30(g/mL),超声功率300 W,超声时间20 min,提取温度80 ℃,提取时间2 h。改变其中一个条件,分别考察NaOH质量分数(A)、料液比(B)、超声功率(C)、超声时间(D)、提取温度(E)、提取时间(F)6个因素对粗多糖得率的影响,试验设计见表1,根据葡萄糖标准曲线计算粗多糖得率。
表 1 单因素设计因素及水平Table 1. Factors and levels of univariate design因素 参数设置 A NaOH质量分数(%) 1.0 1.5 2.0 2.5 3.0 3.5 B 料液比(g/mL) 1:15 1:20 1:25 1:30 1:35 1:40 C 超声功率(W) 0 100 200 300 400 500 D 超声时间(min) 10 15 20 25 30 35 E 提取温度(℃) 50 60 70 80 90 100 F 提取时间(h) 1 2 3 4 5 6 1.2.1.4 Plackett-Burman试验设计
根据单因素实验结果,对小球藻粗多糖提取工艺中6个因素进行Plackett-Burman试验设计,根据结果得到影响粗多糖得率的显著因素 [27],以粗多糖得率为响应值,并对试验结果进行方差分析,试验设计因素与水平见表2。
表 2 Plackett-Burman试验因素及水平Table 2. Factors and levels of PB design experiment水平 因素 A(%) B(g/mL) C(W) D(min) E(℃) F(h) −1 2.5 1:30 300 20 80 3 1 3.5 1:40 400 25 100 4 1.2.1.5 最陡爬坡试验设计
根据Plackett-Burman试验结果设计最陡爬坡试验。在后续的爬坡试验设计中,应增大呈正效应的因素,减小呈负效应的因素,设置合适的步长,从而使显著因素更经济快速地逼近最佳响应区域[28],即提取粗多糖的最优条件。
1.2.1.6 响应面法优化试验
根据最陡爬坡试验结果,采用 Box-Behnken(BBD)设计原理,选择NaOH质量分数、料液比、超声功率、提取时间为自变量,以粗多糖得率为响应值,设计四因素三水平响应面优化试验,试验因素及水平设计见表3。
表 3 响应面试验因素及水平Table 3. Factors and level of response surface experiment水平 因素 NaOH质量分数X1(%) 料液比X2(g/mL) 超声功率X3(W) 提取时间X4(h) −1 1.5 1:20 150 1.5 0 2.0 1:25 200 2.0 1 2.5 1:30 250 2.5 1.2.2 小球藻胞内粗多糖分离纯化及表征
1.2.2.1 阴离子交换柱层析
采用闪式层析柱以DEAE-52纤维素为填料进行装柱,对小球藻胞内粗多糖进行分离纯化[29]。将粗多糖配成5 mg/mL的多糖溶液,多糖溶液经0.22 μm微孔滤膜过滤除菌,依次使用超纯水、0.2、0.5、0.75、1 mol/L的NaCl溶液进行洗脱,流速为2 mL/min,每管收集8 mL,利用蒽酮-硫酸法于620 nm处测定每管吸光度,根据出峰位置进行收集,得到的五种组分(CIP-1、CIP-2、CIP-3、CIP-4、CIP-5),将收集的各组分浓缩,利用截留分子量为3500 Da透析袋透析除盐,冷冻干燥备用。
1.2.2.2 葡聚糖凝胶柱层析
采用球磨口闪式层析柱以Sephadex G-100为填料进行装柱,利用葡聚糖凝胶柱Sephadex G-100对经DEAE-52纤维素柱分离得到的组分进一步纯化[30],选择酸性多糖CIP-3进行进一步纯化。将CIP-3配成8 mg/mL多糖溶液,经0.22 μm微孔滤膜过滤除菌后,使用超纯水洗脱,流速为0.3 mL/min,每管收集3 mL,利用蒽酮-硫酸法于620 nm处测定每管吸光度,根据出峰位置进行收集,得到纯化后组分SCIP,将收集得到的SCIP浓缩后冷冻干燥备用。
1.2.2.3 SCIP紫外光谱分析
取SCIP配成0.5 mg/mL的多糖溶液,以蒸馏水作空白对照,在200~400 nm范围内进行紫外光谱扫描,检测多糖组分中是否有蛋白质和核酸的干扰[31]。
1.2.2.4 SCIP红外光谱分析
取SCIP 1 mg与100 mg干燥KBr粉末在红外灯下研磨均匀,进行压片[8],在4000~400 cm−1范围内进行红外光谱扫描。
1.2.2.5 SCIP分子量测定
通过高效液相色谱仪测定SCIP分子量。在Aipire等[32]基础上,进行调整,精密称取SCIP和葡聚糖系列标准品,均配制成5 mg/mL溶液,12000 r/min离心10 min,上清液用0.22 μm微孔滤膜过滤,将样品转置于1.8 mL进样瓶中。
色谱条件为:色谱柱(BRT105-104-102串联凝胶柱);流动相(0.05 mol/L NaCl溶液);流速(0.6 mL/min);柱温(40 ℃);进样量(20 μL);检测器(示差检测器RI-10A)。与标准品对照,分析处理数据。
1.2.2.6 SCIP单糖组成分析
通过离子色谱仪测定单糖组成。在赵丹等[33]的基础上进行改进,取16种单糖标准品配成10 mg/mL标准溶液,取各单糖标准溶液精密配置成不同浓度梯度(0.01、0.1、0.5、1、5、10、20 mg/mL)的标准品。根据绝对定量方法,测定不同单糖质量,根据单糖摩尔质量计算出摩尔比。
样品准备:精密称量10 mg SCIP置于安瓿瓶中,加入3 mol/L 三氟乙酸10 mL,120 ℃水解3 h。准确吸取酸水解溶液转置于管中氮吹吹干,加入10 mL水涡旋混匀,吸取100 μL加入900 μL超纯水,12000 r/min离心5 min。取上清进行离子色谱分析。
色谱条件为:色谱柱(Dionex Carbopac TMPA20);流动相(A:H2O;B:15 mmol/L NaOH 与100 mmol/L NaOAC等比例混合液);流速(0.3 mL/min);进样量(5 µL);柱温(30 ℃);检测器(电化学检测器)。
1.2.3 SCIP体外抗氧化能力研究
1.2.3.1 对DPPH自由基清除能力
取不同浓度SCIP溶液(0.5、1、2、4、8、12、16、20 mg/mL)1 mL,加入0.004%的 DPPH甲醇溶液1 mL,摇匀,避光保存30 min,517 nm处测吸光度(Ai),1 mL甲醇与1 mL多糖溶液混合在517 nm处吸光度(Aj),1 mL DPPH甲醇溶液与1 mL甲醇混合在517 nm处吸光度(A0)[34],以稀释100倍VC(0.005、0.01、0.02、0.04、0.08、0.12、0.16、0.2 mg/mL)作为阳性对照。DPPH自由基清除率公式为:
清除率(%)=(1−Ai-AjA0)×100 1.2.3.2 对羟基自由基清除能力
配制不同浓度(0.5、1、3、5、10、15、20、25 mg/mL)SCIP溶液,根据羟自由基清除能力检测试剂盒在536 nm处进行测定[22],以稀释100倍VC(0.005、0.01、0.03、0.05、0.1、0.15、0.2、0.25 mg/mL)作为阳性对照。羟自由基清除率公式为:
清除率(%)=(S测−S对)(S空−S对)×100 式中:S测:待测样品吸光值;S对:对照管吸光值;S空:空白管吸光值。
1.3 数据处理
Plackett-Burman试验及方差分析、响应面试验及方差分析采用 Design-Expert 10.0.7软件。IC50预测采用IBM SPSS Statistics 25软件。本试验所作图谱均采用 OriginPro 9.1软件作图,且每个试验均做3个重复。
2. 结果与分析
2.1 小球藻胞内粗多糖提取条件优化
2.1.1 小球藻胞内多糖提取单因素实验结果
由图1A和1B可知,随着NaOH质量浓度和料液比的增加,粗多糖得率都呈现先增高后降低的趋势,且分别在2.5%和1:30(g/mL)时,多糖得率达到最大值。此后,随着NaOH质量浓度和料液比的继续增加都会使碱的浓度过大,从而使多糖被降解而造成得率下降[28],还会造成试剂的浪费。考虑到综合利用和节约成本,所以选择NaOH质量浓度为2.5%、料液比为1:30(g/mL)时作为多糖提取的最优值。
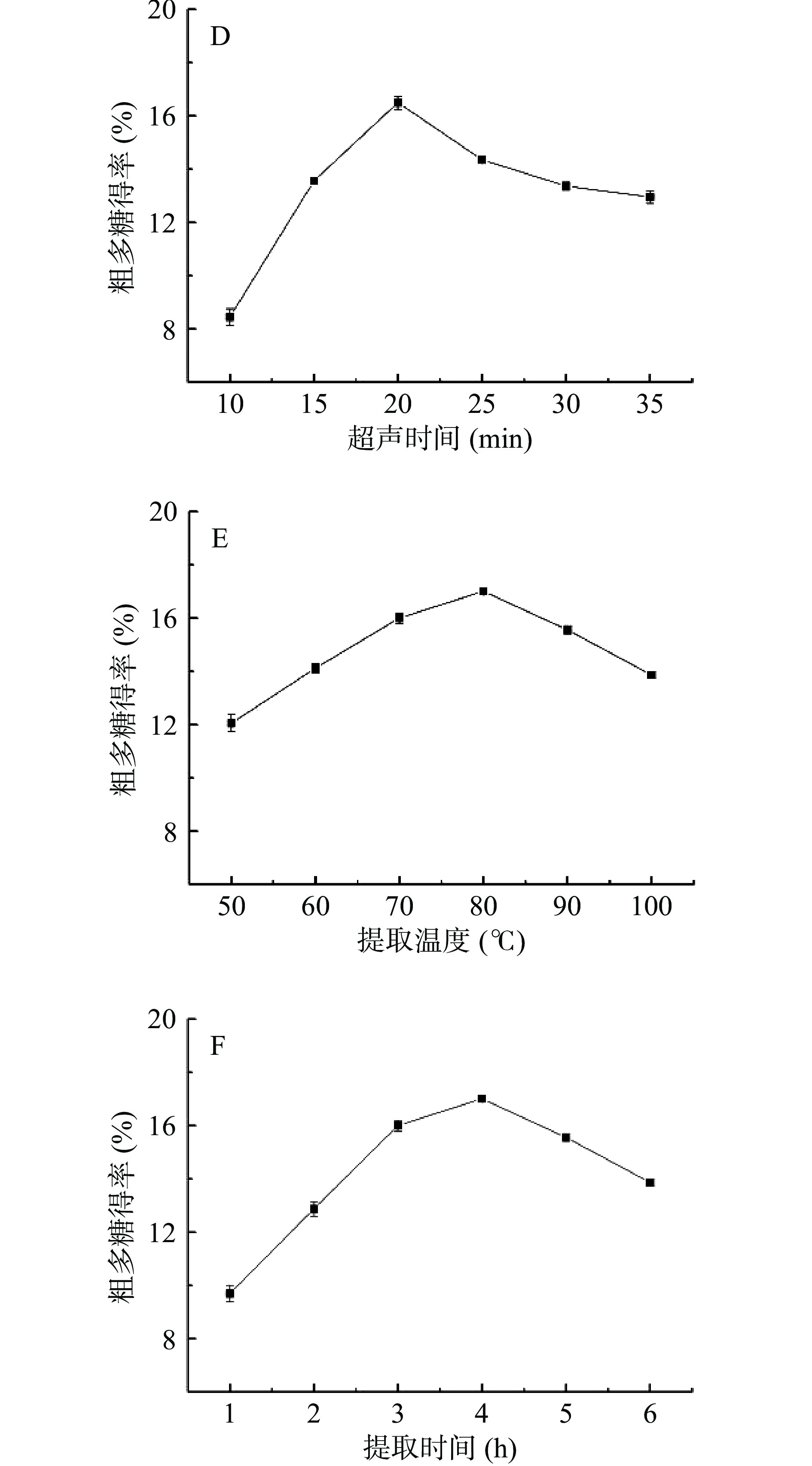
由图1C和1D可知,超声功率为300 W、超声时间为20 min时,多糖得率为最大值。继续增大超声功率和超声时间,多糖的得率会下降,这是因为增加功率和延长时间都会造成热量的增加,从而引起小球藻多糖发生降解[35]。因此,选择超声功率300 W、超声时间为20 min时作为多糖提取的最优值。
由图1E、1F可知,提取温度80 ℃、提取时间4 h时多糖得率最大。温度和提取时间的增加,有助于多糖的溶出,但是温度过高会引起多糖的降解[35],不利于后续的回收。因此,选择提取温度80 ℃、提取时间4 h时作为多糖提取的最优值。
2.1.2 Plackett-Burman试验设计及结果
根据单因素结果设计Plackett-Burman试验见表4,将表4试验结果进行显著性及方差分析见表5。
表 4 Plackett-Burman试验设计及结果Table 4. Design and results of PB experiment试验号 A B C D E F 粗多糖得率(%) 1 −1 −1 −1 1 −1 1 16.094 2 −1 1 −1 1 1 −1 14.567 3 −1 1 1 −1 1 1 7.900 4 −1 −1 −1 −1 −1 −1 17.422 5 1 −1 1 1 −1 1 8.100 6 −1 −1 1 −1 1 1 12.190 7 1 1 −1 1 1 1 8.777 8 1 1 1 −1 −1 −1 9.460 9 −1 1 1 1 −1 −1 9.056 10 1 −1 1 1 1 −1 9.016 11 1 1 −1 −1 −1 1 9.215 12 1 −1 −1 −1 1 −1 15.058 根据表4分析可得,第4组的多糖得率最高,为17.422%,即NaOH质量分数(A)2.5%、料液比(B)1:30(g/mL)、超声功率(C)300 W、超声时间(D)20 min、提取温度(E)80 ℃、提取时间(F)3 h。根据表5分析,A、B、C、F这4个因素对多糖得率影响显著(P<0.05),显著性影响C>B>A>F,且均呈负效应(T<0)[36]。因此,固定超声时间20 min、提取温度80 ℃,进一步研究A、B、C、F之间的交互影响。
表 5 Plackett-Burman试验方差分析Table 5. Variance analysis of PB experiment来源 平方和 自由度 均方 F值 P值 T值 显著性 模型 124.97 6 20.83 14.64 0.0049 ** A 25.82 1 25.82 18.15 0.0080 −1.47 ** B 29.78 1 29.78 20.94 0.0060 −1.58 ** C 53.81 1 53.81 37.83 0.0017 −2.12 ** D 2.75 1 2.65 1.86 0.2307 −0.47 E 0.28 1 0.28 0.20 0.6749 −0.15 F 12.62 1 12.62 8.87 0.0309 −1.03 * 残差 7.11 5 1.42 总和 132.08 11 注:*表示对结果影响显著(P<0.05);**表示对结果影响极显著(P<0.01)。 2.1.3 最陡爬坡试验设计及结果
根据Plackett-Burman试验结果,选择4个主效应因素NaOH质量分数(X1)、料液比(X2)、超声功率(X3)、提取时间(X4)进行最陡爬坡试验,因为此四个因素均为负因素,所以应减小其数值,故设计最陡爬坡试验见表6。
表 6 最陡爬坡试验设计及结果Table 6. Design and results of the steepest ascent experiment试验号 NaOH质量
分数X1(%)料液比X2
(g/mL)超声功率
X3(W)提取时间
X4(h)粗多糖
得率(%)1 0.5 1:10 50 0.5 12.860 2 1.0 1:15 100 1.0 14.879 3 1.5 1:20 150 1.5 16.964 4 2.0 1:25 200 2.0 17.893 5 2.5 1:30 250 2.5 16.107 6 3.0 1:35 300 3.0 14.288 分析表6最陡爬坡试验结果,4号的多糖得率最高,选择4号作为响应面设计的中心点,即NaOH质量分数为2.0%、料液比为1:25(g/mL)、超声功率200 W、提取时间2.0 h。
2.1.4 响应面结果及分析
利用Design-Expert 10.0.7软件的Box-Behnken法设计响应面试验方案,见表7,回归模型及方差分析见表8。
表 7 Box-Behnken试验设计与结果Table 7. Design and results of Box-Behnken experiment试验号 X1 X2 X3 X4 粗多糖得率(%) 1 0 0 0 0 18.073 2 −1 −1 0 0 14.195 3 0 0 −1 1 12.296 4 0 −1 0 −1 15.443 5 0 1 1 0 7.010 6 0 1 0 −1 14.939 7 0 0 1 1 11.897 8 0 0 0 0 17.781 9 −1 0 −1 0 11.539 10 1 0 0 −1 15.908 11 0 0 0 0 17.887 12 0 0 −1 −1 12.455 13 0 0 0 0 18.099 14 −1 0 0 −1 16.399 15 0 −1 0 1 15.204 16 0 1 0 1 14.646 17 −1 0 1 0 10.795 18 −1 1 0 0 13.411 19 0 0 0 0 17.223 20 1 0 0 1 15.696 21 0 0 1 −1 12.057 22 1 0 −1 0 11.287 23 0 −1 −1 0 9.786 24 1 −1 0 0 13.929 25 1 1 0 0 13.146 26 0 −1 1 0 7.727 27 1 0 1 0 10.530 28 0 1 −1 0 8.484 29 −1 0 0 1 16.147 表 8 回归方程及方差分析Table 8. Variance analysis of regression equation方差来源 平方和 自由度 均方 F值 P值 显著性 模型 271.15 14 19.37 49.34 <0.0001 ** X1 0.33 1 0.33 0.84 0.3742 X2 1.80 1 1.80 4.59 0.0503 X3 2.83 1 2.83 7.22 0.0177 * X4 0.14 1 0.14 0.37 0.5543 X1X2 0.000 1 0.000 0.000 1.0000 X1X3 4.409×10−5 1 4.409×10−5 1.123×10−4 0.9917 X1X4 3.968×10−4 1 3.968×10−4 1.011×10−3 0.9751 X2X3 0.085 1 0.085 0.22 0.6481 X2X4 7.055×10−4 1 7.055×10−4 1.797×10−3 0.9668 X3X4 0.000 1 0.000 0.000 1.0000 X12 9.95 1 9.95 25.36 0.0002 ** X22 63.19 1 63.19 161.00 <0.0001 ** X32 224.16 1 224.16 571.09 <0.0001 ** X42 3.880×10−3 1 3.880×10−3 9.885×10−3 0.9222 残差 5.50 14 0.39 失拟项 4.99 10 0.50 3.96 0.0984 误差 0.50 4 0.13 总和 276.64 28 注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。 根据表7试验结果,运用软件对响应值进行分析,得到小球藻胞内多糖提取工艺的实际因素回归方程为:
Y=−165.96+19.44X1+6.06X2+0.92X3−0.56X4+3.72×10−14X1X2−1.33×10−4X1X3+0.04X1X4−5.31×10−3X2X4−8.91×10−17X3X4−4.95X12−0.12X22−2.35×10−3X32+0.10X42
由表8可知,回归模型的P值<0.0001(P<0.01),对结果影响极其显著,失拟项P值为0.0984(P>0.05)不显著,说明该模型充分拟合试验数据,误差小,未知因素对结果干扰小[37],不同因素对粗多糖得率的影响为X3>X2>X1>X4,即超声功率>料液比>NaOH质量分数>提取时间。该模型的决定系数为0.9801>0.9,变异系数CV为4.61%<10%,信噪比RSN为21.588>4.0,说明试验结果可靠性高,相关性良好[38]。
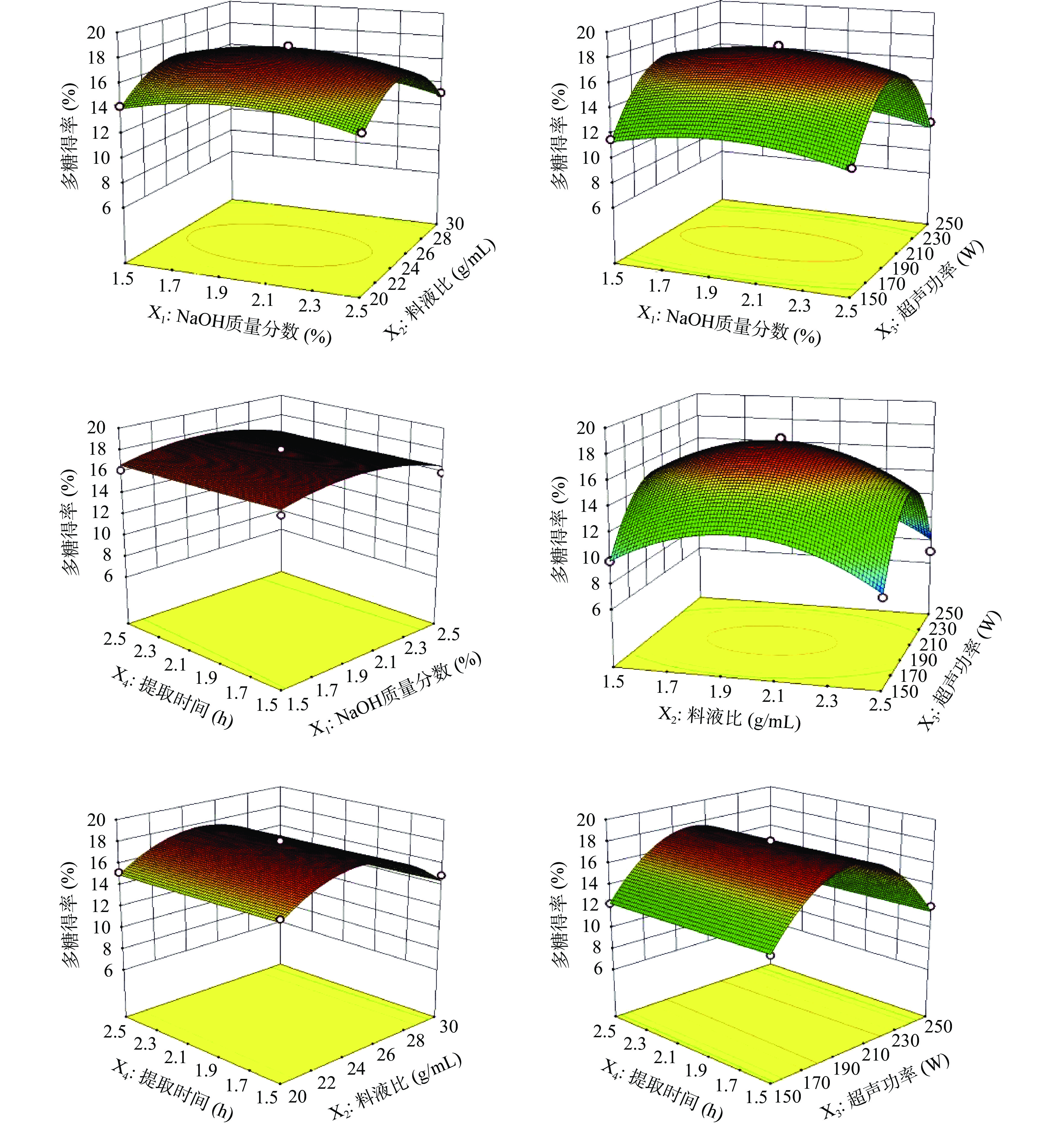
通过软件绘制的响应面三维图可以清晰的反映出各因素间的交互作用对多糖得率的影响,两因素间的交互作用可以通过等高线来体现[39],等高线为椭圆,说明交互作用显著,等高线为圆形,说明交互作用不显著。各因素对多糖得率呈抛物线,即有最大值的存在[40]。如图2显示,有X4存在的三维图,均呈马鞍状,无最大值的存在,其余三个因素之间均存在交互作用,有最大值的存在,其中,X2料液比和X3超声功率的交互作用对多糖得率影响最大。
2.1.5 响应面验证结果
根据Design-Expert 10.0.7软件预测最优方案为NaOH质量分数1.965%、料液比1:24.696(g/mL)、超声功率197.906 W、提取时间1.500 h,此时多糖得率为17.974%。考虑到实际操作情况,并验证响应面结果的真实性,故选取NaOH质量分数为2.0%、料液比为1:25(g/mL)、超声功率为200 W、提取时间为1.5 h,固定超声时间20 min、提取温度80 ℃,进行3组试验,取平均值。最终实际测得小球藻胞内粗多糖得率为18.086%±0.143%,与预测结果仅相差0.112%。证明了所构建的模型对小球藻胞内粗多糖得率的预测是准确可靠的。
2.2 小球藻胞内粗多糖分离纯化及表征
2.2.1 阴离子交换柱层析
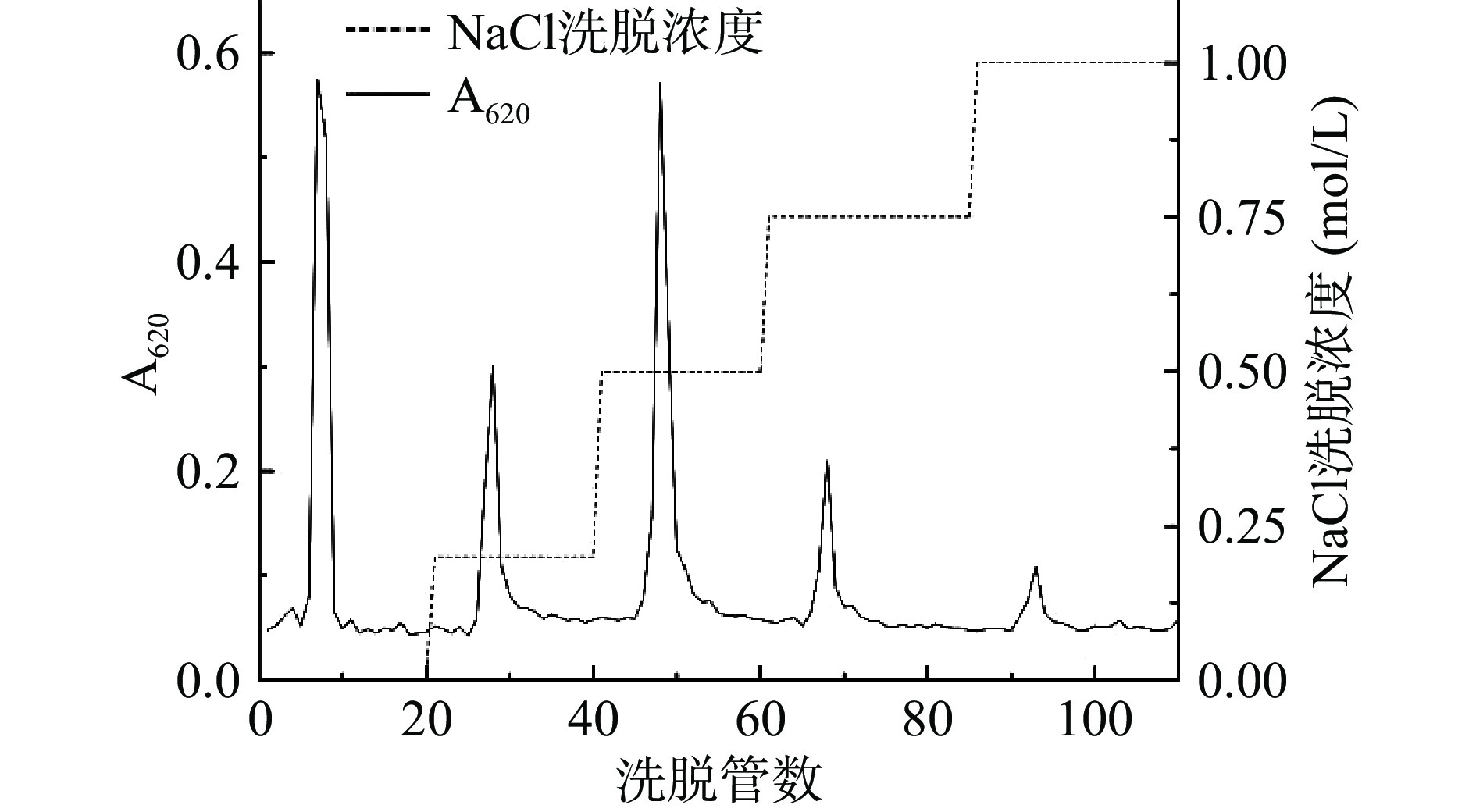
利用超纯水和不同浓度的NaCl溶液对粗多糖溶液进行洗脱后,得到五个独立多糖组分,从左到右依次命名为CIP-1、CIP-2、CIP-3、CIP-4、CIP-5,见图3。其中,CIP-1为超纯水洗脱组分,为中性多糖,其余四种为不同浓度NaCl溶液洗脱组分,为酸性多糖[31]。对五种组分分别进行浓缩、冷冻干燥并回收,发现CIP-3回收率最高,回收率≥35%,且CIP-3所含多糖含量最高,故选择CIP-3进行后续试验。
2.2.2 葡聚糖凝胶柱层析
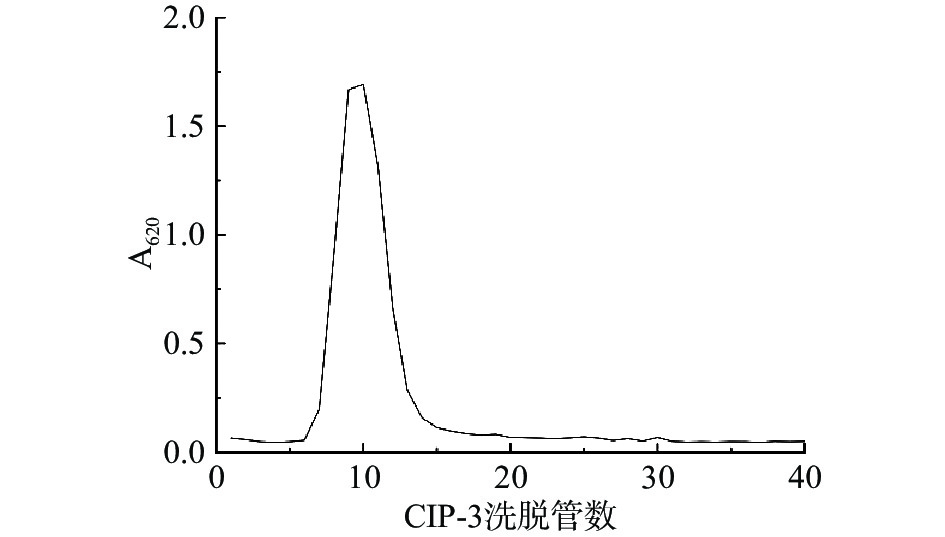
利用葡聚糖凝胶柱Sephadex G-100对CIP-3溶液进行洗脱,见图4,CIP-3峰型单一对称,表明多糖样品的纯度高[41],且回收纯度≥85%,回收浓缩并冷冻干燥CIP-3洗脱后组分,命名为SCIP。
2.2.3 SCIP紫外光谱
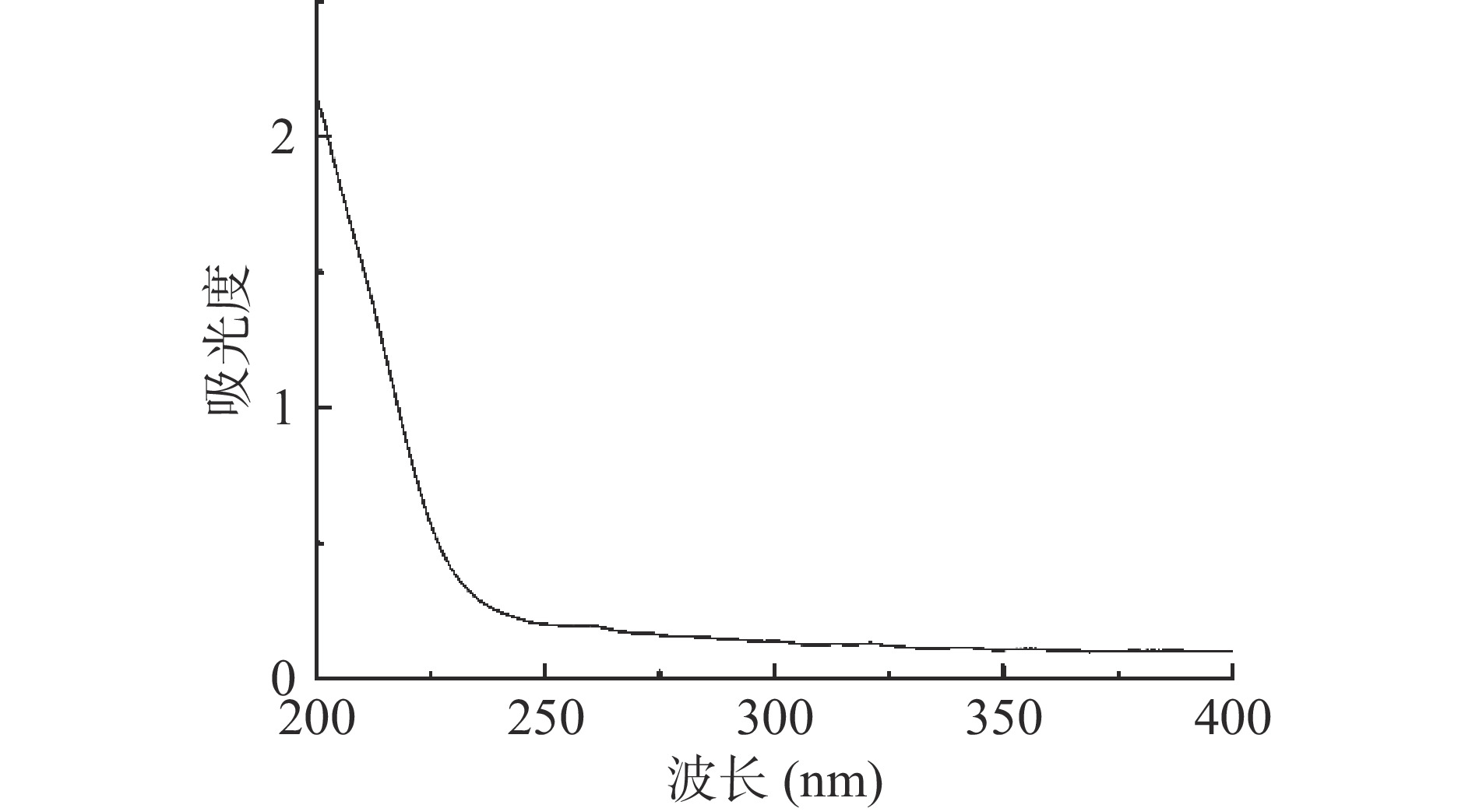
经紫外光谱扫描(图5),SCIP在260 nm和280 nm处无吸收峰,依次表明多糖中核酸和蛋白质等杂质已去除[42]。
2.2.4 SCIP红外色谱
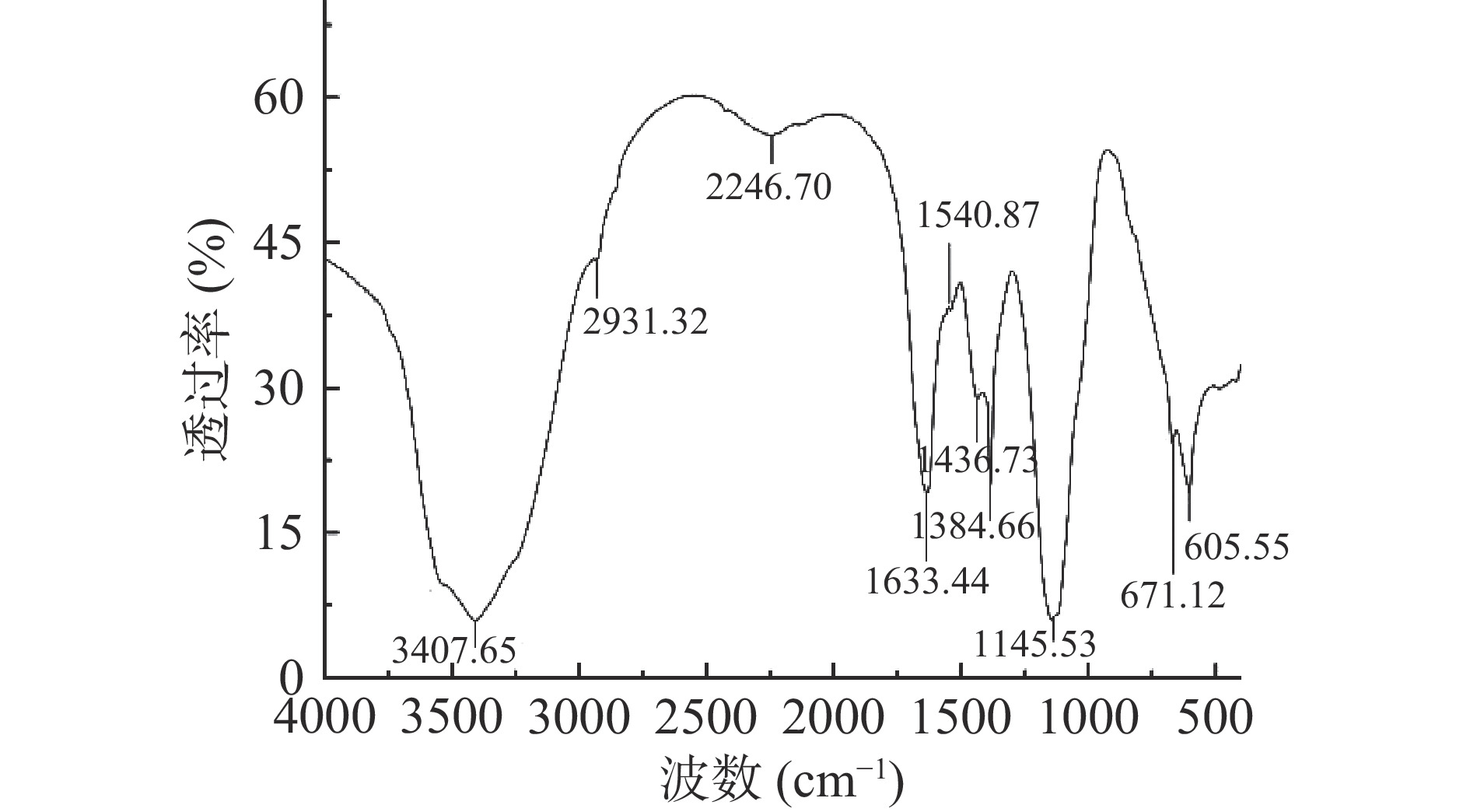
SCIP经傅里叶红外光谱扫描(图6),在3407.65 cm−1有一处宽而强的吸收峰,为-OH的伸缩振动引起的吸收峰[43];2931.32 cm−1为饱和C-H的伸缩振动引起的吸收峰,说明存在鼠李糖甲基或其它饱和碳氢键的伸缩振动[44];1633.44 cm−1的中强峰为糖醛酸C=O伸缩振动引起的吸收峰[45];1384.66 cm−1为C-H变形振动引起的吸收峰[46];1145.53 cm−1是吡喃环上的C-O-C伸缩振动引起的吸收峰[47],以上说明SCIP是一种含有糖醛酸的吡喃糖。
2.2.5 SCIP分子量分布
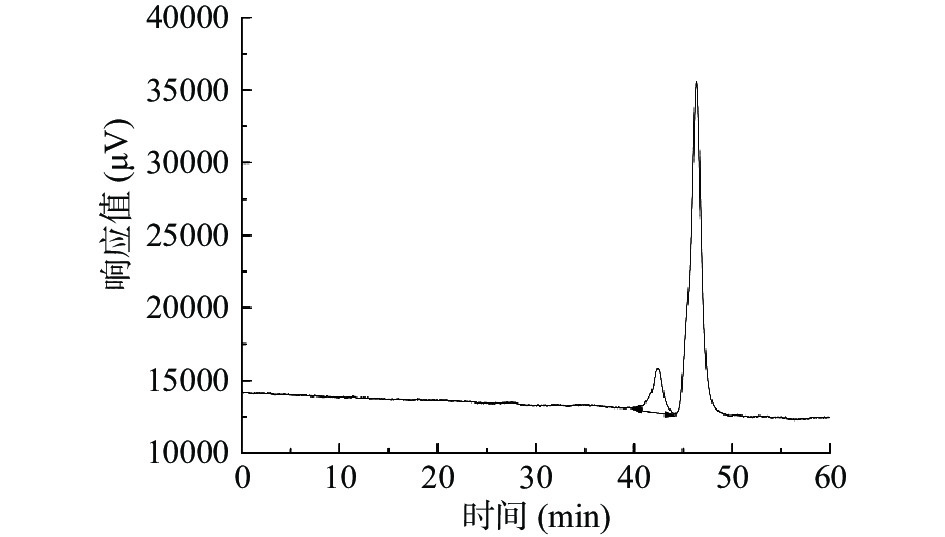
通过高效凝胶渗透色谱对SCIP分子量进行测定,见图7,SCIP为单一的洗脱峰,且峰型对称,证明SCIP为均一的纯化多糖。经计算得到lgMw-RT(重均分子量)的标准曲线y=−0.1889x+12.007,R2=0.9943,x为保留时间,本试验为42.425 min,根据标准曲线计算SCIP的分子量为9838 Da。
2.2.6 SCIP单糖组成
16种混合单糖标准品和SCIP离子色谱图如图8所示,SCIP是由9种单糖组成的均一多糖。出峰时间和摩尔比如图8、表9所示,分析可得,葡萄糖和鼠李糖及半乳糖含量最高,摩尔比为0.300:0.190:0.163,说明SCIP主要由葡萄糖、鼠李糖及半乳糖成分组成。
表 9 SCIP单糖组成Table 9. Monosaccharide composition of SCIP名称 出峰时间(min) 摩尔比 GalN 8.684 0.051 Rha 9.225 0.190 Ara 9.792 0.062 GlcN 10.809 0.096 Gal 12.259 0.163 Glc 13.875 0.300 Xyl 16.184 0.041 GalA 43.759 0.049 GlcA 46.584 0.047 2.3 SCIP体外抗氧化能力研究
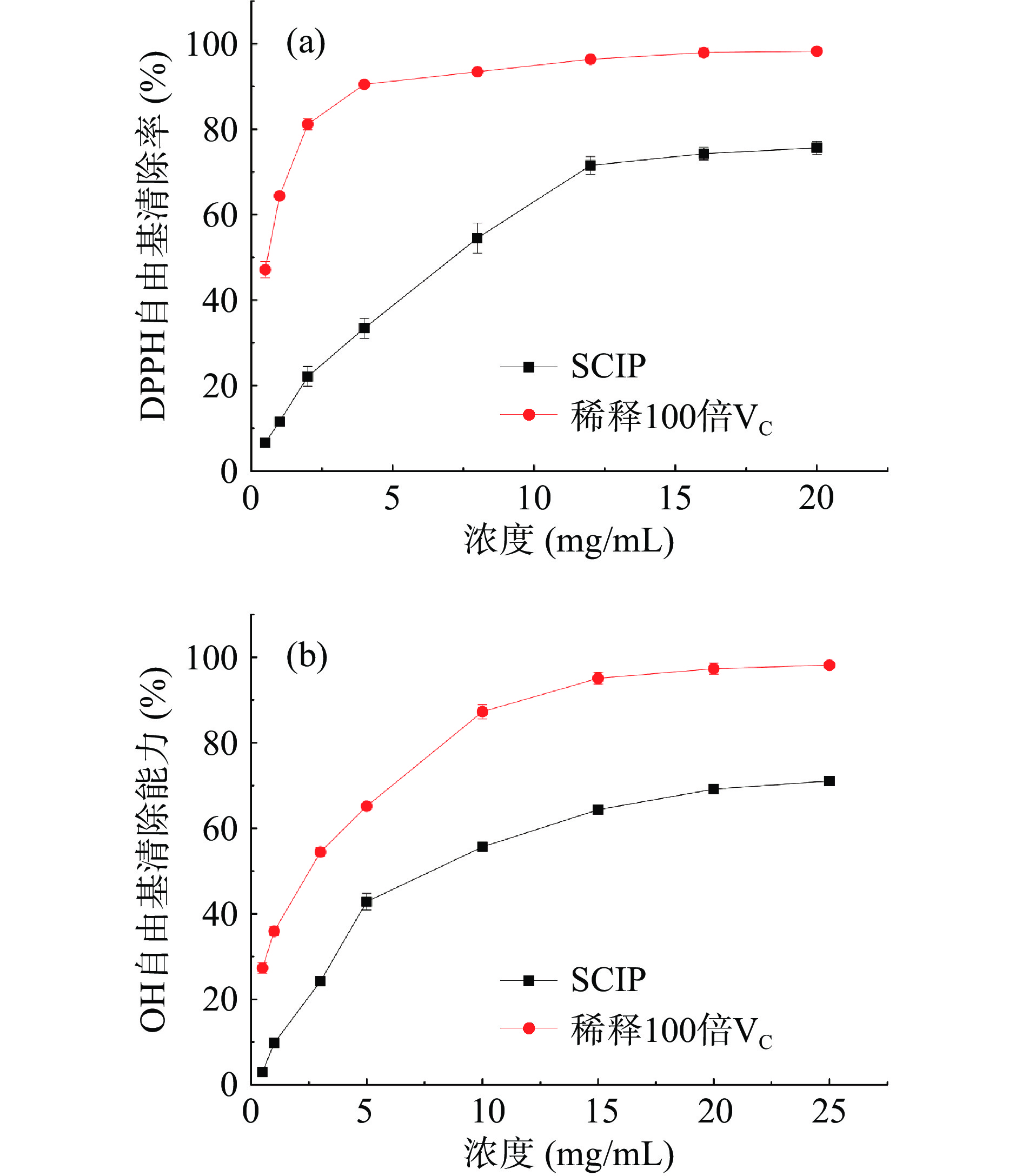
SCIP对DPPH自由基的清除率如图9(a)所示,当多糖浓度从0.5 mg/mL增加到12 mg/mL时,对DPPH自由基的清除率迅速上升,从12 mg/mL增加到20 mg/mL时,增长速度平缓。SCIP质量浓度在20 mg/mL时,对DPPH自由基的清除能力达到最大为75.64%±1.56%,IC50为6.42 mg/mL。
SCIP对OH自由基的清除率如图9(b)所示,当多糖浓度从0.5 mg/mL增加到5 mg/mL时,对OH的自由基清除率迅速上升,从10 mg/mL增加到25 mg/mL时,增长速度平缓。SCIP质量浓度在25 mg/mL时,对OH自由基的清除能力达到最大为71.08%±0.58%,IC50为8.59 mg/mL。孙建瑞等[48]研究表明C.vulgaris 224胞内多糖对DPPH自由基的清除率在60 mg/mL最高可达到61.62%,对羟基自由基的清除率在30 mg/mL时超过50%。本试验得到的小球藻胞内多糖纯化组分SCIP抗氧化活性相比而言有所提升。
3. 结论
本研究采用响应面法对小球藻粗多糖提取过程中的6个条件进行探索,最终确定粗多糖得率的最适值,即NaOH质量分数为2.0%,料液比为1:25(g/mL),超声功率为200 W,超声时间为20 min,提取温度为80 ℃,提取时间为1.5 h,在此条件下,小球藻胞内粗多糖的得率为18.086%±0.143%。
采用DEAE-52纤维素柱和葡聚糖凝胶柱Sephadex G-100对小球藻胞内粗多糖进行分离纯化得到均一组分SCIP。SCIP是一种含有糖醛酸的吡喃糖,分子量为9838 Da,主要由葡萄糖、鼠李糖及半乳糖成分组成。对SCIP进行抗氧化试验,对DPPH自由基的清除率在20 mg/mL达到最大为75.64%±1.56%,IC50为6.42 mg/mL,对OH自由基的清除率在25 mg/mL时最大为71.08%±0.58%,IC50为8.59 mg/mL,表明小球藻胞内多糖具有良好的抗氧化能力,有望应用到天然抗氧化剂开发等方面,同时在医药和功能食品中具有广阔的应用前景。
-
表 1 单因素设计因素及水平
Table 1 Factors and levels of univariate design
因素 参数设置 A NaOH质量分数(%) 1.0 1.5 2.0 2.5 3.0 3.5 B 料液比(g/mL) 1:15 1:20 1:25 1:30 1:35 1:40 C 超声功率(W) 0 100 200 300 400 500 D 超声时间(min) 10 15 20 25 30 35 E 提取温度(℃) 50 60 70 80 90 100 F 提取时间(h) 1 2 3 4 5 6 表 2 Plackett-Burman试验因素及水平
Table 2 Factors and levels of PB design experiment
水平 因素 A(%) B(g/mL) C(W) D(min) E(℃) F(h) −1 2.5 1:30 300 20 80 3 1 3.5 1:40 400 25 100 4 表 3 响应面试验因素及水平
Table 3 Factors and level of response surface experiment
水平 因素 NaOH质量分数X1(%) 料液比X2(g/mL) 超声功率X3(W) 提取时间X4(h) −1 1.5 1:20 150 1.5 0 2.0 1:25 200 2.0 1 2.5 1:30 250 2.5 表 4 Plackett-Burman试验设计及结果
Table 4 Design and results of PB experiment
试验号 A B C D E F 粗多糖得率(%) 1 −1 −1 −1 1 −1 1 16.094 2 −1 1 −1 1 1 −1 14.567 3 −1 1 1 −1 1 1 7.900 4 −1 −1 −1 −1 −1 −1 17.422 5 1 −1 1 1 −1 1 8.100 6 −1 −1 1 −1 1 1 12.190 7 1 1 −1 1 1 1 8.777 8 1 1 1 −1 −1 −1 9.460 9 −1 1 1 1 −1 −1 9.056 10 1 −1 1 1 1 −1 9.016 11 1 1 −1 −1 −1 1 9.215 12 1 −1 −1 −1 1 −1 15.058 表 5 Plackett-Burman试验方差分析
Table 5 Variance analysis of PB experiment
来源 平方和 自由度 均方 F值 P值 T值 显著性 模型 124.97 6 20.83 14.64 0.0049 ** A 25.82 1 25.82 18.15 0.0080 −1.47 ** B 29.78 1 29.78 20.94 0.0060 −1.58 ** C 53.81 1 53.81 37.83 0.0017 −2.12 ** D 2.75 1 2.65 1.86 0.2307 −0.47 E 0.28 1 0.28 0.20 0.6749 −0.15 F 12.62 1 12.62 8.87 0.0309 −1.03 * 残差 7.11 5 1.42 总和 132.08 11 注:*表示对结果影响显著(P<0.05);**表示对结果影响极显著(P<0.01)。 表 6 最陡爬坡试验设计及结果
Table 6 Design and results of the steepest ascent experiment
试验号 NaOH质量
分数X1(%)料液比X2
(g/mL)超声功率
X3(W)提取时间
X4(h)粗多糖
得率(%)1 0.5 1:10 50 0.5 12.860 2 1.0 1:15 100 1.0 14.879 3 1.5 1:20 150 1.5 16.964 4 2.0 1:25 200 2.0 17.893 5 2.5 1:30 250 2.5 16.107 6 3.0 1:35 300 3.0 14.288 表 7 Box-Behnken试验设计与结果
Table 7 Design and results of Box-Behnken experiment
试验号 X1 X2 X3 X4 粗多糖得率(%) 1 0 0 0 0 18.073 2 −1 −1 0 0 14.195 3 0 0 −1 1 12.296 4 0 −1 0 −1 15.443 5 0 1 1 0 7.010 6 0 1 0 −1 14.939 7 0 0 1 1 11.897 8 0 0 0 0 17.781 9 −1 0 −1 0 11.539 10 1 0 0 −1 15.908 11 0 0 0 0 17.887 12 0 0 −1 −1 12.455 13 0 0 0 0 18.099 14 −1 0 0 −1 16.399 15 0 −1 0 1 15.204 16 0 1 0 1 14.646 17 −1 0 1 0 10.795 18 −1 1 0 0 13.411 19 0 0 0 0 17.223 20 1 0 0 1 15.696 21 0 0 1 −1 12.057 22 1 0 −1 0 11.287 23 0 −1 −1 0 9.786 24 1 −1 0 0 13.929 25 1 1 0 0 13.146 26 0 −1 1 0 7.727 27 1 0 1 0 10.530 28 0 1 −1 0 8.484 29 −1 0 0 1 16.147 表 8 回归方程及方差分析
Table 8 Variance analysis of regression equation
方差来源 平方和 自由度 均方 F值 P值 显著性 模型 271.15 14 19.37 49.34 <0.0001 ** X1 0.33 1 0.33 0.84 0.3742 X2 1.80 1 1.80 4.59 0.0503 X3 2.83 1 2.83 7.22 0.0177 * X4 0.14 1 0.14 0.37 0.5543 X1X2 0.000 1 0.000 0.000 1.0000 X1X3 4.409×10−5 1 4.409×10−5 1.123×10−4 0.9917 X1X4 3.968×10−4 1 3.968×10−4 1.011×10−3 0.9751 X2X3 0.085 1 0.085 0.22 0.6481 X2X4 7.055×10−4 1 7.055×10−4 1.797×10−3 0.9668 X3X4 0.000 1 0.000 0.000 1.0000 X12 9.95 1 9.95 25.36 0.0002 ** X22 63.19 1 63.19 161.00 <0.0001 ** X32 224.16 1 224.16 571.09 <0.0001 ** X42 3.880×10−3 1 3.880×10−3 9.885×10−3 0.9222 残差 5.50 14 0.39 失拟项 4.99 10 0.50 3.96 0.0984 误差 0.50 4 0.13 总和 276.64 28 注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。 表 9 SCIP单糖组成
Table 9 Monosaccharide composition of SCIP
名称 出峰时间(min) 摩尔比 GalN 8.684 0.051 Rha 9.225 0.190 Ara 9.792 0.062 GlcN 10.809 0.096 Gal 12.259 0.163 Glc 13.875 0.300 Xyl 16.184 0.041 GalA 43.759 0.049 GlcA 46.584 0.047 -
[1] 李莎兰, 洪亮, 李诚博, 等. 绿藻水溶性多糖的研究概况和进展[J]. 海洋科学,2016,40(9):145−151. [LI S L, HONG L, LI C B, et al. The research progress of water-soluble polysaccharides from green alga[J]. Marine Sciences,2016,40(9):145−151. doi: 10.11759/hykx20151217002 LI S L, HONG L, LI C B, et al. The research progress of water-soluble polysaccharides from green alga[J]. Marine Sciences, 2016, 40(9): 145-151. doi: 10.11759/hykx20151217002
[2] CHEN Y X, LIUX Y, ZHENG X, et al. Antioxidant activities of polysaccharides obtained from Chlorella pyrenoidosa via different ethanol concentrations[J]. International Journal of Biological Macromolecules,2016,91:1−20. doi: 10.1016/j.ijbiomac.2016.05.093
[3] YU M G, CHEN M J, GUI J L, et al. Preparation of Chlorella vulgaris polysaccharides and their antioxidant activity in vitro and in vivo[J]. International Journal of Biological Macromolecules,2019,137:139−150. doi: 10.1016/j.ijbiomac.2019.06.222
[4] QI J, KIM S M. Characterization and immunomodulatory activities of polysaccharides extracted from green alga Chlorella ellipsoidea[J]. International Journal of Biological Macromolecules,2017,95:106−114. doi: 10.1016/j.ijbiomac.2016.11.039
[5] WU S W, LIU H Q, LI S Y, et al. Transcriptome analysis reveals possible immunomodulatory activity mechanism of Chlorella sp. exopolysaccharides on RAW264.7 macrophages[J]. Marine Drugs,2021,19(4):1−17.
[6] 李晓楠, 秦松, 葛保胜. 微藻及其活性物质在免疫调节和抗病毒方面的研究进展[J]. 生物学杂志,2021,38(2):13−17. [LI X N, QIN S, GE B S. Progress of study on immunological regulation and antiviral effects of microalgae and its bioactives[J]. Journal of Biology,2021,38(2):13−17. LI X N, QIN S, GE B S. Progress of study on immunological regulation and antiviral effects of microalgae and its bioactives[J]. Journal of Biology, 2021, 38(2): 13-17.
[7] SANTOYO S, PLAZA M, JAIME L, et al. Pressurized liquid extraction as an alternative process to obtain antiviral agents from the edible microalga Chlorella vulgaris[J]. Journal of Agricultural and Food Chemistry,2010,58(15):8522−8527. doi: 10.1021/jf100369h
[8] 陈晓清, 郑怡, 苏育才. 海水小球藻抗菌多糖的分离纯化[J]. 食品科技,2012,37(4):168−170. [CHEN X Q, ZHENG Y, SU Y C. Isolation and purication of antimicrobial polysaccharides from Chlorella pacifica[J]. Food Science and Technology,2012,37(4):168−170. CHEN X Q, ZHENG Y, SU Y C. Isolation and purication of antimicrobial polysaccharides from Chlorella pacifica[J]. Food Science and Technology, 2012, 37(4): 168-170.
[9] 谭成玉, 赵小霞, 孟繁桐, 等. 海洋小球藻多糖的制备及其体外抑制肿瘤血管生成活性的研究[J]. 中国海洋药物,2014,33(4):33−38. [TAN C Y, ZHAO X X, MENG F T, et al. The preparation and anti-angiogenic activity study of chlorella polysaccharides[J]. Chinese Journal of Marine Drugs,2014,33(4):33−38. TAN C Y, ZHAO X X, MENG F T, et al. The preparation and anti-angiogenic activity study of chlorella polysaccharides[J]. Chinese Journal of Marine Drugs, 2014, 33(4): 33-38.
[10] KANG S M, KIM K N, LEE S H, et al. Anti-inflammatory activity of polysaccharide purified from AMG-assistant extract of Ecklonia cava in LPS-stimulated RAW 264.7 macrophages[J]. Carbohydrate Polymers,2011,85(1):80−85. doi: 10.1016/j.carbpol.2011.01.052
[11] WAN X Z, LI T T, ZHONG R T, et al. Anti-diabetic activity of PUFAs-rich extracts of Chlorella pyrenoidosa and Spirulina platensis in rats[J]. Food and Chemical Toxicology,2019,128:1−23. doi: 10.1016/j.fct.2019.03.035
[12] SONG H, HE M L, GU C K. et al. Extraction optimization, purification, antioxidant activity, and preliminary structural characterization of crude polysaccharide from an arctic Chlorella sp[J]. Polymers,2018,10(3):1−18.
[13] 席波, 宋东辉, 孙晶, 等. 十种微藻粗多糖的抑菌作用及海水小球藻粗多糖的抗氧化活性[J]. 天津科技大学学报,2015,30(5):20−25. [XI B, SONG D H, SUN J, et al. Anti-microbial activities of crude polysaccharide extracts from ten species of microalgae and the antioxidant activities of crude polysaccharide extracts from marineChlorella vulgaris[J]. Journal of Tianjin University of Science and Technology,2015,30(5):20−25. XI B, SONG D H, SUN J, et al. Anti-microbial activities of crude polysaccharide extracts from ten species of microalgae and the antioxidant activities of crude polysaccharide extracts from Marine chlorella vulgaris[J]. Journal of Tianjin University of Science and Technology, 2015, 30(5): 20-25.
[14] 贾敬, 徐殿胜, 庄秀园, 等. 小球藻热水提取物功能成分的活性跟踪分离[J]. 生物工程学报,2017,33(5):743−756. [JIA J, XU D S, ZHUANG X Y, et al. Bioassay-guided isolation of functional components from hot water extract of Chlorella pyrenoidosa[J]. Chinese Journal of Biotechnology,2017,33(5):743−756. JIA J, XU D S, ZHUANG X Y, et al. Bioassay-guided isolation of functional components from hot water extract of Chlorella pyrenoidosa[J]. Chinese Journal of Biotechnology, 2017, 33(5): 743-756.
[15] 赵小霞. 小球藻多糖的制备及芦苇生物活性成分的研究[D]. 大连: 大连海洋大学, 2014. ZHAO X X. Preparation of polysaccharides from Chlorella vulgaris and studies on bioactive components from the Phragmites australis[D]. Dalian: Dalian Ocean University, 2015.
[16] 陈艺煊. 蛋白核小球藻多糖提取分离及抗衰老活性研究[D]. 福州: 福建农林大学, 2017. CHEN Y X. Studies on extraction process of polysaccharides from Chlorella pyrenoidosa and its anti-aging activity[D]. Fuzhou: Fujian Agriculture and Forestry University, 2017.
[17] ZENG W C, ZHANG Z, GAO H, et al. Characterization of antioxidant polysaccharides from Auricularia auricular using microwave-assisted extraction[J]. Carbohydrate Polymers,2012,89(2):694−700. doi: 10.1016/j.carbpol.2012.03.078
[18] 段旭, 冉军舰, 孙俊良, 等. 甘薯渣多糖的提取工艺优化、结构鉴定及其功能活性研究[J]. 食品工业科技, 2022,43(8):228-237 DU X, RAN J J, SUN J L, et al. Study on extraction process optimization, structure identification and functional activity of polysaccharide from sweet potato[J]. Science and Technology of Food Industry, 2022,43(8): 228-237.
[19] 魏文志, 付立霞, 陈国宏. 基于冻融辅助超声波法的小球藻多糖提取工艺优化[J]. 农业工程学报,2012,28(16):270−274. [WEI W Z, FU L X, CHEN G H. Process optimization of polysaccharides extraction from Chlorella pyrenoidosa based on ultrasound assisted by freezing and thawing[J]. Transactions of the Chinese Society of Agricultural Engineering,2012,28(16):270−274. doi: 10.3969/j.issn.1002-6819.2012.16.042 WEI W Z, FU L X, CHEN G H. Process optimization of polysaccharides extraction from Chlorella pyrenoidosa based on ultrasound assisted by freezing and thawing[J]. Transactions of the Chinese Society of Agricultural Engineering, 2012, 28(16): 270-274. doi: 10.3969/j.issn.1002-6819.2012.16.042
[20] ANDERSEN R A. Algal culturing techniques[M]. Oxford: Elsevier Academic Press, 2005: 429−538.
[21] 钟闰, 吴思伟, 何秀苗, 等. 杜氏盐藻胞外多糖抗肿瘤活性及其机制研究[J]. 食品工业科技,2020,41(22):126−133. [ZHONG R, WU S W, HE X M, et al. Antitumor activity and mechanism of exopolysaccharide from Dunaliella salina[J]. Science and Technology of Food Industry,2020,41(22):126−133. ZHONG R, WU S W, HE X M, et al. Antitumor activity and mechanism of exopolysaccharide from Dunaliella salina[J]. Science and Technology of Food Industry, 2020, 41(22): 126-133.
[22] 吴思伟, 李思雨, 孙寒, 等. 一株产胞外多糖微藻的分离鉴定及其多糖抗氧化活性的研究[J]. 食品与发酵工业,2021,47(24):193−200. [WU S W, LI S Y, SUN H, et al. Isolation and identification of an exopolysaccharide-producing microalgae strain and its antioxidant activity[J]. Food and Fermentation Industries,2021,47(24):193−200. doi: 10.13995/j.cnki.11-1802/ts.027350 WU S W, LI S Y, SUN H, et al. Isolation and identification of an exopolysaccharide-producing microalgae strain and its antioxidant activity[J]. Food and Fermentation Industries, 2021,47(24): 193-200. doi: 10.13995/j.cnki.11-1802/ts.027350
[23] 严尚隆, 潘创, 杨贤庆, 等. 长松藻多糖降解、结构表征及降血糖活性测定[J]. 食品与发酵工业,2021,47(18):119−126. [YAN S L, PAN C, YANG X Q, et al. Degradation, structural characterization and hypoglycemic activity of polysaccharides from Codium cylindricum[J]. Food and Fermentation Industry,2021,47(18):119−126. doi: 10.13995/j.cnki.11-1802/ts.027466 YAN S L, PAN C, YANG X Q, et al. Degradation, structural characterization and hypoglycemic activity of polysaccharides from Codium cylindricum[J]. Food and Fermentation Industry, 2021,47(18): 119-126. doi: 10.13995/j.cnki.11-1802/ts.027466
[24] 史瑞琴, 梁静静, 李大伟, 等. 小球藻多糖的分离纯化及理化性质[J]. 食品科学,2020,41(20):61−67. [SHI R Q, LIANG J J, LI D W, et al. Isolation, purification and physicochemical properties of polysaccharides from Chlorella[J]. Food Science,2020,41(20):61−67. doi: 10.7506/spkx1002-6630-20190515-173 SHI R Q, LIANG J J, LI D W, et al. Isolation, purification and physicochemical properties of polysaccharides from Chlorella[J]. Food Science, 2020, 41(20): 61-67. doi: 10.7506/spkx1002-6630-20190515-173
[25] 申希峰, 黄杰涛, 张莲姬, 等. 蒽酮-硫酸法测定榛花多糖含量条件的优化[J]. 食品研究与开发,2017,38(18):150−154. [SHEN X F, HUANG J T, ZHANG L J, et al. Determination of optimal conditions of polysaccharide content of Hazel's flower by anthrone sulfuric acid method[J]. Food Research and Development,2017,38(18):150−154. SHEN X F, HUANG J T, ZHANG L J, et al. Determination of optimal conditions of polysaccharide content of Hazel's flower by anthrone sulfuric acid method [J]. Food Research and Development, 2017, 38(18): 150-154.
[26] 胡月. 红花多糖的结构分析及其抗氧化活性研究 [D]. 石河子: 石河子大学, 2020. HU Y. Structural analysis and antioxidant activities of polysaccharide isolated from Carthamus tinctorius L.[D]. Shihezi: Shihezi University, 2020.
[27] THIRUCHELVI R, VENKATARAHAVAN R, SHARMILA D. Optimization of environmental parameters by Plackett-Burman design and response surface methodology for the adsorption of malachite green onto Gracilaria edulis[J]. Materials Today: Proceedings,2021,37(P2):1−6.
[28] 付婷婷, 马宁, 蒙健宗, 等. 基于响应面法优化一株海洋绿藻胞内多糖提取工艺[J]. 中国酿造,2015,34(9):115−120. [FU T T, MA N, MENG J Z, et al. Optimization of extraction technology of amarine algae intracellular polysaccharide based on response surface methodology[J]. China Brewing,2015,34(9):115−120. doi: 10.11882/j.issn.0254-5071.2015.09.027 FU T T, MA N, MENG J Z, et al. Optimization of extraction technology of amarine algae intracellular polysaccharide based on response surface methodology [J]. China Brewing, 2015, 34(9): 115-120. doi: 10.11882/j.issn.0254-5071.2015.09.027
[29] 吴金松, 耿广威, 陈晓培, 等. 信阳毛尖茶末多糖的分离纯化和体外抗氧化活性研究[J]. 食品工业科技,2020,41(13):181−186. [WU J S, GENG G W, CHEN X P, et al. Isolation, purification and in vitro antioxidant activity of tea dust polysaccharide from Xinyang Maojian[J]. Science and Technology of Food Industry,2020,41(13):181−186. WU J S, GENG G W, CHEN X P, et al. Isolation, purification and in vitro antioxidant activity of Tea Dust polysaccharide from Xinyang Maojian [J]. Science and Technology of Food Industry, 2020, 41(13): 181-186.
[30] SHANG X L, LIU C Y, DONG H Y, et al. Extraction, purification, structural characterization, and antioxidant activity of polysaccharides from wheat bran[J/OL]. Journal of Molecular Structure. 2021-02-15 [2022-2-17]. https://doi.org/10.1016/j.molstruc.2021.130096.
[31] LIU D, SUN Q, XU J, et al. Purification, characterization, and bioactivities of a polysaccharide from mycelial fermentation of Bjerkandera fumosa[J]. Carbohydrate Polymers,2017,167:115−122.
[32] AIPIRE A, YUAN P, AIMAIER A, et al. Preparation, characterization, and immuno-enhancing activity of polysaccharides from Glycyrrhiza uralensis[J]. Biomolecules,2020,10(1):159. doi: 10.3390/biom10010159
[33] 赵丹, 聂波, 宋昆, 等. 离子色谱法测定不同产地葛根多糖中的单糖组成[J]. 分析试验室,2017,36(7):745−749. [ZHAO D, NIE B, SONG K, et al. Determination of monosaccharide in radix puerariae polysaccharide by ion chromatography[J]. Chinese Journal of Analysis Laboratory,2017,36(7):745−749. ZHAO D, NIE B, SONG K, et al. Determination of monosaccharide in radix puerariae polysaccharide by ion chromatography[J]. Chinese Journal of Analysis Laboratory, 2017, 36(7): 745-749.
[34] 杨海燕, 李洁琼, 刘红全, 等. 小球藻EC04产胞内多糖条件优化及抗氧化活性研究[J]. 热带海洋学报,2019,38(6):98−104. [YANG H Y, LI J Q, LIU H Q, et al. Study on the optimum conditions for polysaccharide production of Chlorella EC04 and its antioxidant activity analysis[J]. Journal of Tropical Oceanography,2019,38(6):98−104. YANG H Y, LI J Q, LIU H Q, et al. Study on the optimum conditions for polysaccharide production of Chlorella EC04 and its antioxidant activity analysis[J]. Journal of Tropical Oceanography, 2019, 38(6): 98-104.
[35] 刘芬, 朱顺妮, 徐忠斌, 等. 超声辅助热水浸提小球藻多糖及抗氧化活性测定[J]. 中国酿造,2020,39(2):177−181. [LIU F, ZHU S N, XU Z B, et al. Extraction of polysaccharides from Chlorella sp. by ultrasound-assisted hot water extraction and determination of antioxidant activity[J]. China Brewing,2020,39(2):177−181. doi: 10.11882/j.issn.0254-5071.2020.02.033 LIU F, ZHU S N, XU Z B, et al. Extraction of polysaccharides from Chlorella sp. by ultrasound-assisted hot water extraction and determination of antioxidant activity[J]. China Brewing, 2020, 39(2): 177-181. doi: 10.11882/j.issn.0254-5071.2020.02.033
[36] 葛珍珍, 王杰, 周灿灿, 等. 响应面法优化小球藻培养基[J]. 食品工业科技,2012,33(16):195−198. [GE Z Z, WANG J, ZHOU C C, et al. Optimization of medium for Chlorella vulgaris by response surface analysis[J]. Science and Technology of Food Industry,2012,33(16):195−198. GE Z Z, WANG J, ZHOU C C, et al. Optimization of medium for Chlorella vulgaris by response surface analysis[J]. Science and Technology of Food Industry, 2012; 33(16): 195-198.
[37] 邹成梅, 王甜甜, 何思艳, 等. 响应面法优化茯苓多糖发酵培养基[J]. 中国酿造,2018,37(7):107−111. [ZOU C M, WANG T T, HE S Y, et al. Optimization of fermentation medium of polysaccharides from Poria cocosby response surface methodology[J]. China Brewing,2018,37(7):107−111. doi: 10.11882/j.issn.0254-5071.2018.07.022 ZOU C M, WANG T T, HE S Y, et al. Optimization of fermentation medium of polysaccharides from Poria cocosby response surface methodology[J]. China Brewing, 2018, 37(7): 107-111. doi: 10.11882/j.issn.0254-5071.2018.07.022
[38] VENKATARAGHAVAN R, THIRUCHELVI R, SHARMILA D. Statistical optimization of textile dye effluent adsorption by Gracilaria edulis using Plackett-Burman design and response surface methodology[J]. Heliyon,2020,6(10):1−15.
[39] RATANA C, NATTAYAPORE C, PANYA T, et al. Polysaccharide extraction from Spirulina sp. and its antioxidant capacity[J]. International Journal of Biological Macromolecules,2013,58:73−78. doi: 10.1016/j.ijbiomac.2013.03.046
[40] 孙建瑞, 符丹丹, 赵君峰, 等. 响应面法优化Chlamydomonas sp. 212产胞内多糖发酵工艺及其抑菌活性[J]. 食品科学,2017,38(18):1−7. [SUN J R, FU D D, ZHAO J F, et al. Optimization of fermentation process for the production of intracellular polysaccharide from Chlamydomonas sp. 212 and its antimicrobial activity[J]. Food Science,2017,38(18):1−7. doi: 10.7506/spkx1002-6630-201718001 SUN J R, FU D D, ZHAO J F, et al. Optimization of fermentation process for the production of intracellular polysaccharide from Chlamydomonas sp. 212 and its antimicrobial activity[J]. Food Science, 2017, 38(18): 1-7. doi: 10.7506/spkx1002-6630-201718001
[41] 何坤明, 王国锭, 白新鹏, 等. 山茱萸籽多糖分离纯化、结构表征及抗氧化活性[J]. 食品科学, 2021, 42(19): 81-88. HE K M, GUO G D, BAI X P, et al. Isolation, purification, structure characterization and antioxidant activity of cornus officinalis seeds polysaccharides [J]. Food Science, 2021, 42(19): 81-88.
[42] 贾红倩, 刘嵬, 颜军, 等. 杏鲍菇多糖的分离纯化、乙酰化修饰及其抗氧化活性[J]. 食品工业科技,2018,39(3):39−44. [JIA H Q, LIU W, YAN J, et al. Isolation and purification, acetylation modification and antioxidant activity of polysaccharides of Pleurotus eryngii Quel[J]. Science and Technology of Food Industry,2018,39(3):39−44. JIA H Q, LIU W, YAN J, et al. Isolation and purification, acetylation modification and antioxidant activity of polysaccharides of Pleurotus eryngii Quel[J]. Science and Technology of Food Industry, 2018, 39(3): 39-44.
[43] YANG B, LUO Y X, WU Q J, et al. Hovenia dulcis polysaccharides: Influence of multi-frequency ultrasonic extraction on structure, functional properties, and biological activities[J]. International Journal of Biological Macromolecules,2020,148:1010−1020. doi: 10.1016/j.ijbiomac.2020.01.006
[44] 李亚清, 杨海波, 刘艳, 等. 小球藻多糖的分离纯化和组成分析[J]. 大连水产学院学报,2006(3):294−296. [LI Y Q, YANG H B, LIU Y, et al. Separation purification and analysis of Chlorella polysaccharides from Chlorella sp[J]. Journal of Dalian Fisheries University,2006(3):294−296. LI Y Q, YANG H B, LIU Y, et al. Separation purification and analysis of Chlorella polysaccharides from Chlorella sp[J]. Journal of Dalian Fisheries University, 2006, (3): 294-296.
[45] 何钢, 刘嵬, 李会萍, 等. 银杏叶多糖分离纯化、结构鉴定及抗氧化活性研究[J]. 食品工业科技,2015,36(22):81−86. [HE G, LIU W, LI H P, et al. Isolation and purification, structure identification and antioxidant activity of polysaccharides of Ginkgo biloba leaf[J]. Science and Technology of Food Industry,2015,36(22):81−86. HE G, LIU W, LI H P, et al. Isolation and purification, structure identification and antioxidant activity of polysaccharides of Ginkgo biloba leaf[J]. Science and Technology of Food Industry, 2015, 36(22): 81-86.
[46] 刘艺珠, 刘佩冶, 赵玉梅, 等. 黄花菜多糖的表征与抗氧化活性分析[J]. 食品工业科技, 2022, 43(12): 54-61. LIU Y Z, LIU P Y, ZHAO Y M, et al. Characterization and antioxidant activity analysis of daylily polysaccharides[J]. Food Industry Science and Technology, 2022, 43(12): 54-61.
[47] XU R H, SHEN Q, DING X L, et al. Chemical characterization and antioxidant activity of an exopolysaccharide fraction isolated from Bifidobacterium animalis RH[J]. European Food Research & Technology,2011,232(2):231−240.
[48] 孙建瑞, 赵君峰, 符丹丹, 等. Chlorella vulgaris胞内多糖抗氧化活性及其与糖代谢相关酶的关系[J]. 应用与环境生物学报,2020,26(3):512−519. [SUN J R, ZHAO J F, FU D D, et al. Assessing the antioxidant activity of intracellular polysaccharide from Chlorella vulgaris and its relationship with glycometabolism-related enzymes[J]. Chin J Appl Environ Biol,2020,26(3):512−519. SUN J R, ZHAO J F, FU D D, et al. Assessing the antioxidant activity of intracellular polysaccharide from Chlorella vulgaris and its relationship with glycometabolism-related enzymes[J]. Chin J Appl Environ Biol, 2020, 26 (3): 512-519.





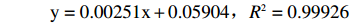
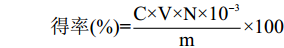
 下载:
下载:
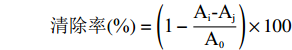
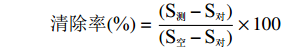

 下载:
下载:
