Ultrasonic Pre-treatment for the Preparation of ACE-inhibitory Peptides from the Tea Residue Protein through Enzymatic Hydrolysis and Its Stability
-
摘要: 血管紧张素转换酶(Angiotensin-I Converting Enzyme,ACE)在血压调节中扮演重要角色,抑制其活性有利于维持血压平衡。食源性ACE抑制肽具有安全、易吸收的特点,受到广泛关注。本研究旨在从茶渣蛋白中获得一种具有高ACE抑制活性的新肽。以ACE抑制率为指标,通过对三种超声方式的比较,确定最佳超声方式;以单因素实验为基础,进行响应面优化确定最佳超声波预处理参数;酶解液分离纯化运用超滤的方法,并对截留分子量小于3 kDa组分进行稳定性分析。结果表明,超声波预处理为最佳处理方式,得最优条件为超声功率300 W、超声温度45 ℃、超声时间25 min。在最佳超声波预处理条件下,ACE抑制率为64.8%,相比于未超声组54.1%提高了10.7%;当截留分子量小于3 kDa时,ACE抑制肽的抑制率为82.3%,相比于原始酶解液提高了17.5%。当温度30 ℃升温至90 ℃,ACE抑制肽的抑制率从82.3%降低至78.3%,减少了4.3%;酸碱度、盐溶液变化其对ACE抑制率表现稳定;模拟消化环境中8 h后,ACE抑制率从82.3%降为62.3%。Abstract: Angiotensin-converting enzyme (ACE) plays an important role in blood pressure regulation, and inhibition of its activity is beneficial to maintain blood pressure balance. Food-derived ACE inhibitory peptides have attracted wide attention due to their safety and easy absorption. This study aimed to obtain a new peptide of high ACE inhibitory activity from tea residue protein. With the ACE inhibitory rate of ACE inhibitory peptides as the index, ultrasonic pre-treatment of tea residue protein was the best method through comparison of three ultrasonic methods. Response surface optimization was used to determine the optimal ultrasonic pretreatment parameters based on the single-factor tests. The enzymatic solution was separated and purified by ultrafiltration, and the stability of components with molecular weight less than 3 kDa was analyzed. The results showed that the optimum ultrasonic pretreatment conditions were ultrasonic power 300 W, ultrasonic temperature 45 °C, ultrasonic time 25 min. Under the optimal conditions, the ACE inhibitory activity was 64.8%, which was 10.7% higher than 54.1% in the control group (without ultrasonic). When the molecular weight cut-off was less than 3 kDa, the inhibition rate of ACE inhibitory peptide was 82.3%, which was 17.5% higher than that of the original hydrolysate. When the temperature rose from 30 to 90 oC, the inhibition rate of ACE inhibitory peptide decreased from 82.3% to 78.3%. The peptide showed stable ACE inhibition rate in pH and salt solution. The inhibition rate of ACE inhibitory peptide decreased from 82.3% to 62.3% after 8 h in simulated digestion environment.
-
血管紧张素转化酶(ACE)是治疗心血管疾病的重要靶点,控制其活性有利于维持血压平衡[1]。心血管疾病是全球最常见的死亡原因之一,导致全球每年约1730万人死亡[2]。目前合成的血管紧张素转换酶抑制药物如卡托普利,作为降压药虽具有良好的降压效果,但同时伴随着过敏、心悸等的副作用。因此,人们将目光投向作用温和、安全、特异、持久的食源性ACE抑制肽[3]。
我国作为世界上生产及消费茶叶最多的国家之一,在茶叶加工过程中产生了大量茶渣。目前茶渣的再利用主要是制作生物吸附剂,制作有机无机复合肥以及动物饲料等[4-5],未能充分利用茶渣资源。茶渣营养成分丰富,其中茶渣蛋白占茶渣干21%~28%[6-7],氨基酸含量占干物质总量的1%~4%[7]。研究发现,茶蛋白在抗氧化、降血脂、抗肿瘤及预防辐射方面等具有积极的作用,对抗氧化功能研究比较充分,而降压功能却鲜有报道。
目前ACE抑制肽的制备方法主要有发酵法、微生物酶解法、基因重组法、化学合成法[8-9],可依据不同ACE抑制肽制备原料选择合适的制备方法,而植物蛋白大多采取酶解法制备ACE抑制肽。传统酶解法制备生物活性肽存在一些弊端,如酶解效率低、产物活性低以及酶解时间长等问题[10-11]。超声波是一种新型的清洁、绿色提取技术,产生的高剪切力和机械能会引起空化,空化气泡在材料表面的剧烈内爆可能引起微射流,导致表面剥落、侵蚀和颗粒破碎[12-13]。这些效应可能有助于增加底物的溶解度,使其更容易被酶利用,从而加快化学反应。Habinshuti等[14]研究发现,超声辅助碱性蛋白酶法可以提高甘薯蛋白酶解产物水解度和抗氧化活性。李莹等[15]采用超声波辅助菠萝蛋白酶水解泥鳅蛋白制备ACE抑制肽,结果显示超声波辅助有效提高了其ACE抑制率。
本研究旨在通过超声波预处理酶解法制备ACE抑制肽,利用响应面法优化工艺参数,并对制备的多肽进行分子量分布和稳定性分析,以期为茶渣高值化利用提供理论基础。
1. 材料与方法
1.1 材料与仪器
茶渣 馒头岭茶厂提供;茶渣蛋白 实验室自制[16],纯度为52.5%±0.03%;氢氧化钠、氯化钾、胰蛋白酶(10.17×104±5.30×103 U/g)、风味蛋白酶(9.59×103±0.23×102 U/g) 诺维信生物技术有限公司;复合蛋白酶(12.41×104±7.25×103 U/g)、碱性蛋白酶(6.53×104±1.46×103 U/g)、木瓜蛋白酶(2.28×104±0.65×103 U/g)、胃蛋白酶(1.2×103±0.55×102 U/g) 广州光华科技有限公司;正辛醇、异辛烷 天津市大茂化学试剂厂;血管紧张素转化酶(ACE) 美国Sigma公司,生化级。
PL203电子天平 梅特勒-托利多仪器有限公司;78-1磁力加热搅拌器 金坛市富华仪器有限公司;754紫外-可见光分光光度计 上海菁华科技仪器有限公司;TL-650CT多用途恒温超声波提取机 江苏天翎仪器有限公司;PHS-3C数显pH计 上海精科;DL-5高速离心机 上海安亭科学仪器厂;KDY-9810凯氏定氮仪 北京市通润源机电技术有限公司;OAPMP220超滤装置 美国PALL公司。
1.2 实验方法
1.2.1 ACE抑制肽的制备
茶渣蛋白ACE抑制肽的酶解工艺流程:茶渣蛋白→超声波预处理→酶解→灭酶活→超滤→离心取上清液。具体步骤:茶渣蛋白粉按比例(w/v)加蒸馏水溶解,调节pH,经超声波预处理后,加入蛋白酶,待酶解完成后沸水浴10 min灭酶活,冷却至室温,在4000 r/min离心10 min后调节上清液至中性,经1 μm滤膜除杂,收集滤液经10、5、3 kDa滤膜分离进行冷冻干燥,并测定ACE抑制活性。
1.2.2 蛋白酶的筛选
以茶渣蛋白为原料,选取胰蛋白酶、木瓜蛋白酶、风味蛋白酶、碱性蛋白酶和复合蛋白酶在最适条件下进行酶解,底物质量浓度为2.5%,加酶量6000 U/g,酶解时间3 h。酶解过程中每隔0.5 h取一次样,测定酶解产物ACE抑制率。
1.2.3 超声方式的确定
通过超声波预处理(超声处理茶渣蛋白后加酶)、不超声和超声前加酶(加酶处理茶渣蛋白后进行超声)三种处理方式对比,其反应条件一致,以确定超声方式。超声条件:功率300 W,温度50 ℃,时间20 min;酶解条件:底物浓度2%,pH8.5,温度60 ℃,加酶量8000 U/g。以ACE抑制率为指标,于酶解反应开始的第0、0.5、1、1.5、2、2.5、3 h时取样,测定其抑制率。
1.2.4 超声波预处理单因素实验
以ACE抑制率为指标,考察超声功率、超声时间、超声温度对ACE抑制活性的影响。固定考察因素:底物浓度2.5%,温度61 ℃,加酶量8310 U/g,pH8.5,超声功率300 W,超声时间20 min,超声温度50 ℃。每个参数变化如下:超声功率200、250、300、350、400 W;超声时间10、20、30、40、50、60 min;超声温度30、35、40、45、50、55、60 ℃。
1.2.5 超声波预处理工艺优化
根据单因素实验的结果,采用Box-Behnken设计确定超声波预处理酶解的最佳条件。以ACE抑制率为响应值,超声功率为因子A,超声时间为因子B,超声温度为因子C。试验因素与水平见表1。
表 1 响应面试验因素与水平Table 1. Variables and levels used for central composite design因素 编码水平 −1 0 1 A超声功率(W) 250 300 350 B超声温度(℃) 40 45 50 C超声时间(min) 20 30 40 1.2.6 ACE抑制活性的测定
采用紫外分光光度法,操作简单、反应快速[17]。简而言之,以血管紧张素转化酶为底物,蛋白质酶解物为阳性对照。由于试剂加入顺序的不同,实验分为空白组b、对照组c、测定组a。测定组:5.0 mmol/L的HHL溶液120 μL,10 μL 0.1×103 U/L ACE,在37 ℃水浴1 h,反应结束后迅速加入150 μL的1 mol/L HCl以终止反应;接着向样品中加入1 mL冰冻乙酸乙酯,旋涡混合后离心(4000 r/min, l5 min);吸取上层脂溶液750 μL,置于120 ℃烘箱烘干;待冷却后加入3 mL去离子水,旋涡半分钟,在228 nm波长处测定吸光度。空白组在加入盐酸后再加入抑制剂,对照组c最先添加ACE之后立刻加入HCl。
计算公式如下:
式中:Aa样品a的吸光值;Ab样品b的吸光值;Ac样品c的吸光值。
1.2.7 茶渣ACE抑制肽的分离
采用响应面法确定的最佳工艺条件,通过超声预处理制备茶渣蛋白酶解液。首先,将制备的酶解液通过1 μm滤膜过滤去除大分子物质和杂质。采用截留分子量分别为10、5和3 kDa的超滤膜进行超滤。超滤条件:滤液浓度5%,pH7.0,压力0.10 MPa,室温操作。按分子量分为4个部分:分子量>10 kDa(简称为Tpep-1)、5~10 kDa(Tpep-2)、3~5 kDa(Tpep-3)、<3 kDa(Tpep-4)。然后旋转蒸发浓缩,冻干,待测。
将所得样品溶于去离子水中,配制浓度为2 mg/L的肽浓缩液,按照本文1.2.6方法测定其ACE抑制率。
1.2.8 茶渣ACE抑制肽的活性研究
进一步对Tpep-4进行了表征,并对其稳定性进行了如下研究。
1.2.8.1 温度对ACE抑制肽活性的影响
将Tpep-4溶于100 mL去离子水中配制成1 mg/mL的多肽溶液,调节pH7.0,分别置于30、40、50、60、70、80、90 ℃中静置5 h,间隔1 h取样,测定ACE抑制率。
1.2.8.2 pH对ACE抑制肽活性的影响
将Tpep-4溶于100 mL去离子水中,配制成1 mg/mL的多肽溶液,用盐酸和氢氧化钠溶液调节多肽溶液的pH分别为2.0、4.0、6.0、8.0和10.0,37 ℃保持2.5 h,间隔0.5 h取样,测定ACE抑制率。
1.2.8.3 盐溶液对ACE抑制肽活性的影响
将Tpep-4溶于0.2、0.4、0.6、0.8、1.0、1.2 mol/L的NaCl溶液中,保证肽质量浓度为1 mg/mL。在室温下放置2 d测定ACE的抑制率。
1.2.8.4 体外消化实验对ACE抑制肽活性的影响
体外消化是根据文献[18]描述的方法进行的,并稍加修改。胃消化过程的体外实验:将Tpep-4配置成2 mg/mL的ACE抑制肽溶液,随后用盐酸将肽溶液的pH调至2.0,加入样品含量5%的胃蛋白酶,37 ℃水浴4 h,间隔1 h采样,水浴结束后100 ℃沸水浴使酶失活5 min,待冷却至室温,测定消化液的ACE抑制率。肠道消化过程的体外实验:取一定剂量的上述消化液,用氢氧化钠调节pH至8.0;按样品量加入5%的胰蛋白酶,在37 ℃水浴中继续消化4 h,同样间隔1 h取样,消化结束后将消化液在100 ℃下放置5 min使酶失活,待冷却至室温,测定消化液ACE抑制率。
1.3 数据处理
数据分析使用Origin 8.5、Design-Expert.8.0.6和SPSS 19.0等软件进行。获得的实验数据是三次平行测试的平均值。
2. 结果与分析
2.1 蛋白酶筛选结果
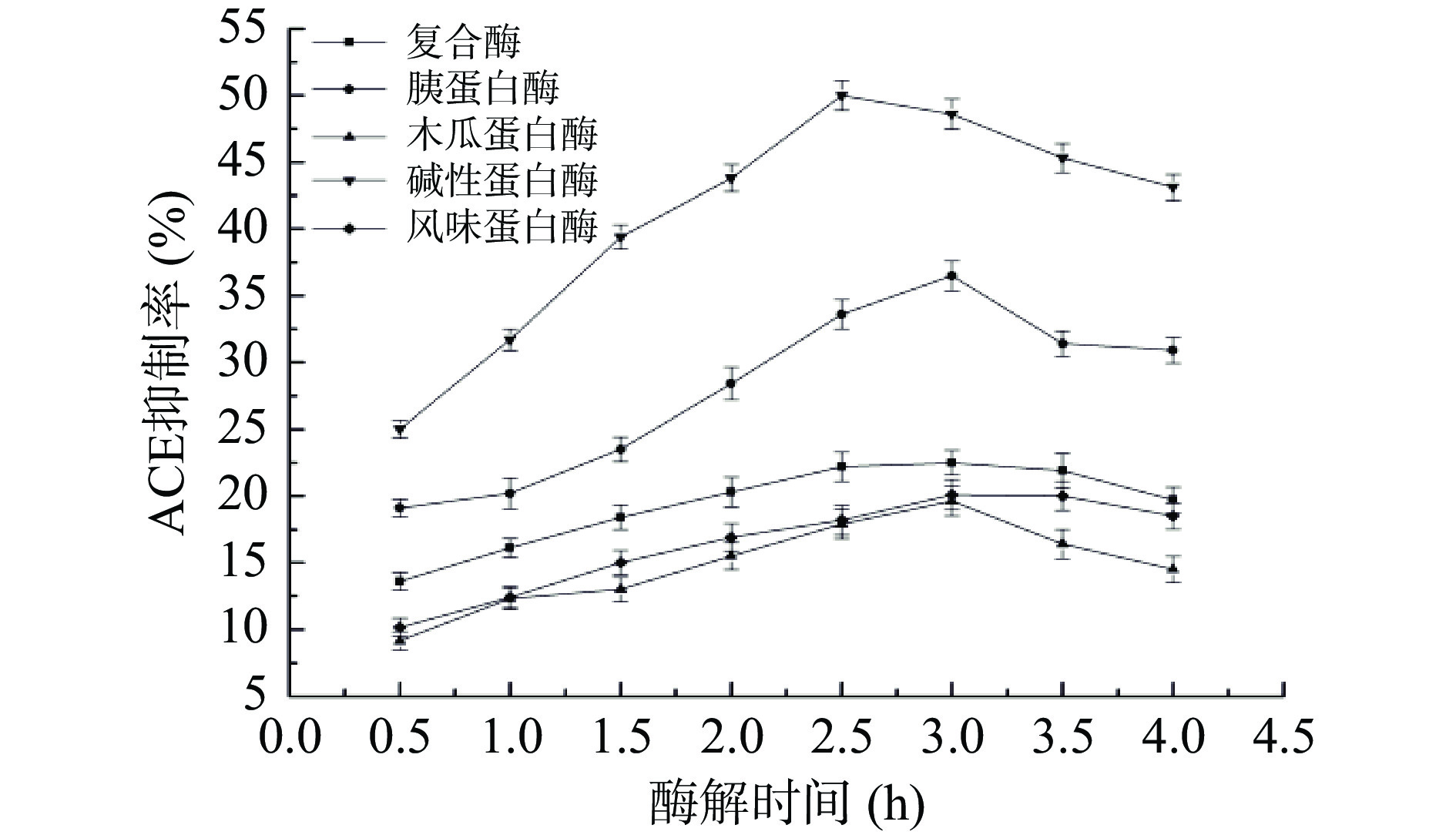
由于不同种类蛋白酶的作用位点不同,酶解获得的多肽片段也不相同,表现出的体外ACE抑制活性存在差异[19-20]。由图1可知,五种蛋白酶的ACE抑制率大小为碱性蛋白酶>胰蛋白酶>复合酶>风味蛋白酶>木瓜蛋白酶。其中,木瓜蛋白酶水解产物的ACE抑制率最低,水解2.5 h后仅为17.9%。碱性蛋白酶水解的产品对ACE的抑制率最高,水解2.5 h后ACE抑制率达到50.0%。因此,选择碱性蛋白酶解制备茶叶渣的ACE抑制性肽。杨晨等[21]等筛选出碱性蛋白酶作为酶解南瓜籽制备南瓜籽ACE抑制肽的最佳酶,所得的ACE抑制率和水解度均为最高。Bhaskar等[22]采用碱性蛋白酶酶解马豆粉,获得一个具有降低ACE活性的肽段序列:TVGMTAKF,并发现其C端含有Phe。研究发现,当ACE抑制肽C末端倒数3个氨基酸残基中含有Trp、Tyr、Phe和Pro时,ACE抑制率大大提高[23],这可能是碱性蛋白酶酶解茶渣蛋白的酶解产物活性较强的原因。
2.2 超声方式的确定
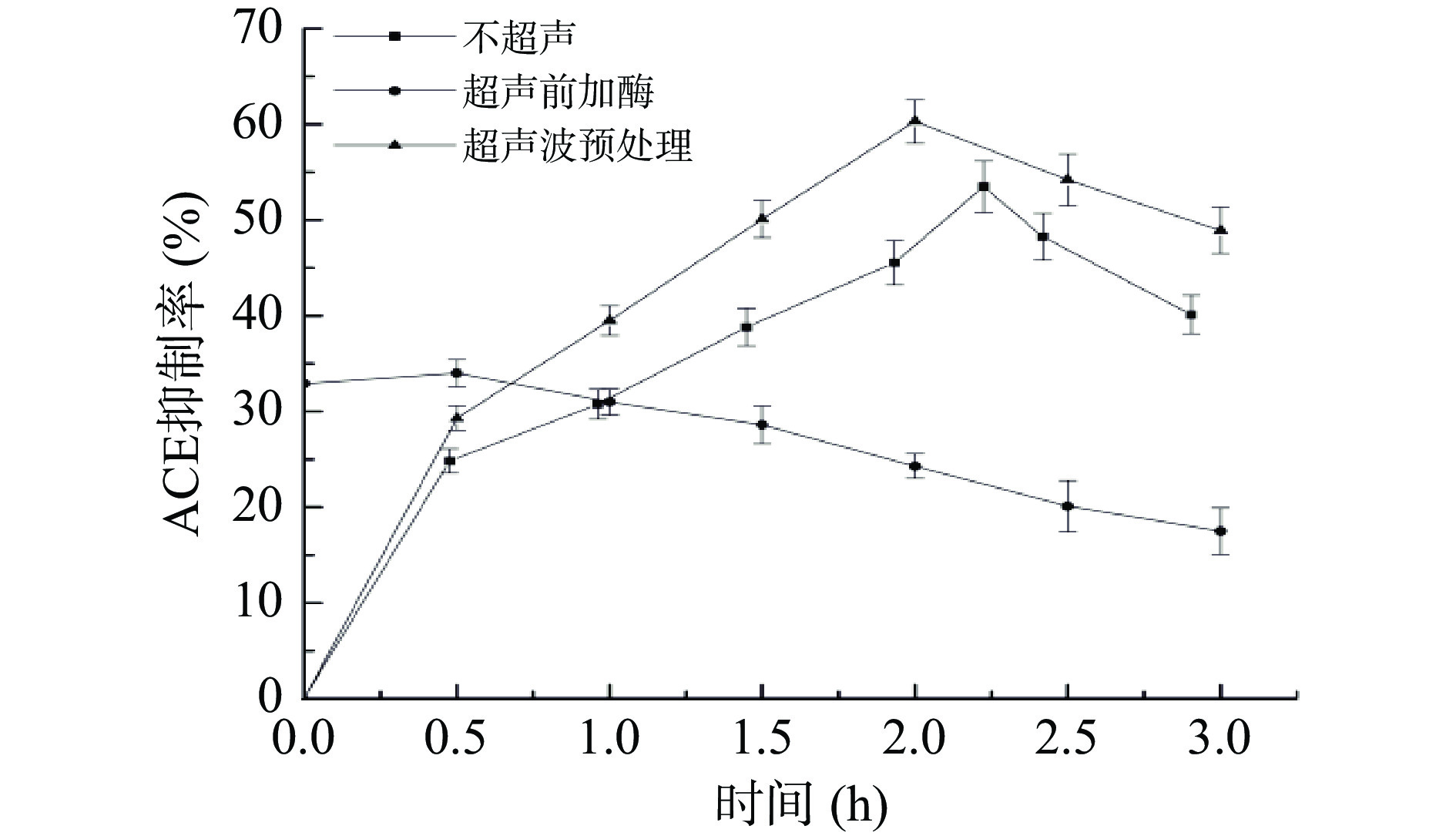
蛋白质分子、细胞壁和细胞内多糖之间的离子相互作用会影响蛋白质的提取[24]。因此,提取过程中细胞壁的破坏是提高蛋白质提取率的关键步骤[25]。图2显示了不同超声方法下ACE抑制肽抑制率随时间的变化,超声波预处理显著提高了茶渣中ACE抑制肽的抑制率,这可能是因为超声预处理破坏了植物细胞细胞壁,使碱性蛋白酶更好的与蛋白质发生作用。
2.3 单因素实验结果
2.3.1 超声功率对ACE抑制率的影响
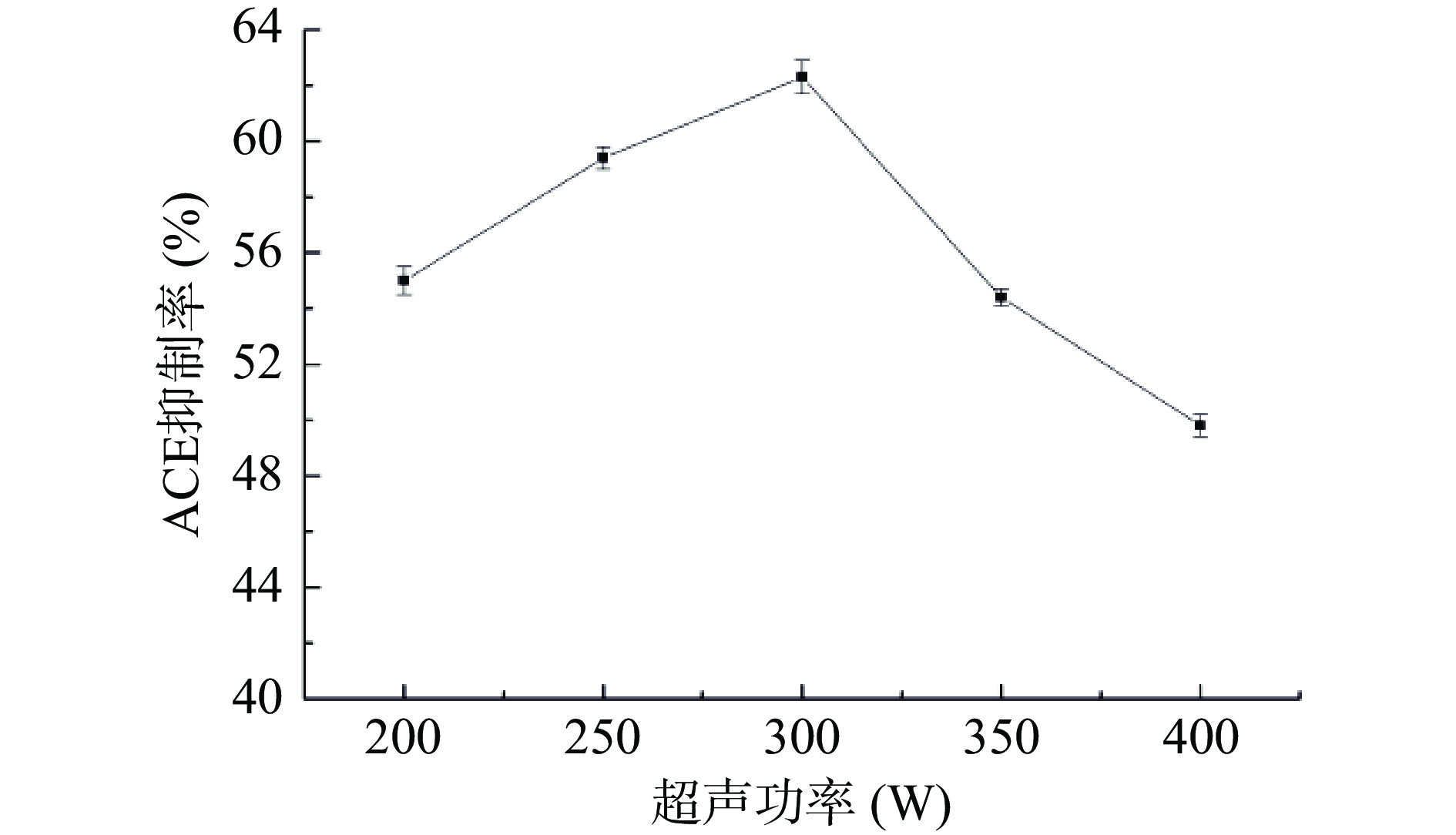
实际生产过程的成本和目标产物的传质效率与超声功率有着密切的联系,需选择合适超声功率进行提取。在茶渣蛋白酶解过程中测试了五种不同水平的超声功率,结果如图3所示。随着超声功率的增加,ACE抑制率呈现先增加后下降的趋势,最高达62.3%±0.6%。适当的超声功率能够破坏细胞壁,为蛋白酶提供更多结合位点增多,更易使茶渣蛋白酶解生成小分子肽段[26]。但超声功率增加到一定程度出现过饱和现象,形成音障,阻碍超声波传递,使ACE抑制率出现下降[27]。综合考虑,选择超声功率300 W为佳。
2.3.2 超声温度对ACE抑制率的影响
即使是同一个物种,不同温度会刺激不同蛋白质溶解。如图4所示,ACE抑制率随着温度的升高而增加,在45 ℃时达到最大值62.8%±0.3%。但当进一步升高时,ACE抑制率开始下降,空话作用逐渐明显,一方面,由于温度升高导致酶发生热变性导致酶活性降低;另一方面,高温、高压环境会导致自由基形成,自由基破坏酶分子构象,酶活性受到抑制[28]。因此,选择超声温度45 ℃为佳。
2.3.3 超声时间对ACE抑制率的影响
如图5所示,随着超声时间的延长,ACE抑制率先升高后降低,在30 min达到最大值62.7%±0.6%,超声带来的声波震动、空化效应和机械剪切作用,对茶渣蛋白提供更多酶切位点[29]。超声时间过长可能将蛋白质结构破坏,影响ACE抑制肽的提取,降低ACE抑制率。因此,选择超声时间30 min为佳。
2.4 响应面优化试验结果
根据单因素实验结果,以超声功率、超声温度、超声时间为响应值,采用Box-Behnken法进行酶解工艺优化。实验数据用软件Design-Expert 8.0.6进行设计,试验设计方案及结果见表2。
表 2 Box-Behnken试验设计及结果Table 2. Experimental design and results for Box-Behnken实验号 超声功率(W) 超声温度(℃) 超声时间(min) ACE抑制率(%) 1 350 40 30 49.7 2 300 45 30 65.5 3 250 45 40 55.3 4 350 45 40 53.5 5 350 50 30 52.3 6 250 45 20 58.7 7 300 45 30 64.9 8 300 50 20 56.3 9 300 40 20 56.3 10 250 50 30 56.3 11 350 45 20 49.8 12 300 45 30 66.1 13 300 45 30 64.7 14 300 40 40 53.9 15 300 50 40 54.9 16 300 45 30 64.5 17 250 40 30 54.3 利用Design-Expert.8.0.6对实验结果进行多元回归拟合,得到多元二次响应面回归模型方程为:
Y=0.38−6.500E−003A−3.625E−003B−1.375E−003C+3.250E−003AB−1.250E−003AC+2.500E−003BC−0.020A2−0.012B2−9.800E−003C2
模型P值极显著(P<0.0001),失拟项不显著(P=0.1379>0.05),表明模型稳定。表3中,该模型的决定系数R2为0.9880,这表明该模型与实际实验拟合效果理想。一次项(A)和二次项(A2、B2、C2)对响应值影响极其显著(P<0.01),说明超声功率、超声温度和超声时间对酶解效果的影响并非一元的简单线性关系。交互项AB对响应值影响极其显著(P<0.01),说明超声功率和超声温度之间的交互作用很好。通过F值比较得到了各因素对ACE抑制率的影响,依次为超声功率>超声温度>超声时间。综上所述,该模型拟合度较好,可以用超声波预处理茶渣蛋白酶解制备茶渣蛋白ACE抑制肽。
表 3 回归方程方差分析表Table 3. Analysis of variance of regression model变量来源 平方和 自由度 平均方差 F值 P值 显著性 模型 506.77 9 56.31 71.61 <0.0001 ** A 45.56 1 46.56 59.21 0.0001 ** B 3.92 1 3.92 4.99 0.0607 C 1.53 1 1.53 1.95 0.2056 * AB 0.09 1 0.09 0.11 0.7451 AC 12.60 1 12.60 16.03 0.0052 ** BC 0.25 1 0.25 0.32 0.5905 A2 183.83 1 183.83 233.77 < 0.0001 ** B2 131.22 1 131.22 166.87 <0.0001 ** C2 81.79 1 81.79 104.02 <0.0001 ** 残差 5.50 7 0.79 失拟项 4.27 3 1.42 4.62 0.0866 纯误差 1.23 4 0.31 总和 512.28 16 如图6A、图6C所示,响应面的斜率趋势平缓,说明超声功率和超声温度以及超声功率和超声时间的交互作用不显著,对应表3中AB的P值为0.7451>0.05,BC为0.5905>0.05。由图6B可知,响应面斜率趋势陡峭,等高线图呈椭圆形,表明超声温度和超声时间的交互作用极显著,与表3中AC(P=0.0052<0.01)的P值相对应。
通过分析和响应面模型预测得到超声预处理酶解制备ACE抑制肽的最佳条件为:底物浓度2%,加酶量8000 U/g,pH8.5,超声功率300 W,超声温度45.29 ℃,超声时间24.56 min(考虑到实际操作,将超声功率、超声温度和超声时间调整为300 W、45 ℃和25 min),此条件下的ACE抑制肽的抑制率为64.8%±0.2%,与预测结果65.61%接近,表明回归模型能够反映酶解制备ACE抑制肽的过程。
2.5 分子量对茶渣ACE抑制肽活性的影响
本实验分别采用截留分子量为10、5、3 kDa的超滤膜对茶渣ACE抑制肽进行分离,得到>10 kDa(TPep-1)、5~10 kDa(TPep-2)、3~5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,分别配制成2 mg/mL的ACE抑制肽溶液,其ACE抑制率如表4所示。结果表明随着分子量的减少其ACE抑制率明显升高,说明小分子量范围的茶渣ACE抑制肽具有更强的活性,这可能是由于高分子质量肽段结构复杂,具备抑制活性的氨基端没有暴露,无法起到降低ACE抑制率的作用[30]。章禹航等[31]在鲅鱼加工副产物制备ACE抑制肽研究时得出类似结论,分子量小于3 kDa的超滤组分具有最高的ACE抑制率。
表 4 不同分子量范围的茶渣ACE肽的抑制率Table 4. Comparison of ACE inhibitory peptides from tea residue with different molecular weight>10 kDa 5~10 kDa 3~5 kDa <3 kDa ACE抑制率(%) 48.6 54.9 74.5 82.3 2.6 茶渣ACE抑制肽的稳定性
肽类物质稳定性差、体内半衰期短、生物膜渗透性差,其稳定性差是肽类药物开发的主要问题[32-33]。
2.6.1 温度对茶渣ACE抑制肽活性的影响
经过不同温度条件处理后的ACE抑制肽的抑制活性结果如图7所示,温度从30 ℃上升到90 ℃,Tpep-4的ACE抑制率都略有下降。90 ℃时随着时间的推移,Tpep-4的ACE抑制率由78.3%降低至74.0%,减少了4.3%,这可能是高温使肽链被破坏从而抑制其活性。这说明,当温度保持在体温时,ACE抑制肽是稳定的,但多肽在加工过程中应控制好温度,避免长时间高温环境。
2.6.2 pH对茶渣ACE抑制肽活性的影响
由图8可知,茶渣ACE抑制肽的活性随着pH的升高有轻微下降,但总体波动范围不大。对比不同pH发现,当pH>8时,随着时间的推移ACE抑制能力的降低幅度有较小波动,但碱性坏境对其ACE抑制活性没有明显影响;而中性和酸性环境下,随着时间推移茶渣ACE抑制肽活性基本不发生变化,这与刺参ACE抑制肽的pH稳定性一致[34]。表明茶渣ACE抑制肽在酸性和碱性条件下仍具有较强抑制活性,其在人体内也能保持良好的活性。
2.6.3 盐溶液对茶渣ACE抑制肽活性的影响
如图9所示,氯化钠盐溶液的浓度从0.2 mol/L增长至0.6 mol/L,茶渣ACE抑制肽的ACE抑制率无显著变化(P>0.05);当盐溶液浓度继续增大至1.2 mol/L时,ACE抑制率出现明显下降趋势此时为69.3%,相比于刘鑫酮从皮氏蛾螺中所制备ACE抑制仍有较高抑制[35]。表明茶渣ACE抑制肽在不同浓度的盐溶液中均表现出良好的活性。
2.6.4 体外消化实验对茶渣ACE抑制肽活性的影响
由表5可知,茶渣ACE抑制肽在经胃消化酶、胰蛋白酶处理后,Tpep-4的ACE抑制率原先的82.3%降至65.2%,其中经过胃蛋白酶处理降低9.0%,胰蛋白酶处理降低8.1%,这可能是因为在消化酶作用下,Tpep-4进一步进行酶解,生成了ACE抑制较弱的片段,其结果相较于刘文颖等[36]研究乳清低聚肽对ACE抑制作用体外消化影响保持较高活性。这说明消化前后茶渣ACE抑制肽都具有较好抑制率,有望在体内能够表现出良好稳定性并发挥其功能。
表 5 茶渣ACE抑制肽体外模拟消化实验结果Table 5. Results of in vitro simulated digestion of tea residue ACE inhibitory peptides时间(h) Tpep-4 胃蛋白酶作用 胰蛋白酶作用 0 1 2 3 4 5 6 7 8 ACE抑制率(%) 82.3±0.20a 78.3±0.15b 76.4±0.25c 75.0±0.20d 73.3±0.25e 72.0±0.20f 70.2±0.47g 67.5±0.15h 65.2±0.20i 注:肩标字母不同表示差异显著(P<0.05)。 3. 结论
利用超声波预处理茶渣蛋白辅助碱性蛋白酶酶解制备ACE抑制肽。通过选择不同的超声方式辅助酶解制备茶渣ACE抑制肽,最终确定超声预处理茶蛋白为最适的超声方式;分析比较5种不同酶制备的茶渣蛋白ACE肽的抑制率,选取了碱性蛋白酶进行后续试验。筛选出超声波辅助制备茶渣蛋白ACE抑制肽的最佳提取工艺条件是超声功率300 W、超声温度45 ℃、超声时间25 min、底物浓度2%、酶添加量8000 U/g、酶解pH8.5、酶解时间2.5 h、酶解温度60 ℃,ACE抑制率为64.8%±0.2%。采用超滤法将酶解液分离成>10 kDa(TPep-1)、5-10 kDa(TPep-2)、3-5 kDa(TPep-3)、<3 kDa(TPep-4)的四种组分,当茶渣蛋白ACE抑制肽的分子量范围<3 kDa、时,ACE抑制率最高达到82.3%±0.6%。TPep-4组分茶渣ACE抑制肽不仅具有良好的热稳定性、pH稳定性和盐溶液稳定性,同时具有较强的抵抗胃蛋白酶和胰蛋白酶消化能力。本试验不仅确定超声波预处理技术可作为制备茶渣蛋白ACE抑制肽的有效方法,也为其进一步研究提供了基础。
-
表 1 响应面试验因素与水平
Table 1 Variables and levels used for central composite design
因素 编码水平 −1 0 1 A超声功率(W) 250 300 350 B超声温度(℃) 40 45 50 C超声时间(min) 20 30 40 表 2 Box-Behnken试验设计及结果
Table 2 Experimental design and results for Box-Behnken
实验号 超声功率(W) 超声温度(℃) 超声时间(min) ACE抑制率(%) 1 350 40 30 49.7 2 300 45 30 65.5 3 250 45 40 55.3 4 350 45 40 53.5 5 350 50 30 52.3 6 250 45 20 58.7 7 300 45 30 64.9 8 300 50 20 56.3 9 300 40 20 56.3 10 250 50 30 56.3 11 350 45 20 49.8 12 300 45 30 66.1 13 300 45 30 64.7 14 300 40 40 53.9 15 300 50 40 54.9 16 300 45 30 64.5 17 250 40 30 54.3 表 3 回归方程方差分析表
Table 3 Analysis of variance of regression model
变量来源 平方和 自由度 平均方差 F值 P值 显著性 模型 506.77 9 56.31 71.61 <0.0001 ** A 45.56 1 46.56 59.21 0.0001 ** B 3.92 1 3.92 4.99 0.0607 C 1.53 1 1.53 1.95 0.2056 * AB 0.09 1 0.09 0.11 0.7451 AC 12.60 1 12.60 16.03 0.0052 ** BC 0.25 1 0.25 0.32 0.5905 A2 183.83 1 183.83 233.77 < 0.0001 ** B2 131.22 1 131.22 166.87 <0.0001 ** C2 81.79 1 81.79 104.02 <0.0001 ** 残差 5.50 7 0.79 失拟项 4.27 3 1.42 4.62 0.0866 纯误差 1.23 4 0.31 总和 512.28 16 表 4 不同分子量范围的茶渣ACE肽的抑制率
Table 4 Comparison of ACE inhibitory peptides from tea residue with different molecular weight
>10 kDa 5~10 kDa 3~5 kDa <3 kDa ACE抑制率(%) 48.6 54.9 74.5 82.3 表 5 茶渣ACE抑制肽体外模拟消化实验结果
Table 5 Results of in vitro simulated digestion of tea residue ACE inhibitory peptides
时间(h) Tpep-4 胃蛋白酶作用 胰蛋白酶作用 0 1 2 3 4 5 6 7 8 ACE抑制率(%) 82.3±0.20a 78.3±0.15b 76.4±0.25c 75.0±0.20d 73.3±0.25e 72.0±0.20f 70.2±0.47g 67.5±0.15h 65.2±0.20i 注:肩标字母不同表示差异显著(P<0.05)。 -
[1] SHI L, MAO C, XU Z, et al. Angiotensin-converting enzymes and drug discovery in cardiovascular diseases[J]. Drug Discovery Today,2010,15(9-10):332−341. doi: 10.1016/j.drudis.2010.02.003
[2] TOWNSEND N, WILSON L, BHATNAGAR P, et al. Cardiovascular disease in Europe: Epidemiological update 2016[J]. European Heart Journal,2016,37(42):3232−3245. doi: 10.1093/eurheartj/ehw334
[3] XUE L, YIN R, HOWELL K, et al. Activity and bioavailability of food protein-derived angiotensin-I-converting enzyme-inhibitory peptides[J]. Comprehensive Reviews in Food Science and Food Safety,2021,20(2):1150−1187. doi: 10.1111/1541-4337.12711
[4] 李福荣, 赵爽, 张秋, 等. 食源性生物活性肽的功能及其在食品中的应用[J]. 食品研究与开发,2020,41(20):210−217. [LI F R, ZHAO S, ZHANG Q, et al. Functions of food derived bioactive peptides and their applications in food[J]. Food Research and Development,2020,41(20):210−217. doi: 10.12161/j.issn.1005-6521.2020.20.035 LI F R, ZHAO S, ZHANG Q, et al. Functions of food derived bioactive peptides and their applications in food[J]. Food Research and Development, 2020, 41(20): 210-217. doi: 10.12161/j.issn.1005-6521.2020.20.035
[5] GIAHI E, JAHADI M, KHOSRAVI-DARANI K. Enzyme-assisted extraction of glycyrrhizic acid from licorice roots using heat reflux and ultrasound methods[J]. Biocatalysis and Agricultural Biotechnology,2021,33:101953. doi: 10.1016/j.bcab.2021.101953
[6] DING X, LI H, WEN Z, et al. Effects of fermented tea residue on fattening performance, meat quality, digestive performance, serum antioxidant capacity, and intestinal morphology in fatteners[J]. Animals,2020,10(2):185. doi: 10.3390/ani10020185
[7] 余芳. 茶叶生物活性成分的功能与提取制备[J]. 江苏调味副食品,2010,27(2):42−45. [YU F. Function and extraction of bioactive components from tea[J]. Jiangsu Condiment and Subsidiary Food,2010,27(2):42−45. doi: 10.3969/j.issn.1006-8481.2010.02.013 YU F. Function and extraction of bioactive components from tea[J]. Jiangsu Condiment and Subsidiary Food, 2010, 27(2): 42-45. doi: 10.3969/j.issn.1006-8481.2010.02.013
[8] 谭力铭, 曹妍, 裴海生, 等. 酸枣仁ACE抑制肽酶解工艺优化[J]. 食品工业科技,2022,43(2):13. [TAN L M, CAO Y, PEI H S, et al. Optimization of enzymatic hydrolysis of ACE inhibitory peptide from Zizyphus jujuba seed[J]. Science and Technology of Food Industry,2022,43(2):13. TAN L M, CAO Y, PEI H S, et al. Optimization of enzymatic hydrolysis of ACE inhibitory peptide from Zizyphus jujuba seed[J]. Science and Technology of Food Industry, 2022, 43(2): 13.
[9] 周亚丽. 魔芋ACE抑制肽分离纯化及体外降血压活性研究[D]. 西安: 陕西科技大学, 2017. ZHOU Y L. Purification of ACE inhibitory peptide from konjac and its antihypertensive activity in vitro[D]. Xi'an: Shaanxi University of Science & Technology, 2017.
[10] 王珂, 马海乐, 李景, 等. 超声预处理辅助酶解玉米胚芽ACE抑制肽的研究[J]. 食品工业科技,2018,39(9):11−15. [WANG K, MA H L, LI J, et al. Study on effects of ultrasonic pretreatment on enzymolysis preparation of ACE-inhibitory peptides from corn germ protein[J]. Science and Technology of Food Industry,2018,39(9):11−15. WANG K, MA H L, LI J, et al. Study on effects of ultrasonic pretreatment on enzymolysis preparation of ACE-inhibitory peptides from corn germ protein[J]. Science and Technology of Food Industry, 2018, 39(9): 11-15.
[11] 杨雪, 李云亮, 王禹程, 等. 超声波预处理对大米蛋白酶解产物ACE抑制率的影响[J]. 中国食品学报,2018,18(12):150−156. [YANG X, LI Y L, WANG Y C, et al. Effects of ultrasound pretreatment on angiotensin-i-converting enzyme (ACE) inhibitory rate of hydrolysate from rice protein[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(12):150−156. YANG X, LI Y L, WANG Y C, et al. Effects of ultrasound pretreatment on angiotensin-i-converting enzyme (ACE) inhibitory rate of hydrolysate from rice protein[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(12): 150-156.
[12] WANG Q, WANG Y, HUANG M, et al. Ultrasound-assisted alkaline proteinase extraction enhances the yield of pecan protein and modifies its functional properties[J]. Ultrasonics Sonochemistry,2021,80:105789. doi: 10.1016/j.ultsonch.2021.105789
[13] TIWARI B K. Ultrasound: A clean, green extraction technology[J]. TrAC Trends in Analytical Chemistry,2015,71:100−109. doi: 10.1016/j.trac.2015.04.013
[14] HABINSHUTI I, MU T, ZHANG M. Ultrasound microwave-assisted enzymatic production and characterisation of antioxidant peptides from sweet potato protein[J]. Ultrasonics Sonochemistry,2020,69:105262. doi: 10.1016/j.ultsonch.2020.105262
[15] 李莹, 周剑忠, 夏秀东, 等. 超声波辅助酶解制备泥鳅蛋白源ACE抑制肽[J]. 中国食品学报,2018,18(9):182−187. [LI Y, ZHOU J Z, XIA X D, et al. Preparation of angiotensin-Ⅰ-converting enzyme inhibitory peptide from loach (Misgurnus anguillicaudatus) protein using ultrasonic assisted enzymatic hydrolysis[J]. Journal of Chinese Institute of Food Science and Technology,2018,18(9):182−187. LI Y, ZHOU J Z, XIA X D, et al. Preparation of angiotensin-Ⅰ-converting enzyme inhibitory peptide from loach (Misgurnus anguillicaudatus) protein using ultrasonic assisted enzymatic hydrolysis[J]. Journal of Chinese Institute of Food Science and Technology, 2018, 18(9): 182-187.
[16] 文静, 解新安, 李雁, 等. 微波辅助碱法提取茶渣蛋白工艺及抗氧化活性研究[J]. 粮食与油脂,2017,30(5):41−44. [WEN J, XIE X A, LI Y, et al. Technology and antioxidant activity of tea-residue protein using microwave-assisted alkaline extraction[J]. Cereals & Oils,2017,30(5):41−44. doi: 10.3969/j.issn.1008-9578.2017.05.012 WEN J, XIE X A, LI Y, et al. Technology and antioxidant activity of tea-residue protein using microwave-assisted alkaline extraction[J]. Cereals & Oils, 2017, 30(5): 41-44. doi: 10.3969/j.issn.1008-9578.2017.05.012
[17] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochem Pharmacol,1971,20(7):1637−1648. doi: 10.1016/0006-2952(71)90292-9
[18] ESCUDERO E, MORA L, TOLDRÁ F. Stability of ACE inhibitory ham peptides against heat treatment and in vitro digestion[J]. Food Chemistry,2014,161:305−311. doi: 10.1016/j.foodchem.2014.03.117
[19] 陈冰冰, 欧颖仪, 叶灏铎, 等. 富硒辣木叶蛋白ACE抑制肽的酶解工艺优化及活性研究[J]. 食品工业科技,2022,43(3):9. [CHEN B B, OU Y Y, YE H Z, et al. Optimization of enzymatic hydrolysis process and activity of ACE inhibitory peptides from selenium-rich Moringa oleifera leaves protein[J]. Science and Technology of Food Industry,2022,43(3):9. CHEN B B, OU Y Y, YE H Z, et al. Optimization of enzymatic hydrolysis process and activity of ACE inhibitory peptides from selenium-rich Moringa oleifera leaves protein[J]. Science and Technology of Food Industry, 2022, 43(3): 9.
[20] 祝素莹, 朱瑜, 张银志, 等. 复合蛋白酶水解核桃粕制备血管紧张素转化酶抑制肽工艺优化[J]. 食品研究与开发,2020,41(17):56−63. [ZHU S Y, ZHU Y, ZHANG Y Z, et al. Optimization of complex protease hydrolysis for preparation of angiotensin converting enzyme inhibitory peptides from walnut dregs[J]. Food Research and Development,2020,41(17):56−63. ZHU S Y, ZHU Y, ZHANG Y Z, et al. Optimization of complex protease hydrolysis for preparation of angiotensin converting enzyme inhibitory peptides from walnut dregs[J]. Food Research and Development, 2020, 41(17): 56-63.
[21] 杨晨, 孔凡, 雷芬芬, 等. 球磨辅助酶解制备南瓜籽ACE抑制肽[J]. 中国油脂,2021,46(9):22−27. [YANG C, KONG F, LEI F F, et al. Preparation of ACE inhibitory peptides from pumpkin seed using ball-milling assisted enzymolysis method[J]. China Oils and Fats,2021,46(9):22−27. YANG C, KONG F, LEI F F, et al. Preparation of ACE inhibitory peptides from pumpkin seed using ball-milling assisted enzymolysis method[J]. China Oils and Fats, 2021, 46(9): 22-27.
[22] BHASKAR B, ANANTHANARAYAN L, JAMDAR S. Purification, identification, and characterization of novel angiotensin I-converting enzyme (ACE) inhibitory peptides from alcalase digested horse gram flour[J]. LWT,2019,103:155−161. doi: 10.1016/j.lwt.2018.12.059
[23] 林凯, 韩雪, 张兰威, 等. ACE抑制肽构效关系及其酶法制备的研究进展[J]. 食品科学,2017,38(3):261−270. [LIN K, HAN X, ZHANG L W, et al. Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J]. Food Science,2017,38(3):261−270. LIN K, HAN X, ZHANG L W, et al. Progress in structure-activity relationship and enzymatic preparation of ACE inhibitory peptides[J]. Food Science, 2017, 38(3): 261-270.
[24] NASERI A, MARINHO G S, HOLDT S L, et al. Enzyme-assisted extraction and characterization of protein from red seaweed Palmaria palmata[J]. Algal Research,2020,47:101849. doi: 10.1016/j.algal.2020.101849
[25] GÖRGÜÇ A, BIRCAN C, YıLMAZ F M. Sesame bran as an unexploited by-product: Effect of enzyme and ultrasound-assisted extraction on the recovery of protein and antioxidant compounds[J]. Food Chemistry,2019,283:637−645. doi: 10.1016/j.foodchem.2019.01.077
[26] 唐金鑫, 由高飞, 李秋阳, 等. 超声波辅助酶解花生蛋白制备α-淀粉酶抑制肽工艺优化[J]. 食品工业科技,2022,43(4):161−168. [TANG J X, YOU G F, LI Q Y, et al. Ultrasonic-assisted ezymatic hydrolysis of peanut protein to prepare α-amylase inhibitory peptide[J]. Science and Technology of Food Industry,2022,43(4):161−168. TANG J X, YOU G F, LI Q Y, et al. Ultrasonic-assisted ezymatic hydrolysis of peanut protein to prepare alpha-amylase inhibitory peptide[J]. Science and Technology of Food Industry, 2022, 43(4): 161-168.
[27] 周婷, 卢方云, 黄瑾, 等. 响应面法优化超声辅助酶法制备无骨鸡爪胶原蛋白肽[J]. 食品工业科技,2021,42(19):182−189. [ZHOU T, LU F Y, HAUNG J, et al. Optimization of ultrasound-assisted enzymatic preparation of boneless chicken feet collagen peptide by response surface methodology[J]. Science and Technology of Food Industry,2021,42(19):182−189. ZHOU T, LU F Y, HAUNG J, et al. Optimization of ultrasound-assisted enzymatic preparation of boneless chicken feet collagen peptide by response surface methodology[J]. Science and Technology of Food Industry, 2021, 42(19): 182-189.
[28] 滕超, 查沛娜, 范园园, 等. 超声波在酶解制备技术中的应用进展[J]. 江苏农业科学,2014,42(6):13−16. [TENG C, CHA P N, FAN Y Y, et al. Application progress of ultrasound in enzymatic preparation technology[J]. Jiangsu Agricultural Sciences,2014,42(6):13−16. doi: 10.3969/j.issn.1002-1302.2014.06.005 TENG C, CHA P N, FAN Y Y, et al. Application progress of ultrasound in enzymatic preparation technology[J]. Jiangsu Agricultural Sciences, 2014, 42(6): 13-16. doi: 10.3969/j.issn.1002-1302.2014.06.005
[29] 柯巧媚, 曾威, 帅雨桐, 等. 酒糟纤维素超声波辅助酶解工艺研究[J]. 食品工业科技,2021:1−19. [KE Q M, ZENG W, SHUAI R T, et al. Study on ultrasonic-assisted enzymatic hydrolysis of distiller’s grains cellulose[J]. Science and Technology of Food Industry,2021:1−19. KE Q M, ZENG W, SHUAI R T, et al. Study on ultrasonic-assisted enzymatic hydrolysis of distiller’s grains cellulose[J]. Science and Technology of Food Industry, 2021: 1-19.
[30] 郝欣悦, 李晓东, 刘璐, 等. 瑞士乳杆菌对契达干酪成熟期间所产ACE抑制肽的影响及其消化稳定性[J]. 食品科学,2021,42(18):143−149. [HAO X Y, LI X D, LIU L, et al. Effect of Lactobacillus helveticus on production of ACE inhibitory peptides in cheddar cheese during ripening and its digestion stability[J]. Food Science,2021,42(18):143−149. doi: 10.7506/spkx1002-6630-20200914-172 HAO X Y, LI X D, LIU L, et al. Effect of Lactobacillus helveticus on production of ACE inhibitory peptides in cheddar cheese during ripening and its digestion stability[J]. Food Science, 2021, 42(18): 143-149. doi: 10.7506/spkx1002-6630-20200914-172
[31] 章禹航, 翟雨, 韩玥颖, 等. 鲅鱼加工副产物水解液中ACE抑制肽分离纯化研究[J]. 农产品加工,2021(13):6−8. [ZHANG Y H, QU Y, HAN Y Y, et al. Study on isolation and purification of ACE inhibitory peptides from spanish mackerel processing byproducts hydrolysate[J]. Agricultural Product Processing,2021(13):6−8. ZHANG Y H, QU Y, HAN Y Y, et al. Study on isolation and purification of ACE inhibitory peptides from spanish mackerel processing byproducts hydrolysate[J]. Agricultural Product Processing, 2021(13): 6-8.
[32] LI M, XIA S, ZHANG Y, et al. Optimization of ACE inhibitory peptides from black soybean by microwave-assisted enzymatic method and study on its stability[J]. LWT,2018,98:358−365. doi: 10.1016/j.lwt.2018.08.045
[33] ZHANG Y, HE P, ZHANG P, et al. Polypeptides-drug conjugates for anticancer therapy[J]. Advanced Healthcare Materials,2021,10(11):2001974. doi: 10.1002/adhm.202001974
[34] 华鑫, 孙乐常, 万楚君, 等. 刺参ACE抑制肽制备及降压功效分析[J]. 食品科学,2018,39(10):125−130. [HUA X, SUN L C, WAN C J, et al. Preparation and antihypertensive activity of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from sea cucumber (Stichopus japonicas)[J]. Food Science,2018,39(10):125−130. doi: 10.7506/spkx1002-6630-201810020 HUA X, SUN C L, WAN C J, et al. Preparation and antihypertensive activity of angiotensin I-converting enzyme (ACE) inhibitory peptides derived from sea cucumber (Stichopus japonicas)[J]. Food Science, 2018, 39(10): 125-130. doi: 10.7506/spkx1002-6630-201810020
[35] 刘鑫烔, 宋铖铖, 乔变文, 等. 两种皮氏蛾螺ACE抑制肽的稳定性和抑制活性[J]. 食品工业科技,2020,41(19):7−12. [LIU X J, SONG C C, QIAO B W, et al. Research on the stability and activity of two ACE inhibitorypeptides from Volutharpa ampullaceal perryi[J]. Science and Technology of Food Industry,2020,41(19):7−12. LIU X J, SONG C C, QIAO B W, et al. Research on the stability and activity of two ACE inhibitorypeptides from Volutharpa ampullaceal perryi[J]. Science and Technology of Food Industry, 2020, 41(19): 7-12.
[36] 刘文颖, 周明, 冯晓文, 等. 乳清低聚肽的血管紧张素转化酶抑制作用及其稳定性研究[J]. 食品与发酵工业,2020,46(16):24−29. [LIU W Y, ZHOU M, FENG X W, et al. Study on stability and ACE inhibitory activity of whey oligopeptides[J]. Food and Fermentation Industries,2020,46(16):24−29. LIU W Y, ZHOU M, FENG X W, et al. Study on stability and ACE inhibitory activity of whey oligopeptides[J]. Food and Fermentation Industries, 2020, 46(16): 24-29.





 下载:
下载:
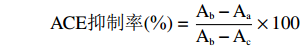






 下载:
下载:
