Study on the Stability of Antioxidant Peptides from Safflower Seeds with Different Molecular Weight
-
摘要: 目的:研究不同分子量红花籽蛋白抗氧化肽活性的稳定性。方法:以脱壳红花籽粕为实验材料,经复合酶酶解分离制备抗氧化肽,以1,1-二苯基-2-三硝基苯肼(1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基、超氧阴离子自由基(superoxide anion radical,O2−·)及羟自由基(hydroxyl free radicals,·OH)清除能力为指标,探讨温度、pH、食品原辅料、金属离子及模拟胃肠消化等环境因素对不同分子量红花籽抗氧化肽活性的影响。结果:红花籽蛋白酶解物<3 kDa(SSPH-Ⅰ)、3~5 kDa(SSPH-Ⅱ)较分离前活性显著增加(P<0.05),SSPH-Ⅲ(5~10 kDa)和SSPH-Ⅳ(>10 kDa)较分离前活性显著降低(P<0.05),选取活性显著增加组分研究发现SSPH-Ⅰ抗氧化活性更加稳定,能在60~121 ℃高温、pH6~8弱酸弱碱条件下保持活性,各自由基清除率维持率达到90%以上,10 g/100 mL NaCl和葡萄糖、0.2 g/100 mL柠檬酸对SSPH-Ⅰ抗氧化活性有增强协同作用,各自由基清除率维持率增加至105%左右,10 g/100 mL的蔗糖和0.2 g/100 mL的防腐剂对活性影响不大,添加Cu2+、Zn2+和K+金属离子对SSPH-Ⅰ抗氧化稳定性显著下降(P<0.05),其影响顺序为:Cu2+>Zn2+>K+>Mg2+>Ca2+,经模拟胃肠消化后活性较稳定,维持率为80%。结论:筛选得到<3 kDa红花籽蛋白抗氧化肽组分活性较高且稳定,为其工业化生产及应用提供理论依据。Abstract: Objective: The stability of antioxidant peptide activity of safflower seed protein with different molecular weight was studied. Methods: Using shelled safflower seed meal as experimental material, antioxidant peptides were prepared by compound enzymatic hydrolysis. The scavenging ability of 1-diphenyl-2-trinitrophenylhydrazine (DPPH) free radical, superoxide anion radical (O2−·) and hydroxyl radical (·OH) were used as indexes. The effects of environmental factors such as temperature, pH, food raw materials, metal ions and simulated gastrointestinal digestion on the activity of antioxidant peptides from safflower seeds with different molecular weight were studied. Results: The activities of the protease hydrolysates <3 kDa (SSPH-Ⅰ) and 3~5 kDa (SSPH-Ⅱ) of safflower seeds were significantly higher than those before separation (P<0.05), while the activities of SSPH-Ⅲ (5~10 kDa) and SSPH-Ⅳ (>10 kDa) were significantly lower than those before separation (P<0.05). It was found that the antioxidant activity of SSPH-Ⅰ was more stable and could maintain its activity under the condition of 60 to 121 ℃ and weak acid and weak base of pH 6~8, and the free radical scavenging rate maintenance rate was more than 90%. 10 g/100 mL NaCl, glucose and 0.2 g/100 mL citric acid enhanced the antioxidant activity of SSPH-Ⅰ. The free radical scavenging rate maintenance rate was to about 105%. Sucrose of 10 g/100 mL and preservatives of 0.2 g/100 mL had little effect on the antioxidant activity. The addition of Cu2+, Zn2+ and K+ metal ions significantly decreased the antioxidant stability of SSPH-I and the order of effect was as follows: Cu2+>Zn2+>K+>Mg2+>Ca2+, was stable after simulated gastrointestinal digestion, and the maintenance rate was 80% (P<0.05). Conclusion: The antioxidant peptides of <3 kDa safflower seed protein showed high activity and stability, which provided theoretical basis for its industrial production and application.
-
红花(Carthamus tinctorius L.)为菊科红花属,为新疆地区代表作物之一。红花籽为红花的种子,气香性温,功能与花相同,都具有防治心脑血管疾病、降低血压等药用价值,富含油脂、蛋白质、维生素与矿物质等营养成分[1-3]。红花籽油中亚油酸含量高达75%~85%,在低温或受热条件下油质稳定[4-5]。红花籽榨油后籽粕中富含蛋白质,同样具有很高的营养价值,其氨基酸种类齐全且比例适宜,疏水性及耐热性氨基酸含量高达40%,可作为补充氨基酸和制备生物活性肽的优质蛋白原料[6]。目前,食源性优质蛋白已成为研究热点,越来越多新型功能肽被开发利用,如沙棘籽蛋白、西瓜籽蛋白及菠萝蜜籽蛋白等[7-9]。与其他植物蛋白相比,红花籽蛋白不仅资源更加丰富,还具有一定的加工特性,乳化性及发泡性与大豆蛋白相似,但在酸性及中性环境中优于大豆蛋白[6,10]。在蛋白酶解多肽生物活性方面,红花籽蛋白经单酶水解后得到具有抗氧化活性的多肽,证实了其制备抗氧化肽的可行性[11]。
多肽作为蛋白质的降解衍生物,更容易被人体吸收利用,在较小浓度下具有较强的生物活性,其性质与蛋白质类似,容易受到环境因素影响,如在食品加工过程中(如高温)或机体胃肠消化阶段,多肽可能会因氧化、脱酰胺或环化等作用而发生降解,导致活性下降甚至消失,此外,常见的食品原辅料及金属离子也可能会与多肽发生作用影响活性。因此,研究红花籽抗氧化肽稳定发挥活性作用的环境条件可保证其在加工过程中的稳定性,为产品的开发及工业化应用提供参考[12]。目前,大部分对红花籽多肽的研究主要在制备工艺、分离纯化及功能构效等方面,对其生物活性的稳定性方面研究较少[13],近年来,已发现杏鲍菇多肽、菜籽肽在高温、强酸强碱环境下会失活[14-15],但关于红花籽抗氧化肽在加工、贮藏应用及胃肠消化等环境中活性稳定性研究尚浅,因此,有必要对红花籽抗氧化肽稳定性研究,保证多肽产品能稳定发挥抗氧化效果。
由于红花籽与籽粕蛋白氨基酸含量及成分等相差甚微[6],考虑红花籽的综合利用,减少营养物质浪费,本试验以脱壳红花籽粕为原料,提取蛋白质后通过复合酶解法制备红花籽抗氧化肽并超滤分离,研究不同分子量多肽在食品加工、贮藏过程及模拟胃肠消化等环境因素中抗氧化活性的稳定性,旨在筛选得到抗氧化活性及稳定性较高的多肽组分,得出抗氧化活性稳定的加工应用条件,为红花籽抗氧化肽的产品开发及产业化提供理论依据。
1. 材料与方法
1.1 材料与仪器
脱壳红花籽粕 新疆伊犁州察布查尔县雅其娜农业发展有限公司;碱性蛋白酶(75000 U/g)、中性蛋白酶(64000 U/g)、胰蛋白酶(25000 U/g)、胃蛋白酶(3000 U/g) 北京博奥拓达科技有限公司;DPPH、邻苯三酚、水杨酸 上海阿拉丁公司;NaCl、柠檬酸、蔗糖、葡萄糖、山梨酸钾、苯甲酸钠 国药集团化学试剂有限公司;其余试剂为国产分析纯。
1000A高速万能粉碎机 永康市太阳机电有限公司;PHJ-3F pH计 天津赛得利斯实验有限公司;JA1003电子天平 上海精科天平;581R高速冷冻离心机 德国Eppendorf公司;UV1901紫外可见分光光度计 杭州艾普仪器设备有限公司;DK-98-1电热恒温水浴锅 天津泰斯特;SCIENTZ-10ND冷冻干燥机 宁波新芝生物公司;ZJMP10-002超滤系统 美国Millipore公司。
1.2 实验方法
1.2.1 红花籽蛋白的提取
脱壳红花籽粕粉碎机粉碎过80目筛,1:5(W/V)正己烷脱脂,搅拌浸提6 h,反复三次,1:10(W/V)比例溶于去离子水,NaOH(1 mol/L)调pH至10,搅拌1 h,4000 r/min冷冻离心10 min,取残渣进行二次浸提,HCl(1 mol/L)调上清液pH至5.5,静置30 min,4000 r/min冷冻离心10 min,取沉淀,调pH至中性,−80 ℃冷冻干燥后−20 ℃封装储藏备用[10]。
1.2.2 红花籽蛋白复合酶水解
配制底物浓度为5%红花籽蛋白溶液,采用碱性蛋白酶与中性蛋白酶2:1复合酶解,酶解温度50 ℃,酶解2 h,酶添加量7000 U/g,酶解过程用NaOH维持pH为8不变。以反应过程中NaOH的消耗量计算水解度(DH),控制水解程度[16],反应完全后,100 ℃灭酶10 min,调溶液pH至中性,3500 r/min离心10 min,得到红花籽蛋白酶解液,测定抗氧化活性,上清液冷冻干燥备用[17]。
1.2.3 红花籽蛋白酶解产物超滤分离
将红花籽蛋白酶解产物复溶于去离子水中,调pH为7,0.45 μL微孔滤膜过滤,选择3、5、10 kDa超滤膜,调节超滤模板进口压力为0.2 Mpa,出口压力不高于0.03 Mpa,常温超滤,收集所得组分SSPH-Ⅰ(<3 kDa)、SSPH-Ⅱ(3~5 kDa)、SSPH-Ⅲ(5~10 kDa)和SSPH-Ⅳ(>10 kDa)多肽溶液,分别测定各组分体外抗氧化活性后冷冻干燥,−20 ℃保存备用。
1.2.4 红花籽蛋白多肽抗氧化稳定性研究
1.2.4.1 温度对红花籽不同分子量多肽抗氧化稳定性的影响
配制浓度为2 mg/mL不同分子量多肽液,分别在水浴条件60、70、80、90、100、121 ℃保温处理2 h,取样后冰水浴迅速冷却至室温进行测定,以各组室温条件抗氧化活性为处理前参照,计算清除能力维持率[14]。
1.2.4.2 pH对红花籽不同分子量多肽抗氧化稳定性的影响
将多肽样品分别溶于pH为3、4、5、6、7、8、9、10、11的Na2HPO4-柠檬酸缓冲液(0.1 mol/L)中,配成质量浓度为200 μg/mL溶液,用HCl和NaOH(1 mol/L)分别调节pH,在室温下静置2 h,以去离子水配制肽溶液为参照,计算清除能力维持率[14]。
1.2.4.3 食品原辅料对红花籽不同分子量多肽抗氧化稳定性影响
配制浓度为2 mg/mL不同分子量多肽液,分别添加NaCl、蔗糖、葡萄糖、柠檬酸、防腐剂山梨酸钾及苯甲酸钠。其中,NaCl、蔗糖和葡萄糖溶液的浓度为2、4、6、8、10 g/100 mL,柠檬酸和防腐剂的浓度为0.04、0.08、0.12、0.16、0.2 g/100 mL,添加蔗糖和葡萄糖组分在100 ℃下放置20 min,其他在室温下静置反应2 h,以未添加以上食品原辅料肽样品为参照,计算清除能力维持率[15,18]。
1.2.4.4 金属离子对红花籽不同分子量多肽抗氧化稳定性的影响
配制浓度为2 mg/mL不同分子量的多肽液,分别加入含有K+、Ca2+、Mg2+、Zn2+和Cu2+的金属盐,使溶液中的金属离子质量浓度为250 μg/mL,在室温下静置2 h,以未添加以上金属盐的肽样品为参照,计算清除能力维持率[15]。
1.2.4.5 体外模拟消化对红花籽蛋白及不同分子量多肽抗氧化稳定性的影响
制备模拟胃液及肠液后,分别取红花籽蛋白(SSP)及分离后的多肽2 mg/mL,调pH至2,控制温度37 ℃,加入5 mL人工胃液混匀,37 ℃水浴振荡2 h,100 ℃水浴加热10 min终止反应,冷却后5000 r/min离心15 min。胃模拟处理2 h后NaOH调pH为8,加入5 mL人工肠液,37 ℃水浴反应3 h,每1 h取样,沸水浴加热10 min终止反应,冷却后5000 r/min离心15 min,以红花籽蛋白为对照,分别计算胃消化、肠消化上清液自由基清除率[19]。
1.2.5 体外抗氧化活性和维持率的测定
1.2.5.1 体外抗氧化活性的测定
DPPH自由基清除率参考MULLA等[20]的方法并稍加改动,水杨酸法测定·OH清除率参考胡磊[21]的方法稍加改动,邻苯三酚法测定O2−·清除率参考LU等[22]的方法并稍加改动。
1.2.5.2 抗氧化活性维持率的测定
为了更直观表达红花籽多肽抗氧化稳定性,各组分别测定处理前、后的DPPH自由基、O2−·及·OH清除率,方法参考1.2.5.1,比值定义为能力维持率,各自由基清除率分别以处理前样品活性为参照,计算公式如下:
式中:A0、A1分别表示处理前、后多肽DPPH自由基清除率;A2、A3表示处理前、后多肽O2−·清除率;A4、A5表示处理前、后多肽·OH清除率。
1.3 数据处理
每组做三次平行试验,采用Excel对试验数据进行整理,SPSS 20.0软件对数据进行差异显著性分析,结果用“平均值±标准差”表示,使用Origin 8.5绘图。
2. 结果与分析
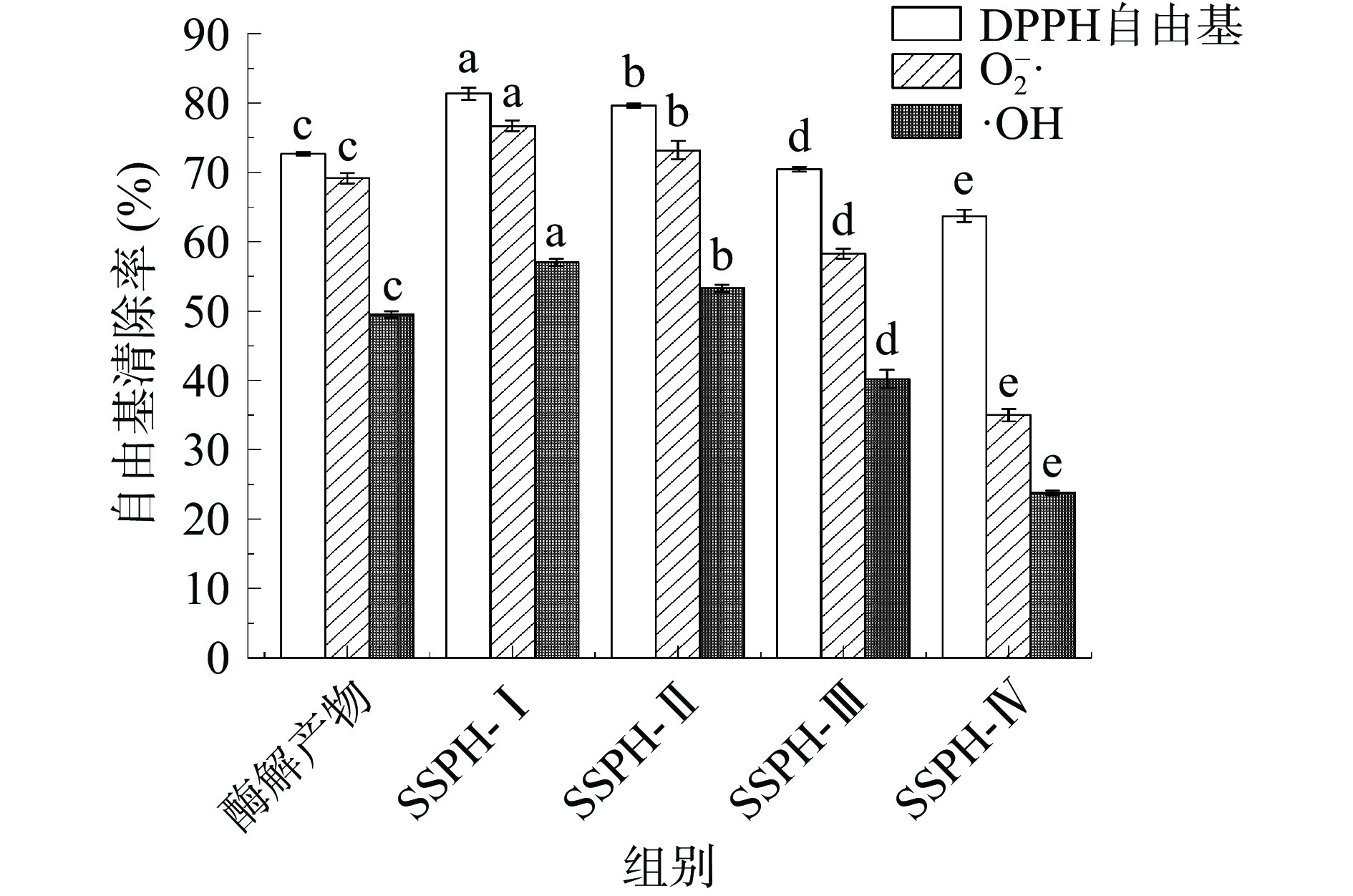
2.1 红花籽蛋白酶解产物及不同分子量多肽抗氧化活性测定
测定酶解产物及各超滤组分DPPH自由基、O2−·及·OH自由基清除率以评价不同组分的抗氧化活性。分离后的红花籽蛋白多肽SSPH-Ⅰ、SSPH-Ⅱ组抗氧化活性显著高于酶解产物(P<0.05),SSPH-Ⅲ、SSPH-Ⅳ组抗氧化活性对比分离前显著降低(P<0.05)(见图1),多肽的抗氧化活性与分子量大小、氨基酸组成种类及排列顺序有关[23],超滤分离后,分子量较小的红花籽多肽抗氧化活性显著高于酶解产物和分子量较大多肽( P<0.05),这可能是因为超滤分子量小的多肽具有较小的空间位阻,可以作为更好的电子供体,与自由基发生反应,将其转化为更稳定的最终产物,这与桃仁、玉米及紫苏籽等大部分植物蛋白肽研究结果相同,同样发现分子量较小的多肽自由基清除率较高[24-26]。因此,只对初步分离后SSPH-Ⅰ和SSPH-Ⅱ的抗氧化活性稳定性进行研究。
2.2 红花籽蛋白抗氧化肽活性稳定性研究
2.2.1 温度对红花籽不同分子量多肽抗氧化稳定性的影响
温度升高对SSPH-Ⅰ和SSPH-Ⅱ多肽组分DPPH自由基、O2−·及·OH清除率的影响并不明显(图2),SSPH-Ⅱ组O2−·和·OH清除能力维持率虽在100 ℃时出现波动,但121 ℃时各自由基清除能力维持率最低仍维持93%左右。SSPH-Ⅰ与SSPH-Ⅱ抗氧化活性对温度的敏感度都较低,这与玉米肽在高温环境下仍能保持抗氧化活性相似[25]。这可能是因为肽段的分子量较小,在不超过某个特定温度的条件下,肽的结构变性较少,也可能是因为,肽的结构较简单,没有受高温分解发生不可逆变性,且红花籽蛋白耐热性氨基酸含量高,红花籽多肽可能含有如Pro等能表现出抗热、抗盐的氨基酸基团[9,27]。因此,在热稳定性测定中,SSPH-Ⅰ与SSPH-Ⅱ的抗氧化活性受高温影响较小。
2.2.2 pH对红花籽不同分子量多肽抗氧化稳定性的影响
不同pH环境下,SSPH-Ⅰ、SSPH-Ⅱ各自由基清除能力维持率具有显著性差异(P<0.05),在强酸强碱环境下,两者DPPH自由基、O2−·及·OH清除能力维持率都显著降低(P<0.05),只维持在40%左右,而pH在6~8时,SSPH-Ⅰ及SSPH-Ⅱ的各自由基清除能力维持率最高达到98%左右(见图3)。这是因为在强酸强碱环境下,红花籽抗氧化肽SSPH-Ⅰ和SSPH-Ⅱ发生外消旋或脱酰胺反应,其含有的L-型氨基酸部分转化为D-型氨基酸,形成D-和L-型多肽混合物,引起了化合物极性、空间位置等结构性质的改变,当在强碱性条件下还可能会消耗红花籽多肽提供清除自由基效果的氢供体上的氢,影响多肽带电荷性质,导致活性下降[28],这与元宝枫籽抗氧化肽在过酸过碱环境中活性显著下降得到的结果一致[29],因此,弱酸弱碱环境对红花籽抗氧化肽活性影响较小。
2.2.3 食品原辅料对红花籽蛋白不同分子量多肽抗氧化稳定性的影响
2.2.3.1 NaCl对红花籽不同分子量多肽抗氧化稳定性的影响
添加不同浓度NaCl对红花籽抗氧化肽SSPH-Ⅰ和SSPH-Ⅱ两组分的DPPH自由基、O2−·及·OH的清除率维持率影响不明显(见图4),SSPH-Ⅰ与SSPH-Ⅱ的自由基清除能力维持率随着NaCl浓度的增加,呈现不断增加的趋势,当NaCl浓度为10 g/100 mL时,SSPH-Ⅰ各自由基清除能力维持率分别增加至108%、107%、105%;SSPH-Ⅱ各自由基清除能力维持率分别增加至105%、106%、104%左右,这可能是因为加入NaCl后,离子化的Na+和Cl−会打破肽的电荷平衡,使溶液体系中的离子强度发生变化,增强自由基清除能力,这与紫花芸豆和鱼胶原蛋白肽研究得到的结果相似[30-31]。由此可见,一定浓度的NaCl可以对多肽抗氧化活性产生增效协同作用。
2.2.3.2 蔗糖和葡萄糖对红花籽不同分子量多肽抗氧化稳定性的影响
添加蔗糖和葡萄糖对红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)活性的影响如图5所示,蔗糖含量在2~10 g/100 mL范围内时,SSPH-Ⅰ三种自由基清除能力维持率均保持在95%以上,SSPH-Ⅱ三种自由基清除能力维持率保持在93%以上,两种分子量多肽的抗氧化活性均未见明显变化。葡萄糖含量在2~10 g/100 mL范围时,SSPH-Ⅰ三种自由基清除能力维持率相比添加蔗糖明显上升,最高浓度下增加至106%,SSPH-Ⅱ的三种自由基清除能力维持率也有所上升,最高浓度下增加至104%(见图5)。葡萄糖对红花籽抗氧化肽活性的影响大于蔗糖,可能是因为100 ℃加热条件下,葡萄糖加入后发生美拉德反应,生成醛、酮等还原性物质在一定程度上提高了抗氧化能力,而蔗糖不属于还原糖,不与多肽发生反应,证实了高温下还原糖与多肽结合产生某些物质能增强抗氧化活性这一结论,且与芝麻多肽美拉德反应后抗氧化活性提高得到的结果相似[32]。因此,在试验浓度范围内,葡萄糖的添加能增强SSPH-Ⅰ和SSPH-Ⅱ的抗氧化活性,添加蔗糖对其活性影响不大。
2.2.3.3 柠檬酸对红花籽不同分子量多肽抗氧化稳定性的影响
在红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)中添加一定浓度的柠檬酸,能够提升SSPH-Ⅰ和SSPH-Ⅱ自由基清除能力。一定浓度范围内,柠檬酸的浓度越高,SSPH-Ⅰ的各自由基清除活性越高,当浓度为0.2 g/100 mL时,各自由基维持率提高了3%~5%(图6a),这可能是因为柠檬酸中的羧基或羟基可能会与肽链上的某些氨基酸残基结合成为供氢体,从而增加自由基清除率。柠檬酸浓度对SSPH-Ⅱ各自由基清除率影响较小,这可能是由于柠檬酸分子的羟基结构对抗氧化剂起到稳定的作用,故当浓度最大时,各维持率接近100%(图6b),与菜籽肽添加柠檬酸后活性稳定结果一致[15]。柠檬酸溶液虽然呈酸性,但试验中的浓度范围对于体系pH影响较小,可忽略不计。因此,柠檬酸有助于提升SSPH-Ⅰ自由基清除能力,对SSPH-Ⅱ活性无明显影响。
2.2.3.4 防腐剂对红花籽不同分子量多肽抗氧化稳定性的影响
防腐剂是食品加工过程中常用的食品添加剂。两种常见防腐剂山梨酸钾和苯甲酸钠添加后对SSPH-Ⅰ与SSPH-Ⅱ的活性稳定性影响较小(见图7)。添加一定浓度山梨酸钾后,如图7a、b所示,SSPH-Ⅰ活性维持率出现先下降后趋于稳定的趋势,SSPH-Ⅱ活性维持率呈缓慢下降趋势;添加一定苯甲酸钠后(图7c、d),SSPH-Ⅰ和SSPH-Ⅱ活性维持率都呈现下降趋势,在两种防腐剂添加浓度达到最大时,SSPH-Ⅰ各自由基维持率最低达到85%以上,SSPH-Ⅱ各自由基维持率最低在83%以上。因此,在规定使用浓度范围内,两者不会对SSPH-Ⅰ和SSPH-Ⅱ自由基清除能力造成严重干扰,红花籽抗氧化肽依然能保持较好的抗氧化功效,这与小米醇溶蛋白肽防腐剂对其稳定性影响的研究结果相似[33]。
2.2.4 金属离子对红花籽不同分子量多肽抗氧化稳定性的影响
食品在加工、储藏和运输中不可避免地要接触各种金属容器,不同金属离子对红花籽抗氧化肽(SSPH-Ⅰ和SSPH-Ⅱ)活性影响差异显著(P<0.05),添加金属离子后SSPH-Ⅰ与SSPH-Ⅱ自由基清除能力维持率显著下降(P<0.05),不同金属离子对SSPH-Ⅰ影响排序为Cu2+>Zn2+>K+>Mg2+>Ca2+,添加Cu2+后,各活性维持率仅在55%、54%、55%左右。金属离子对SSPH-Ⅱ影响排序为Zn2+>Cu2+>K+>Mg2+>Ca2+,添加Zn2+后,各活性维持率仅在52%、53%、52%左右(见表1)。这可能是因为其破坏了多肽之间的特殊化学力作用,导致溶解度降低、疏水基团外露等性质改变[34]。因此,在加工应用过程中应避免与Cu2+、Zn2+等金属离子接触,保持抗氧化活性稳定。
表 1 不同金属离子对红花籽不同分子量多肽活性稳定性影响Table 1. Effects of different metal ions on the activity and stability of polypeptides with different molecular weights in safflower seed金属离子 DPPH自由基清除能力维持率(%) O2−·清除能力维持率(%) ·OH清除能力维持率(%) SSPH-Ⅰ SSPH-Ⅱ SSPH-Ⅰ SSPH-Ⅱ SSPH-Ⅰ SSPH-Ⅱ Ca2+ 90.02±0.61a 90.69±0.07a 89.53±1.12a 89.27±0.94a 89.43±0.42a 88.70±1.26a Mg2+ 87.56±0.22b 85.14±0.59b 86.72±0.56b 86.67±0.45b 87.44±0.38b 88.44±0.25a K+ 78.52±0.30c 76.39±0.96c 77.67±0.53c 76.05±0.72c 77.46±0.38c 70.02±0.52b Zn2+ 70.54±0.13d 52.35±1.24e 69.96±0.79d 53.50±0.95e 70.47±0.21d 52.17±1.04d Cu2+ 55.73±0.76e 68.54±1.05d 54.81±0.51e 68.44±1.23d 55.12±1.86e 57.81±0.55c 注:同列不同字母表示存在显著性差异(P<0.05)。 2.2.5 体外模拟胃肠消化对红花籽蛋白及不同分子量多肽抗氧化活性影响
红花籽蛋白及不同分子量多肽经体外模拟胃肠消化后三种自由基清除率差异较大(图8)。总体来看,消化各个阶段的SSP抗氧化活性显著低于酶解分离后的多肽(P<0.05),且胃消化对自由基清除活性影响显著小于肠消化(P<0.05);SSPH-Ⅰ在胃消化2 h前、后各自由基清除能力无显著差异(P>0.05);肠消化3 h后各自由清除能力显著下降(P<0.05),但维持率仍在80%以上。SSPH-Ⅱ在胃消化后各自由基清除率对比消化前显著下降,肠消化后下降更为显著(P<0.05),三种自由基维持率最高仅为77%,这与菠萝蜜籽抗氧化肽胃肠消化得到的结果相似,在胃肠消化一段时间后活性下降[9]。这可能是因为SSPH-Ⅰ分子量较小,结构简单,酶解位点酶切完全,在消化过程中结构没有被破坏,活性较稳定,对胃肠消化酶具有一定耐受度;而SSPH-Ⅱ抗氧化活性显著下降,是由于SSPH-Ⅱ肽链长度与结构较为复杂,更多的疏水基团被酶解反应破坏,氨基酸排列顺序及结构发生改变,抗氧化活性降低,也可能是因为其在模拟肠道消化过程中对环境变化较敏感,结构发生变化,导致抗氧化活性降低[9,35-36]。综合来看,SSPH-Ⅰ(<3 kDa)对体模拟胃肠消化有更强的耐受性。
3. 结论
本试验研究了加工、贮藏及模拟胃肠消化等环境因素对不同分子量红花籽抗氧化肽稳定性的影响。红花籽蛋白复合酶水解后对酶解产物超滤分离,分离后SSPH-Ⅰ与SSPH-Ⅱ抗氧化活性显著上升(P<0.05),以DPPH自由基、O2−·及·OH清除能力维持率为指标,考察不同分子量抗氧化肽活性稳定性,筛选得到了抗氧化稳定性高的多肽组分(<3 kDa),在高温、弱酸弱碱环境下能保持抗氧化活性稳定,添加一定浓度NaCl、柠檬酸和葡萄糖对SSPH-Ⅰ抗氧化活性具有增效协同作用,蔗糖、防腐剂对其抗氧化活性影响不明显,常见金属离子对红花籽抗氧化肽的稳定性影响不一,在应用过程中避免与Cu2+、Zn2+等金属离子接触,经模拟胃肠消化,SSPH-Ⅰ在模拟胃消化时活性较稳定,在模拟肠消化时活性下降显著(P<0.05),但维持率仍在80%以上。本文初步得到<3 kDa分子量红花籽抗氧化肽活性较强且在常见加工过程及模拟胃肠消化环境影响下活性较稳定,后续可对其进一步纯化,研究体内活性发挥效果,为新型抗氧化肽功能性产品的开发与工业化应用提供理论依据,促进红花产业的经济与发展。
-
表 1 不同金属离子对红花籽不同分子量多肽活性稳定性影响
Table 1 Effects of different metal ions on the activity and stability of polypeptides with different molecular weights in safflower seed
金属离子 DPPH自由基清除能力维持率(%) O2−·清除能力维持率(%) ·OH清除能力维持率(%) SSPH-Ⅰ SSPH-Ⅱ SSPH-Ⅰ SSPH-Ⅱ SSPH-Ⅰ SSPH-Ⅱ Ca2+ 90.02±0.61a 90.69±0.07a 89.53±1.12a 89.27±0.94a 89.43±0.42a 88.70±1.26a Mg2+ 87.56±0.22b 85.14±0.59b 86.72±0.56b 86.67±0.45b 87.44±0.38b 88.44±0.25a K+ 78.52±0.30c 76.39±0.96c 77.67±0.53c 76.05±0.72c 77.46±0.38c 70.02±0.52b Zn2+ 70.54±0.13d 52.35±1.24e 69.96±0.79d 53.50±0.95e 70.47±0.21d 52.17±1.04d Cu2+ 55.73±0.76e 68.54±1.05d 54.81±0.51e 68.44±1.23d 55.12±1.86e 57.81±0.55c 注:同列不同字母表示存在显著性差异(P<0.05)。 -
[1] NIMROUZI M, RUYVARAN M, ZAMANI A, et al. Oil and extract of safflower seed improve fructose induced metabolic syndrome through modulating the homeostasis of trace elements, TNF-α and fatty acids metabolism[J]. Journal of Ethnopharmacology,2020,254:112721. doi: 10.1016/j.jep.2020.112721
[2] ZEMOUR K, LABDELLI A, ADDA A, et al. Phenol content and antioxidant and antiaging activity of safflower seed oil (Carthamus tinctorius L.)[J]. Cosmetics,2019,6(3):55. doi: 10.3390/cosmetics6030055
[3] 袁琴琴, 刘文营. 红花生物活性成分及功能特性研究进展[J]. 食品工业科技,2020,41(3):332−338, 344. [YUAN Qinqin, LIU Wenying. Advances in bioactive components and functional properties of safflower[J]. Science and Technology of Food Industry,2020,41(3):332−338, 344. YUAN Qinqin, LIU Wenying. Advances in bioactive components and functional properties of safflower[J]. Science and Technology of Food Industry, 2020, 41(3): 332-338, 344.
[4] 梁慧珍, 许兰杰, 余永亮, 等. 红花籽油中脂肪酸组成评价与分析[J]. 食品科学,2021,42(6):244−249. [LIANG Huizhen, XU Lanjie, YU Yongliang, et al. Evaluation and analysis of fatty acid composition in safflower seed oil[J]. Food Science,2021,42(6):244−249. LIANG Huizhen, XU Lanjie, YU Yongliang, et al. Evaluation and analysis of fatty acid composition in safflower seed oil[J]. Food Science, 201, 42(6): 244-249.
[5] CHAKRADHARI S, PERKONS I, MIŠINA I, et al. Profiling of the bioactive components of safflower seeds and seed oil: Cultivated (Carthamus tinctorius L.) vs. Wild (Carthamus oxyacantha M.)[J]. European Food Research and Technology,2020,246(3):1−11.
[6] 李保山. 红花籽粕蛋白的分离提取及其功能特性的研究[D]. 石河子 石河子大学, 2014. LI Baoshan. Study on the isolation and extraction of safflower seed meal protein and its functional properties[D]. Shihezi: Shihezi University, 2014.
[7] XIANG H, WATERHOUSE D S, LIU P, et al. Pancreatic lipase-inhibiting protein hydrolysate and peptides from seabuckthorn seed meal: Preparation optimization and inhibitory mechanism[J]. LWT,2020,134:109870. doi: 10.1016/j.lwt.2020.109870
[8] WEN C T, ZHANG J X, Z H H, et al. Study on the structure-activity relationship of watermelon seed antioxidant peptides by using molecular simulations[J]. Food Chemistry,2021,364:130432. doi: 10.1016/j.foodchem.2021.130432
[9] THAI C T, XIAO J B, SHARMILA M D, et al. Identification of antioxidant peptides derived from tropical jackfruit seed and investigation of the stability profiles[J]. Food Chemistry,2021,340:127876. doi: 10.1016/j.foodchem.2020.127876
[10] 吕凯波, 吕述权, 朱家乐. 不同提取方式对红花籽粕蛋白提取率及其功能特性的影响[J]. 食品科技,2020,45(7):249−254. [LYU Kaibo, LYU Shuquan, ZHU Jiale. Effects of different extraction methods on protein extraction rate and functional properties of safflower seed meal[J]. Food Science and Technology,2020,45(7):249−254. LV Kaibo, LV Shuquan, ZHU Jiale. Effects of different extraction methods on protein extraction rate and functional properties of safflower seed meal[J]. Food Science and Technology, 2020, 45(7): 249-254.
[11] 孙立. 红花籽粕抗氧化肽的制备及抗氧化活性研究[D]. 石河子: 石河子大学, 2014. SUN Li. Preparation and antioxidant activity of antioxidant peptide from Carthamus tinctorius seed meal[D]. Shihezi: Shihezi University, 2014.
[12] HOU Y, WU Z, DAI Z, et al. Protein hydrolysates in animal nutrition: Industrial production, bioactive peptides, and functional significance[J]. Journal of Animal Science and Biotechnology,2017,8(1):24. doi: 10.1186/s40104-017-0153-9
[13] MARCO C, DAVID A, MARB C. The challenge of peptide proteolytic stability studies: Scarce data, difficult readability, and the need for harmonization[J]. Angewandte Chemie International Edition,2020,60(4):1686−1688.
[14] 裴云成, 朱丹, 崔采莲, 等. 杏鲍菇柄抗氧化肽的制备及其稳定性初步分析[J]. 食品工业科技,2020,41(4):146−152, 160. [PEI Yuncheng, ZHU Dan, CUI Cailian, et al. Preparation and stability analysis of antioxidant peptides in Pleurotus eryngii stalks[J]. Science and Technology of Food Industry,2020,41(4):146−152, 160. PEI Yuncheng, ZHU Dan, CUI Cailian, et al. Preparation and stability analysis of antioxidant peptides in Pleurella eryngei stalks[J]. Science and Technology of Food Industry, 2020, 41(4): 146-152, 160.
[15] 姚轶俊, 张晶, 鞠兴荣, 等. 菜籽抗氧化肽WDHHAPQLR的环境稳定性研究[J]. 中国粮油学报,2019,34(8):54−60. [YAO Yijun, ZHANG Jing, JU Xingrong, et al. Study on environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J]. Chinese Journal of Cereals and Oils,2019,34(8):54−60. doi: 10.3969/j.issn.1003-0174.2019.08.010 YAO Yijun, ZHANG Jing, JU Xingrong, et al. Study on environmental stability of rapeseed antioxidant peptide WDHHAPQLR[J]. Chinese Journal of Cereals and Oils, 2019, 34(8): 54-60. doi: 10.3969/j.issn.1003-0174.2019.08.010
[16] 杨文博, 张英华. 蛋白质水解度的测定方法研究[J]. 中国调味品,2014,39(3):88−90. [YANG Wenbo, ZHANG Yinghua. Study on the method for determining the degree of hydrolysis of protein[J]. Chinese Condiment,2014,39(3):88−90. doi: 10.3969/j.issn.1000-9973.2014.03.022 YANG Wenbo, ZHANG Yinghua. Study on the method for determining the degree of hydrolysis of protein[J]. Chinese Condiment, 2014, 39(3): 88-90. doi: 10.3969/j.issn.1000-9973.2014.03.022
[17] 朱秀清, 李美莹, 孙冰玉, 等. 复合酶分步水解法制备汉麻多肽及其抗氧化特性研究[J]. 食品工业科技,2021,42(2):161−169. [ZHU Xiuqing, LI Meiying, SUN Bingyu, et al. Preparation of hemp polypeptide by step-by-step hydrolysis of compound enzyme and its antioxidant properties[J]. Science and Technology of Food Industry,2021,42(2):161−169. ZHU Xiuqing, LI Meiying, SUN Bingyu, et al. Preparation of hemp polypeptide by step-by-step hydrolysis of compound enzyme and its antioxidant properties[J]. Science and Technology of Food Industry, 2021 42(2): 161-169.
[18] 胡小军, 江敏, 王标诗, 等. 鱿鱼蛋白抗氧化肽的稳定性及抗疲劳和抗癌活性[J]. 食品工业科技,2017,38(16):60−64. [HU Xiaojun, JIANG Min, WANG Biaoshi, et al. Stability, anti-fatigue and anticancer activity of antioxidant peptides from squid protein[J]. Food Industry Science and Technology,2017,38(16):60−64. HU Xiaojun, JIANG Min, WANG Biaoshi, et al. Stability, anti-fatigue and anticancer activity of antioxidant peptides from squid protein[J]. Food Industry Science and Technology, 2017, 38(16): 60-64.
[19] LI H, GAO X C, ZHOU T Y, et al. Angiotensin I converting enzyme (ACE) inhibitory and antioxidant activity of umami peptides after in vitro gastrointestinal digestion[J]. Journal of Agricultural and Food Chemistry,2020,68(31):8232−8241. doi: 10.1021/acs.jafc.0c02797
[20] MULLA M, AHMED J. Modulating functional and antioxidant properties of proteins from defatted garden cress (Lepidium sativum) seed meal by alcalase hydrolysis[J]. Journal of Food Measurement and Characterization,2019,13(4):3257−3266. doi: 10.1007/s11694-019-00248-8
[21] 胡磊. 紫苏籽抗氧化肽的分离纯化及结构功能研究[D]. 福州: 福州大学, 2017. HU Lei. Isolation, purification and structure and function study of antioxidant peptides from perilla seed[D]. Fuzhou: Fuzhou University, 2017.
[22] LU C, LI H, LI C, et al. Chemical composition and radical scavenging activity of Amygdalus pedunculata pall leaves' essential oil[J]. Food and Chemical Toxicology,2018,119:368−374. doi: 10.1016/j.fct.2018.02.012
[23] LI F, FEI P, XIAO J W, et al. Identification and characterization of antioxidative peptides derived from simulated in vitro gastrointestinal digestion of walnut meal proteins[J]. Food Research International,2019,116:518−526. doi: 10.1016/j.foodres.2018.08.068
[24] 季晓彤, 孙培冬. 桃仁多肽的分离及其抗氧化性能研究[J]. 中国油脂,2018,43(7):77−81. [JI Xiaotong, SUN Peidong. Isolation and antioxidant activity of polypeptides from peach kernel[J]. China Fats and Oils,2018,43(7):77−81. doi: 10.3969/j.issn.1003-7969.2018.07.018 JI Xiaotong, SUN Peidong. Isolation and antioxidant activity of polypeptides from peach kernel[J]. China Fats and Oils, 2018, 43(7): 77-81. doi: 10.3969/j.issn.1003-7969.2018.07.018
[25] 王晓杰, 刘晓兰, 曲悦, 等. 两步水解法制备玉米抗氧化活性肽及产物的稳定性[J]. 中国粮油学报,2020,35(12):67−73. [WANG Xiaojie, LIU Xiaolan, Qu Yue, et al. Preparation of corn antioxidant peptides by two-step hydrolysis and stability of the products[J]. Chinese Journal of Cereals and Oils,2020,35(12):67−73. doi: 10.3969/j.issn.1003-0174.2020.12.012 WANG Xiaojie, LIU Xiaolan, Qu Yue, et al. Preparation of corn antioxidant peptides by two-step hydrolysis and stability of the products[J]. Chinese Journal of Cereals and Oils, 2020, 35(12): 67-73. doi: 10.3969/j.issn.1003-0174.2020.12.012
[26] PARK B Y, YOON K Y. Biological activity of enzymatic hydrolysates and the membrane ultrafiltration fractions from perilla seed meal protein[J]. Czech Journal of Food Sciences,2019,37:180−185. doi: 10.17221/145/2018-CJFS
[27] MIRZAEI M, MIRDAMADI S, SAFAVI M, et al. The stability of antioxidant and ACE-inhibitory peptides as influenced by peptide sequences[J]. Food Science and Technology,2020,130:109710.
[28] PENG L, ZHAO M M, CAO Y L, et al. Purification and identification of anti-oxidant soybean peptides by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Rejuvenation Research,2014,17(2):209−211. doi: 10.1089/rej.2013.1520
[29] 刘速速, 李文凯, 孙华, 等. 元宝枫籽多肽的制备及其抗氧化性的研究[J]. 中国调味品,2021,46(8):6−11. [LIU Susu, LI Wenkai, SUN Hua, et al. Preparation and antioxidant activity of polypeptides from Chinese maple seeds[J]. China Condiment,2021,46(8):6−11. doi: 10.3969/j.issn.1000-9973.2021.08.002 LIU Suosu, LI Wenkai, SUN Hua, et al. Preparation and antioxidant activity of polypeptides from Chinese maple seeds[J]. China Condiment, 2021, 46(8): 6-11. doi: 10.3969/j.issn.1000-9973.2021.08.002
[30] SHEN Q, OU A N, LIU S, et al. Effects of ion concentrations on the hydroxyl radical scavenging rate and reducing power of fish collagen peptides[J]. Journal of Food Biochemistry,2019,43(4):e12789. doi: 10.1111/jfbc.12789
[31] 李雪. 紫花芸豆抗氧化肽的分离纯化及其稳定性的研究[D]. 大庆: 黑龙江八一农垦大学, 2019. LI Xue. Isolation, purification and stability of antioxidant peptides from purple kidney bean[D]. Daqing: Heilongjiang Bayi Agricultural Reclamation University, 2019.
[32] 钱森和, 王洲, 魏明, 等. 美拉德反应对芝麻多肽抗氧化活性的影响[J]. 食品与机械,2018,34(8):24−28,88. [QIAN Senhe, WANG Zhou, WEI Ming, et al. Effect of Maillard reaction on antioxidant activity of sesame peptides[J]. Food and Machinery,2018,34(8):24−28,88. QIAN Senhe, WANG Zhou, WEI Ming, et al. Effect of Maillard reaction on antioxidant activity of sesame peptides[J]. Food and Machinery, 2018, 34(8): 24-28, 88.
[33] 姬中伟. 小米醇溶蛋白肽的制备及其抗氧化与抗炎活性研究[D]. 无锡: 江南大学, 2020. JI Zhongwei. Preparation of millet gliadin peptide and its antioxidant and anti-inflammatory activity[D]. Wuxi: Jiangnan University, 2020.
[34] WONG F C, XIAO J, ONG M G, et al. Identification and characterization of antioxidant peptides from hydrolysate of blue-spotted stingray and their stability against thermal, pH and simulated gastrointestinal digestion treatments[J]. Food Chemistry,2019,271:614−622. doi: 10.1016/j.foodchem.2018.07.206
[35] CHITTCHANG M, MITRA A K, JOHNSTON T P. Interplay of secondary structure and charge on the diffusion of a polypeptide through negatively charged aqueous pores[J]. Pharmaceutical Research,2007,24(3):502−511. doi: 10.1007/s11095-006-9166-3
[36] PIMENTEL F B, CERMEñO M, KLEEKAYAI T, et al. Effect of in vitro simulated gastrointestinal digestion on the antioxidant activity of the red seaweed Porphyra dioica[J]. Food Research International,2020,136:109309. doi: 10.1016/j.foodres.2020.109309






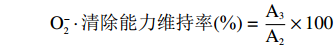

 下载:
下载:







 下载:
下载:
