Preparation and Biological Regulation of Lactones by Microbial Transformation: A Review
-
摘要: 内酯类香料因具有典型奶香和花果香气,被广泛地应用于糖果、饮料、乳制品、烘焙等食品中。得益于近些年来消费者对于产品天然特性的喜爱,内酯类香料的微生物法转化制备备受关注。本文综述了γ-和δ-两类内酯的微生物法转化机理包括脂肪酸进入线粒体方式、β-氧化、环化过程和降解代谢途径。对目前已有的生物转化法调控方式如基于基因组学的基因调控、溶氧氧合、底物分批培养、细胞固定化、菌种诱变等进行了总结,展望了内酯类香料的调控研究方向,为更经济高效的生物法转化内酯类香料提供借鉴。Abstract: Lactones are widely used in confectionery, beverages, dairy products, baking and other foods due to their typical creamy, floral and fruity aromas. In recent years, because consumers prefer the natural properties of products, the preparation and biological regulation of lactones by microbial transformation has attracted much attention. The microbial transformation mechanisms of γ- and δ-lactones are reviewed in this paper, including the way of fatty acids entering mitochondria, β-oxidation, cyclization and degradation metabolic pathways. The existing regulation methods of microbial transformation are also summarized, such as gene regulation based on genomics, dissolved oxygen, substrate batch culture, cell immobilization and strain mutagenesis. The research direction of regulation of lactones is prospected, which can provide reference for more economical and efficient microbial transformation of lactones.
-
Keywords:
- γ-decalactone /
- biological regulation /
- dissolved oxygen /
- lactone degradation
-
内酯类化合物是羟基脂肪酸分子内羟基与羧基脱去一分子水形成的产物,由于羟基官能团的位置不同,可以分为β-内酯,γ-内酯,δ-内酯和大环内酯四类[1-2]。其中γ-内酯,δ-内酯天然存在于动植物中(如表1所示),多体现花果香和奶香,嗅觉阈值普遍较低,故广泛应用于糖果、饮料和糕点等食品中[3]。
内酯类香料的生产制备主要有化学合成、直接提取、微生物合成和微生物转化四种方法。化学合成法原料易得、反应路径短、产率高,但反应需特殊催化剂,且产物多为不具备立体选择性的消旋体[4]。直接提取法设备简单,操作方便,但其成本较高无法产业化生产不符合市场的需求多样化。微生物合成法是指酵母菌和某些丝状真菌在稳定期能合成次生代谢产物内酯,可以得到更为绿色和天然的异构体,但其合成过程不易控制。微生物转化法具有高度化学专一性、位置专一性和立体专一性,可以大大简化制造过程[5-6]。
近些年来,化学法合成香料的香气品质愈发不能满足消费者对于天然的追求,且天然提取香料的价格逐年攀升。微生物转化法制备的芳香化合物具有与天然提取化合物相同的特定立体结构并表现出天然的特性,且其市场价格通常低于天然提取的化合物价格,所以微生物转化法在制备内酯类化合物方面引起了科学界和产业界的广泛关注[7-9]。基于此,本文在查阅相关文献的基础上,解析内酯类香料(主要是γ-癸内酯与δ-癸内酯)的微生物法转化代谢机理和降解代谢途径,综述基因调控、溶氧氧合、底物分批培养、细胞固定化和菌种诱变等生物调控方法的研究进展,并对生物调控的未来研究方向和可能出现的问题进行展望,为微生物法制备芳香化合物提供理论参考。
1. 生物转化法代谢机理
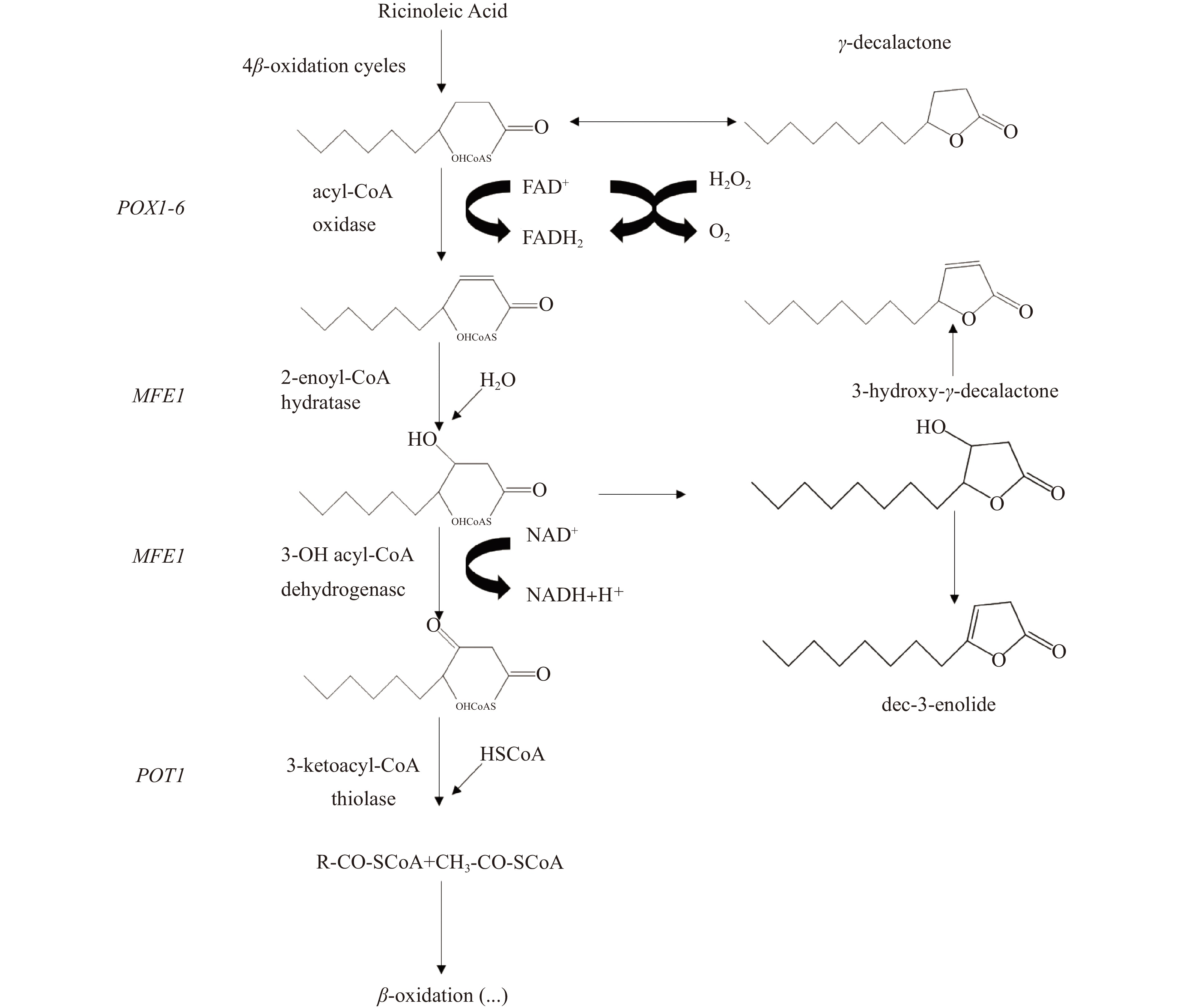
在Okui等[11]研究了几种生物中的羟基化脂肪酸分解代谢后,利用微生物技术生产制备内酯类香料化合物的方式在60年代开始出现。被用于生产内酯类香料的微生物主要有假毕赤酵母属、单胞菌属、假丝酵母属、孢霉属和红酵母属几种,其中的解脂耶氏酵母是应用最为广泛且产量较高的一种菌株。工业生产过程大多使用解脂耶氏酵母代谢蓖麻油酸底物,通过对其主要成分脂肪酸(约90%)进行线粒体转运、β-氧化和缩合环化制备内酯类化合物[12-13]。现以蓖麻油酸为例介绍生物法转化制备内酯类香料的主要生化过程。
1.1 油酸进入线粒体
其主要途径包括以几种脂肪酸或其衍生物为底物,在油酸转运至线粒体时通过微生物细胞内特别是线粒体内一系列关键酶(酯酶和β-氧化酶系)的作用经四步β-氧化,把相应底物氧化为乙酰-CoA,后乙酰-CoA进入循环彻底氧化,脱去碳原子单元,生成前体物质4-羟基酸[14]。由Waché等[15]的研究可知,脂肪酸进入线粒体进行β-氧化循环时,短式中长链脂酰-CoA分子(十个碳原子以下)可以自由通过线粒体内膜,其中的脂酰-CoA脱氢酶为其限速酶,而长链分子需要与极性肉碱结合后在其辅助下通过。脂肪酸进入线粒体共有如下几种方式:一、在脂肪酸转运蛋白的作用下进入线粒体;二、在脂肪酸移位酶的催化下以脂肪酸和脂肪酸结合蛋白结合物的形式进入;三、在酰基辅酶A合成酶的催化下脂肪酸合成脂酰辅酶A,后在脂酰辅酶A结合蛋白或肉碱棕榈酰基转移酶和肉碱/酰基肉碱移位酶的作用下进入[16-19]。
1.2 β-氧化过程
β-氧化是脂肪酸降解中经典的生化代谢路径,也是一个碳链缩短的生物化学反应[20]。如图1所示,在脂酰-CoA脱氢酶的作用下,每一轮β-氧化过程都会切下两个碳原子单元即乙酰-CoA,然后乙酰CoA进入柠檬酸生产循环为细胞生物体生命活动提供所必需的能量。作为蓖麻油酸的十八碳化合物,其必须经过四步β-氧化循环后生成前体物4-羟基酸再进行环化形成内酯[21]。β-氧化过程包括以下四步反应:酰基辅酶A氧化酶催化的氧化反应;烯酰辅酶A氧化酶催化的水合反应;3-羟基辅酶A脱氢酶催化的脱氢反应;3-酮酰-CoA硫解酶催化的硫解反应[22]。
1.3 环化过程
内酯物质的环化过程是指羟基脂肪酸在环化酶的催化下通过分子内失去一分子水发生内酯化反应形成具有光学活性的环状化合物的过程,并为微生物的生长繁殖提供必要的能量[1]。以γ-癸内酯的制备为例,其前体物质4-羟基癸酸在相应的脂肪酶和酯酶的催化作用下,其4位碳原子上的羟基和1位碳原子上的羧基脱水缩合环化生成[23]。在内酯环状化合物中即使是非共轭的双键也可以被选择性的对映转化。常见催化酶有酰基辅酶A氧化酶和3-羟基酰辅酶A脱氢酶等。
1.4 内酯的降解路径
在利用蓖麻油酸生物转化制备内酯时,当产物浓度达到一个最高值后由于细胞对内酯的降解或再利用,会出现缓慢减少的现象。产物内酯的降解可能主要有以下三种途径:一是未内酯化的羟基酸降解速度比产物内酯的降解速度要快,这表明产物内酯的水解过程占主导控制地位。二是通过内酯酶的作用对产物内酯进行开环,后在β-氧化过程中将开环的产物进行氧化降解。三是产物内酯发生ω-氧化生成ω-二羧酸[24]。
2. 生物转化法调控
基于上述内酯的微生物转化机理,研究者利用多种方法对菌株内酯的生物转化进行调控,主要包括基因调控、诱变适宜菌种、改变转化体系的溶氧水平、改变底物添加方式、及时分离菌株细胞来优化微生物体内的最适转化制备反应条件等,最终达到提高微生物细胞内酯类化合物产量的目的(如表2所示)。
2.1 基于基因组学的基因调控
基于基因组学的基因调控是指基于基因组学技术,通过基因工程的方法从分子水平上对微生物进行操作,对其进行改造,敲除、扩增或添加某个基因片段,从而对微生物的相关理化性质及特征进行调控[30]。常被用来以微生物法转化制备内酯类香料的解脂耶氏酵母具有六个酰基辅酶A氧化酶家族—Aox1至6由POX1至POX6基因编码。在解脂耶氏酵母野生型菌株制备内酯的过程中,内酯的积累与Aox的高效表达有关[24]。其中Aox2表现出长链特异性,Aox3表现出短链特异性,Aox4、Aox5和Aox6在直链酰基辅酶A(从碳4到碳18)的整个光谱中表现出弱活性[31]。
POX1基因的破坏导致β-氧化活性增加,但内酯的产量会减少。学者们通过对降解途径中乙酰辅酶氧化酶Aox3的编码基因POX3片段的敲除,或者对具有羟基脂肪酸长链特异性的乙酰辅酶氧化酶Aox2的编码基因POX2的扩增表达,使所产内酯的生产回流和被基因编码降解效应减弱,内酯的产量有了不同程度的提高[32-33]。冯春利等[34-35]利用同源重组和自克隆技术对POX3基因进行敲除,使得γ-癸内酯产量提高了2.73倍。Zhang等[25]通过敲掉POX3与GLT2片段构建工程菌,敲除POX3基因后内酯产量提高2.53倍,GLT2敲除后的内酯产量提升1.31倍。Guo等[36]通过POX2基因的扩增和POX3基因的破坏使得内酯产量提高了2.9倍,除此之外对生产内酯起重要作用的Aox酶进行了基因重组,促进了内酯产量提升。Braga等[37]观察到被破坏POX2-5基因和过表达Aox2p基因菌株的内酯产量减少(如表3所示)。
表 3 生物调控方式与相应内酯产量Table 3. Bioregulatory modalities and corresponding lactone production调控方式 实验处理 菌株 内酯产量 参考文献 基因工程 敲除URA3基因 尿嘧啶缺陷型
解脂耶氏酵母1.03 g/L [34] 敲除POX3基因
扩增POX2基因解脂耶氏酵母AS2.1405 2.75 g/L [36] 敲除GLT2基因 尿嘧啶缺陷型
解脂耶氏酵母1.37 g/L [25] 破坏POX2-5基因
过表达Aox2PMTLY40-2P菌株 产量减少 [37] 过表达LIP2P基因 解脂耶氏酵母JMY3010 3.72 g/L [43] 溶氧氧合 丝瓜海绵固体支持物
增强通气率解脂耶氏酵母W29 5.43 g/L [46] 6巴气压 解脂耶氏酵母W29 4.78 g/L [26] 培养基溶解氧浓度44.4% 解脂耶氏酵母W29 0.68 g/L [45] 底物分批培养 纯氧曝气补料
分批发酵解脂耶氏酵母DSM3286 0.22g/L [49] 补料分批发酵 解脂耶氏酵母ATCC20460 6.83 g/L [27] 添加左旋肉碱 酒酿酵母MF013 2.75 g/L [51] 在脉冲中加入蓖麻油 解脂耶氏酵母W29 7.14 g/L [37] 细胞固定化 添加石蜡油
疏水吸附剂解脂耶氏酵母W29 5.82 g/L [42] 添加Macronet树脂 红桃菌40267 6.54 g/L [52] 添加大孔树脂AB-8 解脂耶氏酵母 2.17 g/L [28] 海藻酸钠和凹凸棒石 解脂耶氏酵母 8.05 g/L [53] 添加天然胶 解脂耶氏酵母W29 6.52 g/L [52] 菌种诱变 菌种诱变 解脂耶氏酵母As2.1405 2.04 g/L [29] 紫外诱变 解脂耶氏酵母 1.44 g/L [40] 研究表明,还可利用基因同源重组法对尿嘧啶关键合成酶基因URA3进行敲除,从而构建尿嘧啶营养缺陷型解脂耶氏酵母来大幅提升内酯产量。冯春利[35]以解脂耶氏酵母AS2.1045为实验菌株构建的尿嘧啶营养缺陷型菌株使γ-癸内酯的产量提高了4.18倍。
2.2 菌种诱变
为选育高产内酯菌株,可采用诱变育种后再进行菌种筛选的方式。诱变育种按诱变因素可分为物理诱变和化学诱变。用化学或物理方法促进菌株细胞原生质体融合也是研究较多的一种菌种诱变育种方法,多种诱变因素一起诱变又称为复合诱变。通过对菌株中特定控制4-羟基癸酰辅酶A的羟基和-CoA基团的内部酯化反应以及醇和酰基辅酶A之间的酯化反应的酶基因进行突变,从而促进产物内酯的生产[38]。
Peng等[10]对内酯生成过程中参与羟基化反应的醇酰基转移酶PpAAT1氨基酸残基进行定点突变,使其更有效的催化4-羟基癸酰辅酶A转化前体物质4-羟基酸为γ-癸内酯,间接提升内酯化合物产量。徐勤[29]在桃子表面和桃树林土壤中筛选出一株以蓖麻油为底物产γ-癸内酯的酵母菌J1,经过对其诱变育种和发酵条件优化,内酯产量达到2.98 g/L。通过对解脂耶氏酵母As2.1405复合诱变及发酵条件优化等使γ-癸内酯的产量提高到2.04 g/L,此外苏畅等[39]还对筛选获得的酵母进行连续紫外诱变、NTG诱变、DES诱变和钴60诱变,使γ-癸内酯产量提高到1.44 g/L[40]。
2.3 溶氧氧合
氧气传质速率代表着生物转化体系中的溶氧水平,氧气传质速率增加时,微生物的呼吸作用加强。因为微生物生长、β-氧化能力与产物内酯的形成相伴而生,所以溶氧浓度的增加和较好的培养基氧化状态能够有效提高菌株体内的β-氧化能力,从而提升菌株对底物的利用率[41-42]。通过在发酵前期常压下增加曝气速率和搅拌速率,以及提高反应器内的空气压力即增加氧溶解度,可以有效提高气体到液体介质的氧传递速率,利于菌体生长[43]。而在产物生成期则降低速率进行分段控制,低溶氧量则有助于产物内酯的积累。因此通过调整溶氧进而调控内酯类香料的转化程度在理论和实践上是可行的[44]。
解脂耶氏酵母的β-氧化过程对培养基中溶氧浓度较为敏感,当氧气超过一定浓度时,3-羟基酰辅酶A脱氢酶在氧化过程中占主导作用,从而不利于细胞中内酯类化合物的产生[45]。氧气浓度也影响着内酯类化合物的细胞内降解过程,较高氧气浓度可以促进内酯类化合物向4-羟基酸的转化。因此为提高内酯化合物产率,应在产物内酯浓度较高时降低培养基中的氧气浓度[42]。
Try等[46]以丝瓜海绵为固体支持物,在强制通气的微型反应器中酵母细胞出现高产γ-癸内酯现象。Braga等[37]发现在低氧化速率,较高的溶氧浓度下,γ-癸内酯的产量提高到了5.4 g/L;并采用增加气动力为搅拌动力的生物反应器中空气压力的方法,提高微生物细胞培养物的充氧,从而增加氧在介质中的溶解度,更有利于内酯的转化[43]。Gomes等[45]通过提升培养基中溶解氧浓度至44.4%使得内酯产量达到680.9 mg/L,并在改变曝气程度及搅拌速度的条件下提高了内酯类化合物的转化速率。Lopes等[26]研究证明了改善氧合可以提高细胞特定的生长速度,呈现高生物量生产力。Reis等[47]使用一种基于空气振荡的小型生物反应器生产γ-癸内酯,通过提高体系中的氧气传质速率,使达到最大内酯产量的时间缩短一半。
2.4 底物分批培养
在菌株发酵培养几个小时后底物完全耗尽,酵母细胞以γ-癸内酯为碳源消耗。因此,γ-癸内酯从培养基中完全消失,从而产物内酯生产率取决于增长率和消耗率之间的差异。底物分批培养可以作为其解决方法,当底物低于菌株消耗利用所需水平时,底物被间歇或连续地供应从而减缓了产物内酯的消耗率提升了内酯产量。不同种底物(如蓖麻油和蓖麻油酸甲酯)的添加方式影响着微生物法转化制备γ-癸内酯的产量,当通过底物分批进料培养发酵时内酯类香料的产量会有所提升[48]。
Moradi等[49]的研究表明纯氧曝气补料分批发酵获得的内酯化合物最高浓度是分批发酵的3倍。Nelma等[27]通过间歇式分批补料发酵培养使内酯化合物产量提高了3倍,同时副产物3-羟基-γ-癸内酯的产量增加,提高了底物的利用效率。闫淑芳等[50]通过底物的二次加入培养实现了产物内酯的浓度提升。Andrade等[7]研究解脂耶氏酵母CCMA 0242菌株在体积分数为30%的蓖麻油作为底物分批培养时体现出较好的产内酯效果。Rong等[51]在以酿酒酵母培养蓖麻油酸产生内酯时,通过向培养基中添加左旋肉碱来提高底物的利用率,加速了脂肪酸的消耗,生物转化周期缩短。并通过向培养基中分别加入γ-己内酯、γ-辛内酯和γ-十二内酯来缓解产物内酯在生物转化过程将要结束时易被酵母细胞降解的现象。结果表明γ-辛内酯竞争性地抑制了产物内酯与内酯降解酶的结合,使得γ-癸内酯的产量有效增加了11%。
2.5 细胞固定化技术
限制生物制备内酯类香料工业化应用的另一主要因素是菌株细胞对内酯化合物浓度的升高较为敏感且产物内酯对菌株细胞具有一定的毒害作用。微生物细胞的固定化技术已被证实能为细胞提供一定的保护作用,通过将产物内酯与菌株细胞分离使其免受物理化学变化或抑制物质的影响[50]。降低产物内酯对菌株的毒害作用及菌株对产物内酯的降解作用,并提高底物的利用率,加快发酵速度,延长细胞的活性和稳定性,从而提高菌株的内酯产量[28]。
研究表明,因为产物内酯对菌株细胞存在一定的毒害作用,所以微生物细胞在生物技术生产过程中细胞活性受到了影响。当内酯化合物浓度高于150 mg/L时细胞生长易被抑制,细胞去极性化,膜流动性增加[41]。Aguedo等[42]通过添加如石蜡油等疏水吸附剂来原位捕获内酯,以此维持酵母细胞的良好体系。一些研究者为此设计了反应分离耦合工艺,产物内酯与酵母可以进行有效分离,进而有效缓解了内酯化合物的毒害作用,间接提升内酯的产量。Alchihab等[52]使用Macronet树脂从生物转化培养基中以80%的吸附率吸附去除γ-癸内酯。于伟等[28]通过添加大孔树脂AB-8吸附产物γ-癸内酯,将产物内酯与酵母细胞进行分离,使产物的生产速率提高了36%、产量达到2.17 g/L。Zhao等[53]将解脂耶氏酵母G3-3.21固定在海藻酸钠和凹凸棒石的混合物上,循环利用酵母并以离子液体作为共溶剂转化蓖麻油生产γ-癸内酯,使内酯产量提高了2.5倍,产物浓度达到8.05 g/L[54-55]。此外,Mohamed等[52]在生产γ-癸内酯的过程中通过添加天然胶使内酯的产量达到6.52 g/L。
2.6 增加细胞疏水性
解脂耶氏酵母细胞显现出亲水性,当细胞接触水分子时细胞对疏水性表面或分子具有良好的吸引力。底物蓖麻油酸作为疏水性介质,不利于酵母细胞的微生物利用转化。在解脂耶氏酵母细胞以蓖麻油为底物转化制备内酯类化合物过程中细胞表面与底物的小液滴之间发生直接接触,通过选择具有亲和力的表面活性剂—阳离子表面活性剂,可以增加细胞与底物间的接触程度[1]。或通过向反应体系中添加有利于疏水性底物蓖麻油酸溶解的极性有机溶剂,从而改善底物蓖麻油酸的分散性并有利于提升酵母细胞的底物传质速率及利用率[56]。
Gomes等[57]研究了细胞疏水性在细胞转化制备γ-癸内酯过程中所起到的作用。在内酯类化合物生产中使用疏水性更强的细胞可以增加底物亲和力,从而增加细胞对底物的吸收程度,间接提高了产物内酯的生产率。Escamilla-Garcia等[44]提出在高通气率下细胞的疏水性会逐渐增加的观点。通过向体系中添加具有亲和力的阳离子表面活性剂或是增加疏水性底物溶解性的极性有机溶剂等方法,有利于改善菌株细胞的膜的通透性从而提升菌株细胞的底物利用率,进而增加内酯类化合物的产量。
3. 总结和展望
生物法制备的内酯类香料属于天然香料,深受消费者喜爱,具有较强的市场竞争力。本文综述了内酯类物质的微生物法转化制备和降解代谢途径,包括微生物细胞内脂肪酸进入线粒体的不同种方式和发生的β-氧化过程。对目前已有的生物转化法调控方式如基于基因组学的基因调控、溶氧氧合、底物分批培养、细胞固定化、菌种诱变等进行了总结,展望了内酯类香料的调控研究方向。
但目前的生物转化法制备工艺存在一些缺陷和不足,如产率不理想、成本高和操作复杂等,限制了其工业化生产规模和应用水平。未来可深入研究菌株细胞中控制β-氧化过程的基因片段、不同种微生物调控研究方法的限制条件和内酯化合物生成过程中参与羟基化反应的醇酰基转移酶的关键基因控制位点。随着生物法制备技术的不断发展,对内酯类香料的生物法制备需要更进一步的认知研究,这对天然香料的高效生物制备具有重要意义。
-
表 1 γ-癸内酯与δ-癸内酯
Table 1 γ-Decalactone and δ-decalactone
表 2 生物转化法调控
Table 2 Regulation by biological transformation
表 3 生物调控方式与相应内酯产量
Table 3 Bioregulatory modalities and corresponding lactone production
调控方式 实验处理 菌株 内酯产量 参考文献 基因工程 敲除URA3基因 尿嘧啶缺陷型
解脂耶氏酵母1.03 g/L [34] 敲除POX3基因
扩增POX2基因解脂耶氏酵母AS2.1405 2.75 g/L [36] 敲除GLT2基因 尿嘧啶缺陷型
解脂耶氏酵母1.37 g/L [25] 破坏POX2-5基因
过表达Aox2PMTLY40-2P菌株 产量减少 [37] 过表达LIP2P基因 解脂耶氏酵母JMY3010 3.72 g/L [43] 溶氧氧合 丝瓜海绵固体支持物
增强通气率解脂耶氏酵母W29 5.43 g/L [46] 6巴气压 解脂耶氏酵母W29 4.78 g/L [26] 培养基溶解氧浓度44.4% 解脂耶氏酵母W29 0.68 g/L [45] 底物分批培养 纯氧曝气补料
分批发酵解脂耶氏酵母DSM3286 0.22g/L [49] 补料分批发酵 解脂耶氏酵母ATCC20460 6.83 g/L [27] 添加左旋肉碱 酒酿酵母MF013 2.75 g/L [51] 在脉冲中加入蓖麻油 解脂耶氏酵母W29 7.14 g/L [37] 细胞固定化 添加石蜡油
疏水吸附剂解脂耶氏酵母W29 5.82 g/L [42] 添加Macronet树脂 红桃菌40267 6.54 g/L [52] 添加大孔树脂AB-8 解脂耶氏酵母 2.17 g/L [28] 海藻酸钠和凹凸棒石 解脂耶氏酵母 8.05 g/L [53] 添加天然胶 解脂耶氏酵母W29 6.52 g/L [52] 菌种诱变 菌种诱变 解脂耶氏酵母As2.1405 2.04 g/L [29] 紫外诱变 解脂耶氏酵母 1.44 g/L [40] -
[1] ROBINSON S L, CHRISTENSON J K, WACKETT L P. Biosynthesis and chemical diversity of β-lactone natural products[J]. Natural Product Reports,2019,36(3):458−475. doi: 10.1039/C8NP00052B
[2] 许春平, 孟丹丹, 冉盼盼, 等. 产香酵母发酵处理烟草花蕾条件优化及烟用香料制备研究[J]. 湖北农业科学,2018,57(1):100−103,111. [XU C P, MENG D D, RAN P P, et al. Optimization of fermentation treatment condition of tobacco bud and preparation of tobacco flavor[J]. Hubei Agricultural Sciences,2018,57(1):100−103,111. XU C P, MENG D D, RAN P P, et al. Optimization of fermentation treatment condition of tobacco bud and preparation of tobacco flavor[J]. Hubei Agricultural Sciences, 2018, 57(1): 100-103, 111.
[3] 孙嘉卿, 冯涛, 宋诗清, 等. 乳品香精的研究进展[J]. 乳业科学与技术,2020,43(3):50−54. [SUN J Q, FENG T, SONG S Q, et al. Progress in research on dairy flavors[J]. Journal of Dairy Science and Technology,2020,43(3):50−54. SUN J Q, FENG T, SONG S Q, et al. Progress in research on dairy flavors[J]. Journal of Dairy Science and Technology, 2020, 43(3): 50-54.
[4] 黄国程. 内酯类香料的醇解反应及其产物质谱裂解规律探讨[J]. 香料香精化妆品,2019(4):10−14. [HUANG G C. Preliminary study on the alcoholysis of lactones and the pyrolysis regularity of their products’ mass spectrum[J]. Flavor Fragrance Cosmetics,2019(4):10−14. doi: 10.3969/j.issn.1000-4475.2019.04.003 HUANG G C. Preliminary study on the alcoholysis of lactones and the pyrolysis regularity of their products’ mass spectrum[J]. Flavor Fragrance Cosmetics, 2019(4): 10-14. doi: 10.3969/j.issn.1000-4475.2019.04.003
[5] 陈臣, 刘政, 于海燕, 等. 奶酪中内酯类物质风味贡献及其生物合成调控进展[J]. 现代食品科技,2020,36(11):305−312. [CHEN C, LIU Z, YU H Y, et al. Flavor contribution of lactones in cheese and its biosynthetic regulation: A review[J]. Modern Food Science and Technology,2020,36(11):305−312. CHEN C, LIU Z, YU H Y, et al. Flavor contribution of lactones in cheese and its biosynthetic regulation: A review[J]. Modern Food Science and Technology, 2020, 36(11): 305-312.
[6] MARELLA E R, DAHLIN J, DAM M I, et al. A single-host fermentation process for the production of flavor lactones from non-hydroxylated fatty acids[J]. Metabolic Engineering,2020,61(9):427−436.
[7] ANDRADE P D, CARVALHO B F, SCHWAN R F, et al. Production of γ-decalactone by yeast strains under different conditions[J]. Food Technol Biotechnol,2017,55(2):225−230.
[8] 王梦泽. 酵母MF-Y11转化蓖麻油酸制备γ-癸内酯的工艺研究[D]. 上海: 上海应用技术大学, 2018: 2−6 WANG M Z. Preparation of γ-decalactone from ricinoleic acid by yeast MF-Y11[D]. Shanghai: Shanghai Institute of Technology, 2018: 2−6.
[9] 王荣霞, 朱廷恒, 汪琨. 添加餐厨废油脂培养酵母进行γ-癸内酯生物转化[J]. 食品与发酵工业,2019,45(20):106−111. [WANG R X, ZHU T H, WANG K. Biotransformation of γ-decalactone from kitchen waste oil by yeasts[J]. Food And Fermentation Industries,2019,45(20):106−111. WANG R X, ZHU T H, WANG K. Biotransformation of γ-decalactone from kitchen waste oil by yeasts[J]. Food And Fermentation Industries, 2019, 45(20): 106-111.
[10] PENG B, YU M, ZHANG B, et al. Differences in PpAAT1 activity in high-and low-aroma peach varieties affect γ-decalactone production[J]. Plant Physiology,2020,182(4):2065−2080. doi: 10.1104/pp.19.00964
[11] OKUI S, UCHIYAMA M, MIZUGAKI M. Metabolism of hydroxy fatty acids. II. Intermediates of the oxidative breakdown of ricinoleic acid by genus candida[J]. Journal of Biochemistry,1963,54(11):536−540.
[12] LIU H, SONG Y, FAN X, et al. Yarrowia lipolytica as an oleaginous platform for the production of value-added fatty acid-based bioproducts[J]. Frontiers in Microbiology,2021,11(1):3249−3262.
[13] SANG M L, LIM H J, CHANG J W, et al. Investigation on the formations of volatile compounds, fatty acids, and γ-lactones in white and brown rice during fermentation[J]. Food Chemistry,2018,269(15):347−354.
[14] 胡泰文, 薛永常. 酰基辅酶A硫酯酶在脂肪酸代谢途径中的作用[J]. 生命的化学,2020,40(5):663−667. [HU T W, XUE Y C. The role progress of acyl-CoA thioesterase in fatty acid metabolism pathway[J]. Chemistry of Life,2020,40(5):663−667. HU T W, XUE Y C. The role progress of acyl-CoA thioesterase in fatty acid metabolism pathway[J]. Chemistry of Life, 2020, 40(5): 663-667.
[15] WACHÉ Y, AGUEDO M, CHOQUET A, et al. Role of β-oxidation enzymes in γ-decalactone production by the yeast Yarrowia lipolytica[J]. Applied and Environmental Microbiology,2001,67(12):5700−5704. doi: 10.1128/AEM.67.12.5700-5704.2001
[16] 刘沛通, 郑晓卫, 段长青, 等. 不饱和脂肪酸对酿酒酵母生长及产香特性影响的研究进展[J]. 食品科学,2020,41(15):314−322. [LIU P T, ZHEGN X W, DUAN C Q, et al. A review of the effect of unsaturated fatty acids on the cell growth and aroma production of saccharomyces cerevisiae during fermentation[J]. Food Science,2020,41(15):314−322. doi: 10.7506/spkx1002-6630-20190729-397 LIU P T, ZHEGN X W, DUAN C Q, et al. A review of the effect of unsaturated fatty acids on the cell growth and aroma production of saccharomyces cerevisiae during fermentation[J]. Food Science, 2020, 41(15): 314-322. doi: 10.7506/spkx1002-6630-20190729-397
[17] LLAMAS M, MAGDALENA J A, GONZÁLEZ F C, et al. Volatile fatty acids as novel building blocks for oil-based chemistry via oleaginous yeast fermentation[J]. Biotechnology and Bioengineering,2020,117(1):18−23.
[18] JU J H, OH B R, HEO S Y, et al. Production of adipic acid by short-and long-chain fatty acid acyl-CoA oxidase engineered in yeast Candida tropicalis[J]. Bioprocess and Biosystems Engineering,2020,43(1):33−43. doi: 10.1007/s00449-019-02202-w
[19] JALLET D, XING D, HUGHES A, et al. Mitochondrial fatty acid β-oxidation is required for storage lipid catabolism in a marine diatom[J]. New Phytologist,2020,14(3):946−958.
[20] HANKO E, DEN C M, VIOLETA S, et al. Engineering β-oxidation in Yarrowia lipolytica for methyl ketone production[J]. Metabolic Engineering,2018,48(7):52−62.
[21] GÉSSYCA P, SOARES A, SOUZA K S T, et al. γ-Decalactone production by Yarrowia lipolytica and Lindnera saturnus in crude glycerol[J]. Preparative Biochemistry and Biotechnology,2017,47(6):633−637. doi: 10.1080/10826068.2017.1286601
[22] ELAIDE A, BRAGA, CARLOS, et al. Generation of flavors and fragrances through biotransformation and de novo synthesis[J]. Food and Bioprocess Technology,2018,19(9):2217−2228.
[23] BORATYŃSKI F, SZCZEPAŃSKA E, SIMEIS D D, et al. Bacterial biotransformation of oleic acid: New findings on the formation of γ-dodecalactone and 10-ketostearic acid in the culture of Micrococcus luteus[J]. Molecules,2020,25(13):3024. doi: 10.3390/molecules25133024
[24] YVES W, AGUEDO M, MARIE T L, et al. Optimization of Yarrowia lipolytica's β-oxidation pathway for γ-decalactone production[J]. Journal of Molecular Catalysis B Enzymatic,2002,19-20(11):347−351.
[25] ZHANG L, LI H, GAO L, et al. Acyl-CoA oxidase 1 is involved in γ-decalactone release from peach (Prunus persica) fruit[J]. Plant Cell Reports,2017,36(6):829−842. doi: 10.1007/s00299-017-2113-4
[26] LOPES M, GOMES N, MOTA M, et al. Yarrowia lipolytica growth under increased air pressure: Influence on enzyme production[J]. Applied Biochemistry and Biotechnology,2009,159(1):46−53. doi: 10.1007/s12010-008-8359-0
[27] GOMES N, TEIXEIRA J A, BELO I. The use of methyl ricinoleate in lactone production by Yarrowia lipolytica: Aspects of bioprocess operation that influence the overall performance[J]. Biocatalysis,2010,28(4):227−234. doi: 10.3109/10242422.2010.493208
[28] 于伟, 徐岩, 喻晓蔚, 等. 生物法转化分离耦合制备γ-癸内酯[J]. 化工进展,2007(8):1151−1154. [YU W, XU Y, YU X W, et al. Simultaneous conversion and separation of γ-decalactone prepared by biological pathway[J]. Chemical Industry and Engineering Progress,2007(8):1151−1154. doi: 10.3321/j.issn:1000-6613.2007.08.019 YU W, XU Y, YU X W, et al. Simultaneous conversion and separation of γ-decalactone prepared by biological pathway[J]. Chemical Industry and Engineering Progress, 2007(8): 1151-1154. doi: 10.3321/j.issn:1000-6613.2007.08.019
[29] 徐勤. 微生物转化法制备γ-癸内酯的研究[D]. 天津: 天津科技大学, 2010: 28−50. XU Q. Preparation of γ-decalactone by microbial transformation[D]. Tianjin: Tianjin University of Science and Technology, 2010: 28−50.
[30] KAVEK M, BHUTADA G, MADL T, et al. Optimization of lipid production with a genome-scale model of Yarrowia lipolytica[J]. BMC Systems Biology,2015,9(1):72. doi: 10.1186/s12918-015-0217-4
[31] GROGUENIN A, WACHE´ Y, GARCI Á EE, et al. Genetic engineering of the β-oxidation pathway in the yeast Yarrowia lipolytica to increase the production of aroma compounds[J]. Journal of Molecular Catalysis B: Enzymatic,2004,28(2):75−79.
[32] CHANG J, RICHARD A R. Pex20p functions as the receptor for non-PTS1/non-PTS2 acyl-CoA oxidase import into peroxisomes of the yeast Yarrowia lipolytica[J]. Traffic,2019,20(7):504−515. doi: 10.1111/tra.12652
[33] 刘文山, 刘立辉, 傅荣昭. 食品用酶毕赤酵母表达载体的构建[J]. 生物技术通讯,2018,29(2):262−265. [LIU W S, LIU L H, FU R Z. Construction of a plasmid for producing enzymes as food additives in Pichia pastoris[J]. Letters In Biotechnology,2018,29(2):262−265. doi: 10.3969/j.issn.1009-0002.2018.02.021 LIU W S, LIU L H, FU R Z. Construction of a plasmid for producing enzymes as food additives in Pichia pastoris[J]. Letters In Biotechnology, 2018, 29(2): 262-265. doi: 10.3969/j.issn.1009-0002.2018.02.021
[34] 冯春利, 任清, 张蕾蕾, 等. 解脂耶氏酵母URA3基因的敲除[J]. 食品与生物技术学报,2010,29(4):624−628. [FENG C L, REN Q, ZHANG L L, et al. The disruption of URA3 gene of Yarrowia lipolytica[J]. Journal of Food Science and Biotechnology,2010,29(4):624−628. FENG C L, REN Q, ZHANG L L, et al. The disruption of URA3 gene of Yarrowia lipolytica[J]. Journal of Food Science and Biotechnology, 2010, 29(4): 624-628.
[35] 冯春利. 高产γ-癸内酯酵母基因工程菌的构建[D]. 北京: 北京工商大学, 2010: 46−76. FENG C L. Construction of high yield γ-decalactone yeast genetically engineered bacteria[D]. Beijing: Beijing Technology and Business University, 2010: 46−76.
[36] GUO Y, SONG H, WANG Z, et al. Expression of POX2 gene and disruption of POX3 genes in the industrial Yarrowia lipolytica on the γ-decalactone production[J]. Microbiological Research,2012,167(4):246−252. doi: 10.1016/j.micres.2011.10.003
[37] BRAGA A, MESQUITA D P, AMARAL A L, et al. Aroma production by Yarrowia lipolytica in airlift and stirred tank bioreactors: Differences in yeast metabolism and morphology[J]. Biochemical Engineering Journal,2015,93(15):55−62.
[38] SONG Z Z, PENG B, GU Z X. et al. Site-directed mutagenesis identified the key active site residues of alcohol acyltransferase PpAAT1 responsible for aroma biosynthesis in peach fruits[J]. Horticulture Research,2021,1(8):32−32.
[39] 苏畅, 任大明, 杜毅, 等. 微生物发酵法生产γ-癸内酯[J]. 食品工业科技,2004(10):118−119,142. [SU C, RENG D M, DU Y, et al. Production of γ-decalactone by microbial fermentation[J]. Science and Technology of Food Industry,2004(10):118−119,142. doi: 10.3969/j.issn.1002-0306.2004.10.043 SU C, RENG D M, DU Y, et al. Production of γ-decalactone by microbial fermentation[J]. Science and Technology of Food Industry, 2004(10): 118-119, 142. doi: 10.3969/j.issn.1002-0306.2004.10.043
[40] 苏畅, 陈洪, 潘仙华. 复合诱变选育γ-癸内酯高产菌的研究[J]. 食品科技,2010,35(10):20−23. [SU C, CHEN H, PAN X H. Study of a strain with high yielding of γ-decalactone mutated by combinated mutagenesis[J]. Food Science and Technology,2010,35(10):20−23. SU C, CHEN H, PAN X H. Study of a strain with high yielding of γ-decalactone mutated by combinated mutagenesis[J]. Food Science and Technology, 2010, 35(10): 20-23.
[41] RONG S, WANG M, YANG S, et al. Improvement in lactone production from biotransformation of ricinoleic acid based on the porous starch delivery system[J]. Journal of Chemical Technology and Biotechnology,2017,20(10):1198−1205.
[42] AGUEDO M, GOMES N, GARCIA E E, et al. Decalactone production by Yarrowia lipolytica under increased O2 transfer rates[J]. Biotechnology Letters,2005,27(20):1617−1621. doi: 10.1007/s10529-005-2517-z
[43] BRAGA A, BELO I. Production of γ-decalactone by Yarrowia lipolytica: Insights into experimental conditions and operating mode optimization[J]. Journal of Chemical Technology and Biotechnology,2015,90(3):559−565. doi: 10.1002/jctb.4349
[44] ESCAMILLA G E, RIORDAN S O’, GOMES N, et al. An air-lift biofilm reactor for the production of γ-decalactones by Yarrowia lipolytica[J]. Process Biochemistry,2014,49(9):1377−1382. doi: 10.1016/j.procbio.2014.05.011
[45] GOMES N, AGUEDO M, TEIXEIRA J, et al. Oxygen mass transfer in a biphasic medium: Influence on the biotransformation of methyl ricinoleate into γ-decalactone by the yeast Yarrowia lipolytica[J]. Biochemical Engineering Journal,2007,35(3):380−386. doi: 10.1016/j.bej.2007.02.002
[46] TRY S, JOËLLE DE-CONINCK, VOILLEY A, et al. Solid state fermentation for the production of γ-decalactones by Yarrowia lipolytica[J]. Process Biochemistry,2018,64(1):9−15.
[47] REIS N, GONCALVES C N, AGUEDO M, et al. Application of a novel oscillatory flow micro-bioreactor to the production of γ-decalactone in a two immiscible liquid phase medium[J]. Biotechnology Letters,2006,28(7):485−490. doi: 10.1007/s10529-006-0003-x
[48] MAAJOWICZ J, NOWAK D, FABISZEWSKA A, et al. Comparison of gamma-decalactone biosynthesis by yeast Yarrowia lipolytica MTLY40-2p and W29 in batch-cultures[J]. Biotechnology and Biotechnological Equipment,2020,34(1):330−340. doi: 10.1080/13102818.2020.1749528
[49] MORADI H, ASADOLLAHI M A, NAHVI I. Improved γ-decalactone production from castor oil by fed-batch cultivation of Yarrowia lipolytica[J]. Biocatalysis and Agricultural Biotechnology,2013,2(1):64−68. doi: 10.1016/j.bcab.2012.11.001
[50] 闫淑芳, 华栋梁, 林山, 等. 微生物法生产γ-癸内酯的初步研究[J]. 生物加工过程,2005(3):74−77. [YAN S F, HUA D L, LIN S, et al. Initial study on γ-decalactone production by microbial bioconversion[J]. Chinese Journal of Bioprocess Engineering,2005(3):74−77. doi: 10.3969/j.issn.1672-3678.2005.03.015 YAN S F, HUA D L, LIN S, et al. Initial study on γ-decalactone production by microbial bioconversion[J]. Chinese Journal of Bioprocess Engineering, 2005(3): 74-77. doi: 10.3969/j.issn.1672-3678.2005.03.015
[51] RONG S, YANG S, LI Q, et al. Improvement of γ-decalactone production by stimulating the import of ricinoleic acid and suppressing the degradation of γ-decalactone in Saccharomyces cerevisiae[J]. Biocatalysis and Biotransformation,2017,35(2):96−102. doi: 10.1080/10242422.2017.1289182
[52] ALCHIHAB M, ALDRIC J M, AGUEDO M, et al. The use of Macronet resins to recover γ-decalactone produced by Rhodotorula aurantiaca from the culture broth[J]. Journal of Industrial Microbiology and Biotechnology,2010,37(2):167−172. doi: 10.1007/s10295-009-0659-z
[53] ZHAO Y, XU Y, JIANG C. Efficient biosynthesis of γ-decalactone in ionic liquids by immobilized whole cells of Yarrowia lipolytica G3-3.21 on attapulgite[J]. Bioprocess and Biosystems Engineering,2015,38(10):2045−2052. doi: 10.1007/s00449-015-1431-6
[54] 赵玉萍, 徐岩, 王栋. 固定化耶氏酵母提高产γ-癸内酯能力[J]. 食品工业科技,2012,33(4):230−233. [ZHAO Y P, XU Y, WANG D. Production capacity of γ-decalactone increased by using immobilized Yarrowia sp J]. Science and Technology of Food Industry,2012,33(4):230−233.
[55] ZHAO C, GU D, NAMBOU K, et al. Metabolome analysis and pathway abundance profiling of Yarrowia lipolytica cultivated on different carbon sources[J]. Journal of Biotechnology,2015,206(20):42−51.
[56] NAMA S, REDDY L V, REDDY B V, et al. Improved production of γ-decalactone from castor oil by UV mutated yeast Sporidiobolus salmonicolor (MTCC 485)[J]. Bioscience Methods,2016(7):6.
[57] GOMES N, TEIXEIRA, JOSÉ A, et al. Empirical modelling as an experimental approach to optimize lactone production[J]. Catalysis Science & Technology,2011,1(1):86−92.







 下载:
下载:
 下载:
下载:
