Research Progress on the Effect of Ultrasonic Modification on Structures and Physicochemical Properties of Dietary Fibers
-
摘要: 天然植物源膳食纤维(dietary fiber,DF)含量丰富,对人体健康有重要生理功能,可溶性膳食纤维(soluble dietary fiber,SDF)作为DF的主要活性成分,其含量关系到DF的品质。天然植物源DF由于SDF含量少且物性差等问题,导致DF未能充分利用,限制了DF相关的功能性产品的开发应用。因此,迫切需要利用加工技术处理DF提高SDF含量,改善DF理化、结构特性。超声波技术作为一种高效且对环境友好的现代食品加工手段,可通过空化效应和机械效应等方式改变物料的结构、提高原料中DF含量,促进活性成分的溶出等,是提升产品加工特性和功能特性的有效方法,在DF的加工制备过程中被广泛应用。本文主要综述了超声波技术提高DF中SDF含量,并对超声波技术对DF的结构特性以及水合特性、吸附特性和黏性等理化特性的影响进行重点介绍。最后对现有研究中存在的问题进行分析总结,对未来研究趋势进行展望,为DF的深度开发应用提供理论依据。Abstract: Natural plant-derived dietary fiber (DF) is rich and has important physiological functions for human health. As the main active component of DF, the content of SDF is related to the quality of DF. Due to the low content of SDF and poor physical properties of natural plant DF, DF can not be fully utilized, which restricts the development and application of DF-related functional products. Therefore, it is urgent to use processing technology to treat DF to increase the content of SDF and improve the physicochemical and structural characteristics of DF. Ultrasonic technology, as an efficient and environmentally friendly modern food processing method, can change the structure of the material, improve yield of DF in raw material, and promote the dissolution of active ingredients by cavitation and mechanical effects. The ultrasonic technology is an effective method to improve the processing and functional characteristics of products, which is widely used in the preparation and modification of DF. This paper mainly reviews the improvement of SDF content in DF by ultrasonic technology, and focuses on the effect of ultrasonic technology on the structural characteristics, hydration characteristics, adsorption characteristics and viscosity of DF. Finally, the problems existing in the existing research are analyzed and summarized, and the future research trends are prospected to provide theoretical basis for the in-depth development and application of DF.
-
膳食纤维(dietary fiber,DF)是指不能被人体小肠消化吸收,可在大肠部分或全部发酵的可食用植物性成分、碳水化合物及其类似物质的总称[1],具有降低血液胆固醇水平[2],调节血糖[3],降低心脏病风险[4],调节肠道功能且防止便秘[3]等诸多功效,对维持机体正常生理功能具有重要作用。DF按其溶解性可分为水溶性膳食纤维(soluble dietary fiber,SDF)和水不溶性膳食纤维(insoluble dietary fiber,IDF)两大类,其中SDF主要包括果胶、树胶、半纤维素等亲水性物质;IDF主要包括纤维素、木质素和部分半纤维素等[5]。DF中SDF含量通常是评价DF品质优劣的重要指标,高品质DF中的SDF含量通常达到30%~50%,因而具有更加优良的加工特性、生理活性和保健功能[6]。但大多数天然DF中SDF含量较少(˂10%),无法满足膳食的平衡要求,因此,需要加工技术处理DF,使得IDF大分子的糖苷键断裂,致密的网状结构疏松,并促进IDF向SDF转化,提高SDF比例,改善DF品质。
超声波技术是一种高效且对环境友好的现代食品加工手段,作用于溶液时会产生空化效应,并进一步引起机械效应和自由基效应,在食品加工中可引发食品组分结构的变化[7]。超声可以根据应用分为不同的频率范围,包括高频低强度的非破坏性超声(˃1 MHz,˂1 W/cm−2),用于化合物的分析或表征以及食品理化特性(熟度、硬度、酸度、含糖量等)分析[8]。另一种是低频高强度超声(20~100 kHz,10~1000 W/cm−2),即功率超声。由于其对加工过程或产品的机械、化学或物理作用,已广泛应用于食品、农业和化工产业[9]。近年来,超声波由于操作简单,绿色高效,易实现自动化等诸多优点越来越受到人们的重视,可作为一种理想的非热加工方式应用于活性物质提取、制备等多方面[10]。此外,超声波技术常与酶法[10]、微波法[11]、化学法[12]等多种技术相结合,缩短处理时间,增强处理效果。目前,关于该技术对膳食纤维结构、理化特性的影响还未深入探究。本文就超声波对DF的提取、结构以及理化特性的影响进行综述,以期为DF的深度开发应用提供理论依据。
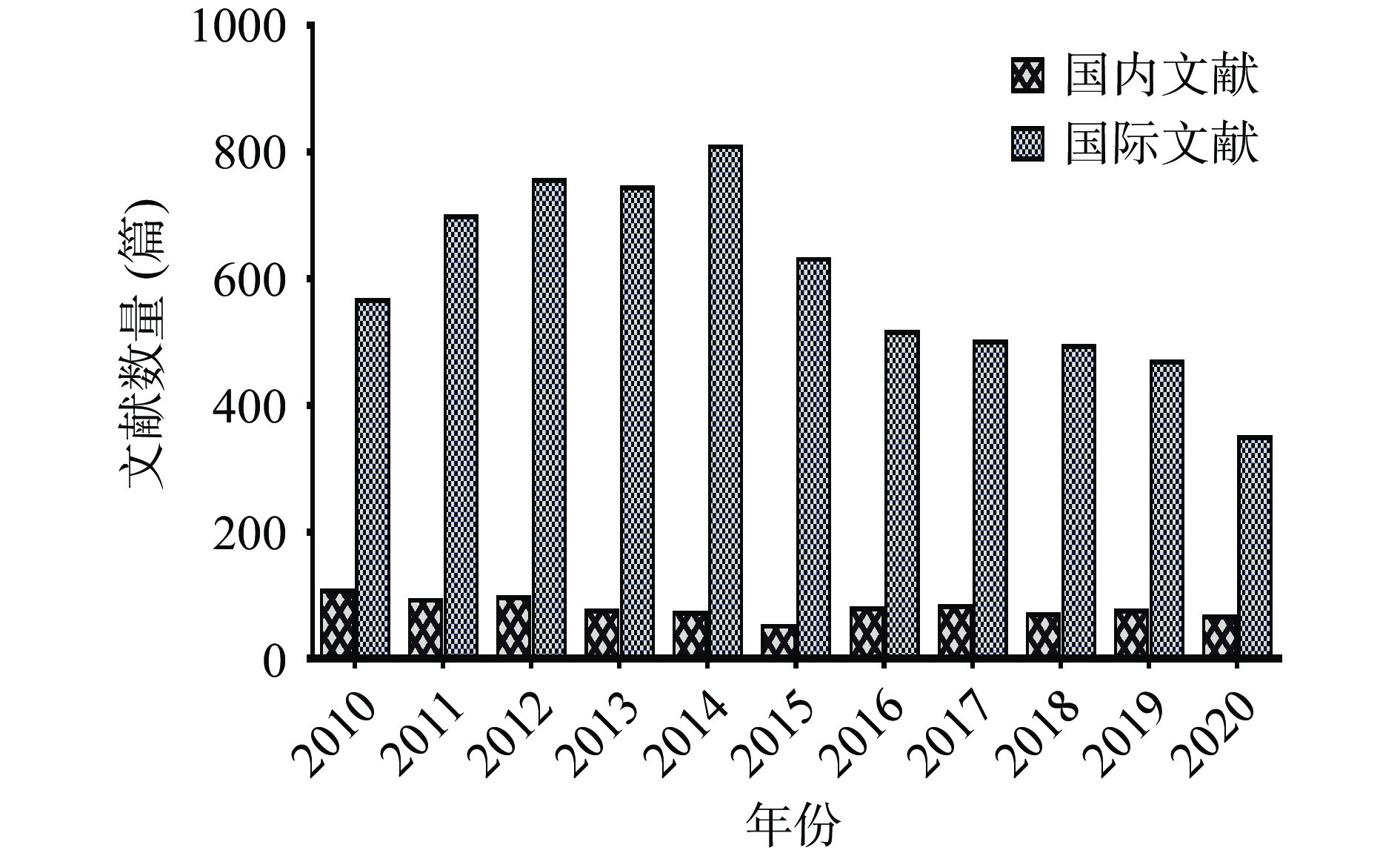
1. 超声波处理DF文献统计分析
通过CNKI、Web of Science等数据库对国内外近10年超声波处理DF相关文献进行统计,结果如图1所示。可以看出,近10年来,国内关于超声波的研究一直保持活跃,相关文献数量总体呈稳定趋势,但国内对超声波的应用及其对DF的功能开发与国际相比还存在一定差距。
2. 超声波处理对SDF含量的影响
可溶性膳食纤维含量高低是评价膳食纤维的重要指标,随着可溶性膳食纤维含量的增加,水合特性、流变特性等这些理化性质会随之改善,通常来说,可溶性膳食纤维含量在10%以上的具有更加优良的理化特性。超声波可通过在植物组织内部产生强烈的振动、高加速度和强大的气蚀破坏植物细胞,减少各组分间的密切连接,使植物组织结构变得疏松多孔,增强细胞质的释放、扩散和溶解,从而提高SDF的提取效率[8]。超声波常与其他物理、化学和酶法等联合使用,用于SDF的提取(表1),效果优于单一方法。Dong等[12]采用超声辅助酶法(超声功率500 W,处理温度65 ℃,处理25 min后,调节pH至4.9,添加纤维素酶0.2%(w/w),50 ℃孵育2 h)提取的咖啡皮SDF含量最高为13.04%,相比酸辅助酶法(0.1 mol/L HCl,固液比1:15 g/mL,60 ℃反应20 min后调节pH至4.9,添加纤维素酶0.2%(w/w),50 ℃孵育2 h)的11.38%,酶法(纤维素酶0.2%(w/w),50 ℃,pH4.9,孵育2 h)的9.54%和酸提取法(0.1 mol/L HCl,固液比1:15 g/mL,60 ℃,反应20 min)的9.16%,SDF含量显著提升(P˂0.05),这与超声的空化作用破坏了DF结构,增大了DF与酶接触的比表面积密切相关[13]。Gan等[11]的研究中也有类似结果,超声-微波法(微波功率500 W,温度80 ℃,处理40 min后,超声功率200 W,温度25 ℃,处理10 min)处理后的柚皮SDF含量为8.35%,显著高于微波法(微波功率500 W,温度80 ℃,处理40 min,SDF含量为7.94%)处理和未处理组(SDF含量为3.62%)(P˂0.05),原因可能是超声处理能增加细胞内压力,使细胞壁破裂,释放更多的活性成分。
表 1 DF的提取方法Table 1. Extraction method of DF纤维来源 提取方法 提取工艺 SDF含量 参考文献 咖啡皮 超声辅助酶法 超声功率500 W,处理温度65 ℃,处理25 min后,调节pH至4.9,
添加纤维素酶0.2%(w/w),50 ℃孵育2 h13.40% Dong等[12] 柚皮 超声-微波法 微波功率500 W,温度80 ℃,处理40 min后,超声功率200 W,温度25 ℃,处理10 min 8.35% Gan等[11] 木瓜皮 超声辅助
碱提取法料液比1:16.55(w/w),超声功率175 W,超声时间30.76 min 36.99% Zhang等[14] 玉米芯 超声-碱解法 液料比37:1(mL/g),碱浓度0.88%,提取温度41 ℃,提取时间20.30 min,超声功率800 W 23.11% 张晓龙等[15] 甘薯渣 超声辅助酶法 料液比1:50,超声功率400 W,超声时间10 min,纤维素酶用量3 μL·g−1,酶解温度65 ℃ 13. 49% 孙健等[16] 香芋皮 超声-微波辅助法 超声功率327 W,微波功率40 W,料液比1:38 g/mL,提取时间12 min 18.58% 陈嫣等[17] 黄皮果肉 超声-微波协同辅助酶法 料液比1:23 g/mL,超声时间25 min,超声功率280 W,纤维素酶用量0.64% 12.55% 文攀等[18] 3. 超声波处理对DF结构的影响
DF独特的结构特性与其复杂多样的物化及功能特性紧密相关[19],超声波技术作为一种物理处理手段,可以机械振动形式在液体介质中产生瞬时强压、强剪切力和局部高温,打断DF长分子链,改变DF单糖含量、粒度和分子聚集状态,从而改变DF的空间结构及分子间作用力,进而影响DF的水合性、吸附性和黏性等理化特性[8]。
3.1 粒径
DF的粒径受加工和消化过程的影响,同时粒径对DF理化特性也有较大影响[1]。牛希等[20]研究发现,燕麦DF经240 W超声处理30 min后,粒径从1281.34 nm减小至300~800 nm,表面结构出现疏松多孔特征,表明超声的空化、剪切等物理作用使得大粒径燕麦DF破坏,粒径减少,随着功率增加至360 W,膳食纤维结构破坏增加,粒径进一步变化(13.55~955.41 nm)。胡筱等[21]研究发现,葵花粕经100 W的超声波处理1 h后,SDF粒径(40.14±1.55 μm)高于处理前(39.50±3.22 μm),可能是SDF发生了部分团聚使得粒径略增。Fan等[22]研究了不同超声强度(0、1、2、3、4和5 W/mL)对豆渣DF粒径的影响,发现当超声强度由0增加到1 W/mL时,豆渣DF粒径略微减小;随着强度增加到4 W/mL,DF的粒径则由79.76 µm骤降到53.96 µm(P˂0.05),表明低超声强度(1 W/mL)对豆渣DF粒径几乎无影响,而高超声强度(4 W/mL)具有更强的空化效应和机械应力;随着超声强度继续增加到5 W/mL,豆渣薄壁组织变形,但DF粒径并未继续减小,可能是此时形成的高黏度DF悬液加强了DF颗粒间的相互作用力,阻碍DF粒径变小。此外,DF的粒度是决定其性能和应用的重要因素[23]。有研究表明,随着豆渣DF粒径的减小(66.7 mm~544.3 nm),其明度和白度显著提升(P˂0.05),Zeta电位持续下降(P˂0.05),膨胀力,水溶性指数和表观黏度显著上升(P˂0.05),有助于在色泽鲜艳、保水率高、低热量的食品中应用[24]。因此,通过超声波处理调节膳食纤维的粒径,进而改善膳食纤维的分子特性,可拓展膳食纤维的应用范围。
3.2 分子量
DF分子量的测定是研究DF功能特性的重要指标[25],研究表明,小分子多糖具有良好的生理活性功能(抑菌性、抗氧化性等)[25-27]。当考虑重均分子量(MW)时,分子量越小,聚合度越低,溶解度越好,黏度越低[28]。重均分子量与数均分子量(Mn)之比(MW/Mn)代表分子量分散系数,可作为样品分子量分布是否均匀的指标,分散系数越小,样品分子量分布越均匀[29]。Shen等[25]采用超声-微波(功率450 W,时间30 min)协同处理黑豆皮(固液比1:40 g/mL),处理后SDF的平均分子量降低了33.21%,表明处理黑豆皮中SDF的分子量发生变化,这可能是因为超声波处理使细胞壁破裂更彻底,SDF溶解更彻底。通常,超声处理后DF分子内部会暴露更多水结合位点和其他极性基团;此外,超声波的空化效应形成瞬间高压,会连续不断冲击破碎DF组织,使得水分更易进入DF内部,表现出更强的水合特性[30]。此外,超声极大程度上破坏了DF糖苷键及多糖链内与链间的氢键作用,使分子量降低,聚合度变小,也为超声处理后DF持水力、膨胀力和持油力的改善提供了理论依据。
3.3 比表面积
通常,物料的比表面积与粒径成反比,超声波处理能有效减小物料粒径,提高物料的比表面积和吸附能力[31]。活性炭在15 wt% H3PO4溶液中浸润45 min后,20 kHz超声处理5 min,发现超声振动效应促进了活性炭表面扩大和孔洞发育,在非空化状态下,中孔(20~500 Å)孔容(孔体积和中孔粒径分布)提高60%~100%;超声空化效应也促进了活性炭孔结构(比表面积和微孔体积)发育,减小了活性炭粒径[31]。此外,声化反应几乎与空化同时发生,在此过程中,通过分解水和氧产生的羟自由基、过氧化氢和其他氧化剂,促进了H3PO4对活性炭中纤维素、木质素等生物聚合物的水解[32-33],进而促进了活性炭孔结构(比表面积和微孔体积)发育。然而,过度的空化会导致活性炭孔隙率降低,可能是由于过量的空化气泡附着在活性炭表面[34],阻碍了活性炭与H3PO4的接触。胡筱等[21]研究发现,葵花粕经100 W的超声波处理1 h后,SDF表面疏松,凹凸不平,部分出现裂缝,呈现出一定的水合特性,而经超声波处理的SDF表面明显平整,出现孔洞结构,比表面积增大,这也为持水力、结合水力和持油力的增加提供了结构基础。张艳等[35]研究发现,将新鲜、干制和冷冻方竹笋DF按照料液比1:10(g/mL),超声波频率25 kHz,功率100 W的条件室温处理1 h,结果显示超声波处理使新鲜方竹笋DF的蜂窝结构更加密集,干制和冷冻方竹笋DF则呈现疏松多孔结构,这也进一步增加了方竹笋DF的比表面积。Huang等[13]在超声功率535 W,作用时间41 min,初始温度45 ℃的条件下对大蒜秸秆IDF进行处理,发现未经处理的IDF表面较光滑平坦,经超声处理后IDF具有明显的蜂窝结构特征,且表面呈现更多的裂纹和孔洞,比表面积增大,可能是由于超声处理的纤维素、木质素及其内部糖苷键被破坏所致。Minjares-Fuentes等[36]利用超声(强度0.05 W/mL)辅助碱处理提取葡萄渣中半纤维素,发现未处理样品与碱处理(20 ℃,60 min)葡萄渣半纤维素表面形态无明显差异;而超声波辅助碱处理样品60 min后,葡萄渣半纤维素表面出现明显断裂,比表面积增大。超声波处理可通过加强植物细胞壁中间层纤维物质的水合作用,强化细胞壁的膨胀和软化过程,加速植物组织细胞破碎,使其比表面积和传质速率显著增加,进而充分释放DF等功能活性成分[37]。比表面积大的物料可有效增加与客体分子的接触面积,暴露更多的反应位点,提升反应效率[38]。超声波处理通过破坏膳食纤维空间结构提高DF的比表面积,使其呈现裂纹和孔洞的疏松结构,这为提升膳食纤维的功能提供重要结构基础。
3.4 孔洞结构
物料孔洞结构的维持依赖于高分子链间不同强度的化学键及物理相互作用,而超声处理过程往往伴随大分子骨架的断裂,部分不溶性成分转变成可溶性成分以及致密的空间结构转变为疏松结构[39]。Izadifar[40]采用84 W的24 kHz超声对小麦干酒糟(wheat dried distiller’s grain,DDG)超声处理30 s,样品比表面积和孔容积分别增至18.847 m2/g和0.016 cm3/g,较处理前分别提升35.5%和33.3%(P˂0.05),表明超声处理能有效促进DDG孔隙发育和植物细胞壁损伤;超声处理前后样品细胞壁孔径主要为中孔(27.34~34.31 Å),随着超声功率(处理20 min内)增加,DDG的总孔容积随之增大,表明超声对样品的力学效应主要表现为中孔范围内孔容积增大,且高功率和超短时间(100%功率,30 s)的能耗较低功率和长超声时间(20%功率,20 min)更少。此外,超声处理后孔体积、比表面积增大,可提高酚类化合物的提取产量和效率(14%以上),证明超声处理有助于天然化合物的提取。Fan等[22]利用超声处理豆渣,初始豆渣DF呈块状,表明光滑,质地致密,无明显碎片;当超声强度为2 W/mL时,豆渣DF呈不规则的块状结构,排列紧密;随着强度继续增加,DF则产生明显的蜂窝样结构,此时薄壁组织完整;当超声强度为4 W/mL时,薄壁组织变得致密,沙漏结构断裂;而当超声强度达到5 W/mL,薄壁组织变形,DF解体。因此,DF孔洞结构的成型受超声功率和DF来源的影响,低功率超声处理仅分解块状结构,高功率超声处理可使DF结构和成分一定程度上分解,功率过高或过低都不利于孔洞结构的形成。
3.5 官能团
DF富含羧基和羟基类侧链基团,可对矿物质元素和电解质(尤其是重金属离子)产生吸附作用[41]。Huang等[13]在超声功率535 W,作用时间41 min,初始温度45 ℃的条件下对大蒜秸秆IDF进行处理,经红外光谱分析发现超声处理IDF在2320 cm−1处出现了一个新的峰,具有三键化合物的特征,表明其脱氢是由超声波诱发的。从超声处理后峰位的变化可以看出,超声可以破坏分子内的化学键,导致有机分子的破坏,增加亲水基团和水结合位点,减小粒径。此外,超声波处理天然纤维素后,纤维素I(1430 cm−1处)的特征峰会向低波数方向移动,纤维素II结晶变体出现,表明超声波处理改变了纤维素的结晶度和晶格结构,处理时间延长,会加剧这种结晶结构的转变[42]。此外,超声处理也会增强-OH、C-H、C-O、C=C和C=O键的吸收峰强度。然而,超声功率、作用时间以及DF来源不同,超声处理对DF的作用效果也不尽相同。经超声处理(100 W,20 min)前后的大蒜秸秆SDF红外光谱相重叠,表明在处理过程中,SDF的官能团和化学结构没有变化[43]。同时,超声处理后糖苷键的破坏可导致SDF的黏度和粒径降低,这可能是自由基或空化效应引起的[43]。总的来说,DF经一定强度的超声处理后红外光谱特征吸收峰的强度有较明显变化,DF各组分重新分布,促使部分IDF向SDF转化。
3.6 晶体结构
X射线衍射(X-ray diffraction,XRD)是评价DF结晶特性的有效方法。晶体纤维素具有明显的XRD峰,具有延伸的晶线和完整的晶面;非晶区由非晶纤维素、半纤维素和木质素组成[44],通常采用非线性多峰拟合函数对X射线衍射图谱进行分峰拟合,评价DF的结晶度指数。万苗苗[45]采用超声辅助EDTA酸提法(超声功率850 W,超声时间79 min,EDTA含量0.25%,pH1.0,固液比1:25 g/mL),微波辅助EDTA酸提法(微波功率550 W,微波时间125 s,EDTA含量0.25%,pH1.0,固液比1:25 g/mL),EDTA辅助酸提法(EDTA含量0.25%,pH1.0,固液比1:30 g/mL,提取温度90 ℃,提取时间90 min)提取柚皮果胶,XRD结果显示,EDTA辅助酸提法和微波辅助EDTA酸提法提取的果胶分别在21°、22°和23°处有强衍射峰,在16°附近有弱衍射峰,表明这两种方法提取的果胶存在部分结晶现象。超声辅助EDTA酸提法提取的果胶没有明显衍射峰,可能是由于超声波的机械和空化作用破坏了果胶的晶体结构。其余不规则峰可能是由于果胶提取过程中变性所致[24],此外,超声辅助EDTA酸提法提取的果胶溶解度最佳(6 h),说明DF的溶解度与结晶度有关,结晶度越高,晶体类型越多,溶解性越差[46]。
4. 超声波处理对DF理化特性的影响
DF的理化特性与其结构特性密切相关,研究DF理化特性与结构之间的关系则为进一步解析DF构效关系提供理论基础[46]。目前DF的理化特性研究主要集中在水合特性、黏性、酶解发酵特性和吸附特性等。
4.1 水合特性
DF结构中存在大量羟基、羧基等亲水基团,使DF具备较强的水合特性(持水力、吸附力和膨胀力)[47-48]。DF水合特性的提高有助于减轻肠道内压力,提高机体排便速度,加速胃肠道内毒物排出,起到预防结肠癌的作用[49-50]。超声波处理DF过程中,空穴效应产生的瞬时高压会不断冲击DF,使得DF粒度减小,比表面积增大,细胞结构疏松,大量亲水基团暴露,水合特性得到强化[51]。牛希等[20]研究发现,燕麦DF经240 W超声处理30 min后,相比对照组,燕麦膳食纤维持水力、膨化力和持油力分别提高8%,52.58%和6.8%(P˂0.05);随着功率增加至360 W,持水力、膨化力和持油力也随之增加,相比对照组分别提高20.16%、155.57%和21.98%(P˂0.05)。胡筱等[21]研究发现,葵花粕经100 W的超声波处理1 h后,与未处理SDF相比,改性后SDF的持水力、结合水力和持油力分别增加了3.09%、17.56%、23.73%。Fan等[22]利用超声波对豆渣DF进行处理,随着超声功率密度从0 W/mL提高到4 W/mL,持水力则从4.20±0.06 g/100 g提升到最高值16.36±1.06 g/100 g(P˂0.05)。Zhang等[14]采用超声辅助碱性提取法(料液比1:16.55(w/w),超声功率175 W,超声时间30.76 min)提取木瓜皮中SDF,发现超声辅助碱性提取法所得SDF的持水力(5.26±0.15 g/g)显著高于碱性提取法(4.93±0.10 g/g)(P˂0.05),可能是由于超声辅助碱处理破坏了DF的三维孔洞结构,降低了DF的碳链长度,增大了DF的表面积。超声处理后的DF分子间作用力减弱,使得DF组织结构松散,溶液更容易进入DF内部,进而提高DF的保水性[52]。
4.2 黏性
黏性是DF重要的理化特性,反映了DF的吸水和凝胶能力[24]。SDF通常具有良好的黏性,能形成高黏度的溶液,可用来改善饮料的黏度和稳定性,提高乳制品的保健功能和应用范围[53]。此外,机体摄入SDF,也可提高小肠内容物的黏度,起到阻碍葡萄糖吸收,控制餐后血糖升高和预防糖尿病的作用[54]。Fan等[22]通过超声波对豆渣DF进行处理,发现处理后豆渣DF悬液表现出独特的多糖剪切稀释现象,在一定超声功率范围内(0~4 W/mL),功率增加,豆渣DF悬液的表观黏度值也会增加,可能是由于超声处理后豆渣DF微粒数量增加,导致溶液更粘稠。通常,DF比表面积随着粒径的减小而增大,提升的比表面积可提供更多的吸附位点和空间,从而产生流动阻力[55]。Huang等[43]通过聚能超声波(100 W,20 min,25 ℃)处理大蒜秸秆SDF,发现在高黏度、低剪切速率条件下,SDF表现出典型的剪切稀化特性(假塑性),而流变性通常与分子量和取代基的分布等结构参数有关。相比对照组,超声处理后的SDF黏度从0.037 Pa·s显著降低至0.010 Pa·s(10 s−1的剪切速率)(P˂0.05),其原因可能是超声处理引起的SDF粒径减小或颗粒形状的改变。Encalada等[56]采用高能超声(超声强度10 W/cm2,料液比1:40 g/mL,处理时间20 min)处理胡萝卜冻干粉,随后加入0.1 mol/L Na2CO3能够在1 h内以低溶液体积(1:60 g/mL)从胡萝卜冻干粉中提取14%的果胶,得到三个低分子量的果胶组分(119240、45266、35940 Da)剪切稀化前在水中表现出较高的牛顿黏性,并制备出弹性模量较低的钙交联凝胶(G=12 Pa),表明超声处理能够破坏原料基质,促进聚合物释放,有效提取富含果胶的组分,且平均分子量的改变可能是影响果胶黏度的直接原因。由于超声处理后DF形成的中空孔洞结构,可使DF迅速膨胀增稠而溶于水,易分散,不成团,因此超声处理后DF是种潜在的增稠保水剂。
4.3 酶解发酵性
由于DF不能被机体中的消化酶水解,但能够被微生物部分酵解和利用[56],因此,为了提高机体肠道菌群对DF的利用效率,可采用超声波对DF进行预处理,使得DF结构疏松,有机大分子转变成小分子物质,有利于DF进一步发酵和降解。粉碎研磨后的木屑可采用纤维素酶酶解,然而水解过程相当缓慢,且水解过程中积累的糖量不足以发酵[57]。超声波可有效破坏植物组织结构,提高酶与底物的接触面积。通过对木屑进行超声波处理,发现高强度超声(10 W/g木屑)可导致木屑结构的破坏和暴露面积增加,通过增加底物的比表面积以及酶与底物复合物的接触位点来提高DF的降解速率[43,58]。此外,超声波(功率:10 W/g木屑,5~10 min)处理与两级研磨(400 r/min)相结合后,酶解效率最高,此时葡萄糖含量(35.5 g/L−1葡萄糖)比对照组增加了2倍[57]。因此,超声波处理可破坏木质纤维素结构,提高底物与酶的接触面积,提升DF的酶解速率。
4.4 吸附性
DF分子表面存在大量活性基团,可以吸附胆固醇、胆汁酸、亚硝酸根和一些致病毒素从而抑制机体的吸收,一些有毒和致癌的物质也可以被DF吸附并排出体外[1,53]。超声波处理对DF吸附特性的影响如表2所示。Huang等[13]对大蒜秸秆IDF进行超声处理,在超声功率535 W、超声时间41 min和初始温度45 ℃条件下,处理后IDF的胆固醇结合力和持油力分别为16.75 mg/g和10.56 g/g,比未处理的IDF分别提高了58.2%和17.9%(P<0.05)。超声处理后IDF具有良好的孔隙率、更小的粒径和更大的表面积,这也赋予了IDF更强的吸附和结合能力。此外,小鼠饲喂8周含Cd2+(100 mg/L)的低DF饲粮,发现饲粮中添加麦麸DF(100 g/kg)能吸附大部分Cd2+,恢复小鼠细胞的体外生长速度。与单纯摄入Cd2+的模型组小鼠相比,饲喂麦麸DF能有效防止Cd2+进入小鼠器官,降低肠道对Cd2+的吸收,消除Cd2+对肠道菌群的毒性,恢复肠道菌群结构。因此,DF可作为一种食物补充成分,对抗重金属毒性[54]。
表 2 超声波处理对DF结构、理化特性以及吸附特性的影响Table 2. Effects of ultrasonic treatment on structure, physicochemical properties and adsorption properties of DF纤维来源 提取方法 提取工艺 结构变化 特性变化 参考文献 大蒜秸秆 超声波 超声功率535 W,处理时间41 min,
处理温度45 ℃形成蜂窝状结构,
亲水基团增加持油力,胆固醇和葡萄糖
结合力显著提升Huang等[13] 大蒜秸秆 聚能超声波 超声功率100 W,处理时间20 min SDF降解为细小颗粒,但未改变SDF一级结构 持水力、持油力、膨胀力和胆固醇
结合力显著提升,葡萄糖吸附力
显著下降Huang等[43] 枳壳 超声高压辅助提取法 超声功率330 W,处理温度68 ℃,
处理时间22 min具有多糖典型特性,
呈半晶体状态黏度增加,Fe2+螯合能力增强 Yang等[46] 青稞 超声辅助酶法 pH4.8,250 U/g纤维素酶,酶解温度43.7 ℃,酶解时间120 min;超声功率300 W,处理时间30 min DF结构破坏,表面疏松多孔,
比表面积增大持水力、持油力、膨胀力和葡萄糖吸附能力显著提升 王彪[59] 西番莲果皮 超声辅助酶法 料液比1:26 g/mL,超声功率250 W处理30 min后加入0.6%的混合酶(淀粉酶:木瓜蛋白酶=1:1),酶解
温度70 ℃处理1 h堆积密度减小,结构疏松,比表面积增大,具有多糖
典型特性溶胀性和持水力显著增加,饱和脂肪酸和不饱和脂肪酸结合力有提升趋势,在胃肠道环境下对胆固醇吸附能力均显著提升 李晗等[60] 由此可见,膳食纤维的理化特性研究主要集中在水合特性、黏性、酶解发酵特性和吸附特性等,而这些理化特性与纤维的比表面积、粒径、亲水基团以及孔洞结构密切相关。超声波处理可通过空化效应等调节膳食纤维的比表面积、粒径以及亲水基团的暴露和孔洞结构的形成,进而改善膳食纤维的理化特性。
5. 结语及展望
超声波处理DF作为一种公认的高效、高利用率、便捷、绿色无污染的物理处理方法,通过调控超声功率及其处理条件,可使生物聚合物的微观结构朝预期转变。因此,超声被认为是改善和微调生物聚合物的结构、疏水性以及改变其尺寸、分子量、结构特性以及生物活性的有效物理工具。目前研究主要集中于超声处理对不同来源DF的辅助提取以及超声处理后对DF的影响等,在食品与健康领域尚缺乏深入、系统研究。
为提高DF理化性质,拓宽其应用领域,今后对超声波处理DF理化性质与结构影响的研究应重点关注以下三个方面:首先,开展DF经超声处理后,其理化性质如黏性、吸附性等在不同pH、温度和溶剂等条件下的变化规律研究;其次,建立DF理化特性与结构关系的数学模型,解析DF理化特性与构象间的关系;最后,加强DF在人与动物不同生长阶段的应用研究,探索最适的添加水平和营养配方,明确DF的在体功能及其作用机制。
-
表 1 DF的提取方法
Table 1 Extraction method of DF
纤维来源 提取方法 提取工艺 SDF含量 参考文献 咖啡皮 超声辅助酶法 超声功率500 W,处理温度65 ℃,处理25 min后,调节pH至4.9,
添加纤维素酶0.2%(w/w),50 ℃孵育2 h13.40% Dong等[12] 柚皮 超声-微波法 微波功率500 W,温度80 ℃,处理40 min后,超声功率200 W,温度25 ℃,处理10 min 8.35% Gan等[11] 木瓜皮 超声辅助
碱提取法料液比1:16.55(w/w),超声功率175 W,超声时间30.76 min 36.99% Zhang等[14] 玉米芯 超声-碱解法 液料比37:1(mL/g),碱浓度0.88%,提取温度41 ℃,提取时间20.30 min,超声功率800 W 23.11% 张晓龙等[15] 甘薯渣 超声辅助酶法 料液比1:50,超声功率400 W,超声时间10 min,纤维素酶用量3 μL·g−1,酶解温度65 ℃ 13. 49% 孙健等[16] 香芋皮 超声-微波辅助法 超声功率327 W,微波功率40 W,料液比1:38 g/mL,提取时间12 min 18.58% 陈嫣等[17] 黄皮果肉 超声-微波协同辅助酶法 料液比1:23 g/mL,超声时间25 min,超声功率280 W,纤维素酶用量0.64% 12.55% 文攀等[18] 表 2 超声波处理对DF结构、理化特性以及吸附特性的影响
Table 2 Effects of ultrasonic treatment on structure, physicochemical properties and adsorption properties of DF
纤维来源 提取方法 提取工艺 结构变化 特性变化 参考文献 大蒜秸秆 超声波 超声功率535 W,处理时间41 min,
处理温度45 ℃形成蜂窝状结构,
亲水基团增加持油力,胆固醇和葡萄糖
结合力显著提升Huang等[13] 大蒜秸秆 聚能超声波 超声功率100 W,处理时间20 min SDF降解为细小颗粒,但未改变SDF一级结构 持水力、持油力、膨胀力和胆固醇
结合力显著提升,葡萄糖吸附力
显著下降Huang等[43] 枳壳 超声高压辅助提取法 超声功率330 W,处理温度68 ℃,
处理时间22 min具有多糖典型特性,
呈半晶体状态黏度增加,Fe2+螯合能力增强 Yang等[46] 青稞 超声辅助酶法 pH4.8,250 U/g纤维素酶,酶解温度43.7 ℃,酶解时间120 min;超声功率300 W,处理时间30 min DF结构破坏,表面疏松多孔,
比表面积增大持水力、持油力、膨胀力和葡萄糖吸附能力显著提升 王彪[59] 西番莲果皮 超声辅助酶法 料液比1:26 g/mL,超声功率250 W处理30 min后加入0.6%的混合酶(淀粉酶:木瓜蛋白酶=1:1),酶解
温度70 ℃处理1 h堆积密度减小,结构疏松,比表面积增大,具有多糖
典型特性溶胀性和持水力显著增加,饱和脂肪酸和不饱和脂肪酸结合力有提升趋势,在胃肠道环境下对胆固醇吸附能力均显著提升 李晗等[60] -
[1] QIAO H, SHAO H, ZHENG X, et al. Modification of sweet potato (Ipomoea batatas Lam.) residues soluble dietary fiber following twin-screw extrusion[J]. Food Chemistry,2021,335:1−10.
[2] LAGE N N, DE FREITAS C M M, GUERRA J F C, et al. Jaboticaba (Myrciaria cauliflora) peel supplementation prevents hepatic steatosis through hypolipidemic effects and cholesterol metabolism modulation in diet-induced NAFLD rat model[J]. Journal of Medicinal Food,2021,1:1−10.
[3] LIU H F, ZENG X Y, HUANG J Y, et al. Dietary fiber extracted from pomelo fruitlets promotes intestinal functions, both in vitro and in vivo[J]. Carbohydrate Polymers,2021,252(15):1−10.
[4] SOLIMAN G. Dietary fiber, atherosclerosis, and cardiovascular disease[J]. Nutrients,2019,5(11):1−11.
[5] CHEN H H, ZHAO C M, LI J, et al. Effects of extrusion on structural and physicochemical properties of soluble dietary fiber from nodes of lotus root[J]. LWT-Food Science and Technology,2018,93:204−211. doi: 10.1016/j.lwt.2018.03.004
[6] 乔汉桢, 刘佳琪, 许雯雯, 等. 甘薯渣膳食纤维的制备及改性工艺研究进展[J]. 饲料研究,2019,42(7):89−94. [QIAO H Z, LIU J Q, XU W W, et al. Preparation and modification of dietary fiber from sweet potato residues[J]. Feed Research,2019,42(7):89−94. QIAO H Z, LIU J Q, XU W W, et al. Preparation and modification of dietary fiber from sweet potato residues[J]. Feed Research, 2019, 42(7): 89-94.
[7] WANG X M, MAJZOOBI M, FARAHNAKY A. Ultrasound-assisted modification of functional properties and biological activity of biopolymers: A review[J]. Ultrasonics Sonochemistry,2020,65:1−37.
[8] MARTINEZ-SOLANO K C, GARCIA-CARRERA N A, TEJADA-ORTIGOZA V, et al. Ultrasound application for the extraction and modification of fiber-rich by-products[J]. Food Engineering Reviews,2020,11:1−20.
[9] ZHOU C S, YU X J, MA H L, et al. Examining of athermal effects in microwave-induced glucose/glycine reaction and degradation of polysaccharide from Porphyra yezoensis[J]. Carbohydrate Polymers,2013,97(1):38−44. doi: 10.1016/j.carbpol.2013.04.033
[10] UMEGO E C, HE R H, REN W B, et al. Ultrasonic-assisted enzymolysis: Principle and applications[J]. Process Biochemistry,2021,100:59−68. doi: 10.1016/j.procbio.2020.09.033
[11] GAN J P, HUANG Z Y, YU Q, et al. Microwave assisted extraction with three modifications on structural and functional properties of soluble dietary fibers from grapefruit peel[J]. Food Hydrocolloids,2020,101:1−40.
[12] DONG W J, WANG D D, HU R S, et al. Chemical composition, structural and functional properties of soluble dietary fiber obtained from coffee peel using different extraction methods[J]. Food Research International,2020,6(13):1−32.
[13] HUANG L R, DING X N, ZHAO Y S, et al. Modification of insoluble dietary fiber from garlic straw with ultrasonic treatment[J]. Journal of Food Processing and Preservation,2018,42(1):1−8.
[14] ZHANG W, ZENG G, PAN Y, et al. Properties of soluble dietary fiber-polysaccharide from papaya peel obtained through alkaline or ultrasound-assisted alkaline extraction[J]. Carbohydrate Polymers,2017,172:102−112. doi: 10.1016/j.carbpol.2017.05.030
[15] 张晓龙, 田亚红, 常丽新, 等. 响应面优化超声-碱解法提取玉米芯中可溶性膳食纤维的工艺[J]. 食品工业科技,2014,35(12):262−267. [ZHANG X L, TIAN Y H, CHANG L X, et al. Ultrasonics-alkali extraction technology of soluble dietary fiber from corn cob by response surface method[J]. Science and Technology of Food Industry,2014,35(12):262−267. doi: 10.13386/j.issn1002-0306.2014.12.049 ZHANG X L, TIAN Y H, CHANG L X, et al. Ultrasonics-alkali extraction technology of soluble dietary fiber from corn cob by response surface method[J]. Science and Technology of Food Industry, 2014, 35(12): 262-267. doi: 10.13386/j.issn1002-0306.2014.12.049
[16] 孙健, 钮福祥, 岳瑞雪, 等. 超声波辅助酶法提取甘薯渣膳食纤维的研究[J]. 核农学报,2014,28(7):1261−1266. [SUN J, NIU F X, YUE R X, et al. Extraction of dietary fiber from sweet potato residues by enzymatic hydrolysis method assisted by ultrasonic technology[J]. Journal of Nuclear Agricultural Sciences,2014,28(7):1261−1266. doi: 10.11869/j.issn.100-8551.2014.07.1261 SUN J, NIU F X, YUE R X, et al. Extraction of dietary fiber from sweet potato residues by enzymatic hydrolysis method assisted by ultrasonic technology[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(7): 1261-1266. doi: 10.11869/j.issn.100-8551.2014.07.1261
[17] 陈嫣, 段振华, 刘艳, 等. 超声波-微波辅助提取香芋皮水溶性膳食纤维工艺[J]. 食品工业,2020,41(12):12−15. [CHEN Y, DUAN Z H, LIU Y, et al. Optimization of ultrasonic-microwave assisted extraction of soluble dietary fiber from taro (Colocasia esculenta) peels[J]. The Food Industry,2020,41(12):12−15. CHEN Y, DUAN Z H, LIU Y, et al. Optimization of ultrasonic-microwave assisted extraction of soluble dietary fiber from taro (Colocasia Esculenta) peels[J]. The Food Industry, 2020, 41(12): 12-15.
[18] 文攀, 裴志胜, 朱婷婷, 等. 黄皮果肉可溶性膳食纤维制备工艺优化及单糖组成和结构表征[J]. 食品工业科技,2020,41(21):29−36. [WEN P, PEI Z S, ZHU T T, et al. Preparation technology optimization of soluble dietary fiber and its structure characterization and composition of monosaccharide from Clausena lansium sarcocarp[J]. Science and Technology of Food Industry,2020,41(21):29−36. WEN P, PEI Z S, ZHU T T, et al. Preparation technology optimization of soluble dietary fiber and its structure characterization and composition of monosaccharide from Clausena lansium sarcocarp[J]. Science and Technology of Food Industry, 2020, 41(21): 29-36.
[19] MENG X H, WU C C, LIU H Z, et al. Dietary fibers fractionated from gardenia (Gardenia jasminoides Ellis) husk: Structure and in vitro hypoglycemic effect[J]. Journal of the Science of Food and Agriculture,2021,10:1−33.
[20] 牛希, 史乾坤, 赵城彬, 等. 超声改性对燕麦膳食纤维理化性质及结构的影响[J]. 食品科学,2020,41(23):1−11. [NIU X, SHI Q K, ZHAO C B, et al. Effect of ultrasonic modification on physicochemical properties and structure of oat dietary fiber[J]. Food Science,2020,41(23):1−11. doi: 10.7506/spkx1002-6630-20200418-237 NIU X, SHI Q K, ZHAO C B, et al. Effect of ultrasonic modification on physicochemical properties and structure of oat dietary fiber[J]. Food Science, 2020, 41(23): 1-11. doi: 10.7506/spkx1002-6630-20200418-237
[21] 胡筱, 潘浪, 朱平平, 等. 超声波改性对葵花粕膳食纤维性质与结构的影响[J]. 中国食品学报,2019,19(11):88−99. [HU X, PAN L, ZHU P P, et al. Effects of ultrasonic modification on the properties and structure of dietary fiber in sunflower meal[J]. Journal of Chinese Institute of Food Science and Technology,2019,19(11):88−99. HU X, PAN L, ZHU P P, et al. Effects of ultrasonic modification on the properties and structure of dietary fiber in sunflower meal[J]. Journal of Chinese Institute of Food Science and Technology, 2019, 19(11): 88-99.
[22] FAN X J, CHANG H D, LIN Y N, et al. Effects of ultrasound-assisted enzyme hydrolysis on the microstructure and physicochemical properties of okara fibers[J]. Ultrasonics Sonochemistry,2020,69:1−34.
[23] ULLAH I, HU Y, YOU J, et al. Influence of okara dietary fiber with varying particle sizes on gelling properties, water state and microstructure of tofu gel[J]. Food Hydrocolloids,2019,89:512−522. doi: 10.1016/j.foodhyd.2018.11.006
[24] ULLAH I, YIN T, XIONG S, et al. Structural characteristics and physicochemical properties of okara (soybean residue) insoluble dietary fiber modified by high-energy wet media milling[J]. LWT-Food Science and Technology,2017,82:15−22. doi: 10.1016/j.lwt.2017.04.014
[25] SHEN M, WEIHAO W H, CAO L K. Soluble dietary fibers from black soybean hulls: Physical and enzymatic modification, structure, physical properties, and cholesterol binding capacity[J]. Journal of Food Science,2020,85(6):1668−1674. doi: 10.1111/1750-3841.15133
[26] ZHANG L, MA L, PAN Y P, et al. Effect of molecular weight on the antibacterial activity of polysaccharides produced by Chaetomium globosum CGMCC 6882[J]. International Journal of Biological Macromolecules,2021,188:863−869. doi: 10.1016/j.ijbiomac.2021.08.059
[27] HU X L, WANG K L, YU M, et al. Characterization and antioxidant activity of a low-molecular-weight xanthan gum[J]. Biomolecules,2019,9(11):1−12.
[28] 曹龙奎, 康丽君, 寇芳, 等. 改性前后小米糠膳食纤维结构分析及体外抑制α-葡萄糖苷酶活性[J]. 食品科学,2018,39(11):46−52. [CAO L K, KANG L J, KOU F, et al. Structural analysis and in vitro inhibitory effect on α-glucosidase activity of millet bran dietary fiber before and after modification[J]. Food Science,2018,39(11):46−52. doi: 10.7506/spkx1002-6630-201811008 CAO L K, KANG L J, KOU F, et al. Structural analysis and in vitro inhibitory effect on α-glucosidase activity of millet bran dietary fiber before and after modification[J]. Food Science, 2018, 39(11): 46-52. doi: 10.7506/spkx1002-6630-201811008
[29] HUI H P, LI X Z, JIN H, et al. Structural characterization, antioxidant and antibacterial activities of two heteropolysaccharides purified from the bulbs of Lilium davidii var. unicolor Cotton[J]. International Journal of Biological Macromolecules,2019,133:306−315. doi: 10.1016/j.ijbiomac.2019.04.082
[30] KHODAEI N, KARBOUNE S. Extraction and structural characterisation of rhamnogalacturonan I-type pectic polysaccharides from potato cell wall[J]. Food Chemistry,2013,139(4):617−623.
[31] ZHANG Z B, LIU X Y, LI D W, et al. Mechanism of ultrasonic impregnation on porosity of activated carbons in non-cavitation and cavitation regimes[J]. Ultrasonics Sonochemistry,2019,51:206−213. doi: 10.1016/j.ultsonch.2018.10.024
[32] THITAME P V, SHUKLA S R. Porosity development of activated carbons prepared from wild almond shells and coir pith using phosphoric acid[J]. Chemical Engineering Communications,2016,203(6):791−800.
[33] UCHIDA T, SATO H, TAKEUCHI S, et al. Investigation of output signal from cavitation sensor by dissolved oxygen level and sonochemical luminescence[J]. Japanese Journal of Applied Physics,2010,49(7):1−3.
[34] XING Z L. Impact of university's optimal human resource management practices on organizational performance[J]. Systems Engineering,2009,29(11):112−122.
[35] 张艳, 何翠, 刘玉凌, 等. 超声波改性对方竹笋膳食纤维性能和结构的影响[J]. 食品与发酵工业,2017,43(1):150−155. [ZHANG Y, HE C, LIU Y L, et al. Effect of ultrasound on physicochemical properties and structure of chimonobambusa dietary fibre[J]. Food and Fermentation Industries,2017,43(1):150−155. ZHANG Y, HE C, LIU Y L, et al. Effect of ultrasound on physicochemical properties and structure of chimonobambusa dietary fibre[J]. Food and Fermentation Industries, 2017, 43(1): 150-155.
[36] MINJARES-FUENTES R, FEMENIA A, GARAU M C, et al. Ultrasound-assisted extraction of hemicelluloses from grape pomace using response surface methodology[J]. Carbohydrate Polymers,2016,138:180−191. doi: 10.1016/j.carbpol.2015.11.045
[37] TOMA M, VINATORU M, PANIWNYK L, et al. Investigation of the effects of ultrasound on vegetal tissues during solvent extraction[J]. Ultrasonics Sonochemistry,2001,8(2):137−142. doi: 10.1016/S1350-4177(00)00033-X
[38] 苟丽娜, 马云翔, 王宇霞, 等. 高比表面积阿魏酸多孔淀粉酯结构表征及体外消化特性[J]. 食品与发酵工业,2021,8:1−11. [GOU L N, MA Y X, WANG Y X, et al. Structural characterization and in vitro digestibility of ferulic acid porous starch ester with high specific surface area[J]. Food and Fermentation Industries,2021,8:1−11. GOU L N, MA Y X, WANG Y X, et al. Structural characterization and in vitro digestibility of ferulic acid porous starch ester with high specific surface area[J]. Food and Fermentation Industries, 2021, 8: 1-11.
[39] ZHU F M, DU B, ZHENG L H. Advance on the bioactivity and potential applications of dietary fiber from grape pomace[J]. Food Chemistry,2015,186:207−212. doi: 10.1016/j.foodchem.2014.07.057
[40] IZADIFAR Z. Ultrasound pretreatment of wheat dried distiller's grain (DDG) for extraction of phenolic compounds[J]. Ultrasonics Sonochemistry,2013,20(6):1359−1369. doi: 10.1016/j.ultsonch.2013.04.004
[41] HUANG L R, MA H L, PENG L. Enzymolysis kinetics of garlic powder with single frequency countercurrent ultrasound pretreatment[J]. Food and Bioproducts Processing,2015,95:292−297. doi: 10.1016/j.fbp.2014.10.015
[42] COLOM X, CARRILLO F. Crystallinity changes in lyocell and viscose-type fibres by caustic treatment[J]. European Polymer Journal,2002,38(11):2225−2230. doi: 10.1016/S0014-3057(02)00132-5
[43] HUANG L R, ZHANG W X, CHENG J, et al. Antioxidant and physicochemical properties of soluble dietary fiber from garlic straw as treated by energy-gathered ultrasound[J]. International Journal of Food Properties,2019,22(1):678−688. doi: 10.1080/10942912.2019.1600544
[44] MA M M, MU T H. Effects of extraction methods and particle size distribution on the structural, physicochemical, and functional properties of dietary fiber from deoiled cumin[J]. Food Chemistry,2016,194:237−246. doi: 10.1016/j.foodchem.2015.07.095
[45] 万苗苗. 柚皮果胶的提取、性质及应用研究[D]. 淮安: 淮阴工学院, 2019. WAN M M. Study on extraction, properties and application of pectin from pomelo peels[D]. Huai’an: Huaiyin Institute of Technology, 2019.
[46] YANG B, WU Q J, LUO Y X, et al. High-pressure ultrasonic-assisted extraction of polysaccharides from Hovenia dulcis: Extraction, structure, antioxidant activity and hypoglycemic[J]. International Journal of Biological Macromolecules,2019,137:676−687. doi: 10.1016/j.ijbiomac.2019.07.034
[47] 乔汉桢, 刘佳文, 王迪, 等. 膳食纤维的理化功能特性及甘薯膳食纤维在动物生产中的应用[J]. 中国畜牧杂志,2019,10(55):25−29. [QIAO H Z, LIU J W, WANG D, et al. Physiochemical and functional properties of sweet potato residue fiber and its application in animal production[J]. Chinese Journal of Animal Science,2019,10(55):25−29. QIAO H Z, LIU J W, WANG D, et al. Physiochemical and functional properties of sweet potato residue fiber and its application in animal production[J]. Chinese Journal of Animal Science, 2019, 10(55): 25-29.
[48] MA R, CHEN J N, ZHOU X J, et al. Effect of chemical and enzymatic modifications on the structural and physicochemical properties of dietary fiber from purple turnip (Brassica rapa L.)[J]. LWT-Food Science and Technology,2021,145:1−10.
[49] SHARMA A, RAO S. Constipation: Pathophysiology and current therapeutic approaches[J]. Handbook of Experimental Pharmacology,2017,239:59−74.
[50] CARRETTA M D, QUIROGA J, LÓPEZ R, et al. Participation of short-chain fatty acids and their receptors in gut inflammation and colon cancer[J]. Frontiers in Physiology,2021,12:1−13.
[51] XIE F Y, ZHAO T, WAN H C, et al. Structural and physicochemical characteristics of rice bran dietary fiber by cellulase and high-pressure homogenization[J]. Applied Sciences,2019,9(7):1−10.
[52] SUN J T, ZHANG Z C, XIAO F G, et al. Ultrasound-assisted alkali extraction of insoluble dietary fiber from soybean residues[J]. IOP Conference Series:Materials Science and Engineering,2018,392:1−7.
[53] CALVACHE J E N, SORIA M, DE ESCALADA P M F, et al. Optimization of the production of dietary fiber concentrates from by-products of papaya (Carica papaya L. var. Formosa) with microwave assistance. Evaluation of its physicochemical and functional characteristics[J]. Journal of Food Processing and Preservation,2017,41(4):1−12.
[54] QI J, LI Y, MASAMBA K G, et al. The effect of chemical treatment on the in vitro hypoglycemic properties of rice bran insoluble dietary fiber[J]. Food Hydrocolloids,2016,52:699−706. doi: 10.1016/j.foodhyd.2015.08.008
[55] ULLAH I, YIN T, XIONG S B, et al. Effects of thermal pre-treatment on physicochemical properties of nano-sized okara (soybean residue) insoluble dietary fiber prepared by wet media milling[J]. Journal of Food Engineering,2018,11(237):18−26.
[56] ENCALADA A M I, PEREZ C D, CALDERON P A, et al. High-power ultrasound pretreatment for efficient extraction of fractions enriched in pectins and antioxidants from discarded carrots (Daucus carota L.)[J]. Journal of Food Engineering,2019,256:28−36. doi: 10.1016/j.jfoodeng.2019.03.007
[57] REVIN V, ATYKYAN N, ZAKHARKIN D. Enzymatic hydrolysis and fermentation of ultradispersed wood particles after ultrasonic pretreatment[J]. Electronic Journal of Biotechnology,2016,20:14−19. doi: 10.1016/j.ejbt.2015.11.007
[58] GUO Y T, LIU W, WU B G, et al. Modification of garlic skin dietary fiber with twin-screw extrusion process and in vivo evaluation of Pb binding[J]. Food Chemistry,2018,268:550−557. doi: 10.1016/j.foodchem.2018.06.047
[59] 王彪. 青稞膳食纤维的改性及其应用研究[D]. 芜湖: 安徽工程大学, 2019. WANG B. Study on modification and application of dietary fiber from hulless barely[D]. Wuhu: Anhui University of Technology and Science, 2019.
[60] 李晗, 杨宗玲, 毕永雪, 等. 超声辅助酶法提取西番莲果皮可溶性膳食纤维及理化性质[J]. 食品工业科技,2020,41(7):161−165. [LI H, YANG Z L, BI Y X, et al. Extraction of soluble dietary fiber from Passiflora edulis peel by ultrasonic assisted enzymatic method and its physicochemical properties[J]. Science and Technology of Food Industry,2020,41(7):161−165. LI H, YANG Z L, BI Y X, et al. Extraction of soluble dietary fiber from passiflora edulis peel by ultrasonic assisted enzymatic method and its physicochemical properties[J]. Science and Technology of Food Industry, 2020, 41(7): 161-165.





 下载:
下载:
 下载:
下载:
