Inhibition of α-Glucosidase Activity and Regulation of Blood Glucose by Methanol Extracts from Amomum tsao-ko
-
摘要: 目的:研究草果甲醇溶出物对α-葡萄糖苷酶的抑制作用及对小鼠高血糖的调节作用。方法:采用4-硝基酚-α-D-吡喃葡萄糖苷法(PNPG),以阿卡波糖为阳性对照,进行α-葡萄糖苷酶体外抑制试验,评估草果甲醇溶出物的α-葡萄糖苷酶抑制率。用高脂饲料喂养小鼠构建异常血糖小鼠模型,在高脂饲料基础上,分别添加100、200 mg/kg的草果甲醇溶出物干预6周,评估草果甲醇溶出物对小鼠空腹血糖、葡萄糖耐量以及胰岛素抵抗的影响。结果:当草果甲醇溶出物溶液浓度为500 mg/L时,对α-葡萄糖苷酶的抑制率达到63.72%。草果甲醇溶出物对α-葡萄糖苷酶的半数抑制浓度(IC50)为0.145 mg/mL。在经灌胃低、高剂量组的草果甲醇溶出物干预2周后,小鼠空腹血糖开始降低并维持稳定,草果低、高剂量组葡萄糖耐量曲线下面积(AUC)在干预6周后均低于模型组(P<0.05)。结论:草果甲醇溶出物可明显抑制α-葡萄糖苷酶活性,并能明显改善小鼠葡萄糖耐量水平。Abstract: Objective: To investigate α-glucosidase inhibitory and high blood glucose regulation of methanol extracts from Amomum tsao-ko in aged mice. Methods: Using 4-N-trophenyl-α-D-glu-copyranoside(PNPG) method with acarbose as positive control, α-glucosidase inhibition test in vitro was carried out to evaluate α-glucosidase inhibition rate of methanol extract from Amomum tsao-ko. The mouse model of abnormal blood glucose was established by feeding mice with high-fat diet. On the basis of high-fat diet, 100 and 200 mg/kg of methanol extracts from Amomum tsao-ko were added for 6 weeks to evaluate the effects of methanol extracts from Amomum tsao-ko on fasting blood glucose, glucose tolerance and insulin resistance in mice. Results: When the concentration of methanol extracts solution was 500 mg/L, the inhibition rate of α-glucosidase reached 63.72%. Half inhibitory concentration (IC50) of methanol extract from Amomum tsao-ko on α-glucosidase was 0.145 mg/mL. The fasting blood glucose of mice in the herb group began to decrease and maintain stability after 2 weeks of intervention by intragastric administration of low and high dose methanol extracts of Amomum tsao-ko groups. The area under the curve (AUC) values of glucose tolerance curve in low and high dose methanol extracts of Amomum tsao-ko groups after 6 weeks intervention were lower than that of model group (P<0.05). Conclusion: Methanol extracts of Amomum tsao-ko could obviously inhibit α-glucosidase activity and improve glucose tolerance in mice.
-
Keywords:
- Amomum tsao-ko /
- methanol extracts /
- α-glucosidase /
- blood glucose
-
过去三十多年间,中国糖尿病患病人数不断增长,2015~2017年我国18岁以上人群糖尿病患病率为11.2%,糖尿病人群中2型糖尿病占90%以上[1-2]。α-葡萄糖苷酶抑制剂通过抑制小肠上皮细胞绒毛膜上的α-葡萄糖苷酶的活性,延缓人体对葡萄糖的吸收,控制餐后血糖的升高,有助于防治2型糖尿病及其并发症[3-4]。近年来,从药用植物中筛选天然的α-葡萄糖苷酶抑制剂成为国内外学者关注的研究热点[5-6]。
草果(Amomum tsao-ko Crevost et Lemaire),别名草果子、草果仁,为姜科(Zingiberaceae)豆蔻属(Amomum)多年生常绿草本植物草果的成熟干燥果实。草果是一种药食同源植物,具有健胃、消食、温中、驱风、促进食欲等药疗作用[7],收录于中国药典,在国内广泛应用于食品香料行业。我国近10多年来对草果化学成分、药理作用及临床应用等方面进行了一系列研究,发现草果可溶出芳香油,富含氨基酸、多种必需微量元素、多糖、多酚及黄酮类化合物[8-9]。国内外对其活性物质的功效研究主要集中于抗氧化活性及降血脂等方面[10-12]。关于草果甲醇溶出物中活性脂质成分抑制α-葡萄糖苷酶活性及血糖调节作用的系统研究尚未见报道。
本研究在前期对草果活性物质进行筛选的基础上,通过体外试验研究草果甲醇溶出物对α-葡萄糖苷酶活性的抑制作用,并通过动物实验研究草果甲醇溶出物对改善空腹血糖、葡萄糖耐量以及胰岛素抵抗三方面的影响,为利用该植物活性成分开发降糖新药提供基础数据。
1. 材料与方法
1.1 材料与仪器
新鲜草果 购自云南;C57BL/6小鼠 成年雄性,SPF级,8周龄,体重28~32 g,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006;柱层层析硅胶 200~300目 青岛海洋化工厂分厂;人体α葡萄糖苷酶检测试剂盒 上海谷研实业有限公司;阿卡波糖标准品 石家庄华荣制药有限公司;PBS磷酸盐 上海雷磁·创益仪器仪表有限公司;胰岛素酶联免疫检测试剂盒 石家庄辉端生物科技有限公司;猪油 台湾正义食品有限公司;无水甲醇 色谱纯,天津市河东区红岩试剂厂;氯仿、丙酮、碳酸氢钠 均为分析纯,天津市恒兴化学试剂制造有限公司;小鼠常规饲料 即空白组饲料,购自河北医科大学动物实验中心;模型组饲料 在常规饲料基础上,添加10%的猪油[13];草果低剂量组饲料 在模型组饲料基础上,每公斤饲料添加100 mg的草果甲醇溶出物;草果高剂量组饲料 在模型组饲料基础上,每公斤饲料添加200 mg的草果甲醇溶出物[14]。
HC-100型高速万能粉碎仪 浙江省永康市金穗机械制造厂;RE-52AA型旋转蒸发仪 上海亚荣生化仪器厂;XD-1200D型超声波细胞粉碎机 南京先欧仪器制造有限公司;RT-6000全自动酶标仪 美国雷杜公司;OneTouch UltraTM快速血糖测定仪及试纸 美国强生公司。
1.2 实验方法
1.2.1 草果甲醇溶出物的制备
取新鲜草果去壳,烘干粉碎为不大于100目粉末。称取50 g草果粉末,加入混合醇提液(200 mL氯仿、400 mL甲醇和40 mL蒸馏水)静置12 h,均质5 min(18000 r/min),冷却后用超声波细胞粉碎仪粉碎10 min(功率70%,工作频率20~25 Hz)。粉碎后混合物经真空抽滤后收集滤液,滤饼加入减半量混合醇提液(100 mL氯仿、200 mL甲醇和20 mL蒸馏水),按照前述方法重复萃取两次,收集3次滤液,加入60 g已活化硅胶粉末,经25 ℃旋转蒸发,得到草果脂质硅胶粉末。将此粉末样品干法上柱(自制50Ø×250 mm的200~300目硅胶氢柱,柱中硅胶分别依次经甲醇、丙酮、氯仿4 h活化预处理),先后用600 mL氯仿、600 mL丙酮、600 mL甲醇洗脱,甲醇洗脱液经微孔滤膜(0.22 μm)过滤,再经蒸发浓缩、冷冻干燥后得到草果甲醇溶出物粉末[15-16]。
1.2.2 溶液的配制
PBS磷酸盐缓冲液:以蒸馏水为溶剂,制成浓度为10 mg/mL,pH为6.8的磷酸盐缓冲液;α-葡萄糖苷酶溶液:以磷酸盐缓冲液为溶剂,配制成浓度为1 U/mL的溶液;PNPG溶液:以磷酸盐缓冲液为溶剂,配制成12.5 mmol/L的溶液;草果甲醇溶出物溶液:取草果甲醇溶出物粉末,用磷酸盐缓冲液配制成浓度为0.02、0.1、0.5、2.5、7.5 mg/mL不同反应梯度的供试品溶液;阿卡波糖溶液:取阿卡波糖标准品,用磷酸盐缓冲液配制成浓度为0.02、0.1、0.5、2.5、7.5 mg/mL不同反应梯度的对照品溶液;碳酸氢钠溶液:以蒸馏水为溶剂,制成pH为9.8的溶液。
1.2.3 α-葡萄糖苷酶抑制实验
α-葡萄糖苷酶抑制实验采用PNPG法[17]。实验底物为对硝基苯基-α-D-吡喃葡萄糖苷(PNPG),以PNP的生成量计算α-葡萄糖苷酶活性。取草果甲醇溶出物样品溶液、阿卡波糖测定溶液各40 μL至96孔板中,加入1 U/mL的α-葡萄糖苷酶溶液40 μL,混匀,于37 ℃孵育5 min;加入12.5 mmol/L的PNPG溶液20 μL,混匀,于37 ℃孵育30 min;加入碳酸氢钠溶液100 μL终止反应(此时反应总体积达200 μL)。以PBS 40 μL为空白对照,以PBS 40 μL代替α-葡萄糖苷酶溶液作为检测背景以消除检测误差,使用酶标仪于405 nm波长处检测各孔的光密度(OD),按下式计算2种待测溶液对于α-葡萄糖苷酶活性的抑制率。
1.2.4 动物实验
1.2.4.1 实验动物分组及造模
实验小鼠经适应性喂养1周后随机分为2组,为空白组(10只)和模型组(40只),空白组以常规饲料喂养,模型组以高脂饲料喂养,连续饲喂6周后,模型组小鼠禁食不禁水14 h,按35 mg/kg∙BW腹腔注射由柠檬酸-柠檬酸钠缓冲液(pH4.35)配制的1%链脲佐菌素(Streptozotocin,STZ)溶液,72 h后剪尾取血,以血糖仪测定空腹血糖高于11.1 mmol/L作为建模成功的标志[18]。本实验建模成功率为75%,将建模成功的30只小鼠随机分为3组,分别为模型组、草果低剂量组、草果高剂量组,每组各10只。各组分别给予模型组饲料、草果低剂量组饲料、草果高剂量组饲料,持续喂养6周后实验结束。实验期间动物自由饮用瓶装饮用水,动物识别采用5%苦味酸标记。
1.2.4.2 一般状态评估
实验期间,每天观察小鼠毛色、饮食水、排泄以及活动等基本情况,每周称量摄食量、饮水量和体重。
1.2.4.3 空腹血糖测定
小鼠禁食不禁水6 h后,通过剪尾采血,测定各组小鼠的空腹血糖。从实验第6周开始,每2周1次,连续4次。
1.2.4.4 糖耐量试验
分别于实验第6和第12周时进行葡萄糖耐量实验。在小鼠禁食10 h后,腹腔注射葡萄糖溶液(1.5 g/kg),分别在注射前(0 min)、注射后15、30、60和120 min 时,通过小鼠尾部采血,使用OneTouch UltraTM快速血糖测定仪测量血糖水平,计算血糖曲线下面积AUC[19],计算公式:
AUC=[(BG0+BG15)+(BG15+BG30)+(BG30+BG60)×2+(BG60+BG120)×4]×0.25×0.5
式中:BGi为在第i min时的血糖值。
1.2.4.5 胰岛素抵抗评估
于实验第13周时,禁食10 h后,于次日眼球后静脉丛采血,用OneTouch UltraTM快速血糖测定仪测定空腹血糖,剩余血液离心(3000 r/min,15 min)取血浆,利用ELISA试剂盒测定空腹胰岛素水平,基于空腹血糖和胰岛素计算HOMA-β和HOMA-IR作为表征胰岛素抵抗的指标[20],计算公式:HOMA-β(%)=[20×空腹胰岛素水平(mIU/L)]/[空腹血糖水平(mmol/L)−3.5],HOMA-IR=空腹血糖(mmol/L)×空腹胰岛素(µU/mL)/22.5。
1.3 数据处理
数据以平均值±标准差表示,采用SPSS19.0软件进行统计分析,正态分布资料两组间比较采用独立样本t检验,非正态分布资料两组间比较采用两独立样本符号秩和检验。多组间比较采用单因素方差分析,如各组符合方差齐性则组间两两比较使用SNK法,如方差不齐,则使用 Dunnett’s T3法。P值小于0.05认为组间差异有统计学意义。
2. 结果与分析
2.1 草果甲醇溶出物对α-葡萄糖苷酶的抑制作用
本研究前期针对草果活性物质进行了筛选,通过丙酮、氯仿、甲醇等对草果脂质进行分离,分别确定各活性组分的生理活性,确定草果甲醇溶出物中富含降糖活性成分[21-22],因此本研究在前期试验的基础上采用甲醇溶出物作为考察对象。
由图1可见,草果甲醇溶出物和阿卡波糖对α-葡萄糖苷酶的抑制均呈剂量依赖关系,随着剂量的加大,抑制率增大。当草果甲醇溶出物溶液浓度为0.5 mg/mL时,对α-葡萄糖苷酶的抑制率达到63.72%。草果甲醇溶出物对α-葡萄糖苷酶的半数抑制浓度(IC50)为0.145 mg/mL,阿卡波糖为0.273 mg/mL,IC50的差异表明草果甲醇溶出物对α-葡萄糖苷酶活性的抑制作用强于阿卡波糖。
2.2 动物实验结果
2.2.1 对小鼠摄食量、饮水量和体重的影响
由表1可见,与空白组相比,模型组在连续高脂饲料喂养6周后,小鼠摄食量、饮水量、体重都显著增加,差异有统计学意义(P<0.05),印证了模型的有效性。本研究以小鼠腹腔注射STZ溶液72 h后采血测定空腹血糖高于11.1 mmol/L为建模成功的标志。12周时模型组小鼠的饮水量、体重均显著(P<0.05)高于空白组,说明小鼠糖脂代谢紊乱状态未得到缓解。经每天饲喂草果低、高剂量组饲料干预6周后,即在实验第12周时,草果低剂量组和草果高剂量组小鼠的摄食量、饮水量都低于模型组(P<0.05),但仍高于空白组(P<0.05)。草果低剂量组和草果高剂量组小鼠的体重变化不明显,在第12周时均显著低于模型组(P<0.05,P<0.01),与常规饲料组相比,差异均无统计学意义(P˃0.05)。说明草果甲醇溶出物可能有改善小鼠代谢,减少体内脂肪存储量,抑制体重增长的作用[23-24]。
表 1 草果甲醇溶出物对小鼠摄食量、饮水量和体重的影响(组别 摄食量(g/d) 饮水量(mL/d) 体重(g) 第6周 第12周 第6周 第12周 第6周 第12周 空白组 8.4±1.7 9.9±2.1 10.2±3.6 12.9±4.2 30.9±3.9 37.9±5.2 模型组 14.3±2.1# 16.8±3.0## 15.7±2.5# 20.4±5.1## 36.3±4.4# 43.2±6.6## 草果低剂量组 13.0±2.5# 13.6±2.2#* 14.8±4.4# 16.6±4.8#* 38.4±4.2# 39.7±6.2* 草果高剂量组 14.5±2.8# 12.1±2.4#* 15.6±3.8# 17.2±6.5#* 37.8±5.1# 37.3±5.3** 注:#表示与空白组比较,P<0.05,##表示与空白组比较,P<0.01;*表示与模型组比较,P<0.05,**表示与模型组比较,P<0.01;图2~图3、表2同。 2.2.2 对小鼠空腹血糖的影响
由图2可见,空白组小鼠比较稳定地维持空腹血糖低水平,模型组、草果低剂量组、草果高剂量组的空腹血糖值在4个观察点上均极显著高于空白组(P<0.01)。当给予低、高剂量的草果甲醇溶出物干预2周后,即实验第8周,草果低、高剂量组小鼠的空腹血糖值开始下降,且均低于模型组。经干预6周后,低剂量组小鼠空腹血糖与模型组比较差异无统计学意义,高剂量组空腹血糖显著低于模型组(P<0.05),这应与草果甲醇溶出物能抑制寡糖分解为单糖,减少肠腔对葡萄糖的吸收相关[25]。但草果低、高剂量组空腹血糖仍高于空白组,可见草果干预后并未逆转空腹血糖受损,尚未能从根本上改善胰岛β细胞的功能[26]。
2.2.3 对小鼠葡萄糖耐量的影响
如图3所示,与空白组相比,模型组在连续高脂饲料喂养6周后,葡萄糖耐量AUC显著增加(P<0.01)。经低、高剂量组的草果甲醇溶出物干预6周后,在实验第12周时,草果低、高剂量组小鼠AUC均显著低于模型组(P<0.05)。草果低剂量组小鼠AUC显著高于空白组(P<0.05),草果高剂量组小鼠AUC与空白组相比,差异无统计学意义(P=0.07˃0.05)。糖耐量低减主要是由于高脂饮食破坏小鼠血糖调节及脂质代谢能力[27-28],引起糖脂代谢紊乱,草果甲醇溶出物对高脂饮食引起的糖耐量异常有一定改善作用。
2.2.4 对小鼠胰岛素抵抗的影响
胰岛素抵抗指数HOMA-IR,会随着胰岛素抵抗水平升高而升高,胰岛β细胞功能HOMA-β,会随着胰岛β细胞功能降低而减少。在动物实验第13周对各组进行胰岛素抵抗评估后发现(表2),与空白组相比,模型组小鼠出现了明显的胰岛素抵抗(P<0.001),当用高剂量草果甲醇溶出物进行干预后,其HOMA-β较模型组升高,差异有统计学意义(P<0.05),HOMA-IR较模型组降低,差异有统计学意义(P<0.05),说明高剂量草果甲醇溶出物改善了由高脂饲料诱导的胰岛素抵抗。
表 2 草果甲醇溶出物对小鼠胰岛素抵抗的影响(组别 n HOMA-β(%) HOMA-IR 空白组 9 68.73±11.52 5.35±0.76 模型组 8 31.46±5.33## 55.22±15.24## 草果低剂量组 10 33.81±4.20## 47.36±13.68## 草果高剂量组 9 38.55±6.07##* 46.40±14.09##* 3. 讨论
天然植物中的多酚、黄酮具有较明确的降糖功效[29]。单恬恬等[30]将草果粉碎后,分别使用70%无水乙醇和超纯水(1:10料液比),经提取、冻干得到草果提取物,测得其中水提物总多酚、总黄酮含量分别为21.83±0.56、24.81±0.11 mg/g,醇提物总多酚、总黄酮含量分别为33.99±0.62、63.24±1.59 mg/g。任洪涛等[31]使用高效液相色谱法检测草果中酚酸,发现其中原儿茶酸含量为9.12~17.42 mg/kg、原儿茶醛为7.11~15.51 mg/kg。本研究前期实验推测,草果甲醇溶出物降糖作用可能与其所含酚类物质儿茶素(儿茶酸)有关[32],且经福林酚法初步测定总酚含量不低于0.5 mg/g。这些研究表明从草果所含化学成分看,草果活性成分应可作为天然降糖物质进行研究。
α-葡萄糖苷酶是小肠内麦芽糖、蔗糖的水解酶,通过饮食摄入的碳水化合物在α-葡萄糖苷酶的作用下,释放葡萄糖并经小肠吸收进入血液,是餐后血糖升高的主要原因。α-葡萄糖苷酶抑制剂则可使淀粉分解为葡萄糖的速度减慢、延缓或抑制葡萄糖的吸收,可有效的降低餐后高血糖[33]。草果属于姜科植物,国内外有较多对姜科植物抑制α-葡萄糖苷酶作用的研究。陈浩南等[34]对高良姜的α-葡萄糖苷酶抑制作用研究中,发现高良姜中有丰富的多酚类化合物,对α-葡萄糖苷酶的IC50为14.45 mg/mL。刘富月[35]对34种生姜中降血糖物质的筛选中,发现7个生姜品种的乙醇提取物对α-葡萄糖苷酶抑制活性超过60%,适合作为α-葡萄糖苷酶抑制剂。吴相欢[36]对黄姜花化学成分和药理活性的研究发现,黄姜花根茎水提物和醇提物对α-葡萄糖苷酶表现极强的抑制效果,且抑制效果均比阳性阿卡波糖好。He等[37-38]的研究发现,草果中的多种二芳基庚烷类化合物具有α-葡萄糖苷酶抑制作用。本研究的体外试验结果表明,草果甲醇溶出物对α-葡萄糖苷酶的IC50为0.145 mg/mL,抑制效果优于阿卡波糖,与上述研究结果一致,说明草果甲醇溶出物有明显的α-葡萄糖苷酶抑制活性。此结果是相较团队前期研究做出的更细化深入的探索。
空腹血糖是临床最常用的检测指标,可反映胰岛β细胞的功能。胰岛β细胞可以分泌适量胰岛素,用以调节机体肌糖原和肝糖原与血液葡萄糖水平之间的平衡,长期处于高血糖状态会影响β细胞功能,增加β 细胞凋亡[24]。Christ等[39]和Cani等[40]的研究认为高脂饮食可间接通过影响肠粘膜通透性介导内毒素入血引起机体长期慢性炎症与胰岛素抵抗、血脂紊乱。在本研究的动物实验中发现,当给予草果甲醇溶出物干预后,原本经高脂饲料诱导的高血糖得到了一定改善,空腹血糖值有所下降,糖耐量受损和胰岛素抵抗均得到一定改善,这可能是由于草果甲醇溶出物能选择性地影响小肠二糖水解酶中消化蔗糖的蔗糖酶,从而抑制蔗糖的吸收,通过降低循环血糖途径对于改善胰岛素抵抗,保护胰岛细胞正常生理功能,起到增强糖耐量作用[26],这与其体外试验中表现出的α-葡萄糖苷酶抑制作用有密切的关联。李姣[41]通过对2型糖尿病大鼠使用草果乙醇提取物以100 mg/(kg·d)的剂量进行干预,发现干预可以降低糖尿病大鼠的空腹血糖水平,改善大鼠胰岛素抵抗状态。此结果与本研究发现草果甲醇溶出物干预具有一定的改善作用的结论一致,说明草果甲醇溶出物具有调节血糖的能力。
综上,本文通过体外实验研究了草果甲醇溶出物对α-葡萄糖苷酶的抑制活性,又通过动物实验进一步验证了其在体内对空腹血糖、糖耐量水平和胰岛素抵抗的改善作用,初步明确了草果醇提物具有改善血糖的生物学活性,确定了草果降糖活性物质富集于甲醇洗脱物中。但本研究并未对草果甲醇溶出物中活性成分进行系统结构解析,在后续研究中,将进一步分析确定活性物质官能团,为草果活性物质的开发提供依据。
-
表 1 草果甲醇溶出物对小鼠摄食量、饮水量和体重的影响(
Table 1 Effects of methanol extracts from Amomum tsao-ko on food intake, water intake and body weight in mice (
组别 摄食量(g/d) 饮水量(mL/d) 体重(g) 第6周 第12周 第6周 第12周 第6周 第12周 空白组 8.4±1.7 9.9±2.1 10.2±3.6 12.9±4.2 30.9±3.9 37.9±5.2 模型组 14.3±2.1# 16.8±3.0## 15.7±2.5# 20.4±5.1## 36.3±4.4# 43.2±6.6## 草果低剂量组 13.0±2.5# 13.6±2.2#* 14.8±4.4# 16.6±4.8#* 38.4±4.2# 39.7±6.2* 草果高剂量组 14.5±2.8# 12.1±2.4#* 15.6±3.8# 17.2±6.5#* 37.8±5.1# 37.3±5.3** 注:#表示与空白组比较,P<0.05,##表示与空白组比较,P<0.01;*表示与模型组比较,P<0.05,**表示与模型组比较,P<0.01;图2~图3、表2同。 表 2 草果甲醇溶出物对小鼠胰岛素抵抗的影响(
Table 2 Effect of methanol extracts from Amomum tsao-ko on insulin resistance in mice (
组别 n HOMA-β(%) HOMA-IR 空白组 9 68.73±11.52 5.35±0.76 模型组 8 31.46±5.33## 55.22±15.24## 草果低剂量组 10 33.81±4.20## 47.36±13.68## 草果高剂量组 9 38.55±6.07##* 46.40±14.09##* -
[1] WANG L, GAO P, ZHANG M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. The Journal of the American Medical Association,2017,317(24):2515−2523. doi: 10.1001/jama.2017.7596
[2] 李咏泽, 滕笛, 史晓光, 等. 根据2018年美国糖尿病学会标准诊断中国糖尿病的患病率: 全国横断面研究[J]. 英国医学杂志中文版,2020,23(9):494−504. [LI Y Z, TENG D, SHI X G, et al. Prevalence of diabetes recorded in mainland China using 2018 diagnostic criteria from the American Diabetes Association: National cross sectional study[J]. The British Medical Journal Chinese Edition,2020,23(9):494−504. [3] 王胜红, 罗超. α-葡萄糖苷酶抑制剂的药理作用及研究进展[J]. 湖北成人教育学院学报,2019,25(2):18−21. [WANG S H, LUO C. Progress in research of α-glucosidase inhibitors and pharmacological effects[J]. Journal of Hubei Adult Education Institute,2019,25(2):18−21. doi: 10.3969/j.issn.1673-3878.2019.02.005 [4] 熊能, 韦圣, 胡忠策. α-葡萄糖苷酶抑制剂的研究进展和趋势[J]. 发酵科技通讯,2018,47(1):58−64. [XIONG N, WEI S, HU Z C. The research progress and trends of α-glucosidase inhibitors[J]. Bulletin of Fermentation Science and Technology,2018,47(1):58−64. [5] 郅丽超, 张琳依, 梁馨元, 等. 天然活性成分对α-葡萄糖苷酶抑制作用的研究进展[J]. 食品安全质量检测学报,2021,12(6):2276−2282. [ZHI L C, ZHANG L Y, LIANG X Y, et al. Research progress on the inhibitory effect of natural active ingredients on α-glucosidase[J]. Journal of Food Safety & Quality,2021,12(6):2276−2282. [6] 宋昱, 黎玉梅, 史丽颖, 等. 金花茶种子对α-葡萄糖苷酶活性的抑制作用研究[J]. 时珍国医国药,2019,30(6):1292−1294. [SONG Y, LI Y M, SHI L Y, et al. Study on the Inhibition of α-glucosidase activity by seeds of Camellia nitidissima Chi[J]. Lishizhen Medicine and Materia Medica Research,2019,30(6):1292−1294. [7] 覃慧薇, 王元忠, 杨美权, 等. 草果的本草考证[J]. 中国实验方剂学杂志,2021,27(6):139−148. [TAN H W, WANG Y Z, YANG M Q, et al. Medical textual research of tsaoko fructus[J]. Chinese Journal of Experimental Traditional Medical Formulae,2021,27(6):139−148. [8] SEONG S H, JI H L, YUN-HYEOK C, et al. Amotsaokonal A–C, benzaldehyde and cycloterpenal from Amomum tsao-ko[J]. Tetrahedron Letters,2015,56(48):6681−6684. doi: 10.1016/j.tetlet.2015.10.045
[9] 柳航, 王敏, 许耶, 等. 草果化学成分的研究[J]. 中成药,2020,42(10):2648−2651. [LIU H, WANG M, XU Y, et al. Chemical constituents from Amomum tsao-ko[J]. Chinese Traditional Patent Medicine,2020,42(10):2648−2651. doi: 10.3969/j.issn.1001-1528.2020.10.021 [10] CUI Q, WANG L T, LIU J Z, et al. Rapid extraction of Amomum tsao-ko essential oil and determination of its chemical composition, antioxidant and antimicrobial activities[J]. Journal of Chromatography B,2017,1061-1062:364−371. doi: 10.1016/j.jchromb.2017.08.001
[11] 袁园, 张潇, 陈碧琼, 等. 草果总黄酮的提取及DPPH自由基清除活性研究[J]. 食品研究与开发,2017,38(15):63−68. [YUAN Y, ZHANG X, CHENG B Q, et al. Extraction method and DPPH radical scavenging activity of flavonoids from Amomum tsao-ko[J]. Food Research and Development,2017,38(15):63−68. doi: 10.3969/j.issn.1005-6521.2017.15.014 [12] 石梅, 黄比翼, 黄锁义. 草果醇提物不同极性部位的体外抗氧化活性研究[J]. 中国药房,2020,31(8):953−956. [SHI M, HUANG B Y, HUANG S Y, et al. Study on in vitro antioxidant activities of different polar parts of ethanol extract from Amomum tsao-ko[J]. China Pharmacy,2020,31(8):953−956. doi: 10.6039/j.issn.1001-0408.2020.08.10 [13] 刘岩, 王竹, 向雪松, 等. 高脂高糖饲料对建立实验糖耐量受损大鼠模型的效果分析[J]. 卫生研究,2014,43(4):603−607,613. [LIU Y, WANG Z, XIANG X S, et al. Analysis of the effect of high glucose and high fat diet on the manufacturing of the experimental pre-diabetic rats model[J]. Journal of Hygiene Research,2014,43(4):603−607,613. [14] PARK J H, CHO Y R, KO H J, et al. Evaluation of 3-week repeated dose oral toxicity on Amomum tsao-ko extract in balb/c mice[J]. Journal of Applied Biological Chemistry,2015,58(2):139−143. doi: 10.3839/jabc.2015.024
[15] 闫倩. 草果甲醇溶出物的抗氧化活性研究[D]. 天津: 天津科技大学, 2013. YAN Q. The anti-oxidant activity of the methanol extract of tsao-ko[D]. Tianjin: Tianjin University of Science and Technology, 2013.
[16] 闫倩, 俞龙泉, 陈野, 等. 草果甲醇溶出物对D-半乳糖致衰老小鼠的抗氧化作用机理研究[J]. 食品工业科技,2014,35(6):351−356. [YAN Q, YU L Q, CHEN Y, et al. Study on mechanism of antioxidant effect of methanol extracts from tsao-ko (Amomum tsao-ko crevost et lemaire) in aged mice induced by D-galactose[J]. Science and Technology of Food Industry,2014,35(6):351−356. [17] 程轩轩, 陈亮元, 郑诗嘉, 等. 广金钱草多糖指纹图谱的建立、含量测定及其对α-葡萄糖苷酶的抑制活性研究[J]. 中国药房,2020,31(2):182−189. [CHENG X X, CHEN L Y, ZHENG S J, et al. Fingerprint establishment, content determination and α-glucosidase inhibitory activity study of polysaccharide from Desmodium styracifolium[J]. China Pharmacy,2020,31(2):182−189. [18] 陈小敏, 谭书明, 黄颖, 等. 刺梨、桑叶、苦瓜饮料对糖尿病小鼠的降糖作用[J]. 中国酿造,2019,38(6):123−127. [CHEN X M, TAN S M, HUANG Y, et al. Hypoglycemic effect of Rosa roxburghii, Morus alba and Momordica charantia beverage on diabetic mice[J]. China Brewing,2019,38(6):123−127. doi: 10.11882/j.issn.0254-5071.2019.06.023 [19] 郭成成, 张晓圆, 玉应香, 等. 绿原酸对高脂饲料诱导的肥胖大鼠糖耐量及其曲线特征的影响[J]. 北京大学学报:医学版,2020,52(2):269−274. [GUO C C, ZHANG X Y, YU Y X, et al. Effects of chlorogenic acid on glucose tolerance and its curve characteristics in high-fat diet-induced obesity rats[J]. Journal of Peking University(Health Sciences),2020,52(2):269−274. [20] 张峥, 徐加英, 陈嘉平, 等. 桑椹对高脂喂养小鼠血糖调节作用[J]. 中国公共卫生,2020,36(8):1157−1159. [ZHANG Z, XU J Y, CHEN J P, et al. Effect of mulberry on glucose regulation in mice fed with high-fat diet[J]. Chinese Journal of Public Health,2020,36(8):1157−1159. doi: 10.11847/zgggws1119596 [21] YU L Q, SHIRAI N, SUZUKI H, et al. Effect of lipid extracted from tsao-ko(Amomum tsao-ko Crevost et Lemaire)on digestive enzyme activity, antioxidant activity, plasma and liver lipids, and blood glucose levels of mice[J]. Journal of Nutritional Science and Vitaminology,2008,54(5):378−383. doi: 10.3177/jnsv.54.378
[22] 俞龙泉, 王惠英, 张文娜, 等. 草果中乙醇提取物对小白鼠生理调节的影响[J]. 食品科技,2012,37(10):182−186. [YU L Q, WANG H Y, ZHANG W N, et al. Effect of the ethanol extracts of Amomum tsao-ko on mouse physiology[J]. Food Science and Technology,2012,37(10):182−186. [23] PARK J H, AHN E K, HWANG M H, et al. Improvement of obesity and dyslipidemic activity of Amomum tsao-ko in C57BL/6 mice fed a high-carbohydrate diet[J]. Molecules,2021,26(6):1638. doi: 10.3390/molecules26061638
[24] SHIM K S, HWANG Y H, JANG S A, et al. Ethanol extract of Amomum tsao-ko ameliorates ovariectomy-induced trabecular loss and fat accumulation[J]. Molecules,2021,26(4):784. doi: 10.3390/molecules26040784
[25] SAHERE R, SOHEILA M, AHMAD H, et al. Kinetics of α-glucosidase inhibition by different fractions of three species of labiatae extracts: A new diabetes treatment model[J]. Pharmaceutical Biology,2017,55(1):1483−1488. doi: 10.1080/13880209.2017.1306569
[26] XU Z R, DU H W, CUI L W, et al. Association of β-cell function and insulin resistance with pediatric type 2 diabetes among Chinese children[J]. World Journal of Diabetes,2021,12(8):1292−1303. doi: 10.4239/wjd.v12.i8.1292
[27] 罗雅亭, 程如越, 梁惠菁, 等. 高脂饮食对小鼠糖、脂代谢及肠道菌群结构的影响[J]. 营养学报,2020,42(5):458−464. [LUO Y T, CHENG R Y, LIANG H J, et al. Effects of high-fat diet on glucose and lipid metabolism and gut microbiota structure in mice[J]. Acta Nutrimenta Sinica,2020,42(5):458−464. doi: 10.3969/j.issn.0512-7955.2020.05.009 [28] 周青青, 蒋丰岭, 王家妮, 等. 不同饮食摄入对小鼠糖脂代谢、肠道菌群的影响[J]. 食品研究与开发,2021,42(10):16−23. [ZHOU Q Q, JIANG F L, WANG J N, et al. Effects of different dietary ingestions on glucose and lipid metabolism, intestinal microbiota in mice[J]. Food Research and Development,2021,42(10):16−23. doi: 10.12161/j.issn.1005-6521.2021.10.003 [29] 咸魁锋, 尹虹. 豆蔻属植物化学成分和药理作用研究进展[J]. 天然产物研究与开发,2019,31(10):1831−1836. [XIAN K F, YIN H. Research progress on chemical constituents and pharmacological activities of Amomum plants[J]. Natural Product Research and Development,2019,31(10):1831−1836. [30] 单恬恬, 代钰, 徐筱莹, 等. 14种香辛料提取物的多酚、黄酮含量及抗氧化活性比较研究[J]. 中国调味品,2019,44(4):80−83, 88. [SHAN T T, DAI Y, XU X Y, et al. Comparative study on polyphenols, flavonoids and antioxidant activities of 14 spices' extracts[J]. China Condiment,2019,44(4):80−83, 88. doi: 10.3969/j.issn.1000-9973.2019.04.017 [31] 任洪涛, 谭年文, 周恒苍, 等. 高效液相色谱法测定草果中4种酚酸含量[J]. 食品安全质量检测学报,2021,12(9):3694−3699. [REN H T, TAN N W, ZHOU H C, et al. Determination of 4 kinds of phenolic acids content from the Amomum tsao-ko by high performance liquid chromatograph[J]. Journal of Food Safety & Quality,2021,12(9):3694−3699. [32] YU L Q, SHIRAI N, SUZUKI H, et al. The effect of methanol extracts of tsao-ko (Amomum tsao-ko Crevost et Lemaire) on digestive enzyme and antioxidant activity in vitro, and plasma lipids and glucose and liver lipids in mice[J]. Journal of Nutritional Science and Vitaminology,2010,56(3):171−176. doi: 10.3177/jnsv.56.171
[33] FLORES-BOCANEGRA L, GONZALEZ-ANDRADE M, BYE R, et al. α-Glucosidase inhibitors from Salvia circinata[J]. Journal of Natural Products,2017,80(5):1584−1593. doi: 10.1021/acs.jnatprod.7b00155
[34] 陈浩南, 李姣, 王婉愉, 等. 高良姜水提物的体外抗氧化和胰脂肪酶、α-葡萄糖苷酶抑制功能研究[J]. 中国调味品,2019,44(4):43−47,51. [CHENG H N, LI J, WANG W Y, et al. Antioxidant activities and inhibitory effects against pancreatic lipase and α-glucosidase of galangal aqueous extracts in vitro[J]. China Condiment,2019,44(4):43−47,51. doi: 10.3969/j.issn.1000-9973.2019.04.010 [35] 刘富月. 生姜中降血糖物质的初步筛选[D]. 泰安: 山东农业大学, 2015. LIU F Y. Preliminary screening of hypoglycemic substance in ginger[D]. Taian: Shandong Agricultural University, 2015.
[36] 吴相欢. 黄姜花药理活性及其相关机制研究[D]. 贵阳: 贵州大学, 2020. WU X H. Study on pharmacological activity of Hedychium avum roxb. and related mechanism [D]. Guiyang: Guizhou University, 2020.
[37] HE X F, ZHANG X K, GENG C A, et al. Tsaokopyranols A–M, 2, 6-epoxydiarylheptanoids from Amomum tsao-ko and their α-glucosidase inhibitory activity[J]. Bioorganic Chemistry,2020,96:103638. doi: 10.1016/j.bioorg.2020.103638
[38] HE X F, WANG H M, GENG C A, et al. Amomutsaokols A–K, diarylheptanoids from Amomum tsao-ko and their α-glucosidase inhibitory activity[J]. Phytochemistry,2020,177:112418. doi: 10.1016/j.phytochem.2020.112418
[39] CHRIST A, LAUTERBACH M, LATZ E. Western diet and the immune system: An inflammatory connection[J]. Immunity,2019,51(5):794−811. doi: 10.1016/j.immuni.2019.09.020
[40] CANI P D, BIBILONI R, KNAUF C, et al. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice[J]. Diabetes, 2008, 57(6): 1470-1481.
[41] 李姣. 草果醇提物对糖尿病大鼠糖脂代谢及氧化应激影响的研究[D]. 郑州: 郑州大学, 2020. LI J. Effects of ethanol extract of Amomum tsao-ko Crevost et Lemarie on glucose and lipid metabolism and oxidative stress in diabetic rats[D]. Zhengzhou: Zhengzhou University, 2020.





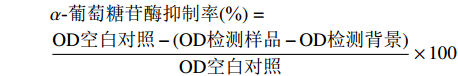

 下载:
下载:


 下载:
下载:
