Research Progress in Chondroitinase
-
摘要: 硫酸软骨素(chondroitin sulfate,CS)是由葡萄糖醛酸和乙酰半乳糖胺交替连接的带负电荷的线性大分子多糖,具有多种生理活性,包括修复关节软骨、抗氧化、降血脂、抗凝血、抗血栓及抗肿瘤等,但CS的高分子量限制了其很多功能的有效发挥。软骨素裂解酶(chondroitinase,Chase)作为一类降解CS的裂解酶,可裂解CS产生低分子量CS,从而有效克服CS生物利用率低的缺点。本文结合笔者工作,简要介绍了CS和低分子量CS的生物活性,阐述了Chase裂解CS的催化机制,系统梳理了Chase的种类和来源、发酵生产和表征以及重组表达和应用方面的研究进展,以期深入理解低分子量CS和Chase的研究现状和发展趋势,促进Chase的工业化生产。Abstract: Chondroitin sulfate (CS) is a negatively charged linear macromolecule polysaccharide interlaced with glucuronic acid and acetylgalactosamine. It has a variety of physiological activities, including repair of articular cartilage, antioxidant, lipid-lowering, anticoagulant, antithrombotic and antitumor, etc. However, the high molecular weight of CS restricts its effective use of many functions. Chondroitinase (Chase), as a type of lyase that degrades CS, can cleave CS to low-molecular-weight CS, which effectively overcomes the shortcomings of low bioavailability. Based on the author’s work, this article briefly introduces the biological activities of CS and low-molecular-weight CS, expounds on the catalytic mechanism of Chase cracking CS, systematically sorts out the types and sources of Chase, fermentation production and characterization, as well as research progress in recombinant expression and application, view intending to deeply understand the research status and development trend of low molecular weight CS and Chase, and promote the industrial production of Chase.
-
硫酸软骨素(chondroitin sulfate,CS)是一类由D-葡萄糖醛酸和N-乙酰-D-半乳糖胺交替连接的带负电荷的线性多糖[1],具有多种生理活性,如治疗骨关节炎、修复关节软骨、抗氧化、延缓衰老、抗凝血、抗血栓、降血脂、抗动脉粥样硬化、抗肿瘤及增强免疫力等功效,广泛应用于医药、食品和化妆品行业[2-3]。由于CS分子量和电荷密度较大,吸收率较低,极大地限制了其功效的发挥,研究发现降低CS分子量后,可以明显提高CS的生物利用率[4]。
软骨素裂解酶(chondroitinase,Chase)是一类可降解CS等糖胺聚糖的裂解酶,可以制备高活性的低分子量CS,且本身也具有多种生物活性和药用价值,如修复脊髓损伤、减轻腰椎间盘突出的症状、治疗瘢痕疙瘩、抑制肿瘤发展以及治疗弱视等[5]。Chase来源于微生物,由产酶菌株发酵获得,目前的研究主要集中于Chase的基因克隆和重组表达方面。为了深入理解低分子量CS和Chase的研究现状和发展趋势,促进Chase的进一步开发利用,本文介绍了CS及低分子量CS的生物活性,Chase的来源、种类、发酵生产、表征以及催化机制,归纳总结了Chase重组表达和应用方面的研究进展。
1. 硫酸软骨素简介
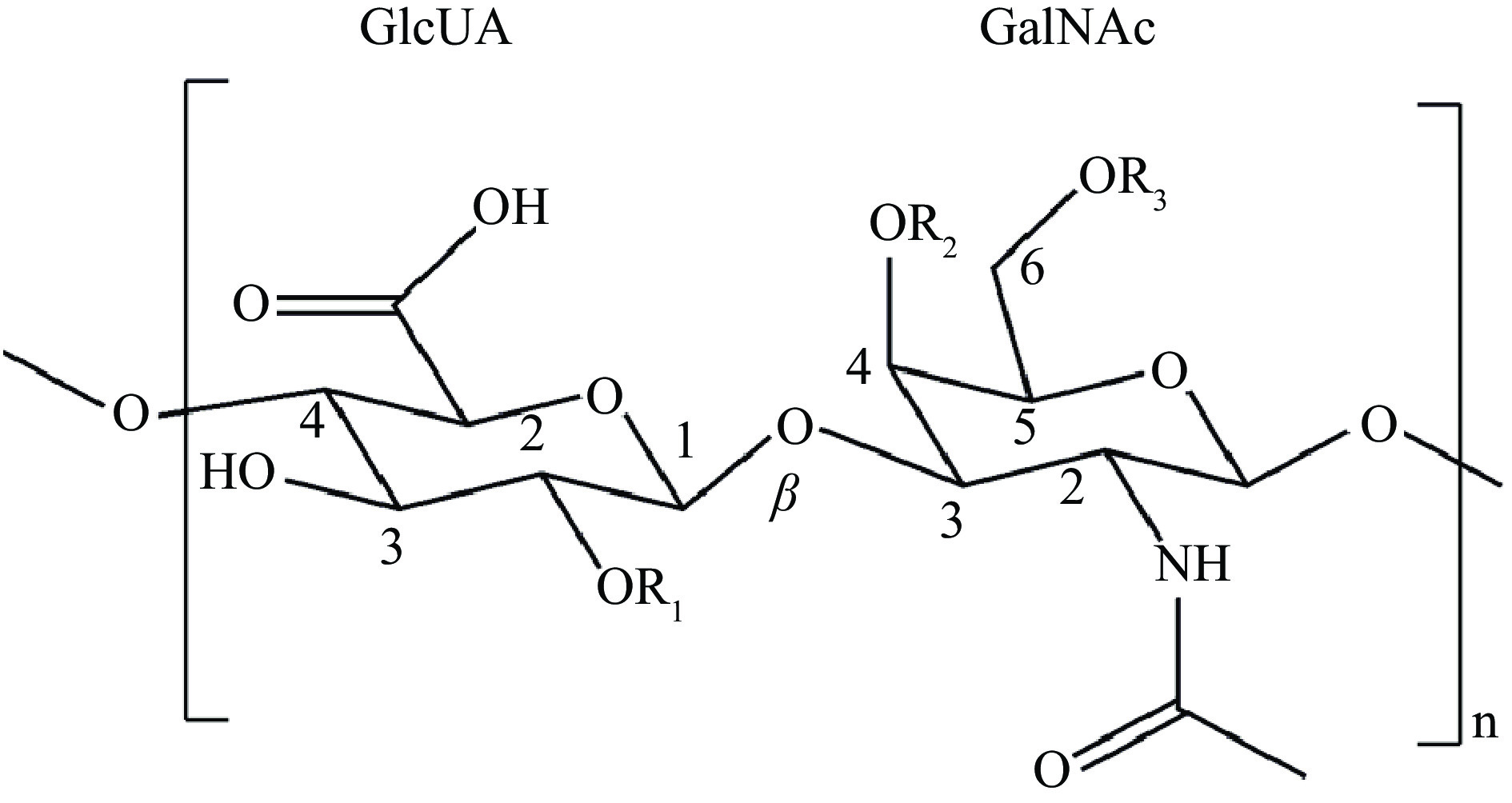
糖胺聚糖(glycosaminoglycans,GAGs)是一类由氨基己糖和己糖醛酸交替连接而成的直链多糖,包括硫酸软骨素(chondroitin sulfate,CS)、透明质酸(hyaluronic acid,HA)、硫酸角质素(keratan sulfate,KS)和硫酸乙酰肝素(heparan sulfate,HS),GAGs在动物体内通常以蛋白聚糖的形式存在[6]。作为GAGs的主要种类,CS是一类从动物组织中提取出的GAGs,广泛存在于脊椎动物结缔组织的细胞表面和细胞外基质中,如骨、软骨、皮肤、韧带和肌腱[7],在保持关节软骨的弹性、抗炎、止血、调节细胞发育、细胞黏附分化和增殖等生命活动中具有至关重要的作用[8]。CS的基本化学结构如图1所示[9],以D-葡萄糖醛酸(D-glucuronic acid,GlcUA)和N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine,GalNAc)通过β-1,3糖苷键连接为基本二糖单位,二糖单位之间通过β-1,4糖苷键连接,分子量约10~100 kDa[10]。GlcUA和GalNAc残基在不同位置都能携带不同数量的硫酸基团,根据硫酸化程度的不同,CS分为多种类型,包括CS-A(GlcUAβ1-3GalNAc(4S))、CS-C(GlcUAβ1-3GalNAc(6S))、CS-D(GlcUA(2S)β1-3GalNAc(6S))、CS-E(GlcUAβ1-3GalNAc(4S, 6S))等。CS-B又称硫酸皮肤素(dermatan sulfate,DS),其二糖单位与CS-A的二糖单位不同,为L-艾杜糖醛酸(L-iduronic acid,IdoUA)和GalNAc,IdoUA和GalNAc通过α-1,3糖苷键连接,GalNAc的4位携带一个硫酸基团[11]。
CS具有多种生物活性,如修复关节软骨、抗氧化、延缓衰老、抗凝血、抗血栓、降血脂、抗动脉粥样硬化及抗肿瘤等,但CS的高分子量和高电荷密度,导致其生物利用率较低,限制了其生物功效的发挥。越来越多的证据表明,低分子量CS具有黏度小、溶解性好、易吸收等优点,可有效克服CS生物利用率低的缺点。目前,低分子量CS主要通过酸降解法、氧化降解法、超声降解法、辐射降解法以及酶解法获得[10]。酸降解法会将CS的硫酸基团去除,从而影响其产物的生物活性;氧化降解法用到的氧化剂多为有毒试剂;超声降解法和辐射降解法,要求较高级的实验设备以及工艺较复杂。相比之下,酶解法具有反应条件温和、催化效率高、操作简便、作用底物专一、产物分子量可控性高、过程无污染、对CS的降解产物影响小的优点,因此具有更高的性价比和优势[9]。Wang等[12]从鸡皮和软骨组织中提取纯化出CS并酶解,发现酶解后低分子量的CS对DPPH的清除率和铁离子还原能力显著提高,也增强了Caco-2细胞对铁的吸收,其原因可能是CS分子量降低和羟基基团数量增加。Li等[13]比较了美鳐软骨CS降解前后的治疗肥胖的效果发现,CS可以抑制胰腺脂肪酶活性,减少肠道脂肪的吸收,较高分子量的CS对脂肪酶的抑制活性高于较低分子量的CS;低分子量CS会影响脂肪细胞的增殖、分化和代谢,改善肥胖,抑制体重、肝脏重量和脂肪组织重量的增加,维持较低的食物消耗,抑制甘油三酯的肠道吸收,调节血清内毒素水平。
2. 软骨素裂解酶
2.1 软骨素裂解酶的催化机制
Chase是一类来源于微生物的,能将硫酸软骨素、软骨素、透明质酸等糖胺聚糖降解为不饱和二糖和寡糖的裂解酶。Chase作用于GlcUA和GalNAc二糖单位之间的β-1,4糖苷键,通过β-消除的方式将CS裂解为不饱和二糖及寡糖,并在产物的非还原端形成4,5-不饱和糖醛酸,裂解机理如图2所示[14]。Chase降解CS的裂解过程一般包括三个阶段:a.中和位于糖醛酸上的羧基,降低pKa以稳定随后形成的烯醇式阴离子中间体;b.广义碱夺去位于糖醛酸C-5处的质子,形成底物的共轭碱碳负离子;c.从羧基发生电子转移,1,4糖苷键断裂,离去基团离去,在糖醛酸C4和C5之间形成双键[15]。
2.2 软骨素裂解酶的种类和来源
Chase根据酶切方式可分为内切型Chase和外切型Chase,内切型Chase随机断裂CS多糖链内部的β-1,4糖苷键,先生成分子质量较大的寡糖,再生成分子质量较小的寡糖,最后生成二糖;外切型Chase从CS多糖链的末端依次断裂β-1,4糖苷键并释放不饱和二糖[16]。来源于肝素黄杆菌的Chase表现内切活性,而来源于金黄节杆菌的Chase为外切型酶。Lunin等[17]通过比对两者的结构,发现外切型Chase(金黄节杆菌)在N端有两段氨基酸的插入,这两段氨基酸形成了含有α-螺旋的环,这些环将开放的裂缝转变为深腔,深腔的大小限制了CS的结合,只能容纳2~3个单糖,因此表现为外切活性。
Chase根据其作用底物可以分为Chase ABC、Chase AC、Chase B等。
2.2.1 软骨素裂解酶ABC
Chase ABC的作用底物为CS-A、CS-B、CS-C和HA,可生成ΔDi-4s、ΔDi-6s、ΔDi-0s不饱和二糖及寡糖。根据酶切方式,Chase ABC又可分为Chase ABC Ⅰ和Chase ABC Ⅱ,其中Chase ABC Ⅰ具有内切活性,将CS降解为不饱和寡糖及二糖,Chase ABC Ⅱ具有外切活性,从CS的末端依次降解释放不饱和二糖[18]。Chase ABC最初在普通变形杆菌(Proteus vulgaris NCTC 4636)中发现[19],随后发现奇异变形杆菌(Proteus mirabilis WP-1)[20]、多形拟杆菌(Bacteroides thetai-otaomicron ATCC 29148)[21]、彭氏变形杆菌(Proteus penneri GT38)[22]、少动鞘氨醇单胞菌(Sphin-gomonas paucimobilis)[23]、弧菌(Vibrio sp. FC509)[24]和不动杆菌(Acinetobacter sp. C26)[25]代谢产物中也含有Chase ABC。
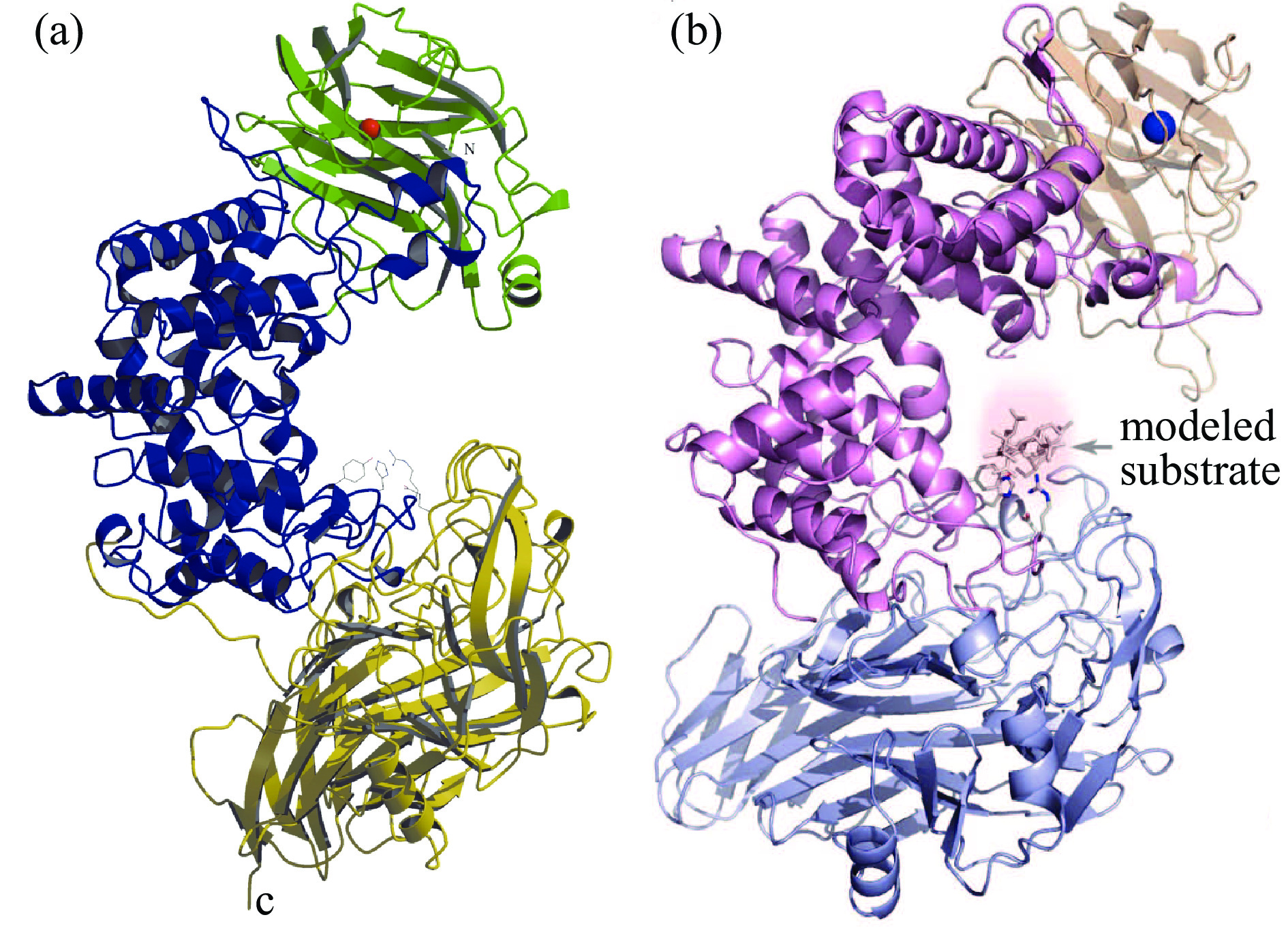
来源于普通变形杆菌的Chase ABC为内切型酶(Chase ABC Ⅰ),其晶体结构已经被解析,如图3(a)所示[26]。Chase ABC Ⅰ由3个结构域组成,N端结构域为双层β-折叠和一个短的α-螺旋,中间结构域为15个α-螺旋,C端结构域为4个反平行的β-折叠[27]。底物结合位点在中间结构域,经过定点突变的方法,发现Chase ABC Ⅰ的催化位点为His501、Tyr508、Arg560和Glu653,其中His501在催化过程中起到广义碱的作用夺取糖醛酸C5上的质子,Glu653参与催化位点氢键网络构建,Arg560起到中和糖醛酸羧基,稳定催化过程中形成的烯醇式阴离子中间体的作用,Tyr508作为质子供体,使离去基团质子化[26]。来源于多形拟杆菌的Chase ABC为外切型酶(Chase ABC Ⅱ),其晶体结构如图3(b)所示,Chase ABC Ⅱ的晶体结构与Chase ABC Ⅰ非常相似,由位于N端的双层β-折叠、位于中间区域的双层(α/α)5圆环和位于C端的4个反平行β-折叠组成[28]。通过定点突变实验,确定Chase ABC Ⅱ的催化位点为His454、Tyr461、Arg512和Glu628[27]。Chase ABC Ⅰ和Chase ABC Ⅱ的N端有Ca2+结合位点,当催化体系中有Ca2+存在时,Chase ABC Ⅰ和Chase ABC Ⅱ的催化效率大大提高。
2.2.2 软骨素裂解酶AC
Chase AC的作用底物为CS-A、CS-C、软骨素和HA,生成ΔDi-4s、ΔDi-6s不饱和二糖及寡糖。Chase AC最早是在肝素黄杆菌(Flavobacterium heparinum ATCC 13125)中发现,该Chase AC是具有内切活性的Chase AC Ⅰ[29]。随后,Hiyama等[30]从土壤中筛选到产胞外Chase AC(Chase AC Ⅱ)的金黄节杆菌(Arthrobacter aure-scens),Chase AC Ⅱ的切割方向为从CS链的还原端到非还原端[31]。随着对Chase AC来源的研究越来越深入,人们陆续筛选出气单胞菌(Aeromonas sp.)[32]、粪便拟杆菌(Bacteroides stercoris HJ-15)[33]、温和气单胞菌(Aeromonas sobria YH311)[34]、粘质沙雷氏菌(Serratia marcescens GT596)[35]、节杆菌(Arthrobacter sp. MAT3885[36]和Arthrobacter sp. CS01[37])发酵可产生Chase AC。
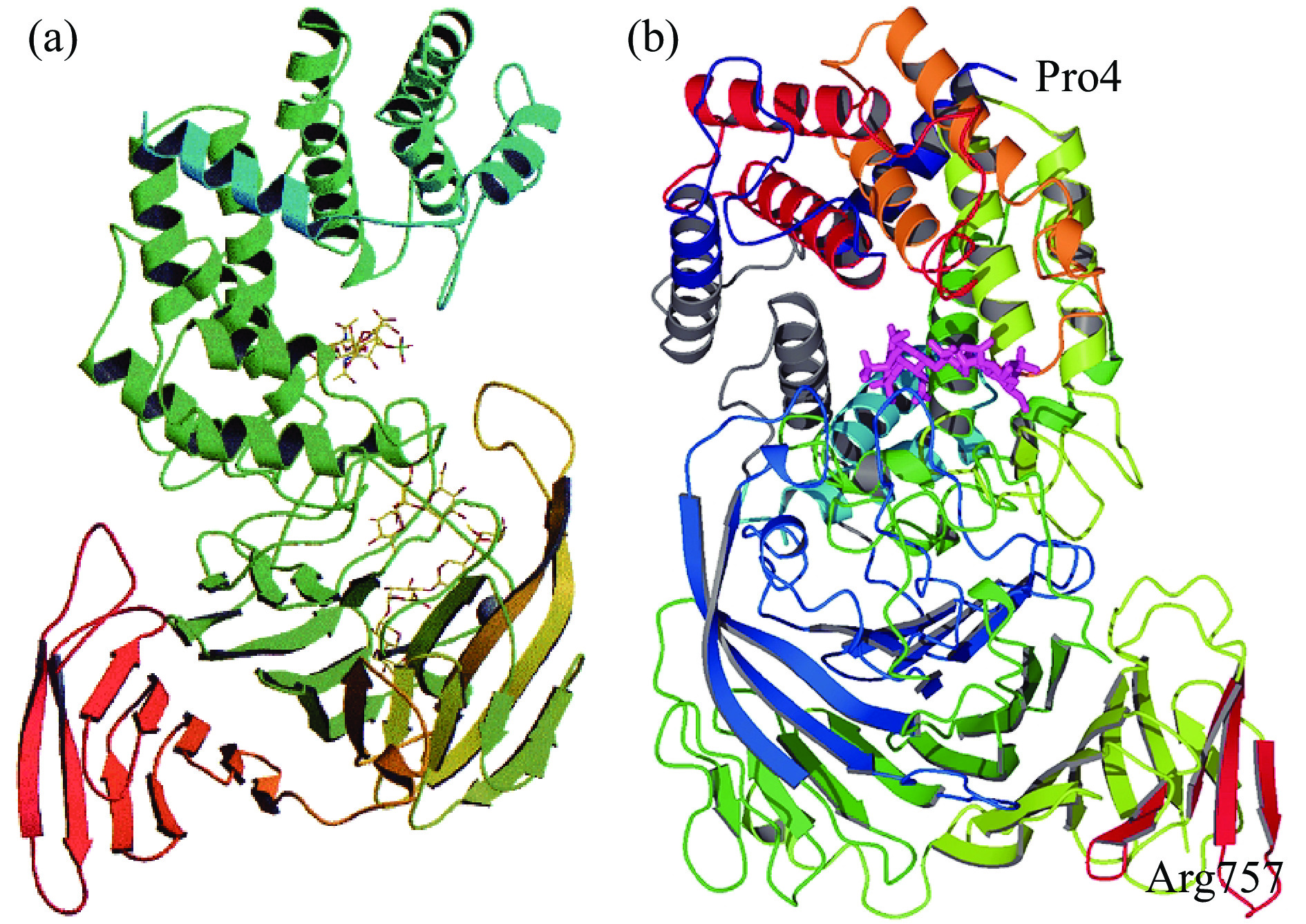
来源于肝素黄杆菌的Chase AC Ⅰ的晶体结构如图4(a)所示,由位于N端的α-螺旋和位于C端的β-折叠两个结构域组成,N端是不完整的双层(α/α)5圆环,包含了催化位点和大部分的底物结合位点,C端是由4个反平行的β-折叠组成[38]。Chase AC Ⅰ的催化中心包括His225、Tyr234、Arg288和 Glu371,其中His225或者Tyr234在催化过程中起到广义碱的作用夺取糖醛酸C5上的质子,Arg288起到中和糖醛酸羧基,稳定催化过程中形成的烯醇式阴离子中间体的作用[14]。来源于金黄节杆菌的Chase AC Ⅱ的晶体结构如图4(b)所示,与Chase AC Ⅰ的晶体结构相似,C端由4个反平行的β-折叠组成,N端由13个α-螺旋组成,其中10个α-螺旋形成不完整的双层(α/α)5圆环,在环面一侧有一凹槽,形成活性位点和底物结合位点[17]。Chase AC Ⅱ的催化位点为Tyr242、His233、Arg296和Glu407,Tyr242在催化过程中夺取糖醛酸C5的质子。与Chase ABC不同的是,Chase AC的活性不受Ca2+的影响。
2.2.3 软骨素裂解酶B
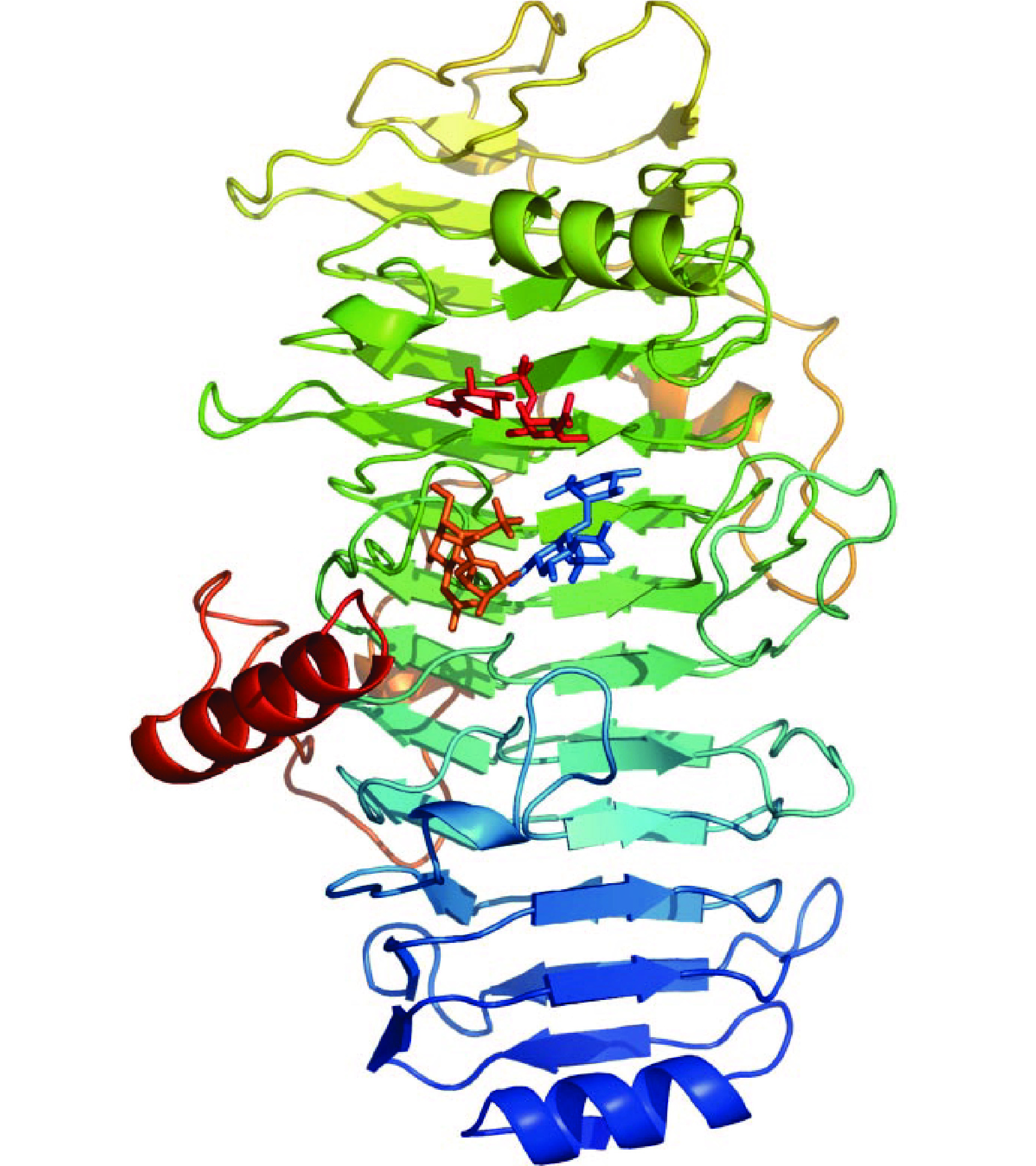
Chase B仅能降解CS-B和HA,生成ΔDi-0s不饱和二糖及寡糖。目前商品化的Chase B来源于肝素黄杆菌,且具有内切活性。由于Chase B作用底物有限,因此对其药用价值的研究比较少[39]。Chase B的晶体结构与Chase ABC和Chase AC的晶体结构完全不同,如图5所示,由13个卷曲的β-螺旋组成[40]。定点突变技术分析表明,Lys250、Arg271、His272和Glu333参与了酶的催化,Glu333可能作为广义碱夺取糖醛酸C5质子[41]。Chase B必须在Ca2+的存在下才能发挥活性,原因可能是Ca2+起到中和IdoUA羧基而稳定随后形成的烯醇式阴离子中间体的作用。
2.3 软骨素裂解酶的发酵生产和表征
Chase最初的生产方式是由原始产酶菌株发酵获得,产酶菌株发酵培养后,经过硫酸铵沉淀、阴离子交换层析、凝胶过滤层析、高效液相色谱等一系列步骤分离纯化出Chase。Chase研究的早期,生产Chase的菌株大多为胞内生产形式[29,33,35]。胞内生产需要对菌株进行细胞破碎,释放目的蛋白Chase,破碎过程会对酶的活性造成一定损失,同时消耗额外能源。因此,近年来国内的研究主要集中在筛选以胞外分泌形式生产Chase的菌株,胞外分泌的菌株将Chase直接释放到发酵液中,无需对细胞进行破碎,节约能源同时减少酶活的损失,缺点在于发酵液成分复杂,Chase的分离纯化较为困难。已筛选到可胞外分泌Chase ABC的菌株有Sphingomonas paucimobilis[23]、Acinetobacter sp. C26[25]等,此外Arthrobacter aurescens[30]、Aeromonas sobria YH311[34]、Arthrobacter sp. MAT3885[36]、Arthrobacter sp. CS01[37]等可分泌产生Chase AC。菌株发酵生产Chase的过程,受碳源、氮源、发酵液pH、发酵温度、通氧量等因素的影响,通过对上述影响因素进行优化,可提高Chase的产量和酶活。但菌株产Chase需要CS作为碳源进行诱导,原因可能是CS胁迫菌株产生Chase,降解利用CS以满足自身生长繁殖。
Chase属于蛋白质类,目前对于蛋白质的分离纯化技术已很成熟,如表1所示,主要采用硫酸铵沉淀、阴离子交换层析和凝胶层析进行Chase的分离纯化。由于Chase分离纯化过程较繁琐,能耗较大,工业化成本较高,酶的比酶活虽然得到一定程度地提升,但分离纯化过程中酶活损失较多。因此,探究新型Chase分离纯化方法对Chase的发酵生产至关重要。
表 1 软骨素裂解酶的纯化和表征Table 1. Purification and characterization of chondroitinase软骨素
裂解酶产酶微生物 分离纯化方法 比酶活
(U/mg(protein))纯化倍数 回收率 最适催化
温度/pH分子量 参考文献 Chase ABC 少动鞘氨醇
单胞菌硫酸铵沉淀、DEAE-Sepharose FF离子交换层析、Sephadex G-100凝胶过滤层析 98.04 155.62 46.87% 40 ℃
pH6.582.3 kDa [42] 不动杆菌C26 硫酸铵沉淀、Q-Sepharose Fast Flow(QFF)阴离子交换层析、Sephadex G-100凝胶过滤层析 348.64 48.09 11.27% 42 ℃
pH5~676 kDa [43] 黄杆菌RC-9 硫酸铵沉淀、QFF阴离子交换层析、Sephacryl S-1000凝胶过滤层析 2.09 1.46 28.06% 32.5 ℃
pH8.041 kDa [44] 普通变形杆菌 60%饱和度硫酸铵沉淀、透析、Sephadex 6B凝胶过滤层析 5000 17.36 35.2% 37 ℃
pH8.0111.3 kDa [45] Chase AC 粘质沙雷氏菌GT596 硫酸铵沉淀、DEAE-Sepharose FF离子交换层析、Sephacryl S-200凝胶过滤层析 81 11 39% 40 ℃
pH7.570 kDa [35] Fu等[42]从Sphingomonas paucimobilis中分离纯化出Chase ABC,并测定了Chase ABC的最适催化温度和pH分别为40 ℃、pH6.5,分子量为82.3 kDa。Zhu等[43]从Acinetobacter sp. C26中纯化出的Chase ABC和来源于Sphingomonas paucimobilis中的Chase ABC酶学性质相似,最适催化温度42 ℃,最适催化pH5.0~6.0,分子量为76 kDa。但是来源于黄杆菌RC-9的Chase ABC的酶学性质与上述两种Chase ABC的性质略有不同,最适催化温度较低(32.5 ℃),最适催化pH偏碱性(8.0),分子量相对较低,为41 kDa[44]。通过测定Chase的酶学性质,发现Chase的分子量大多为70~100 kDa,在偏中性(pH6~8)条件下表现较高的酶活力,其最适催化温度为37~42 ℃,接近人体的温度,有利于其在临床治疗中的应用。
2.4 软骨素裂解酶的基因克隆和重组表达
Chase的传统生产方法是利用Chase产生菌株发酵获得,但是分离纯化步骤繁琐,酶的产量和纯度较低,极大地限制了Chase的工业化生产和应用。随着现代分子生物技术的迅速发展,Chase重组表达技术日趋成熟,利用重组表达体系生产Chase具有低成本、高效率、短周期的优点,重组Chase已广泛应用于医学研究中。早在2001年,Pojasek等[46]在大肠杆菌中表达了来源于肝素黄杆菌的Chase AC和Chase B,并经过一步亲和层析分离纯化出Chase AC和Chase B,比酶活分别为541 U/mg(蛋白质)和84.6 U/mg(蛋白质);Gu Kenan等[29]利用肝素黄杆菌发酵产生Chase AC和Chase B,通过鱼精蛋白沉淀、阴离子交换层析、羟基磷灰石层析和凝胶渗透色谱分离纯化Chase AC,纯化后的Chase AC比酶活为111 U/mg(蛋白质),通过阳离子交换层析、硫酸纤维素层析、羟基磷灰石层析和凝胶渗透色谱分离纯化Chase B,纯化后的Chase B比酶活为278 U/mg(蛋白质),Chase B的比酶活是重组Chase B比酶活的3倍,但分离纯化过程繁琐,酶活损失严重(回收率18.9%)。
大肠杆菌(E. coli)表达系统具有遗传背景清晰、分子操作简便、生长周期短、可实现大规模培养发酵等优点,是表达重组蛋白常用的宿主[47],目前Chase主要在大肠杆菌宿主中重组表达。重组Chase在表达宿主内过表达时快速合成和空间有限等原因,容易发生错误折叠或形成不溶性的包涵体,从而影响重组Chase的产量和活性[48]。因此,改善重组Chase的折叠和溶解性对Chase的活性至关重要,目前主要通过选择和优化信号肽、共表达分子伴侣、引入融合标签以及敲除细胞膜相关基因和定点突变等途径改善重组Chase折叠和溶解性,提高重组Chase的产量和活性。
2.4.1 选择和优化信号肽
信号肽是一段较短的特定氨基酸序列,引导新合成的蛋白质从细胞质中转运到膜外或周质空间,对蛋白质的折叠过程有影响,可促进蛋白质的可溶性表达,避免包涵体的形成。Lu等[49]在E. coli BL21 (DE3)中表达了来源于Proteus vulgaris ATCC33420的Chase ABC Ⅰ,并在Chase ABC Ⅰ的N端引入信号肽PelB,实现了重组Chase ABC Ⅰ的可溶性表达,优化E. coli BL21 (DE3)表达Chase ABC Ⅰ的培养基成分后酶活可达17.55 U/mL(发酵上清液)。Wang等[50]在E. coli BL21 (DE3)中表达了来源于Proteus vulgaris IFO3988 的Chase ABC Ⅰ,并引入信号肽PelB、OmpA和PhoA,发现信号肽的引入使Chase ABC Ⅰ以分泌形式表达,结果表明引入信号肽可使Chase ABC主要以分泌型表达,避免细胞破碎引起的酶活损失,Chase产量和活性明显提高。
2.4.2 共表达分子伴侣
细胞中的某些蛋白质分子可以识别正在合成的多肽或部分折叠的多肽,并与多肽的某些部位相结合,从而帮助这些多肽转运、折叠或组装,这一类分子本身并不参与最终产物的形成,因此被称为“分子伴侣”。分子伴侣可有效改善重组目的蛋白的折叠、溶解性和跨膜运输。Fang等[51]在E. coli BL21 (DE3)中表达了来源于Arthrobacter sp. CS01的Chase AC Ⅱ,共表达了分子伴侣DnaK-DnaJ-GrpE、触发因子(trigger factor,TF)和GroEL-GroES,研究发现共表达分子伴侣GroEs-GroEL显著提高了Chase AC Ⅱ的产量。Li等[52]在大肠杆菌中表达了来源于Proteus vulgaris KCTC2579的Chase ABC Ⅰ,同时为改善折叠和溶解性,共表达了相关的7种分子伴侣,发现共表达分子伴侣GroES可以显著提高Chase ABC Ⅰ的产量,且可以提高Chase ABC Ⅰ与底物CS-A的亲和力。
2.4.3 引入融合标签
融合标签是在重组目的蛋白的N端或C端进行融合表达的特定蛋白质、多肽或寡肽标签。引入融合标签,如谷胱甘肽转移酶(GST)、3-磷酸甘油醛脱氢酶(GAPDH)、麦芽糖结合蛋白(MBP)、小泛素样修饰酶(SUMO)、硫氧还原蛋白(Trx),可提高重组目的蛋白的表达水平,增强溶解度。其中MBP作为最受欢迎的融合标签之一,可显著提高重组目的蛋白的溶解性,而且MBP可与麦芽糖和直链淀粉特异性亲和吸附方便进行分离纯化,因此有越来越多的研究者将MBP与Chase融合表达,促进Chase的可溶性表达。Chen等[53]在表达来源于Proteus vulgaris KCTC2579 的Chase ABC Ⅰ时,引入融合标签MBP与Chase ABC Ⅰ共表达,实现了Chase ABC Ⅰ的可溶性表达,并测定了MBP-Chase ABC Ⅰ的酶学性质,研究发现MBP-Chase ABC Ⅰ的最适催化温度和最适催化pH分别为55 ℃、7.73,MBP-Chase ABC Ⅰ在30 ℃保温210 min,酶活保留78%左右,MBP提高了Chase ABC Ⅰ的热稳定性。
2.4.4 敲除细胞膜相关基因
敲除或抑制与细胞壁和细胞膜生物合成相关的基因,构建重组渗漏菌株,增加膜的通透性,可实现重组目的蛋白的胞外分泌。Wang等[50]克隆表达了来源于Proteus vulgaris IFO3988 的Chase ABC Ⅰ,将309位的异亮氨酸突变为缬氨酸,显著提高了Chase ABC Ⅰ的酶活;在突变的基础上,引入信号肽OmpA,并敲除脂蛋白编码基因(lpp)改善细胞膜通透性,实现了Chase ABC Ⅰ的分泌型表达。
2.5 软骨素裂解酶的应用
2.5.1 软骨素裂解酶在基础研究的应用
Chase降解CS等糖胺聚糖,生成二糖及寡糖,可用于构建二糖和寡糖的文库,研究糖胺聚糖的结构和性质。Chase作为工具酶,可用于高效制备具有多种生物活性的CS低聚糖[54]。Valcarcel等[55]利用Chase降解五种海洋来源CS,构建了Chase催化时间和产物平均分子量的预测模型,根据模型能够有效推测出获得确定分子量的CS所需的催化时间,从而可以利用Chase高效制备不同分子量的CS,有利于不同分子量CS与其生物活性关系的研究。Chase可用于检测药物及各种组织中CS的含量,如鲍伦军等[56]利用Chase酶解-高效液相色谱的方法检测鱼翅中CS的含量,共检测了9种具有代表性的鱼翅产品,其CS含量均在1.24%~3.12%,该方法具有准确度和精密度较高的优点。
2.5.2 软骨素裂解酶在医学领域的应用
Chase作用于硫酸软骨素蛋白聚糖(chondroitin sulfate proteoglycans,CSPGs)的能力决定了其生物活性。CSPGs是机体正常功能所必需的,CSPGs水平的升高或降低会导致各种病理状态,如脊髓损伤和玻璃体脱离等病理状态是由CSPGs水平升高引起的,Chase可特异性地降解CSPGs,降低CSPGs水平,从而使CSPGs恢复正常水平,机体恢复正常功能[57]。因此,Chase在医学领域具有广泛的应用价值。
修复脊髓损伤。脊髓发生原发性损伤后,神经胶质和非中枢神经系统细胞侵入损伤部位,保护脊髓免受继发性损伤,这导致了瘢痕的形成,从而抑制轴突再生。CSPGs作为瘢痕的重要组成部分,在抑制轴突再生中发挥着重要作用。而CSPGs主要是通过CS侧链抑制轴突再生,因此去除CS糖链可使轴突再生,Chase可降解CS糖链,从而能够促进轴突再生,修复脊髓损伤[58]。
减轻腰椎间盘突出。腰椎间盘突出症是指纤维环断裂及髓核突出使腰椎间盘组织局限性移位而压迫邻近的韧带和神经根导致腰痛及下肢疼痛的一种常见病[59]。Chase可选择性地降解椎间盘内软骨基质中的蛋白聚糖,减轻椎间盘内压力,达到消除腰椎间盘突出的临床症状。而且,Chase对神经、血管及周围组织的较高安全性已经得到充分证实,表明Chase在治疗腰椎间盘突出症中的巨大潜力[60]。
治疗瘢痕疙瘩。当机体缺乏弹性纤维(正常皮肤的主要细胞外基质成分)时,皮肤伤口愈合中会形成过度生长的、隆起于皮肤表面的红色或红褐色的异常瘢痕组织,称为瘢痕疙瘩。Ishiko等[61]将取自患者的瘢痕疙瘩组织移植到裸鼠身上,并将Chase ABC注射到移植的瘢痕组织中,发现Chase ABC可以显著降低瘢痕疙瘩组织的体积,恢复弹性纤维的形成。因此,注射Chase可作为治疗瘢痕疙瘩的一种新疗法。
抑制肿瘤的发展。CS可以参与细胞间交流、传导过程,进而调控肿瘤细胞的增殖和迁移[57]。因此,CSPGs经 Chase降解后,侧链的CS基团暴露后作用于细胞,从而阻断信号传导过程,抑制肿瘤的发展[62]。
治疗弱视。弱视的病理本质为视觉皮质功能与结构的发育异常,细胞外基质在视觉发育关键期后期所发生的成分变化被认为是导致视觉皮质可塑性明显降低的重要原因之一,其中CSPGs含量的增加最受关注[63]。用Chase从成熟的细胞外基质中去除CSPGs可促进视觉皮层的可塑性,促进双眼视觉的重建[64]。但该研究仍处于起步阶段,在批准其用于弱视治疗之前,仍需进行大量实验。
2.5.3 软骨素裂解酶在其他领域的应用
Chase还可用于皮革制造业。动物皮革中含有蛋白聚糖,用Chase处理动物皮革,能特异性地降解蛋白聚糖中的糖胺聚糖链,从而使皮革结构变得疏松,增强了皮革的透性和弹性,进而提高了皮革的质量[65]。Chase可以高选择性地裂解CS,因此具有用来特异性的去除粗品肝素中CS杂质制备精品肝素的潜力。
3. 结语
酶解后的低分子量CS相较于未酶解的CS,生物利用率提高,能更好发挥CS的功能。目前对低分子量CS的生理活性研究广泛,抗氧化、抗肿瘤、降血脂等功效都有所涉及,但研究较为笼统,酶解后CS的分子量与生理活性的关系缺乏深入研究,低分子量CS提高生理活性的机理研究较为缺乏。近年来已从多种菌株中获得Chase,Chase的分离纯化方法也较成熟,但在分离纯化过程中Chase酶活损失严重,因此越来越多的研究者利用分子手段,构建Chase的重组表达载体,在宿主细胞中进行异源表达。虽然Chase的重组表达存在重组蛋白错误折叠和溶解性差的困难,但越来越多的研究者通过引入信号肽、融合表达分子伴侣、引入融合标签和敲除细胞壁或细胞膜生物合成的相关基因等方法,改善了重组Chase的溶解度,提高了Chase的产量和酶活。目前对于Chase的重组表达大多停留在实验室阶段,重组Chase的纯度和酶活性大多能达到工业化生产的要求,但重组Chase多采用亲和吸附进行分离纯化,成本较高,是制约Chase工业化生产的主要瓶颈。因此,选择合适的标签构建融合表达载体实现Chase高效快速的分离纯化,是实现Chase工业化生产亟需解决的问题之一。
-
表 1 软骨素裂解酶的纯化和表征
Table 1 Purification and characterization of chondroitinase
软骨素
裂解酶产酶微生物 分离纯化方法 比酶活
(U/mg(protein))纯化倍数 回收率 最适催化
温度/pH分子量 参考文献 Chase ABC 少动鞘氨醇
单胞菌硫酸铵沉淀、DEAE-Sepharose FF离子交换层析、Sephadex G-100凝胶过滤层析 98.04 155.62 46.87% 40 ℃
pH6.582.3 kDa [42] 不动杆菌C26 硫酸铵沉淀、Q-Sepharose Fast Flow(QFF)阴离子交换层析、Sephadex G-100凝胶过滤层析 348.64 48.09 11.27% 42 ℃
pH5~676 kDa [43] 黄杆菌RC-9 硫酸铵沉淀、QFF阴离子交换层析、Sephacryl S-1000凝胶过滤层析 2.09 1.46 28.06% 32.5 ℃
pH8.041 kDa [44] 普通变形杆菌 60%饱和度硫酸铵沉淀、透析、Sephadex 6B凝胶过滤层析 5000 17.36 35.2% 37 ℃
pH8.0111.3 kDa [45] Chase AC 粘质沙雷氏菌GT596 硫酸铵沉淀、DEAE-Sepharose FF离子交换层析、Sephacryl S-200凝胶过滤层析 81 11 39% 40 ℃
pH7.570 kDa [35] -
[1] MARTEL P J, FARRAN A, MONTELL E, et al. Discrepancies in composition and biological effects of different formulations of chondroitin sulfate[J]. Molecules,2015,20(3):4277−4289. doi: 10.3390/molecules20034277
[2] XU X Q, XUE C H, CHANG Y G, et al. Conformational and physicochemical properties of fucosylated chondroitin sulfate from sea cucumber Apostichopus japonicus[J]. Carbohydrate Polymers,2016,152:26−32. doi: 10.1016/j.carbpol.2016.06.061
[3] NOVOA C R, PEREZ M R, BLANCO M, et al. By-products of Scyliorhinus canicula, Prionace glauca and Raja clavata: A valuable source of predominantly 6S sulfated chondroitin sulfate[J]. Carbohydrate Polymers,2017,157:31−37. doi: 10.1016/j.carbpol.2016.09.050
[4] XIAO Y L, LI P L, CHENG Y N, et al. Effect of α-linolenic acid-modified low molecular weight chondroitin sulfate on atherosclerosis in apoE-deficient mice[J]. Biochimica et Biophysica Acta,2016,1860(11):2589−2597. doi: 10.1016/j.bbagen.2016.07.032
[5] MUIR E, DE W F, VERHAAGEN J, et al. Recent advances in the therapeutic uses of chondroitinase ABC[J]. Experimental Neurology, 2019, 321(UNSP 113032).
[6] SMITH P D, COULSON-THOMAS V J, FOSCARIN S, et al. "GAG-ing with the neuron": The role of glycosaminoglycan patterning in the central nervous system[J]. Experimental Neurology,2015,274(B):100−114.
[7] PAL D, SAHA S. Chondroitin: A natural biomarker with immense biomedical applications[J]. RSC Advances,2019,9(48):28061−28077. doi: 10.1039/C9RA05546K
[8] ABDALLAH M M, FERNÁNDEZ N, MATIAS A A, et al. Hyaluronic acid and chondroitin sulfate from marine and terrestrial sources: Extraction and purification methods[J]. Carbohydrate Polymers, 2020, 243:116441.
[9] LAN R, LI Y, SHEN R, et al. Preparation of low-molecular-weight chondroitin sulfates by complex enzyme hydrolysis and their antioxidant activities[J]. Carbohydrate Polymers,2020,241:116302.
[10] IGARASHI N, TAKEGUCHI A, SAKAI S, et al. Effect of molecular sizes of chondroitin sulfate on interaction with L-selectin[J]. International Journal of Carbohydrate Chemistry,2013:856142−856149.
[11] JI Y, ZHANG S L, QIAO M, et al. Synthesis of structurally defined chondroitin sulfate: Paving the way to the structure-activity relationship studies[J]. Carbohydrate Polymers,2020,248:116796−116796.
[12] WANG H N, BETTI M. Sulfated glycosaminoglycan-derived oligosaccharides produced from chicken connective tissue promote iron uptake in a human intestinal Caco-2 cell line[J]. Food Chemistry,2017,220:460−469. doi: 10.1016/j.foodchem.2016.10.025
[13] LI W, KOBAYASHI T, MOROI S, et al. Anti-obesity effects of chondroitin sulfate oligosaccharides from the skate Raja pulchra[J]. Carbohydrate Polymers,2019,214:303−310. doi: 10.1016/j.carbpol.2019.03.025
[14] LINHARDT R J, AVCI F Y, TOIDA T, et al. CS lyases: Structure, activity, and applications in analysis and the treatment of diseases[M]//Volpi N. Advances in Pharmacology, 2006: 187−215.
[15] MICHAUD P, DA COSTA A, COURTOIS B, et al. Polysaccharide lyases: Recent developments as biotechnological tools[J]. Critical Reviews in Biotechnology,2003,23(4):233−266. doi: 10.1080/07388550390447043
[16] 王文爽, 许莹莹, 石立冉, 等. 海洋来源硫酸软骨素降解酶的研究进展[J]. 生命科学,2019,31(9):894−901. [WANG W S, XU Y Y, SHI L R, et al. Research progress in chondroitinase from marine bacteria[J]. Chinese Bulletin of Life Sciences,2019,31(9):894−901. WANG W S, XU Y Y, SHI L R, et al. Research progress in chondroitinase from marine bacteria[J]. Chinese Bulletin of Life Sciences, 2019, 31(9): 894-901.
[17] LUNIN V V, LI Y G, LINHARDT R J, et al. High-resolution crystal structure of Arthrobacter aurescens chondroitin AC lyase: An enzyme-substrate complex defines the catalytic mechanism[J]. Journal of Molecular Biology,2004,337(2):367−386. doi: 10.1016/j.jmb.2003.12.071
[18] PRABHAKAR V, CAPILA I, SOUNDARARAJAN V, et al. Recombinant expression, purification, and biochemical characterization of chondroitinase ABC Ⅱ from Proteus vulgaris[J]. Journal of Biological Chemistry,2009,284(2):974−982. doi: 10.1074/jbc.M806630200
[19] YAMAGATA T, SAITO H, HABUCHI O, et al. Purification and properties of bacterial chondroitinases and chondrosulfatases[J]. Journal of Biological Chemistry,1968,243(7):1523. doi: 10.1016/S0021-9258(18)93574-X
[20] MAKAREM E H, BERK R S. Partial purification and characterization of chondroitinase from Proteus mirabilis[J]. Journal of Infectious Diseases,1968,118(4):427. doi: 10.1093/infdis/118.4.427
[21] LINN S, CHAN T, LIPESKI L, et al. Isolation and characterization of 2 chondroitin lyases from Bacteroides thetaiotaomicron[J]. Journal of Bacteriology,1983,156(2):859−866. doi: 10.1128/jb.156.2.859-866.1983
[22] 陶科, 王忠彦, 胡承, 等. 硫酸软骨素裂解酶ABC产生菌的筛选及酶学性质的初步研究[J]. 四川大学学报(自然科学版),2003(6):1168−1171. [TAO K, WANG Z Y, HU C, et al. Isolation and characterization of a novel chondroitinase ABC producing strain[J]. Journal of Sichuan University (Natural Science Edition),2003(6):1168−1171. TAO K, WANG Z Y, HU C, et al. Isolation and characterization of a novel chondroitinase ABC producing strain[J]. Journal of Sichuan University (Natural Science Edition), 2003(6): 1168-1171.
[23] 刘万顺, 付静芸, 常菁, 等. 硫酸软骨素酶高产菌株的筛选、鉴定和发酵培养条件的研究[J]. 中国海洋大学学报(自然科学版),2012,42(11):35−39. [LIU W S, FU J Y, CHANG J, et al. Screening ang identification of two high chondroitinase producing bacterial strains and determination of their fermenting condition[J]. Periodical of Ocean University of China (Natural Science Edition),2012,42(11):35−39. LIU W S, FU J Y, CHANG J, et al. Screening ang identification of two high chondroitinase producing bacterial strains and determination of their fermenting condition[J]. Periodical of Ocean University of China (Natural Science Edition), 2012, 42(11): 35-39.
[24] WANG W S, CAI X J, HAN N H, et al. Sequencing of chondroitin sulfate oligosaccharides using a novel exolyase from a marine bacterium that degrades hyaluronan and chondroitin sulfate/dermatan sulfate[J]. Biochemical Journal,2017,474(22):3831−3848. doi: 10.1042/BCJ20170591
[25] 张京良, 姜言晖, 朱常亮, 等. 高产胞外硫酸软骨素酶菌株的筛选、鉴定及发酵条件优化[J]. 中国海洋药物,2018,37(3):1−8. [ZHANG J L, JIANG Y H, ZHU C L, et al. Screening, identification and optimization of fermentation conditions of the strain with high-yield extracellular chondroitinase[J]. Chinese Journal of Marine Drugs,2018,37(3):1−8. ZHANG J L, JIANG Y H, ZHU C L, et al. Screening, identification and optimization of fermentation conditions of the strain with high-yield extracellular chondroitinase[J]. Chinese Journal of Marine Drugs, 2018, 37(3): 1-8.
[26] HUANG W J, LUNIN V V, LI Y G, et al. Crystal structure of proteus vulgaris chondroitin sulfate ABC lyase I at 1.9 Å resolution[J]. Journal of Molecular Biology,2003,328(3):623−634. doi: 10.1016/S0022-2836(03)00345-0
[27] BENITO-ARENAS R, ZARATE S G, REVUELTA J, et al. Chondroitin sulfate-degrading enzymes as tools for the development of new pharmaceuticals[J]. Catalysts,2019,9(4):322.
[28] SHAYA D, HAHN B, BJERKAN T M, et al. Composite active site of chondroitin lyase ABC accepting both epimers of uronic acid[J]. Glycobiology,2008,18(3):270−277. doi: 10.1093/glycob/cwn002
[29] GU K N, LINHARDT R J, LALIBERTE M, et al. Purification, characterization and specificity of chondroitin lyases and glycuronidase from Flavobacterium heparinum[J]. Biochemical Journal,1995,312(2):569−577. doi: 10.1042/bj3120569
[30] HIYAMA K, OKADA S. Crystallization and some properties of chondroitinase from Arthrobacter aurescens[J]. Journal of Biological Chemistry,1975,250(5):1824−1828. doi: 10.1016/S0021-9258(19)41768-7
[31] YIN F X, WANG F S, SHENG J Z. Uncovering the catalytic direction of chondroitin AC exolyase from the reducing end towards the non-reducing end[J]. Journal of Biological Chemistry,2016,291(9):4399−4406. doi: 10.1074/jbc.C115.708396
[32] KITAMIKADO M, LEE Y Z. Chondroitinase-producing bacteria in natural habitats[J]. Applied Microbiology,1975,29(3):414−421. doi: 10.1128/am.29.3.414-421.1975
[33] HONG S W, KIM B T, SHIN H Y, et al. Purification and characterization of novel chondroitin ABC and AC lyases from Bacteroides stercoris HJ-15, a human intestinal anaerobic bacterium[J]. European Journal of Biochemistry,2002,269(12):2934−2940. doi: 10.1046/j.1432-1033.2002.02967.x
[34] 阎浩林, 何汉洲, 蔡苏兰, 等. 硫酸软骨素酶产生菌的筛选及酶的分离纯化[J]. 微生物学报,2004(1):79−82. [YAN H L, HE H Z, CAI S L, et al. Screening and purification of chondroitinase from chondroitinase-producing strains[J]. Acta Microbiologica Sinica,2004(1):79−82. doi: 10.3321/j.issn:0001-6209.2004.01.017 YAN H L, HE H Z, CAI S L, et al. Screening and purification of chondroitinase from chondroitinase-producing strains[J]. Acta Microbiologica Sinica, 2004(1): 79-82. doi: 10.3321/j.issn:0001-6209.2004.01.017
[35] TAO K, LONG Z F, GAO Q, et al. Isolation of Serratia marcescens as a chondroitinase-producing bacterium and purification of a novel chondroitinase AC[J]. Biotechnology Letters,2005,27(7):489−493. doi: 10.1007/s10529-005-2538-7
[36] KALE V, FRIDJONSSON O, JONSSON J O, et al. Chondroitin lyase from a marine Arthrobacter sp. MAT3885 for the production of chondroitin sulfate disaccharides[J]. Marine Biotechnology,2015,17(4):479−492. doi: 10.1007/s10126-015-9629-9
[37] FANG Y T, YANG S X, FU X D, et al. Expression, purification and characterization of chondroitinase AC Ⅱ from marine bacterium Arthrobacter sp. CS01[J]. Marine Drugs,2019,17(3):185.
[38] HUANG W J, BOJU L, TKALEC L, et al. Active site of chondroitin AC lyase revealed by the structure of enzyme-oligosaccharide complexes and mutagenesis[J]. Biochemistry,2001,40(8):2359−2372. doi: 10.1021/bi0024254
[39] 蔡苏兰, 阎浩林, 何汉洲. 微生物硫酸软骨素裂解酶的研究进展[J]. 沈阳药科大学学报,2004(1):76−80. [CAI S L, HAN H L, HE H Z, et al. Advances of the study on chondroitinases produced by microorganisms[J]. Journal of Shenyang Pharmaceutical University,2004(1):76−80. doi: 10.3969/j.issn.1006-2858.2004.01.022 CAI S L, HAN H L, HE H Z, et al. Advances of the study on chondroitinases produced by microorganisms[J]. Journal of Shenyang Pharmaceutical University, 2004(1): 76-80. doi: 10.3969/j.issn.1006-2858.2004.01.022
[40] MICHEL G, POJASEK K, LI Y G, et al. The structure of chondroitin B lyase complexed with glycosaminoglycan oligosaccharides unravels a calcium-dependent catalytic machinery[J]. Journal of Biological Chemistry,2004,279(31):32882−32896. doi: 10.1074/jbc.M403421200
[41] HUANG W J, MATTE A, LI Y G, et al. Crystal structure of chondroitinase B from Flavobacterium heparinum and its complex with a disaccharide product at 1.7 angstrom resolution[J]. Journal of Molecular Biology,1999,294(5):1257−1269. doi: 10.1006/jmbi.1999.3292
[42] FU J Y, JIANG Z W, CHANG J, et al. Purification, characterization of chondroitinase ABC from Sphingomonas paucimobilis and in vitro cardiocytoprotection of the enzymatically degraded CS-A[J]. International Journal of Biological Macromolecules,2018,115:737−745. doi: 10.1016/j.ijbiomac.2018.04.117
[43] ZHU C L, ZHANG J L, ZHANG J, et al. Purification and characterization of chondroitinase ABC from Acinetobacter sp C26[J]. International Journal of Biological Macromolecules,2017,95:80−86. doi: 10.1016/j.ijbiomac.2016.10.044
[44] 郭云瑕. 硫酸软骨素酶的发酵生产、性质研究及高活性酶解产物的制备[D]. 青岛: 青岛农业大学, 2017: 22−26 GUO Y X. Fermentation production, characterization of chondroitin sulfate and preparation of highly active enzymatic hydrolysate[D]. Qingdao: Qingdao Agricultural University, 2017: 22−26.
[45] ABDUL-GANI M N, LAFTAAH B A. Purification and characterization of chondroitinase ABC from Proteus vulgaris, an iraqi clinically isolate[J]. Current Science,2017,113(11):2134−2140. doi: 10.18520/cs/v113/i11/2134-2140
[46] POJASEK K, SHRIVER Z, KILEY P, et al. Recombinant expression, purification, and kinetic characterization of chondroitinase AC and chondroitinase B from Flavobacterium heparinum[J]. Biochemical and Biophysical Research Communications,2001,286(2):343−351. doi: 10.1006/bbrc.2001.5380
[47] 黄浩, 王阳, 堵国成, 等. 重组蛋白微生物表达系统的研究进展[J]. 生物产业技术,2019(3):36−43. [HUANG H, WANG Y, ZHU G C, et al. Research progress in microbial expression systems for recombinant protein production[J]. Biotechnology & Business,2019(3):36−43. HUANG H, WANG Y, ZHU G C, et al. Research progress in microbial expression systems for recombinant protein production[J]. Biotechnology & Business, 2019(3): 36-43.
[48] 曹蕾, 唐晓峰. 提高大肠杆菌表达外源蛋白胞外含量的策略[J]. 生物资源,2020,42(4):375−381. [CAO L, TANG X F. Strategies for increasing extracellular content of heterologous protein in Escherichia coli[J]. Biotic Resources,2020,42(4):375−381. CAO L, TANG X F. Strategies for increasing extracellular content of heterologous protein in Escherichia coli[J]. Biotic Resources, 2020, 42(4): 375-381.
[49] LU X Y, ZHONG Q, LIU J, et al. Efficient expression of chondroitinase ABC I for specific disaccharides detection of chondroitin sulfate[J]. International Journal of Biological Macromolecules,2020,143:41−48. doi: 10.1016/j.ijbiomac.2019.11.215
[50] WANG H, ZHANG L, ZHANG W J, et al. Secretory expression of biologically active chondroitinase ABC I for production of chondroitin sulfate oligosaccharides[J]. Carbohydrate Polymers, 2019, 224(UNSP 115135).
[51] FANG Y T, FU X D, XIE W C, et al. Expression, purification and characterisation of chondroitinase AC II with glyceraldehyde-3-phosphate dehydrogenase tag and chaperone (GroEs-GroEL) from Arthrobacter sp. CS01[J]. International Journal of Biological Macromolecules,2019,129:471−476. doi: 10.1016/j.ijbiomac.2019.02.056
[52] LI Y, ZHOU Z, CHEN Z Y. High-level production of ChSase ABC I by co-expressing molecular chaperones in Escherichia coli[J]. International Journal of Biological Macromolecules,2018,119:779−784. doi: 10.1016/j.ijbiomac.2018.08.009
[53] CHEN Z Y, LI Y, YUAN Q P. Expression, purification and thermostability of MBP-chondroitinase ABC I from Proteus vulgaris[J]. International Journal of Biological Macromolecules,2015,72:6−10. doi: 10.1016/j.ijbiomac.2014.07.040
[54] 李晔, 陈振娅, 袁其朋. 硫酸软骨素裂解酶 ABC 的研究进展[J]. 生物工程学报,2015,31(5):621−633. [LI Y, CHEN Z Y, YUAN Q P. Research progress in chondroitinase ABC[J]. Chinese Journal of Biotechnology,2015,31(5):621−633. LI Y, CHEN Z Y, YUAN Q P. Research progress in chondroitinase ABC[J]. Chinese Journal of Biotechnology, 2015, 31(5): 621-633.
[55] VALCARCEL J, GARCIA M R, SAMPAYO L F, et al. Marine chondroitin sulfate of defined molecular weight by enzymatic depolymerization[J]. Carbohydrate Polymers,2020,229:115450. doi: 10.1016/j.carbpol.2019.115450
[56] 鲍伦军, 杨建成, 何振华, 等. 鱼翅中硫酸软骨素的酶解-高效液相色谱法测定[J]. 分析测试学报,2002,21(5):59−61. [BAO L J, YANG J C, HE Z H, et al. Determination of chondroitin sulfate in shark’s fins by enzymolysis-HPLC[J]. Journal of Instrumental Analysis,2002,21(5):59−61. doi: 10.3969/j.issn.1004-4957.2002.05.018 BAO L J, YANG J C, HE Z H, et al. Determination of chondroitin sulfate in shark’s fins by enzymolysis-HPLC[J]. Journal of Instrumental Analysis, 2002, 21(5): 59-61. doi: 10.3969/j.issn.1004-4957.2002.05.018
[57] KASINATHAN N, VOLETY S M, JOSYULA V R. Chondroitinase: A promising therapeutic enzyme[J]. Critical Reviews in Microbiology,2016,42(3):474−484.
[58] ROSENZWEIG E S, SALEGIO E A, LIANG J J, et al. Chondroitinase improves anatomical and functional outcomes after primate spinal cord injury[J]. Nature Neuroscience,2019,22(8):1269. doi: 10.1038/s41593-019-0424-1
[59] 中华医学会放射学分会介入学组. 腰椎间盘突出症的介入和微创治疗操作规范的专家共识[J]. 中华放射学杂志,2014,48(1):10−12. [Intervention Group of Chinese Medical Association Radiology Branch. Expert consensus on interventional and minimally invasive treatment of lumbar disc herniation[J]. Chinese Journal of Radiology,2014,48(1):10−12. doi: 10.3760/cma.j.issn.1005-1201.2014.01.004 Intervention Group of Chinese Medical Association Radiology Branch. Expert consensus on interventional and minimally invasive treatment of lumbar disc herniation[J]. Chinese Journal of Radiology, 2014, 48(1): 10-12. doi: 10.3760/cma.j.issn.1005-1201.2014.01.004
[60] 郑历明, 刘增品, 汪国石, 等. 化学髓核溶解术的新进展[J]. 实用放射学杂志,2001,17(4):303−304. [ZHENG L M, LIU Z P, WANG G S, et al. Development of the chemonucleolysis[J]. Journal of Practical Radiology,2001,17(4):303−304. doi: 10.3969/j.issn.1002-1671.2001.04.024 ZHENG L M, LIU Z P, WANG G S, et al. Development of the chemonucleolysis[J]. Journal of Practical Radiology, 2001, 17(4): 303-304. doi: 10.3969/j.issn.1002-1671.2001.04.024
[61] ISHIKO T, NAITOH M, KUBOTA H, et al. Chondroitinase injection improves keloid pathology by reorganizing the extracellular matrix with regenerated elastic fibers[J]. Journal of Dermatology,2013,40(5):380−383. doi: 10.1111/1346-8138.12116
[62] JAIME R A, BOLYARD C, MEISEN W, et al. Impact of humanized chondroitinase ABC on OV therapy for intracranial tumors[J]. Neuro-Oncology,2014:165.
[63] PIZZORUSSO T, MEDINI P, BERARDI N, et al. Reactivation of ocular dominance plasticity in the adult visual cortex[J]. Science,2002,298(5596):1248−1251. doi: 10.1126/science.1072699
[64] PIZZORUSSO T, MEDINI P, LANDI S, et al. Structural and functional recovery from early monocular deprivation in adult rats[J]. Proceedings of the National Academy of Sciences of the United States of America,2006,103(22):8517−8522. doi: 10.1073/pnas.0602657103
[65] 付静芸. 产硫酸软骨素酶菌株的筛选、发酵、酶的分离纯化及性质的研究[D]. 青岛: 中国海洋大学, 2012 FU J Y. Study on the screening, fermentation of ChSase-producing strains, and purification and properties of the ChSase abstract[D]. Qingdao: Ocean University of China, 2012.





 下载:
下载:

 下载:
下载:
