Study on Antioxidant Properties of Pueraria lobata Polysaccharides and Its Hypoglycemic Effect
-
摘要: 目的:研究葛根多糖的抗氧化性及其降血糖作用。方法:用水提醇沉法对葛根多糖进行提取,并测定多糖含量及葛根多糖的抗氧化能力。大鼠腹腔注射链脲佐菌素(STZ)建立1型糖尿病模型(T1DM),将其分为正常组(蒸馏水100 mg/kg)、模型组(蒸馏水100 mg/kg)、葛根多糖高剂量组(100 mg/kg)、葛根多糖低剂量组(50 mg/kg)、阳性组(二甲双胍100 mg/kg),定期测定大鼠体重及空腹血糖值(FBG),共灌胃8周。最后一周进行口服糖耐量(OGTT)测试,取大鼠血清及肝脏,测定大鼠脂代谢指标以及相关氧化酶的变化。结果:葛根多糖含量为87.80%,在1000 μg/mL浓度下对1,1-二苯基-2-三硝基苯肼自由基(DPPH·)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(ABTS+·)、羟自由基(·OH)、一氧化氮清除剂(PTIO)的清除能力分别为90.2%、83.3%、81.3%、89.0%。与模型组比较,葛根多糖能够有效缓解T1DM大鼠体重的下降,显著降低其FBG(P<0.05),并显著提高OGTT水平(P<0.05),经葛根多糖高剂量治疗后,总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、丙二醛(MDA)水平均显著下降,高密度脂蛋白(HDL-C)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、过氧化氢酶(CAT)水平均显著上升(P<0.05),且所有指标均呈剂量依赖性。结论:葛根多糖具有较好的抗氧化性,可以通过改善T1DM大鼠脂代谢水平和氧化应激水平从而起到降血糖的作用。Abstract: Objective: To study the antioxidant activity of Pueraria lobata polysaccharide and its hypoglycemic effect. Method: The polysaccharides of Pueraria lobata were extracted by water extraction and alcohol precipitation method, and the polysaccharide content and the antioxidant capacity of Pueraria lobata polysaccharides were determined. Rats were intraperitoneally injected with streptozotocin (STZ) to establish a type 1 diabetes model (T1DM), which was divided into normal group (distilled water 100 mg/kg), model group (distilled water 100 mg/kg), high-dose Pueraria lobata polysaccharide group (100 mg/kg), Pueraria lobata polysaccharide low-dose group (50 mg/kg), positive group (metformin 100 mg/kg), the rats' body weight and fasting blood glucose (FBG) were measured regularly for 8 weeks. In the last week, an oral glucose tolerance (OGTT) test was performed, and rat serum and liver were taken to determine the changes in lipid metabolism indexes and related oxidases in rats. Results: The content of Pueraria lobata polysaccharide was 87.80%, and the scavenging abilities of DPPH·, ABTS+·, ·OH, and PTIO were 90.2%, 83.3%, 81.3%, and 89.0% at a concentration of 1000 μg/mL, respectively. Compared with the model group, Pueraria lobata polysaccharide could effectively alleviate the weight loss of T1DM rats, significantly reduced their FBG (P<0.05), and significantly increased the level of OGTT (P<0.05). After high-dose treatment with Pueraria lobata polysaccharide, TC, TG, the levels of LDL-C and MDA decreased significantly, and the levels of HDL-C, SOD, GSH and CAT increased significantly (P<0.05). All indicators were dose-dependent. Conclusion: Pueraria lobata polysaccharide has good antioxidant properties and can reduce blood sugar by improving lipid metabolism and oxidative stress in T1DM rats.
-
Keywords:
- Pueraria lobata polysaccharide /
- antioxidant /
- hypoglycemic /
- lipid metabolism /
- oxidative stress
-
葛根(Pueraria,DC),又名葛藤、葛麻叶、野葛等,属豆科多年生缠绕藤本植物[1],其主要分布在我国辽宁、河北、河南、山东、安徽等地,约占世界品种的50%[2]。于2000年葛根正式被国家卫生部批准列入“既是食品又是药品”名录[3-4]。此外,在《中国药典》、《中药大辞典》、《中华本草》等典籍中也有记载[5]。葛根含有黄酮类、三萜类、皂苷类和多糖类等多种化学成分,具有生津止渴、醒脾解酒、升阳止泻、降脂等功效,对心脑血管疾病、糖尿病、神经保护、解酒保肝和骨质疏松均有一定疗效,此外,其还能够调节肠道菌群[6-8]。许多植物多糖均具有生物活性,包括调节免疫力[9]、调节血糖血脂[10]、抗肿瘤[11]等内在的保健作用。
糖尿病(DM)是21世纪最重要的健康问题之一。1型糖尿病(T1DM)也称为胰岛素依赖型糖尿病(IDDM),从T1DM开始就依赖于胰岛素治疗,糖尿病作为近年来引起代谢紊乱的最常见疾病,其发病率在多数国家呈上升趋势[12]。糖尿病具有多种副作用,可导致组织损伤,体内脂质代谢紊乱,并最终降低糖尿病患者的生活质量[13-14]。
由于葛根富含多种营养活性成分,现已有多种以葛根或其提取物为原料制备的保健食品,如葛根解酒茶、葛根片、葛根口服液等。葛根对治疗糖尿病有良好的效果,葛根、葛根素单独应用或葛根与降糖药、胰岛素联合应用均可以显著降低2型糖尿病大鼠的血糖[15-16]。其主要通过改善胰岛素抵抗、保护胰岛β细胞发挥降糖作用,葛根醇提物具有较强的蛋白酪氨酸磷酸酯酶1B(PTP1B)活性抑制作用,可改善胰岛素抵抗人肝癌细胞HepG2的胰岛素敏感性并增强其葡萄糖摄取能力[17]。近年来,对葛根多糖的研究多集中于提取方法和纯化工艺的优化[18]、降血脂活性的研究[19]以及体外降血糖作用[20],但对葛根多糖在治疗1型糖尿病方面的报道较少,因此,本试验中采用DPPH·、ABTS+·、·OH、PTIO清除率来测定葛根多糖的抗氧化性,采用腹腔注射STZ建立1型糖尿病模型,并对其各项指标进行测定,旨在为开发葛根成为新抗氧化和降血糖产品提供理论参考。
1. 材料与方法
1.1 材料与仪器
葛根 吉林省益丰大药堂;抗坏血酸(VC) 中国医药集团有限公司;SD大鼠 50只雄性无特定病原体(SPF)级,体重(250±20)g,许可证号:SCXK(辽)2015-0001,长春亿斯试验动物中心,严格遵守《延边大学试验动物的保护和使用指南》中的要求,符合动物试验伦理要求;高脂高糖饲料、普通饲料 上海帆泊生物技术有限公司;盐酸二甲双胍片 北京万辉双鹤药业有限责任公司;链脲佐菌素(STZ) 美国Sigma公司;二苯代苦味肼基自由基(DPPH·) 上海化成工业有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+·) 北京索莱宝科技有限公司;一氧化氮清除剂(PTIO) 北京绿源伯德生物科技有限公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)和过氧化氢酶(CAT)试剂盒 江苏南京建城生物工程研究所。
HWS-24型电热恒温水浴锅 上海一恒科学仪器有限公司;ScoutSE-SE202FZH型电子天平 常州奥豪斯仪器有限公司;TG16A-WS型离心机 上海卢湘仪器有限公司;CCA-1111-CE 型旋蒸冷凝器 东京理化器械株式会社;LyoQuest-55实验型冷冻干燥机 西班牙Telstar集团公司;DTC-22B型真空泵 日本ULUACKIKO公司;九安AG-605血糖仪及血糖试纸 天津九安医疗电子股份有限公司;BK-EL10C酶标仪 山东博科生物产业有限公司。
1.2 实验方法
1.2.1 葛根多糖的提取
将葛根破碎,用40目型粉碎机进行粉碎,收集葛根粉末。参考马伟等[21]的方法,采用水提醇沉法对葛根多糖进行提取。按料液比1:20 g/mL,提取时间4 h,100 ℃水提2次,合并2次清液,抽滤,旋蒸,将浓缩液用85%乙醇进行醇沉,收集沉淀,蒸馏水复溶,旋蒸浓缩,采用Sevage法除蛋白,用冻干机进行冻干,收集粉末,按公式(1)计算多糖得率,4 ℃保存备用。
(1) 1.2.2 葛根多糖含量的测定
参考纪宝玉等[22]的方法,采用苯酚硫酸法进行多糖含量的测定。将葡萄糖配制成0.02、0.04、0.06、0.08、0.1 mg/mL的浓度梯度,按苯酚硫酸法步骤进行操作,测定490 nm处不同浓度葡萄糖的OD值,以葡萄糖浓度为横坐标,吸光度为纵坐标绘制标准曲线。称量葛根多糖粉末3 mg,蒸馏水定容至10 mL,取1 mL,加入1 mL 5%苯酚和5 mL的浓硫酸,混合后室温放置20 min,测定490 nm处的OD值。并计算葛根多糖含量。
1.2.3 葛根多糖抗氧化性的测定
按朱家庆等[18]的方法稍作修改,将葛根多糖溶于水配制成50、100、200、400、800、1000 μg/mL的溶液,以VC作为对照组,测定葛根多糖DPPH·、ABTS+·、·OH、PTIO的清除能力。
1.2.4 试验动物分组及给药
选取50只SPF级雄性SD大鼠,适应性喂养7 d,喂养7 d后,10只作为正常组,其余40只以30 mg/kg·BW剂量进行腹腔注射STZ,建立T1DM大鼠模型,72 h后进行血糖测定,尾尖取血,弃掉第一滴血,将第二滴血滴到血糖试纸上进行测定,FBG水平>16.7 mmol/L则造模成功[23],将此时定为灌胃0周。将造模成功大鼠随机分为4组,每组10只,包括模型组、葛根多糖高剂量组(100 mg/kg)、葛根多糖低剂量组(50 mg/kg)、阳性对照组(100 mg/kg盐酸二甲双胍),剂量设定参照蔡春沉等[24]的方法。每天进行灌胃,连续灌胃8周,除试验组外,正常组和模型组每天以等量的蒸馏水灌胃,每周记录所有大鼠的体重和FBG。
1.2.5 大鼠OGTT的测定
在灌胃给药8周后,进行OGTT试验,以1 g/kg·BW灌胃葡萄糖,然后以0、30、60、90 min为时间点分别测定大鼠血糖水平,并记录其数值。严格遵守《延边大学试验动物的保护和使用指南》中的要求,符合动物试验伦理要求。
1.2.6 大鼠TC、TG、HDL-C、LDL-C的测定
TC、TG:心脏取血,以4000 r/min,离心10 min,离心后取大鼠血清,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,37℃孵育10 min,于510 nm测定吸光值,根据公式进行计算。HDL-C、LDL-C的测定:取大鼠血清,依次按试剂盒说明书步骤进行操作,所有反应液混匀后,分别孵育5 min,在546 nm测定2次吸光值,根据公式进行计算。
1.2.7 大鼠SOD、GSH、CAT、MDA的测定
心脏取血,以4000 r/min,离心10 min,离心后取大鼠血清,按照试剂盒说明书中操作表进行操作,并用酶标仪测定各指标吸光度,最后按照公式进行计算。
1.3 数据处理
本试验使用SPSS 23.0对整理后的试验数据进行统计学分析,计算各组均值与标准偏差,进行单因素方差分析,所得的数据以图表和均值±标准偏差(X±SD)的形式表示,P<0.05表示有显著性差异。
2. 结果与分析
2.1 葛根多糖含量的测定
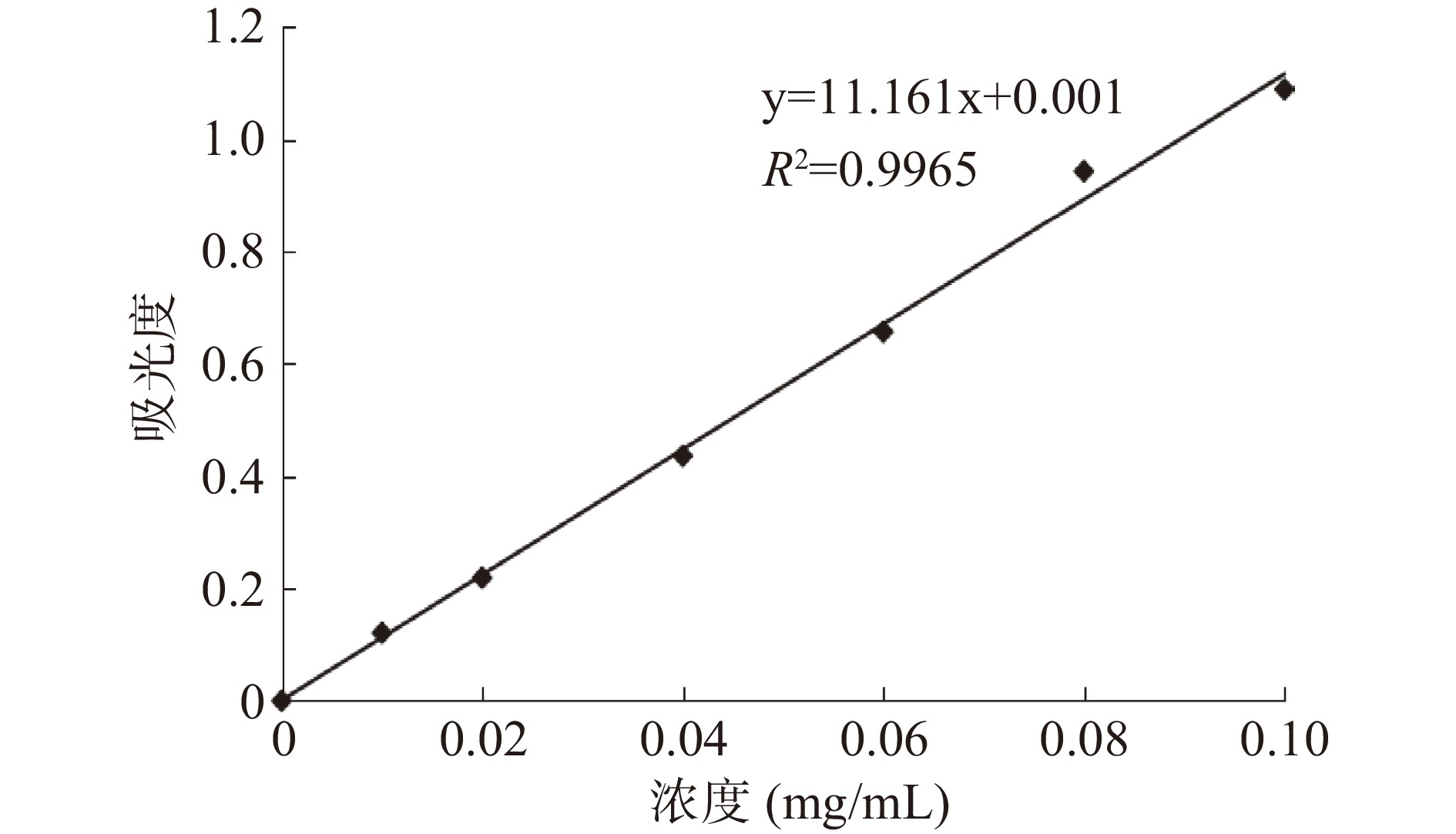
多糖得率为9.87%,图1为多糖标准曲线,标准曲线方程为y=11.161x+0.001(R2=0.9965),计算出多糖含量为87.80%。
2.2 葛根多糖对DPPH·、ABTS+·、·OH、PTIO的清除能力
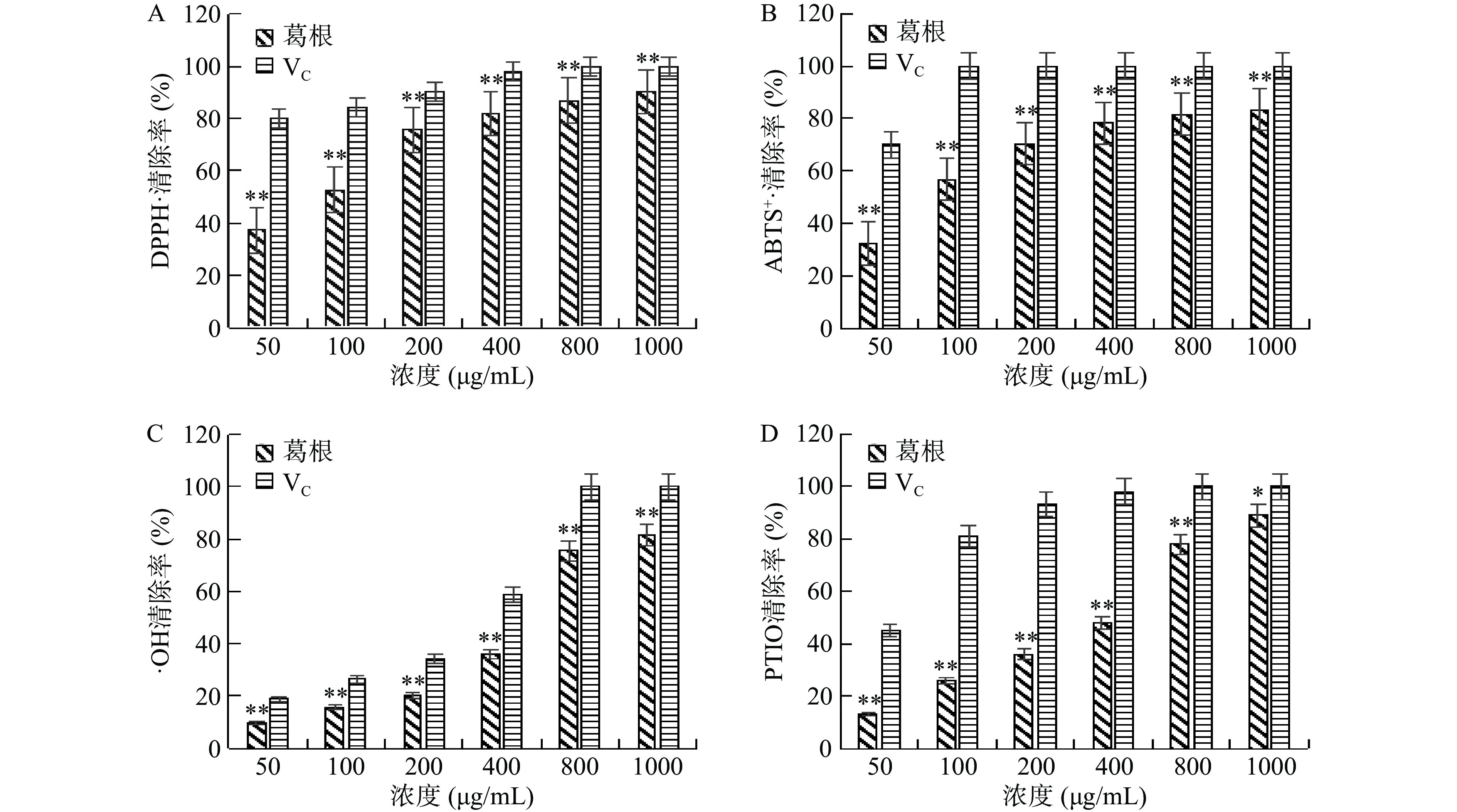
通过DPPH·、ABTS+·、·OH、PTIO清除率实验可判断物质的抗氧化能力。图2为葛根多糖在50、100、200、400、800、1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力,葛根多糖对DPPH·、ABTS+·、·OH、PTIO的清除能力与浓度呈正相关,在1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力分别为90.2%、83.3%、81.3%、89.0%。抗氧化性接近VC。可见,葛根多糖有一定的抗氧化性。
2.3 葛根多糖对大鼠体重、FBG的影响
由表1可知,在灌胃8周后,与正常组相比,T1DM大鼠的体重均显著降低(P<0.05),经葛根多糖治疗后的糖尿病大鼠体重下降得到有效的缓解,并与二甲双胍显示出相似的治疗效果。表2显示,灌胃8周后,实验组大鼠的FBG均显著高于正常组(P<0.05),但经葛根多糖治疗的T1DM大鼠FBG与模型组相比显著下降(P<0.05),与阳性组间差异不显著(P>0.05)。说明葛根多糖能够有效缓解T1DM大鼠体重的下降,降低其血糖水平。
表 1 T1DM大鼠体重(g)Table 1. Body weight of T1DM rats (g)时间(周) 正常组 模型组 葛根多糖高剂量组 葛根多糖低剂量组 阳性组 0 326.28±3.17a 347.72±3.68b 348.28±5.27b 359.96±5.98b 353.68±6.78b 2 347.89±4.64a 386.64±4.39b 368.24±5.76b 376.86±6.84b 380.82±5.38b 4 371.67±2.64a 382.26±4.26b 380.67±4.35b 388.69±6.58b 390.96±6.02b 6 406.64±3.97c 366.89±4.38a 384.72±5.04b 389.86±6.12b 380.74±5.87b 8 431.85±4.98d 332.59±5.02a 358.22±6.32b 363.18±3.82c 352.47±5.12b 注:同行不同字母代表差异显著,P<0.05,表2同。 表 2 T1DM大鼠空腹血糖值(mmol/L)Table 2. Fasting blood glucose of T1DM rats (mmol/L)时间(周) 正常组 模型组 葛根多糖高剂量组 葛根多糖低剂量组 阳性组 0 6.2±0.5a 19.9±0.8b 21.6±0.4b 22.3±0.6b 20.5±0.5b 2 6.0±0.6a 22.5±0.7c 20.3±0.7b 20.5±0.4b 18.9±0.7b 4 5.9±0.7a 23.6±0.9c 18.5±0.6b 18.5±0.7b 17.3±0.6b 6 6.3±0.6a 24.8±0.8c 16.3±0.8b 17.6±0.6b 14.8±0.7b 8 5.8±0.9a 25.8±0.7c 13.2±0.6b 16.7±0.5b 11.9±0.8b 2.4 葛根多糖对大鼠OGTT的影响
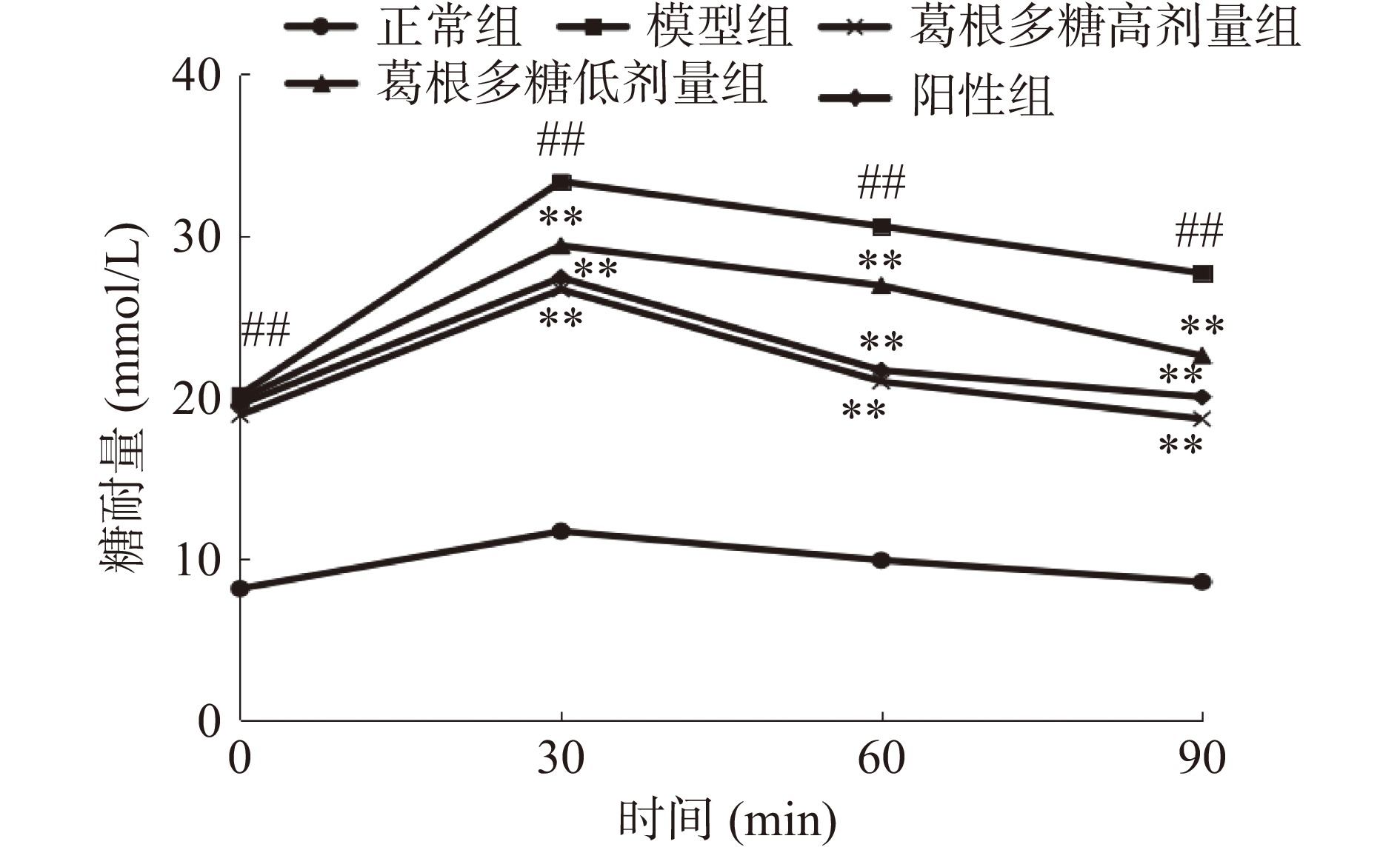
糖耐量作为糖尿病的一种重要指标,能够在一定时间内反映出机体对体内血糖浓度的调节能力,反映其葡萄糖耐受能力。图3为OGTT试验结果,结果显示,与正常组相比,T1DM大鼠的FBG水平在0、30、60和90 min时极显著增加(P<0.01),与模型组相比,经葛根多糖治疗后的大鼠血糖水平在30、60和90 min时极显著降低(P<0.01)。这表明葛根多糖能够有效控制大鼠的血糖水平,提高其糖耐量。
2.5 葛根多糖对大鼠TC、TG、HDL-C、LDL-C的影响
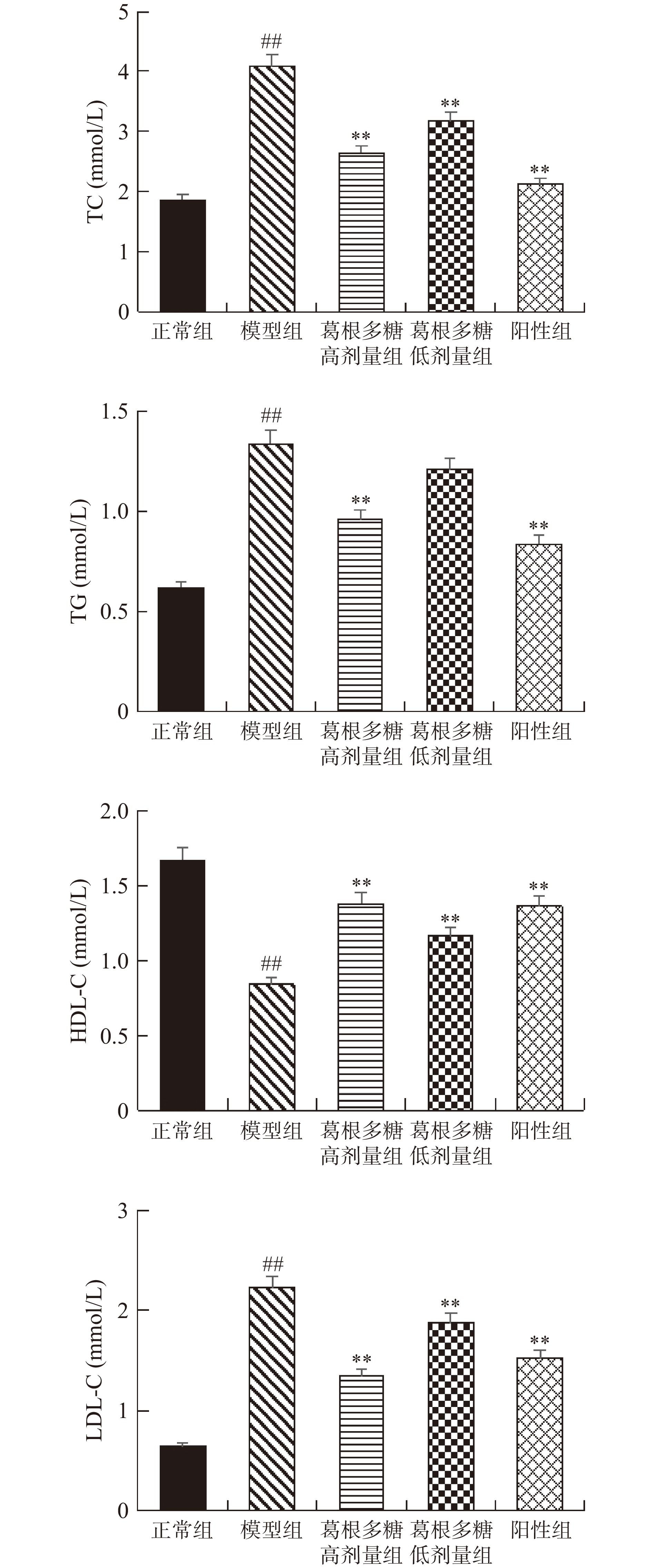
血脂异常是胰岛素代谢失调引发的一种现象,胰岛素的缺乏会加速机体内脂肪的分解,脂肪分解所产生的游离脂肪酸进入肝脏生成TG和酮体,会使TC、HDL-C、LDL-C发生变化,最终导致体内血脂异常[25]。如图4所示,经葛根多糖治疗后,能够极显著降低T1DM大鼠TC、TG、LDL-C水平(P<0.01),极显著提高HDL-C水平(P<0.01)。由此可见,葛根多糖能够调节T1DM大鼠的异常脂代谢情况。
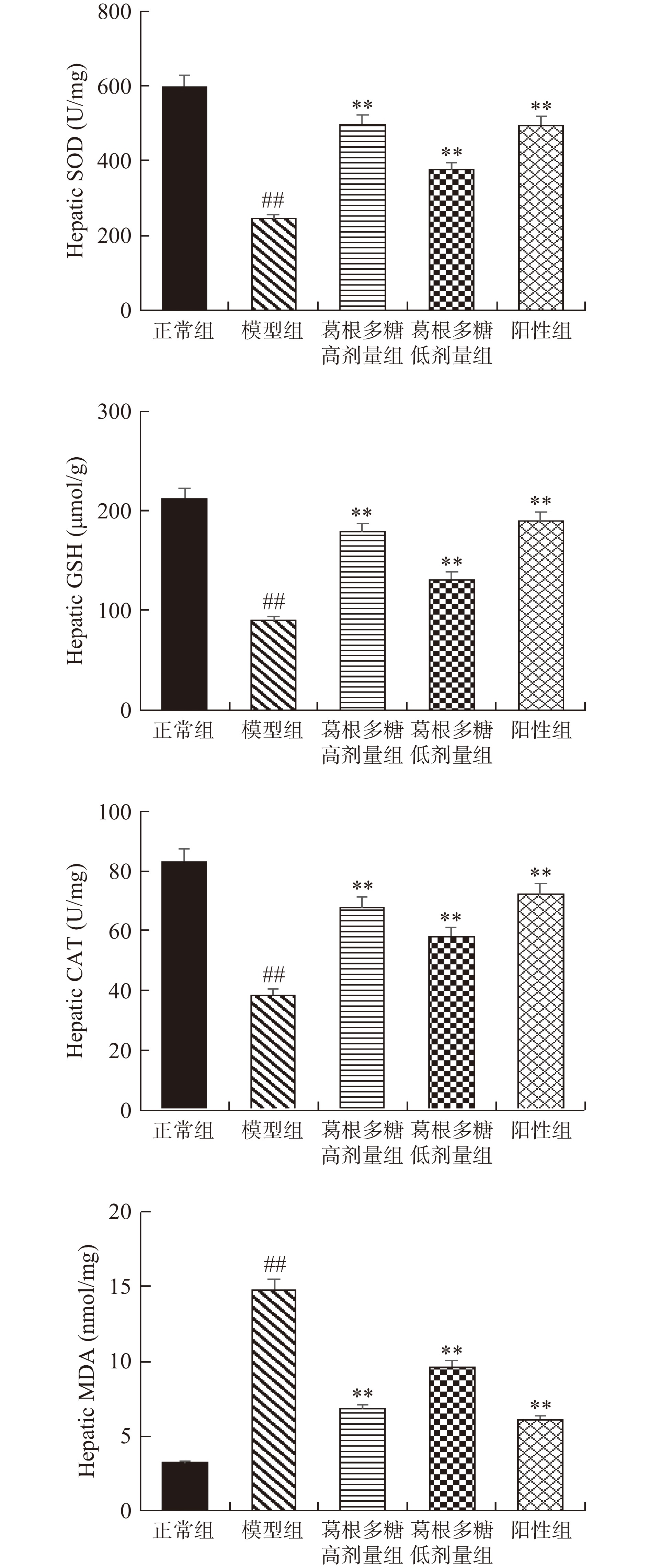
2.6 葛根多糖对大鼠SOD、GSH、CAT、MDA的影响
研究指出通过调节氧化应激相关酶的活力能够改善胰岛细胞的功能,促进葡萄糖代谢,减少对肝组织的损伤[26-27]。SOD、GSH、CAT和MDA的水平能够间接反映出脂代谢和氧化应激水平。如图5所示,与正常组相比,模型组中SOD、GSH、CAT含量均极显著下降(P<0.01),MDA含量极显著升高(P<0.01),经葛根多糖治疗后可有效恢复T1DM大鼠的SOD、GSH、CAT水平,有效降低MDA水平,且与模型组比较,高剂量葛根多糖组能够极显著提高SOD、GSH、CAT水平(P<0.01),极显著降低MDA水平(P<0.01)。
3. 结论与讨论
植物多糖又称植物多聚糖,是植物细胞代谢产生的聚合度超过10的化合物,内部存在若干个α-或β-糖苷键,多糖广泛地存在于植物体内,是植物体内重要的活性物质,所以常被应用于食品、保健品中[28]。本试验中葛根多糖的得率为9.87%,测得多糖提取物中葛根多糖的含量为87.80%。
正常情况下,机体氧化还原系统处于动态平衡,当机体处于应激、病理状态时,会产生·OH、DPPH·等强氧化自由基[29]。植物多糖可通过直接或间接清除自由基、提高抗氧化酶活性或降低氧化酶活性起到抗氧化作用。刘雅娜等[30]利用水提醇沉法对沙棘多糖进行了提取,并测定了DPPH自由基清除率和ABTS+·自由基清除率,试验结果表明,沙棘多糖具有良好的抗氧化作用。另有学者研究了芽球菊苣根多糖和山药多糖的抗氧化性,均显示有很强的自由基清除能力[31-32]。本实验中,显示葛根多糖在50~1000 μg/mL范围内对DPPH·、ABTS+·、·OH、PTIO均有一定的清除能力,且与浓度呈正相关,在1000 μg/mL浓度下对DPPH·、ABTS+·、·OH、PTIO的清除能力分别为90.2%、83.3%、81.3%、89.0%。本研究结果与前人研究结果均显示植物多糖具有很好的抗氧化性。
目前公认的病因为在遗传及环境因素共同作用下,由T细胞免疫介导的胰岛β细胞破坏。胰岛β自身免疫破坏过程历时数月到数年,当胰岛β细胞破坏到一定程度时,糖尿病症状出现[33]。植物多糖因其特殊结构,使其具有多途径、多靶点、多向性、毒副作用小的药理优点,能够通过多种机制、多环节作用于糖尿病[34]。植物多糖降血糖的机制主要是增加胰岛细胞数量、促进胰岛素分泌或释放、增加胰岛素敏感性、改善糖代谢等[35]。
T1DM会导致机体内异常脂代谢情况的发生,导致体内TC、HDL-C、LDL-C发生变化[36-38],其中,甘油三酯水平显著升高为1型糖尿病最为突出的脂代谢紊乱表现[39]。研究指出,葛根多糖有着良好的降血脂活性[19]。在本试验中,与正常组相比,T1DM大鼠血清的TC、TG、LDL-C浓度显著增加(P<0.01),而HDL-C浓度显著降低(P<0.01),表明T1DM大鼠出现了异常的脂代谢情况,其原因可能是T1DM大鼠对葡萄糖利用失调,脂肪分解增加,从而产生了大量的游离脂肪酸,组织吸收脂肪酸的能力降低,FFA大量释放到血液和肝脏中,导致TC、TG、LDL-C的含量增多。与模型组比较,经葛根多糖灌胃后的T1DM大鼠的TC、TG、LDL-C显著降低(P<0.01),HDL-C显著升高(P<0.01)。葛根多糖促进了组织对脂肪酸的吸收,从而缓解了一场脂代谢的情况。
糖尿病患者机体内氧自由基含量增多,过多的氧自由基与脂质相互作用产生过氧化反应[40]。CAT与SOD在机体中具有较强的抗氧化能力,在体内能够抑制氧自由基的生成,能够减少氧自由基对细胞造成的伤害,并且能够降低MDA的生成量[41]。在本试验中,与正常组相比,T1DM大鼠血清的MDA浓度显著增加(P<0.01),而SOD、GSH、CAT浓度显著降低(P<0.01),表明T1DM大鼠出现了氧化应激反应。与模型组大鼠相比,葛根多糖治疗后能够显著抑制这些标志物的变化,可能是通过调节体内相关酶的水平从而提高了清除自由基的效果。
由此,我们认为,葛根多糖具有良好的抗氧化活性,并可以通过调节T1DM大鼠脂代谢及氧化应激反应,从而降低T1DM大鼠血糖。
-
表 1 T1DM大鼠体重(g)
Table 1 Body weight of T1DM rats (g)
时间(周) 正常组 模型组 葛根多糖高剂量组 葛根多糖低剂量组 阳性组 0 326.28±3.17a 347.72±3.68b 348.28±5.27b 359.96±5.98b 353.68±6.78b 2 347.89±4.64a 386.64±4.39b 368.24±5.76b 376.86±6.84b 380.82±5.38b 4 371.67±2.64a 382.26±4.26b 380.67±4.35b 388.69±6.58b 390.96±6.02b 6 406.64±3.97c 366.89±4.38a 384.72±5.04b 389.86±6.12b 380.74±5.87b 8 431.85±4.98d 332.59±5.02a 358.22±6.32b 363.18±3.82c 352.47±5.12b 注:同行不同字母代表差异显著,P<0.05,表2同。 表 2 T1DM大鼠空腹血糖值(mmol/L)
Table 2 Fasting blood glucose of T1DM rats (mmol/L)
时间(周) 正常组 模型组 葛根多糖高剂量组 葛根多糖低剂量组 阳性组 0 6.2±0.5a 19.9±0.8b 21.6±0.4b 22.3±0.6b 20.5±0.5b 2 6.0±0.6a 22.5±0.7c 20.3±0.7b 20.5±0.4b 18.9±0.7b 4 5.9±0.7a 23.6±0.9c 18.5±0.6b 18.5±0.7b 17.3±0.6b 6 6.3±0.6a 24.8±0.8c 16.3±0.8b 17.6±0.6b 14.8±0.7b 8 5.8±0.9a 25.8±0.7c 13.2±0.6b 16.7±0.5b 11.9±0.8b -
[1] 陈艳, 文佳玉, 谢晓芳, 等. 葛根的化学成分及药理作用研究进展[J]. 中药与临床,2021,12(1):53−60. [CHEN Yan, WEN Jiayu, XIE Xiaofang, et al. Research progress on the chemical constituents and pharmacological effects of Pueraria lobata[J]. Chinese Materia Medica and Clinics,2021,12(1):53−60. doi: 10.3969/j.issn.1674-926X.2021.01.013 [2] 刘秀明, 李涛, 李源栋, 等. 基于NIR分析和模式识别技术的葛根品种及产地判别[J]. 食品工业科技,2018,39(22):247−251. [LIU Xiuming, LI Tao, LI Yuandong, et al. Discrimination of Pueraria lobata variety and origin based on NIR analysis and pattern recognition technology[J]. Food Industry Science and Technology,2018,39(22):247−251. [3] 黄晓巍, 张丹丹, 王晋冀, 等. 葛根化学成分及药理作用[J]. 吉林中医药,2018,38(1):87−89. [HUANG Xiaowei, ZHANG Dandan, WANG Jinji, et al. Chemical constituents and pharmacological effects of Pueraria lobata root[J]. Jilin Journal of Traditional Chinese Medicine,2018,38(1):87−89. [4] WEI L T, ZHU P C, CHEN X Q, et al. Anultra high performance liquid chromatography with tandem mass spectrometry method for simult aneous determinati on of thirteen components extracted from Radix Puerariae in rat plasma and tissues: Application to pharmaco kinetic and tissue distribution study[J]. Journal of Separation Science,2020,43(2):418−437. doi: 10.1002/jssc.201900824
[5] 蔡琳. 葛根的化学成分、药理及临床作用的研究进展[J]. 山东化工,2014,43(8):40−41. [CAI Lin. Research progress on the chemical constituents, pharmacology and clinical effects of Pueraria lobata[J]. Shandong Chemical Industry,2014,43(8):40−41. doi: 10.3969/j.issn.1008-021X.2014.08.014 [6] 李树欣. 葛根的化学成分及药理作用的研究进展[J]. 辽宁化工,2020,49(11):1412−1413,1417. [LI Shuxin. Research progress on the chemical constituents and pharmacological effects of Pueraria lobata[J]. Liaoning Chemical Industry,2020,49(11):1412−1413,1417. doi: 10.3969/j.issn.1004-0935.2020.11.023 [7] 孙华, 李春燕, 薛金涛. 葛根的化学成分及药理作用研究进展[J]. 新乡医学院学报,2019,36(11):1097−1101. [SUN Hua, LI Chunyan, XUE Jintao. Research progress on the chemical constituents and pharmacological effects of Pueraria lobata[J]. Journal of Xinxiang Medical College,2019,36(11):1097−1101. [8] CHEN R, LIU B, WANG X Y, et al. Effects of polysaccharide from Pueraria lobata on gut microbiota in mice[J]. International Journal of Biological Macromolecules,2020,158:740−749. doi: 10.1016/j.ijbiomac.2020.04.201
[9] 沈宇, 李野, 张翼, 等. 植物果胶多糖结构与免疫活性研究进展[J]. 中医药学报,2021,49(5):107−110. [SHEN Yu, LI Ye, ZHANG Yi, et al. Research progress on the structure and immune activity of plant pectin polysaccharides[J]. Journal of Traditional Chinese Medicine,2021,49(5):107−110. [10] CHEN Min. Arctium lappa L. polysaccharide can regulate lipid metabolism in type 2 diabetic rats through the SREBP-1/SCD-1 axis[J]. Carbohydrate Research,2020,494:108055−108055. doi: 10.1016/j.carres.2020.108055
[11] 唐健波, 吕都, 彭梅, 等. 酶法辅助热水浸提刺梨多糖工艺优化及其抗肿瘤活性研究[J/OL]. 食品工业科技: 1−11 [2021-07-28]. https://doi.org/10.13386/j.issn1002-0306.2021030147. TANG Jianbo, LV Du, PENG Mei, et al. Enzymatic-assisted hot water extraction process optimization and anti-tumor activity of pear polysaccharides[J/OL]. Food Industry Science and Technology: 1−11 [2021-07-28]. https://doi.org/10.13386/j.issn1002-0306.2021030147.
[12] 李丹丹, 王丽华, 赵丽华, 等. 糖尿病慢病管理系统及数据研究现状及面临问题[J]. 医学信息,2020,33(19):24−27. [LI Dandan, WANG Lihua, ZHAO Lihua, et al. Diabetes chronic disease management system and data research status and problems[J]. Medical Information,2020,33(19):24−27. doi: 10.3969/j.issn.1006-1959.2020.19.008 [13] HELEN R M, CARLA H, JACKIE O, et al. Characteristics and outcomes of pregnant women with type 1 or type 2 diabetes: A 5-year national population-based cohort study[J]. Lancet Diabetes & Endocrinology,2021,9(3):153−164.
[14] KARAM S L, DENDY J, POLU S, et al. Overview of therapeutic inertia in diabetes: Prevalence, causes, and consequences[J]. Diabetes Spectr,2020,3(1):8−15.
[15] 杨飞, 董昕昕, 郭赟. 葛根素对2型糖尿病大鼠的治疗作用[J]. 中国应用生理学杂志,2019,35(4):355−358. [YANG Fei, DONG Xinxin, GUO Yun. Effect of puerarin on type 2 diabetes in rats[J]. Chinese Journal of Applied Physiology,2019,35(4):355−358. doi: 10.12047/j.cjap.5786.2019.075 [16] YANG L, CHEN J, LU H, et al. Pueraria lobata for diabetes mellitus: Past, present and future[J]. Am J Chin Med,2019,47(7):1419−1444. doi: 10.1142/S0192415X19500733
[17] SUN R, DENG X, ZHANG D, et al. Anti-diabetic potential of Pueraria lobata root extract through promoting insulin signaling by PTP1B inhibition[J]. Bioorg Chem,2019,87:12−15. doi: 10.1016/j.bioorg.2019.02.046
[18] 朱家庆, 唐婷范, 刘新梅, 等. 葛根多糖纯化工艺及其抗氧化性能研究[J]. 食品工业科技,2020,41(24):131−136. [ZHU Jiaqing, TANG Tingfan, LIU Xinmei, et al. Purification process of Pueraria lobata polysaccharide and its antioxidant properties[J]. Food Industry Science and Technology,2020,41(24):131−136. [19] 阚晓月. 葛根多糖降血脂活性及其脂质体的制备研究[D]. 镇江: 江苏大学, 2019. KAN Xiaoyue. Study on the blood lipid-lowering activity of Pueraria lobata polysaccharide and its liposome preparation[D]. Zhenjiang: Jiangsu University, 2019.
[20] 钱凯. 葛根多糖的分离、结构表征及其降糖活性研究[D]. 南昌: 江西中医药大学, 2020. QIAN Kai. Isolation, structure characterization and hypoglycemic activity of Pueraria lobata polysaccharide[D]. Nanchang: Jiangxi University of Traditional Chinese Medicine, 2020.
[21] 马伟, 张美琦, 刘振鹏, 等. 正交试验对人参多糖水提醇沉工艺的优化[J]. 东北林业大学学报,2019,47(12):90−94. [MA Wei, ZHANG Meiqi, LIU Zhenpeng, et al. Optimization of water extraction and alcohol precipitation process of ginseng polysaccharide by orthogonal test[J]. Journal of Northeast Forestry University,2019,47(12):90−94. [22] 纪宝玉, 裴莉昕, 陈随清, 等. 葛根不同生长期多糖含量的动态积累研究[J]. 中国实验方剂学杂志,2013,19(16):63−65. [JI Baoyu, PEI Lixin, CHEN Suiqing, et al. Study on the dynamic accumulation of polysaccharide content in different growth periods of Pueraria lobata[J]. Chinese Journal of Experimental Formulas,2013,19(16):63−65. [23] 李钊至, 吕敏, 梁魏, 等. 糖尿病大鼠模型的建立及评价[J]. 基层医学论坛,2017,21(1):4−5. [LI Zhaozhi, LV Min, LIANG Wei, et al. Establishment and evaluation of diabetic rat model[J]. Forum on Primary Medicine,2017,21(1):4−5. [24] 蔡春沉, 徐燕颖, 王洪玺, 等. 葛根多糖对2型糖尿病大鼠的治疗作用及机制研究[J]. 天津中医药,2014,31(2):94−97. [CAI Chunchen, XU Yanying, WANG Hongxi, et al. Study on the therapeutic effect and mechanism of Pueraria lobata polysaccharide on type 2 diabetic rats[J]. Tianjin Traditional Chinese Medicine,2014,31(2):94−97. [25] 刘春梅. 健康体检者血清HDL-C、LDL-C和TG水平检测结果及其血脂异常的发生因素分析[J]. 中国医药指南,2018,16(13):138−139. [LIU Chunmei. Analysis of serum HDL-C, LDL-C and TG levels and the risk factors of dyslipidemia in healthy subjects[J]. Chinese Medical Guide,2018,16(13):138−139. [26] SASIDHARAKURUP H, DIWAKAR S. Computational modelling of TNF-α related pathways regulated by neuroinflammation, oxidative stress and insulin resistance in neurodegeneration[J]. Applied Network Science,2020,5(1):72. doi: 10.1007/s41109-020-00307-w
[27] SUN B, JIA Y, YANG S, et al. Sodium butyrate protects against high-fat diet-induced oxidative stress in rat liver by promoting expression of nuclear factor E2-related factor 2[J]. British Journal of Nutrition,2019,122(4):1−29.
[28] 张琴, 李美东, 罗凯, 等. 植物多糖生物活性功能研究进展[J]. 湖北农业科学,2020,59(24):5−8,15. [ZHANG Qin, LI Meidong, LUO Kai, et al. Research progress on the biological activity of plant polysaccharides[J]. Hubei Agricultural Sciences,2020,59(24):5−8,15. [29] MUHAMMAD M A. Recent trends in chemical modification and antioxidant activities of plants-based polysaccharides[J]. Carbohydrate Polymer Technologies and Applications,2021,2:100045. doi: 10.1016/j.carpta.2021.100045
[30] 刘雅娜, 包晓玮, 王娟, 等. 沙棘多糖抗运动性疲劳及抗氧化作用的研究[J]. 食品工业科技,2021,42(10):321−326. [LIU Yana, BAO Xiaowei, WANG Juan, et al. Research on anti-exercise fatigue and antioxidant effects of seabuckthorn polysaccharides[J]. Food Industry Science and Technology,2021,42(10):321−326. [31] 薛山, 巩子童, 林靖娟, 等. 芽球菊苣根粗多糖提取工艺优化及其体外抗氧化活性和相对分子量分析[J]. 食品工业科技,2021,42(10):138−145. [XUE Shan, GONG Zitong, LIN Jingjuan, et al. Optimization of extraction technology of crude polysaccharide from chicory root and analysis of its in vitro antioxidant activity and relative molecular weight[J]. Food Industry Science and Technology,2021,42(10):138−145. [32] ZHOU S Y, HUANG G L, CHEN G Y. Extraction, structural analysis, derivatization and antioxidant activity of polysaccharide from Chinese yam[J]. Food Chemistry, 361,2021:130089.
[33] 郑朝安. 1型糖尿病的发病机制[J]. 国际儿科学杂志,2020(4):274−278. [ZHENG Chaoan. Pathogenesis of type 1 diabetes[J]. International Journal of Pediatrics,2020(4):274−278. doi: 10.3760/cma.j.issn.1673-4408.2020.04.014 [34] 孟祥云, 郭树明, 杨丽霞. 中药植物多糖对2型糖尿病胰岛素抵抗的作用机制研究进展[J]. 中国实验方剂学杂志,2017,23(8):220−225. [MENG Xiangyun, GUO Shuming, YANG Lixia. Research progress in the mechanism of Chinese herbal plant polysaccharides on insulin resistance in type 2 diabetes[J]. Chinese Journal of Experimental Formulas,2017,23(8):220−225. [35] 董文南, 李克招, 张文婷, 等. 多糖降血糖作用及其机制研究进展[J]. 中国实验方剂学杂志,2019,25(19):219−225. [DONG Wennan, LI Kezhao, ZHANG Wenting, et al. Research progress in the hypoglycemic effect of polysaccharides and its mechanism[J]. Chinese Journal of Experimental Formulas,2019,25(19):219−225. [36] GUO W, ZHU S Q, LI S Y, et al. Microalgae polysaccharides ameliorates obesity in association with modulation of lipid metabolism and gut microbiota in high-fat-diet fed C57BL/6 mice[J]. International Journal of Biological Macromolecules,2021,182:1371−1383. doi: 10.1016/j.ijbiomac.2021.05.067
[37] 曾山容, 邓小敏, 易倍吉, 等. 中医药治疗2型糖尿病血脂异常的研究进展[J]. 大众科技,2021,23(4):73−75. [ZENG Shanrong, DENG Xiaomin, YI Beiji, et al. Research progress of TCM treatment of dyslipidemia in type 2 diabetes[J]. Popular Science and Technology,2021,23(4):73−75. doi: 10.3969/j.issn.1008-1151.2021.04.022 [38] 李秋云, 王彩宁, 史丽萍, 等. 2型糖尿病及前期患者胰岛素抵抗与脂代谢紊乱的关系[J]. 中国全科医学,2011(24):2716−2719. [LI Qiuyun, WANG Caining, SHI Liping, et al. The relationship between insulin resistance and lipid metabolism disorders in patients with type 2 diabetes and pre-diabetes[J]. Chinese General Practice,2011(24):2716−2719. [39] 房丹, 周志焕. 中医药治疗2型糖尿病脂代谢异常的研究进展[J]. 光明中医,2019,34(24):3852−3854. [FANG Dan, ZHOU Zhihuan. Research progress of TCM treatment of abnormal lipid metabolism in type 2 diabetes[J]. Guangming Traditional Chinese Medicine,2019,34(24):3852−3854. doi: 10.3969/j.issn.1003-8914.2019.24.065 [40] MAHMOUD M. SAMAHA, E S, HATEM A S. A comparative study of the role of crocin and sitagliptin in attenuation of STZ-induced diabetes mellitus and the associated inflammatory and apoptotic changes in pancreatic β-islets[J]. Environmental Toxicology and Pharmacology,2019,72:103238. doi: 10.1016/j.etap.2019.103238
[41] 杨鑫, 刘明辉, 马越娇, 等. 复方中药组分抗胰岛素抵抗糖尿病大鼠糖的过氧化作用[J]. 中国当代医药,2018,25(33):33−36. [YANG Xin, LIU Minghui, MA Yuejiao, et al. Anti-glucose peroxidation of the components of compound Chinese medicine against insulin resistance in diabetic rats[J]. China Contemporary Medicine,2018,25(33):33−36. doi: 10.3969/j.issn.1674-4721.2018.33.010






 下载:
下载:
 下载:
下载:
