Optimization of Surfactant-assisted Ultrasonic Extraction of Total Flavonoids from Persimmon Leaves
-
摘要: 目的:优选表面活性剂辅助超声提取柿叶总黄酮工艺。方法:以柿叶为材料,总黄酮得率和DPPH自由基清除率为指标,分别考察表面活性剂种类、表面活性剂质量分数、液料比、超声时间及超声温度对指标的影响,并通过Box-Behnken设计-双响应面法优选总黄酮提取工艺。结果:最佳提取工艺:乙醇体积分数70%、十二烷基硫酸钠质量分数0.6%、液料比22:1 mL/g、超声温度30 ℃和超声时间7.3 min,此时柿叶总黄酮得率的实际值为(103.63±0.10)mg/g,DPPH自由基清除率为(65.35%±0.12%)。结论:优化后的提取工艺可有效地提高柿叶总黄酮得率,为柿叶黄酮类成分资源的研究开发与利用提供一定的理论基础。Abstract: Objective: The surfactant-assisted ultrasonic extraction of total flavonoids from persimmon leaves was optimized. Methods: With the extraction rate of total flavonoids and DPPH radical scavenging rate as the double-indicator response values, the effects of surfactant type and mass fraction, liquid-to-material ratio, ultrasonic time, and ultrasonic temperature were investigated, and the Box-Behnken design-double response surface methodology was used to optimize the extraction process of total flavonoids from persimmon leaves. Results: The obtained optimal extraction process was as follows: Ethanol volume fraction of 70%, the mass fraction of sodium dodecyl sulfate 0.6%, liquid-to-material ratio of 22:1 mL/g, ultrasonic temperature of 30 ℃ and time of 7.3 min. Under these conditions, the actual extraction rate of total flavonoids from persimmon leaves was (103.63±0.10) mg/g and the DPPH radical scavenging rate was (65.35%±0.12%). Conclusion: The optimized extraction process can effectively improve the yield of total flavonoids from persimmon leaves and provide a theoretical basis for the development and utilization of flavonoids resources from persimmon leaves.
-
柿叶为柿树科柿树属植物柿(Diospyros kaki Thunb.)的干燥叶,入药最早见于《滇南本草》[1],目前已作为一种天然食品添加剂广泛用于食品生产,如糖果、茶饮、饼干等[2]。柿叶中富含黄酮、多糖、萜类、多酚及香豆素等多种对人体健康有益的成分[3-4]。黄酮类化合物为柿叶中主要成分之一,在抗氧化、抗菌、抗衰老、调节血压等方面具有显著疗效[5-6]。现代医学研究表明,外源性抗氧化剂可清除活性氧及自由基,防治氧化应激给机体带来的损伤[7]。柿叶抗氧化效果显著,已成为天然抗氧化剂研究和开发的热点之一。
目前,传统有机溶剂在天然活性成分的提取工艺研究中占主导地位,但存在溶剂消耗量大、提取率低等问题。表面活性剂作为一种新型绿色、环保的提取剂,因具有降低固/液表面张力、增加成分溶出、缩短提取时间、减少有机试剂用量等优点,而被广泛应用于天然活性成分提取工艺研究中[8-10]。国内虽已有学者利用超声提取法[5, 11-12]或复合酶协同超声法[13]对柿叶总黄酮的提取工艺进行研究,但将超声提取技术和表面活性剂相结合提取柿叶总黄酮的研究鲜有报道。同时,仅凭借柿叶总黄酮含量高低对提取工艺进行评价具有一定的局限性,若能将总黄酮得率与生物活性相整合则可综合全面地评价其提取工艺[14-15]。因此,本试验在卢鑫等[5]前期研究的基础上,采用表面活性剂协同超声提取技术,以总黄酮得率和抗氧化活性为双指标参数的响应面法优化柿叶总黄酮提取工艺,旨在为柿叶黄酮类成分资源的深入研究开发和利用提供一定的理论依据。
1. 材料与方法
1.1 材料与仪器
柿叶(河北易县) 安国市御颜坊中药材有限公司,山东中医药大学孙稚颖教授鉴定为柿树科柿树属植物柿的干燥叶;芦丁标准品(批号B20771) 上海源叶生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-dipheny1-2picryl-hydrazyl,DPPH,纯度大于97%)、十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)、吐温80(Tween-80) 均为分析纯,上海麦克林生化科技有限公司;无水乙醇 分析纯,天津市富宇精细化工有限公司;氢氧化钠 分析纯,天津市汇杭化工科技有限公司;亚硝酸钠 分析纯,中国医药集团上海化学试剂公司;硝酸铝 分析纯,天津市大茂化学试剂厂。
KQ-500GVDV双频恒温数控超声波清洗器 昆山市超声仪器有限公司;ST16R高速冷冻离心机 赛默飞世尔科技(中国)有限公司;GFL-230电热鼓风干燥箱 天津市莱玻特瑞仪器设备有限公司;QE-300高速离心机 浙江屹立工贸有限公司;FA1204B电子天平 上海佑科仪器仪表有限公司;UV 9100 B紫外可见分光光度计 北京莱伯泰科仪器有限公司。
1.2 实验方法
1.2.1 柿叶总黄酮的提取
1.2.1.1 样品预处理
取适量柿叶药材,置于50 ℃烘箱中,干燥6 h至恒重,用打粉机粉碎,过三号筛,即得柿叶粉末。
1.2.1.2 柿叶总黄酮的提取
参照刘钊等[9]报道的方法,精确称取柿叶粉末0.20 g,置于15 mL离心管中,按照一定的液料比加入一定体积的溶剂,在一定温度下进行超声(固定频率45 kHz)提取,在温度25 ℃和转速13000 r/min下离心15 min,取上清液作为总黄酮提取液。
1.2.2 单因素实验
在前期研究报道的基础上,固定乙醇浓度70%,超声功率350 W[5],分别考察表面活性剂种类、表面活性剂质量分数、液料比、超声时间、超声温度五个因素对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.2.1 不同表面活性剂种类对柿叶总黄酮得率和DPPH自由基清除率的影响
准确称取柿叶粉末0.20 g,在表面活性剂含量0.5%、液料比20:1(mL/g)、超声温度30 ℃、超声时间10 min的条件下,探究非离子型表面活性剂—吐温80(Tween-80)、阴离子型表面活性剂—十二烷基硫酸钠(SDS)、阳离子型表面活性剂—十六烷基三甲基溴化铵(CTAB)、70%乙醇对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.2.2 SDS质量分数对柿叶总黄酮得率和DPPH自由基清除率的影响
准确称取柿叶粉末0.20 g,在液料比20:1(mL/g)、超声时间10 min、超声温度30 ℃、乙醇体积分数70%条件下,探究SDS质量分数为0.0%、0.5%、1.0%、1.5%、2.0%对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.2.3 液料比对柿叶总黄酮得率和DPPH自由基清除率的影响
准确称取柿叶粉末0.20 g,在SDS质量分数0.5%、超声时间10 min、超声温度30 ℃、乙醇体积分数70%的条件下,探究液料比为10:1、20:1、30:1、40:1、50:1(mL/g)对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.2.4 超声时间对柿叶总黄酮得率和DPPH自由基清除率的影响
准确称取柿叶粉末0.20 g,在SDS质量分数0.5%、液料比20:1(mL/g)、超声温度30 ℃、乙醇体积分数70%的条件下,探究超声时间为5、10、15、20、25 min对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.2.5 超声温度对柿叶总黄酮得率和DPPH自由基清除率的影响
准确称取柿叶粉末0.20 g,在SDS质量分数0.5%、液料比20:1(mL/g)、超声时间10 min、乙醇体积分数70%的条件下,探究超声温度为30、40、50、60、70 ℃对柿叶总黄酮得率和DPPH自由基清除率的影响。
1.2.3 响应面试验
根据单因素实验结果和文献报道[5],选择影响较大的三个因素为自变量,根据Box-Behnken中心组合设计原理,以柿叶总黄酮得率和DPPH自由基清除率为双响应值,进行提取工艺优化。响应面试验分析因素水平设计见表1。
表 1 响应面试验分析因素水平设计Table 1. Factors and levels of response surface analysis因素 水平 −1 0 1 SDS含量(%) 0 0.5 1 液料比(mL/g) 10:1 20:1 30:1 超声时间(min) 5 10 15 1.2.4 指标测定
1.2.4.1 总黄酮的测定
参照秦晶晶等[11]报道的柿叶总黄酮测定方法,并稍作修改。依次吸取系列芦丁对照品溶液,分别置于10 mL容量瓶,加水至2.5 mL,加5%亚硝酸钠溶液0.4 mL,摇匀,静置6 min,加10%硝酸铝溶液0.4 mL,摇匀,静置6 min,加4%氢氧化钠溶液6 mL,加乙醇至刻度,摇匀,静置15 min,于510 nm处测定吸光度A。以A为纵坐标,浓度C(mg/mL)为横坐标,测得标准曲线方程为A=11.646C+0.0003,相关系数r=0.9996,表明芦丁在0~0.05 mg/mL范围内,浓度与吸光度呈良好线性关系。
取提取液0.1 mL,加水至2.5 mL,按上述方法测定,计算柿叶总黄酮得率。公式如下:
总黄酮得率(mg/g)=C×V×nm 式中:C为根据回归方程计算得到的质量浓度,mg/mL;V为提取液总体积,mL;n为样品稀释倍数;m为柿叶粉末质量,g。
1.2.4.2 DPPH自由基清除率的测定
参照文献报道的DPPH自由基清除率测定方法[11]。取提取液1 mL,加入无水乙醇,稀释至25 mL。取2 mL稀释液,加入0.1 mg/mL的DPPH溶液2 mL,混合摇匀,室温避光反应30 min,于517 nm测定吸光度A。
DPPH自由基清除率(%)=A空白−(A样品−A对照)A空白×100 式中:A空白为2 mL DPPH溶液加入2 mL乙醇溶液的吸光度;A样品为2 mL DPPH溶液加入2 mL柿叶样品稀释液的吸光度;A对照为2 mL柿叶样品稀释液加入2 mL无水乙醇的吸光度。
1.3 数据处理
实验操作均重复3次,结果以平均值±SD表示。采用软件SPSS26.0、Design-Expert 8.0.6进行数据分析和绘图。方差分析中P<0.05表示差异具有显著统计学意义。
2. 结果与分析
2.1 单因素实验结果
2.1.1 表面活性剂的种类对总黄酮得率和DPPH自由基清除率的影响
从图1可知,不同类型表面活性剂破坏细胞膜的能力不同,导致提取成分的含量也存在一定的差异[9],Tween-80总黄酮得率和DPPH自由基清除率最低,SDS总黄酮得率和DPPH自由基清除率最高,CTAB和70%乙醇次之。因此,实验选择SDS作为表面活性剂。
2.1.2 SDS含量对总黄酮得率和DPPH自由基清除率的影响
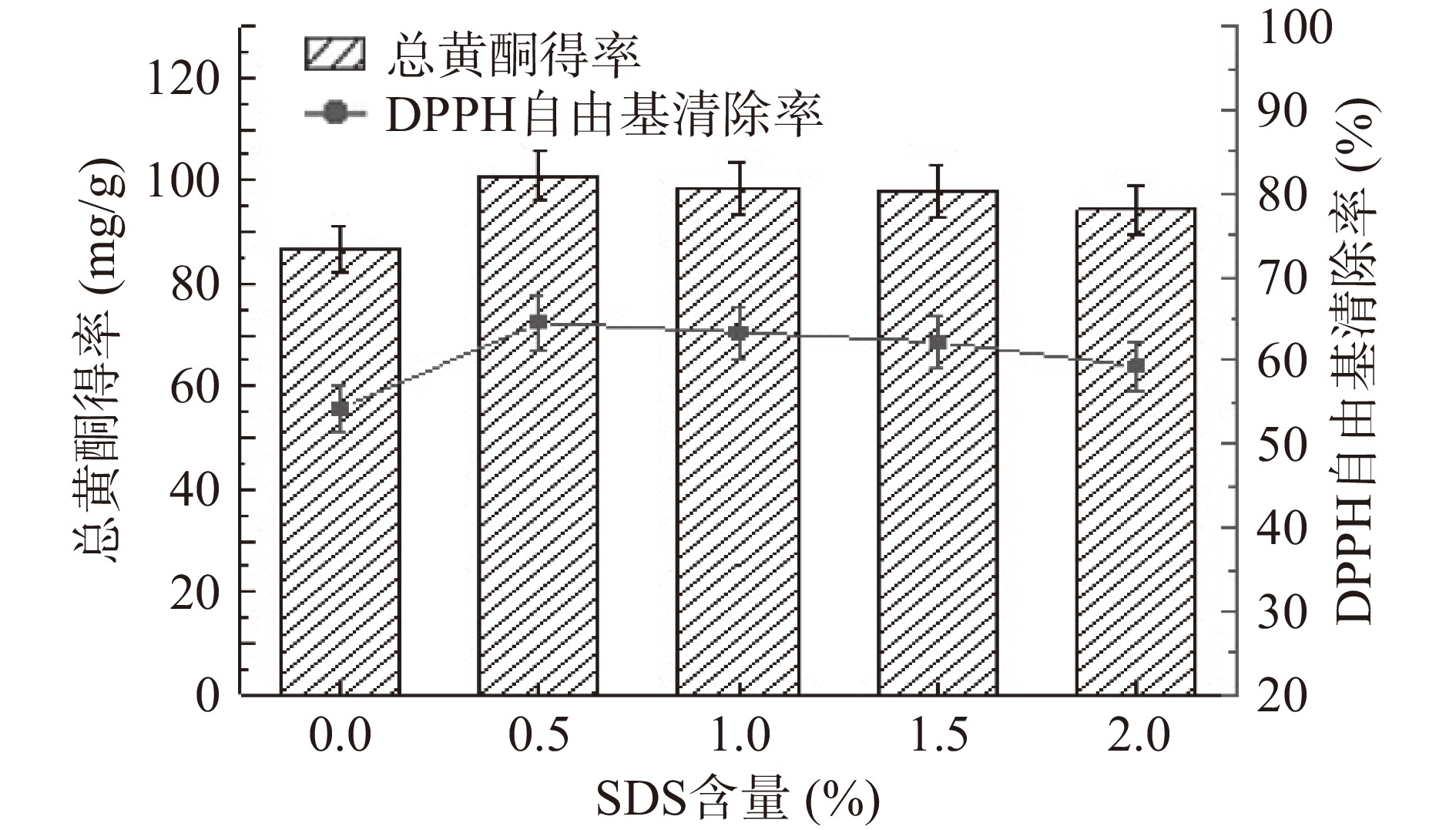
从图2可知,SDS含量在0.0%~0.5%之间,总黄酮得率呈上升趋势;当SDS质量分数为0.5%时,总黄酮得率最高,存在明显差异;SDS含量在0.5%~2%之间,总黄酮得率呈下降趋势。这与前期报道的现象一致,随着SDS含量的增加,溶液中形成的胶束数目增多,对柿叶总黄酮的增溶作用加大[16],当SDS含量增加到一定数值时,胶束形态发生改变,总黄酮得率不再增加,而对其他成分起到较强增溶作用[17],导致总黄酮得率有所下降。对于DPPH自由基清除率,其变化趋势与总黄酮得率一致。综合考虑, SDS质量分数为0.5%较为合适。
2.1.3 液料比对总黄酮得率和DPPH自由基清除率的影响
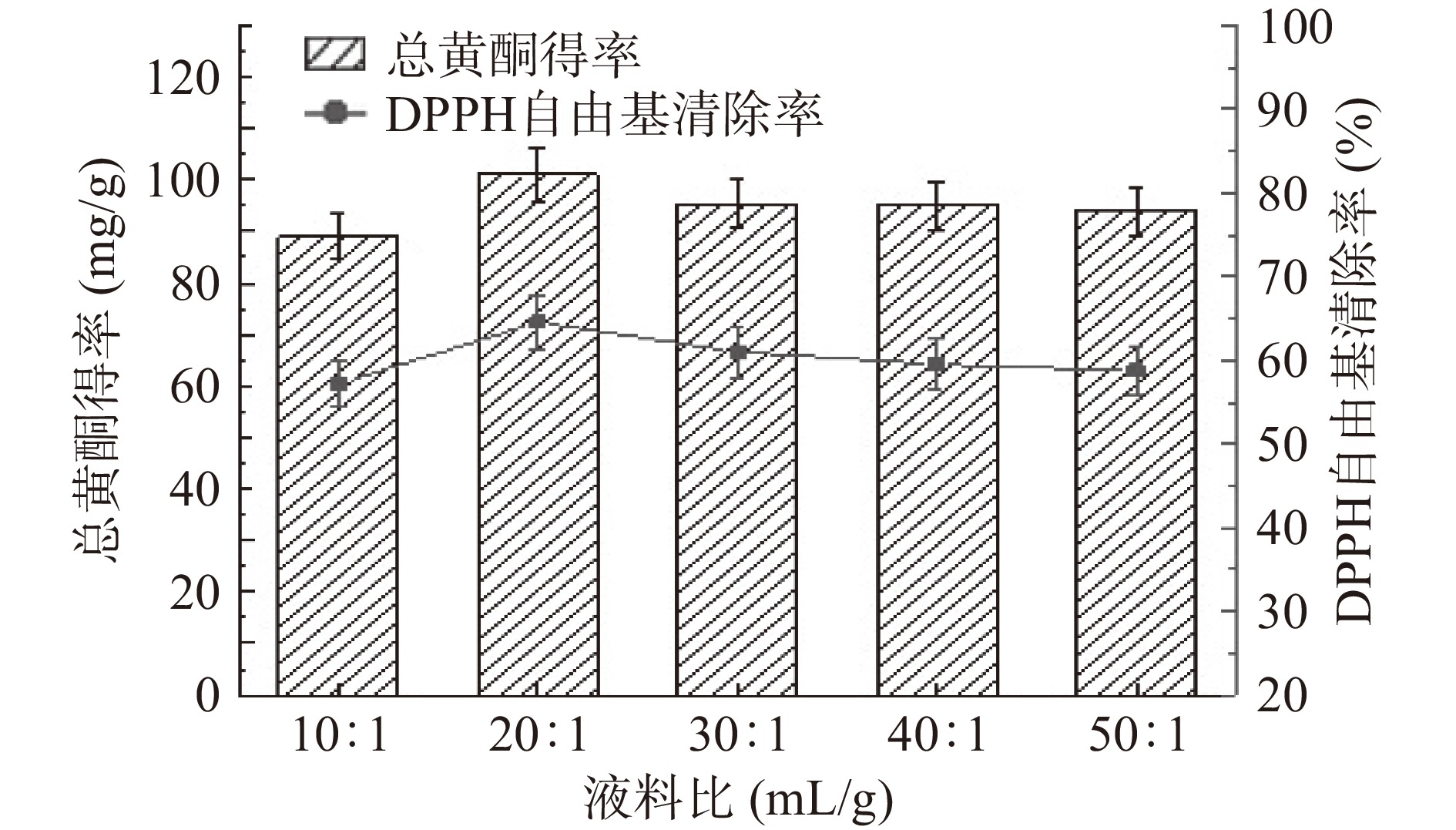
从图3可知,柿叶总黄酮得率随液料比的增大而增加,在20:1 mL/g时达到最高值,之后再增大液料比总黄酮得率反而降低。随着液料比的增加,虽然增大了提取溶剂与柿叶粉末的接触面积,其他杂质、色素的溶出也增多[18-19],使得总黄酮得率出现了下降的趋势。从DPPH清除率角度来看,其变化趋势与总黄酮得率呈现一致性。从节约成本并保证清除率的角度综合考虑,选择液料比为20:1 mL/g。
2.1.4 超声时间对总黄酮得率和DPPH自由基清除率的影响
由图4可知,随着超声时间的延长,柿叶总黄酮得率与DPPH清除率均呈现先升高后降低的趋势,在超声时间10 min时达到最大值,这与前期报道的超声提取柿叶总黄酮工艺相比,大大缩短了提取时间[5, 13]。随着超声时间的延长,柿叶总黄酮得率增加,但空化效应减弱,柿叶对总黄酮的吸附能力增强[20-21],从而对DPPH自由基的清除能力也有所减弱。因此,从柿叶总黄酮得率和DPPH清除率角度综合考虑,确定超声时间为10 min。
2.1.5 超声温度对总黄酮得率和DPPH自由基清除率的影响
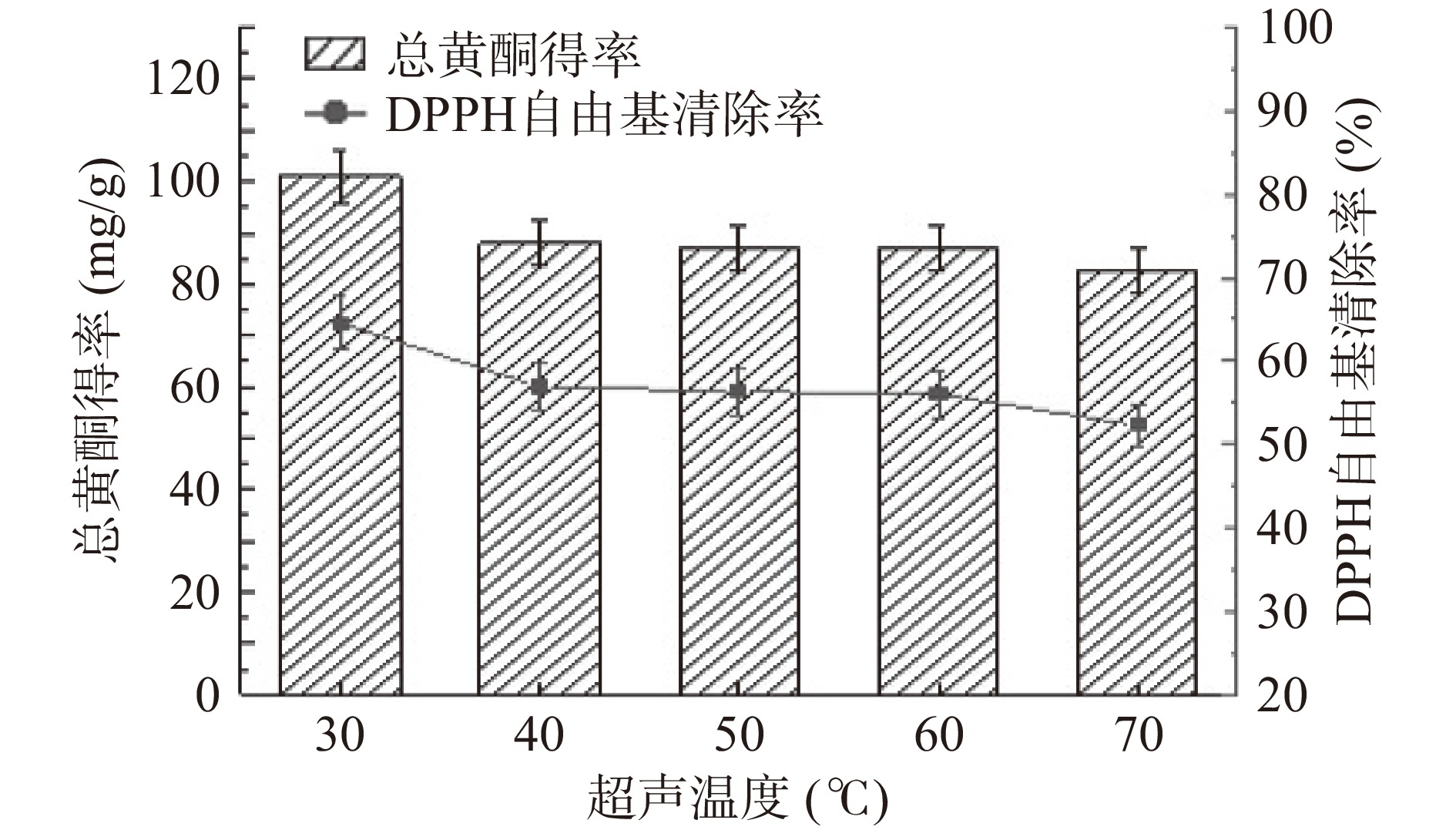
从图5可知,随着温度的升高,总黄酮得率和DPPH清除率均呈现下降的趋势,温度在30 ℃时为最高点,40~60 ℃相对平稳,70 ℃时明显下降。此现象与前期研究结果相一致,温度过高会破坏黄酮的结构,使形成的部分胶束发生离解,导致增溶能力下降[22]。因此,从降低能耗和保证DPPH自由基清除率的角度综合考虑,选择超声温度为30 ℃。
2.2 响应面试验结果
2.2.1 回归模型建立与方差分析
在单因素实验结果分析基础上,选取SDS含量(A)、液料比(B)、超声时间(C)为自变量,总黄酮得率(Y1)和DPPH自由基清除率(Y2)为响应值,运用Box-Behnken设计原理进行三因素三水平的试验设计(表2)。运用Design-Expert 11.0软件对双响应面进行分析,得到Y1和Y2的回归方程分别为:
表 2 双响应面分析设计及结果Table 2. Design and results of double response surface analysis试验号 A SDS
含量B 液料比 C 超声
时间总黄酮得率
(mg/g)DPPH·清除率
(%)1 1 −1 0 91.45 57.19 2 −1 0 1 87.43 54.31 3 0 0 0 102.32 63.37 4 −1 −1 0 86.36 53.27 5 0 0 0 103.79 64.97 6 1 0 −1 98.20 63.29 7 1 0 1 96.01 58.79 8 1 1 0 95.36 61.02 9 −1 0 −1 88.96 59.47 10 0 1 1 94.80 60.34 11 0 0 0 101.40 64.56 12 −1 1 0 87.88 53.76 13 0 0 0 105.20 63.20 14 0 1 −1 97.92 63.68 15 0 −1 1 92.98 58.34 16 0 −1 −1 95.66 59.45 17 0 0 0 104.15 64.51 Y1(总黄酮得率)=103.37+3.8A+1.19B−1.19C+0.5975AB−0.165AC−0.11BC−7.9A2−5.21B2−2.82C2;
Y2(DPPH·清除率)=64.12+2.44A+1.32B−1.76C+0.835AB+0.165AC−0.5575BC−4.65A2−3.16B2−0.5072C2。
由表3和表4可知,两模型均达到极显著水平(P<0.01),且失拟项不显著(P>0.05),说明模型拟合效果较好,无失拟因素存在。总黄酮得率和DPPH自由基清除率的模型决定系数分别为R2=0.9779、R2=0.9695,说明该模型拟合度较好,可以用于表面活性剂辅助超声提取柿叶总黄酮提取工艺的初步和预测。变异系数CV%是衡量每个测量平均值偏离真实情况的参数,两个模型的变异系数分别为1.44%和1.70%,均小于5%,说明模型的实验操作可信、重复性较好[23]。
表 3 柿叶总黄酮得率的方差分析结果Table 3. Analysis of variance on the extraction rate of total flavonoids from persimmon leaves回归方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 589.44 9 65.49 34.39 <0.0001 ** A 115.44 1 115.44 60.62 0.0001 ** B 11.31 1 11.31 5.94 0.0450 * C 11.33 1 11.33 5.95 0.0448 * AB 1.43 1 1.43 0.7498 0.4152 AC 0.1089 1 0.1089 0.0572 0.8179 BC 0.0484 1 0.0484 0.0254 0.8778 A2 262.76 1 262.76 137.97 <0.0001 ** B2 114.28 1 114.28 60.01 0.0001 ** C2 33.54 1 33.54 17.61 0.0041 ** 残差 13.33 7 1.90 失拟性 4.21 3 1.40 0.6163 0.6400 纯误差 9.12 4 2.28 总误差 602.77 16 注:“*”表示P<0.05,有显著性差异;“**”表示P<0.01,有极显著性差异;表4同。 表 4 DPPH自由基清除率的方差分析结果Table 4. Analysis of variance on the radical scavenging rate of DPPH回归方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 234.17 9 26.02 24.74 0.0002 ** A 47.43 1 47.43 45.10 0.0003 ** B 13.91 1 13.91 13.23 0.0083 ** C 24.89 1 24.89 23.66 0.0018 ** AB 2.79 1 2.79 2.65 0.1475 AC 0.1089 1 0.1089 0.1035 0.7570 BC 1.24 1 1.24 1.18 0.3130 A2 91.03 1 91.03 86.55 <0.0001 ** B2 42.1 1 42.10 40.03 0.0004 ** C2 1.08 1 1.08 1.03 0.3440 残差 7. 36 7 1.05 失拟性 4.89 3 1.63 2.63 0.1867 纯误差 2.48 4 0.6193 总误差 241.53 16 总黄酮得率和DPPH自由基清除率的分析结果显示,一次项A、B、C与二次项A2、B2均达到显著水平(P<0.05)。通过对F值的比较,各因素对总黄酮得率和DPPH自由基清除率的影响程度均为SDS含量(A)>超声时间(C)>液料比(B)。其中A、B和C因素以及A2、B2对柿叶总黄酮得率和DPPH自由基清除率的影响具有显著性意义(P<0.05),而各因素交互作用AB、BC、AC的影响均不具有显著性(P>0.05)。
2.2.2 响应面最佳工艺预测及验证实验
通过Design Expert11.0.0软件的分析优化,得到的最佳提取工艺理论值为SDS含量0.63%,液料比22.07:1 mL/g,超声时间7.28 min,此时柿叶总黄酮得率的理论值为103.73 mg/g,DPPH自由基清除率理论值为65.47%。为了便于操作,实际操作时将最优条件调整为SDS含量0.6%,液料比22:1 mL/g,超声时间7.3 min,在此优化条件下重复实验3次,得到柿叶总黄酮得率的实际值为(103.63±0.10)mg/g,DPPH自由基清除率为(65.35%±0.12%),与理论值无显著性差异(P>0.05),说明此方法可行。这与前期仅采用超声提取柿叶总黄酮工艺的研究[5, 13]结果相比,表面活性剂大大提高了总黄酮的提取效率。
3. 结论
本研究以总黄酮得率和DPPH自由基清除率为双指标参数,将化学成分与生物活性进行有机整合,采用双响应面法优化表面活性剂辅助超声提取柿叶总黄酮工艺。表面活性剂的加入使得柿叶总黄酮提取效率和DPPH自由基清除率大大提高,缩短了提取时间,并且用量较低,具有经济和绿色的双重效果。所得最佳提取工艺参数稳定可行,有利于柿叶总黄酮作为天然抗氧化剂在饮品、药品、化妆品和食品等领域的推广应用,为功能性柿叶产品的深入研究与开发提供了一定的理论依据。同时,本研究中仍存在一些尚待解决的问题,需先采用质谱对总黄酮粗提物中化学成分进行定性分析,再利用HPLC对其所含主要黄酮化合物进行定量分析,将为后续进一步从柿叶资源中分离、纯化天然抗氧化剂提供一定的指导作用。
-
表 1 响应面试验分析因素水平设计
Table 1 Factors and levels of response surface analysis
因素 水平 −1 0 1 SDS含量(%) 0 0.5 1 液料比(mL/g) 10:1 20:1 30:1 超声时间(min) 5 10 15 表 2 双响应面分析设计及结果
Table 2 Design and results of double response surface analysis
试验号 A SDS
含量B 液料比 C 超声
时间总黄酮得率
(mg/g)DPPH·清除率
(%)1 1 −1 0 91.45 57.19 2 −1 0 1 87.43 54.31 3 0 0 0 102.32 63.37 4 −1 −1 0 86.36 53.27 5 0 0 0 103.79 64.97 6 1 0 −1 98.20 63.29 7 1 0 1 96.01 58.79 8 1 1 0 95.36 61.02 9 −1 0 −1 88.96 59.47 10 0 1 1 94.80 60.34 11 0 0 0 101.40 64.56 12 −1 1 0 87.88 53.76 13 0 0 0 105.20 63.20 14 0 1 −1 97.92 63.68 15 0 −1 1 92.98 58.34 16 0 −1 −1 95.66 59.45 17 0 0 0 104.15 64.51 表 3 柿叶总黄酮得率的方差分析结果
Table 3 Analysis of variance on the extraction rate of total flavonoids from persimmon leaves
回归方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 589.44 9 65.49 34.39 <0.0001 ** A 115.44 1 115.44 60.62 0.0001 ** B 11.31 1 11.31 5.94 0.0450 * C 11.33 1 11.33 5.95 0.0448 * AB 1.43 1 1.43 0.7498 0.4152 AC 0.1089 1 0.1089 0.0572 0.8179 BC 0.0484 1 0.0484 0.0254 0.8778 A2 262.76 1 262.76 137.97 <0.0001 ** B2 114.28 1 114.28 60.01 0.0001 ** C2 33.54 1 33.54 17.61 0.0041 ** 残差 13.33 7 1.90 失拟性 4.21 3 1.40 0.6163 0.6400 纯误差 9.12 4 2.28 总误差 602.77 16 注:“*”表示P<0.05,有显著性差异;“**”表示P<0.01,有极显著性差异;表4同。 表 4 DPPH自由基清除率的方差分析结果
Table 4 Analysis of variance on the radical scavenging rate of DPPH
回归方差来源 平方和 自由度 均方 F值 P值 显著性 回归模型 234.17 9 26.02 24.74 0.0002 ** A 47.43 1 47.43 45.10 0.0003 ** B 13.91 1 13.91 13.23 0.0083 ** C 24.89 1 24.89 23.66 0.0018 ** AB 2.79 1 2.79 2.65 0.1475 AC 0.1089 1 0.1089 0.1035 0.7570 BC 1.24 1 1.24 1.18 0.3130 A2 91.03 1 91.03 86.55 <0.0001 ** B2 42.1 1 42.10 40.03 0.0004 ** C2 1.08 1 1.08 1.03 0.3440 残差 7. 36 7 1.05 失拟性 4.89 3 1.63 2.63 0.1867 纯误差 2.48 4 0.6193 总误差 241.53 16 -
[1] 郭海彪, 董福越, 李雯珊, 等. 一测多评法测定柿叶提取物中6种黄酮类成分[J]. 中国现代应用药学,2021,38(7):831−835. [GUO H B, DONG F Y, LI W S, et al. Determination of six flavonoids in extract of Diospyros kaki Thunb. leaves by QAMS[J]. Chinese Journal of Modern Applied Pharmacy,2021,38(7):831−835. [2] HOSSAIN A, MOON H K, KIM J K. Effect of pre-treatment and extraction conditions on the antioxidant properties of persimmon (Diospyros kaki) leaves[J]. Bioscience, Biotechnology, and Biochemistry,2017,81(11):2079−2085. doi: 10.1080/09168451.2017.1378088
[3] XUE Y, TAKUYA M, YASUNA H, et al. Isolation and tyrosinase inhibitory effects of polyphenols from the leaves of persimmon, Diospyros kaki[J]. Journal of Agricultural and Food Chemistry,2011,59(11):6011−6017. doi: 10.1021/jf200940h
[4] LI C, WEI Y D, ZHAO S M, et al. Antitumor and immunomodulatory activities of total flavonoids extract from persimmon leaves in H22 liver tumor-bearing mice[J]. Scientific Reports,2018,8(1):1−11.
[5] 卢鑫, 张琳. 柿叶黄酮超声辅助提取工艺及其抗氧化性研究[J]. 食品研究与开发,2016,37(23):99−103. [LU X, ZHANG L. Study on the extraction technology by ultrasonic assisted and antioxidant activity of total flavonoids from persimmon leaves[J]. Food Research and Development,2016,37(23):99−103. doi: 10.3969/j.issn.1005-6521.2016.23.024 [6] RUTH M L H, PAOLA Q R, ANA A, et al. Polyphenolic profile of persimmon leaves by high resolution mass spectrometry (LC-ESI-LTQ-Orbitrap-MS)[J]. Journal of Functional Foods,2016,23:370−377. doi: 10.1016/j.jff.2016.02.048
[7] SECK I, HOSU A, CIMPOIU C. Phytochemicals content, screening and antioxidant/pro-oxidant activities of Carapa procera (barks) (Meliaceae)[J]. South African Journal of Botany,2021,137:369−376. doi: 10.1016/j.sajb.2020.11.019
[8] 孟瑶, 余莲, 秦祥宇, 等. 阴阳离子表面活性剂对无花果叶中有效成分提取工艺优化及初步功能评价[J]. 植物研究,2020,40(5):789−794. [MENG Y, YU L, QIN X Y, et al. Optimization of the active compounds extraction process from fig leaves by anionic and cationic surfactants and preliminary functional evaluation[J]. Bulletin of Botanical Research,2020,40(5):789−794. doi: 10.7525/j.issn.1673-5102.2020.05.019 [9] 刘钊, 严子军, 许逸琼. 利用表面活性剂超声波辅助提取胡柚皮黄酮的研究[J]. 食品研究与开发,2020,41(18):125−130. [LIU Z, YAN Z J, XU Y Q. Study on extraction of flavonoids from Huyou peel with ultrasonic assist of surfactant[J]. Food Research and Development,2020,41(18):125−130. [10] 李陆军, 王志宏, 霍延平, 等. 表面活性剂辅助超声萃取杜仲叶总多酚及其抗氧化活性研究[J]. 日用化学工业,2020,50(3):164−170. [LI L J, WANG Z H, HUO Y P, et al. Study on surfactant-assisted ultrasonic extraction of total polyphenols from Eucommia ulmoides leaves and their antioxidant activity[J]. China Surfactant Detergent & Cosmetics,2020,50(3):164−170. doi: 10.3969/j.issn.1001-1803.2020.03.005 [11] 秦晶晶, 钱慧琴, 赵媛, 等. 柿叶总黄酮提取工艺优化及其抗氧化活性[J]. 食品工业科技,2020,41(13):32−38,45. [QIN J J, QIAN H Q, ZHAO Y, et al. Optimization of the extraction technology of total flavonoids and in vitro antioxidant activity of extract from persimmon leaves[J]. Science and Technology of Food Industry,2020,41(13):32−38,45. [12] 杨露, 李小芳, 罗开沛, 等. 柿叶中总黄酮的超声提取工艺研究[J]. 中药与临床,2016,7(6):27−30. [YANG L, LI X F, LUO K P, et al. Study on the extraction process of total flavonoids in persimmon leaves[J]. Pharmacy and Clinics of Chinese Materia Medica,2016,7(6):27−30. [13] 袁秀平, 华燕青, 王云云. 复合酶协同超声法提取柿叶总黄酮的工艺优化[J]. 中国食品添加剂,2019,30(8):103−108. [YUAN X P, HUA Y Q, WANG Y Y. Extraction of flavonoids from persimmon leaves with ultrasonic combined with compuond enzyme[J]. China Food Additives,2019,30(8):103−108. doi: 10.3969/j.issn.1006-2513.2019.08.011 [14] 赵梦利, 刘妍如, 宋忠兴, 等. 基于成分-抗氧化活性相关的鸡血藤饮片等级评价研究[J]. 中草药,2020,51(4):943−949. [ZHAO M L, LIU Y R, SONG Z X, et al. Research on grade prediction of Spatholobi Caulis via components-anti-oxidant activity correlations[J]. Chinese Traditional and Herbal Drugs,2020,51(4):943−949. doi: 10.7501/j.issn.0253-2670.2020.04.019 [15] 李寒冰, 吴宿慧, 牛明, 等. 中药品质生物评价的历史与发展[J]. 中草药,2017,48(14):2809−2816. [LI H B, WU S H, NIU M, et al. History and development of biological assay for quality of Chinese materia medica[J]. Chinese Traditional and Herbal Drugs,2017,48(14):2809−2816. [16] 杨凯, 张桂菊, 徐宝财. 表面活性剂辅助提取肉苁蓉总黄酮的工艺研究[J]. 日用化学工业,2015,45(6):328−331,341. [YANG K, ZHANG G J, XU B C. Process study on surfactant-assisted extraction of total flavonoids from Cistanche deserticola Y C Ma[J]. China Surfactant Detergent & Cosmetics,2015,45(6):328−331,341. [17] 姜文倩, 郑丹婷, 韩伟. 吐温60协同微波提取甘草黄酮的优化[J]. 南京工业大学学报(自然科学版),2020,42(5):671−676. [JIANG W Q, ZHENG D T, HAN W. Optimization of Tween 60 assisted microwave extraction of glycyrrhizic flavonoids[J]. Journal of Nanjing Tech University (Natural Science Edition),2020,42(5):671−676. [18] 王春林, 武芸, 芦娅妮, 等. Plackett-Burnman联合响应面法优化黑果枸杞黄酮提取工艺及抗氧化性研究[J/OL]. 食品工业科技: 1−12 [2021-07-07]. https://doi.org/10.13386/j.issn1002-0306.2021010239. WANG C L, WU Y, LU Y N, et al. Study on optimization of extraction process of flavonoids from Lycium ruthenicum Murr. by plackett-burnman with response surface methodology and its antioxidation activity[J/OL]. Science and Technology of Food Industry: 1−12 [2021-07-07]. https://doi.org/10.13386/j.issn1002-0306.2021010239.
[19] LEI J, ZHU L, ZHENG Y, et al. Homogenate-ultrasound-assisted ionic liquid extraction of total flavonoids from Selaginella involven: Process optimization, composition identification, and antioxidant activity[J]. ACS Omega,2021,6(22):14327−14340. doi: 10.1021/acsomega.1c01087
[20] 杨子敬, 饶桂维, 王磊. 超声波辅助双水相提取枇杷花总黄酮工艺优化及其抗氧化性[J/OL]. 食品工业科技: 1−15 [2021-07-07]. https://doi.org/10.13386/j.issn1002-0306.2021010186. YANG Z J, RAO G W, WANG L. Ultrasonic assisted aqueous two-phase extraction and antioxidant activity of total flavonoid from Loquat Flower[J/OL]. Science and Technology of Food Industry: 1−15 [2021-07-07]. https://doi.org/10.13386/j.issn1002-0306.2021010186.
[21] ZHONG L, LIU Y, XIONG B, et al. Dendranthema indicum optimization of ultrasound-assisted extraction of total flavonoids from var by response surface methodology[J]. J Anal Methods Chem,2019:1−10.
[22] 苏学军, 郑琳, 钱明月. 表面活性剂协同超声提取陈皮中总黄酮的工艺研究[J]. 中国调味品,2015,40(5):18−21. [SU X J, ZHENG L, QIAN M Y. Study on surfactant assisted ultrasonic extraction of total flavonoids from citrus[J]. China Condiment,2015,40(5):18−21. doi: 10.3969/j.issn.1000-9973.2015.05.005 [23] 薛山, 肖夏, 陈舒怡, 等. 双响应面法结合Matlab法优化葡萄籽多酚提取工艺及羟自由基清除率评价[J]. 食品工业科技,2020,41(3):160−167. [XUE S, XIAO X, CHEN S Y, et al. Dual response surface method combined with matlab to optimize extraction process of grape seed polyphenols and the evaluation on its hydroxyl radical scavenging rate[J]. Science and Technology of Food Industry,2020,41(3):160−167.





 下载:
下载:
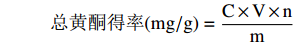



 下载:
下载:
