Research Progress of Edible Fungal Polysaccharides
-
摘要: 多糖是食用真菌最主要的活性成分之一,具有复杂的单糖组成以及结构的多样性,复杂的结构使其具有抗氧化、抗肿瘤、免疫调节等多种生物活性功能,常被应用于功能性食品中。近些年,食用真菌多糖的相关研究越来越受到重视,主要包括多糖的结构解析、提取工艺、传统发酵工艺、生物合成以及生物活性研究等。文中列举了几种常见食用真菌多糖的单糖组成、分子量以及糖苷键的连接方式,比较了传统和新型的提取方法的优缺点,随后,对摇瓶以及小型发酵罐发酵制备食用真菌多糖的现状进行了总结,最后归纳了多糖的生物合成机制及其研究现状。对这些研究进展进行整理、归纳和阐述,可以为接下来真菌多糖的研究以及产业化利用提供理论依据。Abstract: Polysaccharide is one of the most important active ingredients of edible fungi, which is composed of diverse monosaccharide. Polysaccharide has various biological activities such as antioxidant, antitumor and immune regulation. Therefore, it has been widely used as additive in functional foods. In recent years, more and more researches have been conducted on edible fungal polysaccharides, including the structure analysis, extraction process, conventional fermentation process, biosynthesis and biological activity. In this paper, the monosaccharide composition, molecular weight and glycosidic bond connection methods of several common edible fungal polysaccharides are reviewed, and the advantages and disadvantages of traditional and new extraction methods are discussed. Afterwards, the current status of edible fungal polysaccharides produced by fermentation in shake flasks and small bioreactor is summarized, and finally the biosynthetic mechanism of polysaccharides and its current research status are summarized. Sorting out, this review could provide a theoretical basis for the research and industrial utilization of fungal polysaccharides.
-
食用真菌是地球上分布广泛的食物资源,自古以来就备受人们关注,食用真菌一般都是高等真菌的子实体,味道鲜美,营养丰富,含有丰富的蛋白质、脂肪、糖、维生素等成分,具有优异的营养价值和药用价值,灵芝就是一种人们非常熟悉的食用真菌,备受人们的喜爱。近年来随着健康饮食理念的兴起,食用真菌中的一些生物活性成分越来越受到人们的重视。多糖是食用真菌最主要的活性成分之一,是由各种中性糖或糖醛酸通过糖苷键复杂聚合而成的碳水化合物长链。目前,多糖作为天然活性成分已被应用在化妆品行业以及食品行业。最新的研究表明,它们具有丰富的保健和治疗作用,如抗氧化、抗肿瘤、抗突变、抗HIV、抗炎、抗凝血、抗辐射、抗疲劳、抗增殖、降糖治疗、保肝、降压以及免疫调节等[1-3]。目前,研究人员已经对食用真菌如银耳、灵芝、猴头菇等进行了深入的研究,从多糖提取及发酵工艺研究到多糖生物合成研究,再到多糖生物活性研究都已经有了一定的基础,但是,过高的分子量使得多糖的黏度非常大,过高的黏度成为了多糖各种领域研究的一大难题,并且生产的难度大大提高了多糖的成本,使得多糖难以普遍得到应用。本文针对近年来有关食用真菌多糖的研究进行了整理、归纳,将从结构、提取、发酵、生物合成以及生物活性几个方面阐述其研究进展,并对其未来发展趋势进行展望,为接下来真菌多糖的研究以及产业化利用提供理论依据。
1. 多糖的结构特征
多糖根据单糖的组成可以分为两大类:同多糖和杂多糖。其中杂多糖除了具有不同类型的单糖单元外,还具有不同的糖苷键,导致了其结构的多样性。食用真菌多糖大多为杂多糖,由两个或多个不同单糖以不同组合组成主链,在单糖组成、分子量以及糖苷键的连接方式等方面都表现出多样性[4-7]。表1总结了几种常见食用真菌多糖的单糖组成、分子量以及糖苷键的连接方式。不同的食用真菌来源可以看出其单糖组成是有显著差别的,连接方式也具有很强的特异性,不同来源的同一种食用真菌在单糖组成和糖苷键上有一定的相同之处。
表 1 几种不同来源食用菌多糖的单糖组成、分子量及其糖苷键连接方式Table 1. Monosaccharide composition, molecular weight and glycosidic bond connection mode of several edible fungus polysaccharides from different sources多糖来源 单糖组成 分子量(Da) 糖苷键连接方式 参考文献 黑木耳 Glc:Man:Gal:GlcA=98.90:0.11:0.38:0.61
Glc:Man:Gal:Ara:Fuc:GlcA:GalA=
97.56:0.14:1.04:0.11:0.45:0.50:0.204.6×103
6.7×103(1→4)-α-D-glucan
(1→4)-α-D-glucan[8] 杏鲍菇 Man:Glc:Gal=23.02:49.21:27.77
Man:Glc:Gal=10.92:78.60:10.482.54×104
4.63×105(1→3)-Glcp/(1→6)-Manp/(1→2,6)-Galp
(1→3,6)-Glcp/(1→2)-Manp/(1→)-Galp
(1→3)-Glcp/(1→6)-Glcp/(1→)-Glcp
(1→3)-Manp/(1→2,3)-Manp/(1→2,6)-Manp
(1→6)-Galp[9] 银耳 Glc:Xyl:Man:Gal:Fuc=0.3:1.00:1.59:0.01:0.85 3.43×106 (1→3)-α-Manp/β-Xylp-/β-GlcAp- [10] 猴头菇 Fuc:Gal:Glc=5.2:23.9:1.0 1.5×104 α-(1→6)-Galp/O-2位置的α-L-Fucp [7] 灰树花 Man:Glc:Gal=3.30:23.30:1.00 4.1×106 (1 → 4)-α-D-Glcp/C-6位置的1,3,6-β-D-Manp和
1,4,6-α-D-Galp[11] 注:Glc:葡萄糖;Man:甘露糖;Gal:半乳糖;Xyl:木糖;Ara:阿拉伯糖;Fuc:岩藻糖;GlcA:葡萄糖醛酸;GalA:半乳糖醛酸。 食用真菌多糖的一级结构由单糖连接的顺序和摩尔比决定,对多糖的生物活性有着非常重要的影响[5]。目前几种常见的单糖组分包括葡萄糖、甘露糖、半乳糖、木糖、阿拉伯糖、鼠李糖和岩藻糖;不常见的单糖成分包括果糖、核糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰氨基葡萄糖和N-乙酰氨基半乳糖等。有人总结了过去几十年中灵芝多糖的单糖组成和摩尔比的研究结果。发现同一菌株的子实体、菌丝体或发酵液中多糖的单糖组成也有所不同[5]。
分子量是影响天然多糖化学特性和生物活性的关键参数[6]。一般来说,食用真菌多糖的分子量从几千到几百万不等。目前,多糖分子量的测定方法主要有渗透压分析、沉降分析、粘度测定、高效液相色谱法和高效凝胶渗透色谱法等。其中,高效液相色谱法是目前研究中测量多糖分子量应用最为广泛的技术,检测方法简单,检测时间短且检测结果准确。
多糖的糖苷键连接方式复杂多样,并且难以精确检测。甲基化分析是目前研究单糖残基间糖苷键的主要方法。Li等对从猴头菇中提取到的多糖进行了甲基化分析,推测猴头菇多糖的糖苷键为α-(1→6)-半乳糖苷键以及O-2位置的α-L-岩藻糖苷键[7]。
2. 多糖的提取工艺
以经济可持续和节能的方式从食用菌中回收生物活性多糖有很多障碍。传统的食用真菌多糖提取策略包括热水提取法和酸碱提取法,但是传统的提取方法都有很明显的缺点。因此,以食用真菌多糖提取为重点的创新技术和先进技术得到了迅速发展,如超声辅助提取法、微波辅助提取法、酶辅助提取法、亚临界水萃取法等[12-14]。目前已经应用的一些提取方法以及它们的优缺点如表2所示。
表 2 多糖的提取方法Table 2. Extraction methods of polysaccharides提取方法 优点 缺点 提取实例 热水提取法 运行成本低,设备要求简单,
方便人工操作,便于工业生产处理时间延长、能量需求过剩和操作温度高,
容易影响多糖的活性香菇多糖[15]
、灰树花多糖[16]酸碱提取法 比热水提取法提取产量更高 高工作温度以及处理时间过长,部分多糖会被酸碱水解,
导致分子量降低桑黄多糖[17]
、平菇多糖[18-20]超声辅助提取法 溶剂和能源的消耗相对较少、加工时间短 温度很难监测,结果重复性低,不利于工业生产 灰树花多糖[21]
、银耳多糖[22]微波辅助提取法 溶剂消耗低、加工时间短、提取率高 加热不均匀,工作体积小 香菇多糖[23]
、冬虫夏草多糖[24]酶辅助提取法 操作简单、特异性高、效率高、
能耗低、工作温度低较高的酶成本]以及规模化的条件难以控制,
不利于工业生产使用黑木耳多糖[25]
、灰树花多糖[26]亚临界水萃取法 同时提取、分离和解聚 改变结构,影响多糖的生物活性 香菇多糖[27]
、杏鲍菇多糖[28]2.1 热水提取法
热水提取法是最常用的传统提取工艺,一般是在高温(50~100 ℃)下用热水提取一定时间(1.5~5 h)。对于热水提取法,提高处理温度通常会提高多糖的提取效率[29-30]。然而,当温度高于最佳温度时,产率或纯度会随着温度的进一步升高而降低[31-32]。并且当温度高于150 ℃时,15 min后,三螺旋结构将不再存在[33]。提取时间是热水提取法的另一个重要因素,较长的提取时间通常对提取率有积极影响[29-30],但过长的时间也会导致多糖结构的破坏和生物活性的丧失。液固比在多糖的热水提取法中也起着重要作用,因为较高的液固比可能导致较低的粘度,这可以提高溶剂进入细胞的扩散率、多糖到溶剂的传质驱动力以及提取粗多糖的纯度[30]。然而,较高的液固比也意味着用于进一步加工的溶液体积较大,影响整体纯化和生产成本[29]。重复提取有时也用于提高提取率,有研究报告,在热水提取法中重复提取多达6次,可以达到最大提取率[34]。热水提取法具有运行成本低、设备要求简单的显著优势[2]。然而,这种提取技术存在一些缺点,如处理时间延长、能量需求过剩和操作温度高[2,35]。
2.2 酸碱提取法
在酸碱提取法中,碱(如NaOH或KOH)和酸(如HCl或草酸铵)可以用于促进多糖的提取[36]。酸碱提取法通常在热水提取法之后的连续提取步骤中进行,以最大限度地从食用菌中提取多糖,通过热水、1%(w/v)草酸铵和1.25 mol/L氢氧化钠/硼氢化钠溶液连续提取平菇多糖会有更高的产量[18]。与碱性多糖相比,酸性多糖的产量和碳水化合物含量最高,蛋白质杂质较少。酸和碱的处理会破坏细胞壁,降解粗纤维结构和细胞壁蛋白质与葡聚糖之间的可水解连接,从而释放细胞内多糖并提取酸和碱溶部分,将不溶于水的组分转化为水溶性组分。这也是酸碱提取法与热水提取法相比获得更高多糖产量的原因[17,37]。然而,除了可能的高工作温度外,酸碱提取法还有处理时间长的限制。
2.3 超声辅助提取法
超声辅助提取法是利用溶剂中声空化的形成和非对称微气泡的崩塌所产生的空化效应,这些气泡释放大量能量,产生微射流、冲击波和高剪切力。流体动力促进细胞壁破裂、不互溶相之间的传质、增强渗透和毛细管效应以及减小粒径,从而提高提取率和效率[38]。
超声辅助提取法中,在较低的蒸汽压(30~100 mmHg)和温度(30~50 ℃)下利用水,会由于气泡尺寸的增大而促进空化强度[39],产生的局部高温高压、冲击波、微射流、光辐射等物理效应,加快多糖的提取。除水外,还可以使用聚乙二醇(PEG)和NaOH溶液作为溶剂从真菌中提取多糖[22]。较低的频率(20~100 kHz)具有降低溶剂和能源消耗、高处理吞吐量和更短的处理时间等优点[39]。但是,超声辅助提取法过程中的温升难以监测,可能会导致结果重复性较低。此外,有报道称超声波处理导致多糖分子量(MW)下降高达70%[40]。
2.4 微波辅助提取法
在过去的二十年中,微波技术作为食品科学中的干燥和提取工具发挥了重要作用[41]。微波是一种非接触热源,通过溶剂和溶解离子之间的离子传导产生热能,进而破坏细胞壁,协助多糖分子的释放。高频交变电场(通常为2450 MHz)引起极性分子取向的改变,从而引起分子的振动和旋转,进而引起碰撞频率的增加、内压的增加和温度的突然升高,最终导致细胞破裂和溶剂通过细胞壁的扩散[42]。有研究[23]优化了微波辅助提取法提取多糖的操作条件,结果表明,最佳提取条件为:提取时间为24.65 min,微波功率为109.98 W,水与原料之比为21.62 mL/g。在优化条件下,多糖的产率和纯度分别为35.41%±0.62%和73.92%±0.83%。与热水提取法、超声辅助提取法相比,微波辅助提取法提取多糖的产率更高,加工时间更短[24]。微波辅助提取法具有灵活性强、溶剂消耗低、加工时间短、提取率高等优点[24]。然而,微波辅助提取法的主要缺点之一是加热不均匀[43],容易造成一些不必要的损失。
2.5 酶辅助提取法
真菌细胞壁基质的水解和降解可以被酶有效催化,释放出细胞内的生物活性化合物。纤维素酶是提取蘑菇多糖的常用酶,最佳操作温度为50 ℃,pH为4~5[44]。多酶水解(纤维素酶和其他酶,如木瓜蛋白酶、果胶酶、蛋白酶或胰蛋白酶)也已被采用,因为它们有助于打破纤维素、果胶、蛋白质和其他分子之间的物理化学联系,并有助于多糖的释放,从而提高提取率。采用热水提取法、超声辅助提取法和酶辅助提取法三种技术从黑木耳中提取多糖,在三种提取方法中,酶辅助提取法提取黑木耳多糖的得率(35.35±0.54 g/kg)显著高于热水提取法(29.55±0.36 g/kg)和超声辅助提取法(24.68±0.39 g/kg)[25]。有研究表明,与单酶提取和热水提取法相比,利用纤维素酶、果胶酶、胰酶比例2:2:1的组合酶从灰树花中提取的多糖会具有较低的分子量,并表现出更好的抗氧化活性[26]。酶辅助提取法具有操作简单、特异性高、环境友好、效率高、能耗低、工作温度低等优点[3]。然而,相对较高的酶成本是酶辅助提取法的主要缺点之一[41]。此外,酶辅助提取法的规模化是一个挑战,因为酶的活性会受到多种因素的影响,如温度和溶氧等。酶的种类、浓度、温度、pH、反应时间以及液固比对酶辅助提取法的提取率也有影响。
2.6 亚临界水萃取法
亚临界水萃取法(也称为水热萃取或热压缩水萃取)是一种萃取技术,在足够的压力(1~22.1 MPa)下,水在超过沸点(100~374 ℃)的温度下保持液态。因此,亚临界水与室温常压水相比表现出不同的性质。亚临界水萃取法对香菇多糖提取的研究表明,随着处理温度和时间的增加,葡萄糖含量会逐渐增加[27]。随着温度的升高,亚临界水的极性降低,非极性同时增加。因此,使用不同的处理温度可以提取不同极性的多糖。提取的多糖的分子量也随着处理温度的升高而逐渐增加,但由于热降解使得多糖的分子量在130 ℃的临界点上减少。同样,有研究利用亚临界水萃取法研究了温度对杏鲍菇多糖单糖和低聚糖含量的影响。低聚糖含量随着工作温度的升高而增加,在210 ℃时达到最大葡聚糖含量73%。其中,葡萄糖含量在150 ℃时达到最大值,而果糖、甘露糖和海藻糖在180 ℃时达到最大值[28]。
亚临界条件降低了水的介电常数和粘度,使其能够溶解极性、中等极性以及非极性化合物,包括分子量更高的多糖[15]。此外,亚临界水的电离常数随着温度的升高而显著增加,使其更像一种酸性溶液,在无需催化剂的情况下催化化学反应,如降解和水解聚合物键中的醚键和酯键[33,45]。因此,亚临界水萃取法提供了同时提取、多糖分离和解聚的益处[28]。然而,多糖的链构象和结构对超过临界点的压力和温度敏感,会影响多糖的生物活性[33]。
3. 多糖的发酵工艺
在人工栽培技术出现之前,各种食用菌可以从野外采集,但是由于气候因素影响较大,导致价格昂贵,而且产量有限。随着人工栽培和发酵技术的快速发展,许多此类自然资源已被工业扩展和利用,从而成为食品、医药和化妆品的重要来源[46]。目前有很多研究人员已经在发酵培养条件下得到了食用真菌多糖,并通过改变培养条件(培养基组成、pH、添加剂、激素、含氧量、搅拌、光照等)来提高产率,然而,目前报道的食用真菌多糖的发酵研究大多局限于少量的摇瓶及小型发酵罐的生产和提取,而大规模的发酵和分离研究较少,一方面是因为食用真菌的生长时间久,工厂发酵周期过长,还有一方面是因为食用真菌发酵温度大多在25~28 ℃,生长条件较苛刻。
Pokhrel等[47]在摇瓶培养条件下,研究了不同碳源、氮源、浓度、pH和发酵时间对食用真菌多糖产量的影响。其中葡萄糖(3%)是产多糖的最佳碳源,酵母抽提物(1%)是菌丝生长和发酵产多糖的最佳氮源,并且中性和弱碱性环境为最佳发酵条件。以蛹虫草为材料,在不同培养条件(温度、pH、培养基组成)下,对蛹虫草菌丝生长和多糖产量进行了研究,在蔗糖浓度为6%、多肽浓度为1%、磷酸二钾浓度为0.05%时,多糖的产量较高[48]。在桑黄发酵培养基中添加氯化钠后,菌丝生长的速率降低,但多糖的产生及其抗肿瘤活性明显增加[49]。从这些研究中我们可以看到,优化了发酵培养条件后,多糖的产量有了明显的提高。
对于食用真菌多糖的小型发酵罐发酵生产,有研究[50]比较了搅拌釜式反应器(STR)和气升式反应器(AR)在5 L体积多糖发酵生产中的作用,发现剪切应力显著影响胞外多糖的产生,颗粒致密性与胞外多糖含量呈正相关。气升式反应器虽能防止菌丝破裂,但由于混合不均,随着发酵时间的延长,其产量低于搅拌釜式反应器。麦芽糖(53.12 g/L)和多肽(4.21 g/L)的浓度为最佳的培养条件,培养5 d后可得到最大的生物量增长(10.81 g/L)和胞外多糖产量(1.86 g/L)。另一项使用灰树花菌丝体发酵的研究表明[51],补料发酵显著提高了菌丝体的生物量和胞外多糖的产量。在培养了13 d后,分批进料(将葡萄糖含量保持在10~15 g/L)的胞外多糖产量高于分批发酵。总的来说,发酵法制备多糖更方便,更快捷,在未来的医药和食品工业中具有非常好的应用前景。
4. 多糖的生物合成
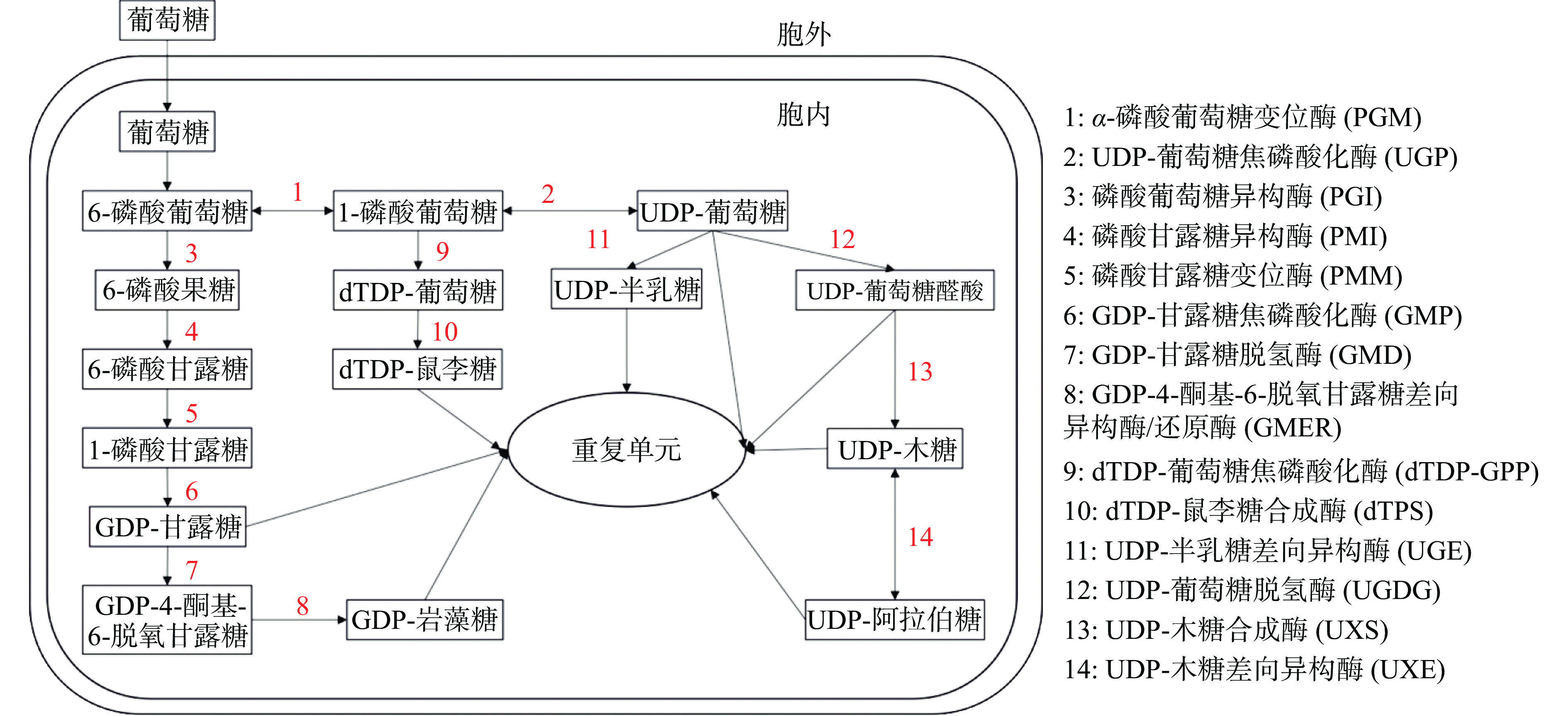
随着基因编辑技术的逐步成熟,人们可以利用该技术对某些物种的特定生物性状进行基因改造,生产难以人工合成的高纯度化合物。目前,食用真菌多糖主要从栽培或野生食用真菌中提取,也可从发酵培养基中提取,利用基因工程或代谢工程方法生产食用真菌多糖的研究还很有限,其主要原因是多糖的合成机制尚未完全获得破解。目前,普遍认为多糖的生物合成途径主要包括核苷酸糖前体的合成、重复单元的组装和聚合过程。但是,针对核苷酸糖前体到重复单元之间的糖基转移酶的研究十分有限,使得后续的合成过程还是未知的。因此,许多研究人员在研究合成相关酶的基础上构建了食用真菌多糖的核苷酸糖前体的简化生物合成途径。基因表达和RNAi介导的基因沉默等方法也被用于生物合成途径的研究。在图1中,根据先前的文献提出了可能的多糖生物合成途径,主要描述了以葡萄糖为碳源时食用真菌中多糖核苷酸糖前体的生物合成途径,以期为食用真菌多糖中代谢途径的分析提供基础。
表达α-磷酸葡萄糖变位酶(PGM)和UDP-葡萄糖焦磷酸化酶(UGP)的基因是增加胞外多糖产量的有效靶点。α-磷酸葡萄糖变位酶(PGM)是糖代谢的关键酶,催化6-磷酸葡萄糖和1-磷酸葡萄糖之间的可逆相互转化,6-磷酸葡萄糖进入糖酵解途径以产生能量,1-磷酸葡萄糖是多糖中糖核苷酸的前体[52],例如,UDP-葡萄糖、UDP-半乳糖、dTDP-鼠李糖。有人研究了PGM基因的过表达对多糖产生和转录水平的影响,发现PGM基因的过度表达导致多糖产量增加的同时还会上调下游编码多糖生物合成相关酶的基因,包括UDP-葡萄糖焦磷酸化酶(UGP)基因等,这很好的证明了PGM基因是多糖生物合成的重要调控基因[53]。UDP-葡萄糖焦磷酸化酶(UGP)催化1-磷酸葡萄糖和UDP-葡萄糖的可逆相互转化[54],是参与碳水化合物代谢和细胞壁生物合成的关键酶。Li等[54]从灵芝中克隆了UGP基因,并研究了UGP基因对多糖合成的影响。在液体培养中,UGP沉默菌株的多糖浓度远低于野生型菌株(30%~56%),可能是因为核苷酸糖前体的减少导致多糖产量的降低,这表明UGP在多糖生物合成中起着重要作用。磷酸葡萄糖异构酶(PGI)和磷酸甘露糖异构酶(PMI)也是多糖合成途径中的关键酶,通过改变不同的培养条件来改变PGI和PMI两种酶的酶活,会导致多糖的单糖组成和摩尔比发生变化[55],说明这两种酶会对多糖的合成产生一定的影响,是合成途径中比较关键的环节。
分子生物学技术对食用真菌的研究以及多糖的生产具有积极的作用,在食用真菌多糖生物合成的研究方面有着巨大的潜在应用。然而,利用分子生物学改造技术生产生物大分子的挑战仍然存在,包括菌株不稳定性、未知的副作用、随后的复杂下游过程、法律可接受性和更高的成本等,仍需要进一步探索。
5. 多糖的生物活性
大量研究表明,由于单糖组成、分子量以及结构构象等方面的不同,食用真菌多糖具有多种生物活性,如抗肿瘤、免疫调节、抗氧化、降血糖、抗炎症以及抗衰老等。越来越多的食用真菌多糖被用来对抗疾病,并且可以作为改善或缓解症状的膳食补充剂[56]。目前食用真菌多糖在不同的生物活性领域都有了一定的研究基础,并对其发挥生物活性进行了一定的机制解析。但由于实验材料的限制,大部分生物活性的研究都停留在细胞实验以及动物实验。
5.1 抗肿瘤活性
目前,癌症是无法解决的致命疾病之一,各种类型的恶性肿瘤因其高发病率和高死亡率而成为世界范围内的重大公共卫生挑战[57]。在前人工作研究的基础上,已知的食用真菌多糖发挥其抗肿瘤的主要途径有:a.口服或制剂预防和延缓癌症的发生;b.直接抑制各类癌细胞的生长;c.联合化疗对肿瘤的免疫刺激作用;d.对体内癌细胞转移或迁移的预防作用[58]。
食用真菌多糖可以通过诱导肿瘤细胞凋亡、细胞周期改变和抑癌基因表达发挥抗肿瘤作用。Zhang等[59]发现从灵芝中提取的多糖可以通过线粒体介导的凋亡途径发挥抗肿瘤活性。一方面,灵芝多糖通过降低线粒体膜电位,增加线粒体细胞色素c的释放。另一方面,灵芝多糖促进p53基因和Bax基因转录,下调Bcl-2基因表达并激活caspase酶家族来促进CT26肿瘤细胞凋亡。此外,Li等[60]的研究发现食用真菌多糖可导致细胞周期阻滞在S期或G0/G1期,并促进HepG2和HeLa癌细胞的凋亡。细胞周期阻滞的原因可能是多糖可以明显上调HepG2癌细胞中p27kip基因和p21cip基因的表达,而抑制细胞生长和发育所必需的cyclinD1/CDK4基因和cyclinE/CDK2基因的活性[61]。
5.2 免疫调节活性
免疫调节活性是天然多糖的关键生物活性之一。目前对食用真菌多糖免疫调节活性的研究主要集中在其对巨噬细胞功能(吞噬功能和细胞因子的产生)的影响[61]。香菇多糖可以通过诱导细胞因子的释放来实现免疫调节作用,同时,与钙离子形成复合物会增强这种免疫调节作用[62]。在一些体内实验中,多糖可促进巨噬细胞的吞噬、自然杀伤细胞的活化和脾细胞的增殖以及小鼠体内Th1细胞因子的水平增加[63]。一些研究进一步发现,多种天然免疫受体能与蘑菇多糖相互作用。有研究人员对不同来源的多糖与TLR4的关系进行了综述[64],发现TLR4是连接多糖和免疫靶细胞的关键细胞表面多糖受体。黑木耳的干燥子实体粉末中制备得到的水溶性黑木耳多糖可通过与这种重要的多糖受体TLR4结合,诱导巨噬细胞活化分泌促炎细胞因子,发挥免疫调节作用[65]。
5.3 抗氧化活性
细胞正常代谢过程中产生的活性氧(ROS)在各种信号传导途径中起着重要的作用。由于细胞应激和酶活性的受损,会导致ROS的过量产生进而引发各种疾病,如衰老、糖尿病、癌症等[66]。目前的研究表明,多糖的抗氧化活性主要是通过清除自由基以及促进抗氧化酶活性实现的。黑木耳多糖具有清除DPPH、超氧阴离子和羟自由基的体外抗氧化能力,且与分子量呈显著正相关[67]。富含β-葡聚糖的红菇粗多糖通过清除OH、DPPH、ABTS和超氧自由基显示出强大的螯合能力和还原能力以及抗氧化活性[68]。抗氧化酶通过催化自由基稳定形成,在防止氧化应激中发挥重要作用。蘑菇多糖已在各种体内外抗氧化活性模型中进行了测试,发现其可调节过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)、谷胱甘肽过氧化物酶(GSH)等[61]。从茶树菇菌丝体中分离的多糖可以增强抗氧化酶活性,也可以降低抗氧化酶活性MDA的产生,这是氧化损伤减轻的原因,从而在保护细胞免受ROS氧化应激中发挥了重要作用[69]。
5.4 降血糖活性
食用真菌多糖对糖尿病模型有一定的积极作用,主要通过防止β细胞氧化应激、再生胰岛细胞、增加葡萄糖消耗和糖原生物合成以及预防糖尿病相关的其他并发症来发挥抗糖尿病活性[70]。灵芝多糖可以通过调节Bcl-2和PDX-1的表达促进β细胞再生[71]。桑黄多糖可促进核分裂并刺激导管干细胞分化以再生胰岛细胞,从而保护受损组织[72]。猴头菇多糖通过降低血糖水平和增加胰岛素水平显示出优异的降血糖活性[73]。血糖水平升高,糖原生成降低,会导致高血糖状态。灵芝多糖可以激活AMPK并下调与糖原分解相关的酶水平来降低血糖,这些酶包括糖原磷酸化酶、果糖-1,6二磷酸酶、磷酸烯醇丙酮酸羧激酶等。此外,它还提高了葡萄糖转运蛋白4(GLUT4)的表达,以促进葡萄糖消耗[74]。从云芝中提取的一种多糖增加了血清中葡萄糖激酶和葡萄糖-6-磷酸酶的含量,降低了糖原合成酶激酶3β,从而增强了糖原生物合成[70]。
5.5 抗炎活性
炎症反应是临床比较常见的病理过程。细胞或组织损伤可能引发炎症反应,这是一种自我保护机制。然而,过度的炎症反应可能导致慢性炎症,这与多种疾病有关。食用真菌多糖具有潜在的抗炎活性。从香菇中提取的多糖在脂多糖诱导的肺损伤小鼠中试验,可减轻肺湿重/干重比率,减少炎症因子,并且可以通过增强肺酶活性(SOD、GSH-Px、CAT和T-AOC)和消除脂质过氧化反应(MDA和LPO)来达到抗氧化状态,显示出更高的抗氧化酶活性,表明其对肺保护的有益作用[75]。此外,猴头菌多糖被发现是对抗炎症性肠病的潜在营养素,猴头菇多糖在治疗C57BL/6小鼠结肠炎后,氧化应激降低,抗氧化酶活性增强,炎性因子、iNOS、COX的释放及转录水平降低。这些对肠损伤的保护作用通过NF-κB、p65和MAPK/Akt途径激活[76]。
5.6 抗衰老
食用真菌多糖可以通过调节新陈代谢和改善免疫系统来防止衰老。通过研究老年小鼠的肠道健康和尿液代谢组学,Xu等[77]发现,香菇中提取的一种多糖可以增强老年小鼠的免疫应答,并影响肠道微生物群的组成,逆转了年龄改变的肠道微生物群结构,如厚壁菌/类杆菌比率降低,缓解了小鼠的衰老。食用真菌多糖也可以通过提高机体免疫力来延缓衰老。灵芝多糖通过促进淋巴细胞增殖和IL-2的产生提高了老年小鼠的免疫功能,改善了小鼠衰老性氧化应激和免疫损伤[78]。食用真菌多糖还可以通过增加IL-6分泌,抑制脂褐素、糖基化终产物(一种与年龄相关的指标)和p53(可能是一种主要的衰老促进剂)的表达,显著减轻氧化应激诱导的衰老[79]。
食用真菌多糖现已广泛应用于美容领域,主要用于延缓皮肤衰老。氧化损伤和紫外线辐射的作用会降低皮肤胶原蛋白含量,加速皮肤老化、出现皱纹、降低弹性和黑色素沉积。黑木耳多糖由于其潜在的抗氧化活性而增加了羟脯氨酸含量(反映胶原蛋白含量),导致MDA的产生和皮肤脂褐素水平的降低(通常称为皮肤表面的老年斑,这是衰老的重要指标之一)[80]。
6. 总结与展望
在我国,食用真菌的历史相当悠久,到了近三四十年,人们对食品健康和营养的追求逐渐提升,同时随着研究手段逐渐成熟,人们开始对食用真菌中的活性成分进行了提取和研究。多糖是食用真菌中研究最为广泛的活性成分,来源广泛,且种类繁多,同时由于几千到几百万不等的分子量以及结构的复杂多样性使其具有多种良好的生物活性。在近几十年的研究中,许多食用真菌多糖的提取方法已经趋于成熟,传统的食用真菌多糖提取策略以及近些年发展起来的新兴策略都各有优缺点,但是如果将两种或两种以上方法结合,有望提高食用真菌多糖提取效率并减少成本。
为了进一步提高食用真菌多糖的产量,发酵是一种相对较好的策略,与从子实体中提取多糖相比较,发酵生产的周期短、产量高,且提取方便。将提取多糖的方法应用于发酵液有望得到更高产量的多糖。生物合成途径的研究是为了探索食用真菌多糖在分子领域的合成机制,但大多数工作都停留在糖基转移酶这一阶段,之后的合成过程还有待研究。很多研究者已经对食用真菌多糖的生物活性进行了研究,足以说明食用真菌多糖是一种很有价值且很有前景的生物活性成分。
目前对于食用真菌的很多研究都仅仅只是一个基础,除了银耳、灵芝等小部分研究较多,大部分食用真菌的研究都仅仅只是刚开始,但是食用真菌多糖有良好的生物活性,并且在食品和工业发展上具有重大的应用前景,值得进一步广泛研究。
-
表 1 几种不同来源食用菌多糖的单糖组成、分子量及其糖苷键连接方式
Table 1 Monosaccharide composition, molecular weight and glycosidic bond connection mode of several edible fungus polysaccharides from different sources
多糖来源 单糖组成 分子量(Da) 糖苷键连接方式 参考文献 黑木耳 Glc:Man:Gal:GlcA=98.90:0.11:0.38:0.61
Glc:Man:Gal:Ara:Fuc:GlcA:GalA=
97.56:0.14:1.04:0.11:0.45:0.50:0.204.6×103
6.7×103(1→4)-α-D-glucan
(1→4)-α-D-glucan[8] 杏鲍菇 Man:Glc:Gal=23.02:49.21:27.77
Man:Glc:Gal=10.92:78.60:10.482.54×104
4.63×105(1→3)-Glcp/(1→6)-Manp/(1→2,6)-Galp
(1→3,6)-Glcp/(1→2)-Manp/(1→)-Galp
(1→3)-Glcp/(1→6)-Glcp/(1→)-Glcp
(1→3)-Manp/(1→2,3)-Manp/(1→2,6)-Manp
(1→6)-Galp[9] 银耳 Glc:Xyl:Man:Gal:Fuc=0.3:1.00:1.59:0.01:0.85 3.43×106 (1→3)-α-Manp/β-Xylp-/β-GlcAp- [10] 猴头菇 Fuc:Gal:Glc=5.2:23.9:1.0 1.5×104 α-(1→6)-Galp/O-2位置的α-L-Fucp [7] 灰树花 Man:Glc:Gal=3.30:23.30:1.00 4.1×106 (1 → 4)-α-D-Glcp/C-6位置的1,3,6-β-D-Manp和
1,4,6-α-D-Galp[11] 注:Glc:葡萄糖;Man:甘露糖;Gal:半乳糖;Xyl:木糖;Ara:阿拉伯糖;Fuc:岩藻糖;GlcA:葡萄糖醛酸;GalA:半乳糖醛酸。 表 2 多糖的提取方法
Table 2 Extraction methods of polysaccharides
提取方法 优点 缺点 提取实例 热水提取法 运行成本低,设备要求简单,
方便人工操作,便于工业生产处理时间延长、能量需求过剩和操作温度高,
容易影响多糖的活性香菇多糖[15]
、灰树花多糖[16]酸碱提取法 比热水提取法提取产量更高 高工作温度以及处理时间过长,部分多糖会被酸碱水解,
导致分子量降低桑黄多糖[17]
、平菇多糖[18-20]超声辅助提取法 溶剂和能源的消耗相对较少、加工时间短 温度很难监测,结果重复性低,不利于工业生产 灰树花多糖[21]
、银耳多糖[22]微波辅助提取法 溶剂消耗低、加工时间短、提取率高 加热不均匀,工作体积小 香菇多糖[23]
、冬虫夏草多糖[24]酶辅助提取法 操作简单、特异性高、效率高、
能耗低、工作温度低较高的酶成本]以及规模化的条件难以控制,
不利于工业生产使用黑木耳多糖[25]
、灰树花多糖[26]亚临界水萃取法 同时提取、分离和解聚 改变结构,影响多糖的生物活性 香菇多糖[27]
、杏鲍菇多糖[28] -
[1] XIE J P, YUN H, DONG H G, et al. Simultaneous extraction, separation and purification of microbial genomic DNA and total RNA from acidic habitat samples[J]. Analytical Methods,2015,7(3):909−917. doi: 10.1039/C4AY01608D
[2] PARNIAKOV O, LEBOVKA N I, VAN HECKE E, et al. Pulsed electric field assisted pressure extraction and solvent extraction from mushroom (Agaricus bisporus)[J]. Food and Bioprocess Technology,2014,7(1):174−183. doi: 10.1007/s11947-013-1059-y
[3] ZHAO Y M, SONG J H, WANG J, et al. Optimization of cellulase‐assisted extraction process and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J]. Journal of the Science of Food and Agriculture,2016,96(13):4484−4491. doi: 10.1002/jsfa.7662
[4] RUTHES A C, SMIDERLE F R, IACOMINI M. Mushroom heteropolysaccharides: A review on their sources, structure and biological effects[J]. Carbohydrate Polymers,2016,136:358−375. doi: 10.1016/j.carbpol.2015.08.061
[5] WANG Q, WANG F, XU Z, et al. Bioactive mushroom polysaccharides: A review on monosaccharide composition, biosynthesis and regulation[J]. Molecules,2017,22(6):955. doi: 10.3390/molecules22060955
[6] TABARSA M, YOU S G, YELITHAO K, et al. Isolation, structural elucidation and immuno-stimulatory properties of polysaccharides from Cuminum cyminum[J]. Carbohydrate Polymers,2020,230:115636. doi: 10.1016/j.carbpol.2019.115636
[7] LI Q Z, WU D, ZHOU S, et al. Structure elucidation of a bioactive polysaccharide from fruiting bodies of Hericium erinaceus in different maturation stages[J]. Carbohydrate Polymers,2016,144:196−204. doi: 10.1016/j.carbpol.2016.02.051
[8] ZHANG Y, ZENG Y, MEN Y, et al. Structural characterization and immunomodulatory activity of exopolysaccharides from submerged culture of Auricularia auricula-judae[J]. International Journal of Biological Macromolecules,2018,115:978−984. doi: 10.1016/j.ijbiomac.2018.04.145
[9] 姜艳红, 张玲帆, 吕瑛, 等. 杏鲍菇多糖PEP-2的结构表征及其对肝癌细胞HepG-2抑制作用的研究[J]. 食品工业科技,2016,37(19):111−116. [JIANG Y H, ZHANG L F, LÜ Y, et al. Chemical characterization of Pleurotus eryngii polysaccharide PEP-2 and its tumor-inhibitory effects against human hepatoblastoma HepG-2 cell[J]. Science and Technology of Food Industry,2016,37(19):111−116. JIANG Y H, ZHANG L F, LÜ Y, et al. Chemical characterization of Pleurotus eryngii polysaccharide PEP-2 and its tumor-inhibitory effects against human hepatoblastoma HepG-2 cell[J]. Science and Technology of Food Industry, 2016, 37(19): 111-116.
[10] WEN L, GAO Q, MA C, et al. Effect of polysaccharides from Tremella fuciformis on UV-induced photoaging[J]. Journal of Functional Foods,2016,20:400−410. doi: 10.1016/j.jff.2015.11.014
[11] LI Q, WANG W, ZHU Y, et al. Structural elucidation and antioxidant activity a novel Se-polysaccharide from Se-enriched Grifola frondosa[J]. Carbohydrate Polymers,2017,161:42−52. doi: 10.1016/j.carbpol.2016.12.041
[12] BARBOSA J R, DOS SANTOS FREITAS M M, DA SILVA MARTINS L H, et al. Polysaccharides of mushroom Pleurotus spp. : New extraction techniques, biological activities and development of new technologies[J]. Carbohydrate Polymers,2020,229:115550. doi: 10.1016/j.carbpol.2019.115550
[13] RUTHES A C, SMIDERLE F R, IACOMINI M. D-glucans from edible mushrooms: A review on the extraction, purification and chemical characterization approaches[J]. Carbohydrate Polymers,2015,117:753−761. doi: 10.1016/j.carbpol.2014.10.051
[14] ZHANG M, CUI S W, CHEUNG P C K, et al. Antitumor polysaccharides from mushrooms: A review on their isolation process, structural characteristics and antitumor activity[J]. Trends in Food Science & Technology,2007,18(1):4−19.
[15] MORALES D, SMIDERLE F R, VILLALVA M, et al. Testing the effect of combining innovative extraction technologies on the biological activities of obtained β-glucan-enriched fractions from Lentinula edodes[J]. Journal of Functional Foods,2019,60:103446. doi: 10.1016/j.jff.2019.103446
[16] SU C H, LAI M N, NG L T. Effects of different extraction temperatures on the physicochemical properties of bioactive polysaccharides from Grifola frondosa[J]. Food Chemistry,2017,220:400−405. doi: 10.1016/j.foodchem.2016.09.181
[17] WANG Z B, PEI J J, MA H L, et al. Effect of extraction media on preliminary characterizations and antioxidant activities of Phellinus linteus polysaccharides[J]. Carbohydrate Polymers,2014,109:49−55. doi: 10.1016/j.carbpol.2014.03.057
[18] SERMWITTAYAWONG D, PATNINAN K, PHOTHIPHIPHIT S, et al. Purification, characterization, and biological activities of purified polysaccharides extracted from the Gray oyster mushroom [Pleurotus sajor-caju (Fr.) Sing.][J]. Journal of Food Biochemistry,2018,42(5):e12606. doi: 10.1111/jfbc.12606
[19] BAEVA E, BLEHA R, LAVROVA E, et al. Polysaccharides from basidiocarps of cultivating mushroom Pleurotus ostreatus: Isolation and structural characterization[J]. Molecules,2019,24(15):2740. doi: 10.3390/molecules24152740
[20] SZWENGIEL A, STACHOWIAK B. Deproteinization of water-soluble ß-glucan during acid extraction from fruiting bodies of Pleurotus ostreatus mushrooms[J]. Carbohydrate Polymers,2016,146:310−319. doi: 10.1016/j.carbpol.2016.03.015
[21] CHEN X Y, JI H Y, XU X M, et al. Optimization of polysaccharide extraction process from Grifola frondosa and its antioxidant and anti-tumor research[J]. Journal of Food Measurement and Characterization,2019,13(1):144−153. doi: 10.1007/s11694-018-9927-9
[22] ZHANG L, WANG M. Polyethylene glycol-based ultrasound-assisted extraction and ultrafiltration separation of polysaccharides from Tremella fuciformis (snow fungus)[J]. Food and Bioproducts Processing,2016,100:464−468. doi: 10.1016/j.fbp.2016.09.007
[23] GIL-RAMÍREZ A, SMIDERLE F R, MORALES D, et al. Strengths and weaknesses of the aniline-blue method used to test mushroom (1→ 3)-β-d-glucans obtained by microwave-assisted extractions[J]. Carbohydrate Polymers,2019,217:135−143. doi: 10.1016/j.carbpol.2019.04.051
[24] WANG N, ZHANG Y, WANG X, et al. Antioxidant property of water-soluble polysaccharides from Poria cocos Wolf using different extraction methods[J]. International Journal of Biological Macromolecules,2016,83:103−110. doi: 10.1016/j.ijbiomac.2015.11.032
[25] LI L, YANG X, PAN L, et al. Comparing three methods of extraction of Auricularia auricula polysaccharides[J]. Current Topics in Nutraceutical Research,2019,17(1):7−11.
[26] FAN Y N, WU X Y, ZHANG M, et al. Physical characteristics and antioxidant effect of polysaccharides extracted by boiling water and enzymolysis from Grifola frondosa[J]. International Journal of Biological Macromolecules,2011,48(5):798−803. doi: 10.1016/j.ijbiomac.2011.03.013
[27] HUAMÁN-LEANDRO L R, GONZÁLEZ-MUÑOZ M J, FERNÁNDEZ-DE-ANA C, et al. Autohydrolysis of Lentinus edodes for obtaining extracts with antiradical properties[J]. Foods,2020,9(1):74. doi: 10.3390/foods9010074
[28] RODRÍGUEZ-SEOANE P, DÍAZ-REINOSO B, GONZÁLEZ-MUÑOZ M J, et al. Innovative technologies for the extraction of saccharidic and phenolic fractions from Pleurotus eryngii[J]. LWT-Food Science and Technology,2019,101:774−782. doi: 10.1016/j.lwt.2018.11.062
[29] WANG Y F, JIA J X, REN X J, et al. Extraction, preliminary characterization and in vitro antioxidant activity of polysaccharides from Oudemansiella radicata mushroom[J]. International Journal of Biological Macromolecules,2018,120:1760−1769. doi: 10.1016/j.ijbiomac.2018.09.209
[30] WU Z W, ZHANG M X, XIE M H, et al. Extraction, characterization and antioxidant activity of mycelial polysaccharides from Paecilomyces hepiali HN1[J]. Carbohydrate Polymers,2016,137:541−548. doi: 10.1016/j.carbpol.2015.11.010
[31] GUO X, ZOU X, SUN M. Optimization of extraction process by response surface methodology and preliminary characterization of polysaccharides from Phellinus igniarius[J]. Carbohydrate Polymers,2010,80(2):344−349. doi: 10.1016/j.carbpol.2009.11.028
[32] LIU Y, ZHOU Y, LIU M, et al. Extraction optimization, characterization, antioxidant and immunomodulatory activities of a novel polysaccharide from the wild mushroom Paxillus involutus[J]. International Journal of Biological Macromolecules,2018,112:326−332. doi: 10.1016/j.ijbiomac.2018.01.132
[33] ZHANG J X, WEN C T, GU J Y, et al. Effects of subcritical water extraction microenvironment on the structure and biological activities of polysaccharides from Lentinus edodes[J]. International Journal of Biological Macromolecules,2019,123:1002−1011. doi: 10.1016/j.ijbiomac.2018.11.194
[34] ZHU M, NIE P, LIANG Y K, et al. Optimizing conditions of polysaccharide extraction from Shiitake mushroom using response surface methodology and its regulating lipid metabolism[J]. Carbohydrate Polymers,2013,95(2):644−648. doi: 10.1016/j.carbpol.2013.03.035
[35] XUE D N, FARID M M. Pulsed electric field extraction of valuable compounds from white button mushroom (Agaricus bisporus)[J]. Innovative Food Science & Emerging Technologies,2015,29:178−186.
[36] YI Y, XU W, WANG H X, et al. Natural polysaccharides experience physiochemical and functional changes during preparation: A review[J]. Carbohydrate Polymers,2020,234:115896. doi: 10.1016/j.carbpol.2020.115896
[37] KLAUS A, KOZARSKI M, NIKSIC M, et al. Antioxidative activities and chemical characterization of polysaccharides extracted from the basidiomycete Schizophyllum commune[J]. LWT-Food Science and Technology,2011,44(10):2005−2011. doi: 10.1016/j.lwt.2011.05.010
[38] KE L Q. Optimization of ultrasonic extraction of polysaccharides from Lentinus edodes based on enzymatic treatment[J]. Journal of Food Processing and Preservation,2015,39(3):254−259. doi: 10.1111/jfpp.12228
[39] ALZORQI I, SUDHEER S, LU T J, et al. Ultrasonically extracted β-d-glucan from artificially cultivated mushroom, characteristic properties and antioxidant activity[J]. Ultrasonics Sonochemistry,2017,35:531−540. doi: 10.1016/j.ultsonch.2016.04.017
[40] LI X Y, WANG L. Effect of extraction method on structure and antioxidant activity of Hohenbuehelia serotina polysaccharides[J]. International Journal of Biological Macromolecules,2016,83:270−276. doi: 10.1016/j.ijbiomac.2015.11.060
[41] MARIĆ M, GRASSINO A N, ZHU Z, et al. An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products: Ultrasound-, microwaves-, and enzyme-assisted extraction[J]. Trends in Food Science & Technology,2018,76:28−37.
[42] XU N, SUN Y H, GUO X L, et al. Optimization of ultrasonic-microwave synergistic extraction of polysaccharides from Morchella conica[J]. Journal of Food Processing and Preservation,2018,42(2):e13423. doi: 10.1111/jfpp.13423
[43] YOU Q H, YIN X L, ZHANG S N, et al. Extraction, purification, and antioxidant activities of polysaccharides from Tricholoma mongolicum Imai[J]. Carbohydrate Polymers,2014,99:1−10. doi: 10.1016/j.carbpol.2013.07.088
[44] YU G, YUE C, ZANG X, et al. Purification, characterization and in vitro bile salt-binding capacity of polysaccharides from Armillaria mellea mushroom[J]. Czech Journal of Food Sciences,2019,37(1):51−56. doi: 10.17221/182/2018-CJFS
[45] YUAN Y, LIU Y, LIU M D, et al. Optimization extraction and bioactivities of polysaccharide from wild Russula griseocarnosa[J]. Saudi Pharmaceutical Journal,2017,25(4):523−530. doi: 10.1016/j.jsps.2017.04.018
[46] BISHOP K S, KAO C H J, XU Y, et al. From 2000 years of Ganoderma lucidum to recent developments in nutraceuticals[J]. Phytochemistry,2015,114:56−65. doi: 10.1016/j.phytochem.2015.02.015
[47] POKHREL C P, OHGA S. Submerged culture conditions for mycelial yield and polysaccharides production by Lyophyllum decastes[J]. Food Chemistry,2007,105(2):641−646. doi: 10.1016/j.foodchem.2007.04.033
[48] KIM S W, HWANG H J, XU C P, et al. Optimization of submerged culture process for the production of mycelial biomass and exo-polysaccharides by Cordyceps militaris C738[J]. Journal of Applied Microbiology,2003,94(1):120−126. doi: 10.1046/j.1365-2672.2003.01754.x
[49] SHU C H, HSU H J. Effects of sodium chloride on the production of bioactive exopolysaccharides in submerged cultures of Phellinus linteus[J]. Journal of Chemical Technology & Biotechnology: International Research in Process, Environmental & Clean Technology,2008,83(5):618−624.
[50] XU C, GENG L, ZHANG W. Production of extracellular polysaccharides by the medicinal mushroom Trametes trogii (higher basidiomycetes) in stirred-tank and airlift reactors[J]. International Journal of Medicinal Mushrooms,2013,15(2):183−189. doi: 10.1615/IntJMedMushr.v15.i2.70
[51] SHIH I L, CHOU B W, CHEN C C, et al. Study of mycelial growth and bioactive polysaccharide production in batch and fed-batch culture of Grifola frondosa[J]. Bioresource Technology,2008,99(4):785−793. doi: 10.1016/j.biortech.2007.01.030
[52] PENG L, LI J, LIU Y, et al. Effects of mixed carbon sources on galactose and mannose content of exopolysaccharides and related enzyme activities in Ganoderma lucidum[J]. Rsc Advances,2016,6(45):39284−39291. doi: 10.1039/C6RA04798J
[53] XU J W, JI S L, LI H J, et al. Increased polysaccharide production and biosynthetic gene expressions in a submerged culture of Ganoderma lucidum by the overexpression of the homologous α-phosphoglucomutase gene[J]. Bioprocess and Biosystems Engineering,2015,38(2):399−405. doi: 10.1007/s00449-014-1279-1
[54] LI M, CHEN T, GAO T, et al. UDP-glucose pyrophosphorylase influences polysaccharide synthesis, cell wall components, and hyphal branching in Ganoderma lucidum via regulation of the balance between glucose-1-phosphate and UDP-glucose[J]. Fungal Genetics and Biology,2015,82:251−263. doi: 10.1016/j.fgb.2015.07.012
[55] PENG L, QIAO S, XU Z, et al. Effects of culture conditions on monosaccharide composition of Ganoderma lucidum exopolysaccharide and on activities of related enzymes[J]. Carbohydrate Polymers,2015,133:104−109. doi: 10.1016/j.carbpol.2015.07.014
[56] GONG P, WANG S, LIU M, et al. Extraction methods, chemical characterizations and biological activities of mushroom polysaccharides: A mini-review[J]. Carbohydrate Research,2020,494:108037. doi: 10.1016/j.carres.2020.108037
[57] FOGLI S, PORTA C, DEL RE M, et al. Optimizing treatment of renal cell carcinoma with VEGFR-TKIs: A comparison of clinical pharmacology and drug-drug interactions of anti-angiogenic drugs[J]. Cancer Treatment Reviews,2020,84:101966. doi: 10.1016/j.ctrv.2020.101966
[58] ZHANG Y, LI S, WANG X, et al. Advances in lentinan: Isolation, structure, chain conformation and bioactivities[J]. Food Hydrocolloids,2011,25(2):196−206. doi: 10.1016/j.foodhyd.2010.02.001
[59] ZHANG S, NIE S, HUANG D, et al. A novel polysaccharide from Ganoderma atrum exerts antitumor activity by activating mitochondria-mediated apoptotic pathway and boosting the immune system[J]. Journal of Agricultural and Food Chemistry,2014,62(7):1581−1589. doi: 10.1021/jf4053012
[60] LI S, GAO A, DONG S, et al. Purification, antitumor and immunomodulatory activity of polysaccharides from soybean residue fermented with Morchella esculenta[J]. International Journal of Biological Macromolecules,2017,96:26−34. doi: 10.1016/j.ijbiomac.2016.12.007
[61] YANG M Y, BELWAL T, DEVKOTA H P, et al. Trends of utilizing mushroom polysaccharides (MPs) as potent nutraceutical components in food and medicine: A comprehensive review[J]. Trends in Food Science & Technology,2019,92:94−110.
[62] CUI Y, YAN H, ZHANG X. Preparation of Lentinula edodes polysaccharide-calcium complex and its immunoactivity[J]. Bioscience, Biotechnology, and Biochemistry,2015,79(10):1619−1623. doi: 10.1080/09168451.2015.1044930
[63] MALLICK S K, MAITI S, BHUTIA S K, et al. Immunostimulatory properties of a polysaccharide isolated from Astraeus hygrometricus[J]. Journal of Medicinal Food,2010,13(3):665−672. doi: 10.1089/jmf.2009.1300
[64] ZHANG X, QI C, GUO Y, et al. Toll-like receptor 4-related immunostimulatory polysaccharides: Primary structure, activity relationships, and possible interaction models[J]. Carbohydrate Polymers,2016,149:186−206. doi: 10.1016/j.carbpol.2016.04.097
[65] PERERA N, YANG F L, CHERN J, et al. Carboxylic and O-acetyl moieties are essential for the immunostimulatory activity of glucuronoxylomannan: A novel TLR4 specific immunostimulator from Auricularia auricula-judae[J]. Chemical Communications,2018,54(51):6995−6998. doi: 10.1039/C7CC09927D
[66] KOZARSKI M, KLAUS A, JAKOVLJEVIC D, et al. Antioxidants of edible mushrooms[J]. Molecules,2015,20(10):19489−19525. doi: 10.3390/molecules201019489
[67] SU Y, LI L. Structural characterization and antioxidant activity of polysaccharide from four auriculariales[J]. Carbohydrate Polymers,2020,229:115407. doi: 10.1016/j.carbpol.2019.115407
[68] KHATUA S, ACHARYA K. Alkaline extractive crude polysaccharide from Russula senecis possesses antioxidant potential and stimulates innate immunity response[J]. Journal of Pharmacy and Pharmacology,2017,69(12):1817−1828. doi: 10.1111/jphp.12813
[69] JING H, LI J, ZHANG J, et al. The antioxidative and anti-aging effects of acidic-and alkalic-extractable mycelium polysaccharides by Agrocybe aegerita (Brig.) Sing[J]. International Journal of Biological Macromolecules,2018,106:1270−1278. doi: 10.1016/j.ijbiomac.2017.08.138
[70] TENG J F, LEE C H, HSU T H, et al. Potential activities and mechanisms of extracellular polysaccharopeptides from fermented Trametes versicolor on regulating glucose homeostasis in insulin-resistant HepG2 cells[J]. PloS One,2018,13(7):e0201131. doi: 10.1371/journal.pone.0201131
[71] MA H T, HSIEH J F, CHEN S T. Anti-diabetic effects of Ganoderma lucidum[J]. Phytochemistry,2015,114:109−113. doi: 10.1016/j.phytochem.2015.02.017
[72] YAMAÇ M, ZEYTINOGLU M, SENTURK H, et al. Effects of black hoof medicinal mushroom, Phellinus linteus (Agaricomycetes), polysaccharide extract in streptozotocin-induced diabetic rats[J]. International Journal of Medicinal Mushrooms,2016,18(4):301−311. doi: 10.1615/IntJMedMushrooms.v18.i4.30
[73] ZHANG C, LI J, HU C, et al. Antihyperglycaemic and organic protective effects on pancreas, liver and kidney by polysaccharides from Hericium erinaceus SG-02 in streptozotocin-induced diabetic mice[J]. Scientific Reports,2017,7(1):1−13. doi: 10.1038/s41598-016-0028-x
[74] XIAO C, WU Q, ZHANG J, et al. Antidiabetic activity of Ganoderma lucidum polysaccharides F31 down-regulated hepatic glucose regulatory enzymes in diabetic mice[J]. Journal of Ethnopharmacology,2017,196:47−57. doi: 10.1016/j.jep.2016.11.044
[75] REN Z, LI J, SONG X, et al. The regulation of inflammation and oxidative status against lung injury of residue polysaccharides by Lentinula edodes[J]. International Journal of Biological Macromolecules,2018,106:185−192. doi: 10.1016/j.ijbiomac.2017.08.008
[76] REN Y, GENG Y, DU Y, et al. Polysaccharide of Hericium erinaceus attenuates colitis in C57BL/6 mice via regulation of oxidative stress, inflammation-related signaling pathways and modulating the composition of the gut microbiota[J]. The Journal of Nutritional Biochemistry,2018,57:67−76. doi: 10.1016/j.jnutbio.2018.03.005
[77] XU X, YANG J, NING Z, et al. Lentinula edodes-derived polysaccharide rejuvenates mice in terms of immune responses and gut microbiota[J]. Food & Function,2015,6(8):2653−2663.
[78] LI W J, NIE S P, PENG X P, et al. Ganoderma atrum polysaccharide improves age-related oxidative stress and immune impairment in mice[J]. Journal of Agricultural and Food Chemistry,2012,60(6):1413−1418. doi: 10.1021/jf204748a
[79] PAN W J, DING Q Y, WANG Y, et al. A bioactive polysaccharide TLH-3 isolated from Tricholoma lobayense protects against oxidative stress-induced premature senescence in cells and mice[J]. Journal of Functional Foods,2018,42:159−170. doi: 10.1016/j.jff.2017.12.070
[80] PENG X B, LI Q, OU L N, et al. GC-MS, FT-IR analysis of black fungus polysaccharides and its inhibition against skin aging in mice[J]. International Journal of Biological Macromolecules,2010,47(2):304−307. doi: 10.1016/j.ijbiomac.2010.03.018





 下载:
下载:
 下载:
下载:
