Optimize the Ultrasonic-assisted Extraction Process for Total Triterpenoids from Lavandula angustifolia and Its Antioxidant Activity in Vitro
-
摘要: 为增加薰衣草残渣的利用价值,优化薰衣草中总三萜提取工艺并测定其体外抗氧化活性。以薰衣草中总三萜的提取量为评价指标,采用单因素实验和响应面法优化薰衣草总三萜超声辅助提取工艺,得到最优工艺为料液比为1:33 (g/mL),乙醇浓度为89%,超声时间为60 min,超声功率为70% (445 W),理论提取量为39.64 mg/g,在该条件,平行验证三次,实际提取量为(39.95±0.32)mg/g与预测值相近。并对薰衣草总三萜进行体外抗氧化活性测定,以VC作为对照,分别对薰衣草总三萜的DPPH自由基清除率、OH自由基清除率和O2−自由基清除率进行测定,其清除率分别为86.83%、42.06%、47.93%。通过超声辅助提取工艺条件优化,薰衣草中总三萜提取量明显提高,并具有较强的抗氧化能力,为薰衣草残渣的再利用提供理论前提,以进一步挖掘利用空间。Abstract: In order to increase the utilization value of Lavandula angustifolia (LA) residue and provide a theoretical basis for the development and utilization of LA waste, the extraction process of total triterpenoids from LA was optimized and its antioxidant activity was determined in vitro. Taking the yield of total triterpenes in LA as the evaluation index, the single factor experiments and the response surface methodology were used to optimize the extraction process of ultrasonic-assisted extraction of total triterpenes from LA. The results showed that the optimum extraction conditions were ethanol concentration 89%, ratio of material to liquid 1:33 (g/mL), extraction time 60 min, and ultrasonic power 70% (445 W). The theoretical extraction volume was 39.64 mg/g, and the actual one was (39.95±0.32) mg/g under this optimum condition, which was close to the predicted value. Afterwards, using VC as a control, DPPH free radical, OH free radical, and O2− free radical scavenging experiments were subjected to measure the anti-oxidant activity of total triterpenes, and their scavenging rates were 86.83%, 42.06% and 47.93%, respectively. After the optimization of the ultrasonic-assisted extraction process conditions, the total triterpenes extracted from LA is significantly increased, and the extract has strong antioxidant activity, which provides a theoretical basis for the reuse of LA waste to further tap the potential value.
-
Keywords:
- Lavandula angustifolia /
- total triterpenes /
- response surface /
- antioxidant
-
薰衣草是一种生长在高温低湿地区的香草植物,我国主要产区在新疆伊犁并作为当地的支柱经济产业之一,具有一定的市场规模[1]。薰衣草具有很高的利用价值,多加工生产成精油。精油是由不同类型的芳香族化合物组成的混合物[2],因薰衣草精油具有镇静催眠[3]、抗菌[3]、抗氧化[4]等药理活性,加之提取技术相对成熟,价格适宜,因此被开发成诸多深受人们喜爱的薰衣草精油产品。薰衣草残渣多作为废料处理[5],其非挥发性化学成分的价值不能得到充分发挥。薰衣草主要研究方向为栽培培育[6]、精油成分 [7]和生物活性评价[8],而其残渣的化学成分鉴定及生物活性研究相对较少,目前国内外对薰衣草非挥发性部位分离得到了三萜类[9]、黄酮类[10]、苯丙素类[11]、酚类[12]、肉桂酸类[13]、咖啡酸类[14]等化合物,其中三萜类是一种在植物中广泛分布的化合物类别,具有较好的抗氧化活性[15]。
植物中非挥发性物质的传统提取方法有浸提法、回流提取法[16]、索氏提取法[17]、超声波提取法[18]、微波提取法[19]、超临界萃取法[20]、常温超高压提取法[21]、亚临界水萃取法[22]、双水相萃取法[23]、沉淀吸附法[24]等。在实验室中常用的提取方法有回流法、超声辅助法、索氏提取法和微波辅助提取等提取方法。在这些方法中,回流提取法、浸提法和索氏提取法相对耗时较长、效率低,微波提取法相对温度变化较快,会对产物生物活性产生一定影响,而其他方法如超临界流体萃取和超高压提取法等方法对设备要求较高、成本相对较高,而超声辅助提取法具有用时短、提取效率高等优点。
因此本文采用超声辅助提取法,研究乙醇浓度、料液比、超声功率和提取时间4个因素对总三萜提取的影响。以薰衣草精油提取后的残渣中总三萜的提取量作为指标,采用响应面法优化超声辅助提取工艺,以期得到最优提取总三萜的工艺条件,并对总三萜提取物进行DPPH自由基、OH自由基、O2−自由基清除率测定,为薰衣草植物资源合理开发利用提供参考依据。
1. 材料与方法
1.1 材料与仪器
法国兰薰衣草 新疆伊犁河谷生物科技有限公司;熊果酸 标准品(纯度 98%),成都普菲德生物技术有限公司;超纯水 实验室自制;无水乙醇、95%乙醇、冰乙酸、氢氧化钠 天津致远化学试剂有限公司;高氯酸 天津市鑫铂特化工有限公司;硫酸亚铁 天津永晟精细化工有限公司;邻二氮菲 天津市福晨化学试剂厂;邻苯三酚、香草醛、DPPH、H2O2、Tris-HCI、Sigma 天津市北联精细化学品开发有限公司;以上分析用试剂均为分析纯。
UV-1200型紫外可见分光光度计 上海美谱达仪器有限公司;FW135型高速多功能粉碎机 北京市永光明医疗仪器有限公司;RE-52AA旋转蒸发器、HH-S数显恒温水浴锅 上海亚荣生化仪器厂;KQ2200B超声清洗机(总功率650 W) 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 薰衣草残渣总三萜测定方法
1.2.1.1 配制标准溶液
精密称取20.00 mg熊果酸标准品,在避光条件下以无水乙醇定容至50 mL容量瓶中,得到质量浓度为400 μg/mL的熊果酸标准溶液。准确吸取2.5 mL熊果酸标准溶液,置于10 mL容量瓶中,无水乙醇定容,即得100 μg/mL质量浓度熊果酸标准溶液[6]。
1.2.1.2 绘制标准曲线
准确吸取100 μg/mL质量浓度熊果酸标准溶液0.00、0.20、0.40、0.60、0.80、1.00 mL分别置于提前标记过的试管(0、1、2、3、4、5)中,85 ℃水浴锅挥干溶剂,加入0.3 mL 5%香草醛-冰乙酸溶液,摇匀;加入1.0 mL高氯酸,摇匀;60 ℃水浴温育15 min,后置于冰水冷却至室温;加入5.0 mL冰乙酸摇匀,放置15 min显色;以空白试剂(0号试管)为参比,通过测定546 nm波长处吸光度通过绘制标准曲线[7]。以熊果酸标准品含量(µg/mL)为横坐标,吸光度为纵坐标,绘制熊果酸标准曲线[6]并得到回归方程为:y=0.057x+0.003,决定系数R2为0.9994。
1.2.1.3 薰衣草残渣总三萜的提取及含量测定
薰衣草提取三次精油后的残渣称取500 g于粉碎机粉碎后,过40目筛得到粗粉备用。精密称取粗粉1.0 g,置于100 mL锥形瓶中,加一定体积一定浓度的乙醇,在一定功率和时间下超声辅助提取,重复三次,滤液合并后浓缩,用无水乙醇定容至50 mL,摇匀,精密吸取2.5 mL提取液置于10 mL容量瓶中定容至刻度线,进行测定,并按照下述公式计算总三萜提取量[6]。
总三萜提取量(mg/g)=mM=C×D×V1000×B×M 式中:C为线性方程计算出样品的质量浓度,μg/mL;D为测定时定容的体积,mL;V为提取液定容体积,mL;B为吸取测定体积,mL;M为称取的样品质量,g;m为样品中总三萜质量,mg。
1.2.2 单因素实验
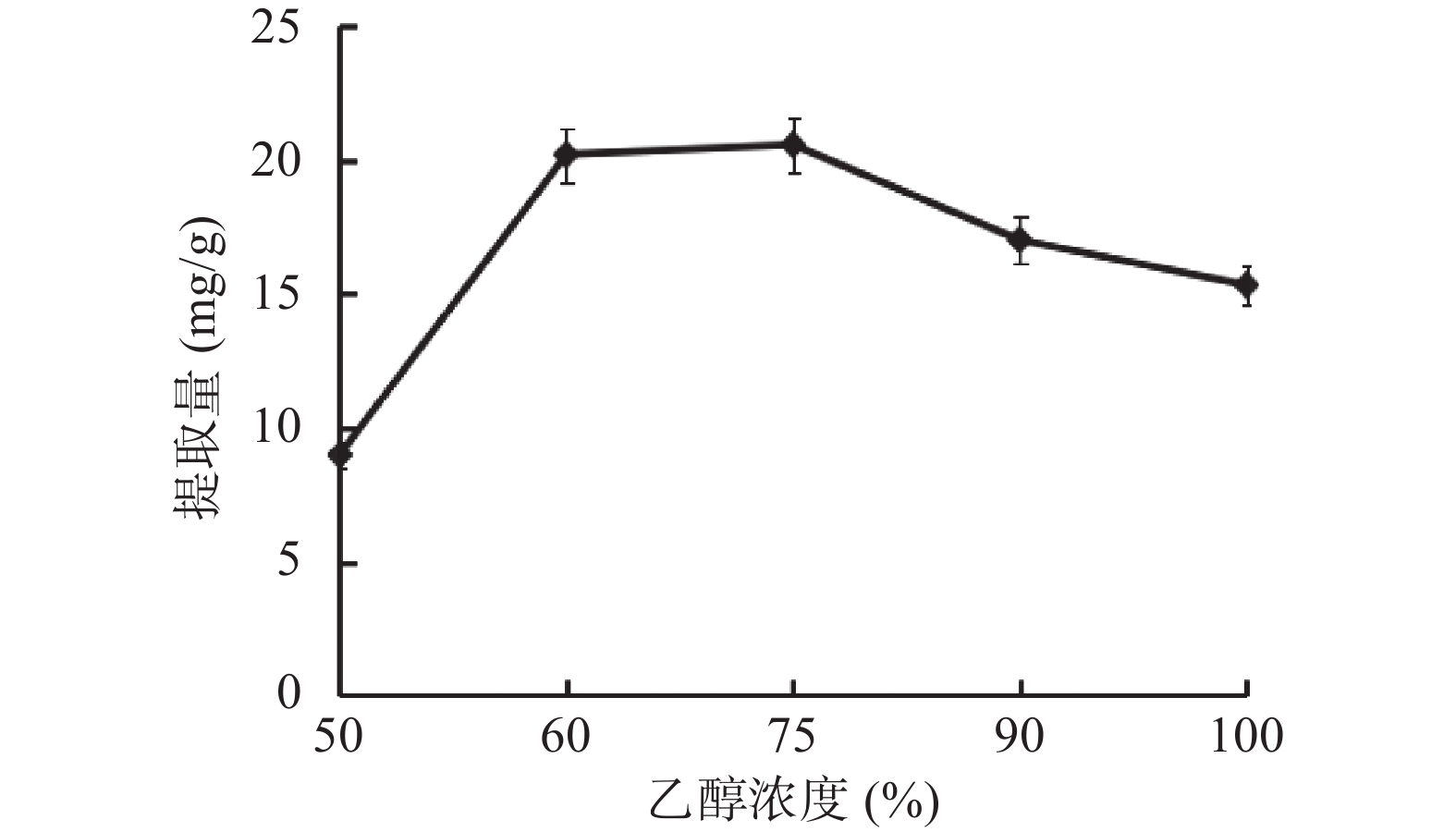
1.2.2.1 乙醇浓度对总三萜提取量的影响
乙醇浓度分别为50%、60%、75%、90%、100%时,在料液比1:20(g/mL)、超声功率260 W、超声时间45 min的条件下,测得其总三萜提取量。
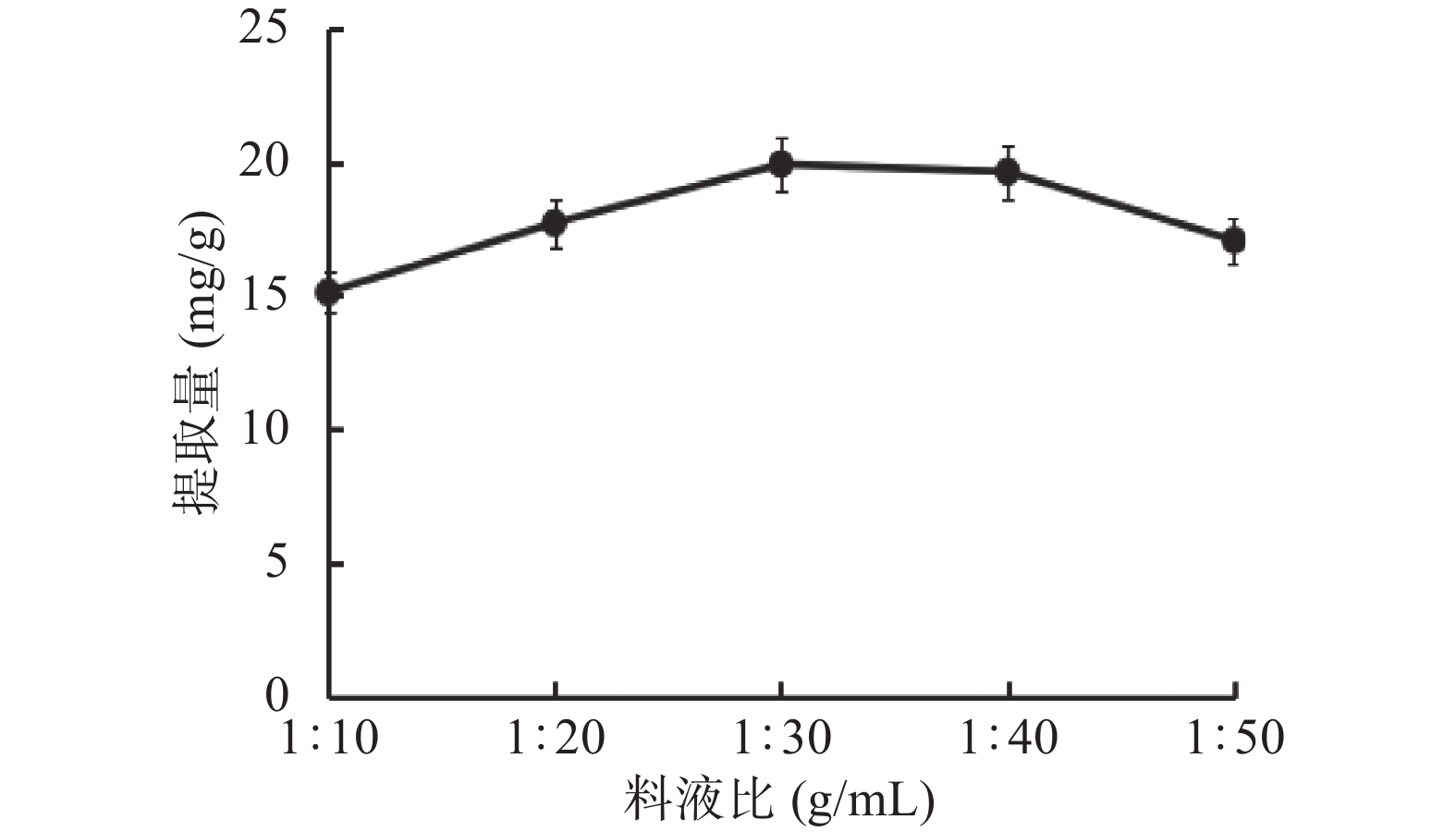
1.2.2.2 料液比对总三萜提取量的影响
料液比分别为1:10、1:20、1:30、1:40、1:50 g/mL时,在无水乙醇、超声功率260 W、超声时间45 min的条件下,测得其总三萜提取量。
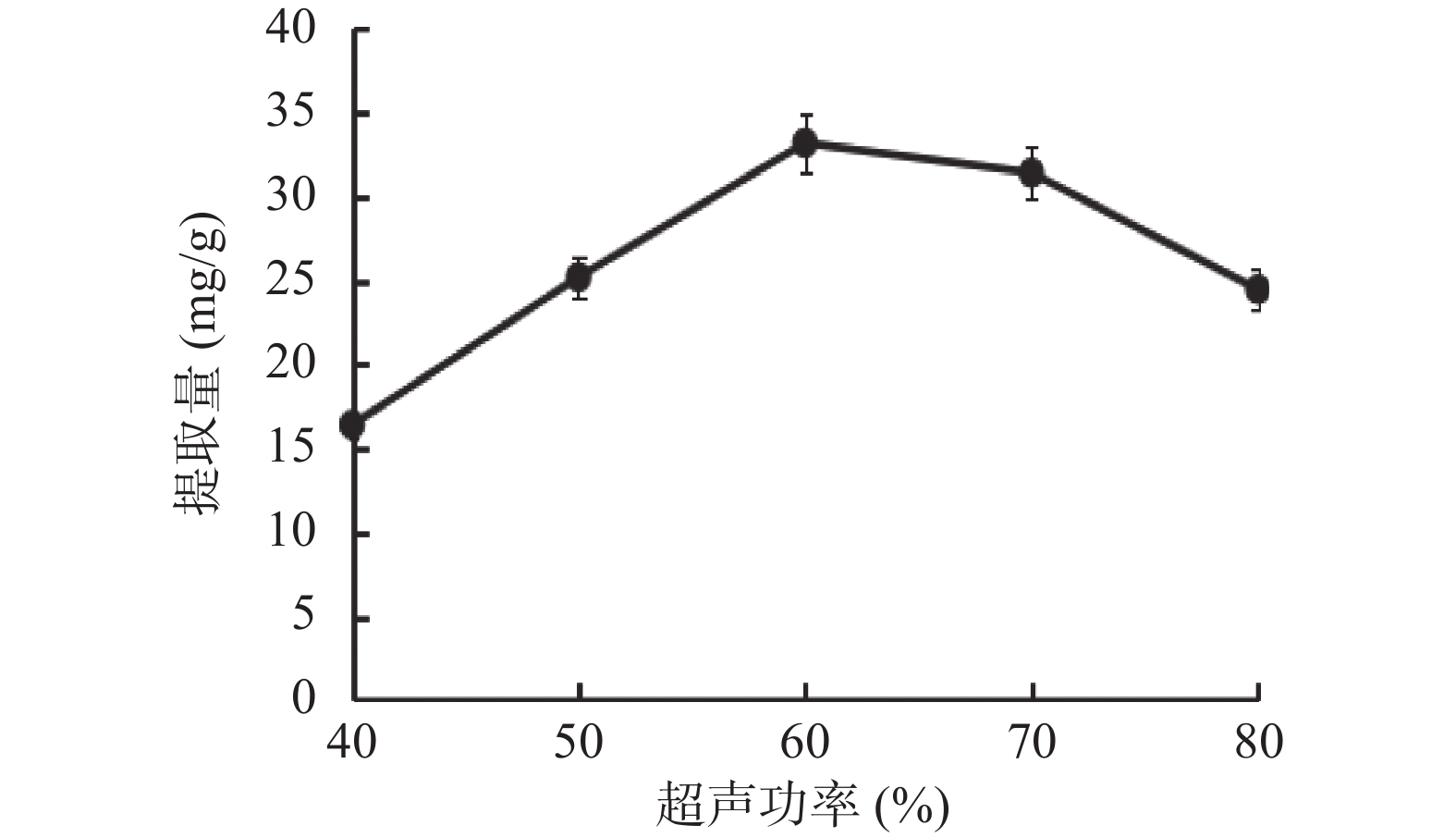
1.2.2.3 超声功率对总三萜提取量的影响
超声功率分别为40%、50%、60%、70%、80%(总功率为650 W)时,在无水乙醇、料液比1:20(g/mL)、超声时间45 min的条件下,测得其总三萜提取量。
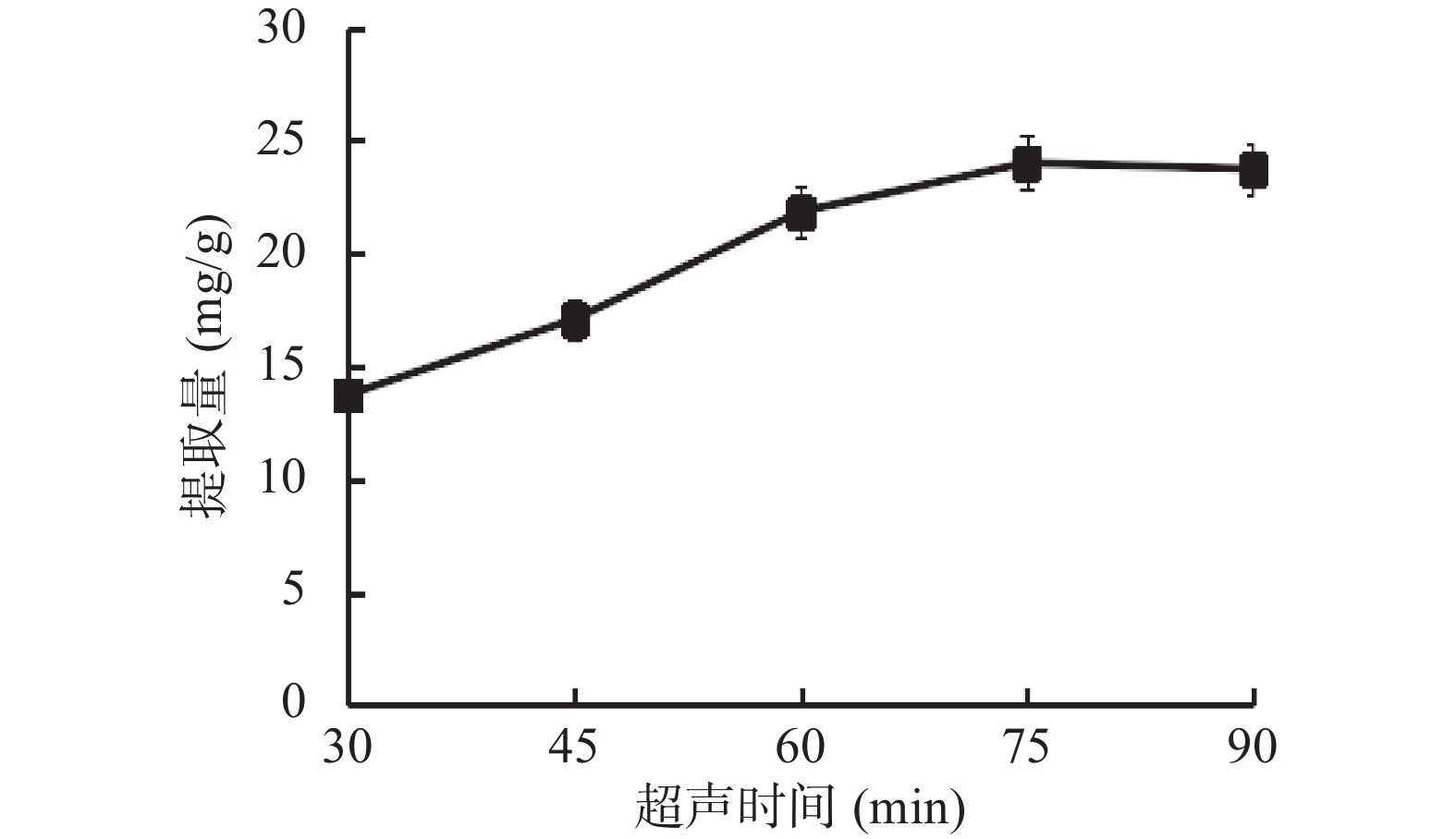
1.2.2.4 超声时间对总三萜提取量的影响
超声时间分别为30、45、60、75、90 min时,在无水乙醇、料液比1:20(g/mL)和超声功率260 W的条件下,测得其总三萜提取量。
1.2.3 响应面优化试验设计
采用统计分析软件 Design-Expert 8.0.6,以乙醇浓度(A)、料液比(B)、超声功率(C)和超声时间(D)作为因素,以总三萜提取量(Y)为考察值,进行4因素3水平的Box-Behnken试验设计,响应面试验因素水平设计见表1。
表 1 响应面试验因素水平设计Table 1. Factors and levels design of response surface test因素 A:乙醇浓度(%) B:料液比(g/mL) C:超声时间(min) D:超声功率(%) 水平(−1) 60 1:20 60 50 水平(0) 75 1:30 75 60 水平(1) 90 1:40 90 70 注:由于超声清洗仪器功率设定按百分比进行设定,故用百分比作为超声功率的单位,超声总功率为650 W。 1.2.4 体外抗氧化活性测定
1.2.4.1 DPPH自由基清除率的测定方法
分别取质量浓度为0、0.2、0.4、0.6、0.8、1.0、1.2 mg/mL 2 mL待测溶液,加入2 mL浓度为0.2 mmol/L的DPPH95%乙醇溶液,室温下30 min避光静置,于517 nm波长处测定得到吸光度值A1;对照组以95%乙醇溶液代替DPPH 95%乙醇溶液,测定得到吸光度值A2;空白组以95%乙醇溶液代替样品溶液,测定得到吸光度值A0。以VC为参照,考察DPPH自由基清除率的强弱[15]。
DPPH自由基清除率(%)=(1−A1−A2A0)×100 1.2.4.2 OH自由基清除率的测定方法
在10 mL比色管中,依次加入0.3 mL浓度为7.5mmol/L硫酸亚铁溶液、0.3 mL浓度为7.5 mmol/L邻二氮菲溶液、1 mL pH为7.45的Tris-HCI缓冲溶液,再加入1 mL浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL的提取液和0.2 mL浓度为7.5 mmol/L H2O2溶液,用蒸馏水定容至刻度,在37 ℃水浴中,反应1 h,在536 nm下测定得到吸光度值A1;以蒸馏水代替H2O2测定得到吸光度值A2;以蒸馏水代替待测溶液测定得到吸光度值A0。以VC作为参照,考察OH自由基清除率的强弱[15]。
OH自由基清除率(%)=(A1−A0)(A2−A0)×100 1.2.4.3 O2−自由基清除率的测定方法
在10 mL比色管中,依次加入2 mL浓度为0.1 mol/L Tris-HCl缓冲溶液、2 mL浓度分别为0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL的提取液、1 mL浓度为0.05 mol/L邻苯三酚,超纯水定容至刻度、摇匀,25 ℃条件水浴中加热20 min后,加入0.5 mL盐酸溶液终止反应,于波长330 nm处测定吸光度值,得到吸光度值A1;以蒸馏水代替待测溶液测定得到吸光度值A0。以VC作为参照,考察O2−自由基清除率的强弱[15]。
O−2自由基清除率(%)=(A0−A1)A0×100 1.3 数据分析
应用 Design-Expert8.0.6软件进行响应曲面试验设计、数据分析和二次模型的建立,通过对回归方程的解析以及响应曲面的分析获得最佳变量水平,通过P值考察(P<0.05)模型及因素的显著性。所有试验重复3次,数据结果用均值±标准差表示。
2. 结果与分析
2.1 单因素实验
2.1.1 薰衣草残渣总三萜含量测定
采用超声辅助提取法对1 g薰衣草残渣进行提取,料液比为1:20,乙醇浓度为无水乙醇,超声功率为260 W,超声时间为30 min,超声三次后合并浓缩定容,在546 nm的波长通过测定其吸光度,带入公式计算得到总三萜的提取量为(11.19±0.15)mg/g。
2.1.2 各因素对薰衣草总三萜提取量的影响
乙醇浓度、料液比、超声功率和超声时间对薰衣草总三萜提取量的影响见图1~图4。如图1所示,乙醇作为提取溶剂,乙醇浓度为自变量,较低浓度的75%乙醇相比无水乙醇提取量更高,推测与总三萜的化学极性大小有关,当提取溶剂极性较小时,提取出更多的杂质,因而总三萜的占比减少[18]。如图2所示,使用不同比例的料液比进行提取,得到1:30的比例时提取量较高,高于此比例时,提取量降低。推测溶剂用量增大,超声波与薰衣草粗粉的作用力减小[19]。如图3所示,超声时间到75 min时,其提取量达到较大值,随着时间的延长提取量接近平稳趋势,推测超声时间越长,可能会影响部分三萜类化合物的稳定性,同时杂质溶出也会增加,反而降低了提取效果[21]。如图4所示,当提取功率提高时,提取量逐渐增大,达60%时提取量最高,继续提高功率提取量下降,推测随着物料破碎程度增大,提取程度越完全而溶出了更多杂质,因此总三萜在提物取中占比减少,致使测定的总三萜含量减少[20]。通过单因素实验选出各因素的较优水平,即乙醇浓度75%、料液比1:30、超声时间75 min和超声功率60%。
2.2 响应面法优化薰衣草残渣总三萜的提取工艺
2.2.1 响应面试验设计与结果
根据单因素实验,得到各因素的较优条件,并将乙醇浓度(A)、料液比(B)、超声时间(C)和超声功率(D)四个因素带入统计分析软件Design Expert 8.0.6,以总三萜提取量(Y)为考察值,进行Box-Behnken设计,响应面试验因素水平设计及结果见表2。
表 2 响应面试验设计及其响应值Table 2. Response surface test design and response values试验号 乙醇浓度 料液比 超声时间 超声功率 提取量(mg/g) 1 1 1 0 0 37.765 2 0 0 0 0 41.817 3 0 −1 0 −1 34.627 4 0 1 0 1 32.583 5 0 0 1 −1 30.486 6 0 0 0 0 41.206 7 −1 1 0 0 28.276 8 0 −1 0 −1 27.063 9 0 0 1 1 36.981 10 −1 0 1 0 24.902 11 1 0 0 1 34.941 12 0 −1 1 0 35.794 13 1 0 −1 0 28.574 14 1 0 1 0 40.943 15 0 1 −1 0 40.297 16 1 0 0 −1 34.528 17 0 0 0 0 39.181 18 −1 −1 0 0 31.961 19 0 0 0 0 40.521 20 0 1 0 −1 36.794 21 1 −1 0 0 29.277 22 0 0 −1 1 36.437 23 0 1 1 0 32.517 24 −1 0 −1 0 35.941 25 −1 0 0 1 34.941 26 0 0 0 0 39.276 27 0 0 1 −1 36.981 28 0 −1 −1 0 27.01 29 0 1 0 1 40.138 根据试验结果,基于参数评估,采用Design Expert 8.0.6对表中的数据进行分析可以反映出响应值与被检变量之间的逻辑关系,对其进行二次多元回归方程拟合,即Y=40.40+1.47A+2.50B+0.79C+1.64D+3.04AB+5.81AC−0.49AD−4.14BC−1.06BD−1.49CD−4.62A2−3.74B2−3.10C2−1.87D2。为检验建立模型的有效性,利用Design Expert 8.0.6进一步进行分析,其中多元回归模型的方差分析结果见表3。
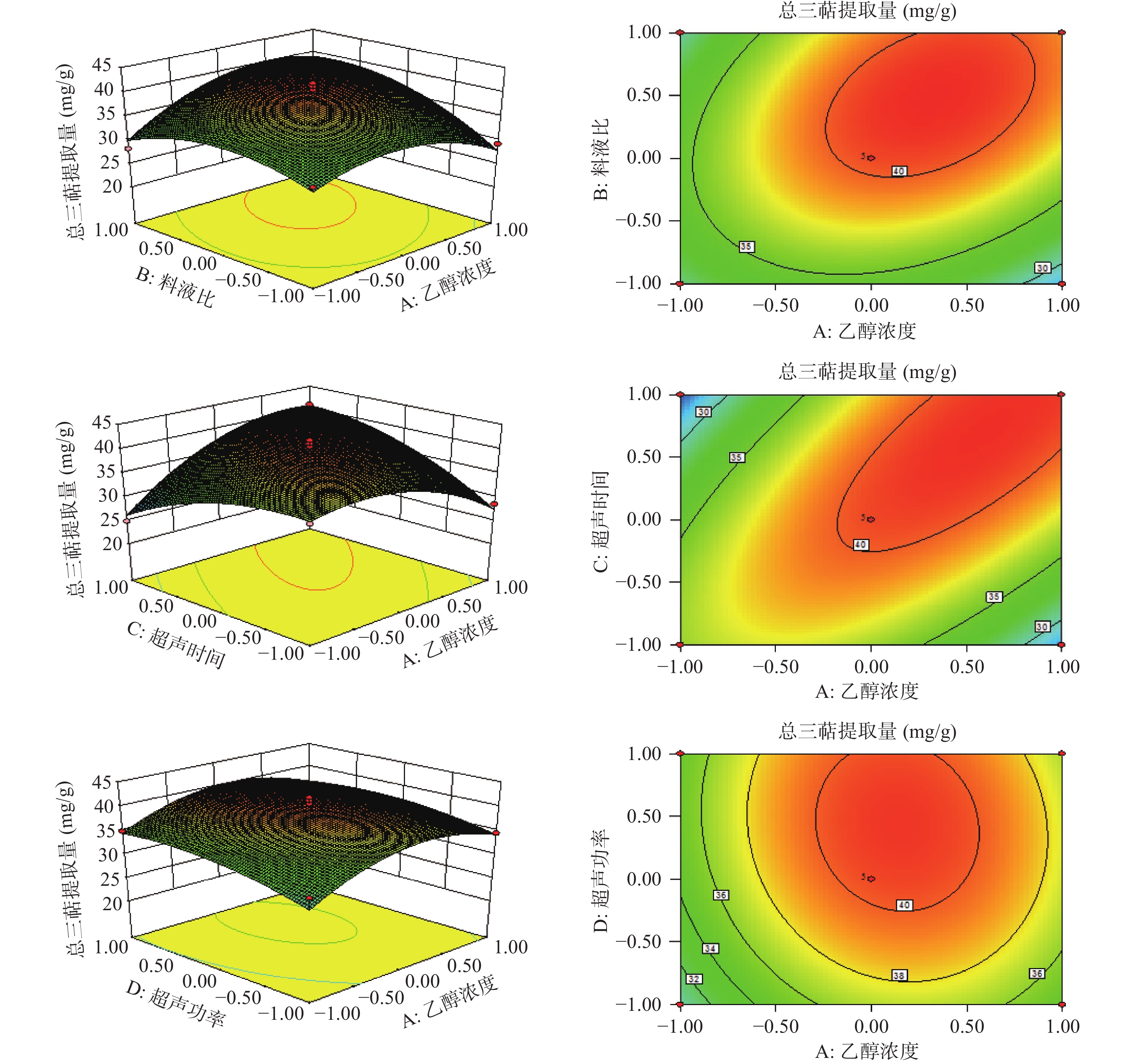
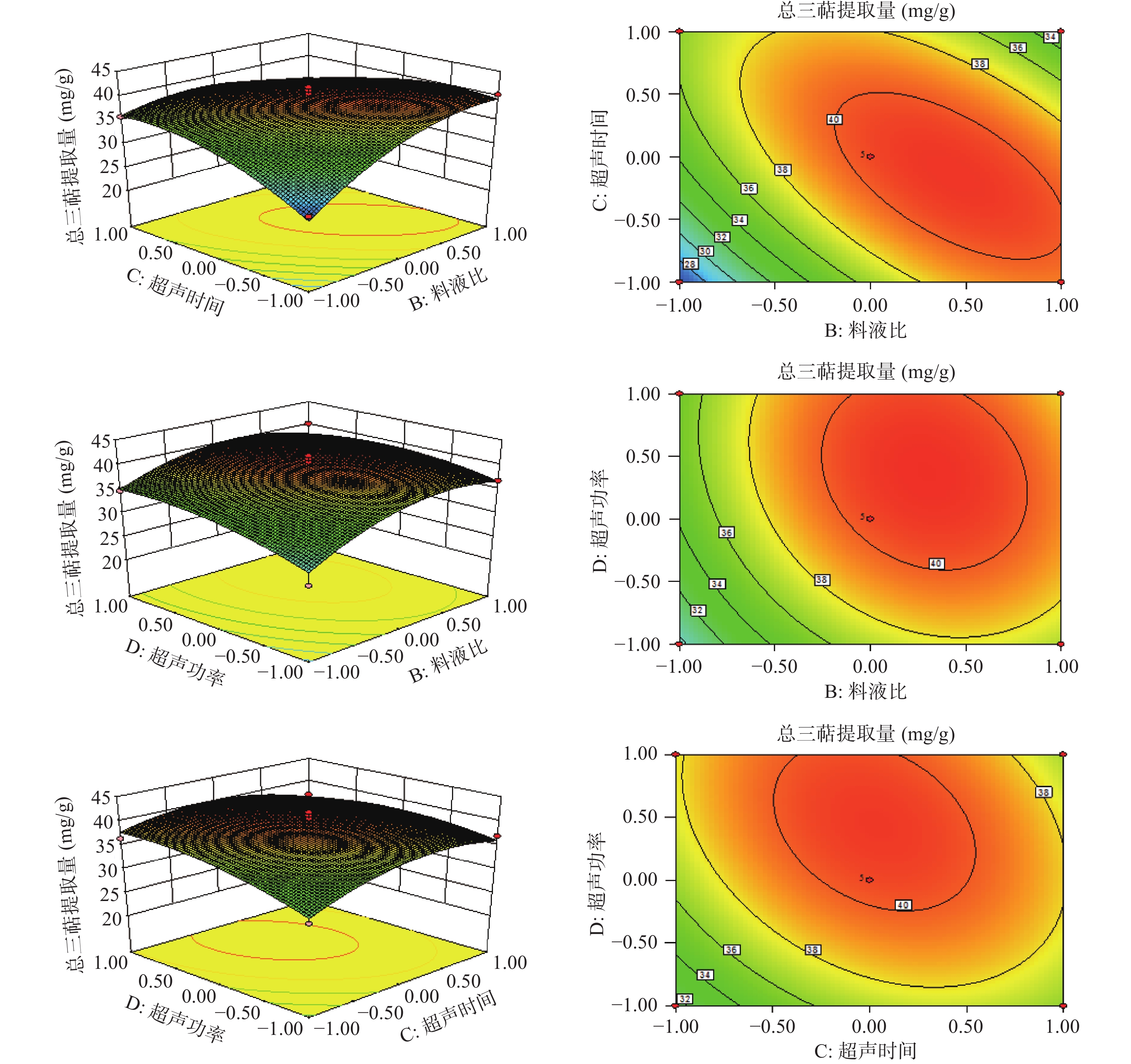
表 3 方差分析及显著性检验Table 3. Variance analysis and significance test方差来源 平方和 自由度 均方 F值 P值 模型 611.90 14 43.71 15.01 <0.0001** A 25.77 1 25.77 8.85 0.0101* B 75.28 1 75.28 25.84 0.0002** C 7.57 1 7.57 2.60 0.1292 D 32.11 1 32.11 11.02 0.0051** AB 37.05 1 37.05 12.72 0.0031** AC 135.12 1 135.12 46.39 <0.0001** AD 0.95 1 0.95 0.32 0.5778 BC 68.59 1 68.59 23.55 0.0003** BD 4.45 1 4.45 1.53 0.2367 CD 8.85 1 8.85 3.04 0.1032 A2 138.71 1 138.71 47.62 <0.0001** B2 90.90 1 90.90 31.21 <0.0001** C2 62.15 1 62.15 21.34 0.0004** D2 22.70 1 22.70 7.79 0.0144* 残差 40.78 14 2.91 失拟项 35.36 10 3.54 2.61 0.1842 纯误差 5.42 4 1.36 总和 652.68 28 注:*表示显著(P<0.05);**表示极显著(P<0.01);R2=0.9375;R2Adj=0.8750;Pred R2=0.6750;Adeq Precision=11.920。 2.2.2 模型的建立及显著性检验
如表3所示,该模型的R2为0.9375,说明总三萜提取量的变化93.75%来自所选试验因素,因此该模型能够很好地描述各个因素与总三萜提取量之间的关系,校正决定系数R2Adj为0.8750表明该模型能够解释87.50%响应值的变化。该模型P值<0.01,拟合极显著,失拟相P>0.05不显著,其中A、D2因素显著(P<0.05),B、D、AB、AC、BC、A2、B2、C2极显著(P<0.01)。试验因素的F值越大其影响响应值的程度越大,结果表明各因素对总三萜提取量影响大小为B>D>A>C,即料液比>超声功率>乙醇浓度>超声时间。
2.2.3 响应面交互作用分析
如图5所示,响应面图均为凹面曲面,表明乙醇浓度(A)、料液比(B)、超声时间(C)和超声功率(D)四个因素在一定范围内与总三萜提取量呈抛物线关系,在试验设定条件范围内存在极高值。表3方差分析显示AB、AC和BC均P<0.01,与图5中AB、AC和BC呈椭圆形的等高线图相对应,表明乙醇浓度与料液比、乙醇浓度与超声时间、料液比与超声时间两两因素之间存在极显著的交互作用。
2.2.4 验证实验
通过Design Expert8.0.6软件求解方程得到最优工艺为乙醇浓度为89%,料液比为1:33,超声时间为60 min,超声功率为70% (445 W),理论提取量为39.64 mg/g,在该条件下平行验证三次计算得到实际提取量为(39.95±0.32)mg/g,与预测值接近,表明该工艺条件具有一定的可行性,此外与乙醇浓度为100%,料液比为1:20,超声时间为30 min,超声功率为260 W相比,提取量明显提高,表明该工艺条件能有效提高薰衣草总三萜的提取量。
2.3 体外抗氧化活性测定
2.3.1 DPPH自由基清除率测定
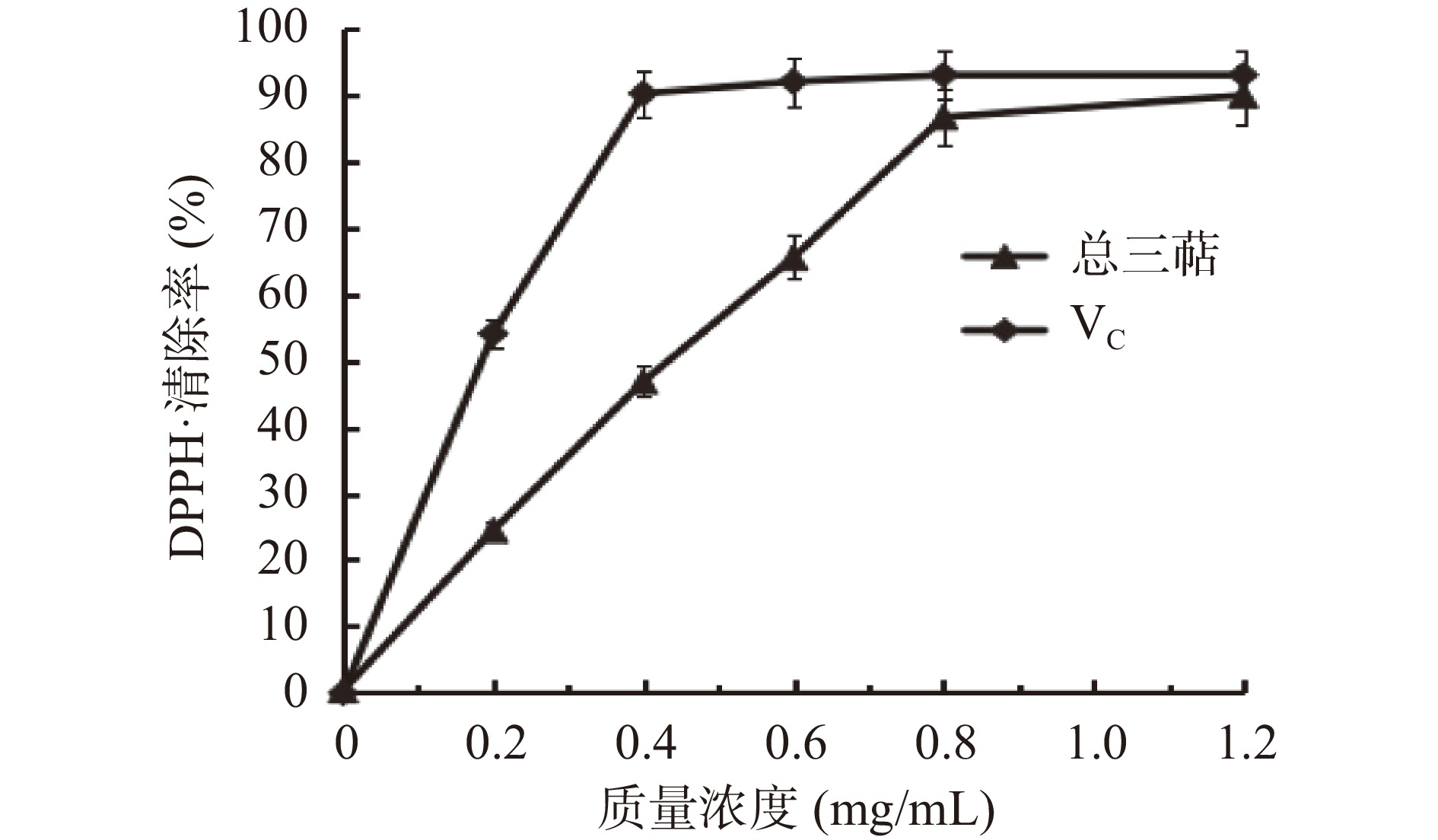
图6中随着薰衣草总三萜浓度变大,DPPH自由基清除率呈现先上升后趋于稳定的趋势,在总三萜浓度在0~0.8 mg/mL范围内DPPH自由基清除率测定结果成剂量效应关系,当浓度达到0.8 mg/mL时,总三萜DPPH自由基清除率到达拐点,后继续增加提取物浓度其清除率达到86.83%并趋于稳定。VC对照组浓度达到0.4 mg/mL时,DPPH自由基清除率出现拐点,其清除率达到90.21%,后继续增加VC浓度,其清除率不再增加。薰衣草总三萜DPPH自由基清除率接近阳性对照VC,最高清除率是同等浓度VC DPPH自由基清除率的96.25%。
2.3.2 OH自由基清除率的测定
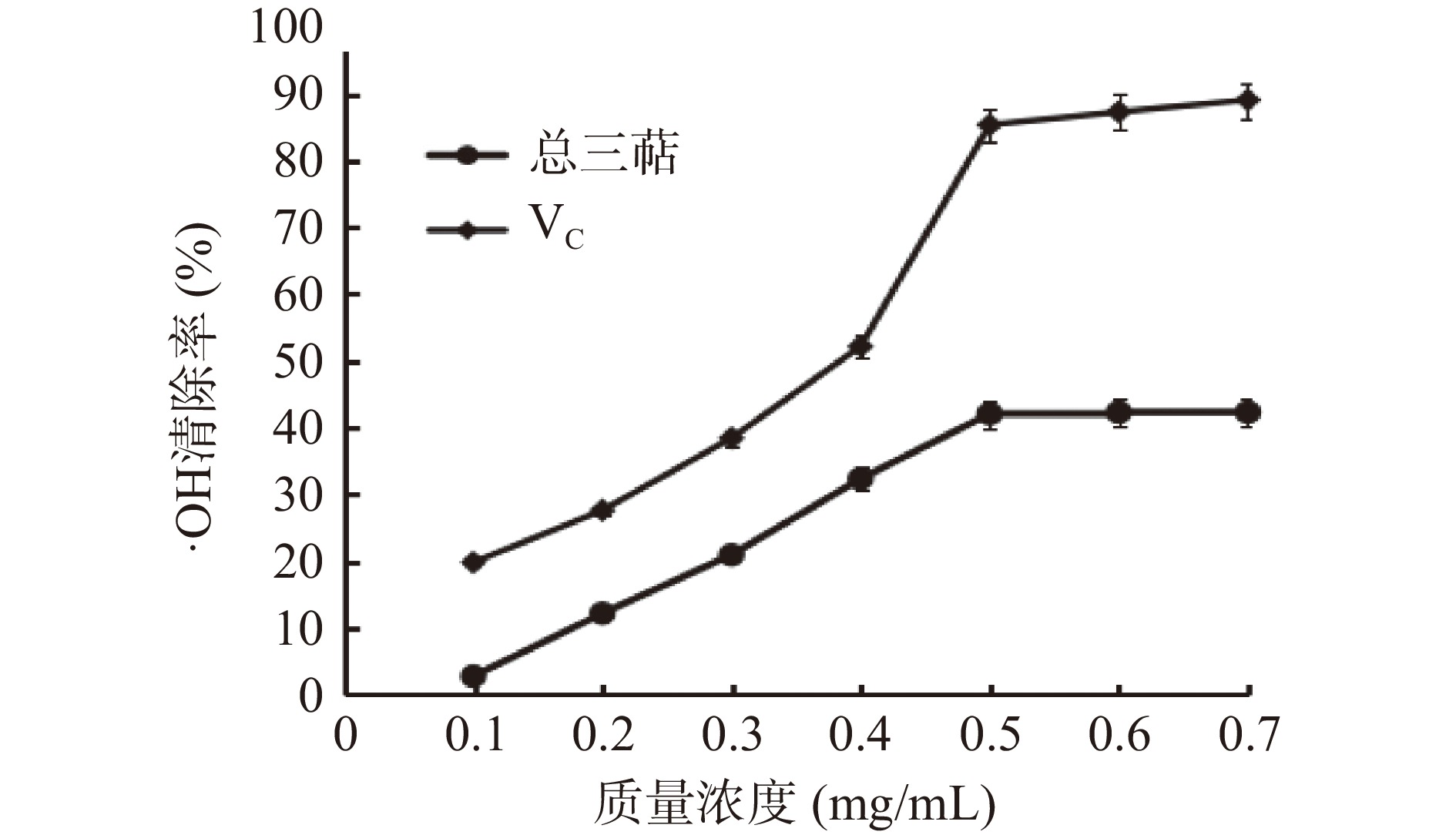
如图7所示,随着薰衣草总三萜浓度的增大,OH自由基清除率呈现先上升后趋于稳定的趋势,在总三萜浓度在0.1~0.7 mg/mL范围内OH自由基清除率测定结果成剂量效应关系,当总三萜浓度达到0.5 mg/mL时,其OH自由基清除率达到42.06%,后趋于平稳,对照组VC的OH自由基清除率最高为85.31%,薰衣草总三萜OH自由基清除率小于阳性对照VC。
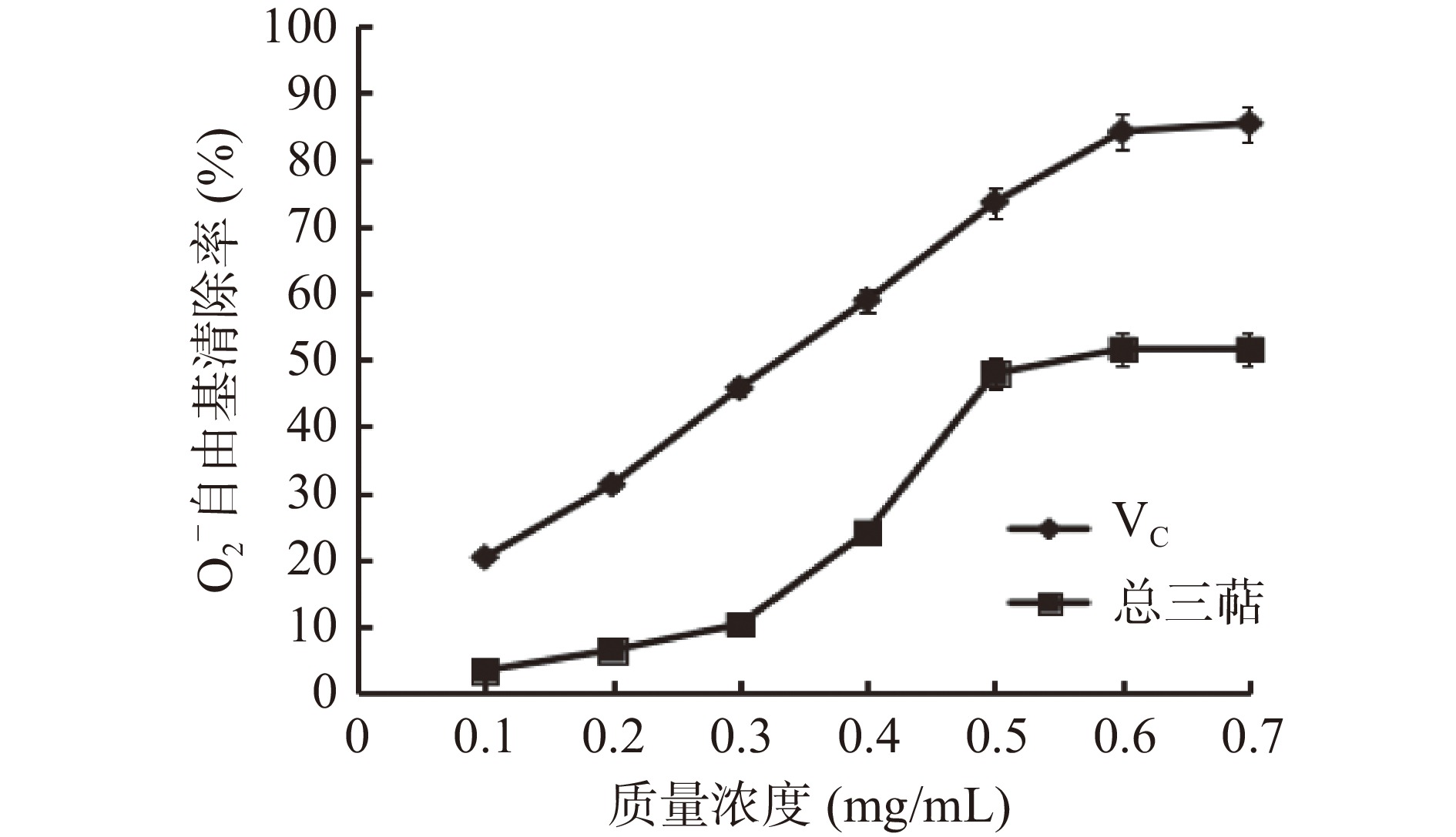
2.3.3 O2−自由基清除率的测定
如图8所示,在总三萜浓度在0.1~0.7 mg/mL范围内O2−自由基清除率测定结果成剂量效应关系,当薰衣草总三萜浓度增大到0.5 mg/mL时,O2−自由基清除率达到47.93%,当VC浓度到达0.6 mg/mL时,其O2−自由基清除率达到84.43%,薰衣草总三萜O2−自由基清除率小于阳性对照VC。
3. 结论
本实验通过单因素实验和响应面优化分析,建立二次多项式模型,理论模型拟合较好,方差分析结果表明各个因素影响程度大小顺序为料液比>超声功率>乙醇浓度>超声时间;响应面相互作用图表明乙醇浓度与料液比、乙醇浓度与超声时间、料液比与超声时间交互作用极显著;响应面优化得到最优工艺条件为乙醇浓度为89%,料液比为1:33,超声辅助提取60 min,超声功率为70% (445 W),该条件下薰衣草总三萜的提取量为(39.95±0.32)mg/g,与预测值接近,表明响应面优化后工艺参数可靠。进一步对薰衣草总三萜进行体外抗氧化活性测定,其中薰衣草总三萜对DPPH自由基清除能力较强,清除率为86.83%,是同等浓度VC DPPH自由基清除率的96.25%,薰衣草总三萜OH自由基和O2−自由基清除率分别为42.06%和47.93%。
通过响应面法优化工艺能够提取得到更多的三萜类有效成分,并具有较强的抗氧化活性,一定程度为薰衣草残渣有效成分的利用提供了理论基础。但未进行分离纯化得到单一化合物,进一步对影响其活性的有效成分进行深入探索。
-
表 1 响应面试验因素水平设计
Table 1 Factors and levels design of response surface test
因素 A:乙醇浓度(%) B:料液比(g/mL) C:超声时间(min) D:超声功率(%) 水平(−1) 60 1:20 60 50 水平(0) 75 1:30 75 60 水平(1) 90 1:40 90 70 注:由于超声清洗仪器功率设定按百分比进行设定,故用百分比作为超声功率的单位,超声总功率为650 W。 表 2 响应面试验设计及其响应值
Table 2 Response surface test design and response values
试验号 乙醇浓度 料液比 超声时间 超声功率 提取量(mg/g) 1 1 1 0 0 37.765 2 0 0 0 0 41.817 3 0 −1 0 −1 34.627 4 0 1 0 1 32.583 5 0 0 1 −1 30.486 6 0 0 0 0 41.206 7 −1 1 0 0 28.276 8 0 −1 0 −1 27.063 9 0 0 1 1 36.981 10 −1 0 1 0 24.902 11 1 0 0 1 34.941 12 0 −1 1 0 35.794 13 1 0 −1 0 28.574 14 1 0 1 0 40.943 15 0 1 −1 0 40.297 16 1 0 0 −1 34.528 17 0 0 0 0 39.181 18 −1 −1 0 0 31.961 19 0 0 0 0 40.521 20 0 1 0 −1 36.794 21 1 −1 0 0 29.277 22 0 0 −1 1 36.437 23 0 1 1 0 32.517 24 −1 0 −1 0 35.941 25 −1 0 0 1 34.941 26 0 0 0 0 39.276 27 0 0 1 −1 36.981 28 0 −1 −1 0 27.01 29 0 1 0 1 40.138 表 3 方差分析及显著性检验
Table 3 Variance analysis and significance test
方差来源 平方和 自由度 均方 F值 P值 模型 611.90 14 43.71 15.01 <0.0001** A 25.77 1 25.77 8.85 0.0101* B 75.28 1 75.28 25.84 0.0002** C 7.57 1 7.57 2.60 0.1292 D 32.11 1 32.11 11.02 0.0051** AB 37.05 1 37.05 12.72 0.0031** AC 135.12 1 135.12 46.39 <0.0001** AD 0.95 1 0.95 0.32 0.5778 BC 68.59 1 68.59 23.55 0.0003** BD 4.45 1 4.45 1.53 0.2367 CD 8.85 1 8.85 3.04 0.1032 A2 138.71 1 138.71 47.62 <0.0001** B2 90.90 1 90.90 31.21 <0.0001** C2 62.15 1 62.15 21.34 0.0004** D2 22.70 1 22.70 7.79 0.0144* 残差 40.78 14 2.91 失拟项 35.36 10 3.54 2.61 0.1842 纯误差 5.42 4 1.36 总和 652.68 28 注:*表示显著(P<0.05);**表示极显著(P<0.01);R2=0.9375;R2Adj=0.8750;Pred R2=0.6750;Adeq Precision=11.920。 -
[1] 蔡永智, 郝晓云, 王力, 等. 中国薰衣草产业发展现状及对策[J]. 北方园艺,2020(12):142−147. [CAI Y Z, HAO X Y, WANG L, et al. Development status and countermeasures of China's lavender industry[J]. Northern Horticulture,2020(12):142−147. [2] MEI W, JAZ A. A novel approach for lavender essential oil authentication and quality assessment science direct[J]. Journal of Pharmaceutical and Biomedical Analysis,2021,199(11):40−44.
[3] 朱燕. 薰衣草精油的提取及抑制枯草芽孢杆菌组效关系研究[D]. 乌鲁木齐: 新疆大学, 2018. ZHU Y. Study on the relationship between the extraction of lavender essential oil and the inhibition of Bacillus Subtilis [D]. Urumqi: Xinjiang University, 2018.
[4] 胡星麟. 薰衣草精油品质评价及杂花薰衣草精油蒸馏残渣化学成分的研究[D]. 南京: 南京师范大学, 2014. HU X L. Evaluation of the quality of essential oil of lavender and the chemical composition of the distillation residue of essential oil of lavender [D]. Nanjing: Nanjing Normal University, 2014.
[5] 阿力木江·麦麦提, 李静. 不同处理对薰衣草秸秆青贮pH值的影响[J]. 现代畜牧兽医,2020,384(11):17−20. [MAIMAITI A, LI J. Effect of different treatments on pH value of lavender straw silage[J]. Modern Journal of Animal Husbandry and Veterinary Medicine,2020,384(11):17−20. [6] 刘健, 郭淑英. 响应曲面法提取苦白蹄中总三萜成分[J]. 吉林医药学院学报,2011,32(5):278−282. [LIU J, GUO S Y . Extraction of total triterpenoids from Bitter White Hoof by response surface method[J]. Journal of Jilin Medical College,2011,32(5):278−282. doi: 10.3969/j.issn.1673-2995.2011.05.012 [7] 景炳年, 魏磊, 周雍, 等. 山银花总三萜超声辅助提取工艺优化及其抗菌抗氧化活性研究[J]. 食品工业科技,2021,42(1):8. [JING B N, WEI L, ZHOU Y, et al. Optimization of ultrasonic-assisted extraction process and antibacterial and antioxidant activity of total triterpenes from Lonicera japonica[J]. Food Industry Science and Technology,2021,42(1):8. [8] 陈斌, 周谦, 钱骅, 等. 伊犁杂花薰衣草叶化学成分研究[J]. 中国野生植物资源,2018,37(5):12−13,33. [CHEN B, ZHOU Q, QIAN H, et al. Study on the chemical constituents of the leaves of Ili lavender[J]. China Wild Plant Resources,2018,37(5):12−13,33. [9] 刘贵有, 杨新周. 狭叶薰衣草化学成分的研究[J]. 中成药,2020,42(5):1214−1218. [LIU G Y, YANG X Z. Study on the chemical constituents of Lavender angustifolia[J]. Chinese Patent Medicine,2020,42(5):1214−1218. doi: 10.3969/j.issn.1001-1528.2020.05.021 [10] 刘贵有, 黄家卫, 杨新周. 狭叶薰衣草中木脂素类化合物的研究[J]. 中草药,2020,668(9):135−140. [LIU G Y, HUANG J W, YANG X Z. Study on lignans inLavender angustifolia[J]. Chinese Herbal Medicine,2020,668(9):135−140. [11] 古丽妮尕尔·阿布力克木, 尼格尔热依·亚迪卡尔, 阿吉艾克拜尔·艾萨. 薰衣草残渣化学成分及其生物活性[J]. 中成药,2019,41(4):104−108. [ABLIKIM G, YADIKAR N, AISA A. The chemical composition and biological activity of lavender residue[J]. Chinese Patent Medicine,2019,41(4):104−108. [12] 王娟. 响应面优化乌梅熊果酸提取工艺研究[J]. 食品工业,2014(1):101−104. [WANG J. Study on the extraction process of ursolic acid from Ebony Plum using response surface methodology[J]. Food Industry,2014(1):101−104. [13] 周茜, 韩雪, 韩晓梅, 等. 响应面试验优化乌梅熊果酸提取工艺及其对大肠杆菌的抑制作用[J]. 食品科学,2016,37(8):67−73. [ZHOU Q, HAN X, HAN X M, et al. Optimization of extraction process of ursolic acid from Ebony Plum and its inhibitory effect on Escherichia coli by response surface experiment[J]. Food Science,2016,37(8):67−73. doi: 10.7506/spkx1002-6630-201608012 [14] 景炳年, 李健, 梁雅辉, 等. 超声波提取炒王不留行总三萜的工艺优化及其抑菌活性研究[J]. 食品工业科技,2018,39(24):157−163. [JING B N, LI J, LIANG Y H, et al. Ultrasonic extraction process optimization and antibacterial activity of total triterpenoids from fried King Buliu Xing[J]. Food Industry Science and Technology,2018,39(24):157−163. [15] 张俊, 李进, 吕海英, 等. 扁桃果皮熊果酸提取工艺优化及体外抗氧化活性研究[J]. 食品与机械,2018,34(2):154−158. [ZHANG J, LI J, LU H Y, et al. Optimization of extraction process of ursolic acid from Almond peel and study on in vitro antioxidant activity[J]. Food and Machinery,2018,34(2):154−158. [16] 王杰, 赵丽霞, 雷建都, 等. 响应面法优化枇杷叶中熊果酸提取工艺及纯化的研究[J]. 热带作物学报,2015,36(8):1518−1524. [WANG J, ZHAO L X, L J D, et al. Optimization of extraction process and purification of ursolic acid from loquat leaves by response surface methodology[J]. Chinese Journal of Tropical Crops,2015,36(8):1518−1524. doi: 10.3969/j.issn.1000-2561.2015.08.026 [17] 郭军, 刘廷国, 黄劲松. 西山焦枣中熊果酸超声法提取工艺研究[J]. 中国农学通报,2015,32(19):175−181. [GUO J, LIU T G, HUANG J S. Study on the ultrasonic extraction technology of ursolic acid from Xishan Jiaozao[J]. Chinese Agricultural Science Bulletin,2015,32(19):175−181. [18] 孟煜嘉, 徐逸凡, 王艳妮, 等. 微波及超声法提取苦丁茶中熊果酸的对比研究[J]. 机电信息,2017(17):36−42. [MENG Y J, XU Y F, WANG Y N, et al. Comparative study on extraction of ursolic acid from Kudingcha by microwave and ultrasonic methods[J]. Electromechanical Information,2017(17):36−42. doi: 10.3969/j.issn.1671-0797.2017.17.009 [19] 秦霞, 刘红, 任晓燕, 等. 应用亚临界水技术对枇杷叶中熊果酸的提取工艺优化研究[J]. 黑龙江工程学院学报,2016(6):41−44. [QIN X, LIU H, REN X Y, et al. Application of subcritical water technology to the optimization of the extraction process of ursolic acid from loquat leaves[J]. Journal of Heilongjiang Institute of Technology,2016(6):41−44. [20] 王欢. 竹柏黄酮类化合物的提取分离纯化及抗氧化活性研究[D]. 吉首: 吉首大学, 2017. WANG H. Extraction, purification and antioxidant activity of bamboo and cypress flavonoids[D]. Jishou: Jishou University, 2017.
[21] 郭华, 刁全平, 张博, 等. 杨树口蘑多糖的超声波辅助提取工艺及其抗氧化活性[J]. 食品工业科技,2018,39(5):180−184. [GUO H, DIAO Q P, ZHANG B, et al. Ultrasonic-assisted extraction process of Tricholoma poplar polysaccharides and its antioxidant activity[J]. Food Industry Science and Technology,2018,39(5):180−184. [22] 王珊珊. 芫荽黄酮的提取, 分离纯化及生物活性研究[D]. 哈尔滨: 哈尔滨商业大学, 2014. WANG S S. Extraction, separation, purification and biological activity of coriander flavonoids[D]. Harbin: Harbin University of Commerce, 2014.
[23] 赵俊仁, 纪玉刚, 邱淡芬, 等. 荔枝果皮果胶提取工艺优化及抗氧化活性分析[J]. 食品工业,2019,277(10):130−134. [ZHAO J R, JI Y G, QIU D F, et al. Optimization of extraction process of pectin fromLitchi peel and analysis of antioxidant activity[J]. Food Industry,2019,277(10):130−134. [24] 刘永, 陈伟健. 超声辅助提取菱角壳色素及热降解动力学[J]. 中国食品添加剂,2015(8):60−65. [LIU Y, CHEN W J. Ultrasound-assisted extraction of water chestnut shell pigment and thermal degradation kinetics[J]. China Food Additives,2015(8):60−65. doi: 10.3969/j.issn.1006-2513.2015.08.002





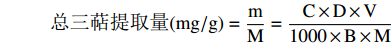
 下载:
下载:
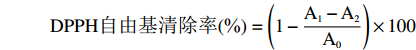
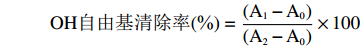
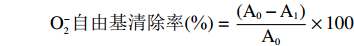
 下载:
下载:
