Effect of High Energy Electron Beam Irradiation on Cell Wall Degradation Related Enzyme Activities and Gene Expressions of Kiwifruit
-
摘要: 以‘海沃德’猕猴桃为试材,经剂量0(对照)、300、400和500 Gy高能电子束辐照后,于0~1 ℃、RH 90%~95%冷库中贮藏90 d,研究电子束辐照对果实硬度、细胞壁组分、软化相关酶活性及其基因表达量的影响。结果表明:高能电子束辐照显著维持了果实的硬度,有效抑制了细胞壁骨架物质原果胶和纤维素的分解,延迟了果实后熟软化。同时,辐照抑制了多聚半乳糖醛酸酶(polygalacturonase,PG)、果胶甲酯酶(pectin methylesterase,PME)、β-半乳糖苷酶(β-D-galaetosidase,β-Gal)和纤维素酶(cellulase,Cx)的活性,降低了PG、PME、β-Gal和Cx编码基因的表达。综合认为,以400 Gy高能电子束辐照对抑制细胞壁降解相关酶活性及基因表达,保持细胞结构的完整性,维持贮藏期间果实硬度效果最好。研究结果为高能电子束用于猕猴桃采后保鲜提供理论依据。Abstract: ‘Hayward’ kiwifruits were used as the test materials to be irradiated with high energy electron beams at doses of 0 (control), 300, 400 and 500 Gy. The fruits were stored at 0~1 ℃, RH 90%~95% for 90 d. The effects of electron beam irradiation on fruit firmness, cell wall components, softening-related enzyme activities and gene expressions were analyzed. The results showed that the high energy electron beam irradiation kept the firmness, effectively inhibited the degradation of cell wall skeletal material (protopectin and cellulose) and delayed the postharvest ripening and softening of kiwifruits. In further, high energy electron beam irradiation significantly inhibited the activities of polygalacturonase (PG), pectin methylesterase (PME), β-D-galaetosidase (β-Gal) and cellulase (Cx), and reduced the expressions of genes encoding PG, PME, β-Gal and Cx. Among the three treatments, 400 Gy high-energy electron beam irradiation showed the best effect on inhibiting cell wall degrading enzyme activity and gene expression, retaining the integrity of cell structure, and maintaining fruit firmness during storage. The study provided a theoretical basis for the use of high-energy electron beams in postharvest kiwifruit preservation.
-
猕猴桃因其风味独特,皮薄多汁,富含维生素C、糖、有机酸、矿物质等多种营养物质而深受消费者青睐[1]。因猕猴桃属于典型的呼吸越变型水果,常温下极易软化、腐烂。质地是评价猕猴桃品质的重要指标之一,对猕猴桃采后商业价值起决定作用。果实软化伴随着细胞壁组分降解、过量乙烯生成、活性氧代谢失衡等一系列复杂生理生化过程,其中细胞壁组分降解是导致果实软化的重要因素之一[2]。果胶和纤维素是构成果实细胞壁的主要多糖物质。在果实贮藏过程中,细胞壁降解酶PG、PME、β-Gal和Cx活性及其基因相对表达量升高,会加速果胶和纤维素降解,细胞壁结构被破坏,导致果实硬度下降[3]。果实软化使细胞内汁液流出,更易引起微生物侵染,加速腐烂,使其失去商业价值。因此,有必要采取一定措施减缓果实软化来延长猕猴桃采后贮藏期。
近年来,人们应用各种技术处理猕猴桃来保持品质和延长货架期。HU等[4]发现漆蜡涂膜通过抑制果实PME和PG活性缓解果胶物质的降解,延缓了猕猴桃的成熟和软化。朱婷婷等[5]研究发现低温贮藏可抑制猕猴桃乙烯合成和淀粉降解相关基因表达,保持果实硬度,延缓其成熟进程;另外,富氢水处理猕猴桃可以缓解果实果胶水解和PG、PME和Cx活性升高,延缓果实硬度下降,降低腐烂率[6]。然而,这些保鲜方法存在成本高、化学成分残留、商业化操作不便等问题,对于猕猴桃采后贮藏仍需寻找一种绿色、安全且高效的保鲜技术。
高能电子束辐照作为一种新型的非热食品加工技术,具有操作简便、处理时间短、不产生放射性污染、辐照剂量均匀等优点[7-8]。高能电子束辐照技术应用于新鲜水果,不仅可以有效杀灭果实表面微生物,降低病虫害,还可抑制果实生理代谢和生化作用,对保持果实营养成分和延长货架期尤为重要[9]。已有研究报道不同剂量的辐照对蓝莓[10]、柑橘[11]、樱桃[12]等水果均起到了良好的保鲜效果。然而,国内外研究者对于电子束辐照猕猴桃保鲜的研究报道较少,且主要集中在辐照对理化品质、抗氧化活性和外观的影响[13-14],关于电子束辐照对猕猴桃软化及相关酶基因表达的影响鲜有报道。因此,本实验以‘海沃德’猕猴桃为试材,探究不同剂量高能电子束辐照对猕猴桃果实采后贮藏过程中细胞壁组分、相关酶活性及基因表达的影响,探明电子束辐照延缓猕猴桃软化的机理,以期为电子束辐照保鲜猕猴桃及其他鲜活果蔬提供理论依据。
1. 材料与方法
1.1 材料与仪器
‘海沃德’猕猴桃 于2020年10月20日采收自陕西省宝鸡市岐山县永红猕猴桃专业合作社基地(北纬34.36°,东经107.14°),果实可溶性固形物含量为6.0%~6.5%。挑选成熟度和大小一致、无病虫害和机械损伤的果实用于实验;RNAprep Pure多糖多酚植物总RNA提取试剂盒、FastKing cDNA第一链合成试剂盒和SuperReal彩色荧光定量预混试剂盒 北京天根生化科技有限公司。
ESS-010-03电子直线型加速器(功率为10 MeV,能量为20 kW) 陕西杨凌核盛辐照公司;TAXT PLUS/50物性测定仪(探头直径为0.5 cm) 英国Stable Micro systems公司;T-203电子天平 北京科普尔科技发展有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;N6000双光束紫外分光光度计 上海佑科仪器仪表有限公司;NanoDropOne超微量分光光度计 美国赛默飞世尔仪器有限公司;SC46-T100 PCR仪 美国伯乐公司;Q6荧光定量PCR仪 美国生命技术公司。
1.2 实验方法
1.2.1 辐照处理
根据黄天姿等[15]的研究,设定辐照剂量为300、400和500 Gy,以不做辐照(0 Gy)的果实为对照组。辐照时,将猕猴桃单层摆放于不锈钢托盘中,通过传送带运进辐照室进行辐照。利用重铬酸银剂量计监测猕猴桃实际吸收剂量,剂量误差小于10%。辐照结束后将各组果实用带孔的0.03 mm厚PE袋包装后立即运回实验室,于阴凉处放置24 h散去田间热后,将其转移至0~1 ℃、RH 90%~95%冷库中贮藏。每15 d取一次样,直到第90 d结束贮藏。每组每次取20个猕猴桃,测定果实硬度和细胞壁组分,部分果肉用液氮速冻,置于−80 ℃冰箱中用于酶活性及基因相对表达量分析。每个指标重复测定3次。
1.2.2 样品制备
可溶性果胶测定液:称取3 g猕猴桃果肉,研磨成浆,转入到50 mL离心管中,加入25 mL 95%乙醇,沸水浴加热30 min。取出后冷却至室温,于8000 r/min离心20 min,弃上清液。再加入95%乙醇,沸水浴加热,重复3~5次。弃上清,向沉淀物中加入20 mL蒸馏水,在50 ℃水浴中保温30 min。取出冷却至室温,于8000 r/min离心20 min,将上清液移入100 mL容量瓶,用少量蒸馏水洗涤沉淀,离心后将上清并入100 mL容量瓶,用蒸馏水定容,备用。
原果胶测定液:上述蒸馏水洗涤后的沉淀物,仍保留在原刻度离心管中。向其中加入25 mL 0.5 mol/L硫酸溶液,在沸水中加热1 h。取出冷却至室温后,于8000 r/min离心20 min,将上清液移入100 mL容量瓶中,加蒸馏水至刻度,备用。
纤维素测定液:向上述沉淀物中缓慢加入20 mL 60%硫酸,25℃放置30 min使纤维素溶解。取5 mL溶解液,移入100 mL容量瓶中,加蒸馏水至刻度,备用。
粗酶提取液:称取猕猴桃果肉3 g,加入5 mL经预冷的95%乙醇,冰浴研磨后倒入离心管,低温放置10 min,于4 ℃、8000 r/min离心20 min。弃上清液,往沉淀物中加入5 mL预冷的80%乙醇,低温放置10 min,相同条件下离心,弃去上清液,向沉淀物中加入5 mL预冷的磷酸提取缓冲液,于4 ℃放置提取20 min,再离心收集上清液,4 ℃保存备用。
1.2.3 指标测定
1.2.3.1 硬度测定
每组随机取5个果实,在其赤道部位均匀取3个点,削去果皮,在TPA模式下测定,单位为kg/cm2。
1.2.3.2 细胞壁组分测定
原果胶和可溶性果胶含量参照曹建康等[16]的咔唑比色法测定,纤维素含量参照李圆圆[17]的蒽酮硫酸法测定。具体如下:分别吸取1 mL原果胶、可溶性果胶待测液,加入到25 mL刻度管中,然后小心地沿着管壁加入6 mL浓硫酸,在沸水中加热20 min,取出冷却至室温后,加入0.2 mL 1.5 g/L咔唑-乙醇溶液,摇匀。在暗处放置30 min后,测定反应液在波长530 nm吸光度值。重复三次,含量用%表示。吸取2 mL纤维素待测液,加入到25 mL刻度管中,加0.5 mL 2%蒽酮试剂和6 mL浓硫酸,震荡后静置12 min,测定反应液在620 nm处的波长。重复三次,含量用%表示。
1.2.3.3 酶活性测定
PG、β-Gal和Cx活性测定参照曹建康等[16]的二硝基水杨酸法;PME活性测定参照刘耀娜等[18]的溴麝香草酚蓝法。具体如下:
PG活性测定:取2支25 mL具塞试管,每支试管中都分别加入1 mL 50 mmol/L、pH5.5乙酸-乙酸钠缓冲液和0.5 mL 10 g/L多聚半乳糖醛酸溶液。再往其中一支试管中加入0.5 mL 1.2.2中的粗酶提取液,另一支试管中加入0.5 mL经煮沸5 min的酶提取液作为对照,混匀后置于37 ℃水浴中保温1 h。保温后,迅速加入1.5 mL 3,5-二硝基水杨酸试剂,在沸水中加热5 min。然后迅速冷却至室温,以蒸馏水稀释至25 mL,混匀,在波长540 nm处测定吸光度。重复三次,酶活性用mg/(h·g)表示。
β-Gal活性测定:取1.2.2中的粗酶提取液0.4 mL,加0.56 mL 0.1 mol/L pH4.0柠檬酸盐缓冲液和0.4 mL 13 mmol/L 4-硝基苯-β-D-吡喃葡萄糖苷溶液,37 ℃保温15 min,加2 mL 0.2 mol/L Na2CO3溶液终止反应,测定波长400 nm处吸光度。重复三次,酶活性用mg/(h·g)表示。
Cx活性测定:取2支25 mL刻度试管编号,分别加入1.5 mL 10 g/L CMC溶液。向一支试管中再加入1.2.2中的0.5 mL粗酶提取液,向另外一支试管中加入0.5 mL经煮沸5 min的酶提取液作为对照,置于37 ℃恒温水浴保温1 h。取出后迅速加入1.5 mL 3,5-二硝基水杨酸试剂,在沸水浴中加热5 min。然后迅速冷却至室温,以蒸馏水稀释至25 mL刻度处,混匀,测定波长540 nm处吸光度。重复三次,酶活性用mg/(h·g)表示。
PME活性测定:称取3 g猕猴桃果肉,加5 mL 8.8%预冷的NaCl冰浴研磨,于4 ℃、8000 r/min离心20 min,收集上清液,用0.1 mol/L NaOH调pH7.5后即为粗酶提取液,4 ℃保存备用。反应体系包括4 mL 0.5%果胶溶液,0.3 mL 0.01%溴麝香草酚蓝,加500 μL粗酶液启动反应,测定620 nm 处的吸光值。重复三次,酶活性用mg/(h·g)表示。
1.2.3.4 实时定量PCR(qRT-PCR)
以猕猴桃基因组数据库中(http://bioinfo.bti.cornell.edu/cgi-bin/kiwi/home.cgi)各基因全长序列为模板,采用NCBI的Primer-BLAST在线设计引物(由北京奥科鼎盛生物科技有限公司合成),引物序列如表1所示。
表 1 定量RT-PCR引物Table 1. Primers used for qRT-PCR基因编号 基因 上游引物 下游引物 产物长度(bp) GU327819.1 PME CCCAACCACGAAACAGCAAC CACTTGCTAGGGGTCTTGCC 167 KY129958.1 PG AACACGAACATTGCTTGCGG GTGTCGTGCATTGTGGTGTC 179 Achn234201 Cx AATCCAAATGTTGCGCTCGG CGAGGTAGTGACCAAGCCAG 150 Achn135641 β-Gal TCTCCAAACGCAGTCTCGTC TGATCCACGCTTGTCCCTTC 160 DQ682826.1 Actin CCTTCGTCTTGACCTTGCTG TCTTTGCTGTCTCCAGCTCC 170 RT-PCR反应体系为:cDNA模板2 μL、荧光染料10 μL、正反向引物(10 μmol/L)各0.6 μL、RNase-Free ddH2O 6.8 μL。PCR反应程序为:95 ℃ 15 min,1个循环;95 ℃ 10 s,40个循环;62 ℃ 30 s,40个循环。以Actin为参比,通过荧光定量PCR仪测定各基因相对表达量。采用2-ΔΔCT法进行结果分析。
1.3 数据处理
数据结果用平均值±标准误表示,利用SPSS 20.0软件进行方差分析,采用Duncan法进行多重比较(P<0.05)。使用Origin 8.5软件作图。
2. 结果与分析
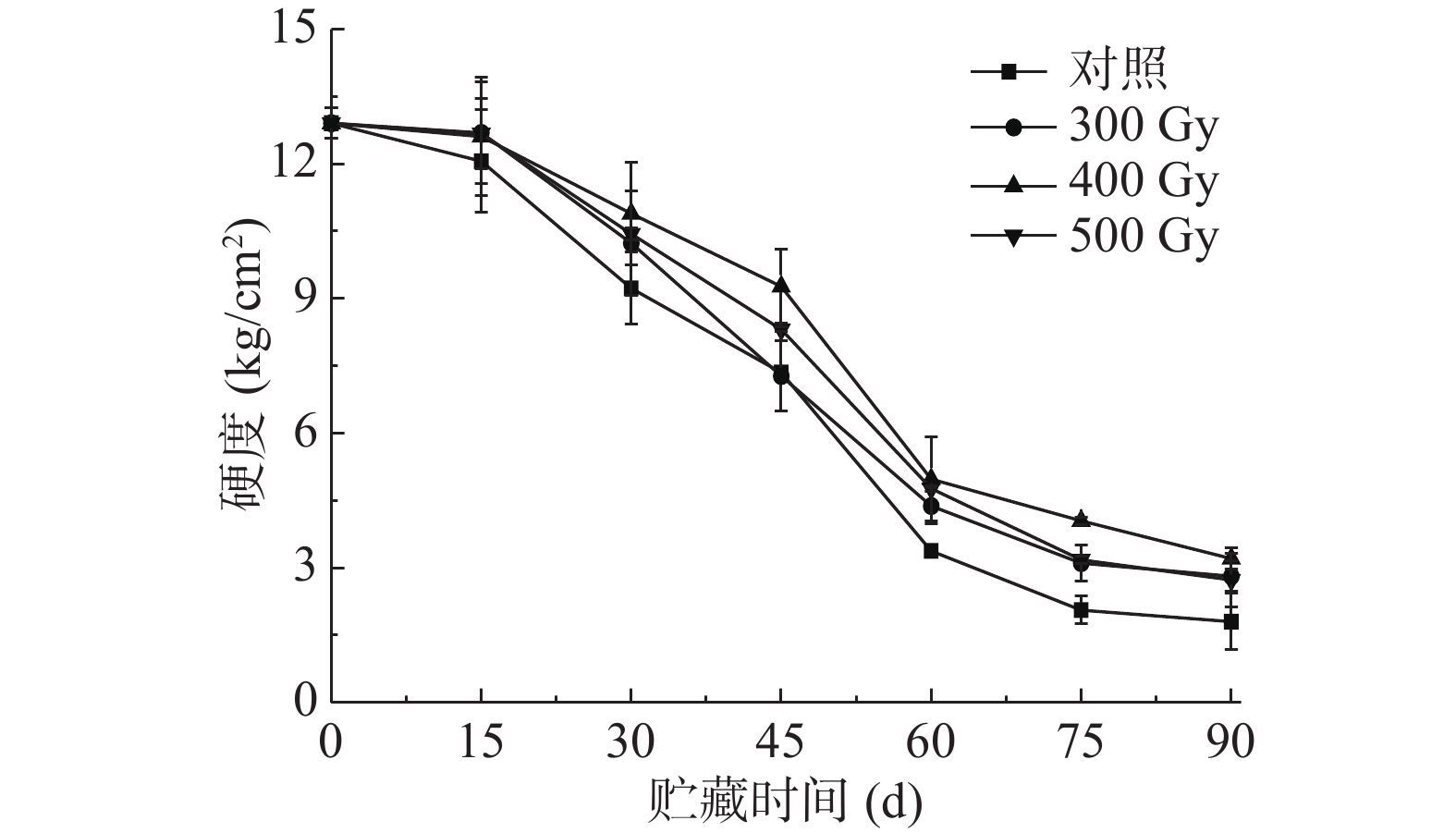
2.1 电子束辐照对猕猴桃贮藏期果实硬度的影响
硬度是评价果实软化最直观的指标。如图1所示,不同剂量辐照处理的猕猴桃果实硬度随贮藏时间延长均呈下降趋势,但辐照组果实硬度总体高于对照组,说明电子束辐照有利于减缓采后猕猴桃贮藏期间果实硬度下降。贮藏后期(60~90 d),四组果实硬度下降速率减慢。贮藏90 d,对照组、300、400和500 Gy辐照组果实硬度分别降低了86.06%、78.22%、75.12%和78.84%。与其他组相比,400 Gy辐照组果实硬度保持效果较好,说明适宜的电子束辐照剂量能延缓果实后熟软化速率。MOSTAFAVI等[19]发现γ辐照(200~400 Gy)可以保持苹果硬度,抑制果实在贮藏过程中的软化;TRUC等[20]研究发现,电子束辐照芒果可显著抑制果实硬度的下降,这与本研究结论一致。
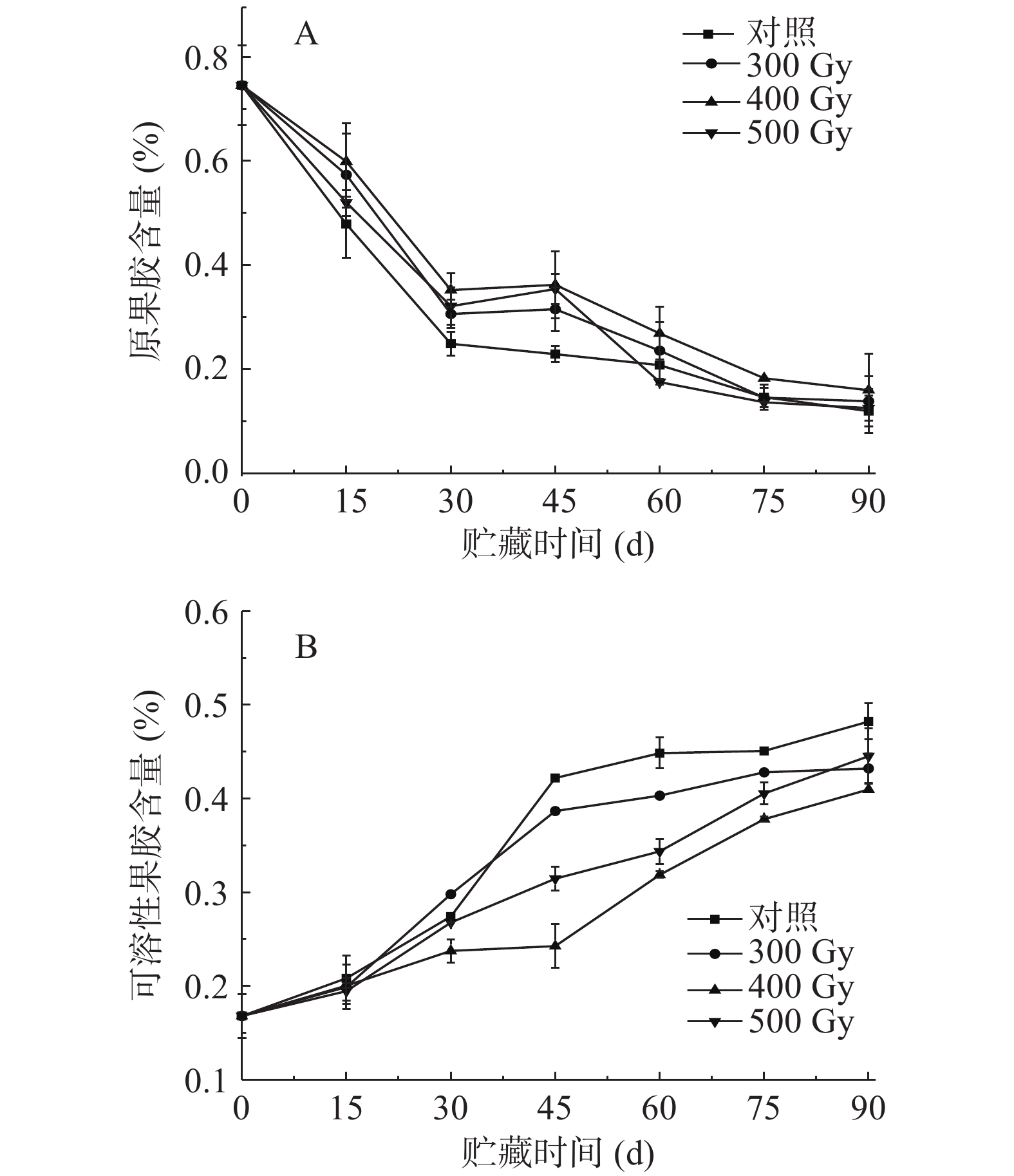
2.2 电子束辐照对猕猴桃贮藏期原果胶和可溶性果胶含量的影响
果胶参与细胞壁分子间相互作用,主要存在于中间片层和初生细胞壁中,在果实后熟软化过程中,原果胶会被相关酶水解成可溶性果胶,导致细胞壁结构破坏[21]。如图2A所示,在整个贮藏期,各组果实中原果胶含量均呈现降低趋势。猕猴桃果实原果胶含量初始值为0.75%,贮藏的前30 d下降速度最快;贮藏第15~45 d,对照组果实原果胶含量明显显著低于其他组(P<0.05),说明在此贮藏期内电子束辐照对维持猕猴桃中原果胶含量效果显著。在辐照组中,500 Gy组果实原果胶含量在贮藏第45 d和90 d时高于其他两组,各组果实原果胶含量没有显著性差异(P>0.05)。表2相关性分析结果显示,对照组果实硬度和原果胶含量呈显著正相关(r=0.865*),而300、400和500 Gy辐照组中二者呈极显著正相关(r=0.911**、r=0.902**、r=0.910**)。
表 2 果实硬度、细胞壁组分、酶活性及其基因表达之间的相关性分析Table 2. Correlation analysis of fruit firmness, cell wall components, enzyme activities and gene expressions剂量(Gy) 指标 硬度(kg/cm2) 原果胶
(%)可溶性果胶
(%)纤维素
(%)0(对照) 硬度 Firmness — 0.865* −0.958** 0.931** 酶活性 PG −0.901** −0.830* 0.956** −0.912** PME −0.991** −0.844* 0.969** −0.923** β-Gal −0.988** −0.912** 0.960** −0.950** Cx −0.790* −0.778* 0.874* −0.793* 基因表达 PG −0.885** −0.971** 0.902** −0.950** PME −0.706 −0.769* 0.677 −0.850* β-Gal −0.817* −0.974** 0.795* −0.935** Cx −0.553 −0.870* 0.574 −0.743 300 硬度 Firmness — 0.911** −0.963** 0.925** 酶活性 PG −0.895** −0.839* 0.896** −0.981** PME −0.943** −0.851* 0.872* −0.891** β-Gal −0.982** −0.941** 0.964** −0.935** Cx −0.639 −0.611 0.747 −0.674 基因表达 PG −0.852* −0.932** 0.869* −0.837* PME −0.138 0.04 0.028 −0.37 β-Gal −0.857* −0.776* 0.876** −0.889** Cx −0.256 −0.578 0.461 −0.275 400 硬度 Firmness — 0.902** −0.976** 0.970** 酶活性 PG −0.917** −0.856* 0.870* −0.948** PME −0.887** −0.762* 0.901** −0.873* β-Gal −0.976** −0.901** 0.986** −0.977** Cx −0.787* −0.825* 0.784* −0.910** 基因表达 PG −0.776* −0.902** 0.827* −0.830* PME −0.130 0.196 0.186 0.000 β-Gal −0.799* −0.882** 0.769* −0.874* Cx 0.203 −0.214 −0.169 0.075 500 硬度 Firmness — 0.910** −0.975** 0.972** 酶活性 PG −0.925** −0.869* 0.914** −0.956** PME −0.960** −0.872* 0.957** −0.966** β-Gal −0.989** −0.922** 0.962** −0.984** Cx −0.875** −0.836* 0.926** −0.893** 基因表达 PG −0.766* −0.851* 0.861* −0.832* PME −0.087 0.116 −0.126 0.019 β-Gal −0.822* −0.863* 0.828* −0.886** Cx −0.321 −0.424 0.395 −0.412 注:*为显著相关(P<0.05);**为极显著相关(P<0.01)。 如图2B所示,各组猕猴桃可溶性果胶含量在贮藏期内均呈升高趋势。贮藏第0 d,可溶性果胶含量为0.17%,随着贮藏时间延长,各组果实可溶性果胶含量逐渐升高且均在第90 d时达到峰值,从高到低依次是对照组(0.48%)、500(0.45%)、300(0.43%)和400 Gy(0.41%)辐照组。其中,前15 d,各组之间不存在显著性差异(P>0.05);30 d时,400 Gy辐照组可溶性果胶含量显著低于其他三组(P<0.05);45 d时,四组含量差异显著(P<0.05)。在贮藏中后期(45~90 d),对照组果实可溶性果胶含量显著高于辐照组(P<0.05),说明电子束辐照对猕猴桃原果胶分解为可溶性果胶起到了一定的抑制作用,使可溶性果胶含量降低。表2相关性分析表明,对照组、300、400、500 Gy组果实硬度和可溶性果胶含量呈极显著负相关(r=−0.958**、r=−0.963**、r=−0.976**、r=−0.975**)。PRAKASH等[22]用剂量为0.5、1.24和3.70 kGy的γ射线辐照番茄,发现随着贮藏时间延长和辐照剂量增加,果实可溶性果胶含量有所降低;WANG等[23]报道,2.5 kGy的γ射线辐照的蓝莓果实在贮藏期内原果胶含量保持较高水平,可溶性果胶含量增加缓慢。上述结果表明,辐照可以通过调节果胶在果实细胞壁中的溶解来保持细胞壁的完整性,从而减少果实在贮藏过程中的软化。
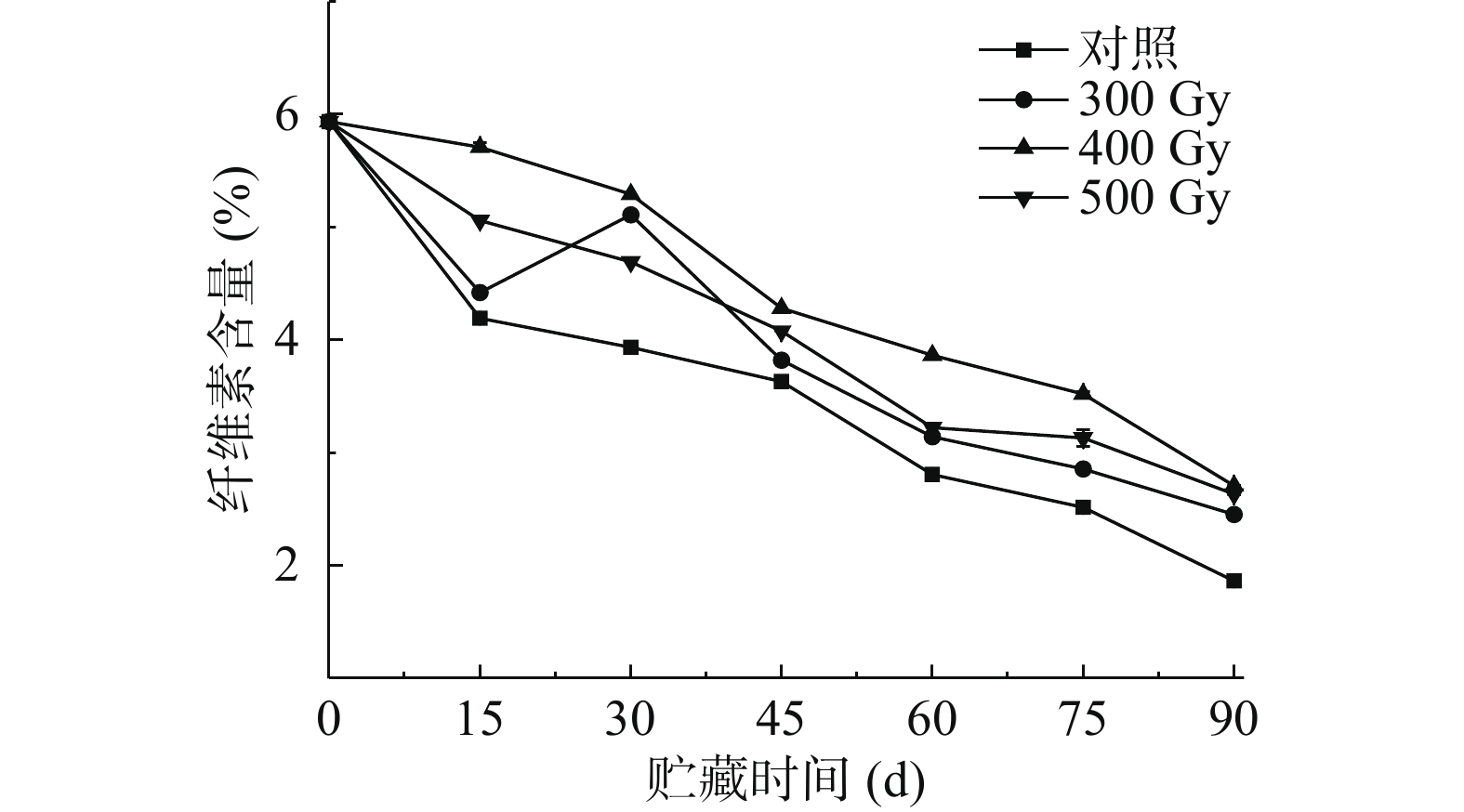
2.3 电子束辐照对猕猴桃贮藏期间纤维素含量的影响
纤维素是构成果实细胞壁的另一重要部分,其分解会促进果实变软。如图3所示,猕猴桃纤维素含量随着贮藏时间增加呈现降低趋势,这与在梨[24]和荔枝[25]中变化类似。贮藏期间,辐照组果实纤维素含量始终高于对照组,差异显著(P<0.05)。各组果实纤维素含量均在贮藏第90 d时降到最低,从高到低依次是400 Gy>500 Gy>300 Gy>对照组,与猕猴桃初始纤维素含量(5.94%)相比分别下降了3.23%、3.31%、3.49%和4.07%。在辐照组中,400 Gy组果实纤维素含量在整个贮藏期始终保持在最高水平。结果表明适宜剂量的电子束辐照能够维持贮藏期间猕猴桃果实的纤维素含量,更好的保持细胞壁结构的完整性。表2相关性分析结果显示,对照组、300、400、500 Gy组果实硬度和纤维素含量呈极显著正相关(r=0.931**、r=0.925**、r=0.970**、r=0.972**)。
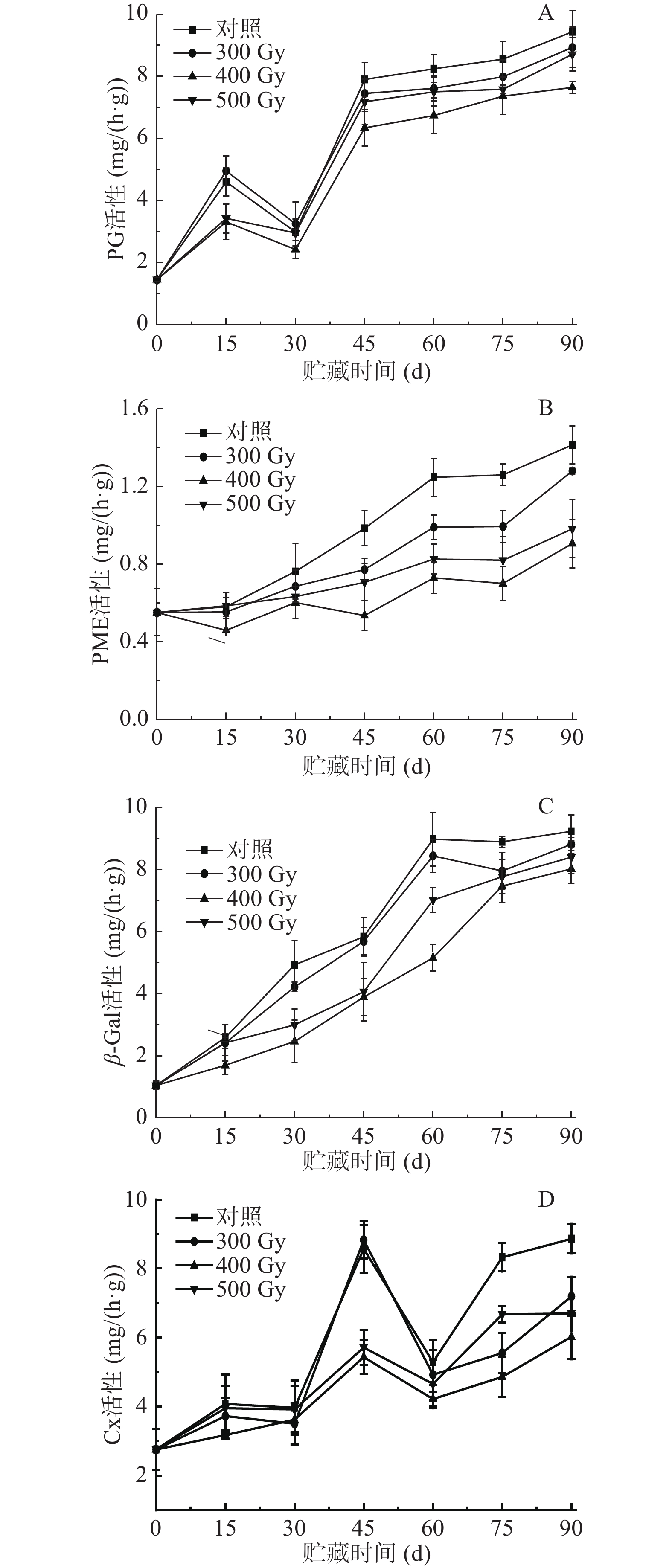
2.4 电子束辐照对猕猴桃贮藏期间细胞壁降解酶活性的影响
PG作为主要的细胞壁降解酶之一,能作用于酯化的高半乳糖醛酸,使细胞壁结构破坏而使果实软化。PME使果胶去甲酯化,催化生成高半乳糖醛酸,为PG提供反应底物[26]。如图4A所示,采后猕猴桃果实PG活性总体呈上升趋势。第0 d时,各组PG活性最低,值为1.46 mg/(h·g)。0~15 d,四组果实PG活性快速上升,15~30 d缓慢下降,30~90 d先快速上升后变为缓慢上升。贮藏0~90 d期间,辐照组猕猴桃PG活性始终低于对照组,从高到低排序为对照组>300 Gy>500 Gy>400 Gy。各组猕猴桃PG活性均在贮藏第90 d时达到峰值,分别为对照组(9.43 mg/(h·g))、300 Gy(8.93 mg/(h·g))、500 Gy(8.71 mg/(h·g))、400 Gy(7.64 mg/(h·g))。研究发现适宜剂量的电子束辐照能使PG活性维持在较低水平,尤其是在贮藏中后期,抑制效果更显著,这可能是由于电子束辐照使酶分子构象发生了变化,降低酶活性,从而可缓解原果胶的水解。由表2可知,各组猕猴桃PG活性与原果胶含量呈显著负相关(P<0.05),与果实硬度、纤维素含量均呈极显著负相关(P<0.01);400 Gy组与可溶性果胶含量呈显著正相关(P<0.05),其他三组与可溶性果胶含量极显著正相关(P<0.01),说明PG对促进果实软化发挥了重要作用。
如图4B所示,采后猕猴桃果实PME活性随着贮藏时间延长呈不断上升趋势。贮藏0~15 d,400 Gy组果实PME活性显著低于其他三组(P<0.05);从第30 d开始至贮藏结束,辐照组猕猴桃PME活性始终低于对照组,差异显著(P<0.05);而在辐照组果实中,PME活性从高到低依次是300 Gy>500 Gy>400 Gy,表明电子束辐照一定程度上可抑制PME活性的上升,减少了PG作用底物,从而保持细胞壁组分不被解聚。表2结果显示,各组猕猴桃PME活性与果实硬度呈极显著负相关(P<0.01),与原果胶含量呈显著负相关(P<0.05);对照组、400、500 Gy果实PME活性与可溶性果胶含量呈极显著正相关(P<0.01),而300 Gy组二者呈显著正相关(P<0.05);对照组、300、500 Gy果实PME活性与纤维含量呈极显著负相关(P<0.01),而400 Gy组二者呈显著负相关(P<0.05)。Martins等[27]研究表明,经1030 Gy的γ射线处理后的桃果实,PG和PME活性在其贮藏期间不受辐照的影响,说明不适宜剂量的辐照对延缓果实软化作用没有积极影响。陈召亮等[28]发现用2 kGy以上剂量的电子束辐照处理草莓,显著降低了PG、PME和Cx活性,延缓细胞壁的降解,这一结果与本文一致。
β-Gal可以去除细胞壁多糖侧链中的半乳糖残基,促进细胞壁结构的解体。如图4C所示,四组果实β-Gal活性在贮藏0~90 d内不断上升,至90 d时达到峰值,对照组、300、400和500 Gy组分别为9.23、8.81、8.02和8.39 mg/h·g。在整个贮藏期,辐照组果实β-Gal活性始终低于对照组,其中,贮藏15~75 d内,400和500 Gy组猕猴桃β-Gal活性显著低于对照组和300 Gy组(P<0.05)。在辐照组中,400 Gy组猕猴桃中β-Gal活性在整个贮藏过程保持最低水平,说明适宜剂量电子束辐照能够显著钝化β-Gal活性,减缓猕猴桃果实采后贮藏时的质地软化。相关性分析表明,各组猕猴桃β-Gal活性与果实硬度、原果胶含量和纤维素含量呈极显著负相关(P<0.01),与可溶性果胶含量呈极显著正相关(P<0.01)(表2),表明β-Gal活性增强与果实质地变软密切相关。
Cx通过将纤维素和半纤维素水解成葡萄糖分子来破坏细胞壁结构。如图4D所示,猕猴桃果实Cx活性整体上呈上升趋势,说明在贮藏过程中果实纤维素含量会不同程度降低。前15 d内,400 Gy组Cx活性显著低于其他组(P<0.05);贮藏第30~60 d,400和500 Gy组Cx活性显著低于对照组和300 Gy组(P<0.05),组间差异不显著(P>0.05);之后,各组Cx活性均明显升高,至贮藏结束,对照组Cx活性达到最高,值为8.87 mg/h·g,分别是300、400和500 Gy组的1.23、1.47倍和1.32倍,组间差异显著(P<0.05)。电子束作为一种非热加工方式,并不能使果实温度达到酶的失活的温度,而是通过电子枪发出的高能电子束直接破坏酶的空间结构致其失活。由表2可知,对照组猕猴桃Cx活性与果实硬度、原果胶、可溶性果胶、纤维素含量呈显著相关(P<0.05),而在300 Gy辐照组果实中相关性不显著;400 Gy辐照组中Cx活性与果实硬度、原果胶、可溶性果胶含量呈显著相关(P<0.05),与纤维素含量呈极显著相关(P<0.01)。相比对照组,电子束辐照能使猕猴桃果实Cx活性在贮藏期间保持较低水平,有效抑制纤维素被降解,维持细胞壁结构。这与陆仙英等[29]以3和6 kJ/m2的短波紫外线(UV-C)照射香梨时Cx活性显著低于对照组的结果相类似。
果实软化主要是由细胞壁降解相关酶对细胞壁的水解引起的,因此采后果实酶活性的控制对于延长货架期至关重要。SINGH等[30]研究了腐胺(PUT)在1、2和3 mmol/L条件下对梨果采后浸泡处理的影响,结果表明2和3 mmol/L的PUT能够抑制PME和Cx的活性,保持梨果实品质。TANG等[31]以红枣为原料,用褪黑素处理后发现抑制了果实PG、PME、β-Gal和Cx活性以及可溶性果胶的产生,并保持原果胶含量,从而延缓果实衰老。GE等[32]在探究磷酸三钠(0.5 g/L)处理对枣果软化的影响时也有相同的结果。上述结果表明,不同的处理方式均不同程度抑制了细胞壁降解酶活性的升高,减缓了果实果胶和纤维素的降解,延缓了猕猴桃后熟软化进程。
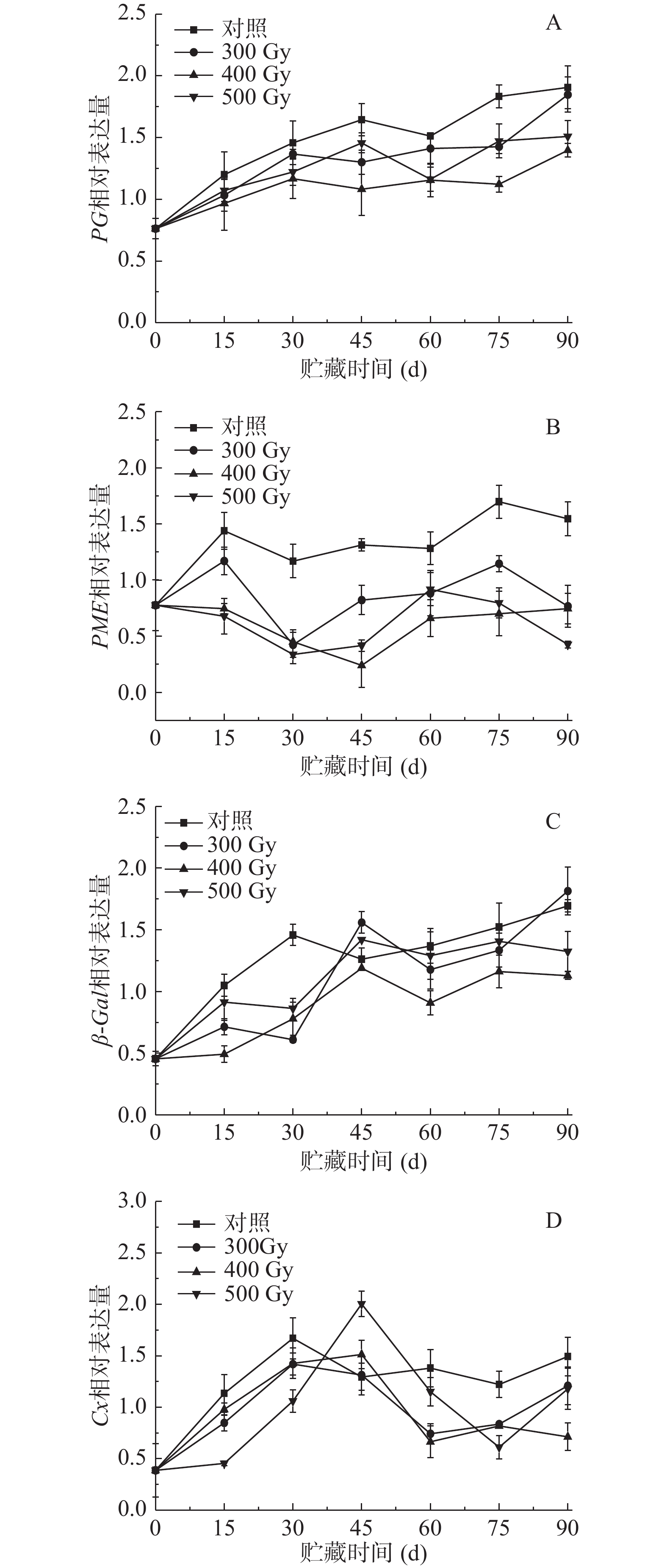
2.5 电子束辐照对猕猴桃贮藏期间细胞壁降解酶基因表达的影响
如图5A所示,在冷藏过程中,PG表达量在对照果和辐照果中均有所增加,辐照组猕猴桃PG表达量始终低于对照组。其中,贮藏0~15 d,辐照组果实PG表达量显著低于对照组,但各辐照组之间差异不显著(P>0.05);从第30 d开始至贮藏结束,四组果实PG表达量差异显著(P<0.05),说明采后电子束辐照对猕猴桃冷藏期间PG调控明显,基本维持在较低水平,特别是400 Gy电子束辐照对于抑制PG表达量的增加效果最明显。表2相关性分析显示,对照组中PG表达量与果实硬度、原果胶、可溶性果胶、纤维素含量呈极显著相关(P<0.01),在500 Gy组中呈显著相关(P<0.05);300和400 Gy组中,PG表达量与果实硬度、可溶性果胶、纤维素含量呈显著相关(P<0.05),而与原果胶含量呈极显著相关(P<0.05)。
如图5B所示,随着猕猴桃采后贮藏时间的延长,PME基因表达量不断提高。贮藏前期(0~30 d),对照组和300 Gy组PME表达量均呈先升高后降低趋势,而400和500 Gy组开始缓慢降低,组间差异显著(P<0.05)。贮藏中后期(30~90 d),四组果实PME表达量随着贮藏时间延长而不断增加。总体而言,各组猕猴桃PME表达水平从高到低依次是对照组>300 Gy>500 Gy>400 Gy,即辐照组在整个贮藏期均显著低于对照组(P<0.05),且辐照组间也存在显著差异(P<0.05)。表2显示,对照组中PME表达量与原果胶、纤维素含量呈显著负相关(P<0.05),与果实硬度、可溶性果胶相关性不显著;而辐照组中五个指标相关性都不显著。可见,与对照相比,不同剂量的电子束辐照对猕猴桃PME基因相对表达量抑制效果明显。WANG等[33]的研究结果表明,壳聚糖涂膜处理对草莓果实冷藏过程中延缓软化效果明显,主要归因于PG和PME活性以及PG1和PME1转录水平受到抑制。POMBO等[34]研究报道紫外-碳辐射对草莓果实软化的影响可能与处理后细胞壁降解相关基因转录的减少有关。上述结果表明,不同的保鲜方式均有效抑制了果实采后贮藏过程中PG和PME基因的表达,进而减缓软化速率。
如图5C所示,整个贮藏期,猕猴桃果实β-Gal相对表达量呈上升趋势,到贮藏第30 d,辐照组显著低于对照组(P<0.05);之后,400 Gy组显著低于其他组(P<0.05);贮藏第90 d时,对照组、300、400和500 Gy组β-Gal相对表达量分别增加了1.67、1.81、1.13和1.32,可知400 Gy组β-Gal基因表达量较其他组β-Gal表达量上升更缓慢,说明电子束辐照剂量为400 Gy时能有效抑制β-Gal基因的表达。表2表明,对照组β-Gal相对表达量与硬度、可溶性果胶含量呈显著相关(P<0.05),与原果胶、纤维素含量呈极显著负相关(P<0.05);在300、400和500 Gy组中,β-Gal与硬度呈显著负相关(P<0.05)(表2)。
如图5D所示,在整个贮藏期,猕猴桃果实Cx基因表达水平呈先上升后降低趋势。其中,对照组和300 Gy组Cx基因在第30 d时达到最高表达量,分别为1.67和1.42,而400和500 Gy组在第45 d时达到峰值,分别为1.51和2.00。从60 d开始到贮藏结束,对照组Cx基因相对表达量显著高于辐照组(P<0.05),与原果胶含量呈显著负相关(r=−0.870*)(表2)。贮藏期间,500 Gy组果实Cx基因表达量与300和400 Gy组差异显著(P<0.05)。同时,剂量为400和500 Gy的电子束辐照延迟了猕猴桃果实Cx基因表达高峰的出现,且在贮藏大多数时期辐照组低于对照组,表明适宜剂量电子束辐照可以通过抑制猕猴桃Cx基因的表达来降低果实的软化速率。WANG等[35]研究显示MeJA处理的蓝莓果实表现出更高含量原果胶和纤维素,及更低水平的可溶性果胶。此外,MeJA处理显著抑制果实PG、PME、β-Gal和Cx活性和转录水平,保持果实硬度。SHI等[36]发现壳聚糖-水杨酸联合处理对保持葡萄柚果实硬度的作用可能归因于其抑制PG、PME、Cx和β-Gal活性及其基因表达的能力。以上结果表明,电子束辐照、MeJA处理和壳聚糖-水杨酸联合处理可以通过抑制细胞壁降解酶活性及其基因表达水平来调节果实细胞壁多糖降解过程,从而减缓贮藏期间果实硬度下降。
3. 结论
果实细胞壁组分降解引起猕猴桃软化,细胞壁降解酶是加速果实后熟软化的重要原因。研究结果表明,高能电子束辐照有效延缓了‘海沃德’猕猴桃原果胶和纤维素含量的下降及可溶性果胶含量的上升,降低了PG、PME、β-Gal和Cx活性。同时,电子束辐照通过抑制PG、PME、β-Gal和Cx基因的表达水平,维持果实硬度,延长猕猴桃采后贮藏期。相比于300和500 Gy,400 Gy剂量的电子束辐照对猕猴桃细胞壁水解酶活性及其基因相对表达量具有更显著的调控作用,从而抑制了猕猴桃果实原果胶和纤维素的降解,保持细胞壁结构完整,延迟了果实软化进程。
-
表 1 定量RT-PCR引物
Table 1 Primers used for qRT-PCR
基因编号 基因 上游引物 下游引物 产物长度(bp) GU327819.1 PME CCCAACCACGAAACAGCAAC CACTTGCTAGGGGTCTTGCC 167 KY129958.1 PG AACACGAACATTGCTTGCGG GTGTCGTGCATTGTGGTGTC 179 Achn234201 Cx AATCCAAATGTTGCGCTCGG CGAGGTAGTGACCAAGCCAG 150 Achn135641 β-Gal TCTCCAAACGCAGTCTCGTC TGATCCACGCTTGTCCCTTC 160 DQ682826.1 Actin CCTTCGTCTTGACCTTGCTG TCTTTGCTGTCTCCAGCTCC 170 表 2 果实硬度、细胞壁组分、酶活性及其基因表达之间的相关性分析
Table 2 Correlation analysis of fruit firmness, cell wall components, enzyme activities and gene expressions
剂量(Gy) 指标 硬度(kg/cm2) 原果胶
(%)可溶性果胶
(%)纤维素
(%)0(对照) 硬度 Firmness — 0.865* −0.958** 0.931** 酶活性 PG −0.901** −0.830* 0.956** −0.912** PME −0.991** −0.844* 0.969** −0.923** β-Gal −0.988** −0.912** 0.960** −0.950** Cx −0.790* −0.778* 0.874* −0.793* 基因表达 PG −0.885** −0.971** 0.902** −0.950** PME −0.706 −0.769* 0.677 −0.850* β-Gal −0.817* −0.974** 0.795* −0.935** Cx −0.553 −0.870* 0.574 −0.743 300 硬度 Firmness — 0.911** −0.963** 0.925** 酶活性 PG −0.895** −0.839* 0.896** −0.981** PME −0.943** −0.851* 0.872* −0.891** β-Gal −0.982** −0.941** 0.964** −0.935** Cx −0.639 −0.611 0.747 −0.674 基因表达 PG −0.852* −0.932** 0.869* −0.837* PME −0.138 0.04 0.028 −0.37 β-Gal −0.857* −0.776* 0.876** −0.889** Cx −0.256 −0.578 0.461 −0.275 400 硬度 Firmness — 0.902** −0.976** 0.970** 酶活性 PG −0.917** −0.856* 0.870* −0.948** PME −0.887** −0.762* 0.901** −0.873* β-Gal −0.976** −0.901** 0.986** −0.977** Cx −0.787* −0.825* 0.784* −0.910** 基因表达 PG −0.776* −0.902** 0.827* −0.830* PME −0.130 0.196 0.186 0.000 β-Gal −0.799* −0.882** 0.769* −0.874* Cx 0.203 −0.214 −0.169 0.075 500 硬度 Firmness — 0.910** −0.975** 0.972** 酶活性 PG −0.925** −0.869* 0.914** −0.956** PME −0.960** −0.872* 0.957** −0.966** β-Gal −0.989** −0.922** 0.962** −0.984** Cx −0.875** −0.836* 0.926** −0.893** 基因表达 PG −0.766* −0.851* 0.861* −0.832* PME −0.087 0.116 −0.126 0.019 β-Gal −0.822* −0.863* 0.828* −0.886** Cx −0.321 −0.424 0.395 −0.412 注:*为显著相关(P<0.05);**为极显著相关(P<0.01)。 -
[1] 李琳, 罗安伟, 李圆圆, 等. 氯吡苯脲和O3处理‘秦美’猕猴桃采后生理品质与电学特性的关系[J]. 食品科学,2019,40(5):258−266. [LI L, LUO A W, LI Y Y, et al. The relationship between postharvest physiological quality and electrical characteristics of 'Qinmei' kiwifruit treated with chlorfenuron and O3[J]. Food Science,2019,40(5):258−266. doi: 10.7506/spkx1002-6630-20171214-175 [2] 董晓庆, 刘洪滩, 朱守亮, 等. 1-MCP结合自发气调包装对‘空心李’果实软化和细胞壁代谢的影响[J]. 中国农学通报,2020,36(22):129−135. [DONG X Q, LIU H T, ZHU S L, et al. Effects of 1-MCP combined with spontaneous modified atmosphere packaging on fruit softening and cell wall metabolism of 'hollow plum'[J]. Chinese Agricultural Science Bulletin,2020,36(22):129−135. [3] IMSABAI W, KETSA S, VAN-DOORN W G. Physiological and biochemical changes during banana ripening and finger drop[J]. Postharvest Biology and Technology,2006,39(2):211−216. doi: 10.1016/j.postharvbio.2005.10.001
[4] HU H L, ZHOU H S, LI P X. Lacquer wax coating improves the sensory and quality attributes of kiwifruit during ambient storage[J]. Scientia Horticulturae,2019,244:31−41. doi: 10.1016/j.scienta.2018.09.026
[5] 朱婷婷, 陈景丹, 方筱琴, 等. 低温贮藏对猕猴桃果实成熟软化相关基因表达影响[J]. 核农学报,2020,34(10):2199−2208. [ZHU T T, CHEN J D, FANG X Q, et al. Effects of low temperature storage on the expression of genes related to kiwi fruit ripening and softening[J]. Journal of Nuclear Agriculture,2020,34(10):2199−2208. doi: 10.11869/j.issn.100-8551.2020.10.2199 [6] HU H L, LI P X, WANG Y N, et al. Hydrogen-rich water delays postharvest ripening and senescence of kiwifruit[J]. Food Chemistry,2014,156(1):100−109.
[7] 邓文敏, 陈浩, 裴颖, 等. 高能电子加速器在食品辐照加工中的应用分析[J]. 核农学报,2012,26(6):919−923. [DENG W M, CHEN H, PEI Y, et al. Application analysis of high-energy electron accelerator in food irradiation processing[J]. Journal of Nuclear Agriculture,2012,26(6):919−923. doi: 10.11869/hnxb.2012.06.0919 [8] GRASSO E M, URIBE-RENDON R M, LEE K. Inactivation of Escherichia coli inoculated onto fresh-cut chopped cabbage using electron-beam processing[J]. Journal of Food Protection,2011,74:115−118. doi: 10.4315/0362-028X.JFP-10-281
[9] PONGSRI R, AIAMLA-OR S, SRILAONG V, et al. Impact of electron-beam irradiation combined with shellac coating on the suppression of chlorophyll degradation and water loss of lime fruit during storage[J]. Postharvest Biology and Technology,2020,172:111364.
[10] KONG Q L, WU A Z, QI W Y, et al. Effects of electron-beam irradiation on blueberries inoculated with Escherichia coli and their nutritional quality and shelf life[J]. Postharvest Biology and Technology,2014,95:28−35. doi: 10.1016/j.postharvbio.2014.04.004
[11] NAM H A, RAMAKRISHNAN S R, KWON J H. Effects of electron-beam irradiation on the quality characteristics of mandarin oranges (Citrus unshiu (Swingle) Marcov) during storage[J]. Food Chemistry,2019,286:338−345. doi: 10.1016/j.foodchem.2019.02.009
[12] 代守鑫. 不同剂量电子束辐照处理对甜樱桃的保鲜效果[J]. 食品与发酵工业,2019,45(20):232−236. [DAI S X. Effects of different doses of electron beam irradiation on the preservation of sweet cherries[J]. Food and Fermentation Industries,2019,45(20):232−236. [13] KIM K H, KWON J S, LEE J O, et al. Physicochemical changes of electron beam-irradiated Korean kiwifruits at low dose levels[J]. Journal of the Korean Society of Food Science and Nutrition,2007,36(5):603−608. doi: 10.3746/jkfn.2007.36.5.603
[14] 周慧娟, 叶正文, 施春晖, 等. 高能电子辐照对猕猴桃保鲜效果的影响[J]. 中国农学通报,2015,31(25):133−138. [ZHOU H J, YE Z W, SHI C H, et al. The effect of high-energy electron irradiation on the preservation of kiwifruit[J]. Chinese Agricultural Science Bulletin,2015,31(25):133−138. doi: 10.11924/j.issn.1000-6850.casb15020106 [15] 黄天姿, 梁锦, 王丹, 等. 电子束辐照对猕猴桃品质及抗性系统的影响[J]. 食品科学,2021,42(9):70−76. [HUANG T Z, LIANG J, WANG D, et al. Effects of electron beam irradiation on the quality and resistance system of kiwifruit[J]. Food Science,2021,42(9):70−76. doi: 10.7506/spkx1002-6630-20200505-031 [16] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化实验指导[M]. 中国轻工业出版社, 2007. CAO J K, JIANG W W, ZHAO Y M. Guidance on postharvest physiological and biochemical experiments of fruits and vegetables[M]. China Light Industry Press, 2007.
[17] 李圆圆. 采前CPPU处理对猕猴桃采后品质及细胞超微结构的影响机制研究[D]. 杨凌: 西北农林科技大学, 2018:20. Li Y Y. Study on the effect mechanism of preharvest CPPU treatment on the quality and cell ultrastructure of kiwifruit after harvest[D]. Yang Ling: Northwest Sci-Tech University of Agriculture and Forestry, 2018: 20.
[18] 刘耀娜, 王毅, 毕阳, 等. 采前乙酰水杨酸处理对厚皮甜瓜果实后熟及软化的影响[J]. 中国农业科学,2017,50(10):1862−1872. [LIU Y N, WANG Y, BI Y, et al. Effects of preharvest acetylsalicylic acid treatment on ripening and softening of muskmelon fruits[J]. Chinese Agricultural Sciences,2017,50(10):1862−1872. doi: 10.3864/j.issn.0578-1752.2017.10.011 [19] MOSTAFAVI H A, MIRMAJLESSI S M, FATHOLLAHI H, et al. Integrated effect of gamma radiation and biocontrol agent on quality parameters of apple fruit: An innovative commercial preservation method[J]. Radiation Physics and Chemistry,2013,91:193−199. doi: 10.1016/j.radphyschem.2013.02.020
[20] TRUC N T, UTHAIRATANAKIJ A, SRILAONG V, et al. Effect of electron beam radiation on disease resistance and quality of harvested mangoes[J]. Radiation Physics and Chemistry,2020,180:109289.
[21] SUN X K, YANG Q, GUO W D, et al. Modification of cell wall polysaccharide during ripening of Chinese bayberry fruit[J]. Scientia Horticulturae,2013,160:155−162. doi: 10.1016/j.scienta.2013.05.048
[22] PRAKASH A, MANLEY J, DECOSTA S, et al. The effects of gamma irradiation on the microbiological, physical and sensory qualities of diced tomatoes[J]. Radiation Physics and Chemistry,2002,63(3):387−390.
[23] WANG C, GAO Y, TAO Y, et al. γ-irradiation treatment decreased degradation of cell-wall polysaccharides in blueberry fruit during cold storage[J]. Postharvest Biology and Technology,2017,131:31−38. doi: 10.1016/j.postharvbio.2017.04.012
[24] WANG Y, MAO H J, LV Y H, et al. Comparative analysis of total wax content, chemical composition and crystal morphology of cuticular wax in Korla pear under different relative humidity of storage[J]. Food Chemistry,2021,339:128097. doi: 10.1016/j.foodchem.2020.128097
[25] REN Y Y, SUN P P, WANG X X, et al. Degradation of cell wall polysaccharides and change of related enzyme activities with fruit softening in Annona squamosa during storage[J]. Postharvest Biology and Technology,2020,166:111203. doi: 10.1016/j.postharvbio.2020.111203
[26] SENECHAL F, WATTIER C, RUSTERUCCI C, et al. Homogalacturonan-modifying enzymes: Structure, expression, and roles in plants[J]. Journal of Experimental Botany,2014,65(18):5125−5160. doi: 10.1093/jxb/eru272
[27] MARTINS M A A, NIFEMI O P, CLARENCE M B, et al. Causes of irradiation-induced softening in peaches[J]. Radiation Physics and Chemistry,2018,152:107−113. doi: 10.1016/j.radphyschem.2018.08.012
[28] 陈召亮, 王海宏, 乔勇进. 电子束辐照对草莓灰霉病菌致病力及致病相关酶活性的影响[J]. 核农学报,2013,8:1156−1161. [CHEN Z L, WANG H H, QIAO Y J. Effects of electron beam irradiation on the pathogenicity and pathogenicity-related enzyme activities of Botrytis cinerea[J]. Journal of Nuclear Agriculture,2013,8:1156−1161. [29] 陆仙英, 刘长虹, 蒋振晖, 等. 采后UV-C处理对延缓香梨软化及相关酶活性的影响[J]. 中国食品学报,2012,12(7):134−139. [LU X Y, LIU C H, JIANG Z H, et al. Effects of postharvest UV-C treatment on delaying softening of fragrant pears and related enzyme activities[J]. Chinese Journal of Food Science,2012,12(7):134−139. doi: 10.3969/j.issn.1009-7848.2012.07.020 [30] SINGH V, JAWANDHA S K, GILL P P S, et al. Putrescine application reduces softening and maintains the quality of pear fruit during cold storage[J]. Acta Physiologiae Plantarum,2019,256:108623.
[31] TANG Q, LI C Y, GE Y H, et al. Exogenous application of melatonin maintains storage quality of jujubes by enhancing anti-oxidative ability and suppressing the activity of cell wall-degrading enzymes[J]. LWT-Food Science and Technology,2020,127:109431. doi: 10.1016/j.lwt.2020.109431
[32] GE Y H, ZHANG J H, LI C Y, et al. Trisodium phosphate delays softening of jujube fruit by inhibiting cell wall-degrading enzyme activities during ambient storage[J]. Scientia Horticulturae,2020,262:109059. doi: 10.1016/j.scienta.2019.109059
[33] WANG K, LI T T, CHEN S Q, et al. The biochemical and molecular mechanisms of softening inhibition by chitosan coating in strawberry fruit (Fragaria x ananassa) during cold storage[J]. Scientia Horticulturae,2020,271:109483. doi: 10.1016/j.scienta.2020.109483
[34] POMBO M A, DOTTO M C, MARTÍNEZ G A, et al. UV-C irradiation delays strawberry fruit softening and modifies the expression of genes involved in cell wall degradation[J]. Postharvest Biology and Technology,2009,51:141−148. doi: 10.1016/j.postharvbio.2008.07.007
[35] WANG H B, CHENG X, WU C E, et al. Retardation of postharvest softening of blueberry fruit by methyl jasmonate is correlated with altered cell wall modification and energy metabolism[J]. Scientia Horticulturae,2020,276:109752.
[36] SHI Z J, YANG H Y, JIAO J Y, et al. Effects of graft copolymer of chitosan and salicylic acid on reducing rot of postharvest fruit and retarding cell wall degradation in grapefruit during storage[J]. Food Chemistry,2019,283:92−100. doi: 10.1016/j.foodchem.2018.12.078





 下载:
下载:
 下载:
下载:
