Optimization of Polysaccharides, Nucleosides and Terpenes Production from Hericium erinaceus by Liquid Fermentation and Its Antioxidant Activity
-
摘要: 为优化猴头菌液体发酵产多糖、核苷、总萜的培养工艺,探究其抗氧化活性。以三种活性成分产量为指标,通过单因素实验筛选出合适的碳源、氮源、温度、转速、pH、接种量,以采用熵权法赋权计算3种活性成分产量的综合评分为响应值,通过Box-Behnken建立数学模型确定猴头菌液体发酵最佳条件,对发酵产物进行抗氧化活性评价。结果表明:最佳碳源为可溶性淀粉和玉米粉,氮源为酵母浸粉和山药汁,温度23.5 ℃,转速128 r/min,pH5.9,接种量8.5%,在该条件下,猴头菌液体发酵条件的综合评分为2.090,与模型预测综合评分2.164基本一致,多糖、核苷、总萜产量分别为5.12、1.17、0.42 mg/mL;发酵全液、发酵液、菌丝体(湿)对DPPH清除率的IC50值分别166、237、53 mg/mL,对ABTS+自由基清除率的IC50 值分别为68、55、72,500 mg/mL时总还原能力分别为0.711、0.708、0.841。本研究为猴头菌液体发酵的工业化生产奠定基础。Abstract: This paper aimed to optimize the culture technology of polysaccharide, nucleoside and total terpene produced by liquid fermentation of Hericium ericium, and explore its antioxidant activity.With the yield of three active ingredients as the index, the suitable carbon source, nitrogen source, temperature, rotational speed, pH and inoculation amount were screened out through single factor experiment. The comprehensive score of the yield of three active ingredients calculated by entropy weight method was used as the response value. A mathematical model was established by Box-Behnken to determine the optimal conditions for liquid fermentation of Hericium ericium. The antioxidant activity of the fermentation products was evaluated. The results showed that: The optimal carbon source was soluble starch and corn meal, the nitrogen source was yeast extract and yam juice, temperature 23.5 ℃, rotating speed 128 r/min, pH5.9, inoculation quantity 8.5%. Under these conditions, the comprehensive score of liquid fermentation condition of Hericium ericium was 2.090, which was basically consistent with the comprehensive score of 2.164 predicted by the model. The yield of polysaccharide, nucleoside and terpene were 5.12, 1.17 and 0.42 mg/mL. The IC50 values of DPPH scavenging rate of fermentation liquid, fermentation liquid and mycelium (wet) were 166, 237, 53 mg/mL, and the IC50 values of ABTS+ scavenging rate were 68, 55, 72 mg/mL. The total reducing capacities at 500 mg/mL were 0.711, 0.708 and 0.841. The study would lay a foundation for the industrialized production of Hericium ericium liquid fermentation.
-
猴头菌(Hericium erinaceus)是我国著名的药食两用真菌。猴头菌隶属真菌界担子菌门猴头菌科,广泛用于治疗胃溃疡、慢性胃炎等疾病。猴头菌味道鲜美、风味独特、含有丰富的营养成分,包括蛋白质、脂肪、纤维素、多糖、微量元素及8种人体必需的氨基酸[1-3]。猴头菌还具有多种功效与作用,猴头菌多糖有抗氧化、抗肿瘤、降血糖、抗衰老、提高免疫力等作用[4-6],猴头菌素等萜类物质具有抗氧化、抗菌、修复神经等功能[7-8],核苷类物质有防止心率失常、降胆固醇、抗氧化等作用[9]。有研究证明,猴头菌多糖、核苷、萜类物质具有清除ABTS+、DPPH等自由基活性,从而发挥其抗氧化作用[10-13]。目前,猴头菌是以传统的固体培养为主,但这种培养方式周期长、受环境影响大、产量低,不利于工厂化生产,而液体发酵培养可以在较短的时间内获得大量菌丝体及富含活性成分的发酵液,具有生产周期短、易于控制发酵条件、产量高等多种优势。目前,对猴头菌液体发酵条件优化的评价指标还停留在生物量的大小,未深入到活性成分。
本文以多糖、核苷、总萜产量为指标,筛选最佳碳源、氮源,考察培养温度、转速、pH、接种量对猴头菌液体发酵的影响,通过Box-Behnken试验确定猴头菌液体发酵的最佳工艺,并对发酵产物总的抗氧化活性进行评价,为猴头菌液体发酵的工业化生产奠定基础。
1. 材料与方法
1.1 材料与仪器
猴头菌(Hericium erinaceus) 由中国工业微生物菌种保藏管理中心提供;尿苷、腺苷、1,1-二苯基-2-三硝基苯肼( DPPH) 大连美仑生物技术有限公司;鸟苷、齐墩果酸 成都曼思特生物科技有限公司;2,2'-联氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS) 梯希爱化成工业发展有限公司;基础培养基:葡萄糖3%、酵母浸粉1.5%、KH2PO4 0.1%、MgSO4·7H2O 0.05%、维生素B1 0.01%。
ZXY-48恒温摇床 常州润华电器有限公司;MHP-160霉菌培养箱 上海精其仪器有限公司;UV-2550紫外分光光度计、LC-20A型高效液相色谱仪、SPD-M20A二极管阵列检测器 日本岛津公司;JM-LB50胶体磨 温州强忠机械设备有限公司。
1.2 实验方法
1.2.1 猴头菌液体种子的制备
用接种针刮取5块约0.5 cm×0.5 cm大小的菌块接入基础培养基中, 25 ℃恒温静置24 h后,140 r/min、温度25 ℃,摇床培养5~6 d。
1.2.2 猴头菌液体发酵培养基组分及培养条件的确定
1.2.2.1 猴头菌液体发酵培养基组分的筛选
调整基础培养基碳源葡萄糖为玉米粉、土豆浸提液、乳糖、可溶性淀粉和复合碳源(玉米粉0.5%+可溶性淀粉2.5%),调整氮源酵母浸粉为蛋白胨、黄豆芽汁、山药汁、黄豆粉、复合氮源(酵母浸粉1%+山药浸提液5%),接种量10%(V/V),25 ℃,120 r/min培养8 d,考察发酵全液中多糖、总萜及核苷的产量。
1.2.2.2 单因素实验确定猴头菌液体发酵条件
以1.2.2.1筛选出的培养基为优化培养基,考察不同培养条件对发酵全液中多糖、总萜、核苷产量的影响,分别设置接种量6%、8%、10%、12%、14%,初始pH 4、5、6、7、8,培养温度21、23、25、27、29 ℃,转速100、110、120、130、140 r/min。单因素按变量取值时,接种量、初始pH、培养温度、转速固定值分别为10%、6、25 ℃、120 r/min,分析各因素的影响。
1.2.2.3 Box-Behnken试验设计方案
在单因素实验结果的基础上,确定接种量、初始pH、培养温度、转速4个因素,结合响应面试验研究各因素及其交互作用对猴头菌液体发酵全液中多糖、总萜及核苷产量的影响,确定猴头菌液体发酵的最佳工艺条件。设计试验因素水平及编码值见表1。
表 1 Box-Behnken实验因素水平表Table 1. Box-Behnken experimental factor level table水平 因素 A 接种量(%) B 转速(r·min−1) C 初始pH D 温度(℃) −1 6 110 4 23 0 8 120 5 25 1 10 130 6 27 1.2.3 活性成分的测定
1.2.3.1 多糖
参照刘晓明等[14]方法,50 mL发酵全液加入5倍体积沸水浸提3 h,离心取上清液,减压浓缩至25 mL,加入5倍体积无水乙醇4 ℃静置过夜,抽滤,沉淀60 ℃干燥至恒重,得粗多糖备用,采用苯酚-硫酸法测定。
1.2.3.2 总萜
参照张琦等[15-16]方法,20 mL发酵全液加入5倍体积乙酸乙酯,超声30 min(30 ℃,160 W),离心取上清液,减压浓缩至10 mL备用,采用香草醛-浓硫酸法测定。
1.2.3.3 核苷
参照游静等[17]方法,取发酵全液10 mL加入2倍体积甲醇,离心取上清液备用,采用高效液相色谱法测定,色谱条件为:Inertsil ODS-SP C18柱(250 mm×4.6 mm,5μm);流动相:纯净水(A)-甲醇(B),梯度洗脱(0~5 min,0→5%B;5~30 min,5%B;30~35 min,5→7.5%B;35~60 min,7.5→21.3%B)。
活性成分产量(mg/mL)=发酵全液活性成分含量(mg/mL)-空白培养基活性成分含量(mg/mL)。
1.2.4 菌丝体干重测定
取100 mL发酵液,蒸馏水洗涤3次,收集菌丝体,75 ℃烘干称重。
1.2.5 抗氧化活性测定
参照薛山[18]方法,用蒸馏水分别将发酵全液、发酵液、菌丝体配制成质量浓度为500 mg/mL的混合液,均质备用。DPPH、ABTS自由基清除能力,总还原力测定方法参照何晋浙等[9]。
1.3数据处理
分别采用系统软SPSS和Design-Expert 8.0.6进行显著性和响应面分析。
2. 结果与分析
2.1 培养基组分筛选
2.1.1 碳源的筛选
碳源对猴头菌液体发酵全液中总萜、多糖、核苷产量的影响如表2所示,以复合碳源和可溶性淀粉为碳源的发酵全液中多糖产量最高,且与其他组差异显著(P<0.05)。碳源对核苷产量影响显著(P<0.05),其中复合组的核苷产量最高,土豆汁的核苷产量最低。复合组、乳糖、玉米粉的发酵全液中总萜产量最高。李卫卫等[19]发现玉米粉是促进猴头菌菌丝体生长的良好碳源,且在培养基中添加一些速效碳源会更有利于其生长。本实验将可溶性淀粉和玉米粉复配后发现复合组活性物质产量显著优于其它组(P<0.05),可溶性淀粉和玉米粉的复合碳源为猴头菌生长的最优碳源,可能是可溶性淀粉便于菌丝体吸收利用,玉米粉可为菌丝体的生长提供附着点,有利于菌丝体的生长和代谢产物的积累[19]。
表 2 碳源对猴头菌液体发酵的影响Table 2. Effects of carbon sources on liquid fermentation of Hericium ericium碳源 多糖(mg/mL) 核苷(mg/mL) 总萜(mg/mL) 葡萄糖 1.27±0.01f 0.14±0.01e 0.16±0.01c 玉米粉 3.48±0.08c 0.37±0.04b 0.21±0.01b 土豆浸提液 1.63±0.03e 0.08±0.01f 0.09±0.01d 乳糖 2.22±0.06d 0.20±0.01d 0.23±0.02ab 可溶性淀粉 3.85±0.02b 0.23±0.01c 0.11±0.01d 复合碳源 4.47±0.01a 0.57±0.03a 0.25±0.01a 注:同列不同字母表示有显著性差异(P<0.05);表3同。 2.1.2 氮源的筛选
不同氮源对猴头菌液体发酵全液中总萜、多糖、核苷产量的影响如表3 所示。复合氮源组的多糖、总萜、核苷产量显著高于其它组(P<0.05)。杨宁等[20]发现在猴头菌培养基中加入山药可促进菌丝体生长,但在本实验中发现以山药汁作为氮源,活性成分产量并不高,推测是山药中氮源不能满足猴头菌前期生长,影响活性成分的合成。Cui等[21]发现酵母抽提物对猴头菌菌丝体和胞外聚合物有显著影响,最优条件下菌丝体生物量为21.47 g/L、胞外聚合物1.837 g/L,本实验将山药汁和酵母浸粉复配作为复合氮源,三种活性成分产量均显著高于其他组(P<0.05),且菌丝体生物量为35.7 g/L,比Cui的研究提高了66.28%,可能是复合氮源中酵母浸粉为速效氮源,发酵前期可被快速吸收,山药汁在提供氮源的基础上还可提供Ca、Zn、Mg等生长因子[22],促进猴头菌的生长及代谢产物累积,综上所述,选定山药汁和酵母浸粉为氮源。
表 3 氮源对猴头菌液体发酵的影响Table 3. Effects of nitrogen sources on liquid fermentation of Hericium ericium氮源 多糖(mg/mL) 核苷(mg/mL) 总萜(mg/mL) 蛋白胨 1.23±0.07e 0.24±0.02e 0.19±0.01c 酵母浸粉 2.01±0.08d 0.35±0.03c 0.21±0.01c 黄豆芽汁 2.97±0.03c 0.27±0.02d 0.23±0.01b 山药汁 3.14±0.01b 0.18±0.01f 0.24±0.01b 黄豆粉 3.07±0.10c 0.37±0.03b 0.20±0.01c 复合氮源 3.85±0.03a 0.41±0.02a 0.27±0.01a 2.2 接种量对猴头菌液体发酵全液中总萜、多糖和核苷的影响
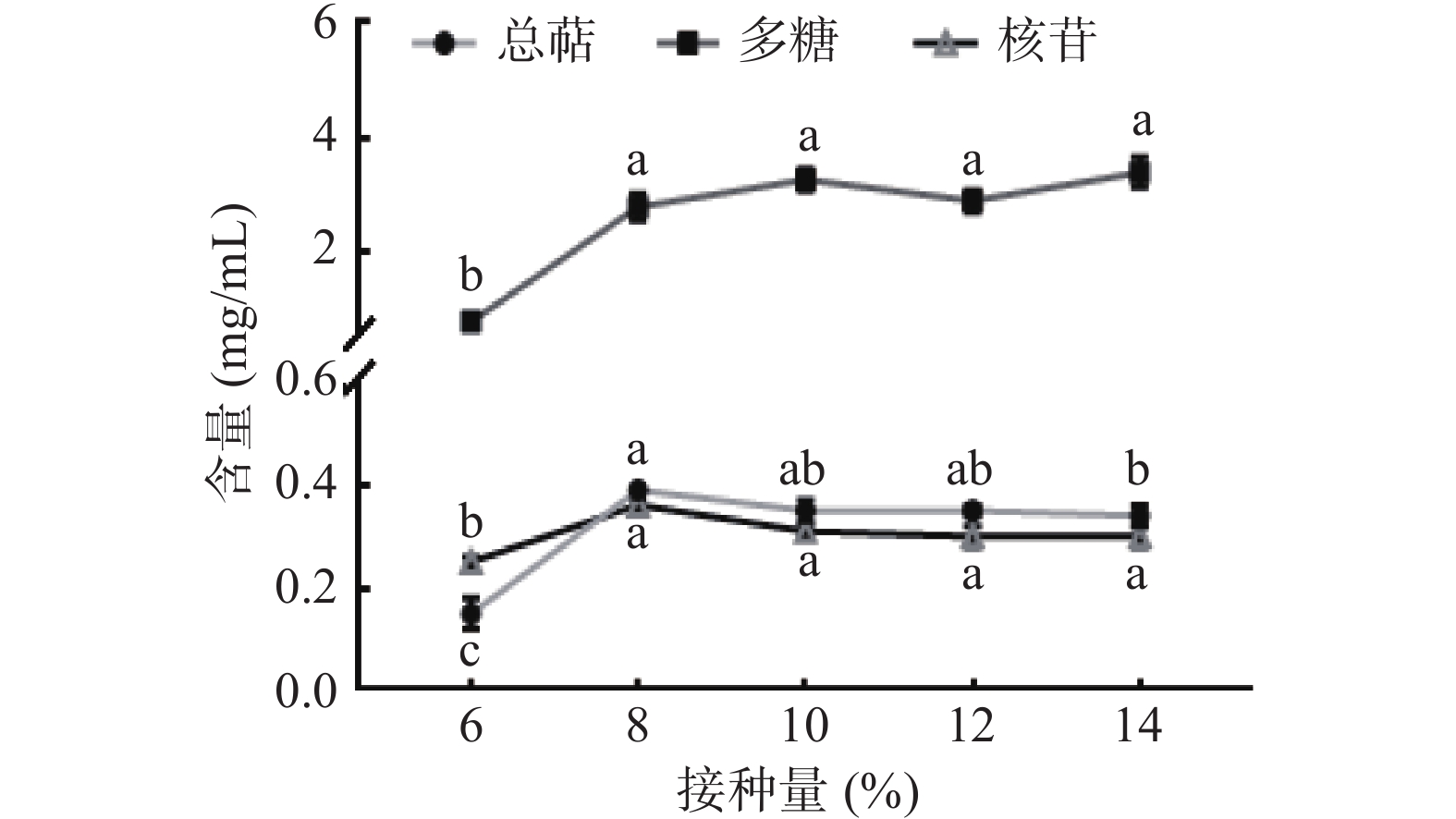
如图1所示,随着接种量的增加,三种活性物质产量均显著升高(P<0.05),当增加至8%时,总萜和核苷达到最高,后略微降低,推测原因是接种量大,菌丝生长点多,代谢产物多,但接种量过大,导致消耗营养物质速度加快,后期会抑制菌丝体生长及代谢产物累积。考虑生产成本,选择8%接种量为最佳参数。
2.3 转速对猴头菌液体发酵全液中总萜、多糖和核苷的影响
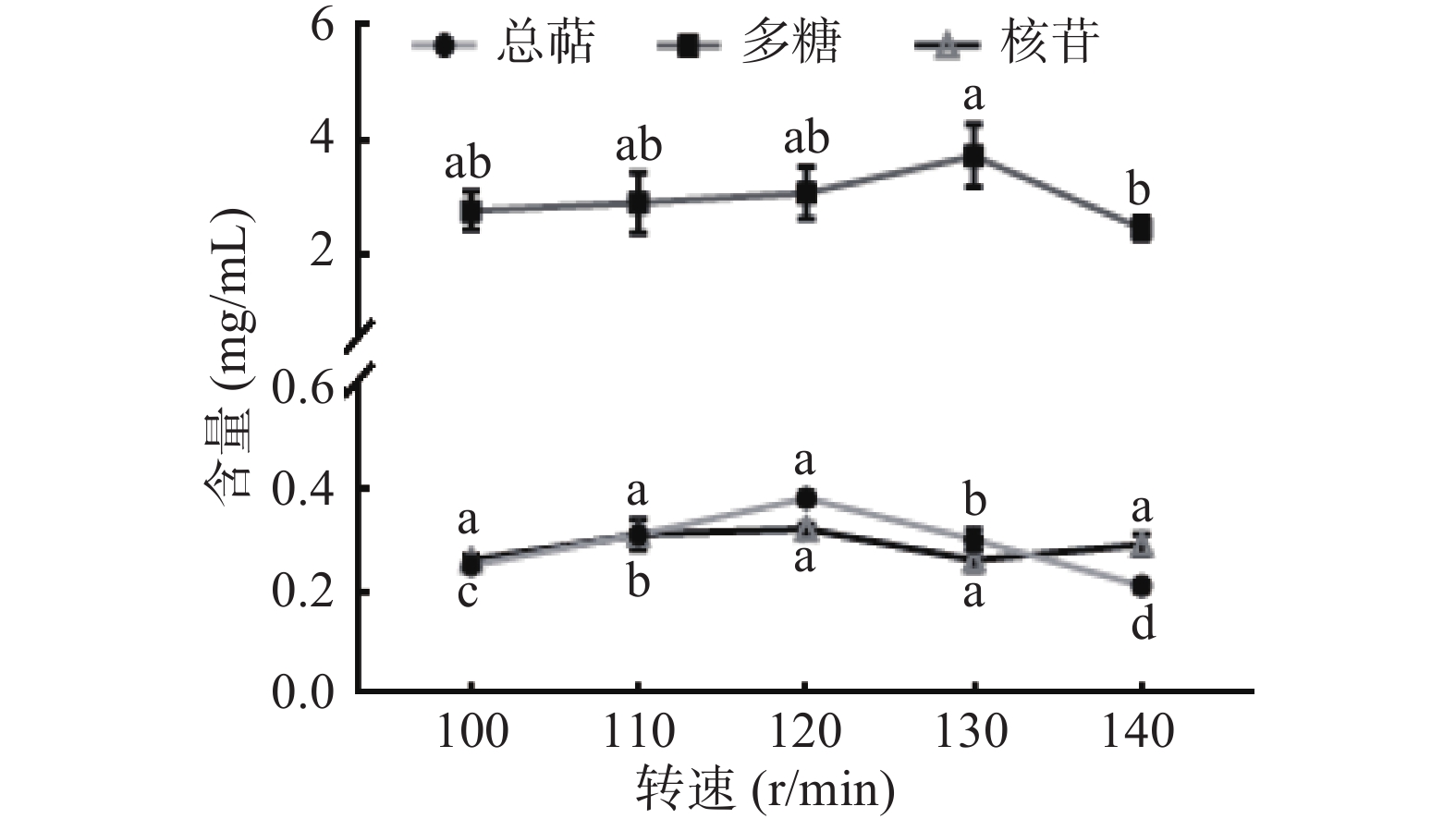
转速主要通过影响发酵环境中的溶氧量来控制猴头菌发酵过程[23]。由图2知,转速对核苷产量并没有显著性影响(P>0.05);多糖产量随着转速的增加而增加,在100~130 r/min无显著性差异(P>0.05),转速增至140 r/min时显著降低(P<0.05);总萜产量随着转速的增加呈现先增后降的趋势,在120 r/min时达到最高,在转速增至130 r/min时显著降低(P<0.05),推测是由于转速增加,溶氧量增大,菌丝体生长过快而消耗发酵液中多糖、萜类物质。综上所述,最终选定最佳转速为120 r/min。
2.4 初始pH对猴头菌液体发酵全液中总萜、多糖和核苷的影响
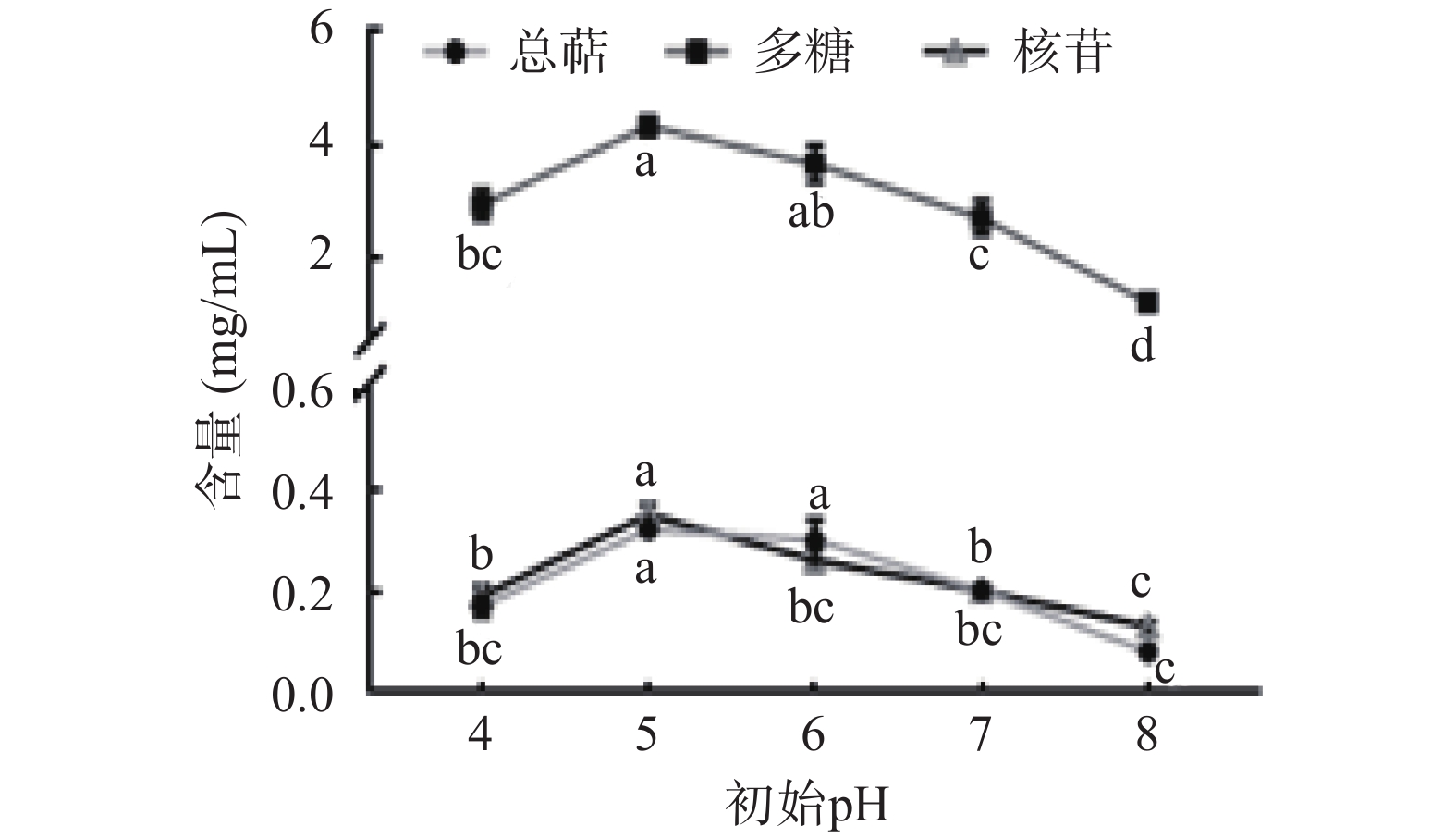
如图3所示,初始pH为5和6时,猴头菌发酵全液中多糖、总萜、核苷产量较高,随着pH的升高,活性物质的产量急剧降低,这是因为猴头菌在中等酸度环境下才能分解培养基中的有机物质,过碱的环境会影响到菌丝体酶的活性,阻碍菌体的新陈代谢[24]。初始pH为6时,核苷产量显著降低(P<0.05),有研究人员发现“酸胁迫”更有利于生物体内腺苷的积累,弱酸性条件下其生物合成关键酶的活性可以维持在较高水平[25]。综上所述,选定初始pH为5。
2.5 培养温度对猴头菌液体发酵全液中总萜、多糖和核苷的影响
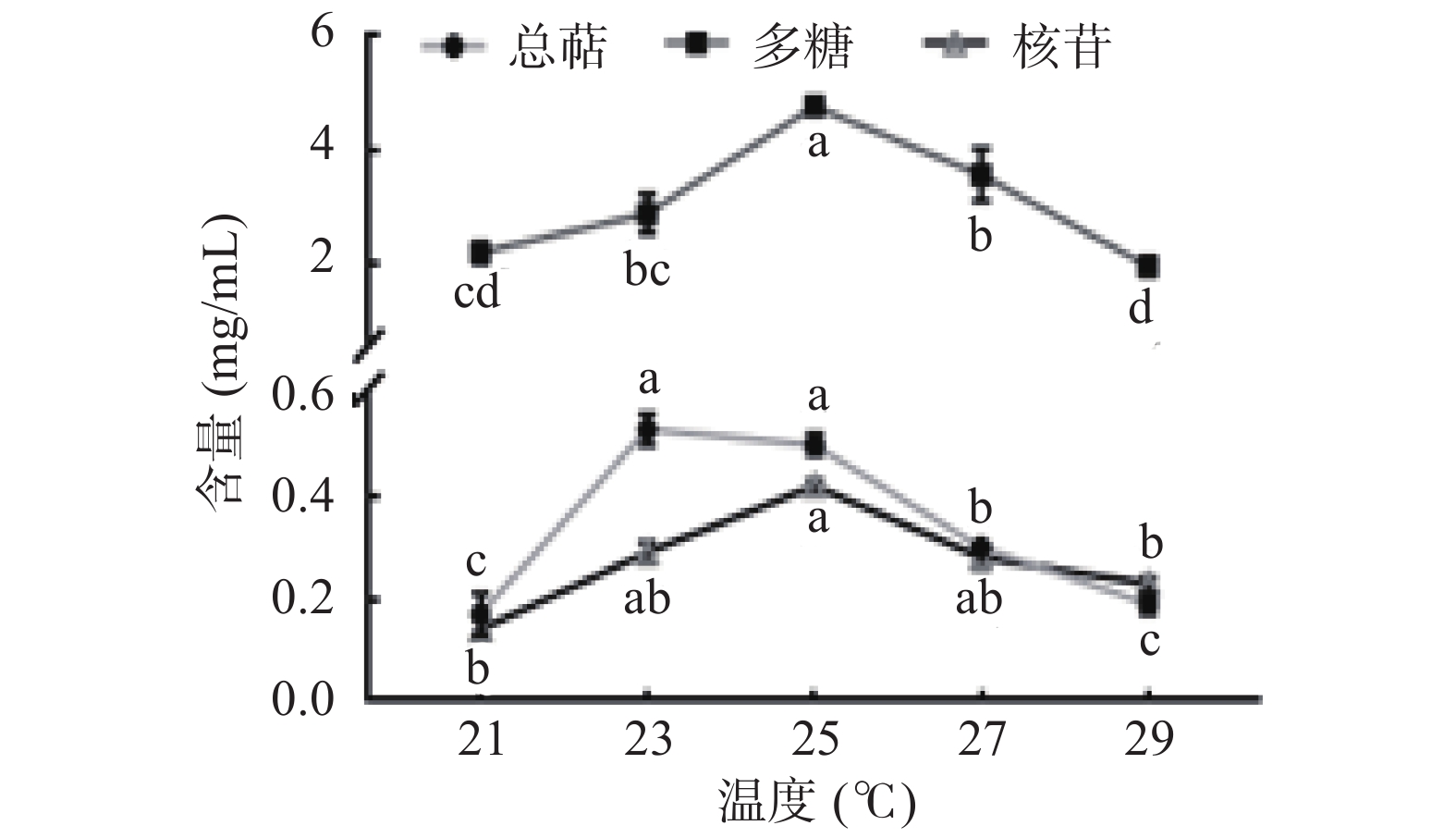
温度主要影响猴头菌发酵进程中某些酶的活性[26]。猴头菌液体发酵过程中多糖、总萜、核苷的产量随温度变化情况如图4所示,三种活性物质产量随温度的升高先增加后减少,多糖在25 ℃时显著高于其它温度(P<0.05),核苷产量在23、25、27 ℃时差异性不显著(P>0.05),Atila等[27]在探究温度对猴头菌生长发育的影响时发现,在25 ℃时,猴头菌具有良好的生长潜力,推测是在25 ℃时,纤维素酶、半纤维素酶、木质素酶等活性较高,可有效分解培养基中营养成分,促进活性物质合成。综上所述,选定25 ℃为最佳温度。
2.6 响应面试验
2.6.1 综合评分计算
熵权法是一种确定指标权重的客观赋权法,可确定多指标评价系统中各指标的权重。将各指标含量数据经归一化处理[指标成分= (实验值−最小值) /(最大值−最小值)],消除指标之间量级和量纲的影响后,熵权法[28]计算得到多糖产量、总萜产量、核苷产量的权重值分别是 0.2925、0.3111、0.3964。按照M=多糖产量×0.2925+总萜产量×0.3111+核苷产量×0.3964,计算不同试验号下各指标产量综合评分。
2.6.2 响应面结果
Box-Behnken设计与结果见表4,利用Design-Expert 8.0.6进行分析和多元回归拟合,建立以综合评分为目标函数的二次回归方程,并对回归方程进行方差分析和显著性检验。
表 4 响应面试验设计及结果Table 4. Response surface experimental design and results实验号 A 接种量(%) B转速(r/min) C初始pH D 温度(℃) 综合评分 1 −1 −1 0 0 1.03 2 1 −1 0 0 1.59 3 −1 1 0 0 1.26 4 1 1 0 0 1.06 5 0 0 −1 −1 1.14 6 0 0 1 −1 1.77 7 0 0 −1 1 1.35 8 0 0 1 1 1.86 9 −1 0 0 −1 1.32 10 1 0 0 −1 1.81 11 −1 0 0 1 1.45 12 1 0 0 1 0.89 13 0 −1 −1 0 1.15 14 0 1 −1 0 0.92 15 0 −1 1 0 1.14 16 0 1 1 0 2.17 17 −1 0 −1 0 1.41 18 1 0 −1 0 0.99 19 −1 0 1 0 1.32 20 1 0 1 0 1.51 21 0 −1 0 −1 1.15 22 0 1 0 −1 1.69 23 0 −1 0 1 1.71 24 0 1 0 1 0.9 25 0 0 0 0 1.69 26 0 0 0 0 1.4 27 0 0 0 0 1.89 28 0 0 0 0 1.69 29 0 0 0 0 1.73 2.6.3 方差分析
综合评分(M)与接种量(A)、转速(B)、初始pH(C)和温度(D)的二次多项回归方程如下:
Y=1.68+0.0050A+0.0192B+0.2342C−0.0600D−0.1900AB+0.1525AC−0.2625AD+0.3150BC−0.3375BD−0.0300CD−0.2429A2−0.2267B2−0.1067C2−0.0679D2
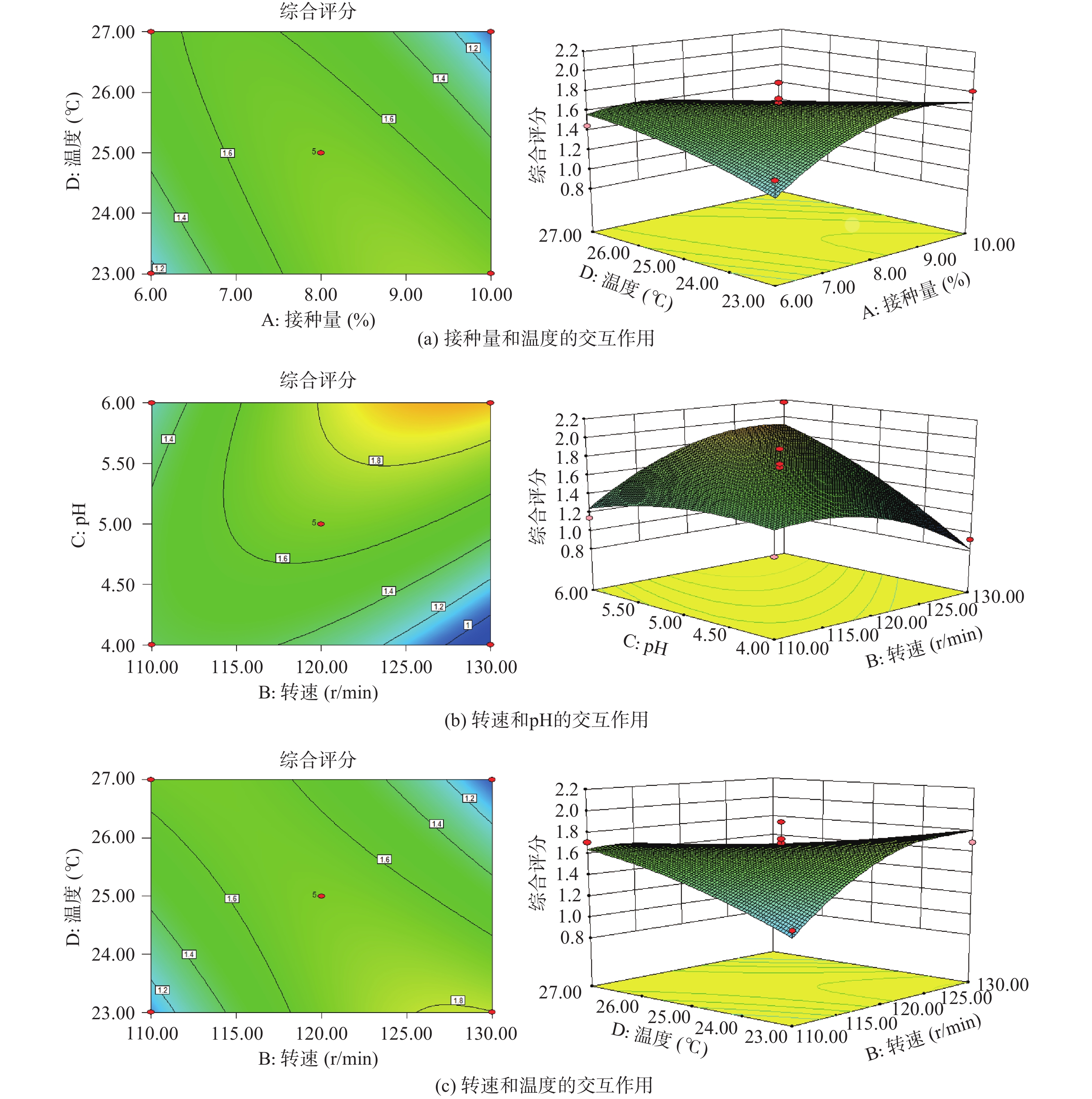
表5方差分析显示,该回归模型极显著(P<0.01),综合评分与各个变量之间存在极显著的线性相关,失拟性在置信区间95%水平上不显著,方程失拟度较小,可利用该模型预测综合评分与变量之间的关系。一次项C,交互项BC、BD影响极显著(P<0.01);交互项AD,平方项A2、B2影响显著(P<0.05)。
表 5 回归方程方差分析及显著性检验Table 5. Test of significance for regression equation coefficients of sensory evaluation来源 总平方和 自由度 均方 F P 显著性 模型 2.69 14 0.1918 4.31 0.0049 ** A 0.0003 1 0.0003 0.0067 0.9357 B 0.0044 1 0.0044 0.0990 0.7576 C 0.6580 1 0.6580 14.78 0.0018 ** D 0.0432 1 0.0432 0.9705 0.3413 AB 0.1444 1 0.1444 3.24 0.0933 AC 0.0930 1 0.0930 2.09 0.1703 AD 0.2756 1 0.2756 6.19 0.0260 * BC 0.3969 1 0.3969 8.92 0.0098 ** BD 0.4556 1 0.4556 10.24 0.0064 ** CD 0.0036 1 0.0036 0.0809 0.7830 A2 0.3828 1 0.3828 8.60 0.0109 * B2 0.3333 1 0.3333 7.49 0.0161 * C2 0.0738 1 0.0738 1.66 0.2188 D2 0.0299 1 0.0299 0.6722 0.4260 残差 0.6232 14 0.0445 失拟项 0.4980 10 0.0498 1.59 0.3469 不显著 纯误差 0.1252 4 0.0313 总和 3.31 28 注:*表示有显著性影响(P<0.05);**表示有极显著影响(P<0.01)。 2.6.4 交互作用分析
根据回归方程绘制等高线和响应面图,由响应面图可以直观地反映两因素间的交互作用,如图5所示,在交互项对综合评分的影响中,AB、AC和CD交互作用的响应面图坡度较平缓,等高线较为松散,交互作用不显著,与上述方差分析结果一致。当等高线为椭圆时表明交互作用较强,当等高线为圆形时则交互作用较弱[29]。由图a知,沿D因素轴方向的较陡,沿因素A轴方向较为平缓,说明与接种量相比,温度对三种活性物质产量影响更大,并且温度与接种量间的交互作用较强。由图b、c知,沿B、D因素轴方向较陡,则转速和温度对综合评分的影响程度较强,转速和pH对综合评分的影响次之,底部等高线为椭圆且较为精密,表明转速和pH间的交互作用显著。
2.6.5 最佳条件的验证试验
通过Design-Expert 8.0.6软件设计,得到综合评分的预测值为2.164,此时工艺参数为接种量8.542%、转速127.96 r/min、pH5.891、温度23.477 ℃。考虑实际方便,调整模型最优发酵工艺参数为:接种量8.5%、转速128 r/min、pH5.9、温度23.5 ℃。采用此优化工艺对猴头菌进行发酵,综合评分为2.090,与预测值相对误差为3.54%,在可接受的范围内。说明利用响应面优化法得到的回归模型发酵工艺参数能较准确地预测三种活性成分产量的综合评分,其结果真实可靠,重现性高。
2.7 发酵产物抗氧化活性评价
发酵产物中萜类、多糖、核苷类物质具有抗氧化活性,通过测定其对ABTS+、DPPH自由基清除能力和总还原力,对发酵产物总的抗氧化活性进行评价。
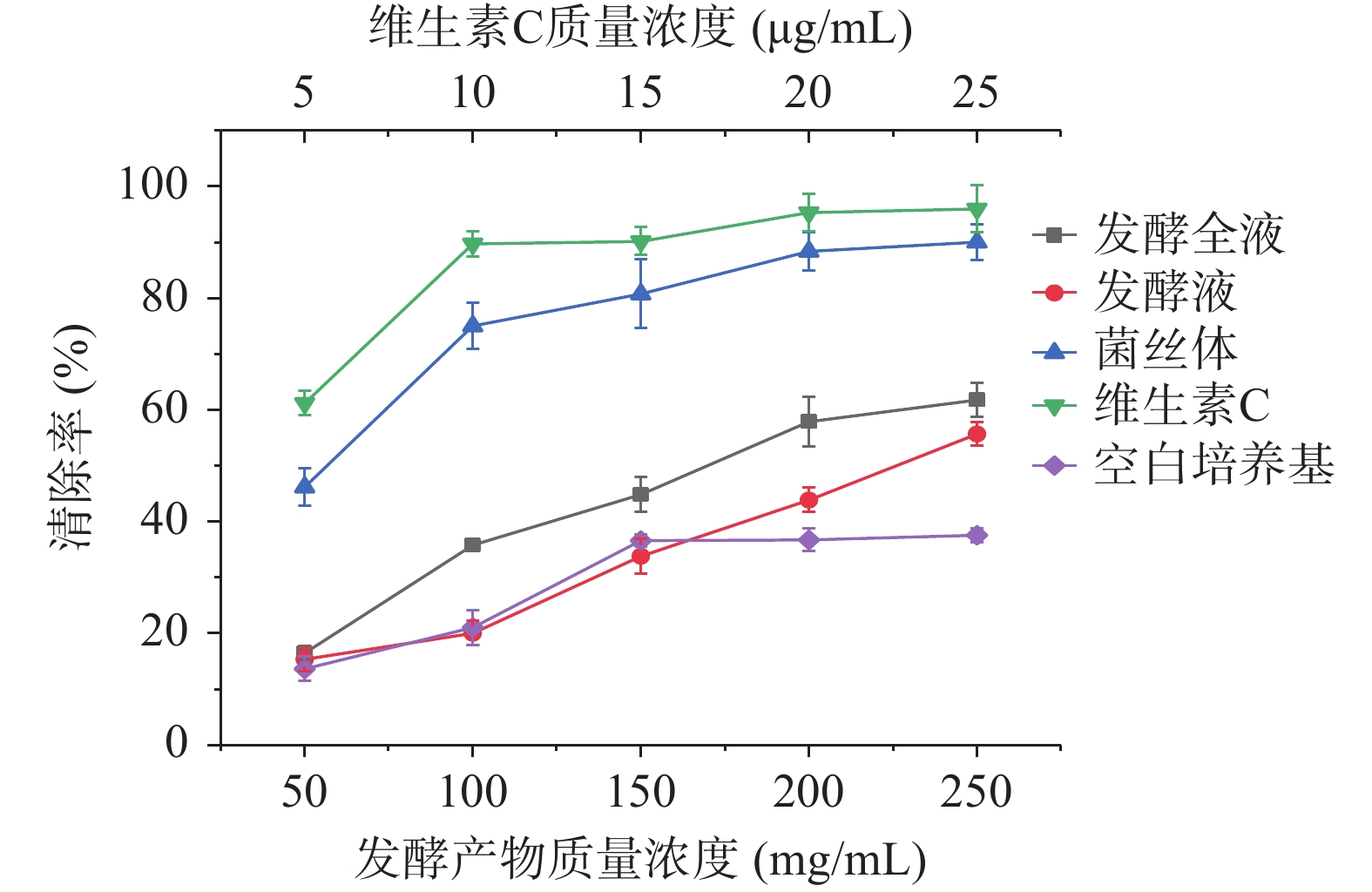
2.7.1 对DPPH自由基清除能力
如图6所示,发酵产物对DPPH自由基清除能力显著高于空白培养基(P<0.05),随着发酵全液、发酵液、菌丝体质量浓度的增加,各样品对DPPH自由基的清除能力增强,其IC50值分别为166、237、53 mg/mL,菌丝体对DPPH自由基清除能力显著高于发酵全液和发酵液(P<0.05),当菌丝体(湿)质量浓度为250 mg/mL时,清除率可达到90.06%±0.70%,趋近于质量浓度为10 μg/mL的维生素C溶液。
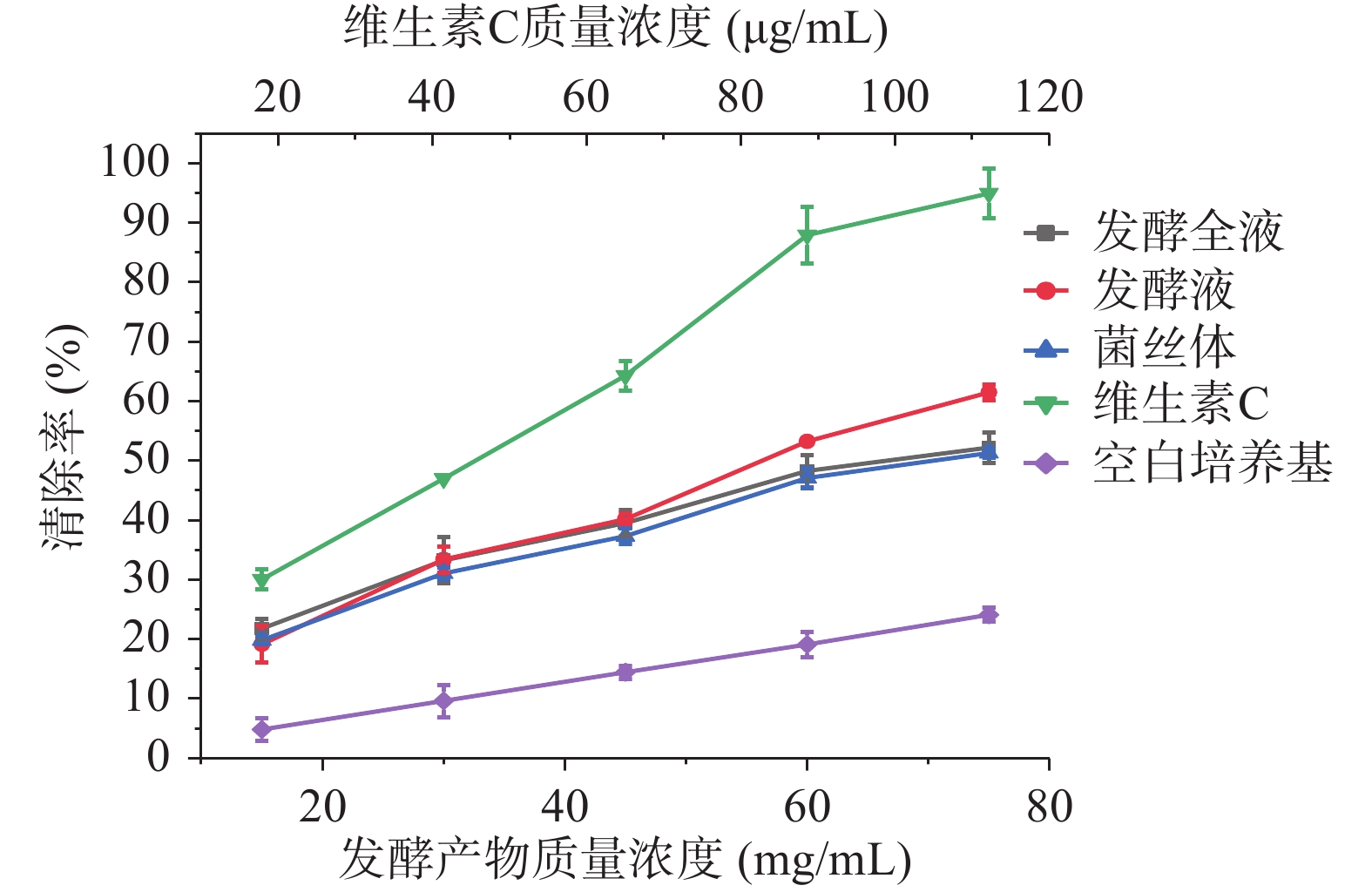
2.7.2 对ABTS+自由基清除能力
如图7所示,发酵全液、发酵液、菌丝体对ABTS+自由基清除能力显著高于空白培养基(P<0.05),随着质量浓度的增加,清除率增强趋势一致,其IC50值分别为68、55、72 mg/mL。发酵液对ABTS+自由基清除率最高,可见胞外代谢产物对ABTS+自由基清除能力较强,在发酵液质量浓度为75 mg/mL时,清除率可达61.49%±0.30%,显著高于发酵全液和菌丝体,低于维生素C(P<0.05)。
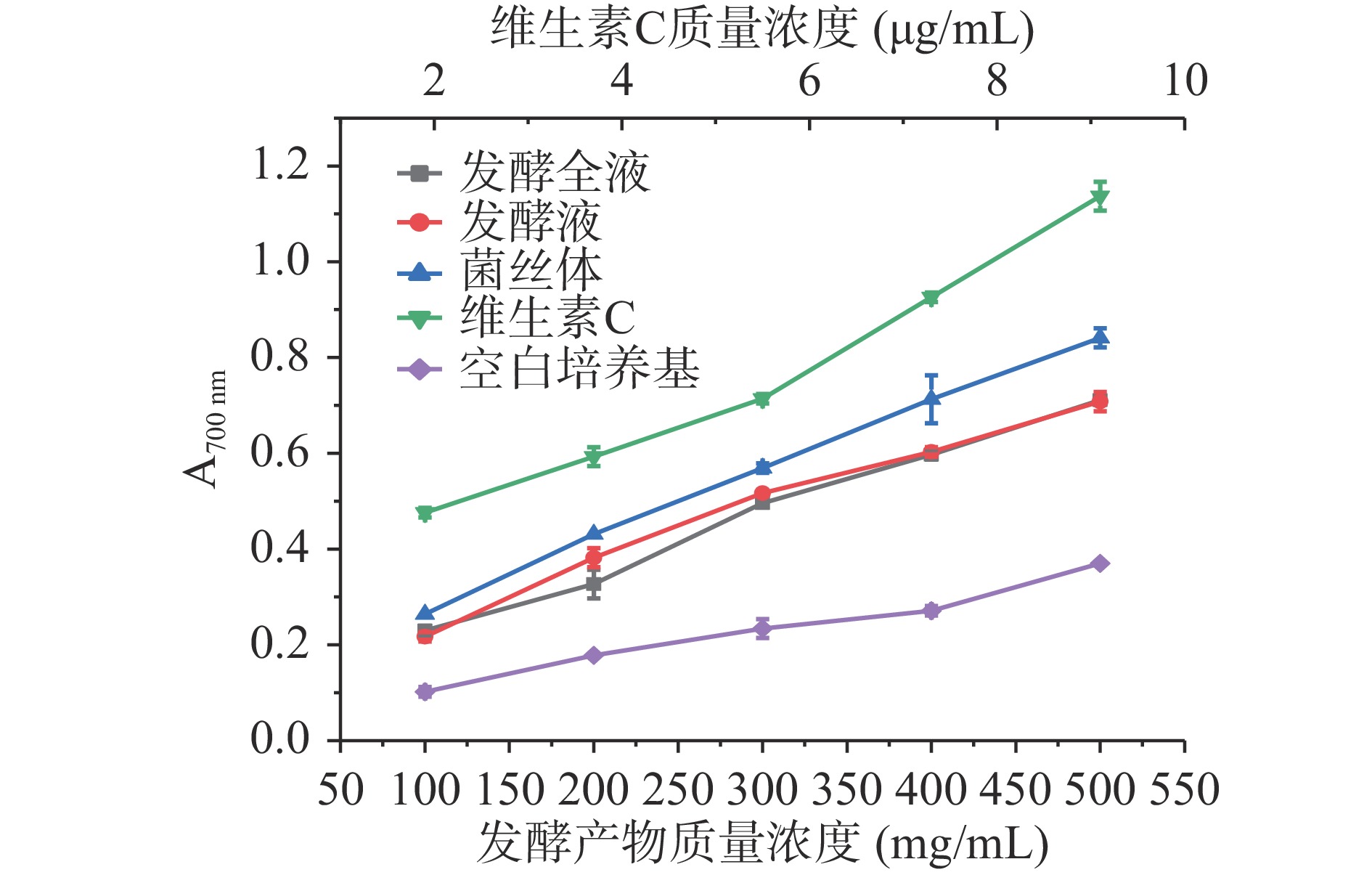
2.7.3 总还原能力
如图8所示,发酵全液、发酵液、菌丝体的总还原能力均显著高于空白培养基(P<0.05),且随着质量浓度的增加,其还原力逐渐增强,在质量浓度为500 mg/mL时,发酵全液和发酵液无显著性差异,分别为0.711、0.708,菌丝体总还原力为0.841,低于维生素C。
3. 结论
本实验在单因素实验基础上,采用响应面试验优化猴头菌液体发酵工艺,确定最佳接种量为8.5%、转速128 r/min、pH5.9、温度23.5 ℃,在该发酵条件下得到的发酵液综合评分为2.090,多糖、核苷、总萜产量分别为5.12、1.17、0.42 mg/mL。对猴头菌发酵产物进行体外抗氧化活性测定,发酵全液、发酵液、菌丝体均质液对DPPH清除率的IC50值分别166、237、53 mg/mL,对ABTS+自由基清除率的IC50值分别为68、55、72 mg/mL,500 mg/mL时总还原能力分别为0.711、0.708、0.841,同一质量浓度下,菌丝体对DPPH自由基清除能力和还原能力较强,发酵液对ABTS+自由基清除能力较强,发酵全液的综合抗氧化能力较强。
目前猴头菌液体发酵条件优化指标还停留在菌丝体生物量上,对其利用也多为提取活性成分,忽略了对发酵过程中菌丝体及发酵液中活性物质产量的考察,本实验以发酵全液中活性成分产量为指标优化猴头菌发酵工艺,得到富含多种活性成分的发酵全液,为猴头菌液体发酵生产、猴头菌活性物质提取以及功能性食品开发提供了参考。
-
表 1 Box-Behnken实验因素水平表
Table 1 Box-Behnken experimental factor level table
水平 因素 A 接种量(%) B 转速(r·min−1) C 初始pH D 温度(℃) −1 6 110 4 23 0 8 120 5 25 1 10 130 6 27 表 2 碳源对猴头菌液体发酵的影响
Table 2 Effects of carbon sources on liquid fermentation of Hericium ericium
碳源 多糖(mg/mL) 核苷(mg/mL) 总萜(mg/mL) 葡萄糖 1.27±0.01f 0.14±0.01e 0.16±0.01c 玉米粉 3.48±0.08c 0.37±0.04b 0.21±0.01b 土豆浸提液 1.63±0.03e 0.08±0.01f 0.09±0.01d 乳糖 2.22±0.06d 0.20±0.01d 0.23±0.02ab 可溶性淀粉 3.85±0.02b 0.23±0.01c 0.11±0.01d 复合碳源 4.47±0.01a 0.57±0.03a 0.25±0.01a 注:同列不同字母表示有显著性差异(P<0.05);表3同。 表 3 氮源对猴头菌液体发酵的影响
Table 3 Effects of nitrogen sources on liquid fermentation of Hericium ericium
氮源 多糖(mg/mL) 核苷(mg/mL) 总萜(mg/mL) 蛋白胨 1.23±0.07e 0.24±0.02e 0.19±0.01c 酵母浸粉 2.01±0.08d 0.35±0.03c 0.21±0.01c 黄豆芽汁 2.97±0.03c 0.27±0.02d 0.23±0.01b 山药汁 3.14±0.01b 0.18±0.01f 0.24±0.01b 黄豆粉 3.07±0.10c 0.37±0.03b 0.20±0.01c 复合氮源 3.85±0.03a 0.41±0.02a 0.27±0.01a 表 4 响应面试验设计及结果
Table 4 Response surface experimental design and results
实验号 A 接种量(%) B转速(r/min) C初始pH D 温度(℃) 综合评分 1 −1 −1 0 0 1.03 2 1 −1 0 0 1.59 3 −1 1 0 0 1.26 4 1 1 0 0 1.06 5 0 0 −1 −1 1.14 6 0 0 1 −1 1.77 7 0 0 −1 1 1.35 8 0 0 1 1 1.86 9 −1 0 0 −1 1.32 10 1 0 0 −1 1.81 11 −1 0 0 1 1.45 12 1 0 0 1 0.89 13 0 −1 −1 0 1.15 14 0 1 −1 0 0.92 15 0 −1 1 0 1.14 16 0 1 1 0 2.17 17 −1 0 −1 0 1.41 18 1 0 −1 0 0.99 19 −1 0 1 0 1.32 20 1 0 1 0 1.51 21 0 −1 0 −1 1.15 22 0 1 0 −1 1.69 23 0 −1 0 1 1.71 24 0 1 0 1 0.9 25 0 0 0 0 1.69 26 0 0 0 0 1.4 27 0 0 0 0 1.89 28 0 0 0 0 1.69 29 0 0 0 0 1.73 表 5 回归方程方差分析及显著性检验
Table 5 Test of significance for regression equation coefficients of sensory evaluation
来源 总平方和 自由度 均方 F P 显著性 模型 2.69 14 0.1918 4.31 0.0049 ** A 0.0003 1 0.0003 0.0067 0.9357 B 0.0044 1 0.0044 0.0990 0.7576 C 0.6580 1 0.6580 14.78 0.0018 ** D 0.0432 1 0.0432 0.9705 0.3413 AB 0.1444 1 0.1444 3.24 0.0933 AC 0.0930 1 0.0930 2.09 0.1703 AD 0.2756 1 0.2756 6.19 0.0260 * BC 0.3969 1 0.3969 8.92 0.0098 ** BD 0.4556 1 0.4556 10.24 0.0064 ** CD 0.0036 1 0.0036 0.0809 0.7830 A2 0.3828 1 0.3828 8.60 0.0109 * B2 0.3333 1 0.3333 7.49 0.0161 * C2 0.0738 1 0.0738 1.66 0.2188 D2 0.0299 1 0.0299 0.6722 0.4260 残差 0.6232 14 0.0445 失拟项 0.4980 10 0.0498 1.59 0.3469 不显著 纯误差 0.1252 4 0.0313 总和 3.31 28 注:*表示有显著性影响(P<0.05);**表示有极显著影响(P<0.01)。 -
[1] ELIASHVILI V. Submerged cultivation of medicinal mushrooms: Bioprocesses and products[J]. Int J Med Mushrooms,2012,14:211−39. doi: 10.1615/IntJMedMushr.v14.i3.10
[2] LEE D G, KANG H W, PARK C G, et al. Isolation and identification of phytochemicals and biological activities of Hericium ernaceus and their contents in Hericium strains using HPLC/UV analysis[J]. Journal of Ethnopharmacology,2016,29(56):367−377.
[3] 雷彤彤, 黄笑非. 玉米猴头菌菌粮营养评价及加工特性研究[J]. 食品与发酵工业,2020,46(15):113−118. [LEI T T, HUANG X F. Effects of Hericium erinaceus on nutritional value and processing characteristics of corn[J]. Food and Fermentation Industries,2020,46(15):113−118. [4] LI S P, SU Z R, DONG T T X, et al. The fruiting body and its caterpillar host of Cordyceps sinensis show close resemblance in main constituents and anti-oxidation activity[J]. Phytomedicine,2002,9:319−324. doi: 10.1078/0944-7113-00134
[5] WANG D D, ZHU X, TANG X, et al. Auxiliary antitumor effects of fungal proteins from Hericium erinaceus by target on the gut microbiota[J]. Journal of Food Science,2020,85(6):1872−1890. doi: 10.1111/1750-3841.15134
[6] 黄越. 猴头菇抗氧化活性成分的分离纯化及结构鉴定研究[D]. 广州: 华南理工大学, 2018. HUANG Y. Study on the isolation, purification and structure identification of antioxidant constituents in Hericium erinaceus[D]. Guangzhou: South China University of Technology, 2018.
[7] HOSKIN D W, MADER J S, FURLONG S J, et al. Inhibition of T cell and natural killer cell function by adenosine and its contribution to immune evasion by tumor cells[J]. International Journal of Oncology,2008,32:527−535.
[8] KAWAGISHI H, SHIMADA A, HOSOKAWA S, et al. Erinacines E, F, and G, stimulators of nerve growth factor (NGF)-synthesis, from the mycelia of Hericium erinaceum[J]. Tetrahedron Letters,1996,37(41):7399−7402. doi: 10.1016/0040-4039(96)01687-5
[9] 何晋浙, 徐瑶阳, 孙培龙. 不同来源猴头菌营养成分及其多糖化学组成和抗氧化活性比较[J]. 食品与发酵工业,2016,42(1):134−140. [HE J Z, XU Y Y, SUN P L. The comparison of nutrients, chemical composition and antioxidant activity of polysaccharides from six Hericium erinaceus specimens[J]. Food and Fermentation Industries,2016,42(1):134−140. [10] LIAO J, HUANG H H. Green magnetic hydrogels synthesis, characterization and flavourzyme immobilization based on chitin from Hericium erinaceus residue alcohol[J]. International Journal of Biological Macromolecules,2019,138:462−472. doi: 10.1016/j.ijbiomac.2019.07.038
[11] ZHU J S, HALPEM G M, JOMES K, et al. The scientific rediscovery of a precious ancient Chinese herbal regimen: Cordyceps sinensis Part II[J]. The Journal of Alternative and Complementary Medicine,1998,4:429−457. doi: 10.1089/acm.1998.4.429
[12] KRZYCZKOWSKI W, MALINOWSKA, HEROLD F. Erinacine A biosynthesis in submerged cultivation of Hericium erinaceus: Quantification and improved cultivation[J]. Engineering in Life Sciences,2010,10(5):446−457. doi: 10.1002/elsc.201000084
[13] 邝嘉华, 黄燕燕, 胡金双, 等. 解淀粉芽孢杆菌DMBA-K4高产胞外多糖的发酵条件优化及其抗氧化活性研究[J]. 食品与发酵工业,2020,46(22):28−35. [KUANG J H, HUANG Y Y, HU J S, et al. Optimization of fermentation conditions and anti-oxidation of exopolysaccharide produced by Bacillus amyloliquefaciens DMBA-K4[J]. Food and Fermentation Industries,2020,46(22):28−35. [14] 刘晓明, 闫云宇, 毕华, 等. 猴头菇菌丝体和发酵液中多糖的含量测定[J]. 中国医药科学,2013,3(6):94−95. [LIU X M, YAN Y Y, BI H, et al. Content determination of polysaccharide form Hericium erinaceus in mycelium and fermentation broth[J]. China Medicine and Pharmacy,2013,3(6):94−95. [15] 张琦, 孙莹, 王兆丰, 等. 不同产地蜜环菌总萜和总糖含量测定[J]. 农业工程,2019,9(9):76−80. [ZHANG Q, SUN Y, WANG Z F, et al. Determination of total polysaccharides and total terpenes in Armillaria mellea in different producing areas[J]. Agricultural Engineering,2019,9(9):76−80. doi: 10.3969/j.issn.2095-1795.2019.09.022 [16] 刘若曦, 何晋浙, 王平. 正交试验优化猴头菌菌丝体中猴头菌素A的超声提取工艺[J]. 中成药,2017,39(2):305−307. [LIU R X, HE J Z, WANG P. Optimization of ultrasonic extraction for erinacine A in mycelia of Hericium erinaceus by orthogonal test[J]. Chinese Traditional Patent Medicine,2017,39(2):305−307. doi: 10.3969/j.issn.1001-1528.2017.02.014 [17] 游静, 张德全, 潘兴娇, 等. 高效液相色谱法同时测定太白贝母与暗紫贝母中9种核苷类成分的含量[J]. 食品与发酵工业,2016,42(1):174−179. [YOU J, ZHANG D Q, PAN X J, et al. Simultaneous determination of nine nucleosides contents using high performance liquid chromatography in Fritillaria taipaiensis P. Y. Li and Fritillaria unibracteata Hsiao et K. C. Hsia[J]. Food and Fermentation Industries,2016,42(1):174−179. [18] 薛山. 紫薯不溶性膳食纤维超声辅助酶法提取工艺及抗氧化活性研究[J]. 食品与机械,2018,34(5):153−157,163. [XUE S. Extraction of insoluble dietary fiber from purple sweet potato by ultrasonic assisted enzyme method and the determination of its hydroxyl radical scavenging ability[J]. Food & Machinery,2018,34(5):153−157,163. [19] 李卫卫, 马红, 尹永刚. 猴头菇液体培养基的筛选和优化[J]. 食药用菌,2020,28(1):42−45. [LI W W, MA H, YIN Y G. Screening and optimization of liquid culture medium of Hericium erinaceus[J]. Edible and Medicinal Mushrooms,2020,28(1):42−45. [20] 杨宁, 郝林. 6种中药对猴头菌液体培养的影响[J]. 山西农业科学,2020,28(1):42−45. [YANG N, HAO L. Effects of six kinds of chinese traditional medicines submerged fermentation of Hericium erinaceus[J]. Journal of Shanxi Agricultural Sciences,2020,28(1):42−45. [21] CUI F J, LIU Z Q, LI Y, et al. Production of mycelial biomass and exo-polymer by Hericium erinaceus CZ-2: Optimization of nutrients levels using response surface methodology[J]. Biotechnology and Bioprocess Engineering,2010,15:299−307. doi: 10.1007/s12257-009-0117-9
[22] 蒋方程, 李傲然, 何静仁, 等. 不同品种山药的营养成分分析及其水提物的体外抗氧化能力研究[J]. 食品工业科技,2018,39(4):6−11. [JIANG F C, LI A R, HE J R, et al. Analysis of nutritious in Rhizoma Dioscoreae from different varieties and antioxidant properties of their water extracts in vitro[J]. Science and Technology of Food Industry,2018,39(4):6−11. [23] 刘梅森, 陈海晏, 郝俊光, 等. 猴头菌液态发酵研究进展[J]. 食品科学,1998,19(6):12−15. [LIU M S, CEHN H Y, HAO J G, et al. Research progress on liquid fermentation of Hericium ericium[J]. Food Science,1998,19(6):12−15. [24] 蔡德华, 董洪新. 猴头菌液体发酵的环境条件试验[J]. 湖北农业科学,2003,20(3):32−35. [CAI D H, DONG H X. A study on submerged fermentation techniques of Hericium erinaceus[J]. Hubei Agricultural Sciences,2003,20(3):32−35. doi: 10.3969/j.issn.0439-8114.2003.03.014 [25] 王大慧, 徐若烊, 黎德超, 等. 酸胁迫对S-腺苷甲硫氨酸和谷胱甘肽生物合成的影响及其生理机制[J]. 食品科学,2020,41(10):61−67. [WANG D H, XU R Y, LI D C, et al. Effect of acid stress on the biosynthesis of S-adenosylmethionine and Glutathione and the underlying physiological mechanism[J]. Food Science,2020,41(10):61−67. doi: 10.7506/spkx1002-6630-20190314-194 [26] 乐超银, 邵伟, 刘庆刚, 等. 猴头菌液体发酵条件的研究[J]. 中国食用菌,1999,18(3):32−34. [LE C Y, SHAO W, LIU Q G, et al. Study on liquid fermentation conditions of Hericium ericium[J]. Edible Fungi of China,1999,18(3):32−34. [27] ATILA F, TUZEL Y, PEKSEN A, et al. The effect of different fruiting temperatures on the yield and nutritional parameters of some wild and hybrid Hericium isolates[J]. Scientia Horticulturae,2021,280:34−42.
[28] 轩瑞瑞, 陈艳萍, 刘春菊, 等. 基于熵权法和灰色关联度法的鲜食糯玉米品质评价[J/OL]. 食品工业科技: 1−14[2021-05-16]. http://kns.cnki.net/kcms/detail/11.1759.TS.20210126.0943.004.html. XUAN R R, CHEN Y P, LIU C J, et al. Quality evaluation of different varieties of fresh-edible waxy corns based on entropy weight method and grey interconnect degree analysis[J]. Science and Technology of Food Industry: 1−14[2021-05-16]. http://kns.cnki.net/kcms/detail/11.1759.TS.20210126.0943.004.html.
[29] 姚芳, 张伟, 徐海祥, 等. 响应面法优化银杏果酶菌协同发酵工艺[J]. 食品工业科技,2021,42(4):77−85. [YAO F, ZHANG W, XU H Y, et al. Optimized the process of enzymes coupled with Lactobacillus plantarum and Saccharomyces cerevisiae to ferment ginkgo seeds by response surface methodology[J]. Science and Technology of Food Industry,2021,42(4):77−85.





 下载:
下载:
 下载:
下载:
