Preparation and Biological Activities of Low Molecular Weight Brown Algae
-
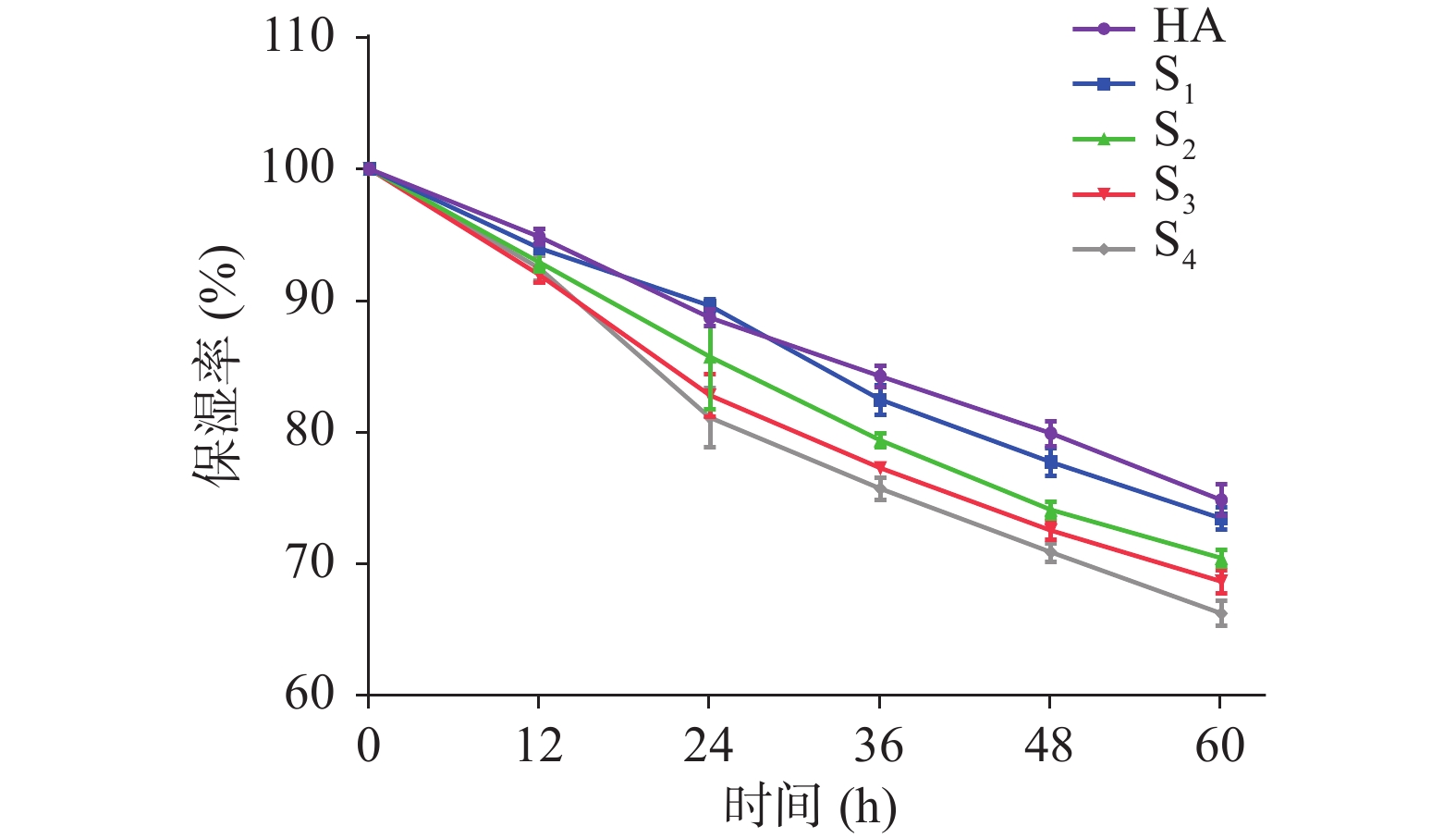
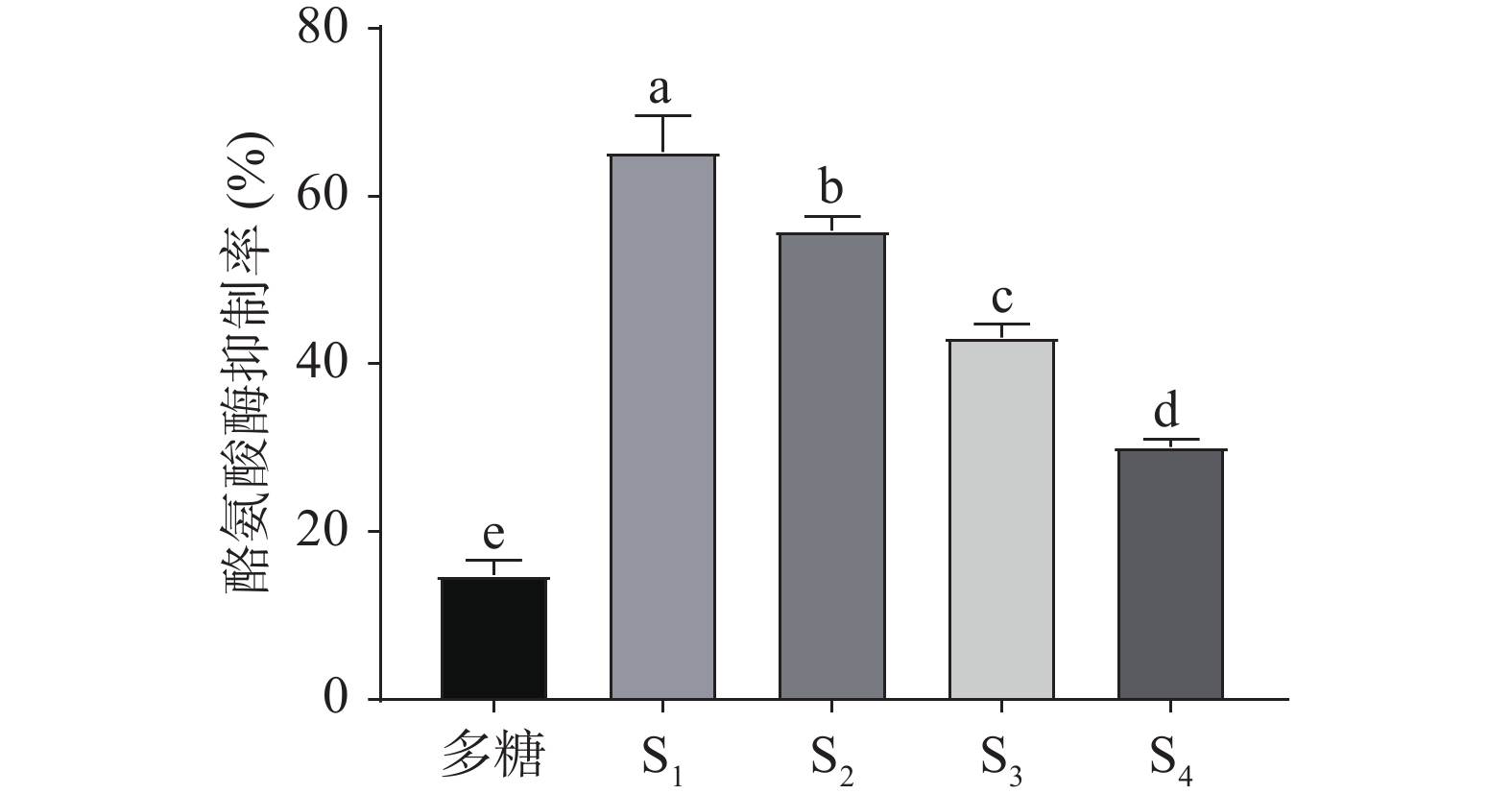
摘要: 利用抗坏血酸协同过氧化氢法降解褐藻多糖,以DPPH自由基清除率为指标,通过工艺优化得到最佳降解条件,然后用超滤技术将降解产物进行分级,获得不同分子量组分,并分析其DPPH自由基清除率、保湿效果,酪氨酸酶抑制率等活性。正交试验结果表明,最佳降解条件为H2O2-VC浓度20 mmol/L、降解温度45 ℃、降解时间3 h,在此条件下获得的降解产物的DPPH自由基清除率达到61.23%,降解产物得率为73.16%。电泳结果表明,降解后的褐藻多糖的条带明显出现在低分子量区。利用超滤系统将降解产物分级为<5 kDa、5~10 kDa、10~30 kDa、>30 kDa四个不同分子量段的组分,研究发现各分子量段之间的活性存在显著差异(P<0.05),尤其<5 kDa组分(其主要成分为2.140×103 Da,占比29.6%)的活性最好,其DPPH自由基清除率为59.27%,60 h后保湿率为75.75%,酪氨酸酶抑制率为65.28%。与褐藻多糖相比,其糖醛酸含量稍有下降。本研究结果可为褐藻多糖在功能性食品等领域的应用提供理论依据。
-
关键词:
- 低分子量褐藻多糖 /
- 制备 /
- DPPH自由基清除率 /
- 保湿效果 /
- 酪氨酸酶抑制率
Abstract: The polysaccharide was degraded by ascorbic acid and hydrogen peroxide, and the optimal degradation conditions were obtained by the index of DPPH free radical scavenging rate. Then the degradation products were classified by ultrafiltration to obtain different molecular weight components, and their activities were analyzed. The optimal degradation conditions were H2O2-VC 20 mmol/L, 45 ℃ and 3 h. Under these conditions, the DPPH free radical scavenging rate reached 61.23%, and the yield of degradation products was 73.16%. Electrophoretic results showed that the bands of the degraded polysaccharides were obviously in the low molecular weight region. Then the degradation products were classified into four different molecular weight fractions, as <5 kDa, 5~10 kDa, 10~30 kDa and >30 kDa by ultrafiltration. There were significant differences among the molecular weight segments (P<0.05), especially the <5 kDa component (main component 2.140×103 Da, 29.6%) had the best biological activity. The DPPH free radical scavenging rate was 59.27%, and the moisture retention rate was 75.75% after 60 h, the tyrosinase inhibition rate was 65.28%. The content of uronic acid of the <5 kDa component decreased slightly compared with polysaccharides. The results could provide theoretical basis for the application of polysaccharides in functional food and other fields. -
褐藻多糖,又名褐藻多糖硫酸酯、褐藻胶,主要来源于海带、巨藻、泡叶藻、墨角藻等海藻,集中于褐藻植物细胞壁中,是一种含有硫酸基团的高分子量的杂多糖,具有抗氧化、降尿酸、抗肿瘤、抗病毒、抗炎等生理功能[1-3],在功能性食品、果蔬保鲜等方面具有较大应用潜力。然而,由于天然褐藻多糖存在着分子量大、粘度高,渗透性差,不利于吸收等问题,其应用受到很大限制。研究表明,通过一定方式降解多糖,获得低分子量多糖,能够提高多糖的生物活性和生物利用率[4-5]。Zhao等[6]以海带为原料制备的低分子量岩藻多糖对超氧自由基、羟自由基等有较强的体外清除作用。Xue等[7]研究表明低分子量的硫酸多糖对低密度脂蛋白的氧化作用强于粗岩藻糖。任立士等研究发现通过利用自由基降解法制备的海藻寡糖,具有良好的清除自由基的能力[8]。因此,通过适当方法降低褐藻多糖分子量,是发挥其生理活性的重要途径。
目前,低分子量褐藻多糖的制备方法可分为物理法、化学法、生物酶解法[7]。生物酶解法条件温和且分子量较易控制,但酶制剂价格昂贵且不易获得[9]。硫酸基团对褐藻多糖活性的发挥起到很重要的作用,Wang等、Mohsin等研究发现,低分子量褐藻多糖自由基清除能力、抗凝血活性与硫酸根含量成正相关[10-11]。Anastyuk等[12]研究发现,由于硫酸酯基及α-1,4-岩藻糖苷键的存在,低分子量褐藻糖对人体恶性黑色素瘤细胞系SK-MEL-28表现出了较好的抑制性。Shao等[13]研究表明,体外抗癌活性与褐藻多糖分子中的硫酸根含量有关。同时,硫酸化的褐藻多糖被报道具有抑制单纯形疱疹病毒(HSV)和人类免疫缺陷病毒(HIV)的能力[14-15],甚至被推断具有抗新冠病毒(coronavirus disease 2019,COVID-19)的能力[16]。因此在选择方法的时候应着重注重对硫酸基团的保护,但化学方法对硫酸基团的破坏较为严重,不适合应用。作者前期实验表明,利用自由基法可有效降解褐藻多糖,同时不会过度破坏硫酸基团。
因此,本实验利用抗坏血酸辅助过氧化氢法对褐藻多糖进行降解,以DPPH自由基清除率为指标进行降解条件优化。利用超滤系统对降解的多糖进行分级,对比不同分子量段降解多糖的DPPH自由基清除率、保湿性以及酪氨酸酶抑制活性,分析其分子量及化学组成,以期为褐藻多糖在食品等领域的应用提供依据。
1. 材料与方法
1.1 材料与仪器
褐藻多糖 山东洁晶集团股份有限公司;琼脂糖凝胶 青岛源叶生物技术公司;透明质酸 广州高良生物科技有限公司;DPPH 北京索莱宝科技有限公司;过氧化氢、抗坏血酸等 均为市售国产分析纯。
真空冷冻干燥机 德国CHREIST公司;DU-800型紫外-可见分光光度计 美国贝克曼公司;SHA-B水浴恒温振荡器 常州国华电器有限公司;高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;DYY-6C型电泳仪 北京市六一仪器厂;超滤膜分离系统 美国赛默飞公司;十八角度激光光谱散射仪 美国Wyatt公司;DGU-20A5R高效液相色谱仪 日本岛津公司。
1.2 实验方法
1.2.1 褐藻多糖的降解
配制1%的褐藻多糖溶液,加入一定体积的30%过氧化氢和抗坏血酸,在一定温度下降解一段时间后,用0.01 mol/L氢氧化钠(NaOH)调节溶液pH至中性,采用200 Da透析袋,蒸馏水透析3 d,冻干后得降解产物。褐藻多糖降解产物得率计算公式如下:
Y=W2W1×100 式中,Y—褐藻多糖降解产物得率(%),W2—降解后多糖质量 (g),W1—降解前多糖质量 (g)。
1.2.2 褐藻多糖降解单因素及正交试验
以褐藻多糖降解产物的DPPH自由基清除率为指标,使用过氧化氢结合抗坏血酸的方法降解褐藻多糖[17-18]。配制1%的褐藻多糖溶液,以实验条件H2O2-VC浓度15 mmol/L(向100 mL褐藻多糖溶液中添加153 µL 30%过氧化氢溶液和0.26 g VC)、降解温度35 ℃、降解时间3 h为固定因素水平,按照5、10、15、20、25 mmol/L,25、35、45、55、65 ℃,1、2、3、4、5 h的因素水平进行单因素实验。根据单因素实验结果,设计3因素3水平正交试验,具体方案见表1,以褐藻多糖降解产物DPPH自由基清除率为指标确定最佳降解条件。
表 1 正交试验因素及水平设计Table 1. Factors and levels used in orthogonal experiment水平 因素 A H2O2-VC浓度(mmol/L) B 降解温度(℃) C 降解时间(h) 1 15 35 2 2 20 45 3 3 25 55 4 1.2.3 DPPH自由基清除率的测定
参照姜美云等[19]的方法,并稍作修改。DPPH自由基清除率的测定方法见表2,反应液充分混匀,室温黑暗处静置反应30 min,在517 nm下测定吸光值A。降解产物溶液浓度配制为1%,用0.025 mg/mL VC做阳性对照,以蒸馏水做空白,DPPH自由基清除率公式计算如下:
清除率(%)=(1−A2−A3A1)×100 表 2 DPPH自由基清除率测定方法Table 2. Determination of DPPH radical scavenging rate试剂 A1对照管(mL) A2样品管(mL) A3样参管(mL) 0.1 mmol/L DPPH 2.4 2.4 0 无水甲醇 0 0 2.4 蒸馏水 1.6 1.1 1.1 样品 0 0.5 0.5 1.2.4 凝胶电泳分析
采用Shi等[20]的凝胶电泳方法,分析褐藻多糖的降解情况。上样缓冲液与样品比例为1:4,上样量为10 µL。电泳条件中电压为80 V,时间45 min。
1.2.5 褐藻多糖降解产物的分级分离
利用超滤膜系统对褐藻多糖降解产物按照分子量进行分级,采用5、10和30 kDa的超滤膜,将降解产物分为小于5 kDa、5~10 kDa、10~30 kDa和大于30 kDa四个组分,分别记为S1、S2、S3、S4,冻干备用。
1.2.6 不同分子量段多糖DPPH自由基清除率测定
将S1、S2、S3、S4四种组分以及褐藻多糖配制成1%溶液,按照1.2.3的方法测定DPPH自由基清除率。
1.2.7 保湿性测定方法
保湿性测定参照屈义[21]的方法,略有修改。在干燥器底部加入200 g变色硅胶。将样品与平板置于干燥箱中,50 ℃干燥至质量恒定。准确称S1、S2、S3、S4以及褐藻多糖各0.1 g,分别加水10 mL。配制完成的溶液均敞口置于恒温密闭硅胶干燥器中,用透明质酸(HA)做对照。分别放置3、6、12、24、36 h后,称量其质量变化,按下式计算保湿率:
Y(%)=MtM0×100 式中,Y—保湿率(%);M0—放入干燥器前样品溶液的质量(g),Mt—干燥后样品溶液的质量(g)。
1.2.8 酪氨酸酶抑制活性的测定
参照Chen等[22]的方法。将S1、S2、S3、S4四种组分以及褐藻多糖配制成1%溶液,作为样品。在反应体系中分别加入样品、L-酪氨酸及PBS缓冲液,在37 ℃中水浴反应15 min,再加入500 U/mL的酪氨酸酶,37 ℃条件下反应15 min,放置冰浴中结束反应,在475 nm下测量吸光值。具体加样步骤见表3。酪氨酸酶抑制率计算公式如下:
酪氨酸酶抑制率(%)=(A1−A2)−(B1−B2)A1−A2×100 式中,A1、A2、B1、B2分别表3中相应反应体系的吸光值。
表 3 抑制酪氨酸酶活性反应体系Table 3. Reaction system for inhibiting tyrosinase activityL-酪氨酸(μL) 样品(μL) PBS缓冲液(μL) 酪氨酸酶(μL) A1 200 − 150 50 A2 200 − 400 − B1 200 150 200 50 B2 200 150 250 − 1.2.9 单糖组成的测定
单糖组成的测定采用柱前衍生高效液相色谱法,具体参照 Chen的方法[22],混合标准品由葡萄糖、岩藻糖、木糖、半乳糖、葡萄糖醛、甘露糖、甘露糖醛酸等7种单糖混合乳糖组成。测定条件设置如下:色谱柱:Agilent EC-C18(3.5 µm,4.6 mm×250 mm),紫外检测波长:254 nm,流动相为乙腈:磷酸盐缓冲液(15:85),流速:1 mL/min,进样量20 µL,以各种标准品的峰面积做标准曲线,计算出样品中各单糖含量。
1.2.10 分子量的测定
将样品用蒸馏水配置为10 mg/mL,采用GPC-十八角激光光散射联用进行分子量分布的分析。色谱仪:Agilent 1260,分析柱:TSK G2500PW(8.0 mm×300 mm,8 µm),流动相为H2O,流速为0.5 mL/min,柱温为30 ℃,进样量为50 μL,选择示差检测器检测。
1.3 数据处理
采用SPSS16.0软件,组间差异经t检验分析,P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。所有实验均进行三次重复,实验结果用
ˉx ±s表示,图形使用GraphPad Prism5(GraphPad Software公司,2365 Northside Dr. Suite 560 San Diego, 美国加州)绘制。2. 结果与分析
2.1 单因素实验结果
如图1A所示,随H2O2-VC用量增加,清除率从40.2%升至56.1%,清除率升高可能与多糖分子量减小和活性多糖片段增多有关[23],H2O2-VC用量为20 mmol/L之后清除率开始下降,这可能是由于H2O2含量过高时,自由基氧化反应剧烈,产物脱硫现象和脱羧反应较为严重[24-25],因此,H2O2-VC的最适用量为20 mmol/L。
一般来说,温度的升高会导致反应速率的增加,更高的温度意味着更高的分子平均动能和单位时间内更多的碰撞[26]。如图1B所示,随着温度的升高,清除率快速升高,当温度到45 ℃时,清除率达到最大,为54.1%,因此,适当提高反应温度有利于活性增强。当温度高于45 ℃时,清除率开始下降,原因可能是当温度过高时,VC活性降低并且H2O2部分分解,导致降解多糖的能力降低,清除率下降[27],因此最适温度为45 ℃。
如图1C所示,随着反应时间的延长,DPPH自由基清除率呈现先上升后平缓趋势,当降解时间为3 h时,清除率达到最大值为48.9%。原因可能随着时间的延长,多糖分子量不再减小或者分子量减小趋势变缓[27-28],使DPPH自由基清除率趋于平缓,因此,最适降解时间为3 h。
2.2 正交试验结果
在单因素实验的基础上,选取H2O2-VC浓度、降解温度和降解时间三个因素,每个因素各取三个水平,结果如表4所示。由表4可知,各因素对抗氧化活性的影响程度依次为H2O2-VC浓度>降解时间>降解温度,H2O2-VC的用量对褐藻多糖降解后DPPH清除率影响最大,最佳组合是A2B2C2,即H2O2-VC浓度为20 mmol/L、降解温度45 ℃、降解时间3 h。随后进行了最佳组合验证实验,所得降解产物的DPPH自由基清除率为61.23%±0.55%,高于正交试验中的最高值,证明正交试验结果有效,此条件下降解产物得率为73.16%。
表 4 正交试验结果Table 4. Orthogonal test results实验号 A H2O2-VC浓度(mmol/L) B 降解温度(℃) C 降解时间(h) DPPH清除率(%) 1 1(15) 1(35) 1(2) 46.2±0.51 2 1 2(45) 2(3) 54.1±0.66 3 1 3(55) 3(4) 47.5±0.78 4 2(20) 1 2 56.3±0.69 5 2 2 3 58.1±0.65 6 2 3 1 50.1±0.26 7 3(25) 1 3 48.6±0.62 8 3 2 1 49.1±0.57 9 3 3 2 49.5±0.89 K1 49.267 50.367 48.467 K2 54.833 53.767 53.300 K3 49.067 49.033 51.400 R 5.766 4.734 4.833 注:K1、K2、K3为各因素水平抑制率的平均值,R为极差。 2.3 褐藻多糖降解效果的凝胶电泳分析
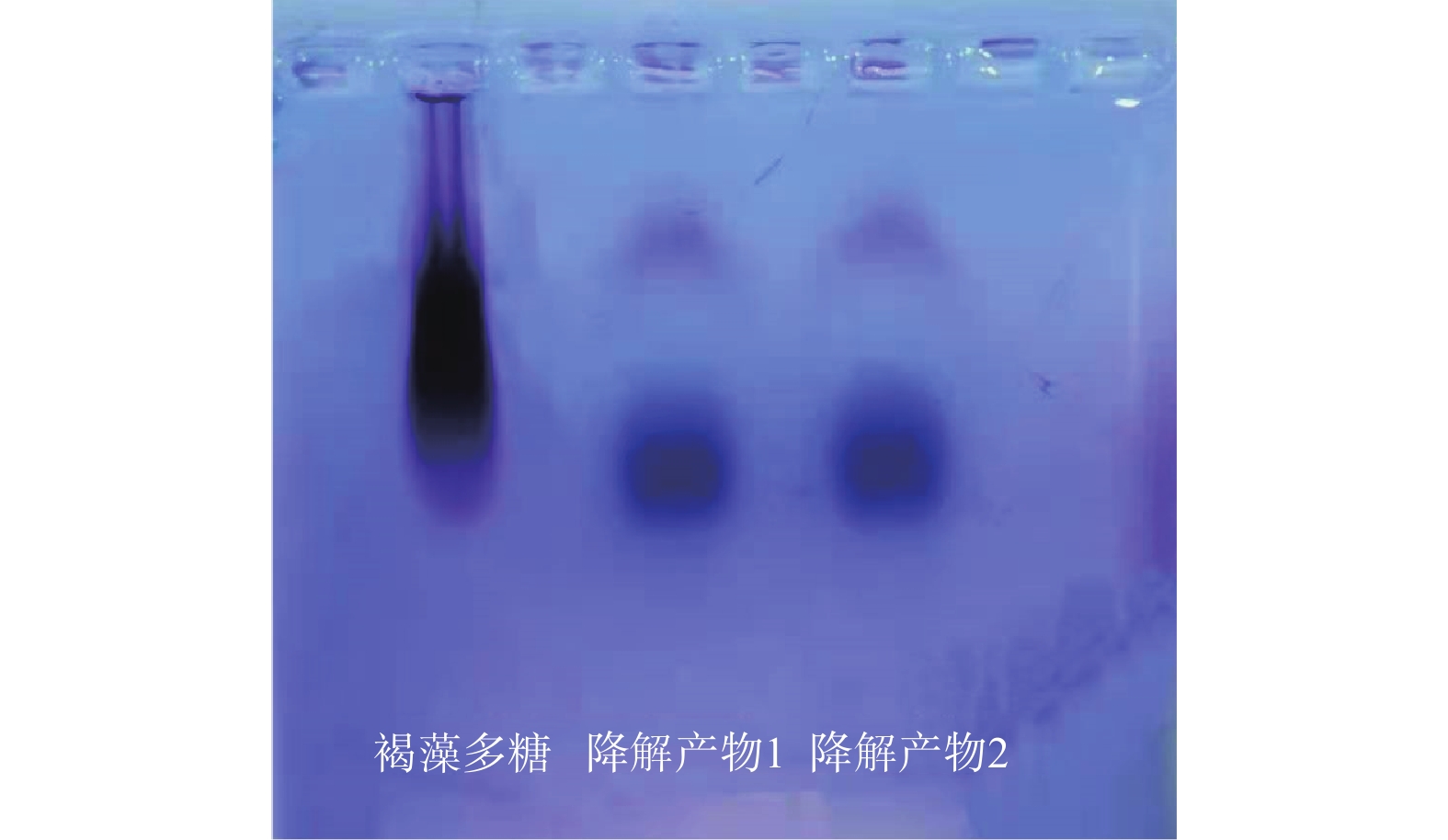
利用上述最佳降解条件降解褐藻多糖,通过凝胶电泳分析褐藻多糖的降解效果。图2为褐藻多糖以及降解产物(降解产物1、2为两个平行)的电泳结果。由图2可知,降解后的褐藻多糖的条带明显出现在低分子量区,说明褐藻多糖中高分子量的组分被降解成相对分子量较低的组分,两个平行样品平行性较好。这与Asha等[29]的研究效果一致,证明自由基降解法能够稳定并有效地降解多糖。
2.4 不同分子量段多糖DPPH自由基清除率对比
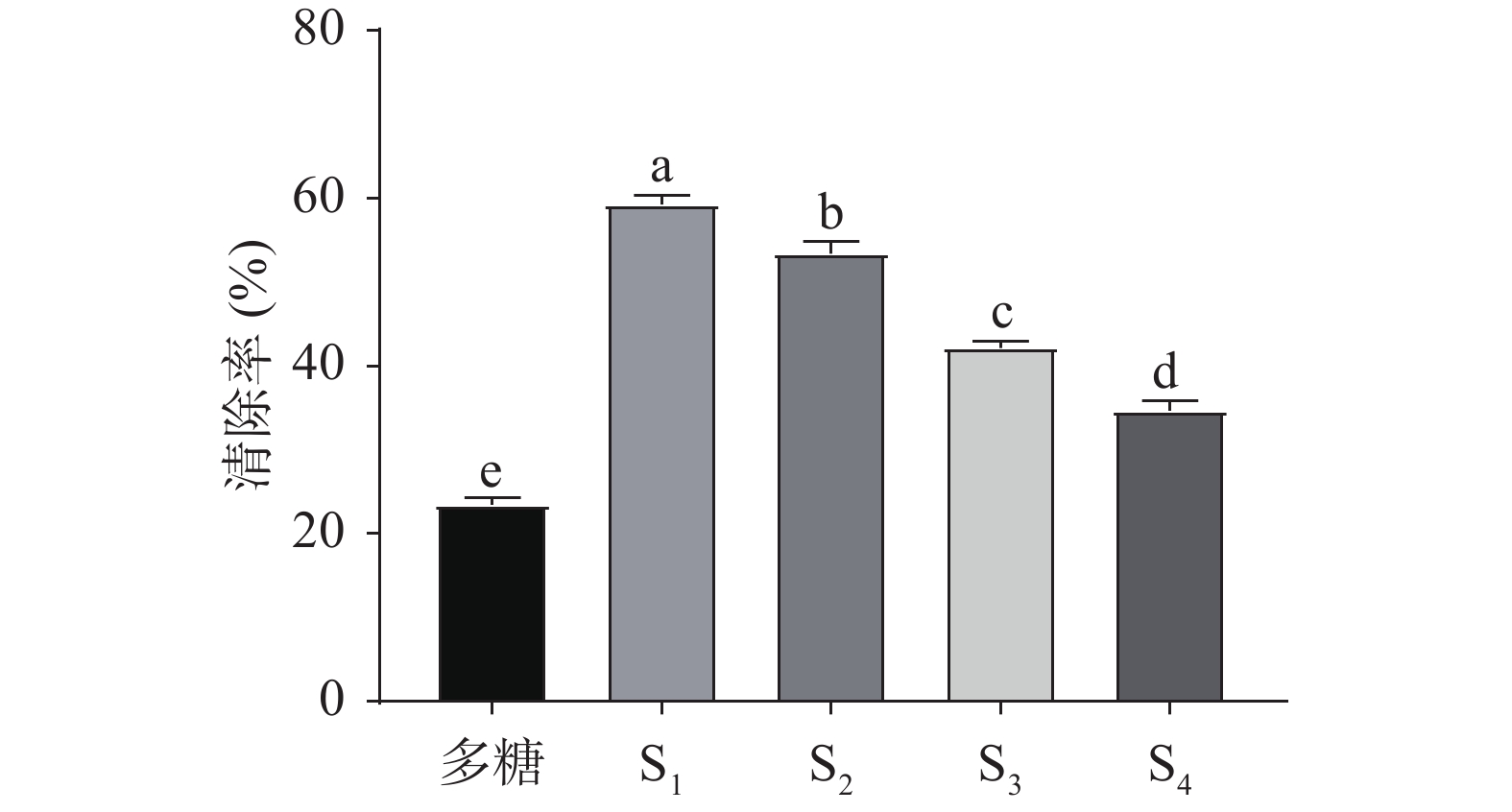
通过超滤系统,将降解后的多糖分为S1、S2、S3、S4四种组分,并配制成1%的溶液,各组分多糖DPPH自由基清除率如图3所示,随着多糖分子量的减小,DPPH自由基清除率显著增高(P<0.05),S1(<5 kDa)的DPPH自由基清除率最高,为59.27%±0.99%,与S2、S3、S4以及多糖组差异显著(P<0.05)。这与支梓鉴[30]研究结果相似,利用超声结合Fe2+和H2O2降解果胶多糖,降解后的果胶多糖具有更强的抗氧化性,且分子量较低的降解多糖抗氧化能力更强。
2.5 不同分子量段多糖保湿性效果对比
由图4可知,各样品保湿率随时间下降,截止60 h,HA的保湿率最高,达到74.61%±0.98%,与S1(73.18%±0.83%)无显著差异。60 h时,S1、S2、S3、S4的保湿率具有显著差异(P<0.05),其保湿顺序依次为S1>S2>S3>S4(图5)。屈义等[21]研究显示,在24 h内,壳聚糖分子量越小,其保湿效果越好;Wang等[31]研究发现低分子量海带多糖(8 kDa)的保湿效果显著地强于海带多糖(87 kDa),甚至比HA效果更好,其可能的原因之一是多糖在降解过程中,糖苷键断裂,使更多的亲水基团暴露,更容易与水分子亲和;另一方面,低分子多糖的空间网状结构的保留能力可能更强[32]。
2.6 酪氨酸酶抑制活性对比
由图5可知,1%浓度的S1、S2、S3、S4组分的酪氨酸酶抑制活性均显著高于褐藻多糖(P<0.05),不同分子量段多糖的酪氨酸酶抑制活性依次为S1>S2>S3>S4,且具有显著差异(P<0.05)。Park等[33]研究显示,通过辐射降解得到的褐藻寡糖,其分子量越低,酪氨酸酶抑制活性越强;李玉芬[9]研究结果表明,褐藻三糖对酪氨酸酶的抑制活性高于褐藻酸钠。
2.7 单糖组成分析
褐藻多糖降解产物经超滤系统分级后的S1组分单糖组成见表5。二者单糖组成和多糖基本相同,主要包括岩藻糖(Fuc),半乳糖(Gal),葡萄糖醛酸(GlcA)、木糖(Xyl)、甘露糖(Man),甘露糖醛酸(ManA)和葡萄糖(Glc),与多糖相比,S1组分的岩藻糖含量略高,由30.21%升高至32.26%。与多糖相比,其葡萄糖醛酸含量相对减少,由13.44%降至11.43%,有学者[34-36]同样发现降解导致糖醛酸质量分数降低,并表明在降解过程中,糖醛酸结构可能变化成内酯,从而导致了糖醛酸的损失。
表 5 不同分子量褐藻多糖的单糖组成Table 5. Monosaccharide composition of low molecular weight brown algal oligosaccharides样品 单糖组成(%) 岩藻糖 半乳糖 葡萄糖醛酸 甘露糖 木糖 甘露糖醛酸 葡萄糖 褐藻多糖 30.21±1.14 20.87±0.08 13.44±0.98 9.55±0.05 9.82±0.86 6.25±0.56 5.66±1.07 S1组分 32.26 ±1.23 18.73±0.56 11.43±1.16 11.81±0.52 10.16±0.77 7.37±0.68 6.17±0.58 2.8 S1组分分子量分布的测定
经过超滤系统分级后得到S1组分(<5 kDa),经过GPC-十八角激光光散射仪测定后,分子量分布见图6、表6。结果表明S1组分主要含有五个组分,分子量分别为4.126×103 、2.968×103、2.140×103、1.768×103、1.006×103 Da,以4.126×103 和2.140×103 Da的组分为主。其中2.140×103 Da含量最高,达到29.6%,其次是4.126×103 Da组分,占比为24.1%。后续可以研究哪个组分在抑制酪氨酸酶活性上发挥了决定性作用,进一步揭示构效关系。
表 6 S1组分的分子量及含量Table 6. Molecular weight and content of S1峰号 分子量(Da) 峰面积占比(%) 1 4.126×103 24.1 2 2.968×103 11.4 3 2.140×103 29.6 4 1.768×103 15.7 5 1.006×103 19.2 3. 结论
本研究以DPPH自由基清除率为评价指标,建立了以H2O2-VC自由基法降解褐藻多糖的方法,正交试验优化得到最佳降解条件为H2O2-VC浓度为20 mmol/L、降解温度45 ℃以及降解时间3 h,最佳条件下降解产物得率为73.16%,DPPH自由基清除率为61.23%。凝胶电泳结果表明,降解后的褐藻多糖的条带明显出现在低分子量区,说明该降解法稳定并有效。通过超滤系统将此产物降解分为<5 kDa、5~10 kDa、10~30 kDa、>30 kDa四段,DPPH自由基清除率、保湿性、以及酪氨酸酶抑制活性研究表明,<5 kDa分子量段的组分的活性显著高于其它组分(P<0.05)。进一步测定了<5 kDa分子量段组分的单糖组成与分子量分布,结果表明,与多糖相比,该组分的岩藻糖含量略高,葡萄糖醛酸含量相对减少;经测定,该组分主要含有五个组分,其中2.140×103 Da含量最高,达到29.6%,其次是4.126×103 Da组分,占比为24.1%。研究结果可为低分子量褐藻多糖的在功能性食品等领域的应用提供数据基础,下一步可以在低分子量褐藻多糖的构效关系方面开展更深入的研究。
-
表 1 正交试验因素及水平设计
Table 1 Factors and levels used in orthogonal experiment
水平 因素 A H2O2-VC浓度(mmol/L) B 降解温度(℃) C 降解时间(h) 1 15 35 2 2 20 45 3 3 25 55 4 表 2 DPPH自由基清除率测定方法
Table 2 Determination of DPPH radical scavenging rate
试剂 A1对照管(mL) A2样品管(mL) A3样参管(mL) 0.1 mmol/L DPPH 2.4 2.4 0 无水甲醇 0 0 2.4 蒸馏水 1.6 1.1 1.1 样品 0 0.5 0.5 表 3 抑制酪氨酸酶活性反应体系
Table 3 Reaction system for inhibiting tyrosinase activity
L-酪氨酸(μL) 样品(μL) PBS缓冲液(μL) 酪氨酸酶(μL) A1 200 − 150 50 A2 200 − 400 − B1 200 150 200 50 B2 200 150 250 − 表 4 正交试验结果
Table 4 Orthogonal test results
实验号 A H2O2-VC浓度(mmol/L) B 降解温度(℃) C 降解时间(h) DPPH清除率(%) 1 1(15) 1(35) 1(2) 46.2±0.51 2 1 2(45) 2(3) 54.1±0.66 3 1 3(55) 3(4) 47.5±0.78 4 2(20) 1 2 56.3±0.69 5 2 2 3 58.1±0.65 6 2 3 1 50.1±0.26 7 3(25) 1 3 48.6±0.62 8 3 2 1 49.1±0.57 9 3 3 2 49.5±0.89 K1 49.267 50.367 48.467 K2 54.833 53.767 53.300 K3 49.067 49.033 51.400 R 5.766 4.734 4.833 注:K1、K2、K3为各因素水平抑制率的平均值,R为极差。 表 5 不同分子量褐藻多糖的单糖组成
Table 5 Monosaccharide composition of low molecular weight brown algal oligosaccharides
样品 单糖组成(%) 岩藻糖 半乳糖 葡萄糖醛酸 甘露糖 木糖 甘露糖醛酸 葡萄糖 褐藻多糖 30.21±1.14 20.87±0.08 13.44±0.98 9.55±0.05 9.82±0.86 6.25±0.56 5.66±1.07 S1组分 32.26 ±1.23 18.73±0.56 11.43±1.16 11.81±0.52 10.16±0.77 7.37±0.68 6.17±0.58 表 6 S1组分的分子量及含量
Table 6 Molecular weight and content of S1
峰号 分子量(Da) 峰面积占比(%) 1 4.126×103 24.1 2 2.968×103 11.4 3 2.140×103 29.6 4 1.768×103 15.7 5 1.006×103 19.2 -
[1] ARUNKUMAR K, RAJ R, RAJA R, et al. Brown seaweeds as a source of anti-hyaluronidase compounds[J]. South African Journal of Botany,2021,139:470−477. doi: 10.1016/j.sajb.2021.03.036
[2] MANIKANDAN R, PARIMALANANDHINI D, MAHALAKSHMI K, et al. Studies on isolation, characterization of fucoidan from brown algae Turbinaria decurrens and evaluation of it's in vivo and in vitro anti-inflammatory activities[J]. International Journal of Biological Macromolecules,2020,160:1263−1276. doi: 10.1016/j.ijbiomac.2020.05.152
[3] JANUARY G G, NAIDOO R K, KIRBY-MCCULLOUGH B, et al. Assessing methodologies for fucoidan extraction from South African brown algae[J]. Algal Research,2019,40:98−102.
[4] ZHOU C S, YU X J, ZHANG Y Z, et al. Ultrasonic degradation, purification and analysis of structure and antioxidant activity of polysaccharide from Porphyra yezoensis Udea[J]. Carbohydrate Polymers,2012,87(3):2046−2051. doi: 10.1016/j.carbpol.2011.10.026
[5] 韩莎莎, 黄臻颖, 沈照鹏, 等. 酶法降解坛紫菜多糖及其产物分析[J]. 食品科学,2015,36(21):145−149. [HAN S S, HUANG Z Y, SHEN Z P, et al. Enzymatic degradation of polysaccharide from Porphyra haitanensis and analysis of its products[J]. Food Science,2015,36(21):145−149. doi: 10.7506/spkx1002-6630-201521028 [6] ZHAO X, XUE C H, LI Z J, et al. Antioxidant and hepatoprotective activities of low molecular weight sulfated polysaccharide from Laminaria japonica[J]. Journal of Applied Phycology,2004,16(2):111−115. doi: 10.1023/B:JAPH.0000044822.10744.59
[7] XUE C H, FANG Y, LIN H, et al. Chemical characters and antioxidative properties of sulfated polysaccharides from Laminaria japonica[J]. Journal of Applied Phycology,2001,13(1):67−70. doi: 10.1023/A:1008103611522
[8] 任立世, 焦思明, 刘洪涛, 等. 岩藻寡糖的制备及抗氧化活性测定[C]//2015中国微生物学会酶工程专业委员会会议论文集. 北京: 中国微生物学会, 2015 : 223. REN L S, JIAO S M, LIU H T, et al. Preparation of algae oligosaccharides and its antioxidative activities in vivo. [C]//2015 Collection of essays of Enzyme Engineering Committee of Chinese Society for Microbiology. Beijing: Chinese Society for Microbiology, 2015 : 223.
[9] 李玉芬. 褐藻胶寡糖的酶解制备及其应用研究[D]. 福州: 福州大学, 2018. LI Y F. Studies on the application of enzymatically prepared alge oligaosaaccharides [D]. Fuzhou: Fuzhou University, 2018.
[10] WANG J, ZHANG Q B, ZHANG Z S, et al. Potential antioxidant and anticoagulant capacity of low molecular weight fucoidan fractions extracted from Laminaria japonica[J]. International Journal of Biological Macromolecule,2010,46(1):6−12. doi: 10.1016/j.ijbiomac.2009.10.015
[11] MOHSIN S, MAHADEVAN R, KURUP G M. Free-radical-scavenging activity and antioxidant effect of ascophyllan from marine brown algaePadina tetrastromatica[J]. Biomedicine and Preventive Nutrition,2014,4(1):75−79. doi: 10.1016/j.bionut.2013.08.006
[12] ANASTYUK S D, SHEVCHENKO N M, ERMAKOVA S P, et al. Anticancer activity in vitro of a fucoidan from the brown alga Fucus evanescens and its low-molecular fragments, structurally characterized by tandem mass-spectrometry[J]. Carbohydrate Polymers,2012,87(1):186−194. doi: 10.1016/j.carbpol.2011.07.036
[13] SHAO P, CHEN X X, SUN P L. In vitro antioxidant and antitumor activities of different sulfated polysaccharides isolated from three algae[J]. International Journal of Biological Macromolecules,2013,62:155−161. doi: 10.1016/j.ijbiomac.2013.08.023
[14] GOMAA H H A, ELSHOUBAKY G A. Antiviral activity of sulfated polysaccharides carrageenan from some marine seaweeds[J]. International Journal of Current Pharmaceutical Review and Research,2016,7(1):34−42.
[15] BESEDNOVA N N, ZVYAGINTSEVA T N, KUZNETSOVA T A, et al. Marine algae metabolites as promising therapeutics for the prevention and treatment of HIV/AIDS[J]. Metabolites,2019,9(5):87. doi: 10.3390/metabo9050087
[16] HANS N, MALIK A, NAIK S. Antiviral activity of sulfated polysaccharides from marine algae and its application in combating COVID-19: Mini review[J]. Bioresource Technology Reports,2021,13:100623. doi: 10.1016/j.biteb.2020.100623
[17] QIU J Q, ZHANG H, WANG Z Y. Ultrasonic degradation of polysaccharides from Auricularia auricula and the antioxidant activity of their degradation products[J]. LWT,2019,113:108266. doi: 10.1016/j.lwt.2019.108266
[18] ZHANG Z S, WANG X M, ZHAO M X, et al. Free-radical degradation by Fe2+/VC/H2O2 and antioxidant activity of polysaccharide from Tremella fuciformis[J]. Carbohydrate Polymers,2014,112:578−582. doi: 10.1016/j.carbpol.2014.06.030
[19] 姜美云, 唐硕, 王婷, 等. 果胶多糖水热法降解及其产物体外抗氧化性评价[J]. 食品科学,2019,40(12):253−259. [JIANG M Y, TANG S, WANG T, et al. Degradation of pectic polysaccharide by hydrothermal treatment and antioxidant activity in vitro of the resulting products[J]. Food Science,2019,40(12):253−259. doi: 10.7506/spkx1002-6630-20180724-295 [20] SHI D L, QI J, ZHANG H, et al. Comparison of hydrothermal depolymerization and oligosaccharide profile of fucoidan and fucosylated chondroitin sulfate fromHolothuria floridana[J]. International Journal of Biological Macromolecules,2019,132:738−747. doi: 10.1016/j.ijbiomac.2019.03.127
[21] 屈义, 周斯仪, 冯陶, 等. 鱼鳔糖胺聚糖的提取及其吸湿保湿性能评价[J]. 食品工业科技,2017,38(16):118−125. [QU Y, ZHOU S Y, FENG T, et al. Extraction of glycosaminoglycans from swim bladder and evaluation of the capacities of its hygroscopicity and moisture retention[J]. Science and Technology of Food Industry,2017,38(16):118−125. [22] CHEN Q R, KOU L Y, WANG F W, et al. Size-dependent whitening activity of enzyme-degraded fucoidan from Laminaria japonica[J]. Carbohydrate Polymers,2019,225:115211. doi: 10.1016/j.carbpol.2019.115211
[23] 黄海潮, 王锦旭, 潘创, 等. 超声波辅助过氧化氢法降解坛紫菜多糖及其抗氧化活性的研究[J]. 南方水产科学,2020,16(1):110−119. [HUANG H C, WANG J X, PAN C, et al. Degradation of Porphyra haitanensis polysaccharide by ultrasonic assisted hydrogen peroxide method and its antioxidant activity analysis[J]. South China Fisheries Science,2020,16(1):110−119. doi: 10.12131/20190220 [24] 赵雪, 李芳, 董诗竹, 等. 相对低分子质量海带岩藻聚糖硫酸酯的制备及其对纤溶系统的影响[J]. 中国海洋药物,2011,30(3):25−30. [ZHAO X, LI F, DONG S Z, et al. Preparation of relative low molecular mass fucoidan from Laminaria japonica and its effect on the fibrinolytic system[J]. Chinese Journal of Marine Drugs,2011,30(3):25−30. [25] OUYANG J M, WANG M, LU P, et al. Degradation of sulfated polysaccharide extracted from algal Laminaria japonica and its modulation on calcium oxalate crystallization[J]. Materials Science and Engineering C,2010,30(7):1022−1029. doi: 10.1016/j.msec.2010.05.002
[26] YUE W, YAO P J, WEI Y N, et al. An innovative method for preparation of acid-free-water-soluble low-molecular-weight chitosan (AFWSLMWC)[J]. Food Chemistry,2008,108(3):1082−1087. doi: 10.1016/j.foodchem.2007.11.047
[27] HOU Y, WANG J, JIN W H, et al. Degradation of Laminaria japonica fucoidan by hydrogen peroxide and antioxidant activities of the degradation products of different molecular weights[J]. Carbohydrate Polymers,2012,87(1):153−159. doi: 10.1016/j.carbpol.2011.07.031
[28] 万真真, 高文宏, 曾新安. 超声波协同过氧化氢氧化法制备低分子质量大豆多糖[J]. 食品与发酵工业,2012,38(10):81−85. [WAN Z Z, GAO W H, ZENG X A. Preparation of low molecular weight hydrogen peroxide with soluble soybean polysaccharide by ultrasonic treatment[J]. Food and Fermentation Industries,2012,38(10):81−85. [29] ASHA K, BADAMALI S K. Highly efficient photocatalytic degradation of lignin by hydrogen peroxide under visible light[J]. Molecular Catalysis,2020,497:111236. doi: 10.1016/j.mcat.2020.111236
[30] 支梓鉴. 超声-芬顿联用技术制备低分子量酸性寡糖[D]. 杭州: 浙江大学, 2017. ZHI Z J. Preparation of low molecular weight acidic oligosaccharides by ultrasound-Fenton treatment[D]. Hangzhou: Zhejiang University, 2017.
[31] WANG J, JIN W H, HOU Y, et al. Chemical composition and moisture-absorption/retention ability of polysaccharides extracted from five algae[J]. International Journal of Biological Macromolecules,2013,57:26−29. doi: 10.1016/j.ijbiomac.2013.03.001
[32] LEKUTTIGE P S F, KIL-NAM K, DAEKYUNG K, et al. Algal polysaccharides: Potential bioactive substances for cosmeceutical applications[J]. Critical Reviews in Biotechnology,2019,39(1):99−113. doi: 10.1080/07388551.2018.1503995
[33] PARK E J, CHOI J I. Melanogenesis inhibitory effect of low molecular weight fucoidan from Undaria pinnatifida[J]. Journal of Applied Phycology,2017,29:2213−2217. doi: 10.1007/s10811-016-1048-4
[34] ZHI Z J, CHEN J L, LI S, et al. Fast preparation of RG-I enriched ultra-low molecular weight pectin by an ultrasound accelerated Fenton process[J]. Scientific Reports,2017,7(1):47−73. doi: 10.1038/s41598-017-00070-6
[35] WEN Y X, GAO L Y, ZHOU H S, et al. Opportunities and challenges of algal fucoidan for diabetes management[J]. Trends in Food Science & Technology,2021,111:628−641.
[36] DAI Y L, JIANG Y F, LU Y A, et al. Fucoidan from acid-processed Hizikia fusiforme attenuates oxidative damage and regulate apoptosis[J]. International Journal of Biological Macromolecules,2020,160:390−397. doi: 10.1016/j.ijbiomac.2020.05.143





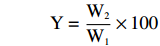
 下载:
下载:
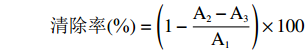
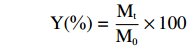
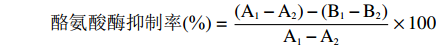
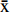

 下载:
下载:
