Tracing the Geographical Origin of Zanthoxylum bungeanum by Volatile Compounds
-
摘要: 采用静态顶空(Headspace,HS)联合气相色谱-质谱联用技术(Gas Chromatography-Mass Spectrometry,GC-MS)对陕西、山东、四川、甘肃4个省份共45个产地花椒的挥发性风味物质进行检测。利用自动质谱退卷积定性系统(AMDIS)结合Kováts保留指数(RI)分析,共得到99种挥发性风味物质。产自陕西、甘肃、山东和四川省的花椒分别鉴定出79、69、68和63种挥发性组分。建立多种数学模型进行产地鉴别,其中正交偏最小二乘法(Orthogonal partial least squares,OPLS-DA)模型能准确区分4个省份的花椒样品,模型拟合参数Q2为0.84,6种关键性差异物质(VIP>2)分别是胡椒酮、蒎烯、萜品烯、3-蒈烯、罗勒烯和α-水芹烯。进一步应用GC-MS全谱数据结合随机森林(Random Forest,RF)模型进行产地鉴别,可以成功区分产自陕西、甘肃、山东和四川省的花椒,准确率为100%。
-
关键词:
- 花椒 /
- 顶空联合气相-色谱质谱法(HS/GC-MS) /
- 挥发性风味物质 /
- 产地溯源
Abstract: The static headspace(HS) combined with gas chromatography-mass spectrometry(GC-MS) was used to analyze the volatile flavor compounds of Zanthoxylum bungeanum from 45 producing areas in Shanxi, Shandong, Sichuan and Gansu. Using automatic mass spectrometry deconvolution qualitative system(AMDIS) and Kováts Retention index(RI) analysis, a total of 99 volatile compounds were obtained. 79, 69, 68 and 63 volatile compounds were identified in Zanthoxylum bungeanum from Shanxi, Gansu, Shandong and Sichuan province. A variety of mathematical models were established to identify the origin. Among them, the Orthogonal partial least squares(OPLS-DA) model could accurately distinguish Zanthoxylum bungeanum samples from 4 provinces, the model fitting parameter Q2 was 0.84, and the 6 key difference substances(VIP>2) were piperonone, pinene, terpinene, 3-carene, ocirene and α-phellandrene. Further application of GC-MS full-spectrum data combined with Random Forest(RF) model for origin identification could successfully distinguish Zanthoxylum bungeanum from Shanxi, Gansu, Shandong and Sichuan provinces, with an accuracy rate of 100%. -
花椒属(Zanthoxylum bungeanum Maxim.)植物属芸香科植物青椒或花椒的干燥成熟果皮[1],按照果实颜色分为红花椒和青花椒(本试验材料为红花椒)。花椒具有开胃之功效[2],是一种典型的药食同源的植物[3],有治疗肝损伤[4]、抑菌[5]、缓解疼痛[6]、杀虫[7]、抗氧化[8]、抗癌[9-11]、消炎[12]等作用。产地溯源技术主要是通过物理[13]、化学[14]和生物[15]方法,建立起能够区分产品产地来源的特征指纹图谱。目前,挥发性风味物质分析可采用的技术有感官分析技术[16]、气相色谱技术[17]、气质联用技术[18]、电子鼻[19]、气相色谱-嗅闻技术[20]和气相色谱质谱-嗅闻技术[21]。在花椒香气成分检测中,应用最为广泛的是气相色谱-质谱联用技术(Gas Chromatography-Mass Spectrometer,GC-MS)[22]。
对花椒的产地判别有多种方法。例如吴振等[23]采用电感耦合等离子体原子发射光谱对红花椒和青花椒中21个无机元素的含量进行测定;吴习宇等[24]采用近红外漫反射光谱结合模式识别对不同产地的花椒样品进行研究;王思思等[25]采用快速气相电子鼻、GC-MS技术结合多元统计方法从挥发性成分的物质构成、模式识别及差异特征方面对不同产地红花椒进行分析,结果表明4大产区红花椒样品可分为三大类;樊丹青等[26]采用GC-MS对甘肃、四川等6个产地红花椒的挥发性成分进行了分析;陈光静等[27]采用GC-MS对3个省的红花椒挥发物进行了比较,结果表明不同产地花椒样品主要成分和含量有所差异。尽管这些报道表明了不同产地花椒的挥发性香气组分存在差异,但采用的前处理方法较为繁琐且未进行明确的产地判别,或进行大致判别但模型的准确率不高且未确定关键差异性物质。
本文建立了一种无需任何前处理的花椒产地鉴别检测方法,采用静态顶空(Headspace,HS)结合气相色谱-质谱联用技术研究陕西、山东、四川、甘肃4个省份45个产地花椒的挥发性风味物质,进而利用主成分分析(Principal component analysis,PCA)、正交偏最小二乘法(Orthogonal partial least squares,OPLS-DA)、偏最小二乘法(Partial least squares method,PLS-DA)、叠加偏最小二乘法(Superposition partial least squares,sPLS-DA)模型以及系统聚类和随机森林(Random Forest,RF)模型对不同产地花椒进行判别分析并确定关键差异性物质,以期为不同产地花椒的香气组分研究和产品品质控制提供理论基础和快速评判方法,为市场上以劣充优、以陈冒新、掺假掺杂的检测和鉴别提供一定的参考依据。
1. 材料与方法
1.1 材料与仪器
花椒样品(干制品)来自陕西、山东、四川和甘肃4个省份,共计45份样品(如表1所示)。所有样品在未检测分析前均密封在−20 ℃避光保存。
表 1 花椒样品产地信息Table 1. Origin information of Chinese pepper陕西 山东 四川 甘肃 合计 韩城12个 泰安4个 汉源2个 天水8个 45个 渭南4个 枣庄4个 茂汶6个 陇南4个 临夏1个 7890A-5975C型气质联用仪、7697A静态顶空进样器 美国安捷伦公司;PL403电子天平(精确度0.1 mg) 梅特勒-托利多仪器上海有限公司。
1.2 实验方法
1.2.1 挥发性成分的提取
准确称取0.25 g的花椒样品(无需预处理)于20 mL顶空瓶中加盖密封,每个样品做3个平行,置静态顶空进样器中按优化后的顶空条件进样。
1.2.2 色谱条件
色谱柱[28]:J&W DB-5MS石英毛细柱(30 m×0.25 mm,0.25 µm);升温程序:40 ℃保持1 min,以3 ℃/min升至150 ℃,保持1 min,再以4 ℃/min升至250 ℃,保持7 min;载气(He)流速1 mL/min,进样量1.0 µL;分流比:10:1;进样口温度:250 ℃。
1.2.3 质谱条件
电子轰击离子源;电子能量70 eV;传输线温度160 ℃;离子源温度230 ℃;四级杆150 ℃;质量扫描范围m/z 50~600;扫描方式:全扫描;调谐文件自动调谐。
1.3 数据处理
安捷伦数据工作站中NIST17.L标准谱库自动检索,通过与标准质谱数据的比对,筛选匹配度达到80%以上的化合物,同时结合化合物结构分析,排除杂质或柱流失等干扰性化合物,并利用自动质谱退卷积定性系统结合保留指数分析。采用待测组分的峰面积作为相应化合物的相对含量。
采用Excel 2010(美国Microsoft公司)进行数据处理及分析;PCA、OPLS-DA模型采用SIMCA 14.1软件(瑞典 Umetrics 公司)完成;PLS-DA、sPLS-DA模型、聚类分析采用Matlab软件完成;RF模型采用R语言的Random Forest完成。
2. 结果与分析
2.1 HS方法的优化
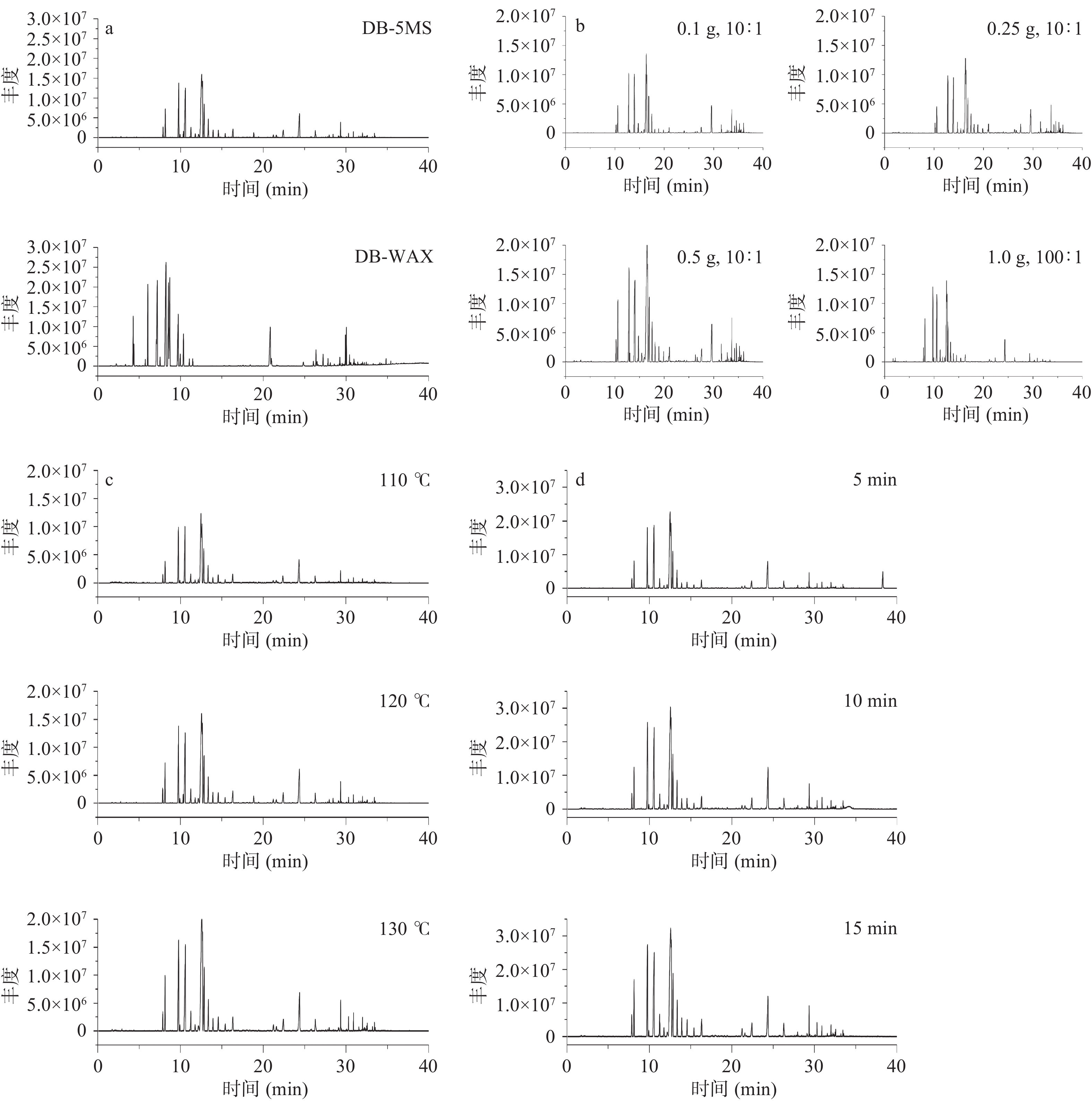
HS方法的分离提取效果受色谱柱、取样量、分流比、加热温度、平衡时间等条件的影响,本研究以陕西省韩城花椒为样品进行试验参数的优化,在预试验的基础上,考察不同色谱柱(DB-5MS、DB-WAX)、取样量与分流比(0.1 g,10:1;0.25 g,10:1;0.5 g,10:1;1.0 g,100:1)、加热温度(110、120、130 ℃)、平衡时间(5、10、15 min)的分离提取效果,每个条件重复3次。
2.1.1 色谱柱对分离效果的影响
在色谱柱的选择方面,比较了强极性柱DB-WAX与非极性柱DB-5MS在挥发性香气物质的分离度差异,DB-WAX色谱柱是聚乙二醇(PEG)固定相,是食品、香精和调味品分析的理想选择,而DB-5MS在分析应用中具有极佳的信噪比,这种性能的改进能提供较好的灵敏度和更完整的质谱图信息。DB-5MS柱对活性化合物惰性极好,且DB-5MS柱流失极低,是用于GC-MS分析的理想色谱柱。DB-WAX在响应值方面有更高的灵敏度(见图1a),但出峰时间在10~20 min时,挥发性香气物质较使用DB-5MS有所损失,综合考虑选择非极性色谱柱DB-5MS。
2.1.2 分流比和取样量对分离提取效果的影响
花椒样品的取样质量直接决定了色谱图中挥发性香气物质的响应值高低,而分流比对保留时间没有很大影响,主要是改善峰型。分流比高,即进入色谱柱的气体少,当色谱峰无法分开或拖尾严重时适当调高分流比,可以改善分离。分流比低,即进入色谱柱的气体多,当分析物含量低,响应值小的时候适当调低分流比,可以增大响应值。
比较了(0.1 g,10:1)、(0.25 g,10:1)、(0.5 g,10:1)与(1.0 g,100:1)的谱图差异(见图1b),0.1 g,10:1可以较完整地展现样品的信息,但由于取样质量过小,易致试验重复性不佳,遂在分流比不变的情况下增大取样质量至0.25 g,两者比较,总体挥发性香气物质的响应值没有很明显的差异。为最大化实现样品的代表性,尝试增大取样质量至0.5 g,此时易导致色谱柱过载,造成分析结果不准确。继续增加质量至1.0 g并提高分流比至100:1,此时丰度较小的挥发性香气物质损失严重。综上,确定花椒取样质量为0.25 g,仪器的分流比为10:1。
2.1.3 加热温度对提取效果的影响
顶空瓶加热温度、定量环温度与传输线温度应由小到大,且传输线温度小于等于进样口的温度。随着顶空瓶加热温度的升高,丰度增大(见图1c),加热温度为110 ℃时,定量环为130 ℃,传输线为150 ℃;加热温度为120 ℃时,定量环为140 ℃,传输线为160 ℃;加热温度为130 ℃时,定量环为150 ℃,传输线为170 ℃。120 ℃时,检测出挥发性物质的种类较110 ℃增多,且增大温度至130 ℃时,种类无明显变化。综上,加热温度选择120 ℃。
2.1.4 平衡时间对提取效果的影响
化合物的分离效果与仪器各个参数息息相关,其之间需要的是平衡与协调。峰面积的大小取决于进样的质量,进样量取决于样品的浓度和体积,体积一般相对固定,而浓度和样品瓶的加热温度和平衡时间有关。随着顶空瓶平衡时间的延长,色谱响应值增加(见图1d),为了尽可能缩短每个样品的进样时间,且兼顾色谱峰的分离效果,故确定平衡时间为10 min。
2.2 不同省份花椒香气成分的组成
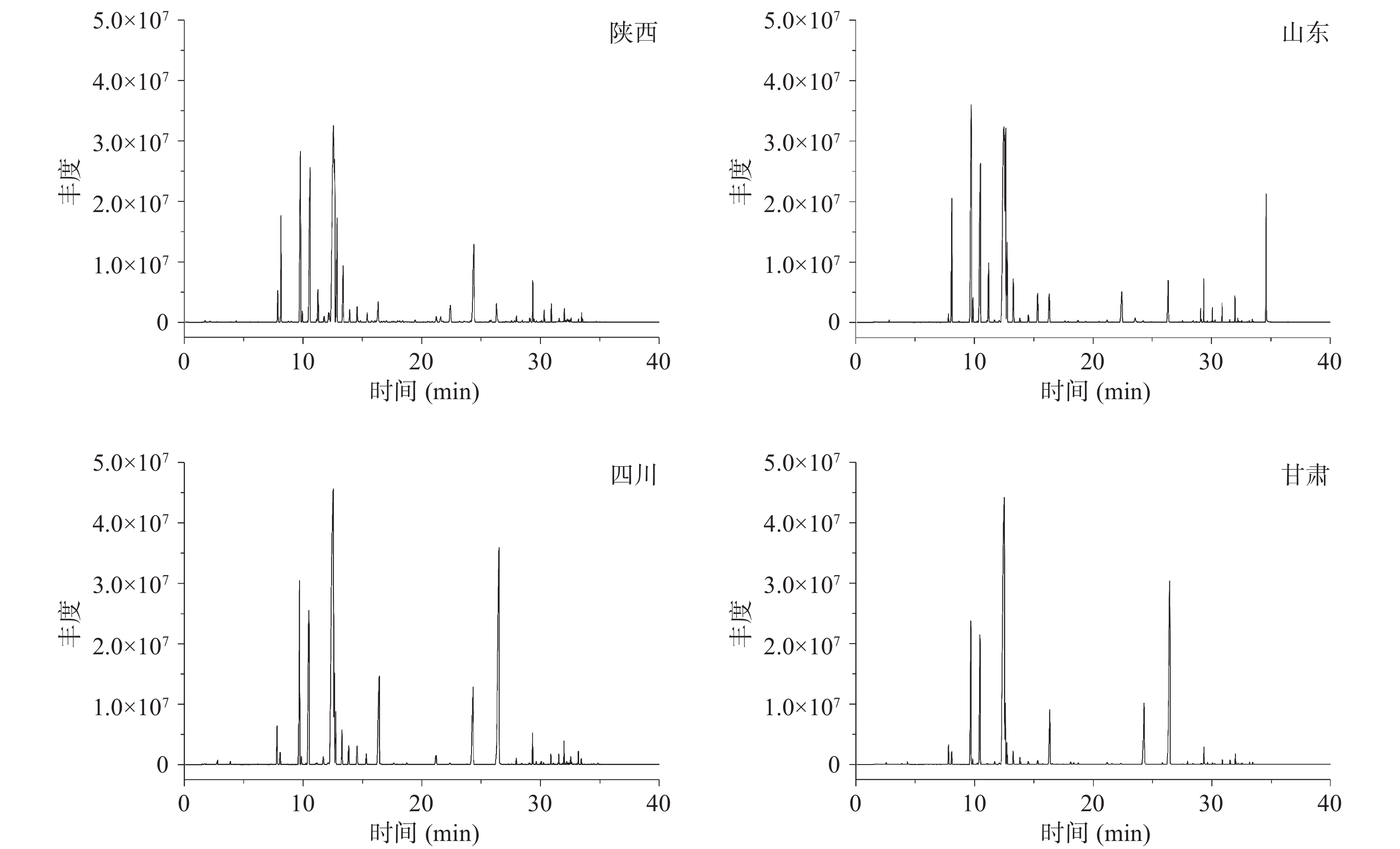
对4省份的45个花椒样品香气成分进行GC-MS检测(结果见表2),选择韩城、泰安、茂汶及陇南4地的样品分别代表陕西、山东、四川、甘肃各省样品的总离子流图(如图2所示)。
表 2 不同产地花椒挥发性物质含量Table 2. Volatile content of Zanthoxylum bungeanum from different origins序号 保留时间 (min) 化合物名称 相对峰面积(RSD%) 陕西 山东 四川 甘肃 1 2.196 2-甲基-3-丁烯-2-醇 2.72E+07(7.82) − 1.61E+07(19.11) 1.34E+06(5.75) 2 2.302 3-甲氧基丁醇 1.66E+06(15.90) − − 2.62E+06(6.20) 3 3.878 乙酸异丁酯 1.08E+07(5.41) 2.01E+06(5.08) 2.08E+07(5.32) 2.29E+07(4.17) 4 3.96 异戊酸甲酯 − 1.68E+06(18.96) − − 5 4.079 3-甲基-2-丁烯醛 8.78E+06(11.23) 3.92E+05(17.38) 5.32E+06(2.97) 4.14E+05(3.37) 6 4.354 己醛 5.20E+06(9.27) 1.25E+06(4.82) 2.68E+06(14.51) 2.72E+06(18.33) 7 4.648 糠醛 4.25E+06(17.64) − − − 8 5.555 反式-2-己烯醛 3.47E+05(4.30) 7.30E+05(7.18) − 2.63E+05(3.67) 9 5.974 丙酸异丁酯 1.95E+06(19.4) − − − 10 6.187 乙酸异戊酯 5.45E+06(4.57) 2.90E+06(12.03) 3.71E+06(2.95) 3.40E+06(4.35) 11 6.618 异己酸甲酯 − − − 1.06E+06(20.54) 12 6.962 庚醛 3.31E+06(4.41) 4.62E+05(20.47) 1.02E+06(7.51) 7.97E+05(3.94) 13 7.269 (E,E)-2,4-己二烯醛 4.37E+06(7.85) 1.04E+06(7.62) 1.04E+07(2.83) 6.60E+06(4.97) 14 7.744 3-侧柏烯 2.32E+08(7.98) 5.01E+05(21.25) 1.47E+08(8.75) 2.19E+08(33.43) 15 7.807 丁苯烯 2.71E+06(20.54) 2.60E+07(11.65) − − 16 7.913 4-甲基-2-戊酸甲酯 − − 1.11E+06(17.87) 1.12E+06(22.88) 17 8.076 蒎烯 1.14E+09(25.73) 6.89E+08(23.37) 1.01E+08(25.38) 9.56E+07(30.13) 18 8.701 莰烯 1.39E+08(2.69) 7.69E+06(3.91) 4.39E+06(2.51) 3.34E+06(3.42) 19 9.014 丁酸异丁酯 1.30E+07(4.52) 8.19E+05(6.66) 3.12E+06(5.61) − 20 9.689 桧烯 2.19E+09(2.78) 1.15E+09(4.71) 1.55E+09(4.16) 1.58E+09(2.98) 21 9.858 β-蒎烯 1.19E+08(4.59) 1.31E+09(15.25) 6.74E+07(2.75) 5.65E+07(3.94) 22 10.471 月桂烯 2.57E+09(2.52) 1.14E+09(2.99) 2.34E+09(5.09) 1.43E+09(3.42) 23 11.153 假单烯柠檬烯 1.59E+07(5.78) 1.14E+07(7.64) 6.74E+06(7.89) 6.48E+06(8.53) 24 11.172 α-水芹烯 2.59E+08(5.78) 2.92E+08(2.48) 1.33E+07(4.03) 1.14E+07(4.03) 25 11.579 乙酸己酯 7.39E+06(4.76) − 9.52E+05(13.05) 1.17E+06(2.31) 26 11.704 α-萜品烯 5.62E+07(4.23) 2.21E+07(6.86) 5.70E+07(5.25) 5.01E+07(4.09) 27 12.098 邻异丙基甲苯 1.60E+08(8.84) 2.24E+07(19.89) 1.54E+07(27.03) 8.29E+06(6.09) 28 12.511 柠檬烯 6.09E+09(27.60) 3.22E+08(11.27) 7.45E+09(16.09) 6.28E+09(28.05) 29 12.598 桉叶油醇 1.32E+09(5.98) 1.08E+09(4.36) 7.01E+08(21.44) 4.78E+08(26.07) 30 12.73 反式-β-罗勒烯 1.03E+09(4.11) 4.57E+08(5.09) 4.90E+08(28.33) 3.50E+08(4.44) 31 13.261 罗勒烯 4.91E+08(4.66) 2.36E+08(4.37) 4.08E+08(4.52) 2.64E+08(4.93) 32 14.575 2-甲基-5-异丙基-二环[3.1.0]己烷-2-醇 1.03E+08(6.88) − − − 33 14.856 正辛醇 7.48E+06(16.88) 1.54E+06(13.44) − − 34 15.326 萜品油烯 7.95E+07(2.59) 1.63E+08(3.94) 8.41E+07(4.38) 7.56E+07(4.07) 35 15.582 2,4-二甲基苯乙烯 1.01E+07(20.57) 1.28E+06(20.08) − 8.23E+05(4.96) 36 16.12 紫苏烯 1.32E+09(4.98) 1.26E+08(20.52) 1.47E+09(4.92) 1.47E+06(8.18) 37 16.345 芳樟醇 1.74E+08(24.82) 2.67E+08(3.79) 1.89E+09(2.35) 1.12E+09(4.55) 38 16.552 壬醛 1.55E+07(5.77) 5.01E+07(17.05) 1.23E+07(4.39) 1.11E+07(3.67) 39 16.752 异戊酸异戊酯 1.21E+08(6.78) 1.58E+06(6.75) − − 40 17.064 乙酸庚酯 1.21E+08(6.77) 1.53E+06(8.78) − − 41 17.484 1,3,8-对戊三烯 1.74E+08(8.77) − − 5.93E+06(6.80) 42 17.896 别罗勒烯 1.59E+07(4.70) 7.46E+06(6.24) 7.07E+06(14.27) 4.78E+06(4.70) 43 18.222 (R)-氧化柠檬烯 1.17E+07(7.88) − − − 44 18.141 1,5,8-对戊三烯 1.17E+07(7.90) 1.41E+06(6.97) − − 45 19.392 香茅醛 4.28E+07(5.52) 3.92E+06(3.54) 3.77E+06(4.34) 7.45E+06(5.51) 46 21.231 4-萜烯醇 5.50E+07(6.89) 2.41E+07(8.98) 8.76E+07(5.89) − 47 21.75 4-异丙基-2-环己烯酮 5.58E+07(13.35) 5.63E+06(6.11) − 3.37E+06(7.34) 48 22.012 2-(4-甲基苯基)丙-2-醇 1.21E+07(12.89) 3.57E+06(4.90) − − 49 22.419 alpha-松油醇 1.67E+08(3.54) 2.46E+08(5.23) 4.74E+07(16.51) − 50 23.182 波斯菊萜 1.08E+07(11.07) 1.28E+07(2.55) 3.10E+06(10.06) 1.45E+06(4.05) 51 23.482 癸醛 2.01E+07(2.91) − 2.33E+06(4.50) 2.49E+06(5.49) 52 24.108 醋酸辛酯 1.24E+07(15.98) 4.60E+06(14.22) − − 53 25.709 枯茗醛 2.62E+07(11.41) 1.17E+06(4.29) 3.26E+06(2.76) 6.85E+05(7.55) 54 25.834 右旋香芹酮 2.44E+07(10.61) 5.26E+05(20.71) 1.55E+07(14.75) 3.81E+06(9.36) 55 26.297 胡椒酮 1.79E+08(4.49) 3.22E+08(23.46) 3.33E+09(6.71) − 56 26.71 3,7-二甲基-6-辛烯酸甲酯 3.35E+06(6.88) 5.92E+07(25.10) − − 57 27.029 柠檬醛 − 8.97E+05(6.80) − − 58 27.279 萜品烯 7.12E+06(4.19) 2.36E+06(3.28) 3.51E+06(3.33) 3.81E+06(3.40) 59 27.548 乙酸冰片酯 1.28E+07(5.53) 8.38E+06(3.67) 1.17E+07(17.62) 6.07E+06(3.84) 60 27.817 对异丙基苯甲醇 1.27E+07(12.88) − − − 61 28.068 紫苏醇 1.84E+06(14.56) − − − 62 28.28 对甲基-1,3,8-三烯 − − 1.62E+06(1.87) 1.53E+06(7.89) 63 28.749 乙酸桃金娘烯酯 − 6.10E+06(20.90) − − 64 29.638 3-蒈烯 − 4.77E+06(21.93) 1.37E+07(9.54) 9.77E+06(7.98) 65 29.663 神经异戊酸酯 8.04E+06(16.78) − − − 66 29.975 α-荜澄茄油烯 − − − 2.72E+06(17.89) 67 29.982 胡椒烯 5.89E+06(6.84) 4.08E+06(9.56) 6.02E+06(6.89) 5.33E+06(3.51) 68 30.094 乙酸香叶酯 8.05E+06(16.53) 4.87E+07(15.93) − − 69 30.251 双环倍半萜烯 − − 1.23E+07(7.19) 4.16E+0(18.49) 70 30.37 十四烷 4.12E+06(6.15) − 2.14E+06(16.74) 9.28E+05(17.86) 71 30.639 a-古芸烯 2.75E+06(6.61) 5.97E+05(8.66) 2.61E+06(4.89) 7.49E+05(6.89) 72 30.876 石竹烯 6.17E+07(5.77) 6.01E+07(7.89) 3.58E+07(3.86) 1.63E+07(6.52) 73 31.064 γ-榄香烯 − − 3.62E+06(15.00) 1.10E+06(11.97) 74 31.139 反式香柠檬烯 − − 3.07E+06(14.41) 1.44E+06(21.99) 75 31.483 金合欢烯 − 7.83E+05(20.60) 5.58E+06(18.75) 1.93E+06(20.64) 76 31.539 α-石竹烯 1.48E+07(4.88) 1.00E+07(6.90) 3.46E+07(5.55) 1.43E+07(3.89) 77 31.614 别香橙烯 6.78E+06(16.80) 2.40E+06(13.89) 5.43E+06(13.72) 2.23E+06(16.83) 78 31.865 γ-丁二烯 5.07E+06(3.78) 1.49E+06(6.52) 2.31E+06(4.68) 1.30E+06(5.90) 79 31.977 右旋大根香叶烯 − − 7.46E+07(13.64) 3.31E+07(16.99) 80 32.102 (Z,Z)-α-法呢烯 − − − 2.63E+06(19.77) 81 32.252 α-丁二烯 6.82E+06(20.06) 2.03E+06(6.52) − 4.18E+06(6.10) 82 32.315 α-法尼烯 9.70E+06(3.66) 3.65E+06(4.75) 4.83E+06(5.87) 2.20E+06(6.86) 83 32.39 β-异丁烯二烯 − − 5.18E+06(16.38) 2.19E+06(17.53) 84 32.409 左旋榄香烯 8.39E+06(15.81) 3.03E+06(18.54) − − 85 32.484 (-)-g-卡丁烯 9.27E+06(16.77) 2.77E+06(15.37) 1.33E+07(18.27) 2.91E+06(18.64) 86 32.553 d-卡丁烯 1.57E+07(15.84) 5.73E+06(16.42) 2.52E+07(17.55) 4.41E+06(16.18) 87 32.634 Β-倍半水芹烯 − − 7.05E+06(20.95) 2.72E+06(19.65) 88 32.772 依兰烯 − − 2.34E+06(16.99) 5.21E+05(20.98) 89 32.803 (+)-α-长叶蒎烯 1.96E+06(17.93) 7.64E+05(16.99) − − 90 32.928 大根香叶烯B − − 1.32E+06(12.74) 3.39E+05(18.56) 91 33.034 环己烷甲醇 2.18E+06(24.74) − − − 92 33.522 氧化石竹烯 1.37E+07(20.66) − 2.90E+06(16.83) 93 33.553 g-石竹烯 2.40E+06(13.74) 4.70E+06(21.31) 3.24E+06(15.77) 2.22E+06(4.79) 94 33.685 十六烷 4.00E+06(17.65) 1.62E+06(26.26) 2.76E+06(19.99) 1.35E+06(13.98) 95 34.492 β-愈创木烯 − − − 8.07E+05(20.01) 96 34.504 Α-毕橙茄醇 3.46E+06(18.65) − − − 97 34.654 花椒素 − 5.09E+08(17.64) 1.07E+06(21.82) − 98 34.961 十七烷 1.29E+06(16.99) − − − 99 35.155 桉油烯醇 1.67E+06(16.73) − − − 定性分析结果表明,4省份花椒共鉴定出99种挥发性物质(表2),可分为醇类、醛类、酮类、酯类、烷类、烯类及其它类化合物。陕西省共鉴定出79种挥发性物质;甘肃省共鉴定出69种挥发性物质;山东省共鉴定出68种挥发性物质;四川省共鉴定出63种挥发性物质。陕西、四川、甘肃3省的花椒样品挥发性物质含量最高的均是柠檬烯,出峰时间在12.511 min,山东省的泰安市宁阳、孙伯两地和枣庄市水泉、徐庄两地挥发性物质含量最高的也是柠檬烯,而泰安市东平、淝城两地及枣庄市卞桥、城头两地挥发性物质含量最高的β-蒎烯,出峰时间在9.858 min。
2.3 不同省份花椒挥发性物质的产地判别分析
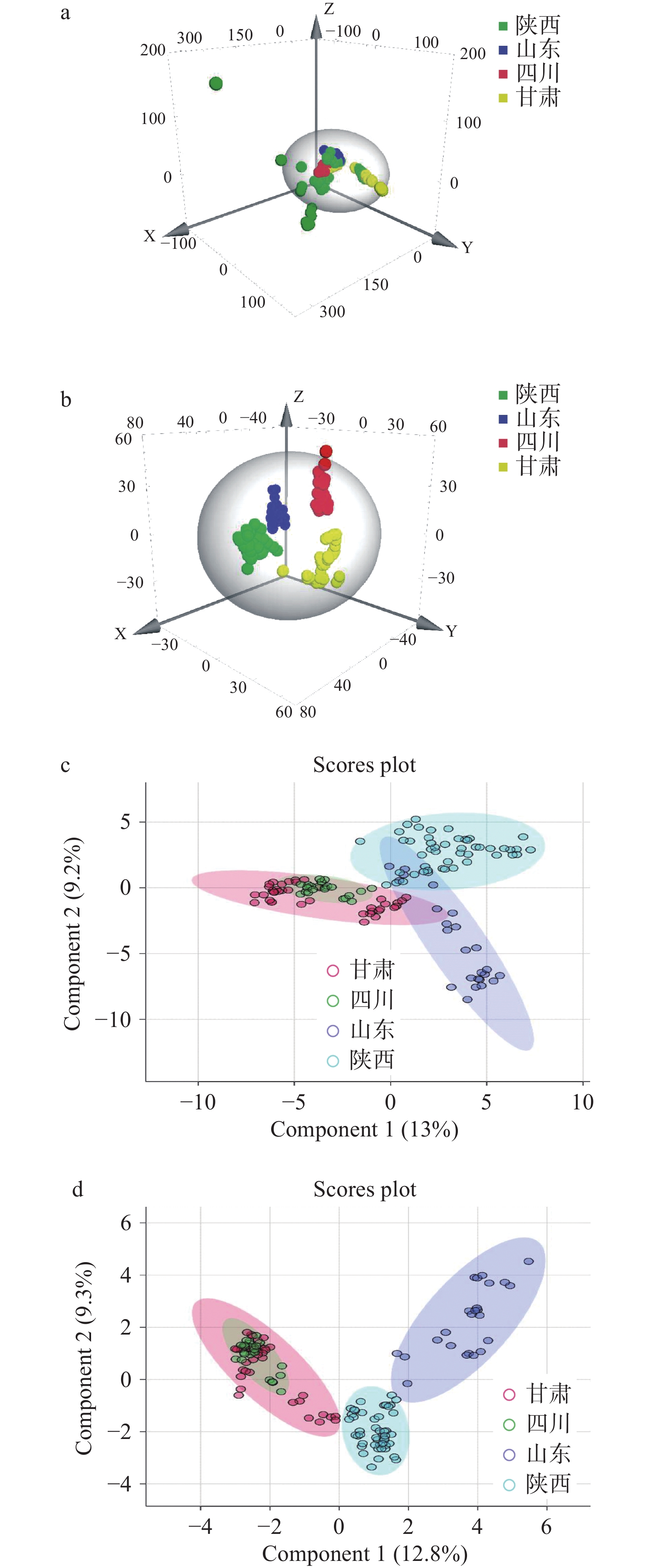
基于4个省份45个产地135个花椒样品香气成分建立了相应的PCA模型(见图3a)和OPLS-DA模型(见图3b),数学模型质量评价指标包括R2X、R2Y和Q2,R2X表示模型中隐变量反映自变量X的变异百分比,R2Y表示模型中隐变量反映自变量Y的变异百分比,Q2表示模型的预测能力,模型所获得的隐变量能够预测X和Y的变异累积百分比。一般来说,R2X、R2Y和Q2的值越大,且R2Y和Q2的比值越接近于1时,表示模型越稳定可靠[29]。
PCA模型表明花椒样品无法获得较好聚类效果。推测由于PCA采用无监督的降维分析方法,样品中品种及产地等因素对该模型的干扰较大,所以无法获得理想效果。而OPLS-DA 是一种用于判别分析的多变量统计分析方法,其原理是对不同处理样本(如观测样本、对照样本)的特性分别进行训练,产生训练集,并检验训练集的可信度。该方法可以先对所需的观察变量进行分组,后根据组别性质对数据进行统计分析,从而可以精确获悉影响分组的关键变量[30]。该PCA模型拟合参数R2X为0.898,R2Y为0.838;OPLS-DA模型拟合参数R2X为0.83,R2Y为0.878,Q2为0.84。通过OPLS-DA模型可成功区分陕西、山东、四川、甘肃4省的花椒样品,且良好的拟合参数证明了该模型的准确性。
为了使组间的差异最大化,进一步利用GC-MS全谱数据建立PLS-DA(见图3c)和sPLS-DA模型(见图3d),模型最终计算出2个主成分,图中每一个点代表一个样品,可见所有的样品都集中分布在散点图的椭圆内(95%可信区内)。PLS-DA模型中陕西和山东、甘肃和四川的部分产地有交集,而sPLS-DA模型中甘肃和四川部分产地有交集,可见此两种模型不如OPLS-DA模型更适宜于表现不同省份花椒样品的差异性。
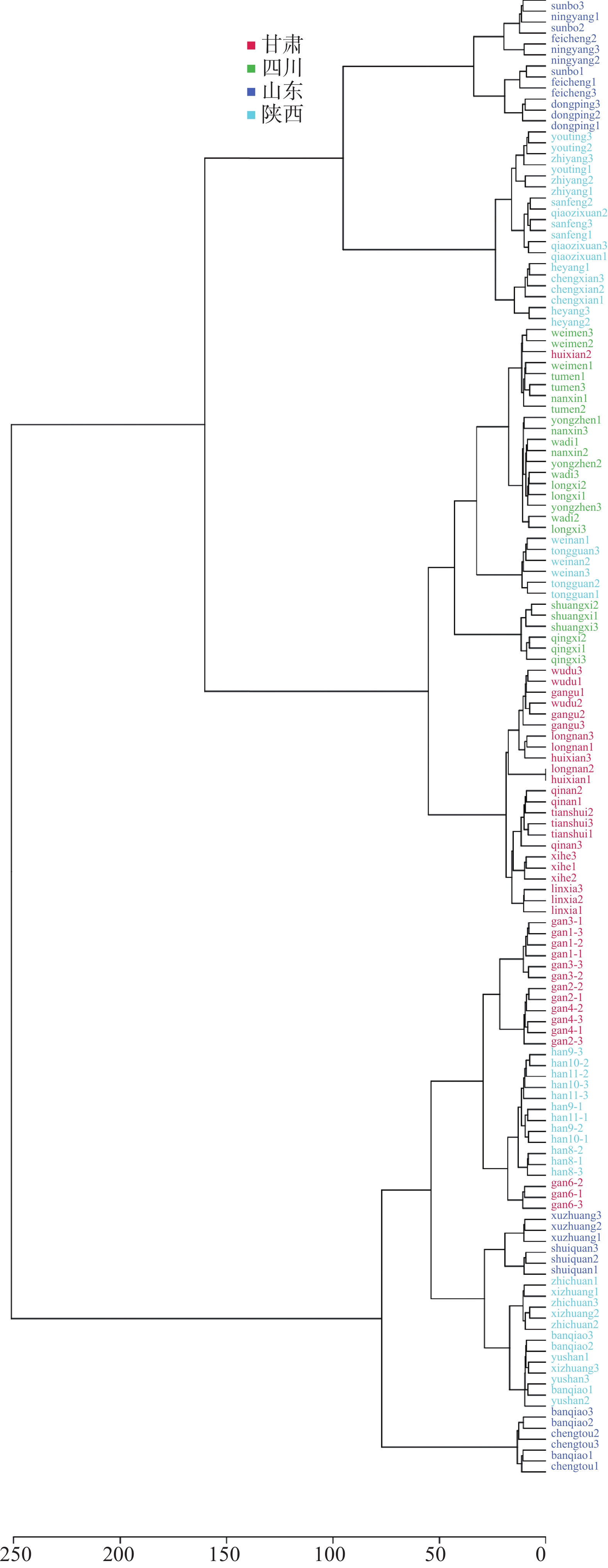
将4省份共45产地的花椒样品GC-MS数据进行系统聚类(见图4),以更加简单、直观的方式反映各产地的花椒样品(具体产地名称见图4下方样品编号,每个产地3个平行,分别列为1、2和3)。结果表明,四川汉源和茂汶的所有样品分布较为集中,甘肃省有1份样品与省内其他样品差异较大,推测可能由于其为市场上未经初选和处理的毛货,与其他样品本身存在较大差异,而陕西韩城的部分花椒样品和山东枣庄的花椒样品聚为同类,推测可能由于两地所处的纬度相近。进一步利用花椒样品GC-MS数据建立随机森林模型,可以成功区分4个省份共135份花椒样品,判别正确率为100%(如表3所示)。
表 3 随机森林分类判别结果Table 3. Random forest classification discrimination results陕西 山东 四川 甘肃 错误率 陕西 48.00 0.00 0.00 0.00 0.00 山东 0.00 24.00 0.00 0.00 0.00 四川 0.00 0.00 24.00 0.00 0.00 甘肃 0.00 0.00 0.00 39.00 0.00 2.4 花椒香气成分主要差异性物质分析
花椒香气成分判别分析结果表明,OPLS-DA模型对于4个省份的花椒样品具有良好的分离性,通过该模型筛选出62种VIP值大于1.0的化合物(见表4),其中VIP值大于2.0的共有6个,分别为胡椒酮、蒎烯、萜品烯、3-蒈烯、罗勒烯和α-水芹烯,可以作为不同省份花椒判别的关键差异性物质。其中胡椒酮是从胡椒油中分离的一种含氧单萜类物质,具有薄荷气味,存在于胡椒科植物中;蒎烯存在于多种天然精油中,有α-蒎烯和β-蒎烯两种异构体;萜品烯为单萜单环类化合物,具有类似柑橘和柠檬的香气,主要用于配制人造柠檬和薄荷精油;罗勒烯有草香、花香并伴有橙花油气息,可用于多种日化香精配方中;α-水芹烯是水芹烯的异构体,有柑橘和胡椒的香味。胡椒酮含量最高的为四川省,其次是山东和陕西,而甘肃省的花椒样品未检出;3-蒈烯含量最高的也为四川省,其次是甘肃和山东,而陕西省的花椒样品未检出;蒎烯含量最高的为陕西省;山东、四川和甘肃分列其次;萜品烯含量最高的为陕西省,明显高于其他省份;罗勒烯含量较高的是陕西和四川省,而甘肃和四川省的花椒样品含量相对较低;α-水芹烯含量较高的是山东和陕西省,而四川和甘肃省的花椒样品含量相对较低。
表 4 不同产地花椒主成分分析中关键挥发性差异物质VIP值Table 4. Key volattiles with value of importance of Zanthoxylum bungeanum from different origins based on OPLS-DA序号 Cas编号 名称 VIP值 1 000089-81-6 胡椒酮 2.18324 2 007785-70-8 蒎烯 2.14603 3 000099-85-4 萜品烯 2.14099 4 013466-78-9 3-蒈烯 2.06972 5 013877-91-3 罗勒烯 2.04259 6 000099-83-2 α-水芹烯 2.04006 7 000562-74-3 4-萜烯醇 1.96256 8 000078-70-6 芳樟醇 1.87689 9 000460-01-5 波斯菊萜 1.86787 10 006753-98-6 α-石竹烯 1.84402 11 000489-40-7 a-古芸烯 1.83995 12 000539-52-6 紫苏烯 1.83141 13 000112-31-2 癸醛 1.82284 14 000483-76-1 d-卡丁烯 1.81587 15 000142-83-6 (E,E)-2,4-己二烯醛 1.78666 16 000138-86-3 柠檬烯 1.77781 17 000586-62-9 萜品油烯 1.74484 18 000499-97-8 假单烯柠檬烯 1.74206 19 000110-19-0 乙酸异丁酯 1.69269 20 000527-84-4 邻异丙基甲苯 1.66035 21 030021-74-0 γ-丁二烯 1.62196 22 039029-41-9 (−)-g-卡丁烯 1.62126 23 000470-82-6 桉叶油醇 1.59106 24 000087-44-5 石竹烯 1.58901 25 018794-84-8 金合欢烯 1.57102 26 000099-86-5 α-萜品烯 1.5583 27 003779-61-1 反式-β-罗勒烯 1.54069 28 000111-71-7 庚醛 1.4763 29 000150-84-5 乙酸香茅酯 1.45906 30 000106-23-0 香茅醛 1.44425 31 003856-25-5 胡椒烯 1.44203 32 007216-56-0 别罗勒烯 1.4291 33 000502-61-4 α-法尼烯 1.41543 34 000076-49-3 乙酸冰片酯 1.41058 35 025246-27-9 别香橙烯 1.41006 36 028634-89-1 丁苯烯 1.37865 37 000508-32-7 1,7,7-三甲基三环[2.2.2.02.6]庚烷 1.37268 38 000489-39-4 (+)-香橙烯 1.37095 39 000123-35-3 月桂烯 1.31101 40 000539-90-2 丁酸异丁酯 1.30613 41 000502-99-8 3,7-二甲基-1,3,7-辛三烯 1.30159 42 006728-26-3 反式-2-己烯醛 1.28547 43 000500-02-7 4-异丙基-2-环己烯酮 1.27445 44 000142-92-7 乙酸己酯 1.27199 45 029873-99-2 γ-榄香烯 1.2604 46 000118-65-0 g-石竹烯 1.25325 47 000101-41-7 苯乙酸甲酯 1.23944 48 000515-13-9 左旋榄香烯 1.23913 49 001195-32-0 2,4-二甲基苯乙烯 1.21939 50 003387-41-5 桧烯 1.20775 51 000629-59-4 十四烷 1.2074 52 000127-91-3 β-蒎烯 1.17874 53 000124-19-6 壬醛 1.1711 54 000544-76-3 十六烷 1.14205 55 000105-87-3 乙酸香叶酯 1.13322 56 000098-55-5 alpha-松油醇 1.12008 57 005989-33-3 顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇 1.11562 58 024703-35-3 双环菊酯 1.09433 59 054324-03-7 双环倍半萜烯 1.06306 60 000122-03-2 枯茗醛 1.06057 61 000107-86-8 3-甲基-2-丁烯醛 1.02188 62 010208-80-7 α-丁二烯 1.0207 3. 结论
通过考察在不同色谱柱、花椒取样量与分流比、加热温度与平衡时间条件下花椒样品的分离提取效果,建立了一套适宜于检测花椒样品挥发性风味物质的HS/GC-MS方法:使用DB-5MS色谱柱,选取0.25 g的花椒样品在120 ℃加热10 min,分流比为10:1。该方法无需对花椒样品进行任何前处理,简单、快捷、高效且重复性、稳定性好。通过对陕西、山东、四川、甘肃4个省份共45个产地即135个花椒样本的挥发性风味物质进行分析,共检测出99种挥发性风味成分,可分为烯类49种、酯类16种、醇类14种、醛类11种、酮类3种、烷类3种、苯类1种、萜类1种及其它类化合物1种,其中陕西省共鉴定出79种;甘肃省共鉴定出69种;山东省共鉴定出68种;四川省共鉴定出63种。基于挥发性风味物质的种类和含量分别建立PCA和OPLS-DA模型进行判别,结果表明OPLS-DA模型可以成功区分不同省份的花椒样品,模型拟合参数R2X为0.83,R2Y为0.878,Q2为0.84,证明了该模型的准确性。基于此模型筛选出62种VIP值大于1.0的化合物,其中VIP值大于2.0的挥发性物质有6个,分别为胡椒酮、蒎烯、萜品烯、3-蒈烯、罗勒烯和α-水芹烯,说明这些挥发性风味物质能够很好地描述不同省份花椒样品的香气差异。进一步基于GC-MS全谱数据建立PLS-DA、sPLS-DA、系统聚类和RF模型,结果表明RF模型可以成功将不同省份的花椒区分开,判别准确率达100%,表明花椒的挥发性物质与其产地具有一定的相关性。
-
表 1 花椒样品产地信息
Table 1 Origin information of Chinese pepper
陕西 山东 四川 甘肃 合计 韩城12个 泰安4个 汉源2个 天水8个 45个 渭南4个 枣庄4个 茂汶6个 陇南4个 临夏1个 表 2 不同产地花椒挥发性物质含量
Table 2 Volatile content of Zanthoxylum bungeanum from different origins
序号 保留时间 (min) 化合物名称 相对峰面积(RSD%) 陕西 山东 四川 甘肃 1 2.196 2-甲基-3-丁烯-2-醇 2.72E+07(7.82) − 1.61E+07(19.11) 1.34E+06(5.75) 2 2.302 3-甲氧基丁醇 1.66E+06(15.90) − − 2.62E+06(6.20) 3 3.878 乙酸异丁酯 1.08E+07(5.41) 2.01E+06(5.08) 2.08E+07(5.32) 2.29E+07(4.17) 4 3.96 异戊酸甲酯 − 1.68E+06(18.96) − − 5 4.079 3-甲基-2-丁烯醛 8.78E+06(11.23) 3.92E+05(17.38) 5.32E+06(2.97) 4.14E+05(3.37) 6 4.354 己醛 5.20E+06(9.27) 1.25E+06(4.82) 2.68E+06(14.51) 2.72E+06(18.33) 7 4.648 糠醛 4.25E+06(17.64) − − − 8 5.555 反式-2-己烯醛 3.47E+05(4.30) 7.30E+05(7.18) − 2.63E+05(3.67) 9 5.974 丙酸异丁酯 1.95E+06(19.4) − − − 10 6.187 乙酸异戊酯 5.45E+06(4.57) 2.90E+06(12.03) 3.71E+06(2.95) 3.40E+06(4.35) 11 6.618 异己酸甲酯 − − − 1.06E+06(20.54) 12 6.962 庚醛 3.31E+06(4.41) 4.62E+05(20.47) 1.02E+06(7.51) 7.97E+05(3.94) 13 7.269 (E,E)-2,4-己二烯醛 4.37E+06(7.85) 1.04E+06(7.62) 1.04E+07(2.83) 6.60E+06(4.97) 14 7.744 3-侧柏烯 2.32E+08(7.98) 5.01E+05(21.25) 1.47E+08(8.75) 2.19E+08(33.43) 15 7.807 丁苯烯 2.71E+06(20.54) 2.60E+07(11.65) − − 16 7.913 4-甲基-2-戊酸甲酯 − − 1.11E+06(17.87) 1.12E+06(22.88) 17 8.076 蒎烯 1.14E+09(25.73) 6.89E+08(23.37) 1.01E+08(25.38) 9.56E+07(30.13) 18 8.701 莰烯 1.39E+08(2.69) 7.69E+06(3.91) 4.39E+06(2.51) 3.34E+06(3.42) 19 9.014 丁酸异丁酯 1.30E+07(4.52) 8.19E+05(6.66) 3.12E+06(5.61) − 20 9.689 桧烯 2.19E+09(2.78) 1.15E+09(4.71) 1.55E+09(4.16) 1.58E+09(2.98) 21 9.858 β-蒎烯 1.19E+08(4.59) 1.31E+09(15.25) 6.74E+07(2.75) 5.65E+07(3.94) 22 10.471 月桂烯 2.57E+09(2.52) 1.14E+09(2.99) 2.34E+09(5.09) 1.43E+09(3.42) 23 11.153 假单烯柠檬烯 1.59E+07(5.78) 1.14E+07(7.64) 6.74E+06(7.89) 6.48E+06(8.53) 24 11.172 α-水芹烯 2.59E+08(5.78) 2.92E+08(2.48) 1.33E+07(4.03) 1.14E+07(4.03) 25 11.579 乙酸己酯 7.39E+06(4.76) − 9.52E+05(13.05) 1.17E+06(2.31) 26 11.704 α-萜品烯 5.62E+07(4.23) 2.21E+07(6.86) 5.70E+07(5.25) 5.01E+07(4.09) 27 12.098 邻异丙基甲苯 1.60E+08(8.84) 2.24E+07(19.89) 1.54E+07(27.03) 8.29E+06(6.09) 28 12.511 柠檬烯 6.09E+09(27.60) 3.22E+08(11.27) 7.45E+09(16.09) 6.28E+09(28.05) 29 12.598 桉叶油醇 1.32E+09(5.98) 1.08E+09(4.36) 7.01E+08(21.44) 4.78E+08(26.07) 30 12.73 反式-β-罗勒烯 1.03E+09(4.11) 4.57E+08(5.09) 4.90E+08(28.33) 3.50E+08(4.44) 31 13.261 罗勒烯 4.91E+08(4.66) 2.36E+08(4.37) 4.08E+08(4.52) 2.64E+08(4.93) 32 14.575 2-甲基-5-异丙基-二环[3.1.0]己烷-2-醇 1.03E+08(6.88) − − − 33 14.856 正辛醇 7.48E+06(16.88) 1.54E+06(13.44) − − 34 15.326 萜品油烯 7.95E+07(2.59) 1.63E+08(3.94) 8.41E+07(4.38) 7.56E+07(4.07) 35 15.582 2,4-二甲基苯乙烯 1.01E+07(20.57) 1.28E+06(20.08) − 8.23E+05(4.96) 36 16.12 紫苏烯 1.32E+09(4.98) 1.26E+08(20.52) 1.47E+09(4.92) 1.47E+06(8.18) 37 16.345 芳樟醇 1.74E+08(24.82) 2.67E+08(3.79) 1.89E+09(2.35) 1.12E+09(4.55) 38 16.552 壬醛 1.55E+07(5.77) 5.01E+07(17.05) 1.23E+07(4.39) 1.11E+07(3.67) 39 16.752 异戊酸异戊酯 1.21E+08(6.78) 1.58E+06(6.75) − − 40 17.064 乙酸庚酯 1.21E+08(6.77) 1.53E+06(8.78) − − 41 17.484 1,3,8-对戊三烯 1.74E+08(8.77) − − 5.93E+06(6.80) 42 17.896 别罗勒烯 1.59E+07(4.70) 7.46E+06(6.24) 7.07E+06(14.27) 4.78E+06(4.70) 43 18.222 (R)-氧化柠檬烯 1.17E+07(7.88) − − − 44 18.141 1,5,8-对戊三烯 1.17E+07(7.90) 1.41E+06(6.97) − − 45 19.392 香茅醛 4.28E+07(5.52) 3.92E+06(3.54) 3.77E+06(4.34) 7.45E+06(5.51) 46 21.231 4-萜烯醇 5.50E+07(6.89) 2.41E+07(8.98) 8.76E+07(5.89) − 47 21.75 4-异丙基-2-环己烯酮 5.58E+07(13.35) 5.63E+06(6.11) − 3.37E+06(7.34) 48 22.012 2-(4-甲基苯基)丙-2-醇 1.21E+07(12.89) 3.57E+06(4.90) − − 49 22.419 alpha-松油醇 1.67E+08(3.54) 2.46E+08(5.23) 4.74E+07(16.51) − 50 23.182 波斯菊萜 1.08E+07(11.07) 1.28E+07(2.55) 3.10E+06(10.06) 1.45E+06(4.05) 51 23.482 癸醛 2.01E+07(2.91) − 2.33E+06(4.50) 2.49E+06(5.49) 52 24.108 醋酸辛酯 1.24E+07(15.98) 4.60E+06(14.22) − − 53 25.709 枯茗醛 2.62E+07(11.41) 1.17E+06(4.29) 3.26E+06(2.76) 6.85E+05(7.55) 54 25.834 右旋香芹酮 2.44E+07(10.61) 5.26E+05(20.71) 1.55E+07(14.75) 3.81E+06(9.36) 55 26.297 胡椒酮 1.79E+08(4.49) 3.22E+08(23.46) 3.33E+09(6.71) − 56 26.71 3,7-二甲基-6-辛烯酸甲酯 3.35E+06(6.88) 5.92E+07(25.10) − − 57 27.029 柠檬醛 − 8.97E+05(6.80) − − 58 27.279 萜品烯 7.12E+06(4.19) 2.36E+06(3.28) 3.51E+06(3.33) 3.81E+06(3.40) 59 27.548 乙酸冰片酯 1.28E+07(5.53) 8.38E+06(3.67) 1.17E+07(17.62) 6.07E+06(3.84) 60 27.817 对异丙基苯甲醇 1.27E+07(12.88) − − − 61 28.068 紫苏醇 1.84E+06(14.56) − − − 62 28.28 对甲基-1,3,8-三烯 − − 1.62E+06(1.87) 1.53E+06(7.89) 63 28.749 乙酸桃金娘烯酯 − 6.10E+06(20.90) − − 64 29.638 3-蒈烯 − 4.77E+06(21.93) 1.37E+07(9.54) 9.77E+06(7.98) 65 29.663 神经异戊酸酯 8.04E+06(16.78) − − − 66 29.975 α-荜澄茄油烯 − − − 2.72E+06(17.89) 67 29.982 胡椒烯 5.89E+06(6.84) 4.08E+06(9.56) 6.02E+06(6.89) 5.33E+06(3.51) 68 30.094 乙酸香叶酯 8.05E+06(16.53) 4.87E+07(15.93) − − 69 30.251 双环倍半萜烯 − − 1.23E+07(7.19) 4.16E+0(18.49) 70 30.37 十四烷 4.12E+06(6.15) − 2.14E+06(16.74) 9.28E+05(17.86) 71 30.639 a-古芸烯 2.75E+06(6.61) 5.97E+05(8.66) 2.61E+06(4.89) 7.49E+05(6.89) 72 30.876 石竹烯 6.17E+07(5.77) 6.01E+07(7.89) 3.58E+07(3.86) 1.63E+07(6.52) 73 31.064 γ-榄香烯 − − 3.62E+06(15.00) 1.10E+06(11.97) 74 31.139 反式香柠檬烯 − − 3.07E+06(14.41) 1.44E+06(21.99) 75 31.483 金合欢烯 − 7.83E+05(20.60) 5.58E+06(18.75) 1.93E+06(20.64) 76 31.539 α-石竹烯 1.48E+07(4.88) 1.00E+07(6.90) 3.46E+07(5.55) 1.43E+07(3.89) 77 31.614 别香橙烯 6.78E+06(16.80) 2.40E+06(13.89) 5.43E+06(13.72) 2.23E+06(16.83) 78 31.865 γ-丁二烯 5.07E+06(3.78) 1.49E+06(6.52) 2.31E+06(4.68) 1.30E+06(5.90) 79 31.977 右旋大根香叶烯 − − 7.46E+07(13.64) 3.31E+07(16.99) 80 32.102 (Z,Z)-α-法呢烯 − − − 2.63E+06(19.77) 81 32.252 α-丁二烯 6.82E+06(20.06) 2.03E+06(6.52) − 4.18E+06(6.10) 82 32.315 α-法尼烯 9.70E+06(3.66) 3.65E+06(4.75) 4.83E+06(5.87) 2.20E+06(6.86) 83 32.39 β-异丁烯二烯 − − 5.18E+06(16.38) 2.19E+06(17.53) 84 32.409 左旋榄香烯 8.39E+06(15.81) 3.03E+06(18.54) − − 85 32.484 (-)-g-卡丁烯 9.27E+06(16.77) 2.77E+06(15.37) 1.33E+07(18.27) 2.91E+06(18.64) 86 32.553 d-卡丁烯 1.57E+07(15.84) 5.73E+06(16.42) 2.52E+07(17.55) 4.41E+06(16.18) 87 32.634 Β-倍半水芹烯 − − 7.05E+06(20.95) 2.72E+06(19.65) 88 32.772 依兰烯 − − 2.34E+06(16.99) 5.21E+05(20.98) 89 32.803 (+)-α-长叶蒎烯 1.96E+06(17.93) 7.64E+05(16.99) − − 90 32.928 大根香叶烯B − − 1.32E+06(12.74) 3.39E+05(18.56) 91 33.034 环己烷甲醇 2.18E+06(24.74) − − − 92 33.522 氧化石竹烯 1.37E+07(20.66) − 2.90E+06(16.83) 93 33.553 g-石竹烯 2.40E+06(13.74) 4.70E+06(21.31) 3.24E+06(15.77) 2.22E+06(4.79) 94 33.685 十六烷 4.00E+06(17.65) 1.62E+06(26.26) 2.76E+06(19.99) 1.35E+06(13.98) 95 34.492 β-愈创木烯 − − − 8.07E+05(20.01) 96 34.504 Α-毕橙茄醇 3.46E+06(18.65) − − − 97 34.654 花椒素 − 5.09E+08(17.64) 1.07E+06(21.82) − 98 34.961 十七烷 1.29E+06(16.99) − − − 99 35.155 桉油烯醇 1.67E+06(16.73) − − − 表 3 随机森林分类判别结果
Table 3 Random forest classification discrimination results
陕西 山东 四川 甘肃 错误率 陕西 48.00 0.00 0.00 0.00 0.00 山东 0.00 24.00 0.00 0.00 0.00 四川 0.00 0.00 24.00 0.00 0.00 甘肃 0.00 0.00 0.00 39.00 0.00 表 4 不同产地花椒主成分分析中关键挥发性差异物质VIP值
Table 4 Key volattiles with value of importance of Zanthoxylum bungeanum from different origins based on OPLS-DA
序号 Cas编号 名称 VIP值 1 000089-81-6 胡椒酮 2.18324 2 007785-70-8 蒎烯 2.14603 3 000099-85-4 萜品烯 2.14099 4 013466-78-9 3-蒈烯 2.06972 5 013877-91-3 罗勒烯 2.04259 6 000099-83-2 α-水芹烯 2.04006 7 000562-74-3 4-萜烯醇 1.96256 8 000078-70-6 芳樟醇 1.87689 9 000460-01-5 波斯菊萜 1.86787 10 006753-98-6 α-石竹烯 1.84402 11 000489-40-7 a-古芸烯 1.83995 12 000539-52-6 紫苏烯 1.83141 13 000112-31-2 癸醛 1.82284 14 000483-76-1 d-卡丁烯 1.81587 15 000142-83-6 (E,E)-2,4-己二烯醛 1.78666 16 000138-86-3 柠檬烯 1.77781 17 000586-62-9 萜品油烯 1.74484 18 000499-97-8 假单烯柠檬烯 1.74206 19 000110-19-0 乙酸异丁酯 1.69269 20 000527-84-4 邻异丙基甲苯 1.66035 21 030021-74-0 γ-丁二烯 1.62196 22 039029-41-9 (−)-g-卡丁烯 1.62126 23 000470-82-6 桉叶油醇 1.59106 24 000087-44-5 石竹烯 1.58901 25 018794-84-8 金合欢烯 1.57102 26 000099-86-5 α-萜品烯 1.5583 27 003779-61-1 反式-β-罗勒烯 1.54069 28 000111-71-7 庚醛 1.4763 29 000150-84-5 乙酸香茅酯 1.45906 30 000106-23-0 香茅醛 1.44425 31 003856-25-5 胡椒烯 1.44203 32 007216-56-0 别罗勒烯 1.4291 33 000502-61-4 α-法尼烯 1.41543 34 000076-49-3 乙酸冰片酯 1.41058 35 025246-27-9 别香橙烯 1.41006 36 028634-89-1 丁苯烯 1.37865 37 000508-32-7 1,7,7-三甲基三环[2.2.2.02.6]庚烷 1.37268 38 000489-39-4 (+)-香橙烯 1.37095 39 000123-35-3 月桂烯 1.31101 40 000539-90-2 丁酸异丁酯 1.30613 41 000502-99-8 3,7-二甲基-1,3,7-辛三烯 1.30159 42 006728-26-3 反式-2-己烯醛 1.28547 43 000500-02-7 4-异丙基-2-环己烯酮 1.27445 44 000142-92-7 乙酸己酯 1.27199 45 029873-99-2 γ-榄香烯 1.2604 46 000118-65-0 g-石竹烯 1.25325 47 000101-41-7 苯乙酸甲酯 1.23944 48 000515-13-9 左旋榄香烯 1.23913 49 001195-32-0 2,4-二甲基苯乙烯 1.21939 50 003387-41-5 桧烯 1.20775 51 000629-59-4 十四烷 1.2074 52 000127-91-3 β-蒎烯 1.17874 53 000124-19-6 壬醛 1.1711 54 000544-76-3 十六烷 1.14205 55 000105-87-3 乙酸香叶酯 1.13322 56 000098-55-5 alpha-松油醇 1.12008 57 005989-33-3 顺-α,α-5-三甲基-5-乙烯基四氢化呋喃-2-甲醇 1.11562 58 024703-35-3 双环菊酯 1.09433 59 054324-03-7 双环倍半萜烯 1.06306 60 000122-03-2 枯茗醛 1.06057 61 000107-86-8 3-甲基-2-丁烯醛 1.02188 62 010208-80-7 α-丁二烯 1.0207 -
[1] 袁海梅, 邱露, 谢贞建, 等. 花椒属植物生物碱类成分及其药理活性研究进展[J]. 中国中药杂志,2015,40(23):4573−4584. [YUAN Haimei, QIU Lu, XIE Zhenjian, et al. Research progress on alkaloids constituents from Zanthoxylum and their pharmacological activities[J]. Journal of Chinese Materia Medicine,2015,40(23):4573−4584. [2] 凌智群, 程宝宏, 魏居国, 等. 花椒功效发展的历史沿革[J]. 云南中医学院学报,2008(4):49−50. [LING Zhiqun, CHENG Baohong, WEI Juguo, et al. Historical evolution of the development of Zanthoxylum bungeanum[J]. Journal of Yunnan University of Traditional Chinese Medicine,2008(4):49−50. doi: 10.3969/j.issn.1000-2723.2008.04.015 [3] 曾京京. 我国花椒的栽培起源和地理分布[J]. 中国农史,2000(4):68−75. [ZENG Jingjing. The cultivation origin and geographical distribution of Zanthoxylum bungeanum in China[J]. Agricultural History of China,2000(4):68−75. [4] 张继, 白贞芳, 杨永利, 等. 甘肃省花椒属药用植物资源[J]. 中国药学杂志,2002(4):17−19. [ZHANG Ji, BAI Zhenfang, YANG Yongli, et al. Resources of medicinal plants of Zanthoxylum in Gansu province[J]. Chinese Pharmaceutical Journal,2002(4):17−19. [5] LU Q, MA R, YANG Y, et al. Zanthoxylum nitidum (Roxb. ) DC: Traditional uses, phytochemistry, pharmacological activities and toxicology[J]. Journal of Ethnopharmacology,2020,260:112946. doi: 10.1016/j.jep.2020.112946
[6] HWANG K A, KWON J E, NOH Y, et al. Effects of Zanthoxylum piperitum ethanol extract on osteoarthritis inflammation and pain[J]. Biomedicine & Pharmacotherapy,2018,105:481−490.
[7] 寇芸芸. 花椒成分分析和杀虫活性研究[D]. 武汉: 武汉轻工大学, 2015. KOU Yunyun. Composition analysis and insecticidal activity of Zanthoxylum bungeanum[D]. Wuhan: Wuhan Polytechnic University, 2015.
[8] 王孟, 吕倩, 董林娟. 花椒醇提物抗氧化性分析及应用[J]. 盐科学与化工,2020,49(3):13−16. [WANG Meng, Lü Qian, DONG Linjuan. Analysis and application of antioxidation of alcohol extract of Zanthoxylum bungeanum Maxim[J]. Journal of Salt Science and Chemical Industry,2020,49(3):13−16. doi: 10.3969/j.issn.2096-3408.2020.03.005 [9] PANG W, LIU S, HE F, et al. Anticancer activities of Zanthoxylum bungeanum seed oil on malignant melanoma[J]. Journal of Ethnopharmacology,2019,229:180−189. doi: 10.1016/j.jep.2018.10.012
[10] TIAN Y, ZHANG C, GUO M. Comparative study on alkaloids and their anti-proliferative activities from three Zanthoxylum species[J]. BMC Complementary and Alternative Medicine,2017,17(1):460. doi: 10.1186/s12906-017-1966-y
[11] FIAZ A, QAZI N U S, ABDUL W. Cytotoxic activity of extracts and crude saponins from Zanthoxylum armatum DC. against human breast (MCF-7, MDA-MB-468) and colorectal (Caco-2) cancer cell lines[J]. BMC Complementary and Alternative Medicine,2017,17(1):368. doi: 10.1186/s12906-017-1882-1
[12] 宋荣, 曹亮, 周佳民, 等. 花椒种质资源及其功能成分和生物学效应研究进展[J]. 湖南农业科学, 2014(17): 23−29. SONG Rong, CAO Liang, ZHOU Jiamin. Research progress on Zanthoxylum bungeanum germplasm resources and their functional components and biological effects[J]. Hunan Agricultural Sciences, 2014(17): 23−29.
[13] 曾炼成, 沈岳, 彭佳红, 等. 基于UHF RFID标签的农产品可追溯系统研究[J]. 安徽农业科学,2010,38(26):14734−14740. [ZENG Liancheng, SHEN Yue, PENG Jiahong, et al. Research on the traceability system of agricultural products based on UHF RFID tags[J]. Journal of Anhui Agricultural Sciences,2010,38(26):14734−14740. doi: 10.3969/j.issn.0517-6611.2010.26.201 [14] 项洋, 柴沙驼, 郝力壮, 等. 化学方法在农产品产地溯源中的研究进展[J]. 食品工业科技,2015,36(20):371−376. [XIANG Yang, CHAI Shatuo, HAO Lizhuang, et al. Research progress of chemical methods in the origin traceability of agricultural products[J]. Science and Technology of Food Industry,2015,36(20):371−376. [15] 宋君, 雷绍荣, 郭灵安, 等. DNA指纹技术在食品掺假、产地溯源检验中的应用[J]. 安徽农业科学,2012,40(6):3226−3233. [SONG Jun, LEI Shaorong, GUO Lingan, et al. Application of DNA fingerprinting technology in food adulteration and origin traceability inspection[J]. Journal of Anhui Agricultural Sciences,2012,40(6):3226−3233. doi: 10.3969/j.issn.0517-6611.2012.06.006 [16] 芮汉明, 郭凯. 食品香气的综合评价技术[J]. 食品工业科技,2008(7):277−280. [RUI Hanming, GUO Kai. Comprehensive evaluation technology of food aroma[J]. Science and Technology of Food Industry,2008(7):277−280. [17] 王芙蓉, 张晓鸣, 佟建明, 等. 食品风味分析技术研究进展[J]. 食品研究与开发,2008(3):170−172. [WANG Furong, ZHANG Xiaoming, TONG Jianming, et al. Research progress in food flavor analysis technology[J]. Food Research and Development,2008(3):170−172. doi: 10.3969/j.issn.1005-6521.2008.03.054 [18] CAI X, MAI R Z, ZOU J J, et al. Analysis of aroma-active compounds in three sweet osmanthus(Osmanthus fragrans) cultivars by GC-olfactometry and GC-MS[J]. Journal of Zhejiang University SCIENCE B,2014,15(7):638−648. doi: 10.1631/jzus.B1400058
[19] 史波林, 赵镭, 支瑞聪, 等. 应用电子鼻判别西湖龙井茶香气品质[J]. 农业工程学报,2011,27(S2):302−306. [SHI Bolin, ZHAO Lei, ZHI Ruicong, et al. Using electronic nose to distinguish the aroma quality of West Lake Longjing tea[J]. Transactions of the Chinese Society of Agricultural Engineering,2011,27(S2):302−306. [20] 苗爱清, 吕海鹏, 孙世利, 等. 乌龙茶香气的HS-SPME-GC-MS/GC-O研究[J]. 茶叶科学,2010,30(S1):583−587. [MIAO Aiqing, Lü Haipeng, SUN Shili, et al. HS-SPME-GC-MS/GC-O study on the aroma of Oolong tea[J]. Tea Science,2010,30(S1):583−587. [21] 马永昆, 李祥波, 蒋家奎. 基于GC-MS和嗅闻仪联用的天然苹果香精关键香气成分分析[J]. 食品科学,2009,30(8):231−234. [MA Yongkun, LI Xiangbo, JIANG Jiakui. Analysis of key aroma components of natural apple flavor based on GC-MS and sniffer[J]. Food Science,2009,30(8):231−234. doi: 10.3321/j.issn:1002-6630.2009.08.051 [22] 杨静, 赵镭, 史波林, 等. 青花椒香气快速气相电子鼻响应特征及GC-MS物质基础分析[J]. 食品科学,2015,36(22):69−74. [YANG Jing, ZHAO Lei, SHI Bolin, et al. The rapid gas-phase electronic nose response characteristics of green pepper aroma and GC-MS material basis analysis[J]. Food Science,2015,36(22):69−74. doi: 10.7506/spkx1002-6630-201522012 [23] 吴振, 李红, 杨勇, 等. 基于无机元素的花椒产地溯源和品种聚类分析[J]. 食品科学,2019,40(16):213−219. [WU Zhen, LI Hong, YANG Yong, et al. Origin traceability and variety cluster analysis of Zanthoxylum bungeanum based on inorganic elements[J]. Food Science,2019,40(16):213−219. doi: 10.7506/spkx1002-6630-20181008-029 [24] 吴习宇, 祝诗平, 黄华, 等. 近红外光谱技术鉴别花椒产地[J]. 光谱学与光谱分析,2018,38(1):68−72. [WU Xiyu, ZHU Shiping, HUANG Hua, et al. Identification of the origin of Zanthoxylum bungeanum by near-infrared spectroscopy[J]. Spectroscopy and Spectral Analysis,2018,38(1):68−72. [25] 王思思, 钟葵, 史波林, 等. 基于多元统计分析的不同产地红花椒挥发性成分差异分析[J]. 中国调味品, 2019, 44(3): 51-56. WANG Sisi, ZHONG Kui, SHI Bolin, et al. Analysis of volatile components of Zanthoxylum bungeanum from different places of origin based on multivariate statistical analysis[J]. China Condiment, 2019, 44(3): 51-56.
[26] 樊丹青, 刘荣, 杨丽, 等. 不同产地花椒挥发油含量及组成成分比较研究[J]. 中药与临床,2014,5(2):16−19. [FAN Danqing, LIU Rong, YANG Li, et al. Analysis on volatile oil of Zanthoxylum bungeanum Maxim . from different origin[J]. Pharmacy and Clinics of Chinese Materia Medica,2014,5(2):16−19. [27] 陈光静, 阚建全, 李建, 等. 不同产地红花椒挥发油化学成分的比较研究[J]. 中国粮油学报,2015,30(1):81−87. [CHEN Guangjing, KAN Jianquan, LI Jian, et al. Analysis of essential oil compounds in Zanthoxylum bungeanum Maxim from different habitats[J]. Journal of the Chinese Cereals and Oils Association,2015,30(1):81−87. [28] YUN J, CUI C J, ZHANG S H, et al. Use of headspace GC/MS combined with chemometric analysis to identify the geographic origins of black tea[J]. Food Chemistry,2021,360:130033. doi: 10.1016/j.foodchem.2021.130033
[29] 杜丽娜. 基于UPLC-MS技术的呼吸道合胞病毒肺炎痰热闭肺证代谢模式及金欣口服液干预研究[D]. 南京: 南京中医药大学, 2015. DU Lina. Research of metabolic characteristic of Respiratory syncytial virus with syndrome of obstruction of the lung by phlegm heat based on UPLC-MS technology and evaluation of Jinxin Oral Liquid[D]. Nanjing: Nanjing University of Chinese Medicine, 2015.
[30] WOLD S, SJöSTRöM M, ERIKSSON L. PLS-regression: A basic tool of chemometrics[J]. Chemometrics and Intelligent Laboratory Systems,2001,58(2):109−130. doi: 10.1016/S0169-7439(01)00155-1





 下载:
下载:
 下载:
下载:
