Effect of Reaction Conditions on the Formation of 3-Deoxyglucosone and 5-Hydroxymethylfurfural in Sugar-acid Reaction System
-
摘要: 为了分析糖-酸反应体系中3-脱氧葡萄糖醛酮(3-deoxyglucosone,3-DG)及5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)的形成规律,本研究构建了果糖/蔗糖/葡萄糖-柠檬酸反应体系,探究糖种类、pH、温度、金属离子种类和含不同价态硫的化合物对3-DG及5-HMF形成的影响,并分析了二者的形成动力学。结果表明:三种糖对3-DG和5-HMF形成的影响不同,果糖和蔗糖反应体系中3-DG和5-HMF生成量远高于葡萄糖反应体系,pH降低和温度升高可促进3-DG和5-HMF形成;Ca2+、Mg2+、Al3+均对3-DG和5-HMF的形成有促进作用;K+能促进3-DG的形成,但对5-HMF的形成无显著影响(P>0.05)。Na2S2O3和Na2SO3可以抑制3-DG及5-HMF的形成,而Na2S2O5对3-DG的形成无影响,但能抑制5-HMF的形成(P<0.05);Na2SO4可促进3-DG及5-HMF的形成;70~90 ℃时3-DG的形成符合零级动力学模型,而100 ℃时符合二级动力学模型;70~100 ℃时5-HMF的形成符合零级动力学模型。
-
关键词:
- 糖-酸反应体系 /
- 3-脱氧葡萄糖醛酮(3-DG) /
- 5-羟甲基糠醛(5-HMF) /
- 反应条件 /
- 动力学
Abstract: In this study, sugar-citric acid reaction systems were applied to study the formation of 3-deoxyglucosone(3-DG) and 5-hydroxymethylfurfural(5-HMF). Fructose/sucrose/glucose-citric acid reaction systems were constructed, the effects of sugar type, pH, temperature, types of metal ions and compounds with different valences of sulfur on the formation of 3-DG and 5-HMF were evaluated. The formation kinetics of 3-DG and 5-HMF were analyzed. Results indicated that the three types of sugar had different effects on the formation of 3-DG and 5-HMF. The amounts of 3-DG and 5-HMF produced in fructose and sucrose reaction systems were much higher than those in glucose reaction system. The amounts of 3-DG and 5-HMF in the fructose-citric acid reaction system increased with the decreasing of pH and the increasing of temperature. Ca2+, Mg2+ and Al3+ promoted the formation of 3-DG and 5-HMF. K+ accelerated the formation of 3-DG, but had no significant effect on the formation of 5-HMF(P>0.05). Na2S2O3 and Na2SO3 inhibited 3-DG and 5-HMF formation, while Na2S2O5 had no significant effect on 3-DG formation, but it inhibited the formation of 5-HMF(P<0.05). Na2SO4 promoted 3-DG and 5-HMF formation. The formation kinetics of 3-DG were in accordance with zero-order kinetics model at 70~90 oC while it followed second-order kinetics model at 100 oC. The formation of 5-HMF followed zero-order kinetics model at 70~100 oC. -
热加工可有效地破坏食品中的酶和微生物,降低水分活度,有利于食品保藏。但是,热加工也会促进内源性污染物的产生,如3-脱氧葡萄糖醛酮(3-deoxyglucosone, 3-DG)和5-羟甲基糠醛(5-Hydroxymethylfurfural, 5-HMF)等[1-3]。研究发现,3-DG具有细胞毒性并会造成细胞损伤[4],诱发糖尿病[5];5-HMF会对人体的黏膜、皮肤和眼睛产生刺激作用[6-7],并损伤肝、肾等器官[8-9],对人体具有潜在危害。因此,研究食品中3-DG和5-HMF的生成规律迫在眉睫。
食品中的3-DG和5-HMF由己糖(果糖或葡萄糖)发生脱水反应形成。3-DG的形成途径有两条:a.在美拉德反应中,果糖或葡萄糖与氨基化合物反应形成Schiff碱,Schiff碱环化形成不稳定的Heyns和Amadori重排产物,pH≤7时通过烯醇化作用形成1,2-烯胺醇,该物质随后脱水形成3-DG[10-11];b.在焦糖化反应中,己糖在酸性条件下也可通过烯醇化作用生成3-DG[10]。3-DG可进一步脱水形成3,4-二脱氧葡萄糖醛酮(3,4-dideoxyglucosone, 3,4-DG),3,4-DG脱去一分子水并环化形成5-HMF[8,10],所以3-DG是5-HMF的前体物质之一。另外,在高温和干燥条件下,果糖和蔗糖可以形成高活性的呋喃果糖阳离子,该物质可直接转化为5-HMF[12]。
3-DG和5-HMF广泛存在于咖啡、曲奇、蜂蜜、果干等食品中[1,10],但有关食品体系中3-DG和5-HMF形成规律的研究鲜有报道。因此,本实验以果糖、葡萄糖、蔗糖和柠檬酸为材料,构建糖-柠檬酸反应体系,研究糖种类、pH、温度、金属离子种类和含不同价态硫的化合物对3-DG及5-HMF形成的影响,并采用零级动力学、一级动力学和二级动力学模型拟合3-DG和5-HMF的形成过程,旨在为糖酸含量丰富的食品中3-DG和5-HMF的形成与控制提供理论基础。
1. 材料与方法
1.1 材料与仪器
5-羟甲基糠醛(5-HMF,纯度≥98%,色谱纯) 上海源叶生物科技有限公司;3-脱氧葡萄糖醛酮(3-DG,纯度≥95%,色谱纯) 加拿大TRC公司;甲醇(色谱纯) 美国Spectrum公司;柠檬酸、柠檬酸钠、葡萄糖、果糖、蔗糖、氯化钾、氯化钙、氯化镁、氯化铝、硫代硫酸钠、亚硫酸钠、焦亚硫酸钠、硫酸钠、二乙三胺五乙酸(DETAPAC)、邻苯二胺 分析纯,北京普博欣生物科技责任有限公司。
Agilent 1200高效液相色谱仪 美国安捷伦公司;ZORBAX Eclipse XDB-C18液相色谱柱(4.6 mm×250 mm,5 μm) 美国安捷伦公司;Millipore型号超纯水系统 美国Millipore公司;HH-1数显恒温水浴锅 常州金坛良友仪器有限公司。
1.2 实验方法
1.2.1 反应条件对糖-柠檬酸反应体系中3-DG及5-HMF形成的影响
1.2.1.1 糖种类的影响
用pH3的0.1 mol/L柠檬酸缓冲液分别溶解果糖、蔗糖和葡萄糖,使其浓度为50 mmol/L,取2 mL于比色管中,在100 ℃下水浴反应1~9 h后,冰水浴中冷却至室温(约25 ℃),定容后测定3-DG及5-HMF含量。
1.2.1.2 pH的影响
分别用pH为3、4、5、6的0.1 mol/L柠檬酸缓冲液溶解果糖,使其浓度为50 mmol/L,取2 mL于比色管中,在100 ℃下水浴反应1~9 h后,冰水浴中冷却至室温(约25 ℃),定容后测定3-DG及5-HMF含量。
1.2.1.3 温度的影响
用pH3的0.1 mol/L柠檬酸缓冲液溶解果糖,使其浓度为50 mmol/L,取2 mL于比色管中,分别置于70、80、90、100 ℃下水浴反应1~9 h后,冰水浴中冷却至室温(约25 ℃),定容后测定3-DG及5-HMF含量。
1.2.1.4 金属离子的影响
用pH3的0.1 mol/L柠檬酸缓冲液溶解果糖,并分别加入不同浓度的KCl、CaCl2、MgCl2或AlCl3,使果糖浓度为50 mmol/L,K+、Ca2+、Mg2+或Al3+的浓度为0、20、40、60、80、100 mmol/L。取2 mL混合液,置于100 ℃下水浴反应5 h后,冰水浴中冷却至室温(约25 ℃),定容后测定3-DG及5-HMF含量。
1.2.1.5 含不同价态硫的化合物的影响
用pH3的0.1 mol/L柠檬酸缓冲液溶解果糖,并分别加入不同浓度的Na2S2O3、Na2SO3、Na2S2O5或Na2SO4(硫价态分别为+2、+4、+4、+6),使果糖浓度为50 mmol/L,各化合物的浓度分别为0、20、40、60、80、100 mmol/L。取2 mL混合液,置于100 ℃下水浴反应5 h后,冰水浴中冷却至室温(约25 ℃),定容后测定3-DG及5-HMF含量。
1.2.2 标准曲线的绘制
浓度为1000 mg/L的3-DG或5-HMF储备液的配制:分别称取3-DG、5-HMF标准品10 mg(精确至0.0001 g)于10 mL容量瓶,一级水溶解并定容,4 ℃冰箱保存。
3-DG标准曲线制作:配制浓度分别为0.5、1.0、5.0、10.0、17.5和25.0 mg/L的3-DG标准工作液;取1 mL上述标准工作液,加入pH7、含18.5 mol/L DETAPAC、浓度为4 mg/mL的邻苯二胺溶液,在60 ℃下水浴反应1 h;反应结束后,样品经0.22 μm聚醚砜滤膜过滤,高效液相色谱仪(High Performance Liquid Chromatography, HPLC)待测。以浓度为横坐标、峰面积为纵坐标绘制3-DG标准曲线。
5-HMF标准曲线制作:配制浓度分别为0.1、1.0、5.0、10.0、20.0 mg/L的5-HMF标准工作溶液,经0.22 µm聚醚砜滤膜过滤,HPLC待测。以浓度为横坐标、峰面积为纵坐标绘制5-HMF标准曲线。
1.2.3 3-DG的测定方法
3-DG的检测参考Hellwig等[13]的方法并稍作修改。3-DG的衍生方法如下:取反应液1 mL,加入pH7、含18.5 mol/L的DETAPAC、浓度为4 mg/mL的邻苯二胺溶液,60 ℃水浴1 h,用0.22 μm的聚醚砜滤膜过滤后,HPLC待测。3-DG的分析条件如下:色谱柱为ZORBAX Eclipse XDB-C18(4.6 mm×250 mm, 5 μm),柱温35 ℃;流动相为甲醇(A)和0.15%醋酸水溶液(B),流速为0.70 mL/min;洗脱条件为0~15 min,20%~50% A;15~18 min,50% A;18~20 min,50~20% A;20~28 min,20% A;检测波长为314 nm,进样量为20 μL。采用外标法定量,标准曲线为y=22.402x+1.4372,相关系数为0.9994。
1.2.4 5-HMF的测定方法
反应液用0.22 μm的聚醚砜滤膜过滤后,利用HPLC分析。5-HMF的分析条件如下:色谱柱为ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm),柱温35 ℃;流动相为甲醇(A)和水(B),流速为0.60 mL/min;洗脱条件为0~16 min,10% A;16~17 min,10%~45% A;17~23 min,45% A;23~24 min,45%~10% A;24~33 min,10% A;检测波长为284 nm,进样量为20 μL。采用外标法定量,标准曲线为y=208.27x+7.4183,相关系数为0.9999。
1.2.5 模型建立
采用零级动力学、一级动力学和二级动力学3种模型分析反应体系中3-DG和5-HMF的变化规律,其公式分别如下:
(1) (2) (3) 式中:t为反应时间,h;C0为3-DG和5-HMF的起始浓度,mg/L;Ct为3-DG和5-HMF在t时间的浓度,mg/L;k0、k1和k2分别为零级动力学、一级动力学和二级动力学的反应速率常数,mg·L−1·h−1、h−1和L·mg−1·h−1。
1.3 数据处理
实验结果以平均值±标准偏差表示;采用SAS 9.2软件对实验数据进行统计分析,显著性检验水平为P=0.05;采用Origin8.0软件绘制图形;采用SPSS 19.0软件进行动力学分析。
2. 结果分析
2.1 糖的种类对糖-柠檬酸反应体系中3-DG及5-HMF形成的影响
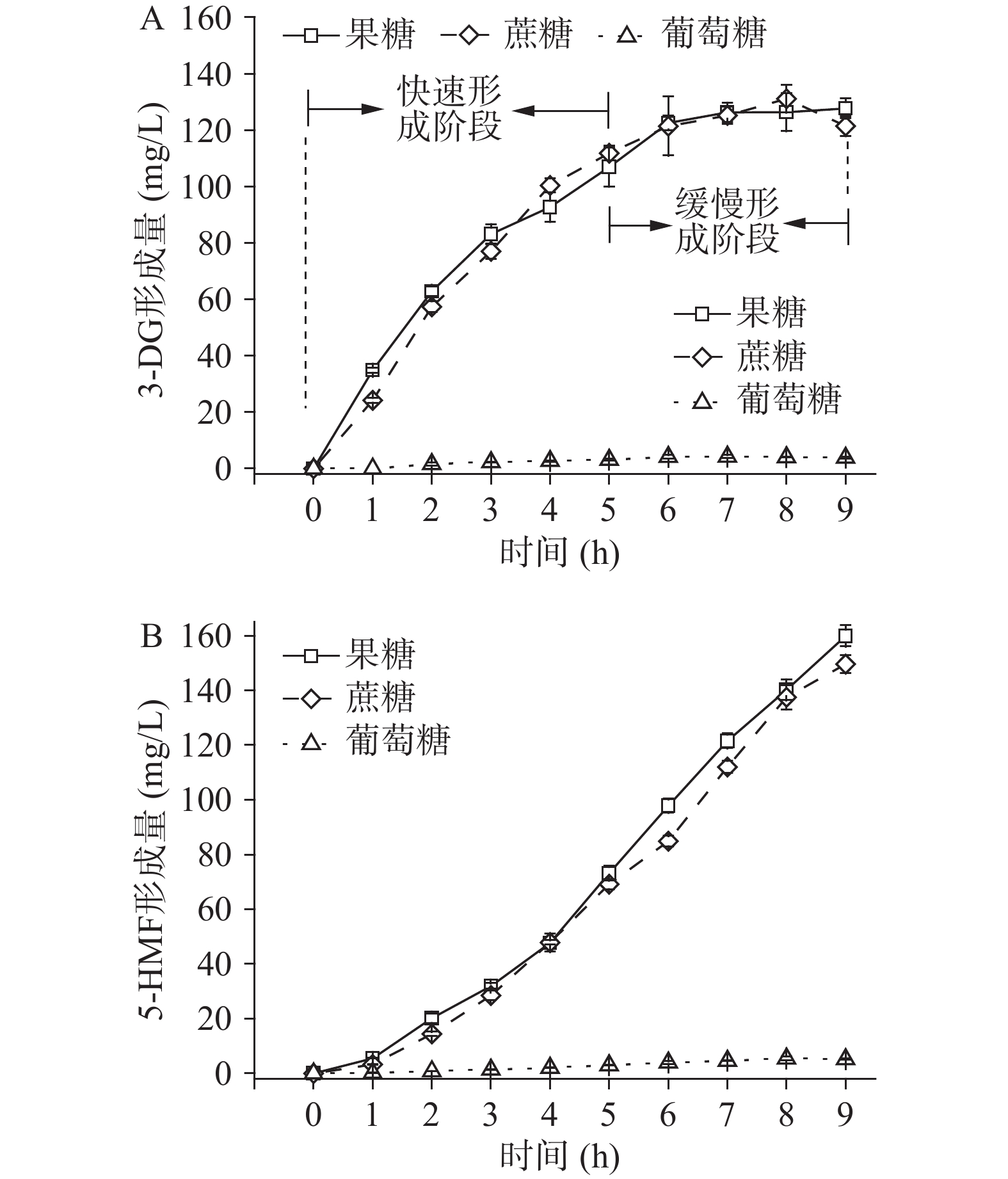
在pH3、糖液浓度为50 mmol/L、温度100 ℃条件下,研究糖的种类(果糖、蔗糖和葡萄糖)对3-DG和5-HMF形成的影响,结果如图1所示。从图1A可知,随加热时间延长,3种糖-柠檬酸反应体系中3-DG的生成量均逐渐增加,且果糖和蔗糖反应体系3-DG生成量远高于葡萄糖反应体系;反应结束时(9 h),果糖和蔗糖反应体系中3-DG生成量分别为葡萄糖反应体系的32.8和31.2倍。在果糖和蔗糖反应体系中,3-DG的形成过程可分为两个阶段。a.快速形成阶段(0~5 h):两反应体系中3-DG生成量分别高达106.9和111.8 mg/L;b.缓慢形成阶段(5~9 h):两反应体系3-DG的量继续逐渐增加,但增长趋势变慢,仅分别增加了20.8和9.6 mg/L;反应9 h时,两反应体系3-DG生成量分别达到127.7和121.4 mg/L的最大值。在酸性条件下加热,蔗糖易发生水解形成葡萄糖和果糖。葡萄糖的结构在溶液中较果糖稳定,这导致单独的葡萄糖体系形成3-DG的量较蔗糖和果糖体系少[14]。
5-HMF的形成如图1B所示,随加热时间延长,果糖、蔗糖和葡萄糖反应体系中5-HMF含量均逐渐增加,反应9 h时,果糖和蔗糖反应体系中5-HMF生成量分别达到159.9和149.6 mg/L的最大值,为葡萄糖反应体系的30.8和28.8倍,该结果与张玉玉等[14]的研究一致。这是因为在酸性加热条件下,蔗糖易发生水解形成葡萄糖和果糖,而水解产生的果糖是蔗糖反应体系中形成5-HMF的主要反应物,且果糖转化成5-HMF的速率比葡萄糖快;另一方面,葡萄糖在水中以环状的结构稳定存在,不易发生烯醇化反应,难以转化为5-HMF[15]。因此,本实验中果糖和蔗糖反应体系5-HMF形成趋势相似,且形成量远多于葡萄糖。
采用零级动力学、一级动力学和二级动力学模型对3种反应体系中3-DG和5-HMF生成过程进行拟合,结果如表1和表2所示。从表1可以看出,R2二级动力学>R2零级动力学>R2一级动力学,且二级动力学模型的R2均大于0.95,说明本研究条件下,3-DG的形成更符合二级动力学模型,即其生成量与加热时间成对数关系。从表2可以看出,采用零级动力学模型分析5-HMF的形成时,各决定系数R2均大于0.95,说明其生成量与加热时间成线性关系。以上动力学结果表明,二级动力学和零级动力学可以分别预测3种反应体系中3-DG和5-HMF的形成。此外,蔗糖和果糖反应体系中3-DG和5-HMF的反应速率常数k均明显大于葡萄糖反应体系,说明这两种反应体系中3-DG和5-HMF的形成速率比葡萄糖反应体系的更快。蔗糖和果糖反应体系中,3-DG的反应速率常数非常接近,5-HMF的速率常数也呈现相似规律,说明两个体系3-DG和5-HMF的形成速率均较为接近,与图1中两反应体系3-DG(A)和5-HMF(B)生成曲线一致的结果吻合。
表 1 不同糖-柠檬酸反应体系中3-DG的形成动力学分析Table 1. Kinetics analysis of 3-DG formation in different sugar-citric acid reaction systems糖种类 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 蔗糖(1~9 h) Ct=36.03+12.13t 12.13 0.8282 Ct=37.58exp(0.17t) 0.17 0.6982 Ct=25.61+49.95lnt 49.95 0.9691 果糖(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 葡萄糖(1~9 h) Ct=0.56+0.47t 0.47 0.8141 Ct=0.16exp(0.47t) 0.47 0.4402 Ct=0.16+1.92lnt 1.92 0.9529 表 2 不同糖-酸柠檬酸反应体系中5-HMF的形成动力学分析Table 2. Kinetics analysis of 5-HMF formation in different sugar-citric acid systems糖种类 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 蔗糖(1~9 h) Ct=−24.61+19.31t 19.31 0.9899 Ct=5.54exp(0.42t) 0.42 0.8593 Ct=−25.34+68.38lnt 68.38 0.8565 果糖(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 葡萄糖(1~9 h) Ct=−1.19+0.72t 0.72 0.9839 Ct=0.04exp(0.63t) 0.63 0.7485 Ct=−1.17+2.51lnt 2.51 0.8304 2.2 pH对果糖-柠檬酸反应体系中3-DG及5-HMF形成的影响
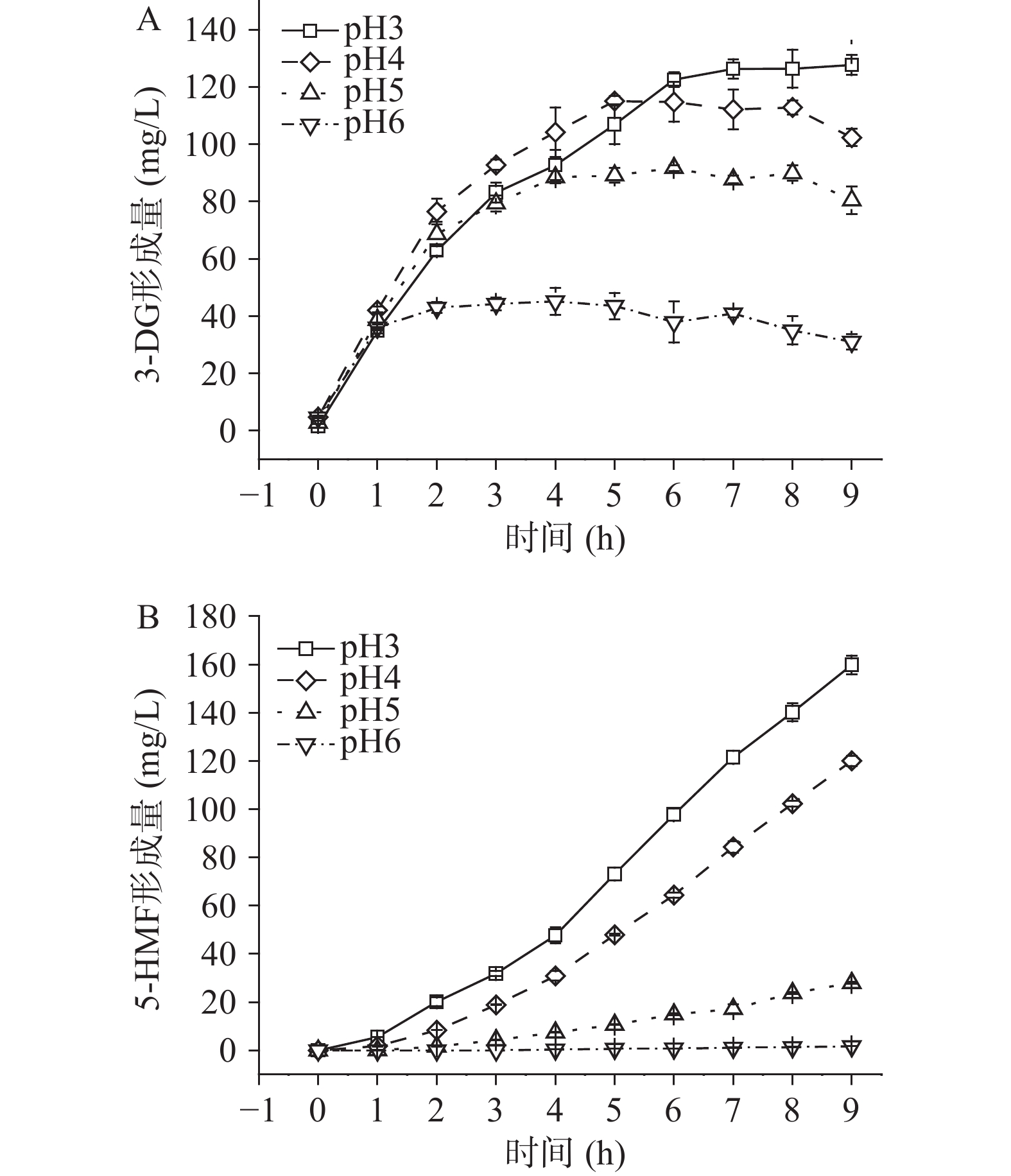
在果糖浓度为50 mmol/L,温度100 ℃条件下,研究pH(3~6)对3-DG和5-HMF形成的影响,结果如图2所示。方差分析表明,pH对3-DG的形成具有显著影响(P<0.05),且反应体系pH越小,3-DG生成量越大;反应结束时(9 h),pH3的反应体系中3-DG生成量高达127.7 mg/L,分别是pH为4、5、6的1.2、1.6和4.1倍。其原因可能是:反应体系pH的降低促进了果糖发生烯醇化反应生成3-DG[10]。另外,pH4~6的反应体系中,反应后期(8~9 h)3-DG含量略有下降,这与3-DG化学性质活泼可能进一步降解形成丙酮醛、5-HMF等产物有关[2]。
pH对5-HMF形成的影响如图2B所示,pH的降低能显著促进5-HMF形成(P<0.05),反应9 h时,在pH3的反应体系中,5-HMF生成量分别是pH为4、5、6反应体系的1.3、5.7和69.4倍;这可能与低pH下3-DG(5-HMF的前体物)生成量增大有关。Pham等的研究发现,降低橙汁pH能促进5-HMF的形成[16],陈醋中5-HMF含量与有机酸含量之间也存在正相关关系[17],这与本实验的规律一致。因此,在实际生产过程中可适当提高反应体系pH以抑制3-DG和5-HMF的形成。
为探究不同pH下3-DG和5-HMF的生成规律,分别采用零级动力学、一级动力学和二级动力学模型对3-DG和5-HMF的生成过程进行拟合(pH为4、5、6的反应体系中,3-DG生成量在后期呈现下降趋势,故分别选取三者中1~8、1~6和1~3 h的时间段进行3-DG形成动力学分析),结果如表3所示。从表3可以看出,R2二级动力学>R2零级动力学>R2一级动力学,且二级动力学模型的R2均大于0.92,说明3-DG的形成符合二级动力学模型,即其生成量与加热时间成对数关系。5-HMF的动力学分析结果如表4所示,通过比较这3个动力学模型的R2,发现5-HMF的形成符合零级动力学模型(R2>0.90),其形成量与时间成线性关系。以上动力学结果表明,二级动力学和零级动力学可以分别较好地预测pH3~6的反应体系中3-DG和5-HMF的形成。通过比较3-DG和5-HMF最适动力学模型的k值发现,k值均随pH的降低而增大,说明pH越小,3-DG和5-HMF生成速率越高。
表 3 不同pH下3-DG的形成动力学分析Table 3. Kinetics analysis of 3-DG formation under different pH valuespH 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 pH3(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 pH4(1~8 h) Ct=56.09+8.94t 8.94 0.7246 Ct=55.21exp(0.11t) 0.11 0.6456 Ct=49.62+35.22lnt 35.22 0.9278 pH5(1~6 h) Ct=42.45+9.59t 9.59 0.7917 Ct=43.43exp(0.15t) 0.15 0.7134 Ct=43.47+29.68lnt 29.68 0.9513 pH6(1~3 h) Ct=32.81+4.13t 4.13 0.8708 Ct=33.27exp(0.10t) 0.10 0.8615 Ct=36.42+7.78lnt 7.78 0.9534 表 4 不同pH下5-HMF的形成动力学分析Table 4. Kinetics analysis of 5-HMF formation under different pH valuespH 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 pH3(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 pH4(1~9 h) Ct=−23.36+15.32t 15.32 0.9827 Ct=3.04exp(0.47t) 0.47 0.8716 Ct=−22.80+53.46lnt 53.46 0.8252 pH5(1~9 h) Ct=−5.59+3.53t 3.53 0.9778 Ct=0.37exp(0.56t) 0.56 0.7750 Ct=−5.46+12.30lnt 12.30 0.8207 pH6(1~9 h) Ct=−0.46+0.23t 0.23 0.9567 Ct=0.0046exp(0.76t) 0.76 0.8190 Ct=−0.43+0.78lnt 0.78 0.7777 2.3 温度对果糖-柠檬酸反应体系中3-DG及5-HMF形成的影响
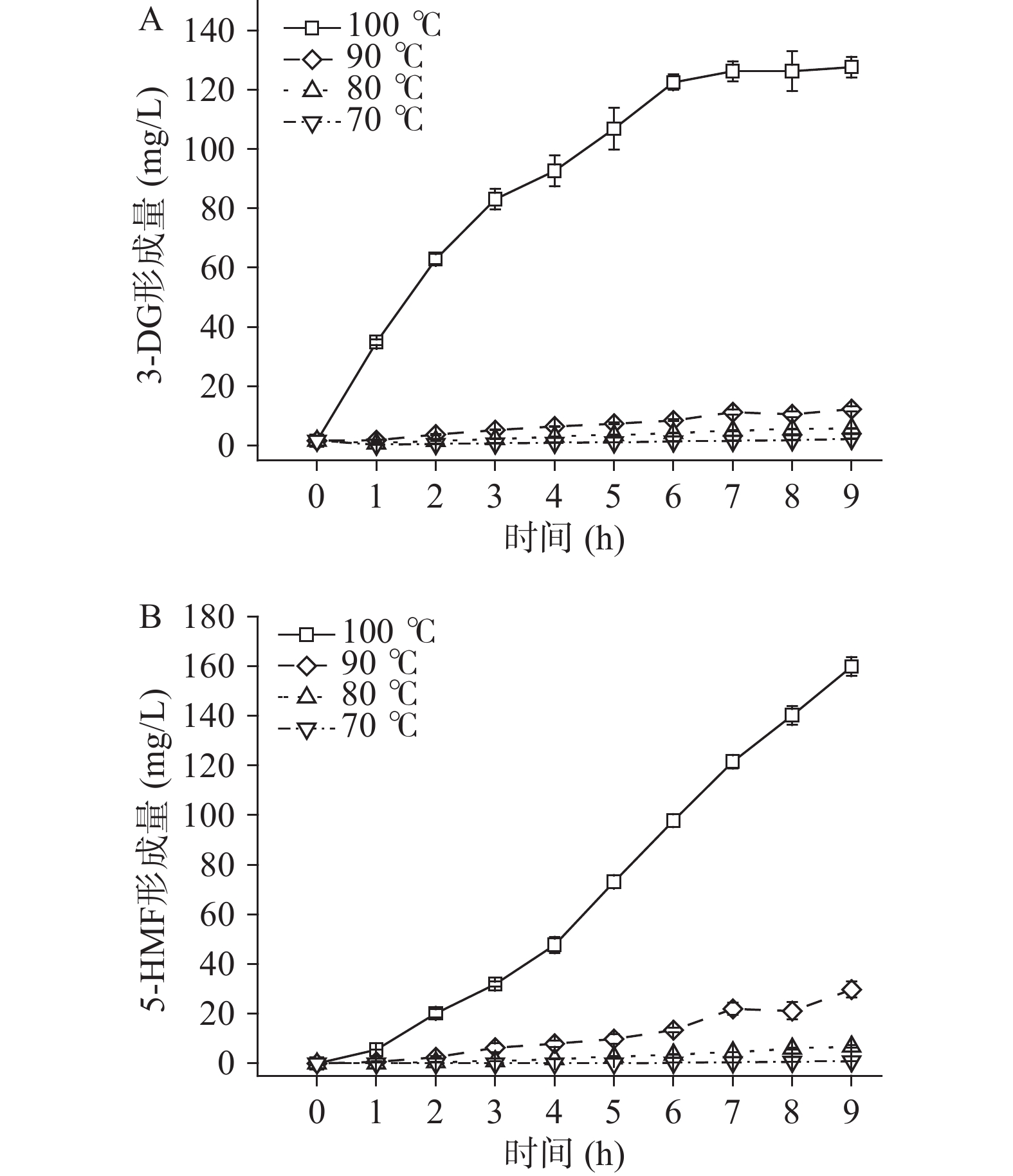
本实验研究了pH3、果糖浓度为50 mmol/L条件下,温度(70、80、90、100 ℃)对果糖-柠檬酸反应体系中3-DG和5-HMF形成的影响,结果如图3所示。方差分析结果表明,温度显著影响反应体系3-DG及5-HMF的形成(P<0.05),且温度越高,3-DG及5-HMF生成量越大。温度70~90 ℃时,温度每升高10 ℃,相同反应时间下3-DG生成量约增加了1.9~3.3倍,但温度从90 ℃提升至100 ℃时,其生成量增加了10.4~19.5倍。温度对5-HMF形成的影响表现出类似的规律(图3B),反应9 h时,100 ℃条件下5-HMF的生成量分别为90、80、70 ℃的5.4、23.5和181.9倍。温度提高对3-DG和5-HMF形成的促进作用体现在两方面:一是温度的提升可促进果糖的开环,而开环的果糖具有较高的反应活性[18];二是较高的温度可促进烯醇化作用和脱水反应,有利于果糖经烯醇化作用形成3-DG,后者进一步脱水形成5-HMF[8,19]。此外,果糖的熔点为95 ℃,当温度提高至100 ℃时,果糖已处于熔融状态,该状态下的果糖极易发生焦糖化反应,导致3-DG和5-HMF大量形成[20]。
分别采用零级动力学、一级动力学和二级动力学模型对不同温度下3-DG和5-HMF的形成过程进行拟合,结果如表5和表6所示。从表5可知,温度100 ℃条件下,R2二级动力学>R2零级动力学>R2一级动力学,与零级动力学和一级动力学模型相比,采用二级动力学模型拟合3-DG的形成过程时,所得方程的R2更高,说明该模型可以很好地描述100 ℃时3-DG的形成;温度为70、80和90 ℃时,零级动力学模型的R2最高,说明上述温度条件下,3-DG的形成符合零级动力学模型。5-HMF的动力学结果如表6所示(在70 ℃条件下,反应1~5 h内无5-HMF形成,故该温度下仅采用6~9 h的数据对5-HMF形成动力学进行分析),温度在70~100 ℃时,零级动力学模型的R2更高,说明5-HMF的形成与时间成线性关系。上述动力学结果表明,在70~90和100 ℃条件下,3-DG的形成分别符合零级和二级动力学模型;零级动力学模型可用于预测70~100 ℃下5-HMF的形成。
表 5 不同温度下3-DG的形成动力学分析Table 5. Kinetics analysis of 3-DG formation at different temperatures温度 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 100 ℃(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 90 ℃(1~9 h) Ct=1.07+1.28t 1.28 0.9735 Ct=2.26exp(0.21t) 0.21 0.8740 Ct=0.69+4.75lnt 4.75 0.9304 80 ℃(1~9 h) Ct=0.24+0.65t 0.65 0.9926 Ct=0.90exp(0.24t) 0.24 0.8821 Ct=0.06+2.41lnt 2.41 0.9394 70 ℃(1~9 h) Ct=0.13+0.18t 0.23 0.9919 Ct=0.30exp(0.23t) 0.23 0.9409 Ct=-0.0040+0.82lnt 0.82 0.8752 表 6 不同温度下5-HMF的形成动力学分析Table 6. Kinetics analysis of 5-HMF formation at different temperatures温度 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 100 ℃(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 90 ℃(1~9 h) Ct=−4.80+3.48t 3.48 0.9479 Ct=1.03exp(0.41t) 0.41 0.8681 Ct=−4.62+12.12lnt 12.12 0.7914 80 ℃(1~9 h) Ct=−1.41+0.88t 0.88 0.9800 Ct=0.06exp(0.62t) 0.62 0.7062 Ct=−1.38+3.06lnt 3.06 0.8220 70 ℃(6~9 h) Ct=−0.81+0.19t 0.19 0.9960 Ct=0.05exp(0.33t) 0.33 0.9953 Ct=−2.15+1.37lnt 1.37 0.9811 2.4 金属离子种类对果糖-柠檬酸反应体系中3-DG及5-HMF形成的影响
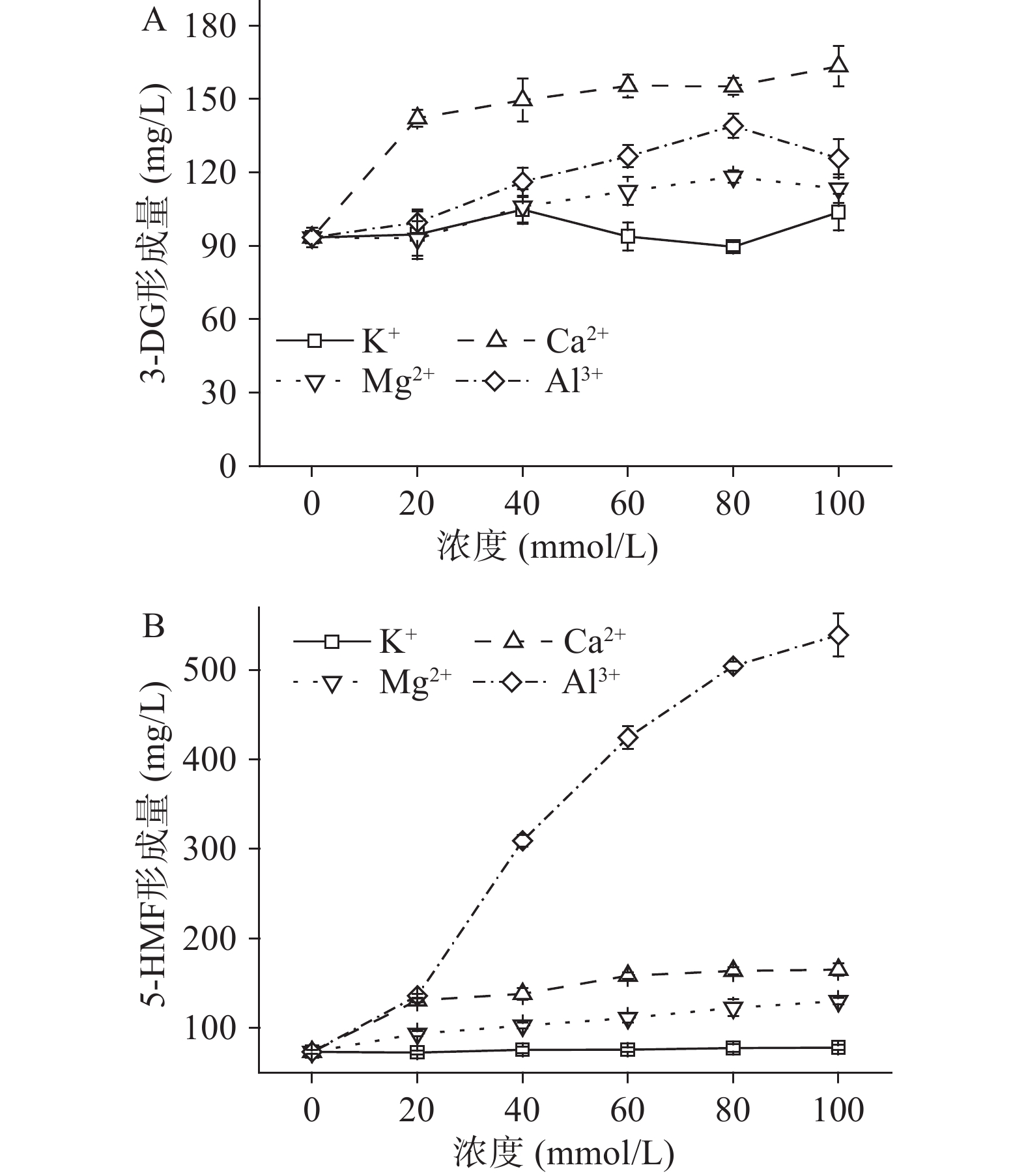
本研究在pH3、果糖浓度为50 mmol/L、温度100 ℃、加热5 h的条件下,分析金属离子种类(K+、Ca2+、Mg2+及Al3+,0~100 mmol/L)对果糖-柠檬酸反应体系3-DG及5-HMF形成的影响,结果如图4所示。从图4A可知,K+、Ca2+、Mg2+和Al3+离子的添加能显著促进3-DG的形成(P<0.05),当其浓度分别为40、100、80、80 mmol/L时,对3-DG形成的促进作用最大,与对照相比,分别增加了12.2%、74.9%、26.6%和48.8%。然而,在一定浓度下,K+(20、60、80 mmol/L)、Mg2+(20 mmol/L)和Al3+(20 mmol/L)的添加对3-DG的形成与对照相比无显著影响(P>0.05)。上述结果表明,金属离子对果糖-柠檬酸反应体系中3-DG形成的影响与其种类和浓度均有关。
离子种类对5-HMF形成的影响如图4B所示。Ca2+、Mg2+和Al3+的添加可显著促进5-HMF的形成(P<0.05),并且三者的促进作用随其浓度的升高而增强,当其浓度为100 mmol/L时,5-HMF的生成量最大,分别高达165.2、129.9和539.2 mg/L,与对照相比,分别增加了125.5%、77.5%和623.3%。该结果与Mesías等[21]的研究结果一致。其原因可能为,Ca2+、Mg2+可催化己糖水解,形成具有高反应活性的呋喃果糖阳离子,该物质进一步转化为5-HMF[22]。Al3+能同时促进3-DG(图4A)和5-HMF的形成,但是其对5-HMF的促进作用远大于3-DG,可能是因为Al3+催化果糖形成呋喃果糖阳离子的作用强于形成3-DG,前者则比3-DG更能有效转化成5-HMF[23]。此外,从图4B可知,K+对5-HMF的形成无显著影响(P>0.05)。Wen等[24]发现K+可促进葡萄糖-天冬酰胺反应体系中5-HMF的形成,这与本实验结果不同,可能与反应体系和反应条件有关。
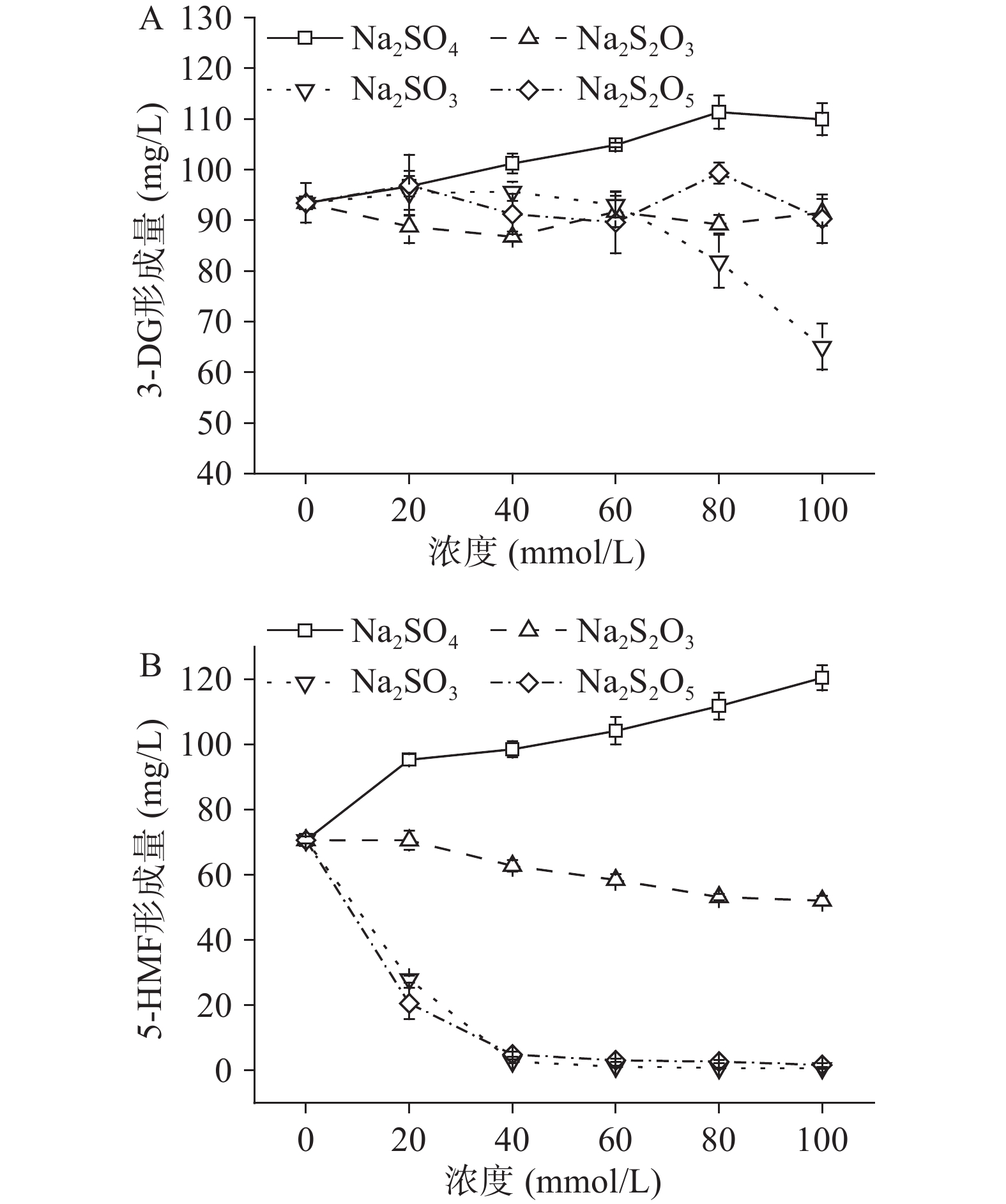
2.5 含不同价态硫的化合物对果糖-柠檬酸反应体系3-DG及5-HMF形成的影响
本研究在pH3、果糖浓度为50 mmol/L、温度100 ℃、加热5 h的条件下,分析了含不同价态硫的化合物(Na2S2O3、Na2SO3、Na2S2O5、Na2SO4,+2、+4、+4、+6,0~100 mmol/L)对果糖-柠檬酸反应体系中3-DG和5-HMF形成的影响,结果如图5所示。从图5A可以看出:当Na2S2O3浓度为40 mmol/L时,其对3-DG的形成有明显抑制作用,抑制率为7.1%,但其他浓度下对3-DG的形成无显著影响(P>0.05),这表明Na2S2O3对3-DG的作用效果与其浓度有关;随Na2SO3浓度增大,其对3-DG形成的抑制效果增强,当其浓度为100 mmol/L时,3-DG生成量与对照相比减少了30.4%,亚硫酸根可与糖类物质的醛基形成加合物[20],在本研究中,推测亚硫酸根可能通过与果糖发生缩合反应,从而抑制3-DG的形成;Na2S2O5对3-DG的形成无显著作用效果(P>0.05);Na2SO4则可显著促进3-DG的形成(P<0.05),且随Na2SO4浓度从20 mmol/L提高至80 mmol/L,3-DG生成量增加了18.7%。上述结果表明,含不同价态硫的化合物对3-DG形成的影响不同,含低价态硫的化合物(+2、+4价)对3-DG的形成无显著影响(P>0.05)或可抑制其形成,而含高价态(+6价)硫的化合物对其形成具有促进作用。
含不同价态硫的化合物对5-HMF形成的作用效果与3-DG不同(图5B)。首先,随Na2SO4浓度增大,其对5-HMF形成的促进作用增强,当其浓度为100 mmol/L时,与对照相比,5-HMF生成量增加了70.6%,该结果与Sun等[25]的研究一致,其原因为Na2SO4可催化果糖转化成5-HMF的反应,促进5-HMF的形成。其次,Na2S2O3、Na2S2O5和Na2SO3则显著抑制5-HMF的形成(P<0.05);Na2S2O3浓度从40 mmol/L增加至100 mmol/L时,5-HMF生成量降低,5-HMF抑制率从11.2%提升至26.3%;Na2S2O5和Na2SO3对5-HMF的抑制有相似的规律,当浓度为40 mmol/L时,二者对5-HMF抑制率分别为99.1%和96.2%,但随浓度(60~100 mmol/L)进一步增大,与40 mmol/L相比,二者对5-HMF的抑制效果已无显著提升(P>0.05),这与Li等[26]的结果一致。Na2SO3的添加可同时抑制3-DG(图5A)和5-HMF的形成,这表明Na2SO3引起5-HMF含量的减少与其抑制了5-HMF的前体物3-DG形成有关。此外,亚硫酸根可与5-HMF的羰基发生反应,从而减少已生成5-HMF的量[27]。综上所述,含低价态硫的化合物(+2、+4价)能抑制5-HMF的形成,而含高价态(+6价)硫的化合物对其形成具有促进作用。
3. 结论
本研究分析了糖种类、pH、温度、离子种类和含不同价态硫的化合物对糖-柠檬酸体系中3-DG和5-HMF形成的影响及二者的形成动力学。得出如下结论:
a.果糖和蔗糖较葡萄糖更容易转化成3-DG及5-HMF,果糖/蔗糖-柠檬酸反应体系中3-DG生成量分别高达127.7和121.4 mg/L,5-HMF的生成量分别高达159.9和149.6 mg/L。3-DG及5-HMF生成量随pH(3~6)的提高而降低。温度升高(70~100 ℃)可促进3-DG和5-HMF的生成。在70~90 ℃下,3-DG的形成符合零级动力学模型;100 ℃下,其形成符合二级动力学模型。在100 ℃条件下,5-HMF的形成符合零级动力学。
b.金属离子种类和含不同价态硫的化合物对果糖-柠檬酸反应体系3-DG及5-HMF的形成有显著影响(P<0.05)。Ca2+、Mg2+、Al3+均能促进体系中3-DG和5-HMF的形成,且金属离子浓度越高,二者生成量越大;K+仅能促进体系中3-DG的形成。硫价态为+2的Na2S2O3可抑制3-DG与5-HMF的形成,且对3-DG的抑制作用与其浓度有关;硫的价态为+4的化合物中,Na2SO3可同时抑制3-DG和5-HMF的形成,Na2S2O5对3-DG形成无显著影响(P˃0.05),但可抑制5-HMF的形成;硫价态为+6的Na2SO4对3-DG和5-HMF的形成起促进作用。本研究可为食品中3-DG和5-HMF的形成与控制提供理论参考。
-
表 1 不同糖-柠檬酸反应体系中3-DG的形成动力学分析
Table 1 Kinetics analysis of 3-DG formation in different sugar-citric acid reaction systems
糖种类 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 蔗糖(1~9 h) Ct=36.03+12.13t 12.13 0.8282 Ct=37.58exp(0.17t) 0.17 0.6982 Ct=25.61+49.95lnt 49.95 0.9691 果糖(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 葡萄糖(1~9 h) Ct=0.56+0.47t 0.47 0.8141 Ct=0.16exp(0.47t) 0.47 0.4402 Ct=0.16+1.92lnt 1.92 0.9529 表 2 不同糖-酸柠檬酸反应体系中5-HMF的形成动力学分析
Table 2 Kinetics analysis of 5-HMF formation in different sugar-citric acid systems
糖种类 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 蔗糖(1~9 h) Ct=−24.61+19.31t 19.31 0.9899 Ct=5.54exp(0.42t) 0.42 0.8593 Ct=−25.34+68.38lnt 68.38 0.8565 果糖(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 葡萄糖(1~9 h) Ct=−1.19+0.72t 0.72 0.9839 Ct=0.04exp(0.63t) 0.63 0.7485 Ct=−1.17+2.51lnt 2.51 0.8304 表 3 不同pH下3-DG的形成动力学分析
Table 3 Kinetics analysis of 3-DG formation under different pH values
pH 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 pH3(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 pH4(1~8 h) Ct=56.09+8.94t 8.94 0.7246 Ct=55.21exp(0.11t) 0.11 0.6456 Ct=49.62+35.22lnt 35.22 0.9278 pH5(1~6 h) Ct=42.45+9.59t 9.59 0.7917 Ct=43.43exp(0.15t) 0.15 0.7134 Ct=43.47+29.68lnt 29.68 0.9513 pH6(1~3 h) Ct=32.81+4.13t 4.13 0.8708 Ct=33.27exp(0.10t) 0.10 0.8615 Ct=36.42+7.78lnt 7.78 0.9534 表 4 不同pH下5-HMF的形成动力学分析
Table 4 Kinetics analysis of 5-HMF formation under different pH values
pH 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 pH3(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 pH4(1~9 h) Ct=−23.36+15.32t 15.32 0.9827 Ct=3.04exp(0.47t) 0.47 0.8716 Ct=−22.80+53.46lnt 53.46 0.8252 pH5(1~9 h) Ct=−5.59+3.53t 3.53 0.9778 Ct=0.37exp(0.56t) 0.56 0.7750 Ct=−5.46+12.30lnt 12.30 0.8207 pH6(1~9 h) Ct=−0.46+0.23t 0.23 0.9567 Ct=0.0046exp(0.76t) 0.76 0.8190 Ct=−0.43+0.78lnt 0.78 0.7777 表 5 不同温度下3-DG的形成动力学分析
Table 5 Kinetics analysis of 3-DG formation at different temperatures
温度 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 100 ℃(1~9 h) Ct=41.65+11.30t 11.30 0.8868 Ct=45.44exp(0.14t) 0.14 0.7793 Ct=33.67+45.34lnt 45.34 0.9846 90 ℃(1~9 h) Ct=1.07+1.28t 1.28 0.9735 Ct=2.26exp(0.21t) 0.21 0.8740 Ct=0.69+4.75lnt 4.75 0.9304 80 ℃(1~9 h) Ct=0.24+0.65t 0.65 0.9926 Ct=0.90exp(0.24t) 0.24 0.8821 Ct=0.06+2.41lnt 2.41 0.9394 70 ℃(1~9 h) Ct=0.13+0.18t 0.23 0.9919 Ct=0.30exp(0.23t) 0.23 0.9409 Ct=-0.0040+0.82lnt 0.82 0.8752 表 6 不同温度下5-HMF的形成动力学分析
Table 6 Kinetics analysis of 5-HMF formation at different temperatures
温度 零级动力学 一级动力学 二级动力学 公式 k R2 公式 k R2 公式 k R2 100 ℃(1~9 h) Ct=−23.01+20.11t 20.11 0.9900 Ct=8.03exp(0.38t) 0.38 0.8880 Ct=−23.76+71.22lnt 71.22 0.8563 90 ℃(1~9 h) Ct=−4.80+3.48t 3.48 0.9479 Ct=1.03exp(0.41t) 0.41 0.8681 Ct=−4.62+12.12lnt 12.12 0.7914 80 ℃(1~9 h) Ct=−1.41+0.88t 0.88 0.9800 Ct=0.06exp(0.62t) 0.62 0.7062 Ct=−1.38+3.06lnt 3.06 0.8220 70 ℃(6~9 h) Ct=−0.81+0.19t 0.19 0.9960 Ct=0.05exp(0.33t) 0.33 0.9953 Ct=−2.15+1.37lnt 1.37 0.9811 -
[1] AKTAG I G, GOKMEN V. A survey of the occurrence of alpha-dicarbonyl compounds and 5-hydroxymethylfurfural in dried fruits, fruit juices, puree and concentrates[J]. Journal of Food Composition and Analysis,2020,91:103523. doi: 10.1016/j.jfca.2020.103523
[2] AKTAG I G, GOKMEN V. Multiresponse kinetic modelling of alpha-dicarbonyl compounds formation in fruit juices during storage[J]. Food Chemistry,2020,320:126620. doi: 10.1016/j.foodchem.2020.126620
[3] 张泽宇, 曹雁平, 朱雨辰. 缓解食品中丙烯酰胺和5-羟甲基糠醛形成的研究进展[J]. 食品工业科技,2020,41(12):324−333,347. [ZHANG Z Y, CAO Y P, ZHU Y C. Mitigation strategies on acrylamide and 5-hydroxymethylfurfural in foods[J]. Science and Technology of Food Industry,2020,41(12):324−333,347. [4] BEISSWENGER P J, DRUMMOND K S, NELSON R G, et al. Susceptibility to diabetic nephropathy is related to dicarbonyl and oxidative stress[J]. Diabetes,2005,54(11):3274−3281. doi: 10.2337/diabetes.54.11.3274
[5] TANG R, FAISAL M, ALATAR A A, et al. Glycation of heme-protein, “myoglobin” by 3-deoxyglucosone: Implications in immunogenicity[J]. Journal of King SAUD University Science,2020,32(5):2598−2602. doi: 10.1016/j.jksus.2020.04.019
[6] SHAPLA U M, SOLAYMAN M, ALAM N, et al. 5-Hydroxymethylfurfural (HMF) levels in honey and other food products: Effects on bees and human health[J]. Chemistry Central Journal,2018,12(1):1−18. doi: 10.1186/s13065-017-0364-3
[7] ABRAHAM K, GUERTLER R, BERG K, et al. Toxicology and risk assessment of 5-Hydroxymethylfurfural in food[J]. Molecular Nutrition & Food Research,2011,55(5):667−678.
[8] GLATT H, SCHNEIDER H, MURKOVIC M, et al. Hydroxymethyl-substituted furans: Mutagenicity in Salmonella typhimurium strains engineered for expression of various human and rodent sulphotransferases[J]. Mutagenesis,2012,27(1):41−48. doi: 10.1093/mutage/ger054
[9] PASTORIZA DE LA CUEVA S, ALVAREZ J, VEGVARI A, et al. Relationship between HMF intake and SMF formation in vivo: An animal and human study[J]. Molecular Nutrition & Food Research,2017,61:16007733.
[10] CAPUANO E, FOGLIANO V. Acrylamide and 5-hydroxymethylfurfural (HMF): A review on metabolism, toxicity, occurrence in food and mitigation strategies[J]. LWT-Food Science and Technology,2011,44(4):793−810. doi: 10.1016/j.lwt.2010.11.002
[11] ZHANG Y, AN X. Inhibitory mechanism of quercetin against the formation of 5-(hydroxymethyl)-2-furaldehyde in buckwheat flour bread by ultra-performance liquid chromatography coupled with high-resolution tandem mass spectrometry[J]. Food Research International,2017,95:68−81. doi: 10.1016/j.foodres.2017.03.007
[12] LOCAS C P, YAYLAYAN V A. Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde (HMF) from sucrose by pyrolysis-GC/MS[J]. Journal of Agricultural and Food Chemistry,2008,56(15):6717−6723. doi: 10.1021/jf8010245
[13] HELLWIG M, DEGEN J, HENLE T. 3-Deoxygalactosone, a “new” 1, 2-dicarbonyl compound in milk products[J]. Journal of Agricultural and Food Chemistry,2010,58(19):10752−10760. doi: 10.1021/jf102388v
[14] 张玉玉, 张兴, 章慧莺, 等. 3种单糖模拟体系中5-羟甲基糠醛的形成动力学分析[J]. 食品科学,2014,35(17):41−47. [ZHANG Y Y, ZHANG X, ZHANG H Y, et al. Kinetic studies on 5-hydroxymethylfurfural formation in three kinds of monosaccharide solution model systems during thermal processing[J]. Food Science,2014,35(17):41−47. doi: 10.7506/spkx1002-6630-201417009 [15] MEDNICK M L. The acid-base-catalyzed conversion of aldohexose into 5-(hydroxymethyl)-2-furfural2[J]. The Journal of Organic Chemistry,1962,27(2):398−403. doi: 10.1021/jo01049a013
[16] PHAM H T, KITYO P, BUVÉ C, et al. Influence of pH and composition on nonenzymatic browning of shelf-stable orange juice during storage[J]. Journal of Agricultural and Food Chemistry,2020,68(19):5402−5411. doi: 10.1021/acs.jafc.9b07630
[17] GONG M, ZHOU Z, YU Y, et al. Investigation of the 5-hydroxymethylfurfural and furfural content of Chinese traditional fermented vinegars from different regions and its correlation with the saccharide and amino acid content[J]. LWT-Food Science and Technology,2020,124:109175. doi: 10.1016/j.lwt.2020.109175
[18] AJANDOUZ E H, TCHIAKPE L S, ORE F D, et al. Effects of pH on caramelization and Maillard reaction kinetics in fructose-lysine model systems[J]. Journal of Food Science,2001,66(7):926−931. doi: 10.1111/j.1365-2621.2001.tb08213.x
[19] AIDA T M, TAJIMA K, WATANABE M, et al. Reactions of d-fructose in water at temperatures up to 400 °C and pressures up to 100 MPa[J]. The Journal of Supercritical Fluids,2007,42(1):110−119. doi: 10.1016/j.supflu.2006.12.017
[20] 阚建全, 谢笔钧. 食品化学[M]. 第三版. 北京: 中国农业大学出版社, 2016: 96−102. KAN J Q, XIE B J. Food chemistry[M]. The Third Edition. Beijing: China Agricultural University Press, 2016: 96−102.
[21] MESÍAS M, HOLGADO F, MÁRQUEZ-RUIZ G, et al. Effect of sodium replacement in cookies on the formation of process contaminants and lipid oxidation[J]. LWT-Food Science and Technology,2015,62(1):633−639. doi: 10.1016/j.lwt.2014.11.028
[22] GÖKMEN V, ŞENYUVA H Z. Effects of some cations on the formation of acrylamide and furfurals in glucose-asparagine model system[J]. European Food Research and Technology,2007,225(5-6):815−820. doi: 10.1007/s00217-006-0486-7
[23] YANG Y, LIU W, WANG N, et al. Effect of different ionic liquids on 5-hydroxymethylfurfural preparation from glucose in DMA over AlCl3: Experimental and theoretical study[J]. Chinese Journal of Chemistry,2015,33(5):583−588. doi: 10.1002/cjoc.201500030
[24] WEN C, SHI X, WANG Z, et al. Effects of metal ions on formation of acrylamide and 5-hydroxymethylfurfural in asparagine-glucose model system[J]. International Journal of Food Science & Technology,2016,51(2):279−285.
[25] SUN K, ZHANG L, SHAO Y, et al. Conversion of monosaccharides into levulinic acid/esters: Impacts of metal sulfate addition and the reaction medium[J]. Journal of Chemical Technology & Biotechnology,2019,94(11):3676−3686.
[26] LI Y, CAI K, HU G, et al. Substitute salts influencing the formation of PAHs in sodium-reduced bacon relevant to Maillard reactions[J]. Food Control,2021,121:107631. doi: 10.1016/j.foodcont.2020.107631
[27] GUAN Y, ZHU S, YU S, et al. Possible mechanism for inhibiting the formation of polymers originated from 5-hydroxymethyl-2-furaldehyde by sulfite groups in the dairy thermal process[J]. Journal of Dairy Science,2013,96(5):2826−2831. doi: 10.3168/jds.2012-6056








 下载:
下载:
 下载:
下载:
