Optimization of Extraction Process of Forsythioside A, Forsythin and Rutin from Forsythia suspensa Leaves Based on Response Surface Methodology and Entropy Weight Method
-
摘要: 本文优化了连翘叶多指标成分的超声提取工艺。采用高效液相色谱法(High Performance Liquid Chromatography,HPLC)同时测定连翘叶提取物中连翘酯苷A、连翘苷和芦丁的提取量,以乙醇浓度、液料比、提取温度及提取时间为考察因素,运用熵权法计算权重系数,进行多指标综合评分,并以综合评分为指标,通过Box-Behnken响应面法优化提取工艺。结果表明,连翘叶最佳提取工艺:乙醇浓度50%,液料比28:1 mL/g,提取温度51 ℃,提取时间25 min。验证实验表明在此优化工艺条件下,连翘酯苷A、连翘苷和芦丁的提取量分别为69.69、22.87、22.46 mg/g,综合评分为32.18,RSD均小于3%。该提取工艺稳定、可行,有效成分提取量较高,适用于连翘叶连翘酯苷A、连翘苷和芦丁的提取。Abstract: In this paper, the ultrasonic extraction technology of Forsythia suspensa leaves was optimized based on multi-index components. The contents of forsythioside A, forsythin and rutin were determined by high performance liquid chromatography (HPLC). The ethanol concentration, liquid-solid ratio, extraction time and extraction temperature were taken as the factors. The entropy weight method was used to obtain comprehensive score by calculating the weight coefficient of each index. Subsequently, the comprehensive score was taken as the index. Finally the Box-Behnken response surface methodology was adopted to optimize the extraction process. The optimum extraction conditions of Forsythia suspensa leaves were as follow: Ethanol concentration 50%, liquid to material ratio 28:1 mL/g, extraction temperature 51 ℃, extraction time 25 min. The results of the validation tests showed that under the optimal conditions, the extraction amount of forsythioside A, forsythin and rutin were 69.69, 22.87 and 22.46 mg/g, respectively, the RSD was less than 3% and comprehensive score was 32.18. The extraction technology was stable and feasible, and the extraction quantity of active components was high. It was suitable for the extraction of Forsythia suspensa leaves.
-
连翘叶是木犀科植物连翘(Forsythia suspensa(Thunb.) Vahl)的干燥叶片。《中华本草》记载“连翘茎叶,性寒,主治心肺积热”[1]。连翘叶的生物活性成分包括苯乙醇苷类、木脂素类、黄酮类、有机酸类、萜类等化合物[2-3]。现代药理研究表明连翘叶具有抗病毒、抗菌、抗氧化、保肝、降血糖血脂等作用[4-9]。连翘叶生物量大,活性多样,但由于连翘的主要用药部位是果实,生产中大量连翘叶被丢弃,目前其开发利用仅限于小部分地区连翘茶的应用,这造成了极大的资源浪费及巨大的经济损失[10-11]。2017年,国家正式批准连翘叶作为新资源食品,为连翘叶的深度开发利用提供了理论依据和政策支持。
目前连翘叶多采用热水浸提、回流等效率较低的方法进行提取,而超声作为一种提取效率高、耗时短、应用范围广的方法,在连翘叶上的应用研究较缺乏。此外,连翘叶的提取多针对连翘酯苷A、连翘苷等单一成分[12-15],有关连翘叶多指标成分的提取工艺研究报道较少。研究表明,连翘叶中连翘酯苷A、连翘苷和芦丁的含量均高于作为药材原料入药的连翘果实中的含量[16],且具有抗氧化[7,17-19]、抗菌抗病毒[5-6,20]、降血脂[21]、神经保护[22-23]等多种药理活性,共同构成连翘叶发挥临床疗效的物质基础。因此本研究以此三个活性成分为指标,采用效率高、时间短的超声提取法,对提取过程中的关键因素,即乙醇浓度、液料比、提取时间、提取温度加以考察。并采用熵权法计算连翘酯苷A、连翘苷和芦丁的相关权重,结合Box-Behnken设计-响应面法(Box-Behnken design-response surface method,BBD-RSM),优选提取工艺,为连翘叶资源的综合开发利用提供参考。
1. 材料与方法
1.1 材料与仪器
连翘叶 2020年8月采自山西省安泽县,经北京中医药大学李卫东研究员鉴定为木犀科连翘属植物连翘的叶,置通风处阴干,粉碎过4号筛,低温储存备用;连翘酯苷A(批号:PS000582)、连翘苷(批号:PS000579) 成都普斯生物科技公司;芦丁(批号:T27F10Z81699) 上海源叶生物科技有限公司;甲醇 分析纯,北京化工厂;醋酸 分析纯,北京化学试剂公司;乙腈 色谱纯,Fisher Scientific公司;娃哈哈纯净水 杭州娃哈哈集团有限公司。
Waters alliance型高效液相色谱仪、Waters 2998 PDA检测器、Empower软件系统 美国Waters公司;BT25S型1/100000电子分析天平 赛多利斯科学仪器北京有限公司;HH-S4A型电热恒温水浴锅 北京科伟永兴仪器有限公司;RE-52型旋转蒸发器、SHZ-Ⅲ型真空泵 上海亚荣生化仪器厂;DFY-200C型摇摆式高速粉碎机 温岭市林大机械有限公司;FD-2A型真空冷冻干燥机 北京博医康实验仪器有限公司;KQ-400KDE型高功率数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 HPLC含量测定方法的建立
1.2.1.1 混合对照品溶液的制备
精密称取连翘酯苷A、连翘苷及芦丁对照品适量,加甲醇制成每1 mL含连翘酯苷A 1.880 mg、连翘苷0.700 mg和芦丁1.000 mg的混合对照品溶液。
1.2.1.2 供试品溶液的制备
精密称取连翘叶粉末(过4号筛)1 g,置于50 mL锥形瓶中,于一定乙醇浓度、液料比、提取时间、提取温度条件下超声提取,冷却后于4 ℃下以8000 r/min转速离心20 min,移出上清液后定容至100 mL,0.45 μm微孔滤膜滤过,待用。
1.2.1.3 色谱条件
色谱柱:Waters XbridgeTM shield C18(4.6×250 mm,5 μm);流动相:乙腈(A)−0.4%乙酸水溶液(B),梯度洗脱(0~8 min,10%~15% A;8~18 min,15%~22% A;18~25 min,22%~40% A;25~30 min,40%~95% A;30~35 min,95% A);测定波长:277 nm;体积流量:l mL/min;柱温:30 ℃;进样量:20 μL[24]。
1.2.1.4 线性关系考察
依次稀释“1.2.1.1”项下混合对照品溶液,分别稀释2、4、8、16、32倍,甲醇溶解,0.45 μm微孔滤膜滤过,即得系列质量浓度的混合对照品溶液。精密吸取系列不同质量浓度的混合对照品溶液各20 μL,注入液相色谱仪,记录峰面积。以各对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)绘制标准曲线,进行回归分析。
1.2.1.5 精密度试验
取“1.2.1.1”项下混合对照品溶液,按“1.2.1.3”项下色谱条件进样检测,连续进样6次。计算连翘酯苷A、连翘苷及芦丁峰面积的RSD。
1.2.1.6 重复性试验
取同一批供试品粉末,平行6份。按“1.2.1.2”项下方法制备供试品溶液,按“1.2.1.3”项下色谱条件依次进样检测。计算连翘酯苷A、连翘苷及芦丁的提取量及RSD。
1.2.1.7 稳定性试验
取同一批供试品溶液,按“1.2.1.3”项下色谱条件在0、2、4、6、8、12 h分别进样测定。计算连翘酯苷A、连翘苷及芦丁峰面积的RSD。
1.2.1.8 加样回收率试验
取已知各指标成分含量的连翘叶供试品粉末0.5 g,共6份,精密称定,分别加入等量的连翘酯苷A、连翘苷及芦丁对照品,按“1.2.1.2”项下方法制备供试品溶液,按“1.2.1.3”项下色谱条件依次进样检测,计算得到连翘酯苷A、连翘苷及芦丁的平均加样回收率及RSD。
1.2.1.9 指标成分的提取量测定
精密吸取对照品溶液和供试品溶液各20 μL,注入液相色谱仪,记录峰面积。采用外标法通过标准曲线回归方程计算各指标成分质量浓度,根据公式计算提取量。
M=C×100/W (1) 式中:M表示指标成分提取量,mg/g;C表示通过标准曲线回归方程得到的指标成分质量浓度,mg/mL;100为定容的体积;W表示称样量,g。
1.2.2 单因素实验
1.2.2.1 不同乙醇浓度对连翘叶中活性成分提取量的影响
液料比30:1 mL/g,提取时间30 min,提取1次,提取温度60 ℃。在其它条件固定的情况下,考察乙醇浓度30%、40%、50%、60%、70%对连翘酯苷A、连翘苷和芦丁提取量的影响。
1.2.2.2 不同液料比对连翘叶中活性成分提取量的影响
乙醇浓度40%,提取时间30 min,提取1次,提取温度60 ℃。在其它条件固定的情况下,考察液料比10:1、15:1、20:1、25:1、30:1、35:1 mL/g对连翘酯苷A、连翘苷和芦丁提取量的影响。
1.2.2.3 不同提取时间对连翘叶中活性成分提取量的影响
乙醇浓度40%,液料比30:1 mL/g,提取1次,提取温度60 ℃。在其它条件固定的情况下,考察提取时间10、20、30、40、50 min对连翘酯苷A、连翘苷和芦丁提取量的影响。
1.2.2.4 不同提取温度对连翘叶中活性成分提取量的影响
乙醇浓度40%,液料比30:1 mL/g,提取1次,提取时间30 min。在其它条件固定的情况下,考察提取温度20、30、40、50、60 ℃对连翘酯苷A、连翘苷和芦丁提取量的影响。
1.2.3 响应面试验
在单因素实验基础上,以乙醇浓度(A)、液料比(B)、提取时间(C)、提取温度(D)为考察因素,各指标成分提取量为评价指标,综合评分(M)为响应值,利用Design-Expert 11.0.4.0软件进行Box-Behnken响应面试验设计,筛选各因素最优组合条件。试验因素与水平见表1。
表 1 因素与水平Table 1. Factors and levels水平 因素 A乙醇浓度
(%)B液料比
(mL/g)C提取时间
(min)D提取温度
(℃)−1 30 20:1 20 40 0 40 25:1 30 50 1 50 30:1 40 60 1.3 数据处理
每个实验重复3次,响应面优化分析及方差分析采用Design-Expert 11.0.4.0软件,作图采用GraphPad Prism 8.0.1软件。
采用熵权法对多个指标进行客观赋权。首先对数据
xij 根据式1进行归一化处理,得到归一化数据x′ij ,再根据式2得到标准化数据pij ,再根据式(3)计算第j个指标的信息熵Hj ,得到的各指标信息熵根据式4转化为熵权wj ,即得评价指标的熵值。x′ij=xij−min(xi)max(xi)−min(xi) (2) pij=x′ijm∑i=1x′ij(i=1,2,⋯,m;j=1,2,3) (3) Hj=−km∑i=1pijln(pij)k=1ln(m) (4) wj=(1−Hj)n∑j=1Hj (5) 式中:
xij 表示第i次试验时第j个评价指标的提取量值;min(xi) 为第j个评价指标的提取量最小值;max(xi) 为第j个评价指标的提取量最大值;x′ij 表示第i次试验时第j个评价指标的归一化值;pijij 表示第i次试验时第j个评价指标的标准化值;Hj 表示第j个评价指标的信息熵值;wj 表示第j个评价指标的熵权值。2. 结果与分析
2.1 HPLC含量测定方法的结果
2.1.1 色谱图
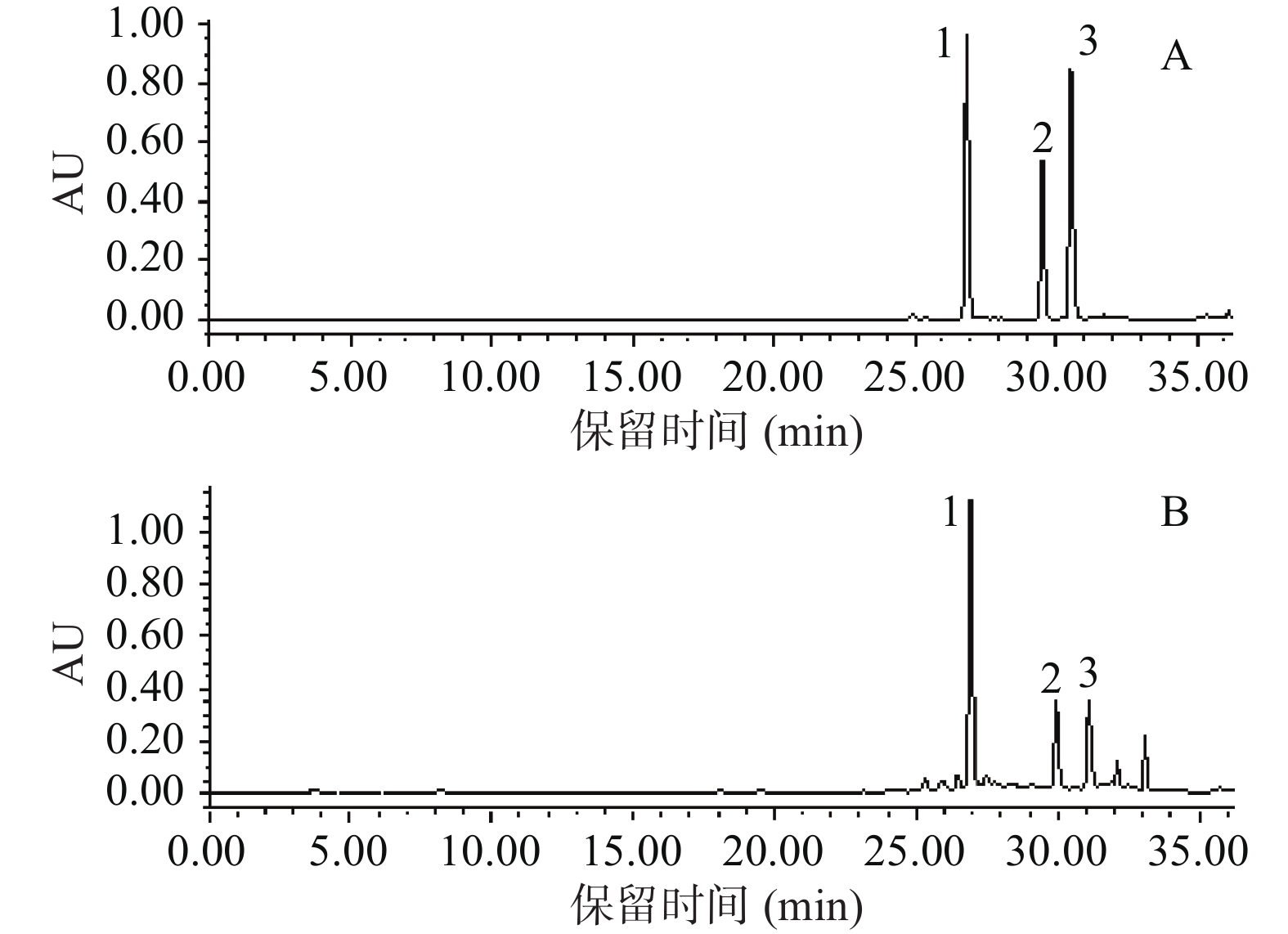
“1.2.1.3”项色谱条件下对照品及样品的色谱图显示3种指标成分在检测波长下分离良好,与对照品保留时间相同,见图1。
2.1.2 线性关系
“1.2.1.4”项下得到各指标成分的回归方程、相关系数(r)及线性范围,见表2,显示连翘酯苷A、连翘苷、芦丁分别在0.058~1.880、0.022~0.700、0.031~1.000 mg/mL范围内与色谱峰面积呈良好的线性关系
表 2 线性关系考察结果Table 2. Results of linear relationship investigation指标性成分 线性回归方程 r n 线性范围(mg/mL) 连翘酯苷A Y =15227008.7617X+192504.3035 0.9998 6 0.058~1.880 连翘苷 Y =12575561.4418X+17580.7313 0.9999 6 0.022~0.700 芦丁 Y =9698992.4208X-95383.7214 0.9994 6 0.031~1.000 2.1.3 方法学考察
“1.2.1.5~1.2.1.8”项下得到的精密度、重复性、稳定性和加样回收率结果见表3。结果表明精密度和重复性均良好,供试品溶液在12 h内稳定,加样回收率合格,符合定量分析的要求。
表 3 精密度、重复性、稳定性和加样回收率结果Table 3. Results of precision, reproducibility, stability and recovery指标性成分 精密度 重复性 稳定性 加样回收率 RSD(%) 提取量(mg/g) RSD(%) RSD(%) 平均加样回收率(%) RSD(%) 连翘酯苷A 1.69 67.02 1.20 1.42 99.11 0.87 连翘苷 0.30 20.58 1.26 2.28 99.53 1.16 芦丁 0.69 21.63 2.34 1.64 100.98 1.11 2.2 单因素实验结果
2.2.1 不同乙醇浓度对连翘叶多指标提取量的影响
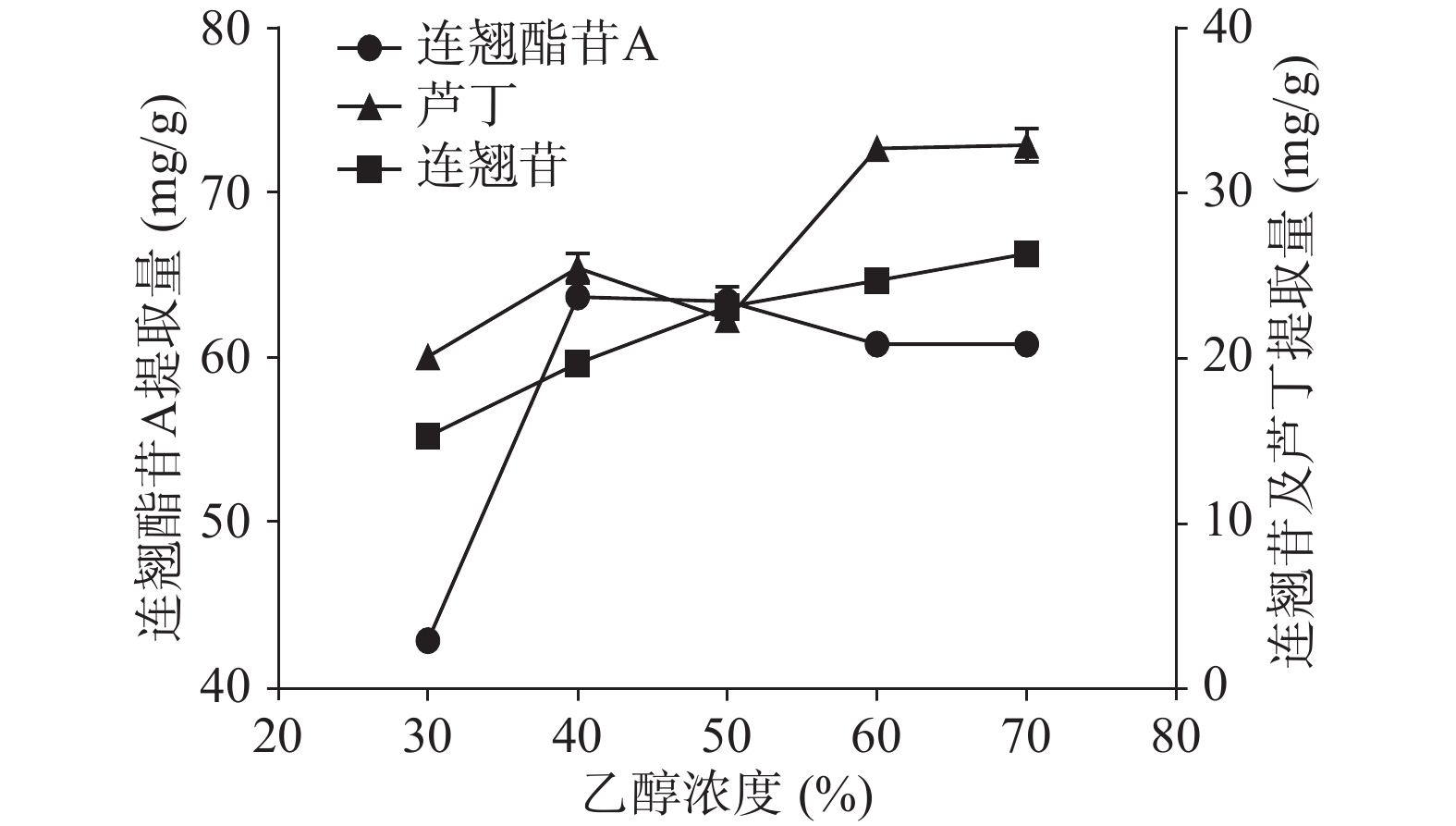
由图2可知,连翘酯苷A的提取量随着乙醇浓度的增加先上升后下降,在乙醇浓度为40%时达到峰值,为63.66 mg/g。而连翘苷和芦丁的提取量则随乙醇浓度的增加有较小幅度的增加。这和刘伟霞等[25]的结果基本一致。综合考虑选择最佳乙醇浓度为40%,并将其作为响应面试验研究参数。
2.2.2 不同液料比对连翘叶多指标提取量的影响
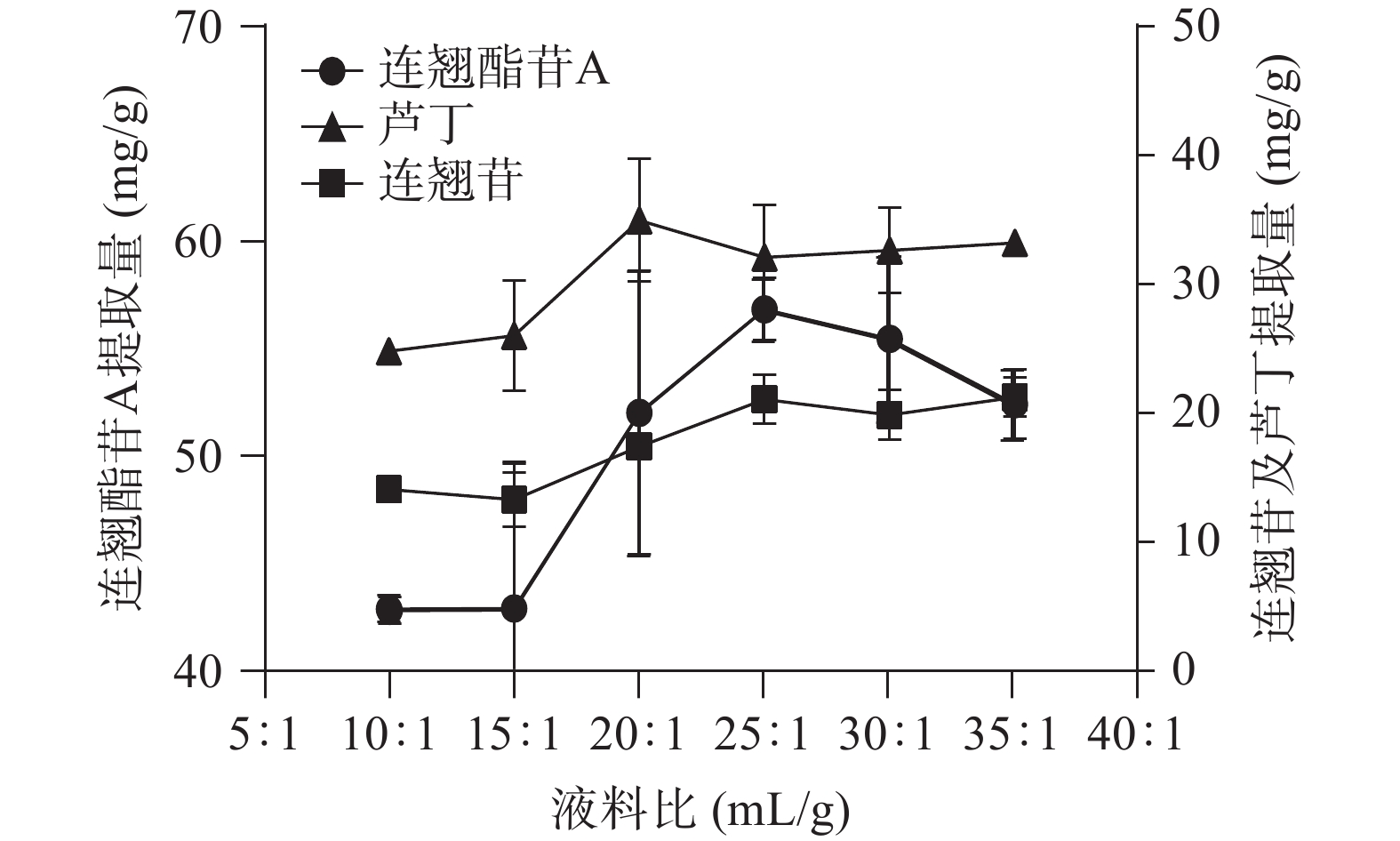
由图3可知,三种成分的提取量趋势基本一致。当液料比增加时,三种成分的提取量先上升后下降或保持平稳。这主要是因为液料比增加,指标成分与溶剂边界层浓度差变大,成分越容易渗透出来,直至成分在溶剂中的扩散达到了平衡,提取量将不再升高。连翘酯苷A和连翘苷提取量在25:1 mL/g时达到峰值,分别为56.79和20.97 mg/g。芦丁在20:1 mL/g时达到峰值,为32.17 mg/g。综合考虑选择最佳液料比为25:1 mL/g,并将其作为响应面试验研究参数。
2.2.3 不同提取时间对连翘叶多指标提取量的影响
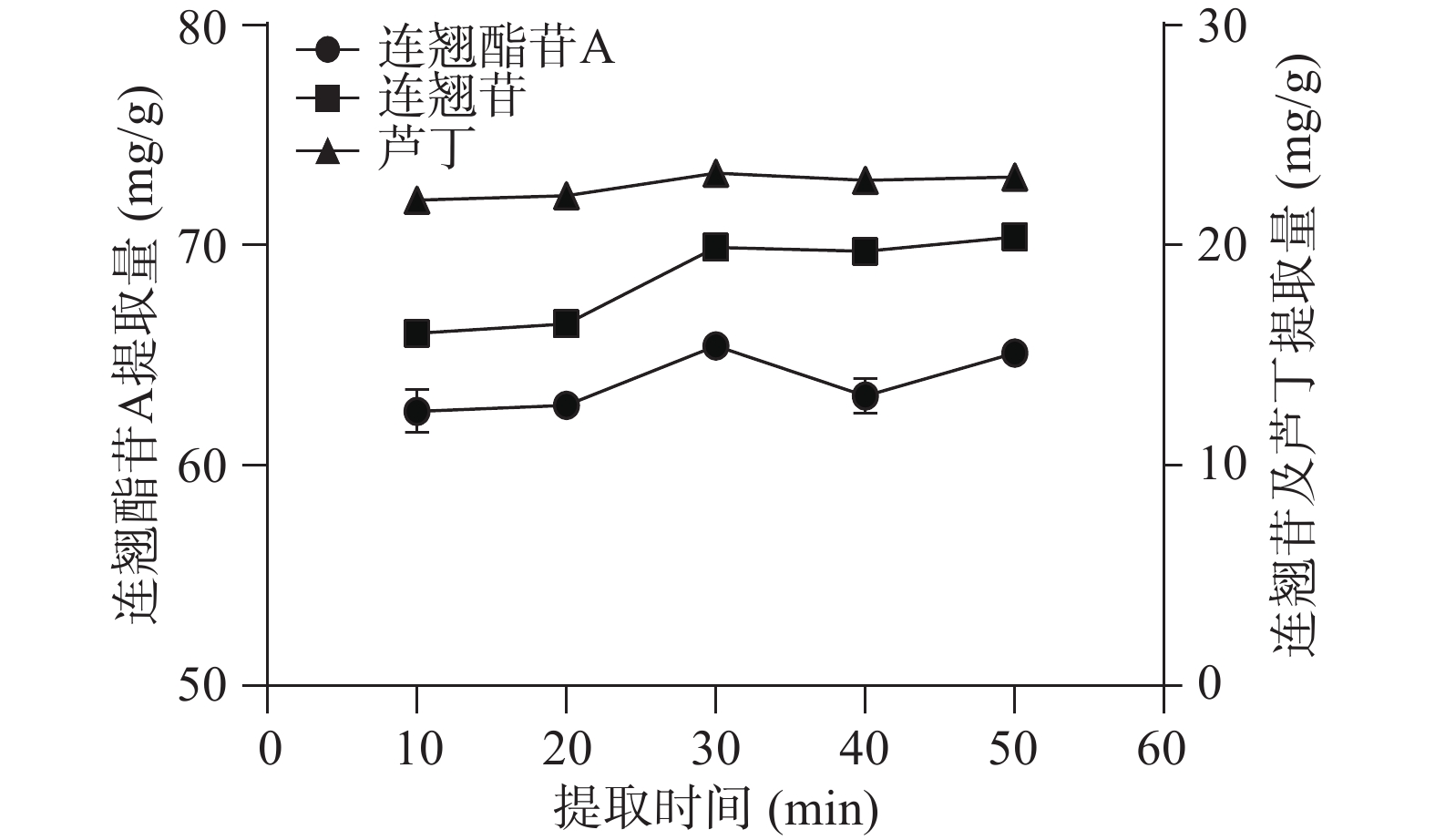
由图4可知,三种成分的提取量变化趋势较一致,均随着提取时间的延长而增加。这可能是因为指标成分与溶剂边界层存在浓度差,超声时间延长强化了空化和机械效应,有利于有效成分的溶出[26]。三种成分的提取量均在30 min时达到峰值,连翘酯苷A为65.44 mg/g,连翘苷为19.92 mg/g,芦丁为23.30 mg/g。综合考虑选择最佳提取时间为30 min,并将其作为响应面试验研究参数。
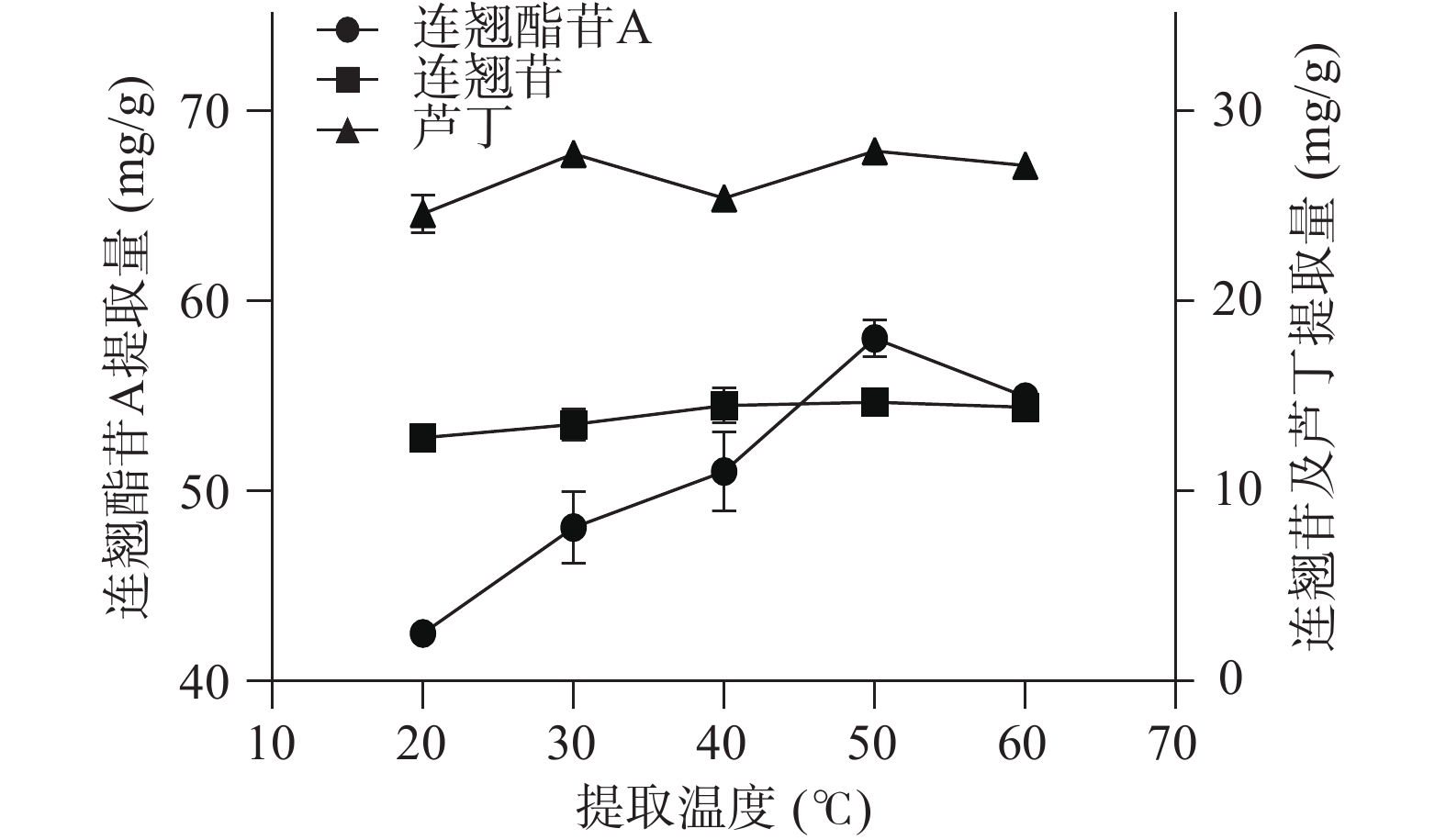
2.2.4 不同提取温度对连翘叶多指标提取量的影响
由图5可知,提取温度对连翘酯苷A提取量影响较显著,对连翘苷和芦丁的提取量影响较小。当温度为50 ℃时,连翘酯苷A提取较完全,为57.88 mg/g。随着提取温度的继续增加,总提取量开始下降,推测其原因可能是连翘酯苷A分子中具有酯键,较高温度易水解[27]。综合考虑选择最佳提取温度为50 ℃,并将其作为响应面试验研究参数。
2.3 响应面试验结果
根据表4进行Box-Benhnken中心组合实验设计,共29个实验点,研究各因素对连翘叶连翘酯苷A、连翘苷、芦丁提取量和综合评分M的影响。响应面试验设计及结果见表4。
表 4 Box-Behnken 响应面试验设计与结果Table 4. Box-Behnken response surface test design and results实验号 因素 提取量(mg/g) 综合评分(M) A B C D 连翘酯苷A 连翘苷 芦丁 1 −1 0 0 −1 35.01 15.27 17.33 20.04 2 −1 1 0 0 65.42 18.36 22.08 29.28 3 0 0 0 0 68.02 20.86 21.40 30.60 4 1 1 0 0 70.22 22.87 21.43 31.90 5 0 −1 1 0 67.23 19.97 20.93 29.89 6 0 0 −1 −1 56.14 17.26 20.51 26.35 7 0 −1 0 −1 46.20 16.53 18.16 23.14 8 −1 −1 0 0 50.97 15.67 17.76 23.59 9 1 0 0 −1 58.99 20.78 22.27 29.07 10 −1 0 0 1 56.05 14.00 21.17 25.21 11 0 −1 −1 0 62.31 18.13 22.21 28.60 12 1 0 0 1 64.14 20.60 23.10 30.35 13 0 1 0 1 64.44 19.71 23.72 30.27 14 0 0 1 1 61.58 18.44 21.85 28.45 15 −1 0 1 0 52.90 15.58 20.79 25.09 16 0 1 −1 0 59.15 20.11 22.64 28.96 17 −1 0 −1 0 48.06 14.72 18.08 22.73 18 0 0 1 −1 59.58 19.11 20.80 27.93 19 0 1 1 0 66.83 20.55 21.29 30.19 20 0 0 0 0 65.64 20.41 20.95 29.76 21 0 0 0 0 65.79 19.54 21.46 29.62 22 0 1 0 −1 56.58 19.77 20.89 27.63 23 0 0 0 0 70.30 20.94 23.81 32.00 24 1 −1 0 0 61.92 20.57 20.58 28.93 25 0 −1 0 1 59.13 17.15 19.37 26.47 26 1 0 1 0 63.57 22.27 20.90 30.11 27 0 0 −1 1 64.59 19.56 20.64 29.07 28 1 0 −1 0 67.62 22.53 21.81 31.38 29 0 0 0 0 67.48 20.62 21.46 30.41 2.3.1 综合评分(M)计算
本实验采用熵权法对多个指标进行客观赋权。熵权法是一种用于衡量指标的离散程度的客观赋权法,离散程度越大,表明该指标对综合评价的影响越大[28],已广泛应用于提取工艺研究[29-31]。本研究利用信息熵这个工具,计算各项指标的权重,最终计算得到连翘酯苷A、连翘苷及芦丁的权重值分别为0.2022、0.4204、0.3774。按M=连翘酯苷A提取量×0.2022+连翘苷提取量×0.4204+芦丁提取量×0.3774,计算不同试验号下各指标成分综合评分(M),结果见表4。
2.3.2 模型建立及方差分析
利用Design-Expert 11.0.4.0软件对表4中综合评分M进行多元二次回归拟合,得回归方程M=30.48+2.98A+1.47B+0.3811C+1.30D−0.6789AB−0.9088AC−0.9716AD−0.0121BC−0.1739BD−0.5509CD−1.97A2−0.5733B2−0.5891C2−2.43D2(R2=0.9472)。对模型进行方差分析,结果见表5。由表5可知该回归模型极显著,说明其拟合度及预测性良好;模型的一次项A项、B项、D项极显著(P<0.01),C项不显著;交互项均不显著;二次项A2项和D2项影响极显著(P<0.01),B2项、C2项不显著;这表明各因素与综合评分M间并非简单的线性关系。失拟项的P值为0.1922>0.05,对综合评分M影响不显著,说明该模型的拟合度良好,可以利用该模型确定最优提取工艺条件。
表 5 方差分析结果Table 5. Results of ANOVA方差来源 平方和 自由度 均方 F P 显著性 模型 218.91 14 15.64 8.29 0.0002 ** A 106.73 1 106.73 56.57 <0.0001 ** B 25.80 1 25.80 13.67 0.0024 ** C 1.74 1 1.74 0.9237 0.3528 D 20.41 1 20.41 10.82 0.0054 ** AB 1.84 1 1.84 0.9771 0.3397 AC 3.30 1 3.30 1.75 0.2070 BC 3.78 1 3.78 2.00 0.1790 BD 0.0006 1 0.0006 0.0003 0.9862 CD 0.1209 1 0.1209 0.0641 0.8038 A² 25.22 1 25.22 13.37 0.0026 ** B² 2.13 1 2.13 1.13 0.3058 C² 2.25 1 2.25 1.19 0.2932 D² 38.43 1 38.43 20.37 0.0005 ** 残差 26.41 14 1.89 失拟项 22.81 10 2.28 2.53 0.1922 纯误差 3.60 4 0.9011 总和 245.32 28 注:*代表结果有显著性差异(P<0.05);**代表结果有极显著性差异(P<0.01)。 2.3.3 响应面分析与优化
利用Design-Expert 11.0.4.0软件根据模型绘制各因素交互作用对综合评分M影响的响应面图,见图6。响应曲面坡度越大,代表该因素对响应值影响越大。对比图6响应面图曲面坡度可知各因素对综合评分M影响大小为乙醇浓度(A)>液料比(B)>提取温度(D)>提取时间(C)。根据模型拟合结果,预测连翘叶最优提取工艺为乙醇浓度为50.01%,液料比为28.41:1 mL/g,提取24.98 min,提取温度为51.01 ℃,综合评分为31.90。
2.3.4 验证实验
取连翘叶粉末3份,按优选的提取工艺进行处理,考虑实际操作,将提取工艺调整为50%乙醇,液料比为28:1 mL/g,提取25 min,提取温度为51 ℃。按此工艺条件重复3次,实验结果见表6。综合评分的实际值与预测值(31.90)的偏差为0.62%。表明该模型基本准确,响应面分析与熵权法相结合得到的连翘叶提取工艺参数稳定、可靠。
表 6 工艺验证结果Table 6. Process validation results编号 提取量(mg/g) 综合评分(M) 连翘酯苷A 连翘苷 芦丁 1 68.63 22.26 22.93 31.89 2 71.37 23.43 22.53 32.79 3 69.07 22.93 21.93 31.88 ˉx 69.69 22.87 22.46 32.18 RSD(%) 2.11 2.57 2.24 1.62 3. 结论
本研究以连翘叶中三种主要活性成分连翘酯苷A、连翘苷和芦丁的提取量为评价指标,针对乙醇浓度、液料比、提取温度及提取时间进行单因素考察,并在此基础上进行响应面试验优化,得到最佳提取工艺为乙醇浓度:50%,液料比28:1 mL/g,提取温度:51 ℃,提取时间:25 min。该条件下,连翘酯苷A、连翘苷和芦丁的提取量分别为69.69、22.87、22.46 mg/g,综合评分为32.18,符合响应面模型验证结果。影响提取量的四个因素影响程度大小顺序为乙醇浓度(A)>液料比(B)>提取温度(D)>提取时间(C)。该工艺条件简单,操作控制容易,稳定性好,为连翘叶的综合开发利用提供了新途径。
-
表 1 因素与水平
Table 1 Factors and levels
水平 因素 A乙醇浓度
(%)B液料比
(mL/g)C提取时间
(min)D提取温度
(℃)−1 30 20:1 20 40 0 40 25:1 30 50 1 50 30:1 40 60 表 2 线性关系考察结果
Table 2 Results of linear relationship investigation
指标性成分 线性回归方程 r n 线性范围(mg/mL) 连翘酯苷A Y =15227008.7617X+192504.3035 0.9998 6 0.058~1.880 连翘苷 Y =12575561.4418X+17580.7313 0.9999 6 0.022~0.700 芦丁 Y =9698992.4208X-95383.7214 0.9994 6 0.031~1.000 表 3 精密度、重复性、稳定性和加样回收率结果
Table 3 Results of precision, reproducibility, stability and recovery
指标性成分 精密度 重复性 稳定性 加样回收率 RSD(%) 提取量(mg/g) RSD(%) RSD(%) 平均加样回收率(%) RSD(%) 连翘酯苷A 1.69 67.02 1.20 1.42 99.11 0.87 连翘苷 0.30 20.58 1.26 2.28 99.53 1.16 芦丁 0.69 21.63 2.34 1.64 100.98 1.11 表 4 Box-Behnken 响应面试验设计与结果
Table 4 Box-Behnken response surface test design and results
实验号 因素 提取量(mg/g) 综合评分(M) A B C D 连翘酯苷A 连翘苷 芦丁 1 −1 0 0 −1 35.01 15.27 17.33 20.04 2 −1 1 0 0 65.42 18.36 22.08 29.28 3 0 0 0 0 68.02 20.86 21.40 30.60 4 1 1 0 0 70.22 22.87 21.43 31.90 5 0 −1 1 0 67.23 19.97 20.93 29.89 6 0 0 −1 −1 56.14 17.26 20.51 26.35 7 0 −1 0 −1 46.20 16.53 18.16 23.14 8 −1 −1 0 0 50.97 15.67 17.76 23.59 9 1 0 0 −1 58.99 20.78 22.27 29.07 10 −1 0 0 1 56.05 14.00 21.17 25.21 11 0 −1 −1 0 62.31 18.13 22.21 28.60 12 1 0 0 1 64.14 20.60 23.10 30.35 13 0 1 0 1 64.44 19.71 23.72 30.27 14 0 0 1 1 61.58 18.44 21.85 28.45 15 −1 0 1 0 52.90 15.58 20.79 25.09 16 0 1 −1 0 59.15 20.11 22.64 28.96 17 −1 0 −1 0 48.06 14.72 18.08 22.73 18 0 0 1 −1 59.58 19.11 20.80 27.93 19 0 1 1 0 66.83 20.55 21.29 30.19 20 0 0 0 0 65.64 20.41 20.95 29.76 21 0 0 0 0 65.79 19.54 21.46 29.62 22 0 1 0 −1 56.58 19.77 20.89 27.63 23 0 0 0 0 70.30 20.94 23.81 32.00 24 1 −1 0 0 61.92 20.57 20.58 28.93 25 0 −1 0 1 59.13 17.15 19.37 26.47 26 1 0 1 0 63.57 22.27 20.90 30.11 27 0 0 −1 1 64.59 19.56 20.64 29.07 28 1 0 −1 0 67.62 22.53 21.81 31.38 29 0 0 0 0 67.48 20.62 21.46 30.41 表 5 方差分析结果
Table 5 Results of ANOVA
方差来源 平方和 自由度 均方 F P 显著性 模型 218.91 14 15.64 8.29 0.0002 ** A 106.73 1 106.73 56.57 <0.0001 ** B 25.80 1 25.80 13.67 0.0024 ** C 1.74 1 1.74 0.9237 0.3528 D 20.41 1 20.41 10.82 0.0054 ** AB 1.84 1 1.84 0.9771 0.3397 AC 3.30 1 3.30 1.75 0.2070 BC 3.78 1 3.78 2.00 0.1790 BD 0.0006 1 0.0006 0.0003 0.9862 CD 0.1209 1 0.1209 0.0641 0.8038 A² 25.22 1 25.22 13.37 0.0026 ** B² 2.13 1 2.13 1.13 0.3058 C² 2.25 1 2.25 1.19 0.2932 D² 38.43 1 38.43 20.37 0.0005 ** 残差 26.41 14 1.89 失拟项 22.81 10 2.28 2.53 0.1922 纯误差 3.60 4 0.9011 总和 245.32 28 注:*代表结果有显著性差异(P<0.05);**代表结果有极显著性差异(P<0.01)。 表 6 工艺验证结果
Table 6 Process validation results
编号 提取量(mg/g) 综合评分(M) 连翘酯苷A 连翘苷 芦丁 1 68.63 22.26 22.93 31.89 2 71.37 23.43 22.53 32.79 3 69.07 22.93 21.93 31.88 ˉx 69.69 22.87 22.46 32.18 RSD(%) 2.11 2.57 2.24 1.62 -
[1] 国家中医药管理局中华本草编委会. 中华本草(第六册)[M]. 上海: 上海科学技术出版社, 1999: 157−159. Chinese Materia Medica Commission. Chinese materia medica[M]. Shanghai: Shanghai Science and Technology Press, 1999: 157−159.
[2] 李敬, 尤颖, 赵庆生, 等. 连翘叶成分及生物活性研究进展[J]. 食品工业科技,2020,41(18):344−352. [LI J, YOU Y, ZHAO Q S, et al. Research progress on composition and biological activity of Forsythia suspensa leaves[J]. Science and Technology of Food Industry,2020,41(18):344−352. [3] 原江锋, 胡金婉, 王大红, 等. 不同产地连翘叶花中主要活性成分的含量分析[J]. 天然产物研究与开发,2020,32(3):389−397. [YUAN J F, HU J W, WANG D H, et al. Analysis of main active components in leaves and flowers of Forsythia suspensa from different regions[J]. Natural Product Research and Development,2020,32(3):389−397. [4] KANG W, WANG J. In vitro antioxidant properties and in vivo lowering blood lipid of Forsythia suspense leaves[J]. Medicinal Chemistry Research,2010,19(7):617−628. doi: 10.1007/s00044-009-9217-5
[5] QU X Y, LI Q J, ZHANG H M, et al. Protective effects of phillyrin against influenza A virus in vivo[J]. Archives of Pharmacal Research,2016,39(7):998−1005. doi: 10.1007/s12272-016-0775-z
[6] 张元波. 连翘叶抗菌作用的主要化学物质基础研究[D]. 山西: 山西大学, 2018. ZHANG Y B. Study on the main chemical substances of the antibacterial effect of Forsythia suspense leaves[D]. Shanxi: Shanxi University, 2018.
[7] 张元波, 张敏, 程启斌, 等. 连翘叶抗氧化谱效相关质量评价研究[J]. 天然产物研究与开发,2017,29(4):629−634. [ZHANG Y B, ZHANG M, CHENG Q B, et al. Relationship between HPLC fingerprint chromatogram and antioxidant activity of Forsythia suspense leaves[J]. Natural Product Research and Development,2017,29(4):629−634. [8] LIU J, LIN L, JIA Z, et al. Antibacterial potential of Forsythia suspensa polysaccharide against resistant Enterobacter cloacae with SHV-12 extended-spectrum β-lactamase (ESBL)[J]. Journal of Cellular and Molecular Medicine,2020,24(15):8763−8771. doi: 10.1111/jcmm.15510
[9] 王静, 黄庆辰, 高敏玥, 等. 连翘叶连翘苷提取物对高脂诱导大鼠肥胖的预防作用[J]. 食品科学,2021,42(9):85−90. [WANG J, HUANG Q C, GAO M Y, et al. Preventive effect of forsythin from Forsythia suspensa leaves on obesity induced by high-fat diet in rats[J]. Food Science,2021,42(9):85−90. doi: 10.7506/spkx1002-6630-20201216-198 [10] 任晓红, 刘鑫. 安泽县连翘资源产业开发利用现状与对策[J]. 山西林业,2018(5):12−13. [REN X H, LIU X. Present situation and countermeasure of exploitation and utilization of Forsythia resource industry in Anze county[J]. Forestry of Shanxi,2018(5):12−13. doi: 10.3969/j.issn.1005-4707.2018.05.005 [11] 王晓燕, 杨莹莹, 叶松华, 等. 有机连翘叶茶中核心营养素及功效成分的测定[J]. 农产品加工,2016(13):55−56,58. [WANG X Y, YANG Y Y, YE S H, et al. Determination of core nutrients and functional components of organic Forsythia suspensa leaves tea[J]. Farm Products Processing,2016(13):55−56,58. [12] 邓祥敏, 朱星宇. 连翘叶中连翘苷元制备工艺的研究[J]. 中医药学报,2019,47(4):80−84. [DENG X M, ZHU X Y. Preparation technology of Forsythia glycogen from Forsythia suspensa leaves[J]. Acta Chinese Medicine and Pharmacology,2019,47(4):80−84. [13] 孙建瑞, 王大红, 邱智军, 等. 连翘叶中连翘酯苷A、芦丁和连翘苷提取纯化工艺优化[J]. 食品科学,2017,38(14):200−205. [SUN J R, WANG D H, QIU Z J, et al. Simultaneous extraction purification of forsythoside A, rutin and phillyrin from Forsythia suspensa leaves[J]. Food Science,2017,38(14):200−205. doi: 10.7506/spkx1002-6630-201714031 [14] 张俊顺, 骆嘉原, 姜喆卉, 等. 连翘苷的提取工艺优化及其抑菌活性[J]. 现代食品科技,2020,36(7):193−201. [ZHANG J S, LUO J Y, JIANG Z H, et al. Optimization of extraction process of phillyrin and its antibacterial activity[J]. Modern Food Science and Technology,2020,36(7):193−201. [15] SUN Y S, HOU Z G, LIU Z B, et al. Ionic liquid-based ultrasonic-assisted extraction of forsythosides from the leaf of Forsythia suspensa (Thunb. ) Vahl and subsequent separation and purification by high-speed counter-current chromatography[J]. Journal of Chromatographic Science,2016,54(8):1445−1452. doi: 10.1093/chromsci/bmw069
[16] 王芳, 白吉庆, 黎丹, 等. 阴坡、阳坡连翘及连翘叶中不同成分含量的比较[J]. 中国现代中药,2016,18(2):185−188,202. [WANG F, BAI J Q, LI D, et al. Comparative study on content of constituents in fruits and leaves of Forsythia suspensa growing on shade and sunny slope[J]. Modern Chinese Medicine,2016,18(2):185−188,202. [17] 齐建红. 连翘苷对几种食用植物油脂的抗氧化作用研究[J]. 食品科技, 2013, 38(4): 274−276. QI J H, Antioxidant effects of forsythia on edible vegetable oils and fats[J]. Food Science and Technology, 2013, 38(4): 274−276.
[18] 邱智军, 原江锋, 张国庆, 等. 连翘叶中连翘苷和连翘酯苷A对食用油脂的抗氧化活性[J]. 食品科学,2015,36(17):39−42. [QIU Z J, YUAN J F, ZHANG G Q, et al. Antioxidant activity of forsythin and forsythiaside A from Forsythia suspensa leaves on edible oils[J]. Food Science,2015,36(17):39−42. doi: 10.7506/spkx1002-6630-201517008 [19] YUAN J F, LIU X Q, YANG J X, et al. Forsythia suspense leaves, a plant: Extraction, purification and antioxidant activity of main active compounds[J]. European Food Research and Technology,2014,238(4):527−533.
[20] DING Y, ZENG L, LI R, et al. 中药连花清瘟胶囊通过抑制病毒繁殖和影响免疫功能发挥抗流感作用[C]//第十六届国际络病学大会论文集. 石家庄: 中华中医药学会络病分会, 2020: 32−33. DING Y, ZENG L, LI R, et al. The Chinese prescription Lianhuaqingwen capsule exerts anti-influenza activity through the inhibition of viral propagation and impacts immune function[C]// Proceedings of the 16th International Congress of Epidemiology. Shijiazhuang: China Association of Traditional Chinese Medicine Branch of Collateral Diseases, 2020: 32−33.
[21] 周菲. 连翘叶减肥保健品开发可行性研究[D]. 山西: 山西大学, 2018. ZHOU F. Feasibility study of anti-obesity products about Forsythia suspensa leaves[D]. Shanxi: Shanxi University, 2018.
[22] KIM J M, KIM S, KIM D H, et al. Neuroprotective effect of forsythiaside against transient cerebral global ischemia in gerbil[J]. European Journal of Pharmacology,2011,660(2-3):326−333.
[23] WANG H M, WANG L W, LIU X M, et al. Neuroprotective effects of forsythiaside on learning and memory deficits in senescence-accelerated mouse prone (SAMP8) mice[J]. Pharmacology, Biochemistry and Behavior,2013,105:134−141. doi: 10.1016/j.pbb.2012.12.016
[24] 王金, 王芳, 王小平, 等. 产地对连翘叶中木脂素和黄酮类成分含量的影响[J]. 西北药学杂志,2016,31(4):334−336. [WANG J, WANG F, WANG X P, et al. Effect of the origin on the content of lignan and flavonoid constitents of Forsythia suspensa leaves[J]. Northwest Pharmaceutical Journal,2016,31(4):334−336. doi: 10.3969/j.issn.1004-2407.2016.04.002 [25] 刘伟霞, 杨建雄. 基于响应面法从连翘叶中提取连翘酯苷A和连翘苷的工艺优化[J]. 天然产物研究与开发,2012,24(8):1098−1104. [LIU W X, YANG J X. Optimization of extraction technology of forsythiaside and phillyrin in Forsythia suspense leaves based on response surface methodology[J]. Natural Product Research and Development,2012,24(8):1098−1104. doi: 10.3969/j.issn.1001-6880.2012.08.020 [26] 刘凤霞, 李芳蓉, 刘淑梅, 等. 超声技术在中草药黄酮类成分提取中的应用研究[J]. 中兽医医药杂志,2018,37(6):88−91. [LIU F X, LI F R, LIU SH M, et al. The application of ultrasonic technology in extracting flavonoids ingredients of Chinese herbaI medicine[J]. Journal of Traditional Chinese Veterinary Medicine,2018,37(6):88−91. [27] 王曙宾, 郑亚杰. 连翘提取物和连翘酯苷A原料中连翘酯苷A的稳定性研究[J]. 中草药,2010,41(6):909−911. [WANG S B, ZHENG Y J. Study on the stability of forsythioside A in Forsythia suspensa extract and raw material[J]. Chinese Traditional and Herbal Drugs,2010,41(6):909−911. [28] 林建潮. 熵权法确定评价指标权重在Excel中的实现[J]. 中国医院统计,2020,27(4):362−364. [LIN J C. Realization of entropy weight method to determine evaluation index weight in Excel[J]. Chinese Journal of Hospital Statistics,2020,27(4):362−364. doi: 10.3969/j.issn.1006-5253.2020.04.018 [29] 李冰韶, 康倩, 陈柽, 等. 基于FAHP-熵权法优选复方双花口服液醇沉工艺研究[J]. 中南药学,2019,17(3):414−419. [LI B S, KANG Q, CHEN C, et al. Optimization of alcohol precipitation technology for Fufang Shuanghua oral liquid based on FAHP-entropy method[J]. Central South Pharmacy,2019,17(3):414−419. [30] 王继龙, 魏舒畅, 刘永琦, 等. 基于G1-熵权法和正交设计优选黄芪百合颗粒的提取纯化工艺[J]. 中草药,2018,49(3):596−603. [WANG J L, WEI S C, LIU Y Q, et al. Optimization of extraction and purification technology for Huangqi Baihe Granules based on G1-entropy method and orthogonal design[J]. Chinese Traditional and Herbal Drugs,2018,49(3):596−603. doi: 10.7501/j.issn.0253-2670.2018.03.014 [31] 吴振起, 高畅, 杨璐, 等. 基于层次分析法结合Box-Behnken设计-响应面法优选养阴清肺汤加味提取工艺[J]. 中草药,2019,50(12):2862−2867. [WU Z Q, GAO C, YANG L, et al. Optimization of extraction process of Modified Yangyin Qingfei Decoction by Box-Behnken response surface methodology based on analytic hierarchy process[J]. Chinese Traditional and Herbal Drugs,2019,50(12):2862−2867. doi: 10.7501/j.issn.0253-2670.2019.12.018






 下载:
下载:

















 下载:
下载:
