Active Proteins and Phospholipids Prepared from Chicken Egg Yolk by Green and Efficient Sequential Separation Technology
-
摘要: 为了实现蛋黄功能性成分的充分利用,采用绿色溶剂从新鲜蛋黄中高效连续分离具有生物活性的卵黄免疫球蛋白(immunoglobulin Y, IgY)、卵黄高磷蛋白(phosvitin, PV)和磷脂(phospholipids, PL)。首先采用水稀释法(稀释倍数为1:10)分离水溶性组分与脂蛋白,通过35%饱和(NH4)2SO4和0.5% NaCl(w/v)对上清液进行盐析并用8% PEG 6000纯化IgY。脂质组分中的PV在pH5.0,90 ℃条件下的NaCl溶液(w/v)中进一步纯化。采用乙醇/乙酸乙酯比例为1:2(v/v)提取蛋黄中全部脂类,进一步采用乙酸乙酯在0 ℃下提纯蛋黄总脂中的PL。经脱盐、冷冻干燥后,IgY、PV和PL的纯度分别为97.38%、78.63%和85.94%。IgY和PV的得率分别为6.15、10.15 mg/mL。蛋黄总脂中PL的含量为35.18%。因其良好的多不饱和脂肪酸/饱和脂肪酸比率(0.70)和相对较低的n-6/n-3比率(5.37),该PL产品可应用于食品加工中。本方法简便、环保并且高效,可从蛋黄中依次分离出高纯度IgY、PV和PL,并为蛋黄的综合利用提供技术支持。Abstract: In order to achieve the full utilization of the functional components of egg yolk, a green solvent was used to separate bioactive immunoglobulin Y(IgY), phosvitin(PV), and phospholipids(PL) from fresh chicken egg yolk efficiently and continuously. Firstly, the water-soluble fraction was separated from the lipoproteins by water dilution(dilution ratio of 1:10), and the supernatant was salted by 35% saturated (NH4)2SO4 and 0.5% NaCl(w/v) and IgY purified by 8% PEG 6000. The PV in the lipid fraction was further purified in NaCl solution(w/v) at pH5.0, 90 ℃. All lipids in egg yolk were extracted using an ethanol/ethyl acetate ratio of 1:2(v/v), and PL in total egg yolk lipid was further purified using ethyl acetate at 0 ℃. After desalting and freeze-drying, the purity of IgY, PV and PL was 97.38%, 78.63% and 85.94%, respectively. The yield of IgY and PV was 6.15 mg/mL egg yolk and 10.15 mg/mL egg yolk, respectively, and the content of PL in lipids accounted for 35.18%. The PL product may be served as a good source of dietetic applications due to its favorable PUFA/SFA ratio(0.70) and comparable lower n-6/n-3 ratio(5.37). These results proved that IgY, PV and PL can be purified in sequence from egg yolk with high purity. Also, this method is very simple, environment friendly and can provide technical support for the comprehensive utilization of egg yolk.
-
Keywords:
- egg yolk /
- bioactive components /
- co-extraction /
- ethyl acetate extraction /
- fatty acids
-
我国是禽蛋生产和消费大国,禽蛋产量占世界总产量的40%以上,已连续多年居世界第一。禽蛋是人类优质蛋白质和脂质摄取的重要来源,具有营养丰富、配比均衡、价廉易得等优点,尤其是蛋黄中富含卵黄免疫球蛋白(immunoglobulin Y, IgY)、卵黄高磷蛋白(phosvitin, PV)、磷脂(phospholipids, PL)等功能活性组分。IgY的结构和功能均与哺乳动物免疫球蛋白(immunoglobulin G, IgG)相似,可通过特异性抗原免疫鸡以产生特异性IgY来对抗多种疾病[1],且在药物、功能性食品和食品保藏等领域均有重要应用[2-3]。PV是蛋黄中主要的磷酸化蛋白,含有30%~50%的磷酸化丝氨酸,具有良好的表面活性[4-5]、抗氧化活性、抗癌活性和抗菌活性,PV因其高附加值而被广泛用于化妆品、营养品、食品和制药工业[6]。PL约占蛋黄油脂总量的33%,主要由80.5%磷脂酰胆碱(phosphatidyl choline, PC)和11.7%磷脂酰肌醇(phosphatidylinositol, PE)组成,被广泛用作营养补充剂,以及食品、药物和化妆品行业中的高效乳化剂和润滑剂[7-9]。
蛋黄是禽蛋中营养丰富的组分,具有高蛋白和高脂质的特点,蛋白和脂质分布在浆质和颗粒中。浆质中含有85%的低密度脂蛋白(low density lipoprotein, LDL)和15%的IgY[4]。颗粒中有70%的高密度脂蛋白(high density lipoprotein, HDL)和16%的PV,它们通过磷钙桥连接。从鲜蛋黄中分离和纯化IgY的主要障碍是存在不溶于水的成分,如脂蛋白[10]。蛋黄中磷脂含量较高,占蛋黄质量的16%,在IgY分离过程中可自发形成双层纳米囊泡[11-12],是IgY纯化步骤的主要障碍之一,为了解决这一问题,可采用水稀释法进行分离[13-14]。目前最常用的方法有卡拉胶[10,15]、辛酸[16]、酸性蒸馏水稀释[17],卡拉胶的去脂效果较好,但对蛋黄颗粒部分的物质提取有影响,不利于蛋黄的综合利用。REN等[18]比较了各种方法对IgY的提取效果,认为酸性条件下的水稀释法是一种绿色环保、极具成本效益的方法。亲和色谱法和离子交换色谱法可获得高纯度、低得率的IgY[19-21]。另外,单一沉淀剂如聚乙二醇[22]和硫酸铵[10,19]已用于进一步纯化IgY。尽管在这些条件下得率很高,IgY的纯度约为80%。经过进一步的研究,硫酸铵和氯化钠共同使用可以使IgY的纯度提高到90%[23]。PV主要以高密度脂蛋白-卵黄高磷蛋白复合物的形式存在于不溶性组分中。己烷、氯仿、乙醚等[24-25]可提取蛋黄中残留的脂质,但有机溶剂残留等问题难以解决,进而限制其应用范围[26]。为了进一步纯化PV,采用NaCl从蛋白混合物中释放PV,后调节pH并加热[27-29]。传统的PL提取方法有很多缺点,超临界二氧化碳萃取法和亚临界丙烷萃取法已广泛应用于去除中性脂质以获得PL,这些方法不仅昂贵、难以大规模生产且产品纯度很低[30-32]。目前的研究多集中在丙酮、石油醚、氯仿等多溶剂萃取体系上,但残留的有毒化学试剂对人体有潜在危害[33]。最近,WANG等[9]发现用乙醇制得的PL纯度和得率均较高。对蛋黄的单一蛋白或脂质组分进行分离纯化普遍存在副产物多、原料利用率低等问题,造成了极大的浪费,而采用绿色高效的方法对蛋黄中多种活性物质进行联合提取可有效避免此类问题并提高蛋制品的附加值。
本文主要研究蛋黄中活性蛋白质和磷脂的提取工艺,拟开发一种使用绿色溶剂联合提取IgY、PV和PL的方法,同时避免使用非食品级溶剂,能够工业化生产,实现蛋黄功能性成分的充分利用。
1. 材料与方法
1.1 材料与仪器
鸡蛋 湖北省武汉市洪山区九峰新跃养鸡场提供;PEG 6000 分析纯,上海默克化学有限公司;正己烷 色谱纯,国药集团化学试剂有限公司;考马斯亮蓝R250、考马斯亮蓝G250 武汉市谷歌生物有限公司;标准IgY、PV、PC、PE 美国Sigma公司;Toyopearl DEAE-650M填料 日本TOSOH公司;所有分离用试剂 均为国产分析纯。
3-30K离心机 德国Sigma公司;Alpha1-4LD冷冻干燥机 德国Marin Christ公司;Waters 2695高效液相色谱仪 美国Waters公司;TSK-GEL G2000SWXLcolume凝胶色谱柱 日本TOSOH公司;Gel DOC 2000凝胶成像系统 美国BIO-RAD公司;Agilent 7890B气相色谱仪、Agilent 5977A质量选择检测器、DB-23毛细管柱 加拿大Agilent公司。
1.2 实验方法
1.2.1 蛋黄生物活性化合物提取、纯化工艺
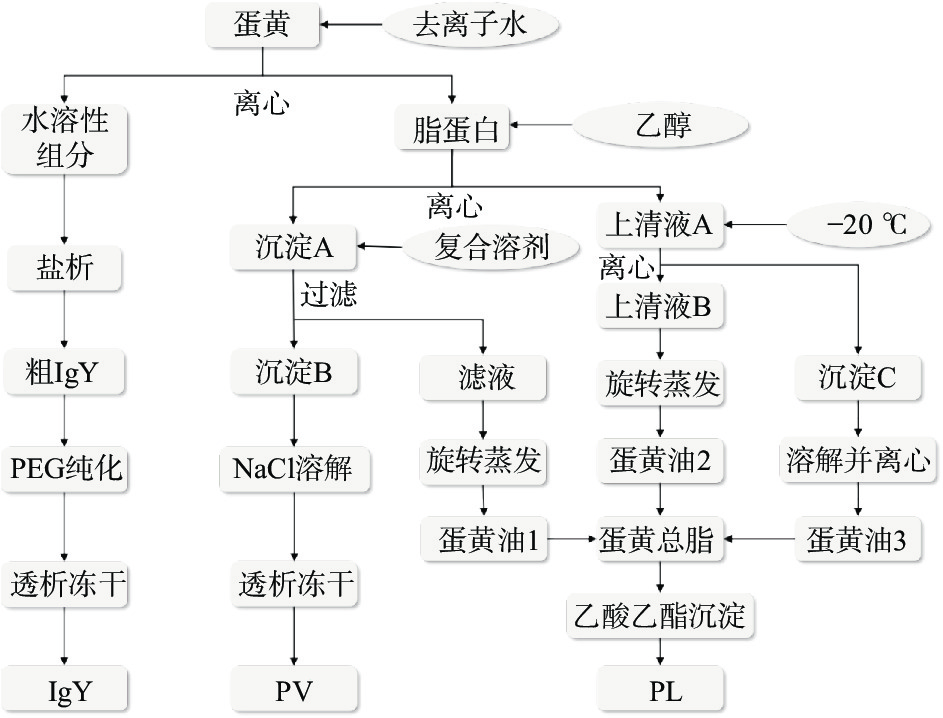
1.2.1.1 工艺流程
先将蛋黄用4 ℃去离子水稀释,离心后得到水溶性组分(water soluble fraction, WSF)和脂蛋白。首先通过盐析从WSF提取IgY,并用PEG 6000进一步纯化。其次,用乙醇从脂蛋白中提取蛋黄油;剩余的沉淀物为PV和一些脂质。用乙醇和乙酸乙酯作为复合溶剂,分离PV和脂类。最后,将所有蛋黄油收集在一起。再加入乙酸乙酯进一步提取PL。提取纯化工艺流程如图1所示。
1.2.1.2 IgY的提取与纯化
分别将蛋黄用6、7、8、9、10、11倍体积的4 ℃去离子水稀释,并用1 mol/L HCl将pH调至5.5,在4 ℃条件下保存过夜,经10000 r/min,4 ℃离心15 min后得到WSF(上清液)和脂蛋白(沉淀)。采用Bradford法测定WSF中蛋白质含量。先向WSF中加入固定浓度(1.0%)的NaCl和不同饱和度(30%、35%、40%、45%、50%)的(NH4)2SO4,优化出最佳饱和度的(NH4)2SO4,后通过最适饱和度(35%)的(NH4)2SO4和不同浓度(0.5%、1.0%、1.5%、2.0%)的NaCl得到最佳的IgY分离条件。在4 ℃下8000 r/min离心15 min后收集沉淀物,用10倍体积的去离子水溶解。通过不同浓度(8%、10%、12%、14%)的PEG 6000再次使悬浮液沉淀,以提高纯度。在4 ℃、8000 r/min离心15 min后,收集沉淀物并用去离子水溶解,放入8~14 kDa透析袋中透析脱盐,后进行冷冻干燥。
1.2.1.3 PV的提取与纯化
将1.2.1.2中的脂蛋白与乙醇以0.8(w/v)的比例均质5 min,并在4 ℃下10000 r/min离心10 min。分别收集沉淀物A和上清液A。将沉淀物A与助溶剂(乙醇:乙酸乙酯= 2:1,v/v)以1:9(w/v)的比例混合,然后在30 ℃条件下磁力搅拌90 min。通过Whatman滤纸过滤混合溶液,得到沉淀物B,所得滤液为残留的蛋黄油。将沉淀物B以1:10(w/v)的比例悬浮在10% NaCl中,将悬浮液分成等分试样。分别将试样调节pH至4.0、5.0、6.0、7.0、8.0、9.0、10.0,在90 ℃下磁力搅拌30 min,优化出最佳pH;后将试样在最适pH 5.0和不同温度(70、75、80、85、90、95 ℃)条件下磁力搅拌30 min,得到最佳的PV分离条件。10000 r/min离心10 min,收集上清液,通过透析脱盐,冷冻干燥后分离出PV。
1.2.1.4 蛋黄油的提取
用乙醇和乙酸乙酯以不同比例(乙醇/乙酸乙酯,v/v=1:0.5、1:1、1:2、1:3、1:4)处理沉淀A,确定复合溶剂(乙醇和乙酸乙酯)的比例后,沉淀A与复合溶剂的添加量在1:6、1:7、1:8、1:9、1:10、1:11(w/v)范围内优化。将混合物在20 °C下磁力搅拌90 min。过滤悬浮液,在45 ℃下旋转蒸发滤液,除去乙醇和乙酸乙酯后得到蛋黄油1。同时,将乙醇提取的馏分上清液A在−20 ℃结晶3 h,然后在4 ℃于4000 r/min离心2 min后分离出上清液B和沉淀C。提取的乙醇馏分(上清液B)包含蛋黄油的主要部分,通过旋转蒸发(40 ℃)除去乙醇,收集蛋黄油2。将剩余蛋白和部分蛋黄油组成的沉淀C转移到30 ℃中水浴10 min,在4 ℃下4000 r/min离心2 min得到蛋黄油3。将多个提取过程得到的油脂收集在一起即为蛋黄总脂,对冷冻干燥的脂质进行进一步分析。
1.2.1.5 PL的提取
将1.2.1.4中获得的总蛋黄油溶解于不同体积(w/v=1:2、1:3、1:4、1:5、1:6、1:7)的乙酸乙酯中,并在不同温度(0、4、−20 ℃)结晶2 h。在4 ℃下4000 r/min离心2 min后收集沉淀物,冷冻干燥。
1.2.2 SDS-PAGE分析
采用周欣[34]的实验方法,通过SDS-PAGE分析所得IgY和PV样品。具体条件为:12%分离胶,4%浓缩胶,pH为8.6的Tris-glycine电极缓冲液。当样品在80 V电压下迁移到浓缩胶和分离胶界面时,调节电压至120 V,直至样品移动至底部。电泳完成后,取出胶,使其在固定液(冰醋酸/乙醇/水,v/v/v=1/5/4)中固定30 min,随后用考马斯亮蓝R-250染色30 min,最后使用脱色液(冰醋酸/乙醇/水,v/v/v=8/25/67)脱色,每小时换一次脱色液,脱色4~5次至凝胶背景颜色褪成无色。
1.2.3 纯度测定
采用美国Waters 2695高效液相色谱仪,用SEC-HPLC法测定PV和IgY的纯度。样品用流动相溶解,使浓度达到1 mg/mL。用TSK-GEL G2000SWXL柱在含有0.2 mol/L NaCl(pH7.0)的0.1 mol/L PBS中于214 nm处检测分析PV的纯度。通过TSK-GEL G3000SWXL柱在含0.05%NaN3、0.1 mol/L Na2SO4(pH6.6)的0.1 mol/L PBS中以0.9 mL/min的速度于280 nm处检测分析IgY的纯度。高效液相色谱中IgY和PV峰面积占总峰面积的百分比即为IgY和PV的纯度。PL纯度测定参见GB/T 5537-2008中钼蓝比色法。
1.2.4 得率和产率的测定
IgY和PV的得率为最终样品冷冻干燥后总质量与原料蛋黄体积之比。蛋黄油产率为最终得到蛋黄油质量与咸蛋黄中理论蛋黄油质量之比。具体计算公式如下:
得率(mg/mL蛋黄)=最终样品冷冻干燥后总质量/原料蛋黄体积
蛋黄油产率(%)=蛋黄油的质量鲜蛋黄的质量×0.34×100 蛋黄总脂中PL的含量(%)=磷脂的质量蛋黄总脂的质量×100 式中:0.34为蛋黄中蛋黄油的理论量[35]。
1.2.5 脂肪酸成分分析
精确称取20 mg油样于10 mL具塞试管,加入4 mL NaOH-MeOH(0.1 mol/L)溶液,通入氮气后密封,涡流振荡15 s后于65 ℃水浴皂化40 min至油滴消失,冷却后加入3 mL BF3-MeOH(14%)溶液,65 ℃加热20 min。流动水冷却,加入2 mL正己烷和2 mL 0.88% NaCl溶液,涡旋15 s,3000 r/min离心5 min。取正己烷(AR)层,加少量无水硫酸钠吸收残余水分,氮气浓缩后用1 mL正己烷复溶,0.22 μm滤膜过滤后进行GC-MS分析。
进样口温度250 ℃,MS检测器温度280 ℃,分流比10:1,进样体积1 μL。升温程序:150 ℃保持0 min,以10 ℃/min升温至230 ℃并保持15 min。离子源温度230 ℃,接口温度250 ℃,溶剂延迟时间2.5 min,开始时间3.0 min,结束时间60.0 min。脂肪酸相对含量的确定采用面积归一化法计算。
1.2.6 薄层色谱分析
蛋黄PL提取物中含有PC、PE和少量脂肪等多种成分,参考刘颖等[36]的方法采用薄层层析法能够有效地鉴定蛋黄PL的成分。展开剂配比为V (氯仿):V (甲醇):V (水)=65:25:4。取硅胶G板活化、密闭冷却、点样、展开,展开10 cm左右,取出吹干,碘蒸气显色。
1.3 数据处理
采用Microsoft Excel 2010分析数据。使用SAS 9.1软件通过单因素方差分析(ANOVA)比较平均值之间的差异。P<0.05时具有统计学意义。
2. 结果与分析
2.1 IgY的提取与纯化
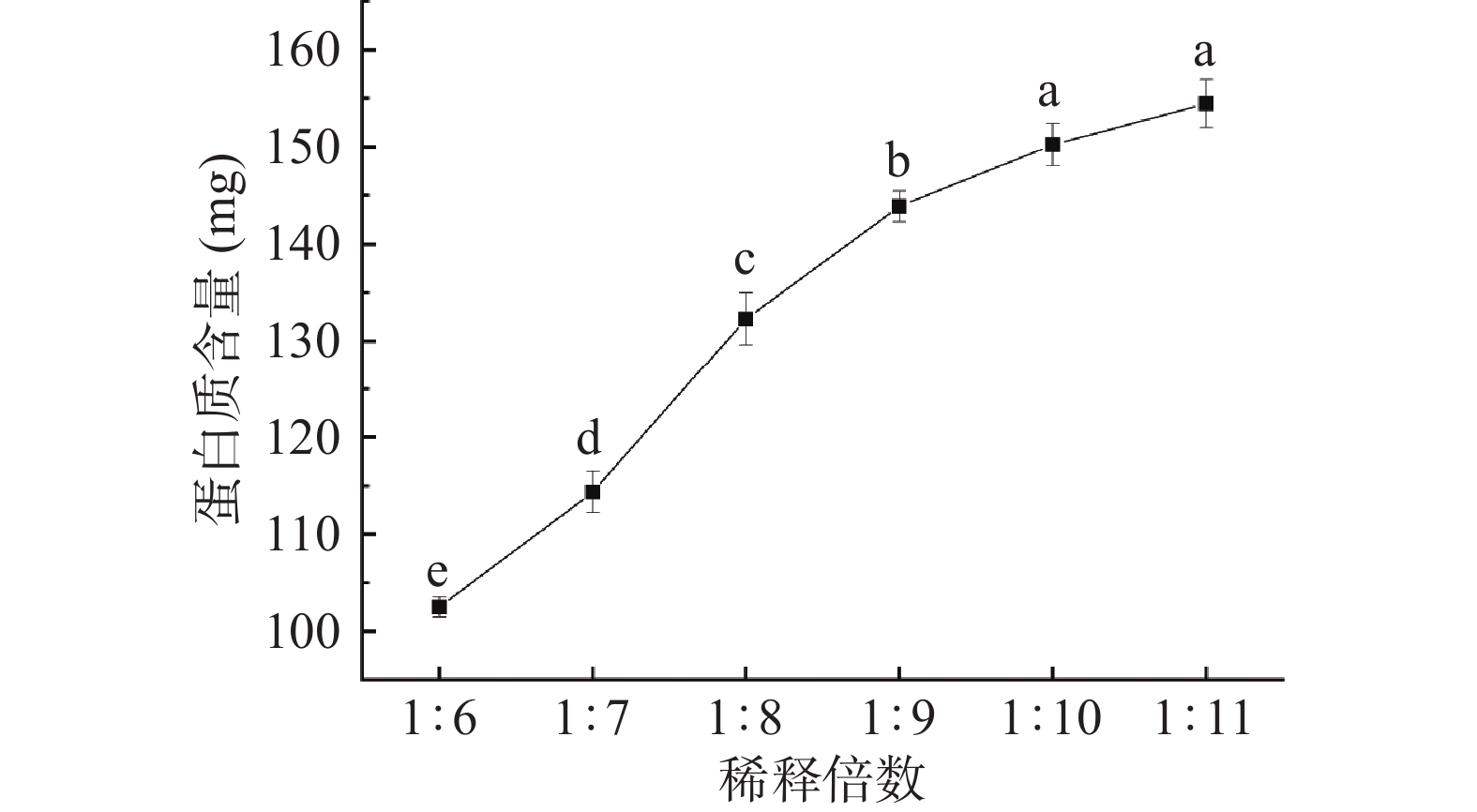
采用水稀释法对IgY进行粗提取。如图2所示,当稀释倍数达到1:10时,蛋白质含量的上升趋势减缓,可能是因为IgY为可溶性蛋白,其表面具有有较多的亲水基团,当其与水接触后会迅速吸水溶解,在稀释倍数为1:10时大多数可溶性蛋白质已被水溶解完全,少数处于蛋黄颗粒部分的蛋白质难以溶解,故蛋白质含量上升减缓。
IgY是一种水溶性蛋白质,常用盐析法从WSF中提取。当单独使用(NH4)2SO4时,上清液中仍有大量IgY[19]。对不同浓度(NH4)2SO4和NaCl组合对IgY粗提效率的影响进行了分析。如图3A所示,当NaCl浓度为1.0%,(NH4)2SO4的浓度由30%增加到50%时,提取过程中IgY的纯度显著下降(P<0.05),而得率则呈相反趋势。图3B显示,1.0% NaCl与固定浓度(35%饱和度)(NH4)2SO4相结合时,IgY的纯度最低。而当NaCl浓度增加至1.0%(w/v)时,IgY的得率最高。之后随着NaCl浓度的增加,IgY的得率缓慢下降。这一现象可能是由于高盐浓度下其他蛋白质的共沉淀作用导致的,这与AKITA等[17]的结果一致。综合考虑纯度和得率,选择35%饱和(NH4)2SO4和0.5% NaCl(w/v)组合从蛋黄中粗提IgY。有研究表明在20%饱和(NH4)2SO4和15% NaCl(w/v)条件下,IgY的纯度和产率分别提高到98.7%和80.9%。NaCl浓度为0.16 mol/L(0.94%)~1.5 mol/L(8.8%)时,浆质蛋白抑制了蛋黄颗粒的分离效果,加入高浓度的NaCl有利于IgY的沉淀[23],而本研究在提取IgY过程中NaCl的使用量大大降低。
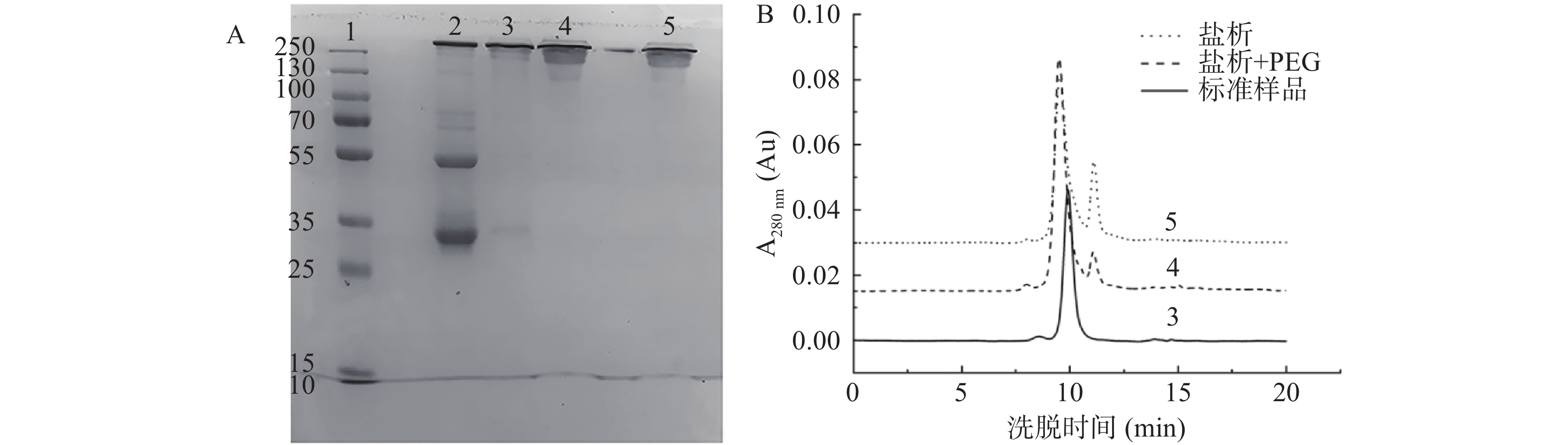
采用PEG 6000(w/v)纯化IgY的结果如图3C所示。当PEG 6000浓度为8%时,IgY的纯度最高,得率最低,纯度和得率分别为97.38%和6.15 mg/mL蛋黄。由图4A可以看出,在用35%(NH4)2SO4和1.0%氯化钠(w/v)沉淀后,泳道3中在33 kDa附近仍然存在大量蛋白质,但用8% PEG 6000(w/v)进一步处理后,泳道4中的杂蛋白明显减少,表明PEG 6000有助于IgY的有效分离。HPLC结果(图4B)显示,盐析后IgY的纯度为87.46%,经过PEG沉淀后纯度提高到97.38%,表明盐析和PEG的组合可有效纯化IgY。
2.2 PV的提取条件选择
沉淀物B中PV主要通过磷钙桥以卵黄高磷蛋白-高密度脂蛋白复合物的形式存在[7]。10% (w/v)NaCl通常用于破坏HDL和PV之间的磷钙桥[28,37]。本文研究了pH对PV提取的影响。结果如表1所示,在pH5.0条件下,分离效果最好(PV纯度为78.63%±0.88%,得率为10.17±0.29 mg/mL),这与REN等[38]的研究结果一致。当pH为5.0时,部分HDL析出,而PV仍存在于上清液中。随着pH逐渐升高,偏离等电点,分子间静电斥力增加,溶解度升高,故上清液中HDL含量增加,使得PV的分离效果下降。
表 1 pH和温度对PV纯度的影响Table 1. Effects of pH and temperature on the purification of PV因素 水平 纯度(%) 得率(mg/mL) pH 4.0 74.86±0.08b 10.70±0.09c 5.0 78.63±0.88a 10.17±0.29d 6.0 67.37±0.40d 11.75±0.13a 7.0 66.44±2.76d 11.90±0.37a 8.0 69.96±0.45c 11.32±0.62b 温度(℃) 70 66.47±4.01c 12.71±0.22a 75 69.36±0.36b 11.92±0.91b 80 78.08±0.16a 10.30±0.06c 85 77.87±1.72a 10.02±0.83c 90 78.72±1.02a 10.14±0.29c 95 78.11±0.09a 9.85±0.46c 注:同列不同小写字母表示同一指标差异显著(P<0.05)。 PV有较好的耐热性,极易溶于水,因此将盐析和加热处理结合可提高其纯度[27,37]。由表1可知,当温度从70 ℃升至80 ℃,PV纯度由66.47%±4.01%显著提高到78.08%±0.16%(P<0.05)。而随着温度由80 ℃升至95 ℃,PV纯度保持稳定,90 ℃时PV的纯度最高。主要是因为随温度升高,部分杂蛋白逐渐变性析出,从而提高了PV纯度。
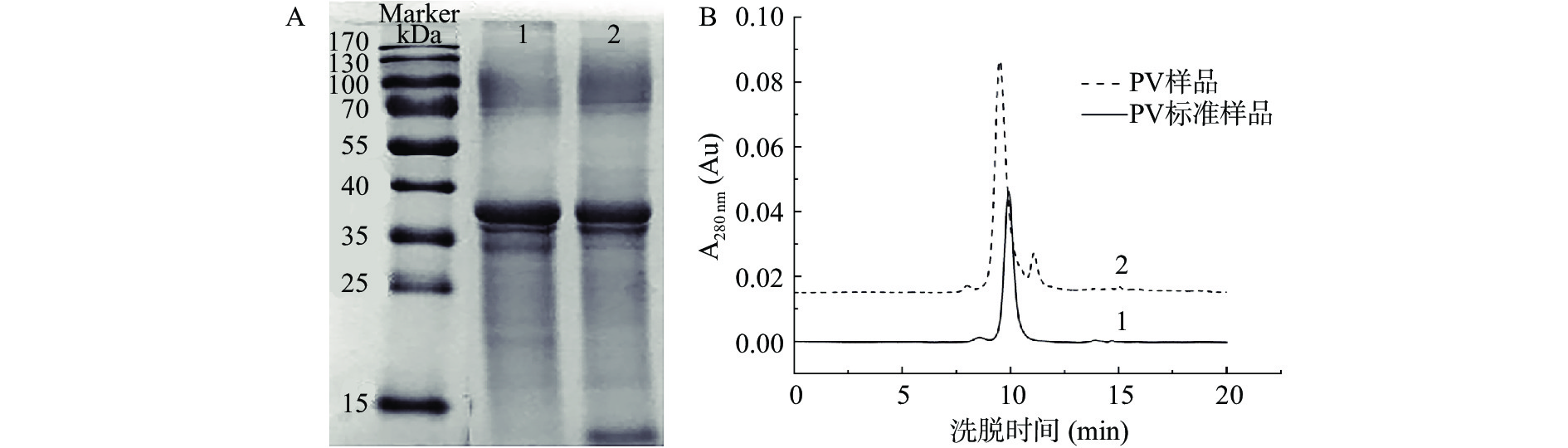
由图5A可以看出,泳道2上的PV样品与泳道1上的PV标准品基本一致,与JIANG等[38]的结果一致。经过HPLC分析(图5B),所得PV的纯度为78.72%,得率为10.14 mg/mL。
2.3 蛋黄油的提取条件选择
鉴于蛋黄油由极性脂质和非极性脂质组成,因此本研究选择极性和非极性溶剂(乙醇/乙酸乙酯)的组合来更好地提取沉淀A中的剩余脂质。图6A表明,乙醇/乙酸乙酯比例为1:2(v/v)时产率最高,主要原因是蛋黄油含有约62%的中性脂质和33%的极性脂质[39]。据相似相溶原理,中性脂质在乙酸乙酯中有较好的溶解性,而PL较易溶于乙醇溶液中,因此当乙醇与乙酸乙酯的比例达到1:2时,恰好与蛋黄油中中性脂质与极性脂质的比例相同,从而使蛋黄油的产率达到最大。如图6B所示,在相同的添加量下,通过乙醇溶剂提取的蛋黄油的产率明显低于复合溶剂。在最佳条件下,本研究中蛋黄油产率最高为88.09%,得率为30.10 mg/mL,高于NIELSEN用乙醇提取所得结果[40],表明新型混合溶剂乙醇/乙酸乙酯具有较高的提取效率。KOVALCUKS等[41]采用溶剂混合物乙醇/氯仿和2-丙醇/己烷进行蛋黄油的提取,得率分别为29.91 mg/mL和27.29 mg/mL。
2.4 PL的提取条件选择
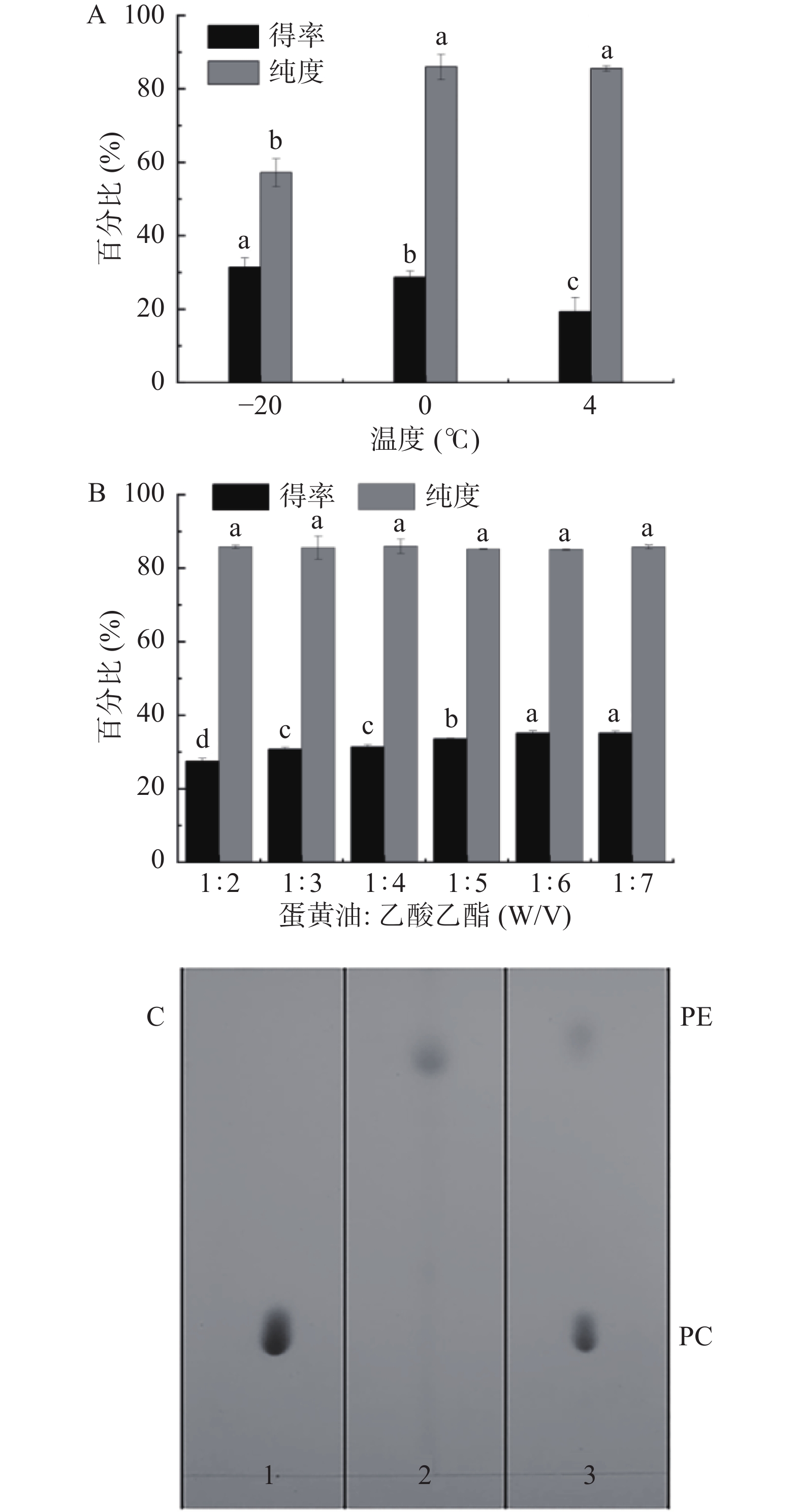
在提取蛋黄油的基础上,进一步采用乙酸乙酯从蛋黄总脂中沉淀出PL。乙酸乙酯是一种非极性溶剂,具有价格低廉、低毒性、易挥发等特点。结果表明,温度对PL提取率的影响较大,如图7A所示,在−20 ℃下蛋黄总脂中PL的含量(the content of PL in lipids, CPLL)为31.43%,可能是因为低温会降低PL的溶解度。而在−20 ℃下PL的纯度为56.4%,远低于4 ℃和0 ℃下的纯度,可能是中性脂质在−20 ℃下共沉淀的结果。综合考虑CPLL和纯度,选择0 ℃条件下沉淀PL。
图7B为乙酸乙酯对CPLL和PL得率的影响。所得PL的纯度(约85.94%)与乙酸乙酯浓度没有显著差异。随着蛋黄油中乙酸乙酯(w/v)比例的增加,CPLL显著增加(P<0.05)。在0 ℃,蛋黄油/乙酸乙酯为1:6(w/v)条件下,PL样品的纯度为85.94%,CPLL为35.18%。WANG等[9]用95%乙醇提取PL,最终纯度为80%,表明乙酸乙酯提取可获得纯度较高的PL。结果表明,用乙酸乙酯提取PL具有较好的效果。PL样品的薄层色谱分析如图7C所示,表明所获得的PL主要由PC和PE组成,且PC占了样本的大部分。
2.5 脂肪酸组成分析
进一步对蛋黄总脂和PL中脂肪酸组成进行气相色谱分析,结果如表2所示。由表2可知,两种样品中都存在8种脂肪酸。蛋黄总脂的脂肪酸组成具有最高的油酸含量(C18:1),其次是相同比例的饱和棕榈油酸(C16:0)。脂肪酸含量由高到低依次为:单不饱和脂肪酸(monounsaturated fatty acid, MUFA)>饱和脂肪酸(saturated fatty acid, SFA)>多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)。PC的脂肪酸含量由高到低依次为:SFA>MUFA>PUFA,饱和脂肪酸含量由12.67%上升到24.41%,而总单不饱和脂肪酸含量明显下降,可能是由于油酸(C18:1)含量的下降。PUFA/SFA比值和n-6/n-3比值都是人体营养膳食的重要诱导因子。已有研究表明,建议膳食中PUFA/SFA的比值大于0.4,n-6/n-3的比值不大于4 [42-43]。表2中的数据表明PL具有合适的PUFA/SFA比值(0.70),蛋黄总脂和PL的n-6/n-3比值分别为12.6和5.37。本方法提取的PL样品含有丰富且平衡的脂肪酸成分,是为人类营养提供平衡膳食的良好添加剂。
表 2 蛋黄总脂和PL的脂肪酸组成Table 2. Fatty acid compositions of total egg yolk lipids and phospholipids脂肪酸 含量(%) 蛋黄总脂 PL C16:0 25.21±0.17 25.86±0.26 C16:1 4.73±0.11 2.46±0.06 C18:0 7.64±0.31 8.82±0.13 C18:1 41.60±0.33 26.80±0.34 C18:2n-6 10.64±0.10 15.51±0.21 C20:4n-6 1.09±0.02 5.07±0.08 C22:5n-3 0.44±0.03 2.31±0.06 C22:6n-3 0.50±0.06 1.52±0.02 SFA 32.85±0.48 34.68±0.41 MUFA 46.33±0.44 29.26±0.40 PUFA 12.67±0.33 24.41±0.37 n-3 0.94±0.09 3.83±0.08 n-6 11.73±0.12 20.58±0.29 PUFA/SFA 0.39±0.02 0.70±0.02 n-6/n-3 12.60±1.33 5.37±0.18 3. 结论
在不使用有毒溶剂的前提下,从新鲜的鸡蛋黄中依次分离出IgY,PV和PL。采用了盐析和PEG结合的新方法从WSF中纯化IgY,以此获得高得率、高纯度的IgY样品;用乙酸乙酯和乙醇作为复合溶剂,同时提取了PV和蛋黄油。在最佳条件下,PV和蛋黄油可以得到更大程度的分离;用冷冻非极性溶剂乙酸乙酯处理蛋黄总脂,得到了大量高纯度的PL,且PL具有良好的PUSA/SFA比值,可作为食品工业添加剂。结果表明,本研究通过绿色高效连续分离技术能够获得纯度、得率较高的IgY、PV和PL组分,该方法便捷、高效,在工业化生产中具有很大的应用潜力。
-
表 1 pH和温度对PV纯度的影响
Table 1 Effects of pH and temperature on the purification of PV
因素 水平 纯度(%) 得率(mg/mL) pH 4.0 74.86±0.08b 10.70±0.09c 5.0 78.63±0.88a 10.17±0.29d 6.0 67.37±0.40d 11.75±0.13a 7.0 66.44±2.76d 11.90±0.37a 8.0 69.96±0.45c 11.32±0.62b 温度(℃) 70 66.47±4.01c 12.71±0.22a 75 69.36±0.36b 11.92±0.91b 80 78.08±0.16a 10.30±0.06c 85 77.87±1.72a 10.02±0.83c 90 78.72±1.02a 10.14±0.29c 95 78.11±0.09a 9.85±0.46c 注:同列不同小写字母表示同一指标差异显著(P<0.05)。 表 2 蛋黄总脂和PL的脂肪酸组成
Table 2 Fatty acid compositions of total egg yolk lipids and phospholipids
脂肪酸 含量(%) 蛋黄总脂 PL C16:0 25.21±0.17 25.86±0.26 C16:1 4.73±0.11 2.46±0.06 C18:0 7.64±0.31 8.82±0.13 C18:1 41.60±0.33 26.80±0.34 C18:2n-6 10.64±0.10 15.51±0.21 C20:4n-6 1.09±0.02 5.07±0.08 C22:5n-3 0.44±0.03 2.31±0.06 C22:6n-3 0.50±0.06 1.52±0.02 SFA 32.85±0.48 34.68±0.41 MUFA 46.33±0.44 29.26±0.40 PUFA 12.67±0.33 24.41±0.37 n-3 0.94±0.09 3.83±0.08 n-6 11.73±0.12 20.58±0.29 PUFA/SFA 0.39±0.02 0.70±0.02 n-6/n-3 12.60±1.33 5.37±0.18 -
[1] WANG L H, LI X Y, JIN L J, et al. Characterization of chicken egg yolk immunoglobulins(IgYs) specific for the most prevalent capsular serotypes of mastitis-causing Staphylococcus aureus[J]. Veterinary Microbiology,2013,84(3-4):264−271. doi: 10.1016/j.vetmic.2010.11.029
[2] OLIVER C, VALENZUELA K, SILVA H, et al. Effectiveness of egg yolk immunoglobulin against the intracellular salmonid pathogen Piscirickettsia salmonis[J]. Journal of Applied Microbiology,2015,119(2):365−376. doi: 10.1111/jam.12857
[3] PEREIRA E P V, TILBURG M F V, FLOREAN E O P T, et al. Egg yolk antibodies(IgY) and their applications in human and veterinary health: A review[J]. International Immunopharmacology,2019,73(3):293−303.
[4] CUI Y, LI X, LU M, et al. Role of polysaccharide conjugation in physicochemical and emulsifying properties of egg phosvitin and the calcium binding capacity of its phosphopeptides[J]. Food & Function,2019,10(4):1808−1815.
[5] DUAN X, ZHOU Y, LI M, et al. Postfertilization changes in conformation of egg yolk phosvitin and biological activities of phosphopeptides[J]. Food Research International,2014,62:1008−1014. doi: 10.1016/j.foodres.2014.05.027
[6] DUFFULER P, GIARRATANO M, NADERI N, et al. High hydrostatic pressure induced extraction and selective transfer of β-phosvitin from the egg yolk granule to plasma fractions[J]. Food Chemistry,2020,321(12):66−74.
[7] GUO D, WAN P, LIU J, et al. Use of egg yolk phospholipids to boost the generation of the key odorants as well as maintain a lower level of acrylamide for vacuum fried French fries[J]. Food Control,2020,121:107592.
[8] HOOGEVEST P V, TIEMESSEN H, METSELAAR J M, et al. The use of phospholipids to make pharmaceutical form line extensions[J]. European Journal of Lipid Science and Technology,2021,123(4):1−38.
[9] WANG H, YAO L, LEE S L, et al. Simultaneous texturization and extraction of phospholipids from liquid egg yolk using renewable solvents[J]. European Journal of Lipid Science & Technology, 2017, 119(2).
[10] TONG C, GENG F, HE Z, et al. A simple method for isolating chicken egg yolk immunoglobulin using effective delipidation solution and ammonium sulfate[J]. Poultry science,2015,94(1):104−110. doi: 10.3382/ps/peu005
[11] KONDRATOWICZ A, NEUNERT G, NIEZGODA N, et al. Egg yolk extracts as potential liposomes shell material: Composition compared with vesicles characteristics[J]. Journal of Food Science,2018,83(10-12):2527−2535.
[12] BERNARDO J, VIDEIRA R A, VALENTAO P, et al. Extraction of phospholipid-rich fractions from egg yolk and development of liposomes entrapping a dietary polyphenol with neuroactive potential[J]. Food and Chemical Toxicology,2019,133:110749−110749. doi: 10.1016/j.fct.2019.110749
[13] 张元来, 张兆旺. 水稀释法与辛酸法提取鸡卵黄抗体的比较[J]. 畜牧兽医杂志,2017,36(1):28−33. [ZHANG Y L, ZHANG Z W. Comparison of water dilution method and caprylic acid method of extracting yolk antibodies[J]. Journal of Animal Science and Veterinary Medicine,2017,36(1):28−33. doi: 10.3969/j.issn.1004-6704.2017.01.008 [14] ZHOU X, WANG Y R, AHN D U, et al. An easy and simple separation method for Fc and Fab fragments from chicken immunoglobulin Y(IgY)[J]. Journal of Chromatography B,2020:1141.
[15] TAN S H, MOHAMEDALI A, KAPUR A, et al. A novel, cost-effective and efficient chicken egg IgY purification procedure[J]. Journal of Immunological Methods,2012,380(1-2):73−76. doi: 10.1016/j.jim.2012.03.003
[16] REDWAN E M, ALJADAWI A A, UVERSKY V N. Simple and efficient protocol for immunoglobulin Y purification from Chicken egg yolk[J]. Poultry Science, 2021, 100(3).
[17] AKITA E M, NAKAI S. Immunoglobulins from egg-yolk-isolation and purification[J]. Journal of Food Science,1992,57:629−634. doi: 10.1111/j.1365-2621.1992.tb08058.x
[18] REN H, YANG W J, THIRUMALAI D, et al. A comparative evaluation of six principal IgY antibody extraction methods[J]. Alternatives to Laboratory Animals,2016,44:11−20. doi: 10.1177/026119291604400111
[19] KO K Y, AHN D U. Preparation of immunoglobulin Y from egg yolk using ammonium sulfate precipitation and ion exchange chromatography[J]. Poultry Science,2007,86(2):400−407. doi: 10.1093/ps/86.2.400
[20] JIANG X, DIRAVIVAM T, ZHANG X. Affinity purification of egg yolk immunoglobulins(IgY) using a human mycoplasma protein[J]. Journal of Chromatography B,2016,1012-1013:37−41. doi: 10.1016/j.jchromb.2016.01.012
[21] BALARAMAN H B, RATHNASAMY S K. High selective purification of IgY from quail egg: Process design and quantification of deep eutectic solvent based ultrasound assisted liquid phase microextraction coupled with preparative chromatography-ScienceDirect[J]. International Journal of Biological Macromolecules,2020,146:253−262. doi: 10.1016/j.ijbiomac.2019.12.242
[22] GE S, YANG Y, CHELLIAPPAN B, et al. Evaluation of different IgY preparation methods and storage stability as potential animal feed supplement[J]. Pakistan Journal of Zoology,2020,52(6):2305−2311.
[23] LEE H Y, ABEVRATHNE E D N S, CHOI I, et al. Sequential separation of immunoglobulin Y and phosvitin from chicken egg yolk without using organic solvents[J]. Poultry science,2014,93:2668−2677. doi: 10.3382/ps.2014-04093
[24] XU C N, YIN Y G, WANG E L, et al. Optimized process of extracting phosvitin from hen egg yolk based on genetic algorithm[J]. Journal of Jilin University(Engineering and Technology Edition),2011,41(3):876−881.
[25] LOSSO J, NAKAI S. A simple procedure for the isolation of phosvitin from chicken egg yolk[J]. Egg Uses and Processing Technologies, 1994, 21(2): 150−157.
[26] CASTELLANIO, MARTINET V, DAVID-BRIAND E, et al. Egg yolk phosvitin: Preparation of metal-free purified protein by fast protein liquid chromatography using aqueous solvents[J]. Journal of Chromatography B,2003,791(1-2):273−284. doi: 10.1016/S1570-0232(03)00230-7
[27] SAMOOEL J, UK A D, KI CHANG N, et al. Separation of phosvitin from egg yolk without using organic solvents[J]. Asian Australasian Journal of Animal Sciences,2013,26(11):1622−1629. doi: 10.5713/ajas.2013.13263
[28] ZHANG X, QIU N, GENG F, et al. Simply and effectively preparing high-purity phosvitin using polyethylene glycol and anion-exchange chromatography[J]. Journal of Separation Science,2011,34(22):3295−3301. doi: 10.1002/jssc.201100601
[29] KO K Y, NAM K C, JO C, et al. A simple and efficient method for preparing partially purified phosvitin from egg yolk using ethanol and salts[J]. Poultry Science,2011,90(5):1096−1104. doi: 10.3382/ps.2010-01138
[30] SPRICK B, LINGHU Z, AMA MCH ARLA J K, et al. Selective extraction of phospholipids from whey protein phospholipid concentrate using supercritical carbon dioxide and ethanol as a co-solvent[J]. Journal of Dairy Science,2019,102(12):10855−10866. doi: 10.3168/jds.2019-16419
[31] LI B, LINGHU Z, HUSSAIN F, et al. 0536 Extraction of phospholipids from procream using supercritical carbon dioxide and ethanol as a modifier[J]. Journal of Animal Science,2016,94(5):256.
[32] LI Y, OBADI M, QI Y, et al. Extraction of oat lipids and phospholipids using subcritical propane and dimethyl ether: Experimental data and modeling[J]. European Journal of Lipid Science and Technology, 2020, 123(1).
[33] BOSELLI E, CABONI M F. Supercritical carbon dioxide extraction of phospholipids from dried egg yolk without organic modifier[J]. Journal of Supercritical Fluids,2000,19(1):45−50. doi: 10.1016/S0896-8446(00)00073-5
[34] 周欣. 鸡卵黄免疫球蛋白Fab片段的制备及其抗炎活性研究[D]. 武汉: 华中农业大学, 2020. ZHOU X. Preparation of Fab fragment of immunoglobulin of egg yolk and its anti-inflammatory activity[D]. Wuhan: Huazhong Agricultural University, 2020.
[35] MINE Y. Egg bioscience and biotechnology[J]. Egg Bioscience and Biotechnology-Research and Markets,2008,3(5):48−55.
[36] 刘颖, 肖静静, 李硕绵, 等. 蛋黄卵磷脂提取方法的研究[J]. 河北农业大学学报,2013,36(6):105−108. [LIU Y, XIAO J J, LI S J, et al. Study on the extraction methods of egg yolk lecithin[J]. Journal of Agricultural University of Hebei,2013,36(6):105−108. [37] REN J, WU J. Thermal-aided phosvitin extraction from egg yolk[J]. Journal of the Science of Food & Agriculture,2015,95:2595−2600.
[38] JIANG B, WANG L, WANG X, et al. Ultrasonic thermal-assisted extraction of phosvitin from egg yolk and evaluation of its properties[J]. Polymers, 2019, 11(8).
[39] NASOPOULOU C, GOGAKI V, PANAGOPOULOU E, et al. Hen egg yolk lipid fractions with antiatherogenic properties[J]. Animal Science Journal,2013,84(3):264−271.
[40] NIELSEN H, SHUKLA V K S. In situ solid phase extraction of lipids from spray-dried egg yolk by ethanol with subsequent removal of triacylglycerols by cold temperature crystallization[J]. LWT - Food Science and Technology,2004,37(6):613−618. doi: 10.1016/j.lwt.2003.12.007
[41] KOVALCUKS A, DUMA M. Solvent extraction of egg oil from liquid egg yolk[C]. Baltic Conference on Food Science & Technology 2014.
[42] BELHAJ K, MANSOURI F, SINDIC M, et al. Effect of rearing season on meat and intramuscular fat quality of beni-guil sheep[J]. Journal of Food Quality,2021,101(7):1−9.
[43] HOWES N L, BEKHIT E, BURRITT D J, et al. Opportunities and implications of pasture-based lamb fattening to enhance the long-chain fatty acid composition in meat[J]. Comprehensive Reviews in Food Science & Food Safety,2015,14(1):22−36.





 下载:
下载:




 下载:
下载:
