Determination of Sex Hormone Residues in Shrimp by EMR Solid Phase Extraction-Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
-
摘要: 本研究建立EMR固相萃取结合超高效液相色谱-串联质谱测定虾肉中15种性激素残留的分析方法。样品采用0.1 mol/L乙二胺四乙酸二钠溶液-乙腈溶液提取,经Captiva EMR固相萃取SPE小柱净化,CAPCELLPAK C18 BB-H(3 µm,2.1 mm×150 mm)色谱柱分离,电喷雾离子源正负离子分开扫描;多反应监测模式的超高效液相色谱-串联质联质谱法进行检测,以空白基质匹配外标法定量。正离子流动相为甲醇和0.1%甲酸,检测雄激素与孕激素;负离子流动相为乙腈和0.01%氨水溶液,检测雌激素。结果表明,经EMR固相萃取净化的虾肉样品中的15种性激素残留在1~50 µg/kg浓度范围内线性关系良好,相关系数(r)均大于0.99,方法检出限为0.0015~0.436 µg/kg,定量限为0.0051~1.453 µg/kg,平均回收率在85.31%~119.84%,相对标准偏差为2.11%~9.86%(n=6)。本方法操作快速简单,重复性好,灵敏度较高,适用于虾肉中15种性激素残留的检测。Abstract: A method for the determination of 15 sex hormones in shrimp meat by EMR solid phase extraction combined with ultra performance liquid chromatography-tandem mass spectrometry was established. The samples was extracted with 0.1 mol/L ethylenediaminetetraacetic acid disodium solution and acetonitrile solution, purified by Captiva EMR SPE cartridge, separated by CAPCELLPAK C18 BB-H (3 µm, 2.1 mm×150 mm) column, and scanned by positive and negative ions of electrospray ion source. Ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS/MS) with multiple reaction monitoring mode was used for detection, and blank matrix matching external standard method was used for quantification. The positive ion mobile phase was methanol and 0.1% formic acid, and androgen and progesterone were detected. The negative ion mobile phase was acetonitrile and 0.01% ammonia aqueous solution to detect estrogen. The results showed that the 15 kinds of sex hormone residues in shrimp meat samples purified by EMR solid phase extraction had a good linear relationship in the concentration range of 1~50 μg/kg, and the correlation coefficients (r) were all greater than 0.99. The detection limits of the method were 0.0015~0.436 μg/kg, and the quantitative limits were 0.0051~1.453 μg/kg. The average recoveries were 85.31%~119.84%, and the relative standard deviations were 2.11%~9.86% (n=6). The method was rapid, simple, reproducible and sensitive, which was suitable for the detection of 15 kinds of sex hormone residues in shrimp meat.
-
近年来由于虾的养殖过程中存在非法过量使用促进生长的性激素等不规范操作,导致虾肉制品中激素残留量超标时有发生[1-4],诸如“激素虾事件”等,因此虾肉的性激素残留量成为社会关注的热点之一[5-9]。性激素主要是由性腺(睾丸和卵巢)、肾上腺皮质及调控器官产生和分泌的促(抑)性的甾体激素[10],具有促生长的作用,因此常被用作促进生长剂以加快动物的生长发育,提高饲料的转化利用率,但性激素由于稳定性强、代谢时间长,蓄积于人们体内会影响正常生理激素平衡,严重者将引发癌症[11-14]。我国在2020年农业农村部250号公告[14]已禁止使用己烯雌酚、甲基睾丸酮、群勃龙等化学合成类激素,并规定这些化合物在食品中不得检出。尽管如此,由于商业利益驱动,这些禁药依然屡禁不止[15]。
虾肉基质复杂、性激素种类繁多,各种类化合物前处理步骤[16-17]不同且复杂,目前检测性激素前处理的方法有液液萃取法[18]、固相萃取法[19]和超临界流体萃取法[20-22]等。固相萃取法操作简单、分离效果好且具有选择性,广泛应用于检测复杂基质的前处理。超高效液相-质谱联用法[23-26]具有高效液相色谱法和串联质谱的优点,进一步提升了灵敏度和分离分析效率,简化前处理步骤,且可在同一时间分析多种化合物等特点,已被广泛应用于动物源产品及水产品的药物残留检验[27-28]。
目前,我国有关水产品的性激素检测的国家检验标准有:《农业部958号公告-10-2007水产品中雌二醇残留量的测定气相色谱-质谱法》[29]、《SN/T 1980-2007进出口动物源性食品中孕激素类药物残留量的检测方法高效液相色谱-质谱/质谱》[30]、《SC/T 3029-2006水产品中甲基睾酮残留量的测定液相色谱》[31]、《农业部1163号公告-9-2009动物性食品中己烯雌酚残留检测气相色谱-质谱法》[32]、《SC/T 3020-2004水产品中己烯雌酚残留量的测定酶联免疫法》[33],均为单一化合物检测。《SN/T 3235-2012出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法》[34]对水产品性激素多组分化合物检测,但此标准对本研究的15种性激素只包括其中2种,因此本研究建立的水产品15种性激素提取方法为首次研究,本研究使用固相萃取法对比两种SPE萃取净化柱,对虾肉样品的前处理进行方法研究,结合超高效液相色谱-串联三重四极杆质谱法分析检测虾肉中的15种性激素检测,为水产品性激素多组分检测研究提供参考。
1. 材料与方法
1.1 材料与仪器
新鲜虾肉 广西沿海地区(包括北海市、钦州市、防城港市)共96批,去掉样品中不可食用部分,取可食用部分,绞碎均质后,−20 ℃冷冻保存,待检测。
15种性激素标准品:雌三醇、雌二醇、炔雌醇、雌酮、炔诺酮、己烯雌酚、左炔诺孕酮、黄体酮、睾丸酮、甲基睾丸酮、群勃龙、醋酸甲羟孕酮、诺龙、丙酸睾酮、苯丙酸诺龙 纯度均大于98.0%,德国Dr.Ehrenstorfer公司;甲醇、乙腈、甲酸 色谱纯,美国Thermo Fisher 公司;乙二胺四乙酸二钠、氨水均 分析纯,国药集团化学试剂有限公司;Oasis PRiME HLB (3 mL 60 mg) 美国Waters公司;Captiva EMR-Lipid(3 mL,300 mg) 美国Agilent公司;实验用水 超纯水。
QTRAP 4500液相色谱串联四极杆质谱联用仪 美国AB公司;Milli-Q Advantage A10超纯水机 德国Millipore公司;PGC753e型电子天平 艾德姆衡器(武汉)有限公司;Multi Reax型全自动振荡器 Heidolph公司;X3R型高速冷冻离心机 Thermo公司;Genius NM32LA型氮气发生器 PEAK公司;ATR Autovap S60型多样品自动浓缩仪 力德生物科技(上海)有限公司。
1.2 实验方法
1.2.1 标准溶液的配制
混合标准储备液:分别精密称取15种激素标准物质10 mg(精确至0.1 mg),各置于50 mL容量瓶,加适量的甲醇溶解,并定容至刻度,摇匀,配制成浓度为200 µg/mL标准储备液。移取标准储备液各5.00 mL,置同一个100 mL容量瓶中,加甲醇定容至刻度,摇匀,制成混合标准中间液(10.0 µg/mL)。
系列标准工作溶液:分别精密量取适量的混合标准储备液,用空白基质提取液稀释,制得到系列标准工作液。
1.2.2 样品处理
提取:称取样品2.5 g(精确到0.01 g)于50 mL离心管中,加入2 mL 0.1 mol/L乙二胺四乙酸二钠溶液,涡旋震荡提取1 min,使样品被打散,再加入8 mL乙腈,涡旋震荡提取5 min,使样品与提取溶剂充分混合后,超声提取5 min,−2 ℃冷冻离心10000 r/min 10 min,取上清液4 mL待净化。
净化:将4 mL上清液转移至Captiva EMR小柱中,在重力作用下自然洗脱流出,再用1 mL 80%乙腈水冲洗柱子,保持3~5秒每滴流出,同时收集全部流出液与洗脱液,于45 ℃氮吹至近干,用30%乙腈水溶液定容至1 mL,放入超声波清洗机中超声提取1 min,0.22 µm微孔滤膜过滤置于进样小瓶中,待测。
1.2.3 仪器条件
1.2.3.1 正离子模式液相色谱条件
色谱柱:CAPCELLPAK C18 BB-H(3 μm,2.1 mm×150 mm)。流动相:A:甲醇,B:0.1%甲酸溶液,梯度洗脱条件见表1。柱温:35 ℃,流速:0.3 mL/min,进样量:20 μL。
表 1 正离子梯度洗脱程序Table 1. Positive ion gradient elution program时间(min) A(%) B(%) 0 10 90 1 10 90 9 90 10 12 90 10 12.1 10 90 19 10 90 1.2.3.2 正离子模式质谱条件
离子源:电喷雾离子源(ESI+);电喷雾电压(IS):4500 V;离子源温度(TEM):550 ℃;气帘气(CUR)流速:30 L/min;雾化气(GS1)流速:55 L/min;辅助加热气(GS2)流速:55 L/min。
1.2.3.3 负离子模式液相色谱条件
色谱柱:CAPCELLPAK C18 BB-H(3 μm,2.1 mm×150 mm)。流动相:A:乙腈,B:0.01%氨水溶液,梯度洗脱条件见表2。柱温:35 ℃,流速:0.4 mL/min,进样量:20 μL。
表 2 负离子梯度洗脱程序Table 2. Negative ion gradient elution program时间(min) A(%) B(%) 0 90 10 2 90 10 6 65 35 9 65 35 11 95 5 13 95 5 13.1 90 10 16 90 10 1.2.3.4 负离子模式质谱条件
离子源:电喷雾离子源(ESI−);电喷雾电压(IS):−4500 V;离子源温度(TEM):550 ℃;气帘气(CUR)流速:35 L/min;雾化气(GS1)流速:50 L/min;辅助加热气(GS2)流速:50 L/min。
15种激素的定性离子、定量离子与碰撞能量见表3。
表 3 15种性激素定性、定量离子和质谱信息Table 3. 15 kinds of qualitative and quantitative ion of sex hormone and mass spectrum information序号 组分名称 扫描模式 母离子(m/z) 子离子(m/z) 1 丙酸睾酮 + 345.2 109.1*,97.1 2 睾丸酮 + 289.2 109.1*,97.2 3 甲基睾丸酮 + 303.1 97.2*,109.1 4 左炔诺孕酮 + 313.2 109.1*,245.2 5 醋酸甲羟孕酮 + 387.3 285.4*,327.3 6 黄体酮 + 315.3 109.1*,97.1 7 炔诺酮 + 299.2 231.4*,109.1 8 苯丙酸诺龙 + 407.2 257.2*,105.2 9 群勃龙 + 271.1 253.2*,199.1 10 诺龙 + 275.2 257.2*,109.1 11 雌二醇 − 271.4 145.2*,183.1 12 雌三醇 − 287.1 171.1*,145.1 13 雌酮 − 269.1 143.1*,145.1 14 己烯雌酚 − 267.1 237.2*,251.2 15 炔雌醇 − 295.2 159.0*,145.0 注:+表示正离子;−表示负离子;*为定量离子。 1.3 数据处理
使用MultiQuant3.0.2分析软件对数据进行定量定性分析。
2. 结果与分析
2.1 质谱离子源参数的选择
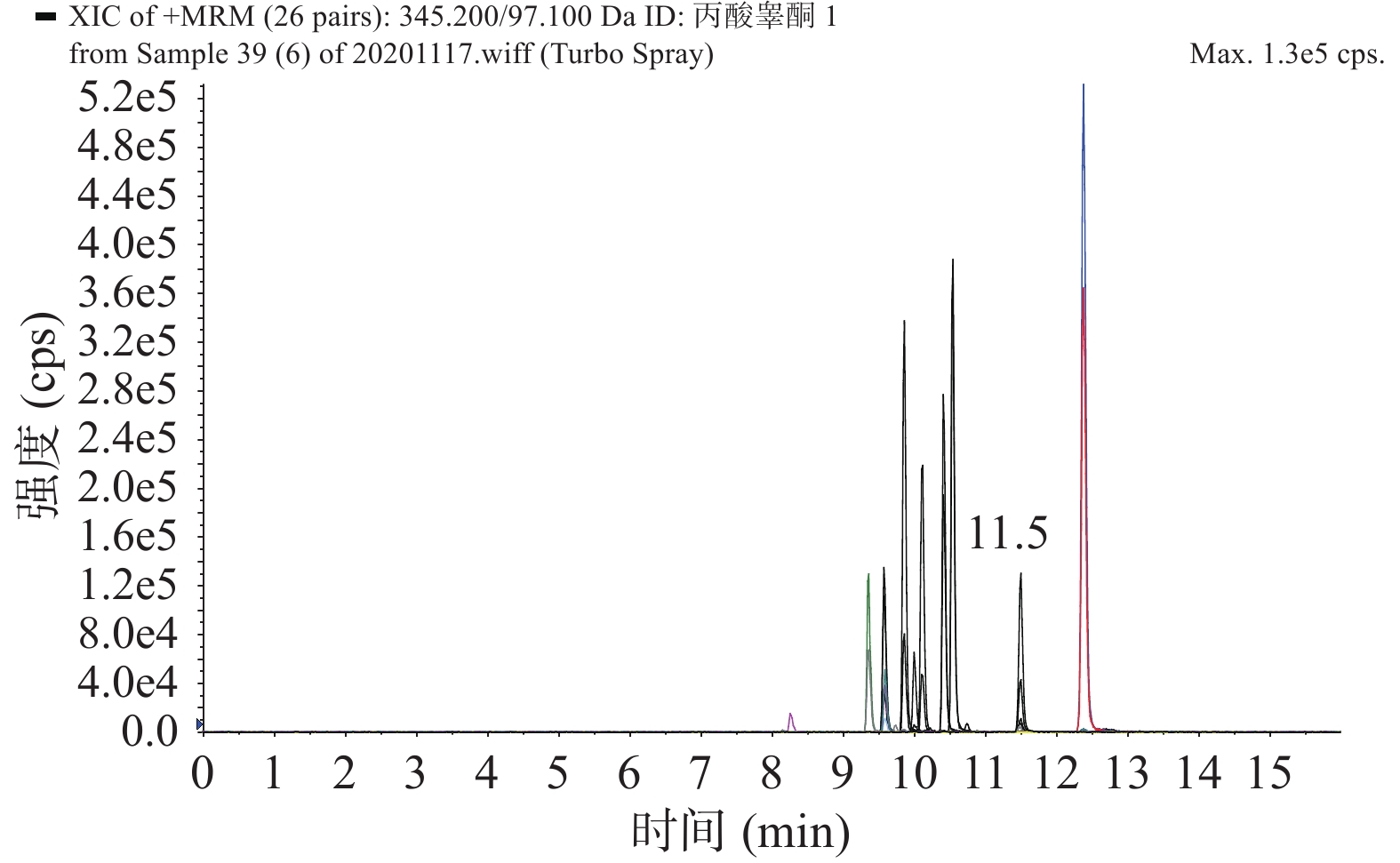
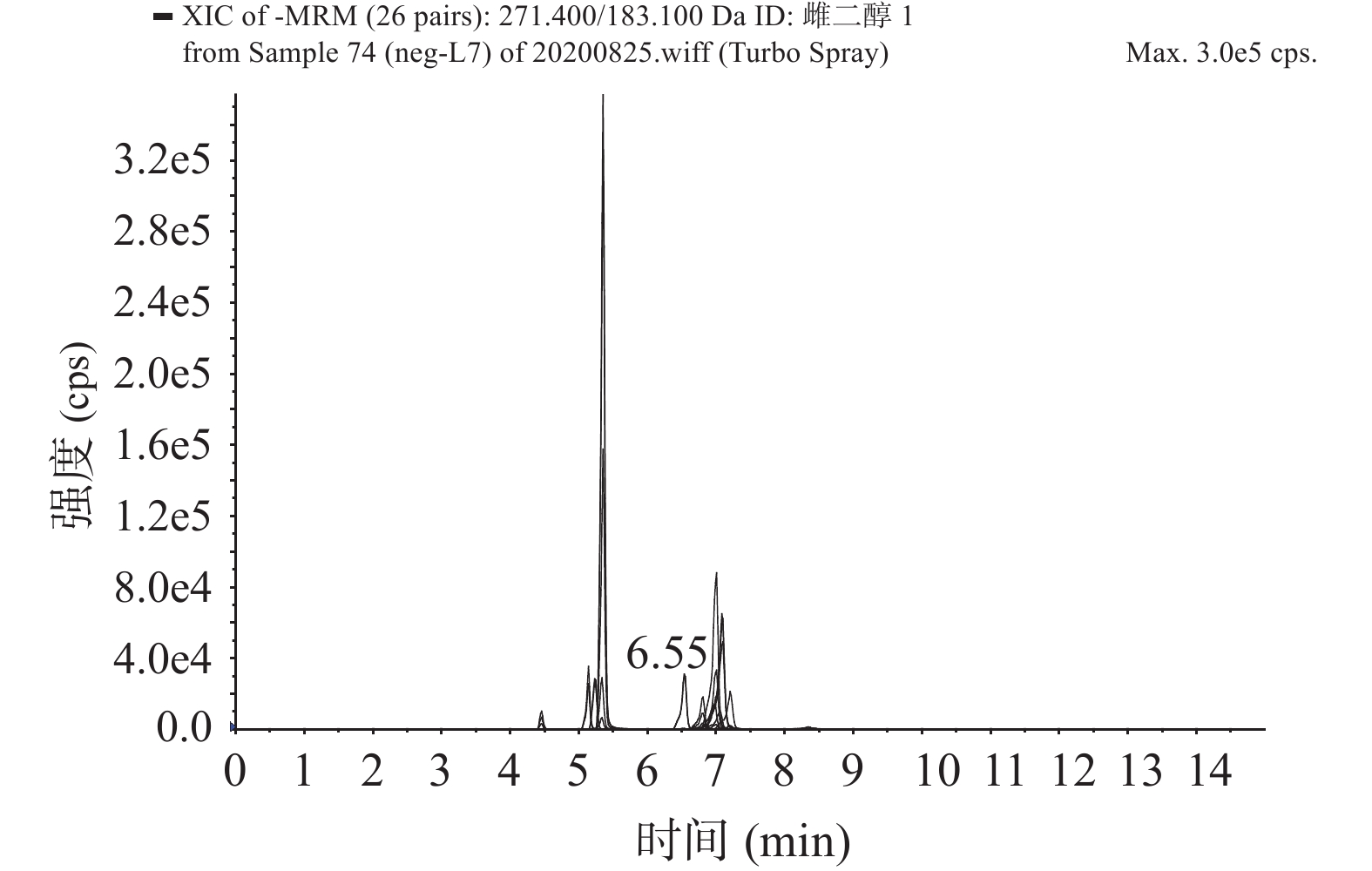
本研究测定目标化合物较多,极性相差大,在质谱中的响应差别也较大,要对化合物进行离子源参数优化,将流动相与标准溶液注射泵链接,同时将流动相与标准溶液注入质谱仪中。发现雌激素在负离子扫描模式下响应更高,而雄激素和孕激素在正离子扫描模式下响应更高。因此在正、负模式分开扫描下,对质谱的电喷雾电压、离子源温度、气帘气流速、碰撞能量等一系列参数进行优化,得到了化合物响应值最大时离子源条件见1.2.3,得到最佳质谱条件见表3。质谱图见图1、图2。
2.2 色谱条件的选择
2.2.1 色谱柱的选择
分别考察CAPCELL PAK C18 MGⅢ-H (3 μm,2.0 mm×100 mm) 、CORTECS®UPLC®HILIC (1.6 μm,2.1 mm×100 mm)、Agilent SB-Aq RRHD (1.8 μm,2.1 mm × 100 mm)、CAPCELLPAK C18 BB-H(3 μm,2.1 mm×150 mm)等4 种不同型号色谱柱对相同浓度的标准溶液扫描分析,考察其保留时间和分离效果。结果发现四根柱子中CAPCELLPAK C18 BB-H(3 μm,2.1 mm×150 mm)测定正离子项目组分保留时间明显缩短,分离度更好,测定负离子项目组分的峰型更好,且可在高pH下使用,因此选用CAPCELLPAK C18 BB-H(3 μm,2.1 mm×150 mm)色谱柱进行虾肉样品性激素的检测。
2.2.2 流动相的选择
在流动相系统选择中,考察了甲醇-水、乙腈-水、乙腈-0.1%甲酸水、乙腈-0.01%氨水(负离子)4组流动相,采用多反应监测模式进行试验,结果显示,正离子模式采用乙腈-0.1%甲酸水作为流动相时分离度和响应值最高,而负离子模式采用乙腈-0.01%氨水作为流动相时分离度和响应值较高。所以采用多反应监测模式分开对正、负离子进行测定,梯度洗脱时,通过改变流动相的比例,使15种性激素均获得有效分离,且峰形良好,灵敏度高,利于分辨。
2.3 样品前处理条件的设计
2.3.1 提取溶剂的选择
本实验考察了乙腈、80%乙腈、0.1 mol/L乙二胺四乙酸二钠-乙腈、0.1 mol/L乙二胺四乙酸二钠-2%甲酸乙腈4组溶剂的提取效果,如图3所示,0.1 mol/L乙二胺四乙酸二钠-乙腈提取溶液的平均回收率为93.29%,高于乙腈提取溶液,且实验中发现虾肉在0.1 mol/L乙二胺四乙酸二钠-乙腈较易散开,从而提高了结果准确性。因此选择0.1 mol/L乙二胺四乙酸二钠-乙腈为提取溶液。
2.3.2 净化条件的选择
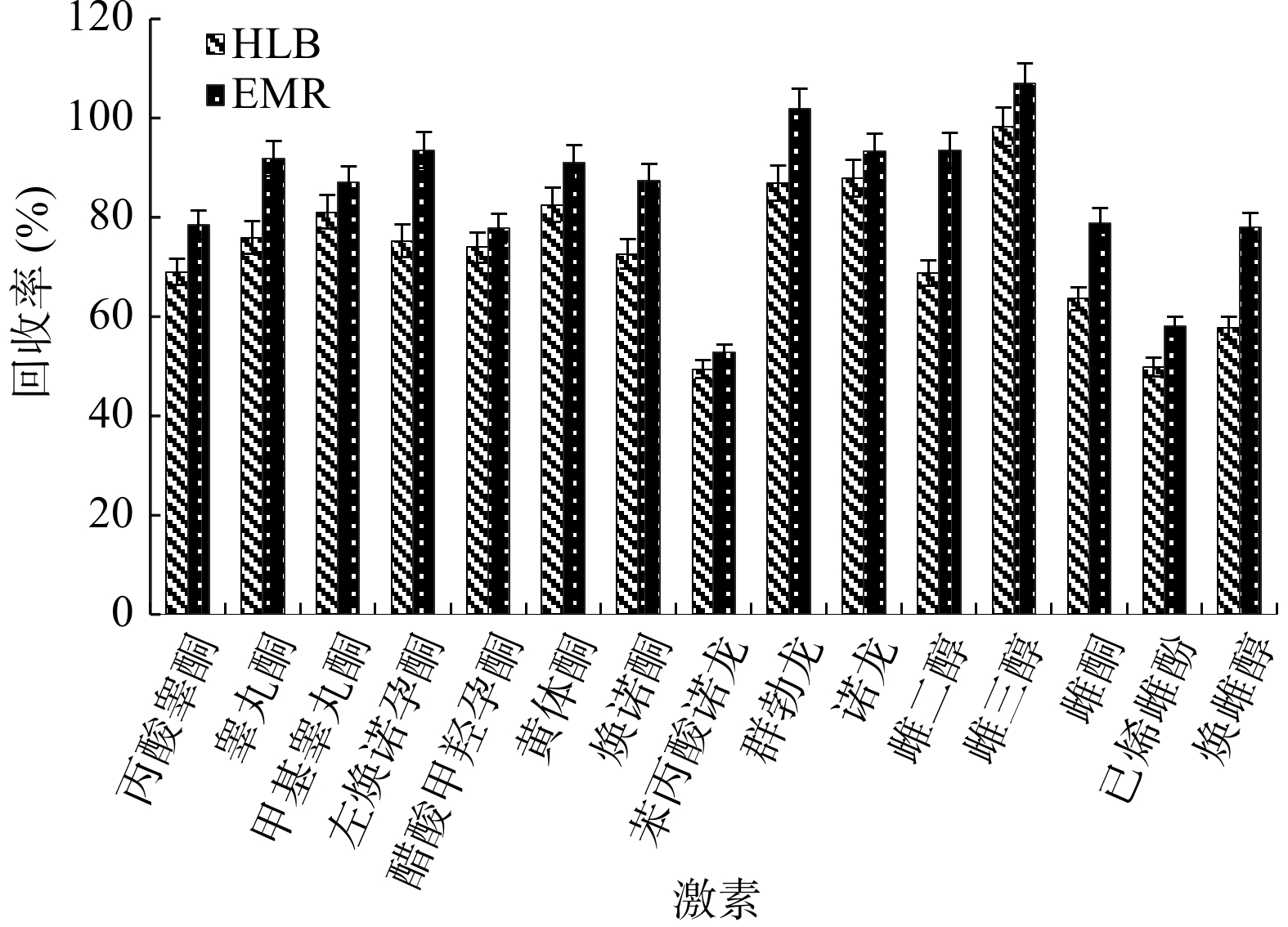
本研究选用Oasis PRiME HLB和Captiva EMR这两种SPE固相萃取小柱进行净化效果的对比,通过对比各类化合物回收率来选择最优的净化条件。PRiME HLB具有特殊设计的填料,蛋白和磷脂基质干扰去除率可达90%以上,因此有效地保护了色谱柱的使用寿命,且样品经提取后可直接过柱,简化了净化过程。Captiva EMR作为一种新型的固相萃取柱,具有高选择性的去除脂质基质,且不会造成分析物损失的特点,因此能最大程度减少目标分析物的基质干扰,具有高效的净化效果。
由图4可以看出,用EMR柱净化的回收率比用HLB柱净化的回收率高,且相对稳定,所以选用EMR作为净化柱进行样品净化。
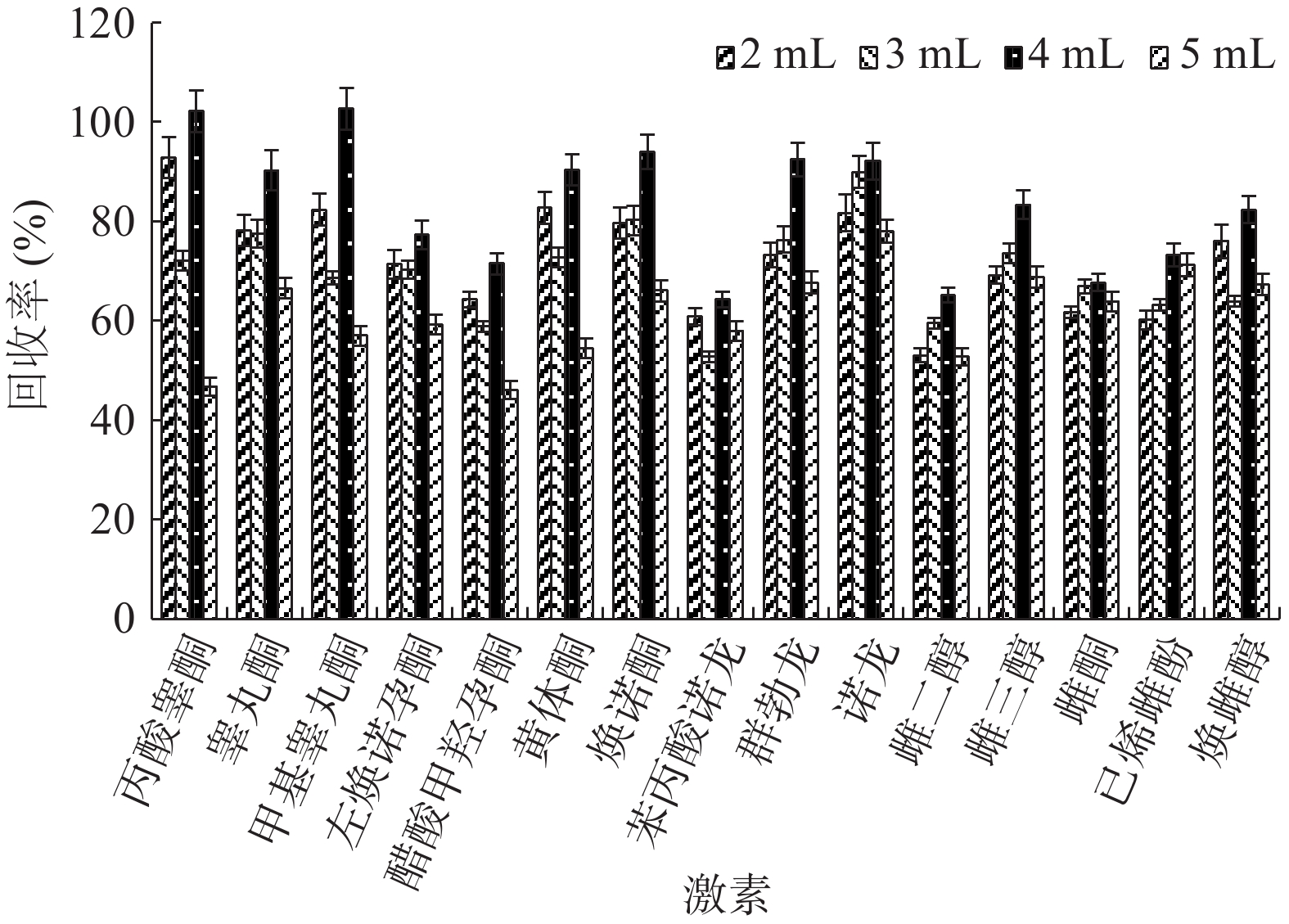
2.3.3 固相小柱上样体积的选择
实验还分别考察了样品离心后的上清液吸取量2、2.5、3、4、5 mL上Captiva EMR过滤柱后回收率的对比,由图5可以看出,上清液取4 mL时的回收率最高。所以选择取上清液4 mL转移至Captiva EMR过滤柱中按1.2.2净化操作。
2.3.4 淋洗溶液的选择
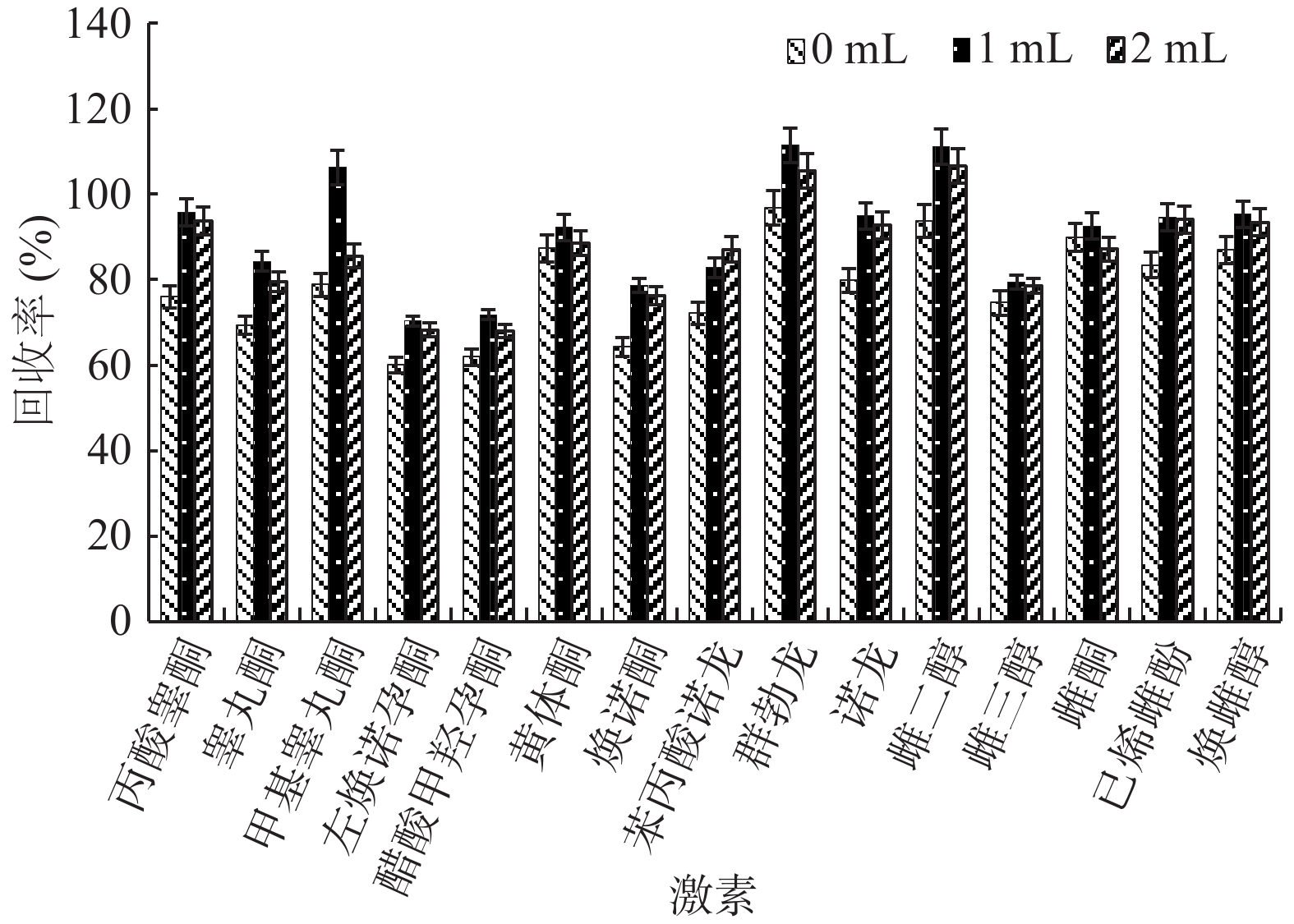
淋洗方式进行了直接收集流出液不进行洗脱、1 mL 80%乙腈水冲洗柱子、2 mL 80%乙腈水冲洗柱子三种方式的对比。
由图6可以看出,洗脱方式为收集全部流出液后,再用80%乙腈水冲洗柱子比直接收集全部流出液的回收率高,其中1 mL比2 mL的洗脱液回收率数据接近,但1 mL洗脱液回收率较高,因此选用的洗脱液体积为1 mL。
2.3.5 定容液的选择
因为定容溶剂可能会使检测中出现溶剂效应,产生溶剂峰、峰展宽、峰分叉,增加噪音响应并降低化合物的灵敏度等现象,所以样品经过提取、净化和氮吹浓缩后,定容溶剂的选择尤为重要。本研究选择用乙腈定容,考察了乙腈浓度为10%、20%、30%、40%、50%时回收率的影响。
由图7可以看出,乙腈浓度为10%、20%、40%、50%时回收率较低,浓度为30%时回收率较高,数据较为平稳,因此选用30%乙腈水为定容浓度。
2.4 基质效应
采用UPLC-MS/MS分析样品时,基质效应是影响定量结果准确性的重要因素。基质效应(ME)是指在样品测定过程中,由于待测物以外其他物质的存在或其他物理、化学因素直接或间接影响离子化效果,从而影响待测物响应的现象。基质效应的计算公式:
化合物 丙酸睾酮 醋酸甲羟孕酮 黄体酮 苯丙酸诺龙 群勃龙 雌二醇 雌三醇 炔雌醇 基质效应
ME(%)4.08 2.29 −1.12 0.87 −7.18 −23.19 −30.68 −25.83 由表4可以看出,正离子模式下的化合物表现为弱基质效应,负离子模式下的化合物表现为中等基质效应。其中除丙酸睾酮、醋酸甲羟孕酮、苯丙酸诺龙表现为基质增加效应外,其余均表现为基质抑制效应。因此,本实验采用基质匹配的方法,消除基质效应的影响。
2.5 方法学验证
2.5.1 标准曲线、检出限和定量限
由于样品基质复杂,存在基质效应,本实验采用空白基质溶液稀释标准溶液,可以消除基质干扰。以目标化合物定量离子的峰面积为纵坐标,质量浓度为横坐标绘制标准曲线。称取2.5 g虾肉样品空白基质,分别加入混合标准溶液按1.2.2方法处理样品,制得质量浓度分别为1、2、5、10、20、30、50 μg/kg的基质混合标准曲线。以3倍信噪比(S/N=3)对应的空白样品添加质量浓度作为检出限(limit of detection, LOD),10倍信噪比(S/N=10)为定量限(limit of quantitation,LOQ)。15种性激素的线性方程、线性范围、相关系数见表5。
表 5 15种性激素的线性方程、线性范围和相关系数Table 5. Linear equation, linear range and correlation coefficient of 15 sex hormones化合物 线性回归方程 线性范围(μg/kg) 线性相关系数r LOD LOQ 丙酸睾酮 y=4014.88373x+1373.57225 1~50 0.99851 0.089 0.298 睾丸酮 y=15206.45462x+231.03431 1~50 0.99869 0.017 0.056 甲基睾丸酮 y=8347.72239x+21936.27137 1~50 0.99532 0.023 0.077 左炔诺孕酮 y=3176.75098x+717.19989 1~50 0.99971 0.224 0.748 醋酸甲羟孕酮 y=12677.48294x+2468.16680 1~50 0.99910 0.436 1.453 黄体酮 y=16046.47473x+2311.21787 1~50 0.99835 0.0059 0.0198 炔诺酮 y=6471.25207x+902.55291 1~50 0.99827 0.037 0.123 苯丙酸诺龙 y=11114.66551x+2815.75167 1~50 0.99927 0.0127 0.042 群勃龙 y=5439.21227x+1481.62853 1~50 0.99544 0.103 0.342 诺龙 y=1910.93057x+7411.76972 1~50 0.99263 0.081 0.272 雌二醇 y=0.02377x+0.02912 1~50 0.99863 0.0058 0.019 雌三醇 y=2.44525x+3.62599 1~50 0.99203 0.0041 0.0138 雌酮 y=0.03511x+0.03629 1~50 0.99987 0.0015 0.0051 己烯雌酚 y=0.03112x+0.02953 1~50 0.99943 0.0018 0.0061 炔雌醇 y=0.00240x+-0.00357 1~50 0.99827 0.055 0.184 本实验在线性范围内,相关系数r均大于0.99,线性良好,检出限范围0.0015~0.436 µg/kg, 定量限范围是0.0051~1.453 µg/kg。
2.5.2 方法回收率和精密度
为评价分析方法的准确性和可靠性,考察了虾肉样品的空白基质在2、4、40 μg/kg加标浓度下15种药物的回收率,每个加标浓度平行测试6次,外标法定量,计算平均回收率与精密度。结果表明,15种药物的平均加标回收率为85.31%~119.84%,相对标准偏差为2.11%~9.86%,见表6。
表 6 15种性激素的平均加标回收率和相对标准偏差(n=6)Table 6. Average spiked recovery and relative standard deviation of 15 sex hormones化合物 加入量 2 μg/kg 加入量4 μg/kg 加入量40 μg/kg 回收率(%) RSD(%) 回收率(%) RSD(%) 回收率(%) RSD(%) 丙酸睾酮 114.83 3.69 119.84 4.29 114.89 8.78 睾丸酮 115.50 4.01 119.59 6.84 105.55 9.27 甲基睾丸酮 118.39 7.34 118.54 6.74 95.41 7.51 左炔诺孕酮 100.29 9.86 105.96 7.12 93.83 9.13 醋酸甲羟孕酮 87.77 7.02 97.80 5.03 94.32 8.23 黄体酮 103.16 5.71 103.80 8.18 96.96 6.47 炔诺酮 94.76 9.11 105.17 6.24 101.71 6.24 苯丙酸诺龙 95.14 6.16 93.36 7.44 95.31 4.74 群勃龙 117.05 6.97 103.78 5.71 92.01 9.13 诺龙 108.31 8.71 106.73 7.10 106.75 6.24 雌二醇 112.50 2.13 111.66 3.60 101.29 3.40 雌三醇 108.51 8.03 111.19 3.57 99.83 4.20 雌酮 96.57 3.75 98.64 2.11 96.14 8.62 己烯雌酚 95.91 8.10 97.20 4.45 96.38 3.05 炔雌醇 85.31 7.43 101.62 7.01 104.42 4.35 3. 结论
本研究建立EMR固相萃取高效液相色谱-串联质谱法测定虾肉中15种性激素的检测方法。通过设计前处理方法的提取溶剂的选择、净化条件的选择:对比了Oasis PRiME HLB和Captiva EMR的净化效果、淋洗溶液的选择、定容液的选择、如何更好消除基质效应等。结果显示,1 mol/L乙二胺四乙酸二钠-乙腈是最合适的提取试剂,Captiva EMR柱的净化效果最佳,取4 mL上清液过柱后,1 mL 80%乙腈淋洗,30%乙腈定容的提取方法在1~50 µg/mL浓度范围内线性关系良好,相关系数(r)均大于0.99,方法检出限为0.0015~0.436 µg/kg,定量限为0.0051~1.453 µg/kg,平均回收率在85.31%~119.84%,相对标准偏差为2.11%~9.86%(n=6)。本方法简单快速,为食品检测机构检测应对大批量虾肉中多组分性激素检测提供了技术参考。
-
表 1 正离子梯度洗脱程序
Table 1 Positive ion gradient elution program
时间(min) A(%) B(%) 0 10 90 1 10 90 9 90 10 12 90 10 12.1 10 90 19 10 90 表 2 负离子梯度洗脱程序
Table 2 Negative ion gradient elution program
时间(min) A(%) B(%) 0 90 10 2 90 10 6 65 35 9 65 35 11 95 5 13 95 5 13.1 90 10 16 90 10 表 3 15种性激素定性、定量离子和质谱信息
Table 3 15 kinds of qualitative and quantitative ion of sex hormone and mass spectrum information
序号 组分名称 扫描模式 母离子(m/z) 子离子(m/z) 1 丙酸睾酮 + 345.2 109.1*,97.1 2 睾丸酮 + 289.2 109.1*,97.2 3 甲基睾丸酮 + 303.1 97.2*,109.1 4 左炔诺孕酮 + 313.2 109.1*,245.2 5 醋酸甲羟孕酮 + 387.3 285.4*,327.3 6 黄体酮 + 315.3 109.1*,97.1 7 炔诺酮 + 299.2 231.4*,109.1 8 苯丙酸诺龙 + 407.2 257.2*,105.2 9 群勃龙 + 271.1 253.2*,199.1 10 诺龙 + 275.2 257.2*,109.1 11 雌二醇 − 271.4 145.2*,183.1 12 雌三醇 − 287.1 171.1*,145.1 13 雌酮 − 269.1 143.1*,145.1 14 己烯雌酚 − 267.1 237.2*,251.2 15 炔雌醇 − 295.2 159.0*,145.0 注:+表示正离子;−表示负离子;*为定量离子。 表 4 部分性激素的基质效应
Table 4 Part of the matrix effect of sex hormones
化合物 丙酸睾酮 醋酸甲羟孕酮 黄体酮 苯丙酸诺龙 群勃龙 雌二醇 雌三醇 炔雌醇 基质效应
ME(%)4.08 2.29 −1.12 0.87 −7.18 −23.19 −30.68 −25.83 表 5 15种性激素的线性方程、线性范围和相关系数
Table 5 Linear equation, linear range and correlation coefficient of 15 sex hormones
化合物 线性回归方程 线性范围(μg/kg) 线性相关系数r LOD LOQ 丙酸睾酮 y=4014.88373x+1373.57225 1~50 0.99851 0.089 0.298 睾丸酮 y=15206.45462x+231.03431 1~50 0.99869 0.017 0.056 甲基睾丸酮 y=8347.72239x+21936.27137 1~50 0.99532 0.023 0.077 左炔诺孕酮 y=3176.75098x+717.19989 1~50 0.99971 0.224 0.748 醋酸甲羟孕酮 y=12677.48294x+2468.16680 1~50 0.99910 0.436 1.453 黄体酮 y=16046.47473x+2311.21787 1~50 0.99835 0.0059 0.0198 炔诺酮 y=6471.25207x+902.55291 1~50 0.99827 0.037 0.123 苯丙酸诺龙 y=11114.66551x+2815.75167 1~50 0.99927 0.0127 0.042 群勃龙 y=5439.21227x+1481.62853 1~50 0.99544 0.103 0.342 诺龙 y=1910.93057x+7411.76972 1~50 0.99263 0.081 0.272 雌二醇 y=0.02377x+0.02912 1~50 0.99863 0.0058 0.019 雌三醇 y=2.44525x+3.62599 1~50 0.99203 0.0041 0.0138 雌酮 y=0.03511x+0.03629 1~50 0.99987 0.0015 0.0051 己烯雌酚 y=0.03112x+0.02953 1~50 0.99943 0.0018 0.0061 炔雌醇 y=0.00240x+-0.00357 1~50 0.99827 0.055 0.184 表 6 15种性激素的平均加标回收率和相对标准偏差(n=6)
Table 6 Average spiked recovery and relative standard deviation of 15 sex hormones
化合物 加入量 2 μg/kg 加入量4 μg/kg 加入量40 μg/kg 回收率(%) RSD(%) 回收率(%) RSD(%) 回收率(%) RSD(%) 丙酸睾酮 114.83 3.69 119.84 4.29 114.89 8.78 睾丸酮 115.50 4.01 119.59 6.84 105.55 9.27 甲基睾丸酮 118.39 7.34 118.54 6.74 95.41 7.51 左炔诺孕酮 100.29 9.86 105.96 7.12 93.83 9.13 醋酸甲羟孕酮 87.77 7.02 97.80 5.03 94.32 8.23 黄体酮 103.16 5.71 103.80 8.18 96.96 6.47 炔诺酮 94.76 9.11 105.17 6.24 101.71 6.24 苯丙酸诺龙 95.14 6.16 93.36 7.44 95.31 4.74 群勃龙 117.05 6.97 103.78 5.71 92.01 9.13 诺龙 108.31 8.71 106.73 7.10 106.75 6.24 雌二醇 112.50 2.13 111.66 3.60 101.29 3.40 雌三醇 108.51 8.03 111.19 3.57 99.83 4.20 雌酮 96.57 3.75 98.64 2.11 96.14 8.62 己烯雌酚 95.91 8.10 97.20 4.45 96.38 3.05 炔雌醇 85.31 7.43 101.62 7.01 104.42 4.35 -
[1] 龚文杰, 龚世园, 储张杰, 等. 外源激素戊酸雌二醇对黄鳝生长的影响[J]. 湖北农业科学,2009,48(4):937−939. [GONG W J, GONG S Y, CHU Z J, et al. Effects of exogenous hormone estradiol valerate on growth of Monopterus albus[J]. Hubei Agricultural Sciences,2009,48(4):937−939. doi: 10.3969/j.issn.0439-8114.2009.04.050 [2] 田海伟, 冯浩彬, 李晋, 等. QuEChERS-高效液相色谱-串联质谱法快速测定牛奶中18种糖皮质激素类药物残留[J]. 食品科学,2017,38(12):310−314. [TIAN H W, FENG H B, LI J, et al. Determination of glucocorticoid residues in milk by high performance liquid chromatography-tandem mass spectrometry[J]. Food Science,2017,38(12):310−314. doi: 10.7506/spkx1002-6630-201712048 [3] 李诗言, 王扬, 周凡, 等. 新型QuEChERS方法结合高效液相色谱串联四极杆飞行时间质谱法快速测定鱼肉中14种激素[J]. 中国渔业质量与标准,2016,6(5):52−58. [LI S Y, WANG Y, ZHOU F, et al. Rapid determination of 14 hormones in fish by high performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry[J]. Chinese Journal of Fishery Quality and Standards,2016,6(5):52−58. [4] 谭芳, 黄璐, 郑琦. 超声萃取-高效液相色谱法同时测定奶粉中4 种雌激素类残留[J]. 食品科学,2014,35(12):156−159. [TAN F, HUANG L, ZHENG Q. Simultaneous determination of estrogens in milk powder by ultrasonic extraction and high performance liquid chromatography[J]. Food Science,2014,35(12):156−159. doi: 10.7506/spkx1002-6630-201412031 [5] 徐连伟. 水产品中药物残留及检测方法分析[J]. 科学与财富,2020(8):82. [XU L W. Analysis of drug residues and detection methods in aquatic products[J]. Science and Wealth,2020(8):82. [6] 关歆. 水产品中药物残留的控制对策[J]. 中国水产,2018(9):49−51. [GUAN X. The control countermeasures of drug residues in aquatic products[J]. Journal of Aquaculture in China,2018(9):49−51. [7] 张蕾, 高璐. 我国水产品安全的法制现状及完善[J]. 山西省政法管理干部学院学报,2017,30(2):20−23. [ZHANG L, GAO L. Current situation and improvement of legal system of aquatic product safety in China[J]. Journal of Shanxi Political and Legal Management Cadre Institute,2017,30(2):20−23. doi: 10.3969/j.issn.1672-1500.2017.02.006 [8] AVAR P, MAASZ G, P TAKÁCS, et al. HPLC-MS/MS analysis of steroid hormones in environmental water samples[J]. Drug Testing and Analysis,2016,8(1):124−128.
[9] BRABANDER BRABANDER H F D, BIZEC B L, PINEL G, et al. Past, present and future of mass spectrometry in the analysis of residues of banned substances in meat-producing animals[J]. Journal of Mass Spectrometry,2007,42(8):983−998. doi: 10.1002/jms.1272
[10] 罗辉泰, 黄晓兰, 吴惠勤, 等. QuECHERS/液相色谱串联质谱法同时测定鱼肉中30 种激素类及氯霉素类药物残留[J]. 分析测试学报,2012,30(12):1329−1337. [LUO H T, HUANG X L, WU H Q, et al. Simultaneous determination of 30 hormone and chloramphenicol residues in fish by QuEChERS/liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Measurement,2012,30(12):1329−1337. [11] 杨佳艺, 李洪. 动物源食品中性激素残留及其检测方法概述[J]. 食品工业科技,2012,33(2):423−426,429. [YANG J Y, LI H. Overview of sex hormone residue in animal origin food and its detection method[J]. Science and Technology of Food Industry,2012,33(2):423−426,429. [12] NACHMAN K E, SMITH T J S. Hormone use in food animal production: Assessing potential dietary exposures and breast cancerrisk[J]. Current Environmental Health Rptorts,2015,2(1):1−14. doi: 10.1007/s40572-014-0042-8
[13] TAN X T, LI Z M, DENG L G, et al. Analysis of 13 kinds of steroid hormones in raw milk using modified QuEChERS method combined with UPLC-QTOF-MS[J]. Journal of Integrative Agriculture,2016,15(9):2163−2174. doi: 10.1016/j.jchromb.2017.06.008
[14] 农业农村部. 食品动物中禁止使用的药物及其他化合物清单 中华人民共和国农业农村部公告第250号公告[EB/OL]. (2019-12-27)[2020-01-06]. http://www.moa.gov.cn/nybgb/2020/202002/202004/t20200414_6341556.htm Ministry of Agriculture and Rural Affairs. List of drugs and other compounds prohibited from use in food animals. Announcement No. 250 of the Ministry of Agriculture and Rural Affairs, PRC. (2019-12-27)[2020-01-06]. http://www.moa.gov.cn/nybgb/2020/202002/202004/t20200414_6341556.htm
[15] 韩诗宁. 雌激素污染物在水产品中的富集及生物降解研究[D]. 长春: 吉林农业大学, 2020. HAN S N. Study on the enrichment and biodegradation of estrogens in aquatic products [D]. Changchun: Jilin Agricultural University, 2020.
[16] 孙俐. 酶联免疫法测定动物源性食品中二苯乙烯类激素残留量[J]. 食品研究与开发,2008(6):93−97. [SUN L. Determination of residues of stilbene hormones in food of animal origin by enzyme-linked immunoassay[J]. Food Research and Development,2008(6):93−97. doi: 10.3969/j.issn.1005-6521.2008.06.026 [17] 蔡爱君, 李雪. 液质联用与气质联用测定水产品中雌二醇残留的效果对比研究[J]. 现代食品,2017(23):96−98. [CAI A J, LI X. Comparative study on the effect of liquid mass spectrometry and mass spectrometry for the determination of estradiol residues in aquatic products[J]. Modern Food,2017(23):96−98. [18] 鹿倩, 杨莉, 王峥涛. 血液中类固醇激素分析方法的研究进展[J]. 中草药,2018,49(15):3710−3720. [LU Q, YANG L, WANG Z T. Research progress of methods for the analysis of steroid hormones in blood[J]. Chinese Journal of Herbal Medicine,2018,49(15):3710−3720. doi: 10.7501/j.issn.0253-2670.2017.18.034 [19] ZHANG Aizhi, WANG Quanlin, SHEN Jian, et al. Simultaneous determination of sex hormones in egg products by ZnCl2 depositing lipid, solid-phase extraction and ultra performance liquid chromatography/electrospray ionization tandem mass spectrometry[J]. Analytica Chimica Acta,2010,678(1):108−116. doi: 10.1016/j.aca.2010.08.014
[20] 李首昌. 固相萃取在食品农药残留检测应用探讨[J]. 现代化农业,2020(3):33−35. [LI S C. Application of solid phase extraction in determination of pesticide residues in food[J]. Modern Agriculture,2020(3):33−35. doi: 10.3969/j.issn.1001-0254.2020.03.018 [21] 李崇豪, 李诗言, 陈康, 等. 新型固相萃取填料及其在水产品质量安全检测中的应用[J]. 食品安全质量检测学报, 2018, 9(18): 4870−4876. LI C H, LI S Y, CHEN K, et al. Journal of Food Safety and Quality Inspection, 2018, 9(18): 4870−4876.
[22] 刘杨. 固相萃取技术在食品检测前处理中的应用进展[J]. 食品安全导刊,2019(28):68−69. [LIU Y. Application progress of solid phase extraction technology in food detection pre-treatment[J]. Food Safety Guide,2019(28):68−69. [23] 杨帆, 莫文电, 段玉林, 等. 超高效液相色谱-串联质谱法测定水产品及其制品中3种抗生素和14种性激素残留量[J]. 食品安全质量检测学报,2019,10(8):2247−2257. [YANG F, MO W D, DUAN Y L, et al. Determination of residues of 3 antibiotics and 14 sex hormones in aquatic products by ultra-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Food Safety and Quality Inspection,2019,10(8):2247−2257. doi: 10.3969/j.issn.2095-0381.2019.08.025 [24] 陈秋华, 张天闻, 傅红, 等. 超高效液相色谱-四极杆飞行时间质谱法快速筛查水产品中16种激素残留[J]. 食品科学,2018,39(20):337−343. [CHEN Q H, ZHANG T W, FU H, et al. Rapid screening of 16 hormone residues in aquaculture products by ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry[J]. Food Science,2018,39(20):337−343. doi: 10.7506/spkx1002-6630-201820049 [25] 赵琼. 液相色谱-串联质谱技术在动物源性食品兽药残留检测中的应用研究[J]. 食品安全导刊,2020(6):129. [ZHAO Q. Application of liquid chromatography-tandem mass spectrometry in the determination of veterinary drug residues in food of animal origin[J]. Food Safety Review,2020(6):129. [26] 张卫卫, 韩四海, 李璇, 等. 超高效液相色谱-串联质谱法在食品安全检测中的应用[J]. 食品安全质量检测学报,2020,11(21):7966−7974. [ZHANG W W, HAN S H, LI X, et al. Application of ultra-performance liquid chromatography-tandem mass spectrometry in food safety detection[J]. Journal of Food Safety and Quality,2020,11(21):7966−7974. [27] YANG Y, SHAO B, ZHANG J, et al. Determination of the residues of 50 anabolic hormones in muscle, milk and liver by very-high-pressure liquid chromatography-electrospray ionization tandem mass spectrometry[J]. Journal of Chromatography, B. Analytical Technologies in the Biomedical and Life Sciences,2009,877(5-6):489−96. doi: 10.1016/j.jchromb.2008.12.054
[28] SCARTH J, CLARKE A, HANDS J, et al. Validation of a quantitative multi-residue urinary assay for the detection of androgen, oestrogen and progestagen abuse in the bovine[J]. Chromatographia,2010,71(3−4):241−252. doi: 10.1365/s10337-009-1429-9
[29] 中华人民共和国农业部. 农业部958号公告-10-2007水产品中雌二醇残留量的测定气相色谱-质谱法[S]. 北京: 中国标准出版社, 2007. Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Announcement No. 958 of the Ministry of Agriculture of the People’s Republic of China-10-2007 Determination of estradiol residues in aquatic products by gas chromatography-mass spectrometry [S]. Beijing: China Standars Press, 2007.
[30] 中华人民共和国国家质量监督检验检疫总局. SN/T 1980-2007进出口动物源性食品中孕激素类药物残留量的检测方法高效液相色谱-质谱/质谱[S]. 北京: 中国标准出版社, 2007. General Administration of Quality Supervision, Inspection and Quarantine of the People’s Republic of China. SN/T 1980-2007 Method for the determination of residues of progesterone drugs in imported and exported foods of animal origin—High performance liquid chromatography-mass spectrometry/mass spectrometry [S]. Beijing: China Standars Press, 2007.
[31] 中华人民共和国农业部SC/T 3029-2006水产品中甲基睾酮残留量的测定液相色谱法[S]. 北京: 中国标准出版社, 2006. Ministry of Agriculture of the People’s Republic of China. SC/T 3029-2006 Determination of methyl testosterone residues in aquatic products by liquid chromatography [S]. Beijing: China Standars Press, 2006.
[32] 中华人民共和国农业部 农业部 1163号公告-9-2009水产品中己烯雌酚残留检测气相色谱-质谱法[S]. 北京: 中国标准出版社, 2009. Ministry of Agriculture and Rural Affairs of the People’s Republic of China. Announcement No. 958 of the Ministry of Agriculture of the People’s Republic of China-9-2009 Deter-mination of diethylstilbestrol residues in aquatic products by gas chromatography-mass spectrometry [S]. Beijing: China Standars Press, 2009.
[33] 中华人民共和国农业部. SC/T 3020-2004水产品中己烯雌酚残留量的测定酶联免疫法 [S]. 北京: 中国标准出版社, 2004. Ministry of Agriculture of the People’s Republic of China. SC/T 3020-2004 Determination of diethylstilbestrol residue in aquatic products enzyme-linked immunoassay [S]. Beijing: China Standars Press, 2004.
[34] 中华人民共和国国家质量监督检验检疫总局. SN/T 3235-2012 出口动物源食品中多类禁用药物残留量检测方法 液相色谱-质谱/质谱法[S]. 北京: 中国标准出版社, 2012. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3235-2012 Method for the determination of residues of banned drugs in food of animal origin for export: Liquid chromatography-mass spectrometry/mass spectrometry [S]. Beijing: China Standars Press, 2012.





 下载:
下载:

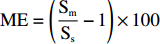
 下载:
下载:
