Dissipation,Residues and Dietary Risk Assessment of Lambda-Cyhalothrin in Bananas
-
摘要: 为了探究高效氯氟氰菊酯在香蕉中的残留消解行为和膳食摄入风险,选择海南儋州(巴西蕉)、广西南宁(威廉斯香蕉)、云南玉溪(巴西蕉)、广东佛山(过山香)四个试验地进行田间试验,采用气相色谱对高效氯氟氰菊酯在香蕉全果及果肉中的残留消解结果进行测定,并对其长期膳食暴露风险进行评估。结果表明:高效氯氟氰菊酯标准曲线线性方程为y=155711x−387.55,R2=0.9997,在0.01~1 mg/kg的添加水平下,平均回收率为79%~110%,相对标准差(RSD)为2.2%~9.5%;在香蕉中的最低检出浓度为0.01 mg/kg;高效氯氟氰菊酯在香蕉中的消解动态符合一级动力学方程,半衰期为22.1 d,消解动态方程为C=0.12878e−0.03136t;评估结果显示高效氯氟氰菊酯的膳食风险概率为76.84%,表明香蕉中残留的高效氯氟氰菊酯长期摄入膳食风险可接受。Abstract: In order to explore the residual digestion behavior and dietary intake risk of lambda-cyhalothrin in bananas, Hainan Danzhou (Brazilian banana), Guangxi Nanning (Williams banana), Yunnan Yuxi (Brazilian banana), and Guangdong Foshan (Guoshanxiang) were selected for field experiments. The results of the residue digestion of lambda-cyhalothrin in banana fruit and pulp were determined by gas chromatography, and the long-term dietary exposure risk was evaluated. The results showed the linear equation of the standard curve of lambda-cyhalothrin was y=155711x−387.55, R2=0.9997; At the level of 0.01~1 mg/kg, the average recovery rate was 79%~110%, and the relative standard deviation (RSD) was 2.2%~9.5%; The limit of quantification(LOQ) of lambda-cyhalothrin in banana was 0.01 mg/kg; The digestion dynamics of lambda-cyhalothrin in bananas conform to the first-order kinetic equation, the half-lifewas 22.1 d, the digestion dynamic equation was C=0.12878e−0.03136t; The evaluation results showed that the dietary risk probability of lambda-cyhalothrin was 76.84%, indicating that the long-term dietary risk of lambda-cyhalothrin residues in bananas was acceptable.
-
Keywords:
- lambda-cyhalothrin /
- banana /
- residue and digestion /
- dietary risk assessment /
- field trial
-
香蕉是日常生活中的常见的热带水果,世界四大水果之一,其因营养丰富、口感软糯、深受人们喜爱。香蕉的生长周期短、产量高,在全球水果品种产量中位居第二,2018年达到11456.89万吨,是热带地区重要的经济作物,在全球进出口水果贸易中占据重要地位。香蕉原产自东南亚,在我国产地主要分布在海南、广东、福建、广西、云南等地[1]。热带温暖潮湿的生长环境导致病虫害的频发,香蕉生长中常见的虫害有香蕉花蓟马[2]、冠网蝽、香蕉弄蝶[3]、交脉蚜[4]、斜纹夜蛾等。目前在香蕉上登记的杀虫剂只有氯氟·吡虫啉、矿物油、螺虫·噻虫啉等三种药剂,而高效氯氟氰菊酯作为一种高效广谱拟除虫菊酯杀虫剂、杀螨剂,在实际农业生产中已被广泛应用于香蕉花蓟马、香蕉弄蝶、交脉蚜的防治。
高效氯氟氰菊酯具有触杀和胃毒作用,作用于害虫的神经系统,通过干扰钠离子通道,抑制神经传导,破坏神经元活动使害虫死亡[5-6],对鳞翅类、鞘翅类和半翅类害虫的药效尤为突出,对其他害虫比如叶螨、锈螨等也有良好效果。高效氯氟氰菊酯对小白鼠属中等毒性,对鱼类、蜜蜂、蚕有剧毒[7-10],并且喷洒后耐雨水冲刷,自然光下稳定性好,不容易降解,在田间使用过程中易造成残留,污染农产品,危害环境,因此需要对其使用和残留情况进行监测。高效氯氟氰菊酯的测定一般采用气相色谱[11-12]、液相色谱[13]或者质谱联用法[14]等方法,刘钰等[15]用GC测定小麦中高效氯氟氰菊酯残留,其方法定量限为0.01 mg/kg,回收率为98%~101%;Sharma等[16]采用GC-MS测定卷心菜中高效氯氟氰菊酯残留,定量限为0.01 mg/kg;张盈等[17]利用气相色谱建立同时快速测定高效氯氟氰菊酯和腐霉利在鲜食辣椒中残留的检测方法,方法检出限为0.01 mg/kg,回收率为88%~102%。利用气相色谱测定高效氯氟氰菊酯的残留可以满足试验对灵敏度的要求,且方法简单,同时可以实现对大批量样品的快速检测。
目前我国在GB2763-2019食品中最大农药残留限量[18]中对高效氯氟氰菊酯在小麦、玉米、大白菜、柑橘等作物上的最大残留限量(MRL)进行了规定,但对其在香蕉上的MRL值并没有作出规定,有关于香蕉中高效氯氟氰菊酯的降解研究也比较少;随着高效氯氟氰菊酯应用范围扩大,使用频率增加,其安全性应引起人们的重视,因此对高效氯氟氰菊酯在香蕉上进行残留消解试验和膳食风险评估尤为重要。本实验开展一年四地规范残留试验,对海南、广西、广东、云南四个地区的香蕉中高效氯氟氰菊酯的残留行为进行分析,通过QuEChERS前处理方法处理样品,采用气相色谱分析,研究高效氯氟氰菊酯在香蕉中的消解动态、最终残留情况以及膳食暴露风险评估,以期对今后高效氯氟氰菊酯的安全使用提供参考依据。
1. 材料与方法
1.1 材料与仪器
氯氟氰菊酯标准品 浓度1000 µg/mL、纯度99.5%,北京坛墨质检科技有限公司BW2020-037;乙腈 色谱纯,美国Fisher;氯化钠 分析纯,广州化学试剂厂。
Agilent GC-7890B 气相色谱仪-电子捕获检测器;CR22N 型落地式高速冷冻离心机 日本日立公司;L204 电子天平 瑞士梅特勒-托利多公司;HT-200 多管涡旋混合器 北京优晟联合科技有限公司;DM-1 色谱柱(30 m×0.32 mm ID×0.25 μm),美国安捷伦公司。
1.2 实验方法
1.2.1 田间实验
按农药残留试验准则要求设试验小区,试验小区布置:设处理小区4株树,3次重复,另设对照小区2株树,小区之间设保护带。施药剂量为33.3 mg a.i./kg(10%高效氯氟氰菊酯水乳剂3000倍液),采取全株喷雾施药,每棵树用水量约为400 mL,施药次数为2次,施药间隔期7 d,采收前42 d第一次施药。消解动态曲线根据一级动力学方程(1)拟合,半衰期按照公式(2)进行计算:
(1) (2) 式中,C表示高效氯氟氰菊酯施药后的残留量,mg/kg;C0表示施药后的初始残留量,mg/kg;k为消解系数;t代表时间,d;DT50为半衰期,d。
1.2.2 残留消解实验
残留消解试验在海南和广东两地进行,按照1.2.1田间实验设计进行施药,最后一次施药后2 h、1、7、14、28、35 d时取香蕉2 kg,分成两份制备香蕉全果、果肉样品。将样品捣碎匀浆后取200 g,分别装入塑料瓶中,标明编号,密封包装后在−20 ℃冰柜中保存。
1.2.3 最终残留实验
最终残留试验在海南、广东、云南、广西四地进行,施药方式及样品处理同1.2.2残留消解试验,距离最后一次施药间隔时间28、35 d时采样。
1.2.4 样品分析
1.2.4.1 提取与净化
分别称取香蕉全果、果肉样品10 g(精确到0.01 g)于50 mL塑料离心管,加20 mL乙腈提取,加4 g氯化钠,多管涡旋振荡器2500 r/min,涡旋5 min,8000 r/min离心5 min,取10 mL上清液加入15 mL净化管(900 mg MgSO4、150 mg PSA),2500 r/min涡旋2 min,8000 r/min离心5 min,取上清液过0.22 μm有机滤膜,待测。
1.2.4.2 检测条件
流速:1.0 mL/ min,进样量:1 μL,进样口温度:250 ℃,检测器温度:290 ℃,进样方式:不分流进样,载气:氮气(纯度99. 999%),升温程序:升温至120 ℃,保持1 min;以20 ℃/min升温至280 ℃,保持0.5 min;以5 ℃/min升温至305 ℃,保持4 min。
1.2.5 标准溶液配制及添加回收实验
移取0.1 g的氯氟氰菊酯标准品,配制成1000 µg/mL的氯氟氰菊酯标准储备液,冷藏避光保存,有效期6个月。将1000 µg/mL的氯氟氰菊酯标准储备液用丙酮稀释配得10 µg/mL的二级标准储备液,冷藏避光保存,有效期3个月。参照样品前处理的方法处理空白样品,得到不含有待测农药的空白基质,利用基质溶液将10 µg/mL的氯氟氰菊酯二级标准储备液稀释配得0.5、0.2、0.1、0.05、0.01 μg/mL系列标准工作液(标准工作液在4 ℃冷藏避光保存,有效期3 d)。
参考高效氯氟氰菊酯在香蕉中的最大残留限量值,选择在全果、果肉中分别添加3个水平(表1)的标准品,按照1.2.2的方法进行样品前处理,每个水平重复5次,计算最终每个水平的平均回收率和相对标准偏差(RSD)。
表 1 高效氯氟氰菊酯在香蕉全果及果肉中的回收率及标准偏差Table 1. Recovery rate and standard deviation of lambda-cyhalothrin in banana fruits and flesh基质 添加水平(mg·kg−1) 回收率(%) 平均回收率(%) 相对标准偏差RSD(%) 1 2 3 4 5 全果 0.01 112 114 109 108 109 110 2.2 0.15 110 113 105 104 107 108 3.2 1.00 86 74 77 78 79 79 5.5 果肉 0.01 104 107 101 112 107 106 3.7 0.15 105 99 102 103 106 103 2.6 1.00 82 94 86 79 73 83 9.5 1.2.6 膳食风险评估
长期膳食摄入风险评估是在农药残留试验和毒理学实验的基础上,对居民因为膳食摄入农药给自身带来的健康风险进行定量评价,参考2002年卫生部发布的中国居民营养与健康状况调查中一般人群对于米、面及其制品、蔬菜类、水果类、畜禽类、奶及奶制品、蛋及蛋制品、植物油、糖、淀粉、食盐等各类食品的消费量,通过农药残留试验,获得香蕉上高效氯氟氰菊酯的残留试验中值和最高残留值,结合我国居民人均膳食结构和已制定的最大残留限量(MRLs),计算高效氯氟氰菊酯在我国的估算每日摄入量(NEDI),计算公式如下:
(3) (4) 式中:STMRi指农药在某一食品中的规范残留试验中值;STMR-Pi 表示用加工因子校正的规范残留试验中值;Fi指一般人群某一食品的消费量。计算NEDI时,如果没有合适的STMR或STMR-P,可以使用相应的MRL。当风险概率≤100%时,表示该慢性风险在可接受范围,风险概率越小,安全性越高;当风险概率>100%时,表示该风险已经超过了可接受范围。
1.3 数据处理
利用Excel 2007处理数据,Origin 2019进行方程拟合与绘图。
2. 结果与分析
2.1 标准曲线和线性关系
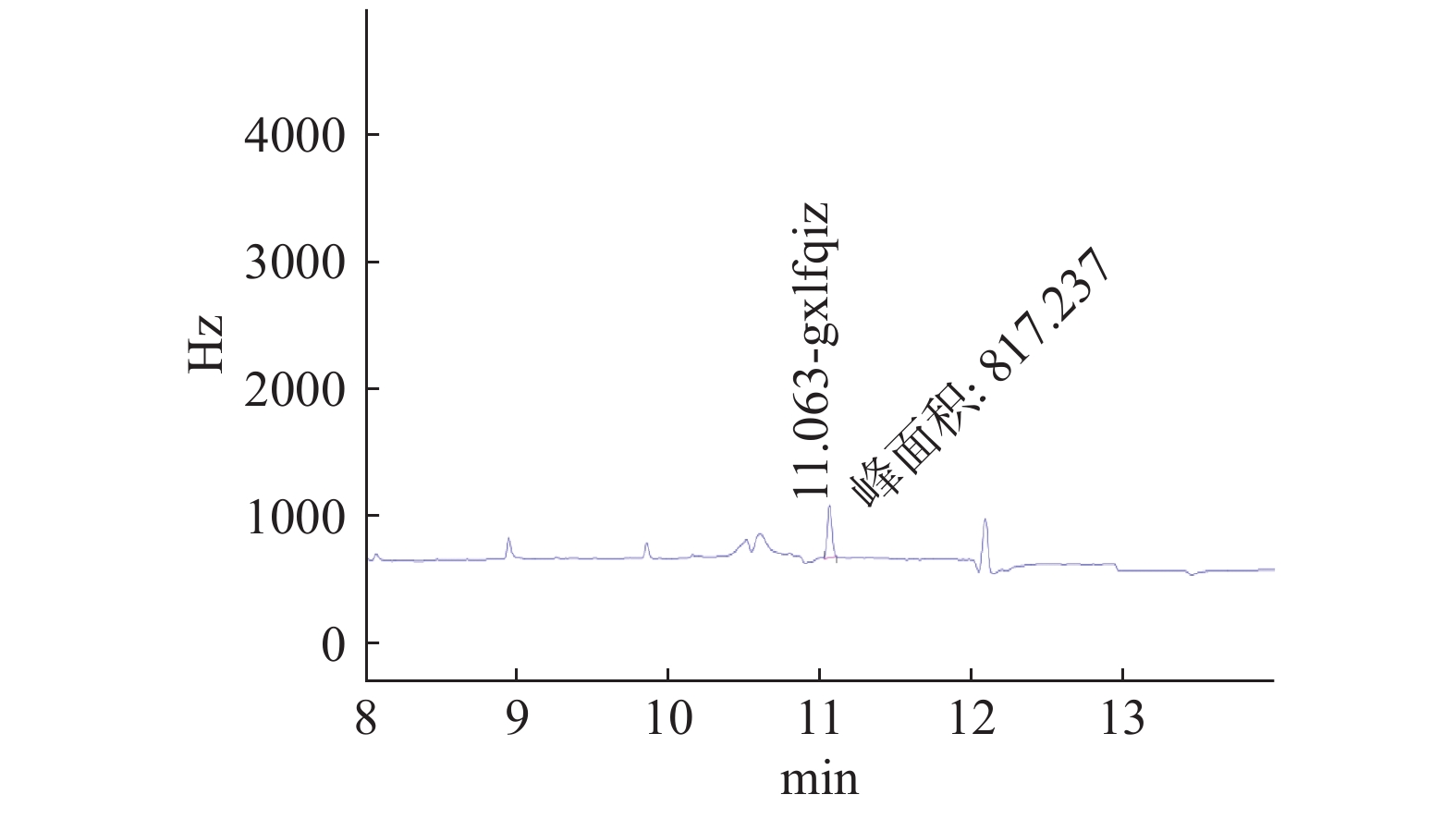
实验中高效氯氟氰菊酯的保留时间为11.06 min左右,标准线性方程为y=155711x−387.55,R2=0.9997,其中y代表峰面积,x代表浓度,结果表明高效氯氟氰菊酯的浓度与峰面积具有良好的线性关系。
2.2 基质效应
基质效应(matrix effect, ME)指分析液中某些基质物质存在改变了目标分析物的响应值,对最终结果的准确性产生影响的现象[19]。基质效应通常是利用基质与溶剂分别配制的标准溶液曲线斜率之比表示[20],ME>0.8为基质抑制效应,ME<1.2为基质增强效应,比值在0.8~1.2之间表示弱基质效应,对试验结果影响可忽略[21]。香蕉中含有糖类、蛋白质等多种组分,有研究表明香蕉对苯醚甲环唑及噻呋酰胺具有基质抑制效应[22],对氯氰菊酯、联苯菊酯等拟除虫菊酯具有基质增强效应[23]。为了试验结果的准确性,采用基质匹配曲线进行定量。
2.3 方法验证
方法灵敏度通过测定最小检出量(Limit of detection, LOD)和最低检测浓度(Limit of quantification, LOQ)表示,通过加标回收实验测得高效氯氟氰菊酯的LOD值为0.01 ng,LOQ值为0.01 mg/kg。利用QuEChERS方法进行样品前处理,气相色谱图如图1所示,在高效氯氟氰菊酯信号附近没有干扰信号。由表1可得,高效氯氟氰菊酯的平均回收率为79%~110%,相对标准差(RSD)为2.2%~9.5%,符合农药残留实验准则要求[24],该方法可靠。
2.4 高效氯氟氰菊酯在香蕉中的残留消解动态
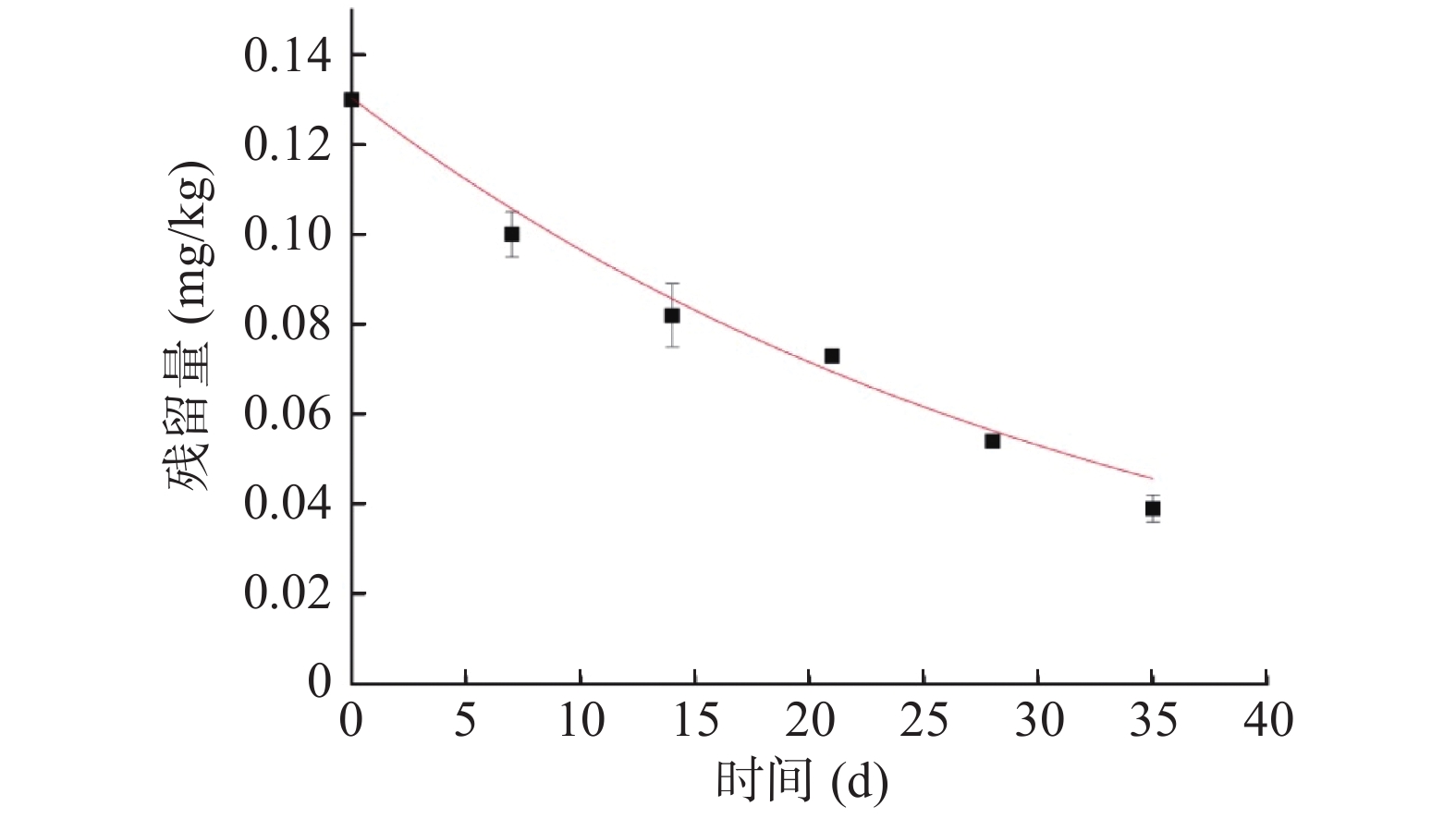
动态残留消解试验在海南和广东两地进行,海南试验点香蕉全果施药后原始积累量0.02 mg/kg,全果及果肉在采样第7 d后残留量均<0.01;广东点原始积累量0.13 mg/kg,通过数据拟合得到消解动态方程为C=0.12878e−0.03136t,相关系数为R2=0.98676,残留半衰期为22.1 d,高效氯氟氰菊酯在香蕉中的消解动态符合一级动力学方程(图2)。
2.5 最终残留
试验结果如表2,由表2可知,在相同的施药条件下,采样距末次施药间隔28 d时,海南、广东、云南、广西四地香蕉全果中高效氯氟氰菊酯的残留量分别为:<0.01、0.054、0.016、0.059 mg/kg,残留中值STMR为0.035 mg/kg;果肉中残留量均<0.01 mg/kg;35 d时四地全果中残留量分别为<0.01、0.040、0.015、0.057 mg/kg;果肉中均<0.01 mg/kg。
表 2 高效氯氟氰菊酯在四个地区最终残留量Table 2. Final residues of lambda-cyhalothrin in the four regions地区 基质 施药剂量(mg·kg−1) 施药次数 高效氯氟氰菊酯残留量(mg·kg−1) 采收间隔期(d) 28 35 海南 全果 33.3 2 <0.01 <0.01 果肉 <0.01 <0.01 广东 全果 33.3 2 0.054 0.040 果肉 <0.01 <0.01 云南 全果 33.3 2 0.016 0.015 果肉 <0.01 <0.01 广西 全果 33.3 2 0.059 0.057 果肉 <0.01 <0.01 2.6 风险评估
根据GB2763-2019食品中农药最大残留限量,高效氯氟氰菊酯的每日允许摄入量ADI值为0.02 mg/kg·bw,香蕉中高效氯氟氰菊酯的MRL值选择本实验的残留中值进行计算,如表3所示,最终结果得出高效氯氟氰菊酯的膳食风险概率为76.84%,为可接受风险。
表 3 高效氯氟氰菊酯膳食风险评估模型Table 3. Lambda-cyhalothrin dietary risk assessment model食物种类 膳食量(kg) 参考限量(mg·kg−1) 限量来源 NEDI(mg) 日允许摄入量(mg) 风险概率(%) 米及其制品 0.2399 1 糙米,中国 0.2399 ADI×63 面及其制品 0.1385 0.5 大麦,中国 0.06925 其它谷类 0.0233 0.2 玉米,中国 0.00466 薯类 0.0495 0.02 马铃薯,中国 0.00099 干豆类及其制品 0.016 0.05 大豆,中国 0.0008 深色蔬菜 0.0915 0.6a 芹菜,残留中值 0.0549 浅色蔬菜 0.1837 2 叶用莴苣,中国 0.3674 腌菜 0.0103 0.15 腌制小黄瓜,中国 0.001545 水果 0.0457 0.035b 香蕉,残留中值 0.0015995 坚果 0.0039 0.01 坚果,中国 0.000039 畜禽类 0.0795 0.05 哺乳动物内脏,中国 0.003975 奶及其制品 0.0263 0.2 生乳,中国 0.00526 蛋及其制品 0.0236 0.02 蛋类,中国 0.000472 鱼虾类 0.0301 0 0 植物油 0.0327 0.2 花生仁,中国 0.00654 动物油 0.0087 3 0.0261 糖、淀粉 0.0044 0.05 甜菜,中国 0.00022 食盐 0.012 15 茶叶,中国 0.18 酱油 0.009 0.5 三七花(干) 0.0045 合计 1.0286 / / 0.9681505 1.26 76.84 注:“a”残留中值查询农业部药检所所得,“b”表示本实验的残留中值。 3. 结论与讨论
本实验的农药残留检测采用QuEChERS方法处理、气相色谱(配ECD检测器)法进行条件优化,建立了测定高效氯氟氰菊酯在香蕉中残留量的分析方法,其精密度和准确性都能达到农药残留分析测定的要求;高效氯氟氰菊酯在香蕉中的LOD值为0.01 ng,高于杨周宁[25]测得的小白菜中的结果0.0017 ng。相比于小白菜,香蕉中含有大量的果胶、碳水化合物、蛋白质等物质,干扰物较多,对农药的提取、净化和测定带来困难。
广东和海南两地高效氯氟氰菊酯的残留消解试验,海南在第7 d后香蕉中的残留值均<0.01 mg/kg,广东香蕉全果中残留半衰期为22.1 d。同等施药条件下,海南气温更高、降水丰沛,农药降解更快,半衰期更短,留量少。
四个实验点的最终残留结果显示各采样时间的香蕉果肉中均未检出高效氯氟氰菊酯残留,表明高效氯氟氰菊酯在香蕉果肉中没有内吸,残留主要在香蕉果皮上,由于高效氯氟氰菊酯的结构是亲脂的,而香蕉皮上蜡质含量大,这就成了主要的残留部位,刘艳萍在香蕉上进行几种亲脂性农药残留试验时也得到了类似的结果[26]。
相同的施药条件下,28 d时海南香蕉全果中高效氯氟氰菊酯残留量<0.01 mg/kg,低于同时期广东(0.054 mg/kg)、广西(0.059 mg/kg)、云南(0.016 mg/kg)三地的实验结果;35 d时这三个地区的高效氯氟氰菊酯残留量均>0.01 mg/kg(广东0.040 mg/kg、广西0.057 mg/kg、云南0.015 mg/kg;)。四地高效氯氟氰菊酯残留量随时间推移逐渐减少,农药在田间施用后温度、降雨量、施药浓度、水分、田间管理(包括套袋、灌溉)等多种因素都会对其产生影响;香蕉生长时果实膨大的过程造成的生物稀释作用[27]以及香蕉植株内的多种新陈代谢反应也会促进农药的进一步降解;对于其他三地,海南的香蕉样品中高效氯氟氰菊酯的残留量最少,考虑原因可能是由于四个香蕉产地的环境差异,海南属于季风性热带气候,相对于广东、广西、云南三个内陆城市,年日照时长较长,降水量大,温湿度更高,农药的降解速度更快。
中国及CAC等国家或组织对于香蕉中高效氯氟氰菊酯使用的MRL值都没有规定,欧盟标准规定为0.15 mg/kg,本试验结果高效氯氟氰菊酯在四地的残留试验中28 d的残留量最大值为0.059 mg/kg,小于欧盟的限量标准(0.15 mg/kg)。
对高效氯氟氰菊酯在香蕉最终残留试验结果进行膳食风险评估,得出风险概率为76.84%,小于100%,风险可接受。建议10%高效氯氟氰菊酯水乳剂以施药剂量有效成分33.3 mg/kg(制剂3000倍液),香蕉蓟马若虫盛发期施药,施药次数为2次,以喷雾方式施药,施药间隔期7 d,推荐安全间隔期为28 d。
-
表 1 高效氯氟氰菊酯在香蕉全果及果肉中的回收率及标准偏差
Table 1 Recovery rate and standard deviation of lambda-cyhalothrin in banana fruits and flesh
基质 添加水平(mg·kg−1) 回收率(%) 平均回收率(%) 相对标准偏差RSD(%) 1 2 3 4 5 全果 0.01 112 114 109 108 109 110 2.2 0.15 110 113 105 104 107 108 3.2 1.00 86 74 77 78 79 79 5.5 果肉 0.01 104 107 101 112 107 106 3.7 0.15 105 99 102 103 106 103 2.6 1.00 82 94 86 79 73 83 9.5 表 2 高效氯氟氰菊酯在四个地区最终残留量
Table 2 Final residues of lambda-cyhalothrin in the four regions
地区 基质 施药剂量(mg·kg−1) 施药次数 高效氯氟氰菊酯残留量(mg·kg−1) 采收间隔期(d) 28 35 海南 全果 33.3 2 <0.01 <0.01 果肉 <0.01 <0.01 广东 全果 33.3 2 0.054 0.040 果肉 <0.01 <0.01 云南 全果 33.3 2 0.016 0.015 果肉 <0.01 <0.01 广西 全果 33.3 2 0.059 0.057 果肉 <0.01 <0.01 表 3 高效氯氟氰菊酯膳食风险评估模型
Table 3 Lambda-cyhalothrin dietary risk assessment model
食物种类 膳食量(kg) 参考限量(mg·kg−1) 限量来源 NEDI(mg) 日允许摄入量(mg) 风险概率(%) 米及其制品 0.2399 1 糙米,中国 0.2399 ADI×63 面及其制品 0.1385 0.5 大麦,中国 0.06925 其它谷类 0.0233 0.2 玉米,中国 0.00466 薯类 0.0495 0.02 马铃薯,中国 0.00099 干豆类及其制品 0.016 0.05 大豆,中国 0.0008 深色蔬菜 0.0915 0.6a 芹菜,残留中值 0.0549 浅色蔬菜 0.1837 2 叶用莴苣,中国 0.3674 腌菜 0.0103 0.15 腌制小黄瓜,中国 0.001545 水果 0.0457 0.035b 香蕉,残留中值 0.0015995 坚果 0.0039 0.01 坚果,中国 0.000039 畜禽类 0.0795 0.05 哺乳动物内脏,中国 0.003975 奶及其制品 0.0263 0.2 生乳,中国 0.00526 蛋及其制品 0.0236 0.02 蛋类,中国 0.000472 鱼虾类 0.0301 0 0 植物油 0.0327 0.2 花生仁,中国 0.00654 动物油 0.0087 3 0.0261 糖、淀粉 0.0044 0.05 甜菜,中国 0.00022 食盐 0.012 15 茶叶,中国 0.18 酱油 0.009 0.5 三七花(干) 0.0045 合计 1.0286 / / 0.9681505 1.26 76.84 注:“a”残留中值查询农业部药检所所得,“b”表示本实验的残留中值。 -
[1] 王芳, 谢江辉, 过建春, 等. 2017年我国香蕉产业发展情况及2018年发展趋势与对策[J]. 中国热带农业,2018(4):27−32. doi: 10.3969/j.issn.1673-0658.2018.04.007 [2] Yu D, Huang P, Chen Y, et al. Effects of flower thrips (Thysanoptera: Thripidae) on nutritional quality of banana (Zingiberales: Musaceae) buds[J]. Plos One,2018,13(8).
[3] N Chitra, K Gunathilagaraj, S Kuttalam, et al. Banana leaf roller Erionota torus evans (Lepidoptera: hesperiidae)- a new threat[J]. Indian Journal of Entomology,2016,78(4):378−380. doi: 10.5958/0974-8172.2016.00098.5
[4] Haim B, Zvi M, Victoria S. Insects associated with the banana aphid Pentalonianigronervosa Coquerel (Hemiptera: Aphididae) in banana plantations with special emphasis on the ant community[J]. Phytoparasitica,2017,45(3):361−372. doi: 10.1007/s12600-017-0592-z
[5] SJayakrishnan, AKDikshit, JPSingh, et al. Dissipation of lambda-cyhalothrin on tomato (Lycopersicon esculentum Mill.) and removal of its residues by different washing processes and steaming[J]. Bulletin of Environmental Contamination and Toxicology,2005,75(2):324−328. doi: 10.1007/s00128-005-0756-2
[6] Adam B, Michał K, Jan B. Lambda-cyhalothrin affects swimming activity and physiological responses of Daphnia magna[J]. Chemosphere,2019,216:805−811. doi: 10.1016/j.chemosphere.2018.10.192
[7] 杨琳, 石凯威, 李莉. 高效氯氟氰菊酯对大鼠皮层神经元钠通道的影响[J]. 农药,2016,55(12):891−893, 914. [8] SalakoA F, Amaeze N H, Shobajo H M, et al. Comparative acute toxicity of three pyrethroids (Deltamethrin, cypermethrin and lambda-cyhalothrin) on guppy fish (Poeciliareticulata peters, 1859)[J]. Scientific African,2020,9:e00504. doi: 10.1016/j.sciaf.2020.e00504
[9] 汤庆坤, 黄深惠, 蒋满贵, 等. 6种拟除虫菊酯类杀虫剂对家蚕的毒性作用[J]. 广西蚕业,2020,57(3):34−36. [10] 周凌云, 张莉, 魏芸芸. 4种拟除虫菊酯类杀虫剂对蜜蜂的毒性和安全性评价[J]. 资源开发与市场,2014,30(6):641−643. doi: 10.3969/j.issn.1005-8141.2014.06.001 [11] 米健奎. 高效氯氟氰菊酯在小白菜和甘蓝上残留和降解的研究[D]. 合肥: 安徽农业大学, 2019. [12] 虞游毅, 杨璐, 廖享, 等. 高效氯氟氰菊酯和氯氰菊酯在苹果中的残留降解动态及其去除方法[J]. 浙江农业学报,2018,30(8):1376−1381. doi: 10.3969/j.issn.1004-1524.2018.08.15 [13] 丁怡, 李荣玉, 刘世江, 等. 高效液相色谱法测定茶叶中的5种农药残留[J]. 中国农学通报,2020,36(29):132−138. doi: 10.11924/j.issn.1000-6850.casb19010113 [14] 陈婷, 续艳丽, 张新中, 等. GC-MS/MS测定葡萄中高效氯氟氰菊酯[J]. 湖北农业科学,2020,59(10):127−130. [15] 刘钰, 董崭, 周庆新, 等. 气相色谱检测小麦中高效氯氟氰菊酯的残留分析方法[J]. 农药科学与管理,2018,39(12):32−36. doi: 10.3969/j.issn.1002-5480.2018.12.009 [16] Sharma K K, Tripathy V, Mohapatra S, et al. Dissipation kinetics and consumer risk assessment of novaluron + lambda-cyhalothrin co-formulation in cabbage[J]. Ecotoxicology and Environmental Safety,2021,208:111494−111494. doi: 10.1016/j.ecoenv.2020.111494
[17] 张盈, 魏进, 段婷婷, 等. 贵州辣椒中腐霉利和高效氯氟氰菊酯的残留及膳食风险评估[J]. 农药,2021,60(3):192−195, 200. [18] GB 2763-2019食品安全国家标准 食品中农药最大残留限量[S]. [19] 吴学进, 王明月, 马晨, 等. QuEChERS/超高效液相色谱-串联质谱法同时测定香蕉中8种植物生长调节剂残留[J]. 热带作物学报,2020,41(11):2297−2304. doi: 10.3969/j.issn.1000-2561.2020.11.022 [20] 胡胜杰, 李优, 周莹, 等. QuEChERS法结合液相色谱-串联质谱测定保健食品中50种非食用添加物[J]. 色谱,2019,37(7):701−711. [21] 覃玲, 董亚蕾, 王钢力, 等. 分散固相萃取-液相色谱-串联质谱法测定常见动物源性食品中42种兽药残留[J]. 色谱,2018,36(9):880−888. [22] 赵小云, 谢德芳. 超高效液相色谱-串联质谱对香蕉中苯醚甲环唑和噻呋酰胺农药残留的检测[J]. 江苏农业科学,2019,47(2):181−185. [23] 乐渊, 李春丽, 刘春华, 等. 多壁碳纳米管滤过型净化-气相色谱串联质谱法测定香蕉中5种拟除虫菊酯类杀虫剂残留[J]. 农药,2019,58(7):515−518, 531. [24] 中华人民共和国农业行业标准NY/T 788-2004农药残留试验准则[J]. 农业质量标准, 2004(4): 29-33. [25] 杨周宁, 杨仁斌, 佘佳荣, 等. 高效氯氟氰菊酯在小白菜和土壤中的残留动态研究[J]. 现代农业科技,2011(1):188−190. doi: 10.3969/j.issn.1007-5739.2011.01.125 [26] 刘艳萍, 王思威, 刘丰茂, 等. 四种常用三唑类杀菌剂在香蕉上残留行为及使用评价研究[J]. 植物保护,2014,40(5):100−105. doi: 10.3969/j.issn.0529-1542.2014.05.18 [27] 邓露晴. 高效氯氟氰菊酯在菠萝和金橘中的残留及膳食风险评估[D]. 广州: 华南农业大学, 2018.







 下载:
下载:


 下载:
下载:
