Effects of Different Quick-freezing Methods on Protein Properties of Largemouth Bass (Lateolabrax japonicus)
-
摘要: 本文以大口黑鲈为原料,为研究不同降温速率(液氮速冻(1.81 ℃)、冷冻液速冻(0.15 ℃)、平板速冻(0.14 ℃))对冷冻贮藏中(0、1、2、4、12、24周)鲈鱼肉蛋白质特性的影响,通过测定鱼肉中盐溶性蛋白、巯基、羰基、Ca2+-ATPase酶活含量、表面疏水性、内源性荧光光谱和蛋白质组成的变化,并采用双因素方差和相关性分析研究速冻方式和贮藏时间考察冻结后对鱼肉蛋白变性情况。结果表明:随冻藏时间的推移,盐溶性蛋白值呈下降趋势:平板组与液氮组,分别在冻藏末期最低与最高;巯基与Ca2+-ATPase酶活值均呈先上升后下降的趋势;肌原纤维蛋白内源性荧光强度上升,产生蓝移现象,肌原纤维蛋白羰基与表面疏水性值显著性上升(P<0.05)。SDS-PAGE电泳结果表明,冻藏期间肌原纤维蛋白发生降解,而液氮组降温速率快,蛋白质降解程度越慢,平板组与其恰恰相反。液氮速冻形成冰晶体积与原料中水的分布相似,利于贮藏。相比较于液氮速冻,冷冻液速冻形成最大冰晶带时间长于液氮速冻,短于平板速冻,两者相差不大。双因素方差与指标间相关性分析表明,速冻方式对肌原纤维蛋白活性巯基、最大荧光强度影响显著(P<0.05),而冻藏时间是影响鲈鱼蛋白质的主因,冻藏时间越长,肌原纤维蛋白氨基酸侧链基团被氧化修饰,是造成蛋白质降解或聚集的主要因素。Abstract: In this paper, largemouth bass was used as raw material to study the effects of different cooling rates (liquid nitrogen quick freezing (1.81 ℃), freezing liquid quick freezing (0.15 ℃), flat plate quick freezing (0.14 ℃)) in freezing storage (0, 1, 2, 4, 12, 24 weeks), the influence of the physical and chemical properties of largemouth bass protein, by measuring the salt-soluble protein, sulfhydryl group, carbonyl group, Ca2+-ATPase activity content, surface hydrophobicity, endogenous fluorescence spectrum and protein composition changes in the fish meat, and using double factor variance and correlation analysis study quick-freezing method and storage time to investigate the degeneration of fish protein after freezing. The results showed that with the passage of frozen storage time, the value of salt-soluble protein showed a downward trend: The plate group and liquid nitrogen group had the lowest and the highest at the end of the frozen storage, respectively; the activity values of sulfhydryl and Ca2+-ATPase both increased first and then decreased. The endogenous fluorescence intensity of fibrin increased, resulting in a blue shift phenomenon, and the value of myofibrillar protein carbonyl and surface hydrophobicity increased significantly (P<0.05). The results of SDS-PAGE electrophoresis showed that myofibrillar protein was degraded during the freezing period, while the liquid nitrogen group had a faster cooling rate and a slower degree of protein degradation, while the plate group was the opposite. The volume of ice crystals formed by quick freezing of liquid nitrogen was similar to the distribution of water in the raw material, which was conducive to storage. Compared with liquid nitrogen quick freezing, the time for the formation of the maximum ice crystal zone in the quick freezing of liquid nitrogen was longer than that of liquid nitrogen quick freezing and shorter than that of flat quick freezing, and there was not much difference between the two. The correlation analysis between the two-factor variance and the indicators showed that the quick freezing method had a significant effect on the active sulfhydryl group and the maximum fluorescence intensity of myofibril protein (P<0.05). The freezing time was the main factor affecting the protein of the sea bass. The oxidative modification of amino acid side chain groups in myofibrillar protein was the main factor causing the degradation or aggregation of protein.
-
Keywords:
- largemouth bass /
- quick-freezing method /
- protein properties /
- frozen storage
-
大口黑鲈(Lateolabrax japonicus),属于真鲈科。鲈鱼原产于美国,在20世纪80年代,作为替代品种引入中国。我国鲈鱼的养殖产量大且逐年递增,广东省是全国养殖淡水鲈鱼第一大省,占全国养殖鲈鱼总产量的58.6%,浙江省其次,仅占13.6%[1]。鲈鱼肉质细嫩、肉为蒜瓣形,滋味鲜美,蛋白质含量丰富,富含钙、锌等微量元素,营养价值高[2-3]。与海鲈鱼相比,淡水鲈鱼水分含量高,易变质或破胆,且糖原含量较少,僵直时间短,内源性蛋白酶在常温下活性最高,造成鱼体死亡后自溶速度快,易产生不愉快的气味,影响消费者的购买欲,不利于鲈鱼的鲜销。
为了避免鱼肉蛋白的浪费,应自其捕捞开始就采取低温保鲜方法延缓腐败菌的繁殖速率。冷冻保鲜是目前应用最广泛的水产品保鲜方式,将水产品冻结,并保持低温状态,能够较长时间的保证水产品新鲜度。在贮藏期内,脂肪氧化、蛋白质降解变性、水分流失等一系列化学反应的发生[4],进而加快冻品品质劣变[5]。鱼肉在冻藏过程中对鱼肉风味品质影响最大的是蛋白质变性降解,造成蛋白质变性是由冻结方式、贮藏温度、时间以及贮藏期间的温度波动等多因素协同作用导致的[6]。目前,市面上应用广泛且效果显著的快速冻结技术:液氮速冻技术——液氮速冻能够迅速冻结,以最短时间穿过最大结晶区,形成细小且分布均匀的冰晶,最大限度的减少组织被破坏程度,且解冻后原料最大限度的保持食品原有品质[7]。Hame等[8]指出在大眼鱼冻藏过程中,冻藏时间的长短与肌肉中巯基含量成反比。Sun等[9]比较浸没冷冻与空气冷冻鲤鱼并贮藏,发现不同冷冻贮藏方式的细胞中冰晶的形成可能会因机械应力对肌肉组织结构造成不可逆转的损害,进而影响鲤鱼品质。Careche[10]等发现鳕鱼、鲈鱼鱼片的感官品质与肌球蛋白的含量有强相关性。Yuan[11]等通过比较速冻(1 ℃/min)与慢冻(0.01 ℃/min)对鱼肉肌原纤维蛋白变性的影响,发现冻结速率对肌原纤维蛋白影响不显著(P>0.05)。液体浸渍冷冻是利用一些无毒,对食品没有伤害且冰点较低的试剂配置成冷冻液,将样品浸没于冷冻液内,与样品直接或间接接触的新型冷冻技术。浸渍冷冻技术在果蔬方面应用广泛,水产品中应用较少[12]。Yang[13]等比较不同速冻方式、贮藏在不同温度的河豚鱼片,发现浸没冷冻(−30 ℃)的鱼片最接近液氮冷冻处理的样品。近几年,有关于淡水鲈鱼肉冻藏过程中蛋白质品质相关报道较少,因此探究液氮、冷冻液、平板速冻三种速冻方式的达−18 ℃时间快慢对冻藏过程中鲈鱼蛋白品质的影响具有重大意义。
本文以鲈鱼为研究对象,采用液氮、包装浸渍、平板速冻,三种速冻方式对真空包装鲈鱼块进行冻结处理,记录鱼块中心温度,待鱼块达−18 ℃时间,停止记录,置于−18 ℃下贮藏。通过测定盐溶性蛋白含量、巯基、Ca2+-ATPase酶活、羰基化合物、表面疏水性、内源性荧光光谱等为蛋白类理化指标,并结合贮藏过程中鲈鱼肌原纤维蛋白SDS-PAGE凝胶电泳结果,综合分析不同降温速率对鲈鱼在低温贮藏期内蛋白组成的变化情况,深入分析冷冻鲈鱼肌原纤维蛋白品质特性变化的内在原因,旨在为淡水大口黑鲈冷冻保鲜技术研究提供理论参考依据。
1. 材料与方法
1.1 材料与仪器
新鲜鲈鱼(650±50 g)(Lateolabrax japonicus) 湖北省武汉市白沙洲水产品批发市场;无水乙醇、丙二醇、氯化钠、盐酸、三氯乙酸、2,4-二硝基苯肼、十二烷基硫酸钠等 国药集团化学集团有限公司;8-苯胺-1苯磺酸 源叶生物有限公司;牛血清蛋白、DTNB Biosharp;EGTA 飞扬生物有限公司;Tris、盐酸胍 BioFroxx GmbH;以上试剂均为分析纯。
KLS-YXD-1柜式液氮速冻机 成都科莱斯低温设备有限公司;BC/BD-200HEF冰箱 青岛海尔特种电冰柜有限公司;DZD-600/S2E真空包装机 燕城神州食品机械(北京)有限公司;3K15离心机 德国Sigma公司;CF15R高速低温离心机 日本日立公司;pH计FE20 梅特勒-托利多仪器(上海)有限公司;T18 basic均质机 德国IKA公司;F-4600日立荧光光谱仪 日本岛津RF5301;722N可见分光光度计 上海仪电分析仪器有限公司;HH-ZK2恒温水浴锅 巩义市予华仪器有限责任公司;RC-4HA/C迷你型温湿度记录仪 江苏精创电器有限公司。
1.2 实验方法
1.2.1 样品预处理
在4 ℃的冷库中取鲜活鲈鱼用榔头敲晕,宰杀,统一取自鱼体两侧鳃盖后至尾鳍前取体背部肌肉作为样品进行测定。取宰杀后清洗干净的鱼背部白肉,将其分割成3 cm×3 cm×3 cm。鱼块样本随机分装在聚乙烯薄膜真空袋中,真空包装。将包装好的鲈鱼块,随机分成3组,共498袋,165/组。
1.2.2 冻结与冻藏
将整理好的真空包装鲈鱼块随机分成三组,分别进行如下预冻处理。其中温度记录仪探头插入鱼块中,使用真空包装抽真空并封口后分别放入冷冻液与平板中,每隔30 s对温度进行一次记录。
液氮组:样品装盘放入柜式液氮速冻机,将温度记录仪探头插入鱼肉中,每隔30 s记录一次温度,待鱼肉中心温度到−18 ℃后,停止记录,取出。
冷冻液组:现配现用的冷冻液在宰杀鲈鱼时放入−4 ℃进行预冷,将真空包装好的样品浸没在冷冻液中,温度记录仪探头插入鱼肉中,待鱼肉中心温度到−18 ℃后,取出。
平板组:直接将真空包装好的鲈鱼块,于托盘中平摊放置,放入−30 ℃的冷库中,将温度记录仪探头插入鱼肉中,待鱼肉中心温度到−18 ℃后,取出。
以上3种预冻处理的样品均放置在−18 ℃冰箱中冻藏,分别于0、1、2、4、12、24 周测定相关指标。取样后于4 ℃解冻8 h,第二天提取肌原纤维蛋白测定相关指标。
1.2.3 蛋白类指标测定
1.2.3.1 肌原纤维蛋白的提取
参考任丽娜等[14]的方法,取3 g鲈鱼肉,加入30 mL的20 mmol Tris-马来酸缓冲液(50 mmol/L KCl-20 mmol Tris-马来酸,pH7.0),均质,以4 ℃、9000 r/min离心10 min后弃去上清液,重复上述操作2次。将沉淀与Tris-马来酸缓冲液(0.6 mol/L KCl-20 mmol/L Tris-马来酸,pH7.0)按一定比例混合,匀浆,于4 ℃冰箱静置60 min,取出后于4 ℃、9000 r/min离心30 min,所得上清液为肌原纤维蛋白溶液。
1.2.3.2 肌原纤维蛋白浓度测定
采用双缩脲方法[14]绘制蛋白浓度标准曲线,分别以浓度和吸光度值为X和Y轴,建立回归方程y=0.0.24x−0.002(R2=1.000)。
1.2.3.3 总巯基含量的测定
参照董开成方法[15],取1 mL蛋白样品溶液(0.4%),加0.2 mol/L Tris-HCl(其中含8 mol/L尿素,10 mmol/L EDTA,2% SDS,pH7.0)缓冲液至10 mL,混匀后室温放置30 min,取4 mL,加入0.4 mL 0.1% DTNB(Tris-HCl,pH8.0);在40 ℃反应25 min后,测定412 nm处的吸光值,对照管用0.6 mol/L KCl-20 mmol/L Tris-马来酸溶液代替样品溶液外,其他试剂均一样。计算公式如下:
(1) 式中:X为总巯基摩尔浓度,mol/g;C0为肌原纤维蛋白质浓度,mg/mL;A为412 nm处的吸光值;D为稀释倍数;
1.2.3.4 活性巯基测定
取1 mL肌原纤维蛋白样品溶液(0.4%),加入9 mL 0.2 mol/L Tris-HCl(10 mmol/L EDTA,2% SDS,pH7.0)缓冲液,混匀后在室温下放置30 min,取4 mL,加入0.4 mL 0.1% DTNB(Tris-HCl,pH8.0);在40 ℃反应25 min后,测定412 nm处的吸光值,空白用0.6 mol/L KCl-20 mmol/L Tris-马来酸溶液代替样品溶液外,其他试剂均一样。计算公式与式(1)一致。
1.2.3.5 羰基化合物
羰基化合物含量测定参照石钢鹏[16]等的方法进行测定。取0.5 mL肌原纤维蛋白溶液分装于离心管中,2 mL 2,4-二硝基苯肼(DNPH)溶液(10 mmol/L,用2 mol/L HCl溶解)与2 mL 2 mol/LHCl溶液分别加入离心管中。避光静置1 h(每10 min涡漩混匀,25 ℃)。随后加入2.5 mL 20%三氯乙酸沉淀蛋白,11000 ×g离心3 min,取沉淀用2 mL乙酸乙酯/乙醇(1:1,v/v)洗涤3次,留沉淀。加入6 mL 6 mol·L−1的盐酸胍溶解沉淀,室温放置10 min后11000 ×g离心3 min,在370 nm波长下测定上清液的吸光度。蛋白质中的羰基含量(nmol/mg蛋白质),参照公式(1)计算,其摩尔消光系数22000 L·(mol·cm)−1。
1.2.3.6 Ca2+-ATPase酶活
采用南京建成生物工程研究所提供的超微量Ca2+-ATPase酶测试盒测定。
1.2.3.7 表面疏水性的测定
参考李清正[17]等方法,略作修改。以1-苯奈氨-8-磺酸(8-anilino-1-naphthalenesulfonicacid,ANS)作为荧光探针,用0.6 mol/L KCl-10 mmol/L(pH7.0)磷酸盐缓冲液将肌原纤维蛋白浓度分别调至0.1、0.2、0.3、0.5 mg/mL。4种质量浓度的蛋白溶液各取4 mL,加入20 μL pH7.0含8 mmol/L ANS的0.1 mol/L磷酸盐缓冲液,混匀后用荧光分光光度计测定,条件为:激发波长和发射波长分别为390和470 nm,宽均为5 nm。用荧光强度对蛋白质浓度的斜率表示蛋白质表面疏水性。
1.2.3.8 内源荧光光谱
参考朱姝冉[18]方法,略作修改。取3 mL肌原纤维蛋白溶液(1 mg/mL),于1 cm四通石英比色皿中,以280 nm为激发波长,在荧光分光光度计上记录270~450 nm波长范围内的荧光发射光谱。发射光谱的操作条件为:扫描范围270~450 nm,扫描速度2400 nm/min,激发狭缝和发射狭缝宽均为2.5 nm,响应时间为0.5 s,记录数据波长间隔为1 nm。
1.2.3.9 SDS-PAGE凝胶电泳
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)参考Laemmli[19]的方法,稍作修改。吸取前处理后的上清液8 μL进行点样,浓缩胶质量分数为4%,分离胶质量分数为12%。样品在浓缩胶中电压为80 V,进入分离胶后电压改为120 V。
1.3 数据处理
每组试验至少做3次,并计算出平均值和标准方差以表示试验结果,试验数据采用软件Graphpad Prism 5.0、OriginPro 2017 SR 2、Image J处理、作图,用软件SPSS 20.0进行显著性差异分析与相关性分析(P<0.05)、用OriginPro 2017 SR 2双向方差分析(ANOVA)分析了速冻方式和贮藏时间对冷冻鲈鱼肉片蛋白类指标的相互作用的影响。
2. 结果与分析
2.1 鲈鱼肉中心部位的冻结曲线
冻结曲线是反映食品在冻结过程中,其中心温度与冻结所用时间的关系曲线,一般划分三个阶段:先下降放出显热、中间平滑,食品中大部分的水结晶、最后下降至−18 ℃[13]。如图1,第一阶段(Ⅰ):从食物的初始温度到冻结点,曲线陡峭;第二阶段(Ⅱ):冰晶生成区,组织中液态水变成固态冰,曲线较为平坦,此时食品中大部分水都冻结成固态冰,该温度区间称为最大冰晶生成带;第三阶段(Ⅲ):食品中残留的水继续冻结成冰,恒温不变。第三阶段斜率大于第二阶段。冻结过程中,冻结速率对于样品品质有直接的影响。形成最大冰晶带速率越快,冰晶体积越小,分布更为均匀,对组织的破坏性越小,越有利于食品的保存[20-21]。
图1反映的是三种冻结方式处理的大口黑鲈鲈鱼鱼块的中心温度从4 ℃降至−18 ℃的温度变化曲线。从图中可以看出,冷冻液速冻最大冰晶带温度区间为−0.6~−1.3 ℃,用时13 min,其中心温度降至−18 ℃用时142 min。平板速冻最大冰晶带温度区间为−0.5~−1 ℃,用时52 min,降至−18 ℃全程耗时156 min,而液氮速冻的最大冰晶生成带温度区间为−2.45~−6.22 ℃,用时5 min,而液氮组中心温度降至−18 ℃仅用时12 min,整体用时最短,冻结效率最高,约是冷冻液速冻的11.8倍,平板速冻的13倍。液氮速冻、冷冻液速冻、平板速冻的降温速率分别是1.81、0.15、0.14 ℃/min。由此可见,液氮速冻生成最大冰晶带时间最短,降温速率最快,所形成的冰晶小且分布均匀,对细胞损伤最小,而平板速冻与冷冻液速冻的降温速率相差不大,冷冻液组形成最大冰晶带的时间和所用时间均早于平板组。由此推测经液氮速冻冻藏的鲈鱼鱼块品质最佳,冷冻液组次之,平板速冻最差。
2.2 盐溶性蛋白浓度
蛋白质变性程度可以用盐溶性蛋白的含量来评价[22],鱼肉在冻藏时蛋白质会降解或变性导致其溶解性发生变化,盐溶性蛋白总量下降[23]。肌原纤维蛋白对肌肉质地和持水力有重要作用。如图2所示,−18 ℃冻藏下,与新鲜鱼块相比,液氮组、冷冻液组、平板组24周时盐溶性蛋白含量分别为19.62、19.53、19.33 mg/mL,分别下降到新鲜样品的87.16%、86.76%、85.87%。三组样品随时间推移呈显著性下降趋势(P<0.05),其中下降速率:平板组>冷冻液组>液氮组,这与2.1结果一致。鲁珺[7]通过比较三种速速冻方式对银鲳鱼贮藏150 d,发现液氮速冻对肌原纤维蛋白有较好的维持作用,与图2结果相符。平板组在最大结晶区停留时间最长,冻结速率最慢,肌原纤维蛋白含量在贮藏末期最低。液氮组冻藏4周时,盐溶性蛋白含量开始显著性下降(P<0.05);冷冻液组贮藏前4周,盐溶性蛋白含量呈现一定波动,于4周时显著下降(P<0.05),而平板组冻藏2周后就开始下降。冻结过程中介质温度会对肌原纤维蛋白产生影响,介质温度越低,冻结速率越快,盐溶性蛋白含量越高,鱼肉品质越好[24]。
2.3 巯基含量
由图3可知,鲈鱼蛋白质的巯基值在冻藏第4周呈上升的趋势,随后下降。巯基是鱼肉蛋白中亲水基团,巯基的变化可表征蛋白质的氧化程度。如图3a所示,在贮藏4周时,3组均达到最大值,分别为4.83(液氮组)、5.13(冷冻液组)、5.07(平板组)μmol/g,导致巯基上升可能是速冻处理导致蛋白质的三维立体结构发生变化,使原藏于蛋白质内部的巯基基团向外暴露。这与Makri[25]研究的金头鲷在−22 ℃中巯基含量变化趋势一致。贮藏末期,液氮组、冷冻液组、平板组分别下降到4周时的81.99%、70.57%、75.74%,由此可见巯基下降速率:冷冻液组>平板组>液氮组。总的来说,贮藏末期的3组总巯基含量与新鲜值相比相差不大,但与4周时的总巯基值相比显著下降(P<0.05)。其中液氮组总巯基含量在4周时最大值远小于另2组,且贮藏24周时最高,平板速冻次之,冷冻液最低,说明液氮速冻形成的冰晶对蛋白质空间结构破坏最小,与2.1结论一致。−18 ℃冻藏,活性巯基的变化趋势与总巯基一致,呈现出冻藏前期显著上升,后期显著下降的趋势(P<0.05)。液氮组、冷冻液组、平板组第4周时活性巯基含量分别为4.53、4.28、4.96 μmol/g,其上升原因与总巯基上升原因一致。贮藏末期分别下降到4周时的73.95%、65.65%、66.73%。造成这一现象的可能是液氮速冻在最大冰晶带停留时间最短,形成的冰晶小且均匀,而平板速冻与冷冻液速冻降温速率相差不大,活性巯基贮藏末期相差不大,这一结果与杨艳丽等研究凡纳滨对虾经液氮速冻和超低温速冻后蛋白质发生了轻微的速冻变性,变性程度低于冷库速冻的结果类似[26]。随着−18 ℃冻藏时间的推移,鱼肉中微量的水变得“游离”,细胞中出现冰水混合的现象,使蛋白质劣变程度加深,游离的活性巯基易被氧化形成二硫键,巯基含量的下降[4,27]。
2.4 羰基含量
蛋白羰基含量是蛋白质氧化损伤的敏感指标,羰基的形成是蛋白质分子被机体产生的氧自由基修饰的重要产物[28-29],故可测定羰基含量判断蛋白质受到氧化损伤程度的指标之一[30-32]。由图4可看出,不同速冻方式冻藏的鲈鱼肉,随冻藏时间的推移,羰基值显著上升(P<0.05)。新鲜鲈鱼肉羰基化合物含量为84.48 nmol/g,经4周贮藏后,液氮组、冷冻液组、平板组分别上升到新鲜值的164%、145%、205%,其中冷冻液组、平板组第2周时羰基含量比贮藏4周时高,可能是形成的羰基化合物不稳定,与机体内其他物质发生反应,进而导致羰基值含量下降[33],这与Estevez M等[34]研究发现猪肉羰基变化趋势相似。冻藏2周,三组之间羰基值差异显著(P<0.05),其趋势与2.1最大冰晶带形成时间长短对应,时间越长,羰基值越大。冻藏4周,平板组与另两组差异显著,可能原因是冻藏期间冰箱的合开导致温度波动使得液氮组冰晶出现熔融现象,导致其品质下降。冻藏12周后,羰基值:冷冻液组<液氮组<平板组,3组之间差异不大(P>0.05)。冻藏末期,平板组值最高、液氮组次之,冷冻液组最小,冷冻液组与平板组之间差异显著(P<0.05)。羰基值上升可能原因是肌原纤维蛋白降解,包裹于蛋白内部的氨基酸暴露,肽键和氨基酸侧链被自由基氧化,生成羰基化合物[35]。不同处理组羰基值不同,原因可能是液氮组形成最大冰晶带时间短,形成冰晶小且均匀,对鱼肉组织结构破坏最小。而平板组形成最大冰晶带时间最长,速冻期间细胞内水分不断向外渗透到细胞外并持续凝固导致形成冰晶较大,细胞受冰晶挤压变形或破裂,使鱼肉组织结构破坏。
2.5 Ca2+-ATPase酶活
肌原纤维蛋白是一类蛋白的总称,其中原肌球蛋白、肌球蛋白、肌动球蛋白等占主要成分,肌肉中存在的肌球蛋白与肌动球蛋白在能量的作用下生成肌动球蛋白,而Ca2+-ATPase酶活性与肌球蛋白的头部区域密切相关,可反映样品在冻藏过程蛋白质变性程度的重要指标[36]。如图5所示,−18 ℃冻藏下,不同速冻方式的Ca2+-ATPase酶活力显著下降(P<0.05)。贮藏1周Ca2+-ATPase酶活达最大,分别为11.38(液氮组)、10.76(冷冻液组)、11.15(平板组)μmolPi/mgrot/10 min,Ca2+-ATPase酶活上升可能是在速冻或冻藏过程中酶发生了部分解聚作用,使得肌动蛋白和肌球蛋白结合加强。鲁珺在银鲳鱼速冻处理贮藏30 d后过程发现酶活上升[37],这与本文得出相似的趋势。1周后3组Ca2+-ATPase酶活值显著下降(P<0.05),至24周分别降至3.52(液氮组)、2.44(冷冻液组)、3.96(平板组)μmol Pi/m grot/10 min。冻藏引起Ca2+-ATPase酶活下降的原因是多方面的,如pH的下降、巯基氧化、温度、冰晶大小等[38]贮藏过程这些因素的变化均会导致Ca2+-ATPase酶活性的下降。闫春子等[39]认为巯基氧化形成二硫键导致的分子聚合是Ca2+-ATPase酶活性下降的主因。Ca2+-ATPase酶活性下降可能的原因是不同速冻方式的降温速率有差别以及贮藏时温度的波动引起冰晶增大或溶解产生“游离”的水,鱼肉细胞结构被破坏,导致蛋白质之间的化学键发生变化,引起Ca2+-ATPase酶活的下降。
2.6 表面疏水性
蛋白质的表面疏水性反映的是蛋白质分子表面的疏水性残基的相对含量,新鲜鱼肉蛋白质的疏水性基团被包裹于蛋白质分子内部,具有较低的表面疏水性[40]。如图6,前2周内各速冻处理的样品表面疏水性变化大体上呈上升趋势,2周后稍微平缓,24周时增长至最大值。其中液氮组2周与另2组差异显著(P<0.05),4周后变化速率不大,趋于平缓。冻藏24周3组均显著增大(P<0.05)。冻藏初期,折叠态的肌原纤维蛋白分子部分开始伸展,原先位于蛋白质多肽链内部的疏水性基团外露,引起表面疏水性值上升。与新鲜鲈鱼肉的表面疏水性值相比,24周时分别上升至新鲜值的5.82(液氮组)、5.89(冷冻液组)、5.69(平板组)倍。这与2.7巯基变化趋势相对应。Zhou等[41]研究发现,罗非鱼糜在−18 ℃冻藏24周后,样品表面疏水性相对初始值翻倍。冻藏中期,3组均表面疏水性均有先减小,后上升的波动情况发生,冻藏期间表面疏水性值下降可能是暴露的疏水残基通过化学作用力发生聚合,游离的疏水基团减少[42]。Benjakin和SutthiPan[6]也发现泥蟹蟹肉在贮藏中期,表面疏水性值显著上升,随后随冻藏时间逐渐减少,与本文趋势类似。
2.7 内源荧光强度
鱼肉蛋白中色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)在230~310 nm间具有吸收紫外入射光而发射荧光的特性[43],可根据该氨基酸残基的位置和微环境变化,判断蛋白质空间结构变化以及变性程度。
结合表1与图7,各速冻处理后的肌原纤维蛋白的内源性荧光强度变化趋势相近,大体上随着冻藏时间的推移,最大荧光强度明显上升,其中冻藏前4周,肌原纤维蛋白的内源性荧光强度呈先上升,后下降的趋势,速冻初期内源性荧光强度上升可能是不同速冻处理介质温度不同,形成冰晶的速度不一,大小不均匀,导致细胞破损,内部疏水基团暴露,造成内源性荧光强度上升。荧光强度下降可能是暴露的疏水性氨基酸残基,通过化学作用力重新发生聚集,游离的氨基酸减少,与荧光探针结合表征的量就减少[38, 40]。从最大荧光强度对应的波长变化,液氮组280 nm处激发时,最大吸收波长见表1,发射波长变化范围为335.2~338.6 nm。贮藏前1周,λmax下降,发生蓝移现象,2周时λmax从336.4 nm红移至337 nm,随后直至冻藏末期λmax下降,持续发生蓝移现象。与液氮组不同的是,平板组与冷冻液组,4周时λmax均从338.6 nm蓝移至335 nm,冻藏12周时分别红移至336.6和336.8 nm,贮藏末期发生蓝移现象。荧光最大吸收峰红移表明色氨酸等荧光发射基团暴露于极性更大的微环境中,反之蓝移则表明发射基团周围的微环境极性减小,疏水性较大[43]。
表 1 不同速冻方式在贮藏期间鲈鱼最大内源性荧光强度Table 1. Maximum endogenous fluorescence intensity of Lateolabrax japonicus during storage in different quick-freezing methods贮藏
时间(周)液氮速冻 冷冻液速冻 平板速冻 波长
(nm)荧光
强度波长
(nm)荧光
强度波长
(nm)荧光
强度0 338.6 232.23 338.6 232.23 338.6 232.23 1 336.4 716.37 336.4 717.53 338 687.63 2 337 521.4 335.8 508.3 336.4 445.87 4 336 626.97 335 661.63 335 623.6 12 335.8 1013 336.8 895.2 336.6 889.97 24 335.2 1452.33 334 1406.33 335.4 1495 2.8 冻藏期间不同速冻方式对鲈鱼肌原纤维蛋白的降解
SDS-PAGE是用来评价肉类产品在贮藏和加工过程中蛋白质稳定性的影响的技术之一[44]。SDS-PAGE法分离蛋白的原理是根据蛋白质能与阳离子表面活性剂SDS依据重量比结合成复合物,使蛋白质按分子大小分离。本文采用不同速冻方式对鲈鱼肉进行快速冷冻,于−18 ℃进行冻藏,分别于0、1、2、4、12、24周提取肌原纤维蛋白。一些研究者发现冻藏会引起肌原纤维蛋白空间结构的改变和蛋白分子间的聚合,在电泳图上表征为蛋白条带的消失或增强[45]。图8参照Shi等[46]和Araki[47]等的相关研究,对电泳条带所属蛋白质亚基进行标注。
![]() 图 8 冻藏期间鲈鱼肌原纤维蛋白的SDS-PAGE图谱注:M:Marker蛋白标样;条带1~3:分别为冷冻液组、平板组、液氮组贮藏1周蛋白条带;条带4~6:分别为上述三组贮藏2周蛋白条带;条带7~9:分别为贮藏4周蛋白条带;条带10~12:分别为贮藏12周蛋白条带;条带13~15:分别为贮藏24周蛋白条带;条带16:为新鲜样品蛋白条带。Co:肌联蛋白;MHC-2:肌球蛋白重链二聚体;MHC:肌球蛋白重链;Ac:肌动蛋白;TM:原肌球蛋白;TNT:肌钙蛋白T亚基;TNI:肌钙蛋白I亚基;MLC-1:肌球蛋白轻链1亚基;MLC-2:肌球蛋白轻链2亚基;MLC-3:肌球蛋白轻链3亚基。Figure 8. SDS-PAGE patterns of myofibrillar proteins of Lateolabrax japonicus during frozen storage
图 8 冻藏期间鲈鱼肌原纤维蛋白的SDS-PAGE图谱注:M:Marker蛋白标样;条带1~3:分别为冷冻液组、平板组、液氮组贮藏1周蛋白条带;条带4~6:分别为上述三组贮藏2周蛋白条带;条带7~9:分别为贮藏4周蛋白条带;条带10~12:分别为贮藏12周蛋白条带;条带13~15:分别为贮藏24周蛋白条带;条带16:为新鲜样品蛋白条带。Co:肌联蛋白;MHC-2:肌球蛋白重链二聚体;MHC:肌球蛋白重链;Ac:肌动蛋白;TM:原肌球蛋白;TNT:肌钙蛋白T亚基;TNI:肌钙蛋白I亚基;MLC-1:肌球蛋白轻链1亚基;MLC-2:肌球蛋白轻链2亚基;MLC-3:肌球蛋白轻链3亚基。Figure 8. SDS-PAGE patterns of myofibrillar proteins of Lateolabrax japonicus during frozen storage通过SDS-PAGE凝胶电泳分析不同速冻方式的鲈鱼肉经冻藏后肌原纤维蛋白变化情况,如图8所示。新鲜鲈鱼肉肌原纤维蛋白主要条带有10条,分别如图8中泳道16所示。经冷冻液、平板、液氮速冻后贮藏1周肌原纤维蛋白明显条带有9条,从上到下分别是分子量245 kDa Co、220 kDa MHC、180 kDa MHC-2、48 kDa Ac、35 kDa TNT、<35 kDa MLC-1、25 kDa TNI、<20 kDa MLC-2、MLC-3,其中TM条带消失。泳道16的MHC条带与泳道13~15相比变淡变浅,说明在冷冻贮藏过程中二硫化物的降解速率随时间的推移逐渐变快,Lu等[48]也得出类似的结论。随着贮藏时间的延长,主要的蛋白质条带信号均有减弱,一定程度上表明肌原纤维蛋白中不同分子量的蛋白质发生变性,蛋白质亚基均出现不同程度的降解或聚集,且通过Image J对电泳条带灰度值的计算,发现冷冻液组与平板组蛋白质降解速度快于液氮组,整个贮藏过程中Ac灰度值液氮组始终大于另两组,而平板组与冷冻液组相差不大,这一结果与Ca2+-ATPase酶活变化趋势相符。通过观察泳道16,发现MHC在浓缩胶部分形成一些颜色较暗的条带,可能原因是速冻方式处理导致大分子蛋白质发生交联,形成了高分子质量的聚集,堆积在分离胶的顶部,甚至可能存在于浓缩胶中,无法进入到分离胶,形成一些颜色较暗的条带[49]。贮藏12周时,冷冻液组的肌球蛋白轻链变浅变细,冻藏末期条带消失,蛋白质高度降解。24周时,不同速冻方式的肌原纤维蛋白的Co与MHC-2条带边缘逐渐模糊,降解最为严重。电泳结果表明,液氮速冻能够维持鲈鱼的蛋白质品质,延长货架期。并且这种保护仅持续12周,24周液氮速冻样品的条带与另两组差别不大,优势不明显。
2.9 双因素方差分析与指标之间相关性分析
双因素方差分析结果表明:贮藏时间对鲈鱼过程中冻藏过程中肌原纤维蛋白、总巯基、表面疏水性含量、最大荧光强度有显著影响(P<0.05),对其他蛋白类指标影响不显著(P>0.05)。从表2看出,速冻方式对活性巯基含量和色氨酸最大荧光强度有显著性影响(P<0.05),速冻方式与贮藏时间的交互作用对表面疏水性(P=4.221×10−4<0.01)与色氨酸最大荧光强度(P=5.777×10−12<0.01)有极显著性影响。冷冻速率的快慢,对肌原纤维蛋白的空间结构有影响,冷冻速率越慢,蛋白质空间结构被破坏程度越大,导致包埋于蛋白内部氨基酸游离,导致活性巯基含量升高以及色氨酸荧光强度上升。综上所述,贮藏时间是影响鲈鱼鱼片蛋白品质的主要因素,这一点与Shi[50]等得出的结论一致。三种速冻方式的降温速率不同,使其对鲈鱼鱼快蛋白质空间结构有影响,但影响不显著(P>0.05)。
表 2 冻藏大口黑鲈的蛋白类指标速冻方式和贮藏时间的双因素方差分析结果Table 2. Results of two-factor analysis of variance for the quick-freezing method and storage time of the protein index of frozen Lateolabrax japonicus指标/因素 速冻方式 贮藏时间 速冻方式&贮藏时间 F(df=2) P-value F(df=5) P-value F(df=10) P-value 盐溶性蛋白 1.466 0.244 16.789 1.502×10−8 0.592 0.810 总巯基 1.802 0.179 64.230 1.110×10−16 1.238 0.301 活性巯基 5.429 0.012 0.812 0.554 1.181 0.354 Ca2+-ATPase酶活 1.145 0.336 1.877 0.139 0.565 0.824 羰基 0.082 0.922 1.422 0.256 0.519 0.858 表面疏水性 2.883 0.069 283.259 0.000 4.444 4.221×10−4 最大荧光强度 21.779 6.327×10−7 7068.047 0.000 20.420 5.777×10−12 相关性分析结果表明,如表3所示,盐溶性蛋白与Ca2+-ATPase酶活性极显著正相关,与羰基、表面疏水性、最大荧光强度呈极显著负相关(P<0.01),与Ac、MLC-3呈负相关(P<0.05)。肌球蛋白是肌原纤维蛋白的主要成分,随冻藏时间推移肌球蛋白的头部是自由基氧化修饰的主要靶标。总巯基与活性巯基极显著正相关(P<0.01),与Ca2+-ATPase酶活性、MHC显著性负相关(P<0.05);活性巯基与最大荧光强度呈极显著负相关(P<0.01);Ca2+-ATPase酶活性与羰基、表面疏水性、最大荧光强度呈极显著负相关,与TNT呈极显著正相关(P<0.01),与MLC-3呈显著负相关(P<0.05),这可能是因为肌钙蛋白与肌球蛋白的蛋白质结构改变,导致Ca2+-ATPase酶活性下降。羰基与表面疏水性、最大荧光强度极显著正相关(P<0.01),与MHC呈显著负相关;表面疏水性与最大荧光强度极显著正相关,与MHC呈极显著负相关(P<0.01),与Co、TNT呈显著负相关(P<0.05);最大荧光强度与MHC呈极显著负相关(P<0.01),与TNT呈显著负相关(P<0.05);Co与MHC、Ac、TNT、MLC-3之间呈极显著正相关(P<0.01)。鱼肉在冻藏过程中发生两种变性,分别是是蛋白质的聚集和蛋白质多肽链的展开。肌原纤维蛋白随贮藏时间的推移,氧自由基与非氧自由基氢过氧化物对氨基酸侧链基团的修饰,导致蛋白质断裂或交联聚集。原蛋白质分子表面氨基酸与周围水分子相互作用及分子内相互作用也会影响蛋白质完整性及立体构象稳定性。综上所述:降温速率的不同,对氨基酸侧链基团的修饰程度有差异,而氨基酸侧链基团与蛋白质氧化变性密切相关。
表 3 不同速冻处理对冻藏期间鲈鱼肌原纤维蛋白质生化特性的相关性分析Table 3. Correlation analysis of different quick-freezing treatments on the biochemical characteristics of Lateolabrax japonicus myofibril Protein during frozen storage指标 盐溶性蛋白 总巯基 活性巯基 Ca2+-ATPase酶活 羰基 表面疏水性 最大荧光强度 Co MHC Ac TNT MLC-3 盐溶性蛋白 1 总巯基 −0.070 1 活性巯基 0.146 0.751** 1 Ca2+-ATPase酶活 0.743** −0.294* 0.017 1 羰基 −0.697** 0.066 −0.189 −0.823** 1 表面疏水性 −0.587** −0.057 −0.267 −0.686** 0.804** 1 最大荧光强度 −0.599** −0.077 −0.353** −0.634** 0.824** 0.921** 1 Co −0.166 0.134 0.210 −0.158 −0.045 −0.325* −0.258 1 MHC 0.108 −.545** −0.269* 0.267 −0.325* −0.438** −0.442** 0.603** 1 Ac −0.280* −0.265 −0.105 −0.197 0.131 −0.001 0.023 0.753** 0.765** 1 TNT 0.078 −0.166 0.193 0.350** −0.199 −.298* −0.290* 0.449** 0.551** 0.590** 1 MLC-3 −0.273* 0.087 0.237 −0.293* 0.226 −.014 0.014 0.827** 0.479** 0.832** 0.480** 1 注:*表示显著相关,P<0.05;**表示极显著相关,P<0.01。 3. 结论
可依据鲈鱼肉块中心温度以及最大冰晶带形成时间,可推测出鲈鱼蛋白特性随贮藏时间推移劣变顺序:平板组>冷冻液组>液氮组;肌原纤维蛋白总量呈下降趋势:平板组冻结速率最慢,液氮组最快,分别在冻藏末期最低与最高;巯基值与Ca2+-ATPase酶活均呈先上升后下降的趋势,巯基值4周时升至最高,Ca2+-ATPase酶活1周时酶活力最强,随之下降。三组羰基值显著上升,冻藏末期,平板组值最高、液氮组次之,冷冻液组最小,冷冻液组与平板组之间差异显著(P<0.05)。贮藏前期具有较低的表面疏水性值,随贮藏时间的推移,肌原纤维蛋白疏水性基团暴露,导致后期表面疏水性显著上升。内源性荧光强度与蛋白质疏水性基团紧密相关。电泳结果表明,液氮速冻能够维持鲈鱼的蛋白质品质,延长货架期。并且这种保护仅持续12周,24周液氮速冻样品的条带与另两组差别不大,优势不明显。结果表明:液氮速冻形成冰晶体积与原料中水的分布相似,对细胞损伤最小,利于贮藏。相比较于液氮速冻,冷冻液速冻形成最大冰晶带时间长于液氮速冻,短于平板速冻,两者相差不大。而冻藏期间蛋白特性出现波动,可能原因是冰箱的温度波动导致液氮组中细且小的冰晶变得“游离”,细胞中出现冰水混合的现象,加速蛋白质氧化。另两组形成冰晶大,溶解所需温度高。通过双因素方差分析和相关性分析表明,速冻处理对鲈鱼肌原纤维蛋白之间的变化关联不显著(P>0.05),而贮藏时间是影响鲈鱼蛋白质品质的主因,贮藏时间越长,鱼肉蛋白质氧化降解,加速其劣变降解。
-
图 8 冻藏期间鲈鱼肌原纤维蛋白的SDS-PAGE图谱
注:M:Marker蛋白标样;条带1~3:分别为冷冻液组、平板组、液氮组贮藏1周蛋白条带;条带4~6:分别为上述三组贮藏2周蛋白条带;条带7~9:分别为贮藏4周蛋白条带;条带10~12:分别为贮藏12周蛋白条带;条带13~15:分别为贮藏24周蛋白条带;条带16:为新鲜样品蛋白条带。Co:肌联蛋白;MHC-2:肌球蛋白重链二聚体;MHC:肌球蛋白重链;Ac:肌动蛋白;TM:原肌球蛋白;TNT:肌钙蛋白T亚基;TNI:肌钙蛋白I亚基;MLC-1:肌球蛋白轻链1亚基;MLC-2:肌球蛋白轻链2亚基;MLC-3:肌球蛋白轻链3亚基。
Figure 8. SDS-PAGE patterns of myofibrillar proteins of Lateolabrax japonicus during frozen storage
表 1 不同速冻方式在贮藏期间鲈鱼最大内源性荧光强度
Table 1 Maximum endogenous fluorescence intensity of Lateolabrax japonicus during storage in different quick-freezing methods
贮藏
时间(周)液氮速冻 冷冻液速冻 平板速冻 波长
(nm)荧光
强度波长
(nm)荧光
强度波长
(nm)荧光
强度0 338.6 232.23 338.6 232.23 338.6 232.23 1 336.4 716.37 336.4 717.53 338 687.63 2 337 521.4 335.8 508.3 336.4 445.87 4 336 626.97 335 661.63 335 623.6 12 335.8 1013 336.8 895.2 336.6 889.97 24 335.2 1452.33 334 1406.33 335.4 1495 表 2 冻藏大口黑鲈的蛋白类指标速冻方式和贮藏时间的双因素方差分析结果
Table 2 Results of two-factor analysis of variance for the quick-freezing method and storage time of the protein index of frozen Lateolabrax japonicus
指标/因素 速冻方式 贮藏时间 速冻方式&贮藏时间 F(df=2) P-value F(df=5) P-value F(df=10) P-value 盐溶性蛋白 1.466 0.244 16.789 1.502×10−8 0.592 0.810 总巯基 1.802 0.179 64.230 1.110×10−16 1.238 0.301 活性巯基 5.429 0.012 0.812 0.554 1.181 0.354 Ca2+-ATPase酶活 1.145 0.336 1.877 0.139 0.565 0.824 羰基 0.082 0.922 1.422 0.256 0.519 0.858 表面疏水性 2.883 0.069 283.259 0.000 4.444 4.221×10−4 最大荧光强度 21.779 6.327×10−7 7068.047 0.000 20.420 5.777×10−12 表 3 不同速冻处理对冻藏期间鲈鱼肌原纤维蛋白质生化特性的相关性分析
Table 3 Correlation analysis of different quick-freezing treatments on the biochemical characteristics of Lateolabrax japonicus myofibril Protein during frozen storage
指标 盐溶性蛋白 总巯基 活性巯基 Ca2+-ATPase酶活 羰基 表面疏水性 最大荧光强度 Co MHC Ac TNT MLC-3 盐溶性蛋白 1 总巯基 −0.070 1 活性巯基 0.146 0.751** 1 Ca2+-ATPase酶活 0.743** −0.294* 0.017 1 羰基 −0.697** 0.066 −0.189 −0.823** 1 表面疏水性 −0.587** −0.057 −0.267 −0.686** 0.804** 1 最大荧光强度 −0.599** −0.077 −0.353** −0.634** 0.824** 0.921** 1 Co −0.166 0.134 0.210 −0.158 −0.045 −0.325* −0.258 1 MHC 0.108 −.545** −0.269* 0.267 −0.325* −0.438** −0.442** 0.603** 1 Ac −0.280* −0.265 −0.105 −0.197 0.131 −0.001 0.023 0.753** 0.765** 1 TNT 0.078 −0.166 0.193 0.350** −0.199 −.298* −0.290* 0.449** 0.551** 0.590** 1 MLC-3 −0.273* 0.087 0.237 −0.293* 0.226 −.014 0.014 0.827** 0.479** 0.832** 0.480** 1 注:*表示显著相关,P<0.05;**表示极显著相关,P<0.01。 -
[1] 农业部渔业渔政管理局. 2020中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2020: 1−158. Fishery and Fishery Administra-tion Bureau of the Ministry of Agriculture. 2020 China fishery statistics yearbook[M]. Beijing: China Agriculture Press, 2020: 1−158.
[2] 吴燕燕, 李冰, 朱小静, 等. 养殖海水和淡水鲈鱼的营养组成分析比较[J]. 食品工业科技,2016,37(20):348−352. [Wu Yanyan, Li Bing, Zhu Xiaojing, et al. Analysis and comparison of nutritional composition of cultured seawater and freshwater sea bass[J]. Food Industry Science and Technology,2016,37(20):348−352. [3] 邓锦锋, 王安利, 周初霞, 等. 鲈鱼的营养研究进展[J]. 饲料工业,2006,27(10):59−60. [Deng Jinfeng, Wang Anli, Zhou Chuxia, et al. Nutritional research progress of sea bass[J]. Feed Industry,2006,27(10):59−60. doi: 10.3969/j.issn.1001-991X.2006.10.017 [4] 郭园园, 孔保华. 冷冻贮藏引起的鱼肉蛋白质变性及物理化学特性的变化[J]. 食品科学,2011,32(7):335−340. [Guo Yuanyuan, Kong Baohua. Fish protein denaturation and changes in physical and chemical properties caused by frozen storage[J]. Food Science,2011,32(7):335−340. [5] 王联珠, 谭乐义, 陈远惠, 等. 我国冷冻水产品质量状况及发展前景[J]. 海洋水产研究,2002,23(2):83−88. [Wang Lianzhu, Tan Leyi, Chen Yuanhui, et al. The quality status and development prospects of frozen aquatic products in my country[J]. Marine Fisheries Research,2002,23(2):83−88. [6] Benjakul S, Sutthipan N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology,2009,42(3):723−729. doi: 10.1016/j.lwt.2008.10.003
[7] 鲁裙. 液氮深冷速冻对带鱼和银鳍品质及其肌肉组织的影响[D]. 杭州: 浙江大学, 2015. Lu Qun. The effect of liquid nitro-gen deep freezing and quick freezing on the quality and muscle tissue of hairtail and silver fin[D]. Hangzhou: Zhejiang University, 2015.
[8] Hamre K, Lie Ø, Sandnes K. Development of lipid oxidation and flesh colour in frozen stored fillets of Norwegian spring-spawning herring (Clupea harengus L.). Effects of treatment with ascorbic acid[J]. Food Chemistry,2003,82(3):447−453. doi: 10.1016/S0308-8146(03)00070-0
[9] Sun Q, Sun F, Xia X, et al. The comparison of ultrasound-assisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J]. Ultrasonics Sono-chemistry,2019,51:281−291. doi: 10.1016/j.ultsonch.2018.10.006
[10] Careche M, Tejada M. Hake natural actomyosin interaction with free fatty acids during frozen storage[J]. Journal of the Science of Food and Agriculture,1994,64(4):501−507. doi: 10.1002/jsfa.2740640417
[11] Yuan C, Yu K, Chen S, et al. Effect of freezing rate on the denaturation of myofibrillar protein in fish muscle[J]. Transactions of the Japan Society of Refrigerating and Air Conditioning Engineers,2006,23(3):329−334.
[12] Liang D, Lin F, Yang G, et al. Advantages of immersion freezing for quality preservation of litchi fruit during frozen storage[J]. LWT-Food Science and Technology,2015,60(2):948−956. doi: 10.1016/j.lwt.2014.10.034
[13] Yang F, Jing D, Diao Y, et al. Effect of immersion freezing with edible solution on freezing efficiency and physical properties of obscure pufferfish (Takifugu obscurus) fillets[J]. LWT,2020,118:108762. doi: 10.1016/j.lwt.2019.108762
[14] 任丽娜. 白鲢鱼肉肌原纤维蛋白冷冻变性的研究[D]. 无锡: 江南大学, 2014. Ren Lina. Study on frozen denaturation of silver carp myofibrillar protein[D]. Wuxi: Jiangnan University, 2014.
[15] 董开成. 不同低温预处理对小黄鱼贮藏过程中品质的影响[D]. 杭州: 浙江大学, 2015. Dong Kaicheng. The effect of diffe-rent low-temperature pretreatments on the quality of small yellow croaker during storage[D]. Hangzhou: Zhejiang University, 2015.
[16] 石钢鹏, 周俊鹏, 章蔚, 等. 超高压与热烫预处理对克氏原螯虾肉冻藏品质的影响[J]. 食品工业科技,2020,41(15):288−296, 322. [Shi Gangpeng, Zhou Junpeng, Zhang Wei, et al. Effects of ultra-high pressure and blanching pretreatment on the quality of frozen Procambarus clarkii[J]. Food Industry Science and Technology,2020,41(15):288−296, 322. [17] 李清正, 张顺亮, 罗永康, 等. 温度对复合肌原纤维蛋白结构及其表面疏水性的影响[J]. 肉类研究,2017,31(2):6−10. [Li Qingzheng, Zhang Shunliang, Luo Yongkang, et al. The effect of temperature on the structure of composite myofibril protein and its surface hydrophobicity[J]. Meat Research,2017,31(2):6−10. doi: 10.7506/rlyj1001-8123-201702002 [18] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature,1970,227(5259):680−685. doi: 10.1038/227680a0
[19] 朱姝冉, 张淼, 周光宏, 等. 利用光谱技术分析加热温度对肌红蛋白结构的影响[J]. 食品工业科技,2018,39(24):35−39. [Zhu Shuran, Zhang Miao, Zhou Guanghong, et al. Analysis of the influence of heating temperature on the structure of myoglobin using spectroscopy[J]. Food Industry Science and Technology,2018,39(24):35−39. [20] 向迎春, 黄佳奇, 杨志坚, 等. 冻结方式对凡纳滨对虾贮藏中组织冰晶及品质的影响[J]. 食品工业科技,2018,39(5):280−286. [Xiang Yingchun, Huang Jiaqi, Yang Zhijian, et al. Effects of freezing methods on ice crystals and quality of Litopenaeus vannamei in storage[J]. Science and Technology of Food Industry,2018,39(5):280−286. [21] Kaale L D, Eikevik T M, Bardal T, et al. The effect of cooling rates on the ice crystal growth in air-packed salmon fillets during superchilling and superchilled storage[J]. International Journal of Refrigeration,2013,36(1):110−119. doi: 10.1016/j.ijrefrig.2012.09.006
[22] 丁玉庭, 陈艳, 邹礼根, 等. 猪PSE肉与正常肉肌原纤维蛋白质抽提率和持水性的比较研究[J]. 中国食品学报,2004,.4(2):62−65. [Ding Yuting, Chen Yan, Zou Ligen, et al. Comparative study on protein extraction rate and water holding capacity of pig PSE meat and normal meat myofibril[J]. Chinese Journal of Food Science,2004,.4(2):62−65. doi: 10.3969/j.issn.1009-7848.2004.02.013 [23] 黄莉, 吕鸿皓, 董福家, 等. 骨蛋白水解物和魔芋复配对冷冻鱼糜抗冻效果的研究[J]. 食品工业科技,2014,35(22):139−144. [Huang Li, Lv Honghao, Dong Fujia, et al. Study on the antifreeze effect of bone protein hydrolysate and konjac on frozen surimi[J]. Food Industry Science and Technology,2014,35(22):139−144. [24] Gao W, Huang Y, Zeng X, et al. Effect of soluble soybean polysaccharides on freeze-denaturation and structure of myofibrillar protein of bighead carp surimi with liquid nitrogen freezing[J]. International Journal of Biological Macromolecules,2019,135:839−844. doi: 10.1016/j.ijbiomac.2019.05.186
[25] Makri M. Full length research paper biochemical and textural properties of frozen stored (−22 ℃) gilthead seabream (Sparus aurata) fillets[J]. African Journal of Biotechnology,2009,8(7):1287−1299.
[26] 杨利艳, 曹文红, 章超桦, 等. 冷冻方式对凡纳滨对虾品质特性的影响[J]. 食品与机械,2011(5):156−159, 199. [Yang Liyan, Cao Wenhong, Zhang Chaohua, et al. Effects of freezing methods on the quality characteristics of Litopenaeus vannamei[J]. Food and Machinery,2011(5):156−159, 199. doi: 10.3969/j.issn.1003-5788.2011.05.041 [27] Buttkus H. The sulfhydryl content of rabbit and trout myosins in relation to protein stability[J]. Canadian Journal of Biochemistry,1971,49(1):97−107. doi: 10.1139/o71-015
[28] Levine R L, Wehr N, Williams J A, et al. Determination of carbonyl groups in oxidized proteins[J]. Methods in Molecular Biology,2000,99(1):15.
[29] 朱卫星, 王远亮, 李宗军. 蛋白质氧化机制及其评价技术研究进展[J]. 食品工业科技,2011,32(11):483−486. [Zhu Weixing, Wang Yuanliang, Li Zongjun. Progress in protein oxidation mechanism and its evaluation technology[J]. Science and Technology of Food Industry,2011,32(11):483−486. [30] Estévez M. Protein carbonyls in meat systems: A review[J]. Meat Science,2011,89(3):259−279. doi: 10.1016/j.meatsci.2011.04.025
[31] Sitte N, Merker K, Von Zglinicki T, et al. Protein oxidation and degradation during proliferative senescence of human MRC-5 fibroblasts[J]. Free Radical Biology and Medicine,2000,28(5):701−708.
[32] 文镜, 张春华, 董雨, 等. 蛋白质羰基含量与蛋白质氧化损伤[J]. 食品科学,2003,24(10):153−157. [Wen Jing, Zhang Chunhua, Dong Yu, et al. Protein carbonyl content and protein oxidative damage[J]. Food Science,2003,24(10):153−157. doi: 10.3321/j.issn:1002-6630.2003.10.039 [33] Estevez M, Ventanas S, Heinonen M, et al. Protein carbonylation and water-holding capacity of pork subjected to frozen storage: Effect of muscle type, premincing, and packaging[J]. Journal of Agricultural & Food Chemistry,2011,59(10):5435−5443.
[34] 卢涵. 鳙鱼肉低温贮藏过程中蛋白氧化、组织蛋白酶活性与品质变化规律的研究[D]. 北京: 中国农业大学. Lu Han. Study on protein oxidation, cathepsin activity and quality changes during low-temperature storage of bighead carp meat[D]. Beijing: China Agricultural University.
[35] 蒋祎人, 李涛, 刘友明, 等. 丙二醛氧化修饰对白鲢肌原纤维蛋白结构性质的影响[J]. 食品科学,2020,41(6):1−7. [Jiang Yiren, Li Tao, Liu Youming, et al. The effect of malondialdehyde oxidative modification on the structure and properties of silver carp myofibril protein[J]. Food Science,2020,41(6):1−7. doi: 10.7506/spkx1002-6630-20190411-143 [36] 赵亚, 石启龙, 曹淑敏. 南美白对虾贮藏期间Ca2+-ATPase活力变化规律与机制[J]. 食品科学,2018,39(5):258−264. [Zhao Ya, Shi Qilong, Cao Shumin. The law and mechanism of Ca2+-ATPase activity change of Penaeus vannamei during storage[J]. Food Science,2018,39(5):258−264. doi: 10.7506/spkx1002-6630-201805039 [37] 鲁珺. 液氮深冷速冻对带鱼和银鲳品质及其肌肉组织的影响[D]. 杭州: 浙江大学, 2015. Lu Jun. The effect of liquid nitro-gen deep freezing and quick freezing on the quality and muscle tissue of hairtail and silver pomfret[D]. Hangzhou: Zhejiang University, 2015.
[38] 曾名勇, 黄海, 李八方. 鳙肌肉蛋白质生化特性在冻藏过程中的变化[J]. 水产学报,2003,27(5):480−485. [Zeng Mingyong, Huang Hai, Li Bafang. Changes in the biochemical properties of bighead carp muscle protein during freezing storage[J]. Journal of Fisheries,2003,27(5):480−485. [39] 闫春子, 夏文水, 许艳顺. 超高压对草鱼肌原纤维蛋白结构的影响[J]. 食品与生物技术学报,2018,37(4):424−428. [Yan Chunzi, Xia Wenshui, Xu Yanshun. The effect of ultra-high pressure on the structure of grass carp myofibril protein[J]. Journal of Food and Biotechnology,2018,37(4):424−428. doi: 10.3969/j.issn.1673-1689.2018.04.014 [40] Riebroy S, Benjakul S, Visessanguan W, et al. Acid-induced gelation of natural actomyosin from Atlantic cod (Gadus morhua) and burbot (Lota lota)[J]. Food Hydrocolloids,2009,23(1):26−39. doi: 10.1016/j.foodhyd.2007.11.010
[41] Zhou A, Benjakul S, Pan K, et al. Cryoprotective effects of trehalose and sodium lactate on tilapia (Sarotherodon nilotica) surimi during frozen storage[J]. Food Chemistry,2006,96(1):96−103. doi: 10.1016/j.foodchem.2005.02.013
[42] Leelapongwattana K, Benjakul S, Visessanguan W, et al. Physicochemical and biochemical changes during frozen storage of minced flesh of lizardfish (Saurida micropectoralis)[J]. Food Chemistry,2005,90(1−2):141−150. doi: 10.1016/j.foodchem.2004.03.038
[43] Wang K, Sun D W, Pu H, et al. Principles and applications of spectroscopic techniques for evaluating food protein conformational changes: A review[J]. Trends in Food Science & Technology,2017,67:207−219.
[44] 袁春红, 陈舜胜, 程裕东, 等. 冻结条件与冻藏温度对鲤鱼肉肌原纤维蛋白冷冻变性的影响[J]. 上海水产大学学报,2001,10(1):44−48. [Yuan Chunhong, Chen shunsheng, Cheng Yudong, et al. The effects of freezing conditions and freezing storage temperature on the freezing denaturation of carp myofibril protein[J]. Journal of Shanghai Fisheries University,2001,10(1):44−48. [45] 郭园园, 孔保华, 夏秀芳, 等. 冷冻-解冻循环对鲤鱼肉物理化学特性的影响[J]. 食品科学,2011,32(13):125−130. [Guo Yuanyuan, Kong Baohua, Xia Fangfang, et al. Effects of freezing thawing cycle on physicochemical properties of carp meat[J]. Food Science,2011,32(13):125−130. [46] Shi L, Beamer S K, Yin T, et al. Mass balance for isoelectric solubilization/precipitation of carp, chicken, menhaden, and krill[J]. LWT-Food Science and Technology,2017,81:26−34. doi: 10.1016/j.lwt.2017.03.029
[47] Maruyama N. Comparison of reactivity of transglutaminase to various fish actomyosins[J]. Fish Sci,1995,61:495−500. doi: 10.2331/fishsci.61.495
[48] Lu H, Zhang L, Li Q, et al. Comparison of gel properties and biochemical characteristics of myofibrillar protein from bighead carp (Aristichthys nobilis) affected by frozen storage and a hydroxyl radical-generation oxidizing system[J]. Food Chemistry,2017,223(May 15):96−103.
[49] Decker E A, Xiong Y L, Calvert J T, et al. Chemical, physical, and functional properties of oxidized turkey white muscle myofibrillar protein[J]. J Agric Food Chem,1993,41(2):186−189. doi: 10.1021/jf00026a007
[50] Shi L, Yin T, Xiong G, et al. Microstructure and physicochemical properties: Effect of pre-chilling and storage time on the quality of channel catfish during frozen storage[J]. LWT,2020:109606.






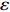

 下载:
下载:







 下载:
下载:
