Correlation Analysis between Properties and Calcium-holding Capacity of Different Casein Phosphopeptide Products
-
摘要: 为探究酪蛋白磷酸肽(CPP)产品性质对其持钙能力的影响,以市面上常见的7种酪蛋白磷酸肽产品为研究对象,测定了酪蛋白磷酸肽含量、氮磷含量及氮磷比(N/P)、分子量分布、氨基酸组成,并对其理化性质与持钙能力进行相关性分析。结果表明,7种产品的酪蛋白磷酸肽含量及N/P结果分别在1.30%~18.50%和12.70~46.80之间,氨基酸含量为70.50~901.00 mg/g,且主要以脯氨酸为主,分子量分布则集中在5000 Da以下(除7号样品)。以不同添加量(0.05、0.1、0.2 g/L)将7种酪蛋白磷酸肽产品加入到模拟反应体系中测定其持钙能力,发现1、2和6号产品的持钙能力较强,7号样品的持钙能力最差。将上述结果进行主成分分析(R1=0.674,R2=0.167),结果表明酪蛋白磷酸肽产品的分子量分布、氨基酸含量以及酪蛋白磷酸肽的含量与其持钙能力强弱存在一定的关联。进一步进行相关性分析发现,分子量>10 kDa的组分含量与酪蛋白磷酸肽样品的持钙能力强弱呈现极显著的负相关性(相关系数−0.985~−0.975,P<0.01),而分子量分布类似且异亮氨酸(相关系数0.766~0.768,P<0.05)和苯丙氨酸(相关系数0.758~0.759,P<0.05)含量较高的CPP样品中则表现更强的持钙能力。本研究为评价和提高酪蛋白磷酸肽产品质量提供了一定的理论依据。Abstract: In order to investigate the influence of the properties of casein phosphopeptide(CPP) on its calcium-holding capacity, the content of CPP, nitrogen and phosphorus content, molecular weight distribution, amino acid composition and content were determined using 7 kinds of commercial CPP products. The correlation between physical and chemical properties and calcium holding capacity was analyzed. The results showed that the CPP content and N/P of 7 kinds of CPP products were 1.30%~18.50% and 12.70~46.80, respectively. The content of total amino acid of 7 kinds of CPP products were 70.50~901.00 mg/g, and proline was the most abundant amino acid among those CPP products. The molecular weight of those CPP products were <5000 Da(except for No.7 CPP products). Meanwhile, the amount of CPP added to the simulated reaction system at different levels(0.05, 0.1, 0.2 g/L) were also determined using those commercial CPP products, No. 1, No. 2 and No. 6 products showed better calcium holding capacity, while No.7 products showed the worst calcium holding capacity. Then the above mentioned results were subjected to principal component analysis(R1=0.674, R2=0.167), the results showed that there was a correlation between the molecular weight distribution, amino acid content and the calcium-holding capacity of CPP products. Further correlation analysis was found that the content of molecular weight >10 kDa showed a highly significant negative correlation with the calcium-holding capacity of CPP samples(correlation coefficient −0.985~−0.975, P<0.01), while CPP samples with similar molecular weight distribution and higher content of isoleucine(correlation coefficient 0.766~0.768, P<0.05) and phenylalanine(correlation coefficient 0.758~0.759, P<0.05) showed a stronger calcium-holding capacity. This study provided a theoretical basis for evaluating and improving the quality of CPP products.
-
酪蛋白磷酸肽(Casein Phosphopeptide,CPP)是以牛乳酪蛋白为原料,经过酶水解、分离纯化得到的一种含有磷酸丝氨酸簇的生物活性多肽,其相对分子质量为1000~5000 Da[1-2]。研究表明,酪蛋白磷酸肽中特殊的磷酸丝氨酸簇等核心结构具有螯合钙等矿物离子的能力,特别是能在小肠中性或偏碱性的环境中与钙离子鳌合成钙盐,从而抵抗消化道中各种消化酶的水解并阻止钙离子形成磷酸钙沉淀[3-4]。此外,酪蛋白还被证明能够有效地增加钙在体内的滞留时间,同时促进肠壁细胞对钙离子的吸收和利用[5-6]。
钙是人体中含量最丰富的矿物质元素,约占成年人体重的1.5%~2.0%左右[7]。而钙缺乏会导致儿童生长发育不良、骨质疏松、佝偻病等情况的发生[8]。我国营养调查显示,儿童、青少年、孕妇和老年人普遍存在缺钙的现象[9]。酪蛋白磷酸肽作为一种良好促钙吸收剂能够有效地提高钙的吸收利用率,从而预防佝偻病、龋齿、儿童发育不良等疾病[10-12]。我国目前已经逐步将酪蛋白磷酸肽作为营养强化剂应用于婴幼儿奶粉、钙强化乳制品、蛋白饮料和营养补充剂等[13-14]。
然而由于加工原料和制备方法的差异,不同酪蛋白磷酸肽组分性质差异较大。前人的研究表明酪蛋白磷酸肽产品的氨基酸组成和排序、水解度等对磷酸基结合钙的能力会产生很大的影响[2,13,15]。因此,本研究对不同酪蛋白磷酸肽产品的性质进行分析,并通过体外模拟实验考察这些酪蛋白磷酸肽产品在不同添加量剂量下的持钙能力,基于主成分分析和相关性分析的方法研究不同酪蛋白磷酸肽产品特性影响其持钙能力的关键因素,为酪蛋白磷酸肽在食品中更好的应用提供一定的依据。
1. 材料与方法
1.1 材料与仪器
7种市面上在售商业化酪蛋白磷酸肽产品 采购自7家不同的生物科技公司;乙腈、甲醇、甲酸 色谱纯,美国Tedia公司;异硫氰酸苯酯、正亮氨酸 天津博纳艾尔杰有限公司;实验室超纯水 由美国MiLLipore公司纯水净化系统制备;无水乙醇、氯化钡、三氟乙酸、盐酸、三乙胺、醋酸钠、冰醋酸 分析纯,中国上海国药化学试剂有限公司。
2695高效液相色谱串联四极杆质谱、2690超高效液相色谱串联四极杆质谱 美国Waters公司;3K15冷冻离心机 美国Sigma公司;AX205电子天平、FE20 pH计 瑞士Mettler Toledo公司;DHG-9070A鼓风干燥烘箱 中国常州金坛仪器有限公司;TDL-5-A型台式离心机 中国上海安亭仪器厂。
1.2 实验方法
1.2.1 CPP含量测定
根据文献[1,16]:准确称取5.0 g CPP样品,加入40 mL超纯水,充分搅拌振荡使其溶解,用0.1 mol/L盐酸将pH调至4.5并用超纯水将体积定容至50 mL,室温下静置60 min。随后将溶液在室温条件下5000×g离心30 min收集上清液,同时将沉淀重复上述步骤处理。将以上步骤所得的上清液混合,并用超纯水将体积定容至100 mL。接下来加入BaCl2,使其浓度达到50 mmol/L,充分搅拌后加入100 mL无水乙醇充分振荡后置于4 ℃冰箱中静置24 h,同样的在室温条件下5000×g离心30 min收集上清液。继续向沉淀中加入100 mL 50%的乙醇(搅拌破碎沉淀),并且在室温条件下5000×g离心30 min。重复该步骤搅拌离心两次,将所得的沉淀在60 ℃的条件下减压干燥24 h(真空度≤24 mm Hg)。最终称量所得的沉淀质量并通过以下公式计算CPP含量:
(1) 式中:c:CPP含量,%;m1:干燥后的乙醇钡沉淀的质量,g;m2:称样的质量,g。
1.2.2 CPP总氮、总磷含量及N/P(摩尔比)的计算
根据GB 5009.5-2016《食品中蛋白质的测定》中凯氏定氮法测定[17]。CPP中总磷的含量采用X射线荧光仪测定。将CPP中总氮和总磷的含量通过公式计算得到N/P(摩尔比)[2,18]:
(2) 式中:n:N/P摩尔比;n1:N的质量百分含量,%;n2:P的质量百分含量,%;31:P的相对分子质量,g/mol;14:N的相对分子质量,g/mol。
1.2.3 CPP的氨基酸组成
根据文献[19],准确称取一定量的CPP样品(使样品氨基酸总量在50~75 mg范围内),置于15 mL水解管中,随后加入10 mL 6 mol/L盐酸,充分振摇使CPP样品均匀分散于溶液中,同时充N2 3 min混匀密封。然后置110 ℃烘箱中水解24 h,取出冷却后加入4.8 mL 10 mol/L NaOH中和水解液。之后将水解液全部转移到50 mL容量瓶内,用超纯水定容至刻度,混匀。定容后的样液用双层滤纸过滤,收集滤液在15000×g下离心15 min,取上清液供衍生使用。
准确量取样品溶液或氨基酸混合标准品溶液200 μL,置于1.5 mL塑料离心管中,准确加入20 μL正亮氨酸内标溶液,三乙胺乙腈溶液100 µL,异硫氰酸苯酯乙腈溶液100 µL,充分振荡混匀,室温条件下静置2 h,然后加入正己烷400 µL,充分振摇萃取后放置20 min,取下层溶液,用0.45 µm微孔滤膜过滤。
HPLC条件如下:色谱柱:Venusil-AA氨基酸分析专用柱(100 Å,4.6 mm×250 mm,5 μm);检测波长:254 nm;柱温:40 ℃;流动相A:称取15.2 g无水醋酸钠,加水1850 mL,溶解后用冰醋酸调pH至6.5,然后加乙腈140 mL,混匀,用0.45 µm滤膜过滤。流动相B:80%(v/v)乙腈溶液,进样量:10 µL。
1.2.4 CPP的分子量分布
根据文献[2],经过适当修改后用于测定CPP样品的分子量分布情况。具体操作如下:配制浓度为10 mg/mL的CPP样品,采用Waters高效液相色谱仪(配2487紫外检测器),对酪蛋白磷酸肽的分子量分布进行测定。
HPLC条件如下:色谱柱:TSKgel2000 SWXL(300 mm×7.8 mm);流动相:乙腈/水/三氟乙酸,45/55/0.1(v/v);检测波长:220 nm;流速:0.5 mL/min;柱温:30 ℃;进样量:10 μL。
1.2.5 CPP的持钙能力分析
根据文献[2,15,20]并经过适当调整:由于钙离子进入人体后易与人体内的磷酸根离子结合生成磷酸钙沉淀,不能被人体吸收,而CPP具有螯合钙离子、阻止生成磷酸钙沉淀的作用,因此建立与人体温(37 ℃)、小肠末端pH条件(pH=7.2)相同的模拟反应体系。向模拟反应体系中引入磷酸根离子和CPP,然后加入钙离子,观察CPP阻止磷酸钙沉淀的效果并用pH-Stat法检测。
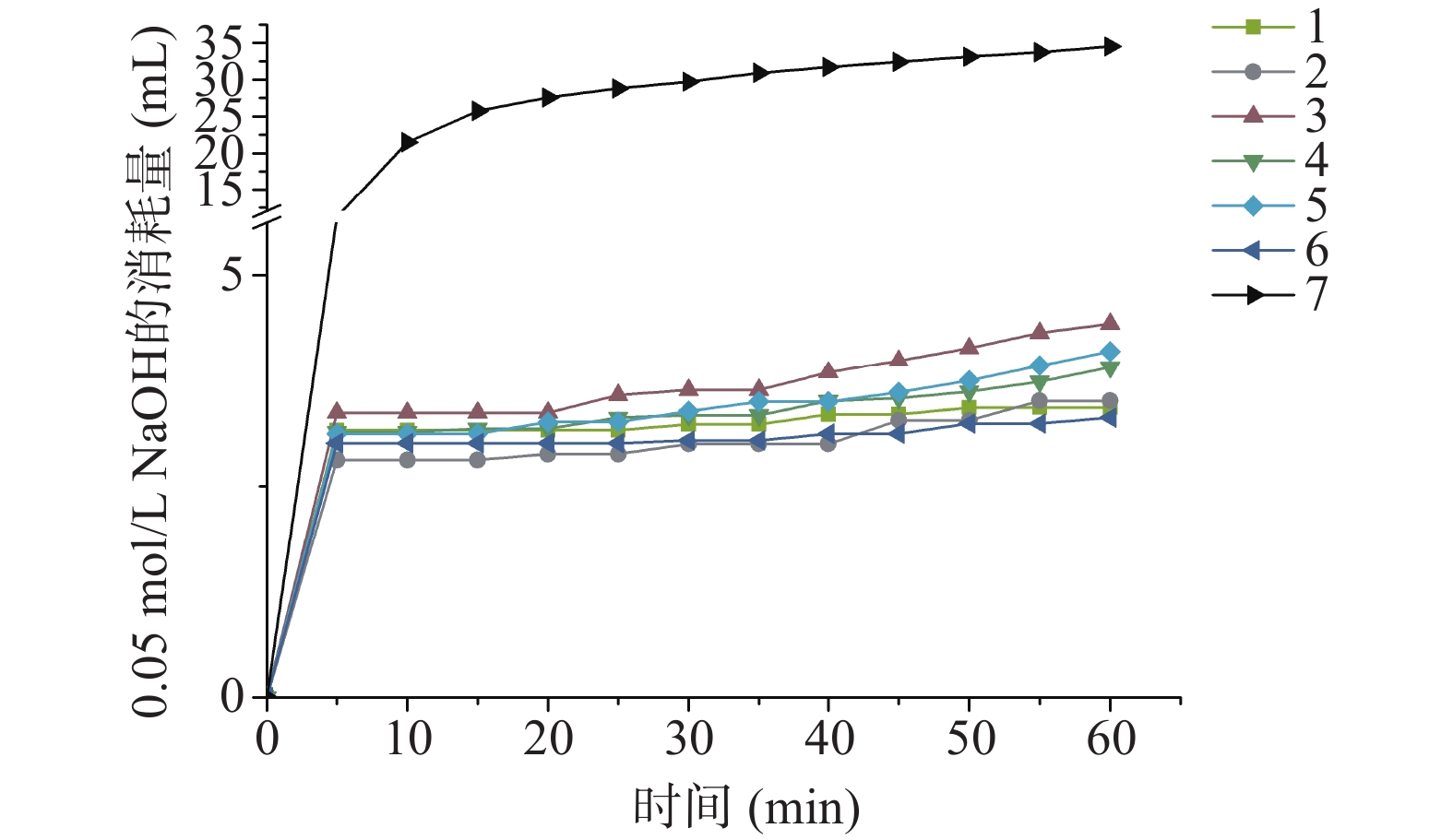
具体实验步骤如下:向酶反应器中加入适量NaH2PO4和CPP,使二者在模拟反应体系中的浓度分别为8 mmol/L和0.05、0.1、0.2 g/L。将模拟反应体系溶液加热至37 ℃保温后加入0.1 mol/L的CaCl2溶液,使模拟反应体系中 CaCl2的浓度为8 mmol/L,并且模拟反应体系中Ca:P(摩尔比)=1:1,其中P是由NaH2PO4所提供的以不同解离状态存在的磷酸根中的磷。接下来立即用0.05 mol/L的NaOH溶液,在2 min内将反应体系的pH调节至7.2,并不断滴加0.05 mol/L NaOH,使模拟反应体系的pH保持在7.2。从调节pH开始计时的第2 min开始,每隔5 min记录一次0.05 mol/L NaOH的消耗量,持续1 h。以时间为横坐标,0.05 mol/L NaOH的消耗量为纵坐标作图。
1.3 数据处理
所有的实验都重复三次,且实验结果用平均值±标准偏差来表示。采用Stastistics(9.1版本)中的一般线性模型程序进行显著性分析(P<0.05),并且使用最小显著差异(LSD)法进行全配对多重比较。本研究还进一步采用瑞士Umetrics公司的SIMCA 13.0软件进行主成分分析(Principle Component Analysis, PCA)对不同CPP产品的理化性质降维处理,比较不同CPP产品理化性质的差异。选取PCA中的主要贡献因素并进一步通过SPSS 19.0软件中的Pearson线性关系模型对CPP产品理化性质和其持钙能力的强弱相关性进行分析。
2. 结果与分析
2.1 不同产品的CPP含量
本研究测定了7种样品中CPP的含量,结果见表1。结果表明不同样品之间CPP含量存在明显差异,4号样品中CPP含量最高为18.50%(P<0.05),其次是3号和6号样品,2号和5号样品中CPP含量较低,仅有7%~8%左右,而CPP含量最低的是7号样品,仅为1.30%左右。
2.2 不同产品中总氮、总磷含量及N/P比
从表2的结果来看,除7号样品之外不同CPP样品中氮元素含量差异不大,所有样品中1号样品磷元素含量最高。N/P是评价CPP质量的一个重要指标,N/P>24为高N/P CPP,15~24为中N/P CPP,而<15为低N/P CPP[2,21]。本研究中7种样品除1号和7号样品外均为高N/P CPP,且6号CPP样品N/P最高,其次是2号和5号样品。
表 2 CPP中N、P含量及比值Table 2. N and P content and ratio in CPP物料编号 N含量(%) P含量(%) N/P 1 11.70±0.32b 1.57±0.15a 16.50 2 12.90±0.21a 0.74±0.03c 38.80 3 11.90±0.33b 0.96±0.11b 27.40 4 11.80±0.47b 0.81±0.04bc 32.20 5 12.20±0.18b 0.74±0.13b 36.50 6 13.30±0.28a 0.72±0.19b 46.80 7 9.01±0.46c 0.71±0.22b 12.70 2.3 不同产品中氨基酸组成及含量
本研究采用酸水解和PITC衍生法对7种CPP样品进行了前处理,并用HPLC结合氨基酸分析专用液相色谱柱测定了7种CPP样品中氨基酸的组成和含量,结果如表3所示。从总氨基酸含量结果来看,2号样品中总氨基酸含量最高,7号样品中总氨基酸含量显著低于其它样品(P<0.05),而其它各样品中总氨基酸含量差异不明显。比较各样品中氨基酸组成来看,各CPP样品中谷氨酸含量较高,其次还含有一定量的亮氨酸和异亮氨酸,这与文献结果相似[2,21-23]。表3结果还显示,7种样品中脯氨酸含量均最高,且显著高于其他种类氨基酸(P<0.05),这与徐曼和王青华等测定的自制CPP以及商业CPP的氨基酸组成结果存在明显差异[15,22]。文献中报道的CPP中脯氨酸的含量在30~90 mg/g之间[15,22],本研究中除7号CPP样品之外,其它样品的脯氨酸含量为168.00~369.00 mg/g。参考文献报道的结果来看[24-26],一般牛乳中氨基酸含量最高的是谷氨酸,脯氨酸含量一般在100 mg/g左右,推测本研究中所购买的7种商品化CPP产品脯氨酸含量较高可能与原料选择以及制备方法有关。
表 3 CPP中氨基酸组成及含量(mg/g)Table 3. Composition and content of amino acid in CPP(mg/g)氨基酸 1 2 3 4 5 6 7 Asp 4.35±0.03d 8.62±0.12a 4.48±0.21cd 4.84±0.11bc 5.27±0.33b 4.83±0.09bc 5.24±0.14b Glu 77.80±2.13b 136.00±5.87a 60.20±5.03c 57.5±3.73c 70.70±2.18b 60.50±2.44c 15.40±1.51d Ser 9.35±1.96b 14.50±1.07a 6.93±0.83b 7.25±1.01b 8.69±0.53b 7.63±0.72b 3.98±0.50c Gly 9.01±2.69a 8.30±1.53a 3.84±0.74b 4.21±1.82b 5.26±1.43b 4.49±0.93b 1.40±0.34c His 9.21±0.85c 31.50±4.75a 15.50±3.99b 15.0±4.28b 17.20±3.86b 18.00±4.04b 1.61±0.41d Arg 10.50±0.78b 14.40±1.21a 6.65±0.60c 7.25±0.73c 9.26±0.65b 7.84±0.33c 2.41±0.53d Thr 28.60±3.31c 71.30±8.50a 31.60±4.69b 33.6±4.28bc 37.60±5.75b 38.50±2.07b 2.95±0.42d Ala 8.61±2.15b 14.00±3.77a 6.70±1.09c 7.03±1.00c 8.43±2.23b 7.67±0.80c 2.21±0.13d Pro 168.00±9.98c 369.00±21.60a 286.00±17.50b 257.00±20.00b 280.00±16.20b 302.00±35.90b 6.76±1.96d Tyr 17.30±4.03b 30.20±6.22a 12.00±2.77b 13.7±1.09b 17.40±2.43b 15.00±4.11b 3.86±1.52c Val 19.70±5.51b 36.30±8.24a 17.70±3.90b 17.60±4.14b 20.60±2.99b 19.40±2.73b 4.22±1.86c Met 7.72±0.99b 14.40±5.87a 7.23±3.71b 7.03±2.02b 8.15±1.76b 7.86±2.75b 1.88±0.63c Cys 1.77±0.01c 5.30±1.77a 2.95±0.40b 2.83±0.58b 2.25±0.66bc 2.76±0.37b 0.19±0.00d Ile 20.70±5.57b 41.10±7.14a 20.80±3.86b 20.30±6.07 23.00±3.99b 22.60±5.50b 3.31±1.00c Leu 15.20±1.71c 63.10±8.22a 31.80±6.93b 30.80±7.04b 34.60±3.07b 34.30±4.73b 6.48±0.72d Phe 20.00±3.86b 42.10±5.19a 22.00±4.29b 20.60±3.33b 22.90±1.88b 23.40±2.00b 3.40±0.75c Lys 9.10±2.23a 0.85±0.14c 0.62±0.08c 0.58±0.13c 9.92±1.44a 0.58±0.00c 5.13±1.11b 总量 438.00±41.00c 901.00±92.20a 537.00±71.40b 507.00±49.50bc 581.00±62.30b 578.00±66.90b 70.50±21.80d 注:同行不同小写字母表示差异显著,P<0.05。 2.4 不同产品中CPP的分子量分布
本研究采用HPLC法对7种样品的分子量分布情况进行了分析测定,结果如表4所示。1~6号CPP样品的分子量主要集中在5000 Da以下,如3和4号样品分子量80%以上集中在1000 Da以下,2和5号样品中约80%样品分子量集中在5000 Da以下,这与文献的CPP分子量结果基本相符[2,21-22,27]。而7号CPP样品分子量仅有20%左右小于5000 Da,一般认为酪蛋白磷酸肽的分子量在5000 Da以下,7号样品分子量仅有20%左右小于5000 Da也与前面测定发现的7号样品CPP含量较低相符合。
表 4 CPP中分子量分布(%)Table 4. Molecular weight distribution in CPP(%)物料编号 >10000 Da 5000~10000 Da 1000~5000 Da <1000 Da 1 2.70±0.02d 6.82±0.39d 55.40±0.14a 35.10±0.52b 2 10.80±0.23b 16.20±0.22a 42.40±0.28b 30.70±0.30c 3 0.15±0.00f 0.37±0.01f 12.10±0.21c 87.40±0.21a 4 1.60±0.02e 0.85±0.01e 14.80±0.32c 82.70±0.33a 5 6.89±0.15c 12.60±0.27b 44.50±0.03b 36.00±0.45b 6 7.12±0.00c 12.30±0.00b 43.80±0.40b 36.70±0.40b 7 66.80±0.17a 10.20±0.11c 9.60±0.25d 13.40±0.31d 2.5 不同CPP样品在不同添加量条件下的持钙能力
本研究比较不同CPP样品在不同添加量情况下的持钙能力,结果如图1~图3所示。从磷酸钙沉淀形成的时间来看,1~7号CPP样品按照0.05、0.1和0.2 g/L加入模拟反应体系后磷酸钙沉淀开始生成的时间大约都在5~15 min左右,不同CPP样品对于磷酸钙沉淀生成的时间没有明显影响,整体上7种CPP样品的持钙能力呈现出随着添加量的增加而增强趋势。比较不同CPP样品在添加量为0.05、0.1和0.2 g/L时的持钙能力结果来看,1、2和6 号样品中NaOH的消耗量最少,表明这三种CPP样品在三种添加量条件下的持钙能力均较强,其次是4号CPP样品,3号和5号CPP样品的持钙能力略差于前面四种样品,7号CPP样品持钙能力极差。结合之前对7种CPP样品的几项指标测试结果来看,7号样品的CPP含量最低,且大多为分子量高于10000 Da的大分子,同时N/P最低,这些可能都是造成7号CPP样品持钙能力明显弱于其它样品的原因[2,15]。而比较其它样品来看,6号CPP样品N/P最高,且CPP含量为15.20%;2号CPP样品虽然CPP含量不高,但氨基酸含量明显高于其它样品;4号样品CPP含量最高,且分子量分布主要集中在1000 Da以内,这些CPP样品以不同添加量加入模拟反应体系中的持钙能力有明显的差异。因此,CPP产品性质与持钙能力的关联还需要进一步分析。
2.6 CPP样品性质与持钙能力的主成分分析及相关性分析
根据CPP产品理化性质的分析结果以及不同添加量情况下的持钙能力研究结果来看,不同CPP产品的理化性质存在明显差异,并且持钙能力同样存在明差异。但其中的信息复杂重叠,大量的结果造成了分析的困难。因此,本研究采用主成分分析的方法,对CPP的氨基酸组成及含量、分子量分布情况、N/P比、CPP含量以及持钙能力的结果进行筛选分析,能够剔除不重要的信息,消除指标间的重叠性,从而简化分析过程[28-29]。
主成分分析的得分图和载荷图见图5和图6,由得分图可知前两个主成分的累计贡献率为84.1%(R1=0.674,R2=0.167),其中主成分1代表数据集中所有变量的67.4%的信息,能够在很大程度上反映数据集的信息,主成分2代表16.7%,两个主成分的累积贡献率大于80%,能够很好地代表所有变量的信息[28-29]。载荷图反映了由主成分1和主成分2构成的线性方程的系数的结果,载荷的绝对值越大,该因素对主成分的影响就越大,这个影响在图中通过载荷代表的点到原点的距离来反映。如果载荷离原点较远,表示这个因素对样品间的差异存在显著的贡献[30]。由载荷图可知,对主成分1有显著贡献的指标为大多数氨基酸的含量、分子量>10000 Da的组分比例以及持钙能力的结果。对主成分2有显著贡献的指标为分子量在5000~10000 Da以及<1000 Da的组分比例、天冬氨酸含量、赖氨酸含量和CPP含量。结合主成分得分图和载荷图,可以描述CPP样品性质特征与持钙能力之间的关联。在得分图中(图5),7号CPP样品分布在得分图的左下侧区域,结合载荷图(图6)分布结果来看,7号CPP样品分子量大于10000 Da的比例最高且赖氨酸含量较高,而7号CPP样品在不同添加量条件下持钙能力测试中氢氧化钠消耗量较高,表明持钙能力较差。2号CPP样品分布在得分图的右下侧区域,结合载荷图分布结果来看,2号CPP样品除赖氨酸之外的其它氨基酸的含量较高,同时持钙能力较强。其余CPP样品主要分布在得分图的中间区域,其中3号和4号样品分布在得分图的上侧区域,结合载荷图分布结果来看。这些样品的CPP含量以及分子量小于1000 Da的组分含量明显高于其它样品,同时持钙能力要强于7号样品。从主成分分析的结果来看,分子量大于10000 Da的组分含量较高以及赖氨酸含量较高的样品持钙能力较差。而苯丙氨酸、异亮氨酸、缬氨酸等氨基酸的含量较高,分子量小于1000和1000~5000 Da组分的含量以及CPP含量较高的CPP样品持钙能力较强。同时,结果提示这些主成分分析中的主要贡献因素包括分子量分布、氨基酸含量以及CPP含量与CPP样品的持钙能力强弱存在一定关联。
![]() 图 6 7种CPP样品的主成分分析载荷图注:CHC1:CPP添加量为0.05 g/L的持钙能力测试中氢氧化钠消耗量;CHC2:CPP添加量为0.1 g/L的持钙能力测试中氢氧化钠消耗量;CHC3:CPP添加量为0.2 g/L的持钙能力测试中氢氧化钠消耗量;Mw1:分子量大于10000 Da的组分含量;Mw2:分子量5000~10000 Da的组分含量;Mw3:分子量1000~5000 Da的组分含量;Mw4:分子量小于1000 Da的组分含量;Content:CPP含量。Figure 6. Principal component analysis loadings for 7 CPP samples
图 6 7种CPP样品的主成分分析载荷图注:CHC1:CPP添加量为0.05 g/L的持钙能力测试中氢氧化钠消耗量;CHC2:CPP添加量为0.1 g/L的持钙能力测试中氢氧化钠消耗量;CHC3:CPP添加量为0.2 g/L的持钙能力测试中氢氧化钠消耗量;Mw1:分子量大于10000 Da的组分含量;Mw2:分子量5000~10000 Da的组分含量;Mw3:分子量1000~5000 Da的组分含量;Mw4:分子量小于1000 Da的组分含量;Content:CPP含量。Figure 6. Principal component analysis loadings for 7 CPP samples因此,为了进一步分析CPP样品性质与持钙能力强弱的关联,基于主成分分析的结果,本研究选择了第一主成分和第二主成分中主要贡献因素包括:丙氨酸、脯氨酸、酪氨酸、缬氨酸、甲硫氨酸、异亮氨酸、苯丙氨酸、赖氨酸,分子量分布情况(>10 kDa,0.5~10 kDa,0.1~0.5 kDa以及<0.1 kDa的比例)以及CPP的含量与CPP的持钙能力进一步进行了相关性分析。结果如表5所示,在不同的CPP添加量条件下,CPP样品中分子量分布>10 kDa的组分比例与持钙能力均呈现极显著的负相关性(P<0.01),即CPP样品分子量>10 kDa的比例越高,持钙能力越差。除此之外,当CPP的添加量为0.1和0.2 g/L时,还发现CPP样品中异亮氨酸和苯丙氨酸的含量与持钙能力表现出显著的正相关性(P<0.05)。相关性分析结果表明,对于不同CPP样品来说分子量>10 kDa的组分比例越高,其持钙能力越差。而对于分子量分布结果相似的CPP样品来说,其异亮氨酸和苯丙氨酸含量越高,其持钙能力更好。目前对于CPP产品理化性质与持钙能力的研究结果主要发现CPP产品水解度、纯度越高,其持钙能力越强[2,15,27]。本研究发现了CPP产品分子量小的组分比例越高,其持钙能力越强,CPP产品分子量小的组分比例高,从本质上来看其实也就反映了CPP产品的水解度和纯度越高。另外,还有研究发现CPP产品的磷酸基密度对持钙能力也有显著影响,而CPP产品的氨基酸组成和排序对其磷酸基密度起到关键影响[2,13,18],但相关研究并没有具体指出哪些氨基酸对持钙能力起到了显著影响,本研究结果则发现了异亮氨酸和苯丙氨酸含量较高的CPP产品其持钙能力更好。
表 5 CPP样品特性与持钙能力的相关性分析Table 5. Correlation analysis of CPP sample characteristics and calcium-holding capacity指标 丙氨酸 脯氨酸 酪氨酸 缬氨酸 甲硫氨酸 异亮氨酸 苯丙氨酸 赖氨酸 分子量
(>10 kDa)分子量
(0.5~10 kDa)分子量
(0.1~0.5 kDa)分子量
(<0.1 kDa)CPP含量 持钙能力(添加量0.05 g/L) 0.720 0.686 0.669 0.723 0.719 0.746 0.738 −0.136 −0.985** 0.010 0.517 0.494 0.746 持钙能力(添加量0.1 g/L) 0.747 0.704 0.7 0.748 0.743 0.768* 0.759* −0.14 −0.975** 0.025 0.543 0.461 0.733 持钙能力(添加量0.2 g/L) 0.743 0.703 0.694 0.744 0.74 0.766* 0.758* −0.159 −0.975** 0.017 0.538 0.467 0.743 注:*表示显著,P<0.05;**表示极显著,P<0.01。 3. 结论
本研究对市场上常见的7种酪蛋白磷酸肽产品的CPP含量、氮磷比、分子量分布、氨基酸组成等主要性质进行了分析测定,同时采用模拟反应体系对7种酪蛋白磷酸肽产品在不同添加量(0.05、0.1、0.2 g/L)情况下的持钙能力进行了分析比较,发现不同产品的性质和持钙能力存在显著的差异。通过主成分分析和相关性分析发现CPP样品中分子量>10 kDa的组分比例与CPP持钙能力强弱呈极显著的负相关性(P<0.01)。而CPP中异亮氨酸和苯丙氨酸的含量与持钙能力表现出显著的正相关性(P<0.05)。研究结果表明,从提高酪蛋白磷酸肽产品持钙能力的角度上考虑,在制备酪蛋白磷酸肽的工艺过程中,应该选择合适的水解途径或水解酶,将酪蛋白磷酸肽产品的分子量尽量控制在10 kDa以下,并适当提高产品异亮氨酸和苯丙氨酸的含量。而从使用酪蛋白磷酸肽产品的角度考虑,也应该重点关注酪蛋白磷酸肽产品的分子量分布(>10 kDa的含量)和异亮氨酸及苯丙氨酸的含量水平,以保证酪蛋白磷酸肽产品能够发挥稳定持钙能力。本文从不同CPP产品的主要性质和持钙能力入手,通过主成分分析和相关性分析的方法,探究CPP原料性质与其持钙能力的关联,为提高以及评价CPP产品质量提供了一定的参考依据。
-
图 6 7种CPP样品的主成分分析载荷图
注:CHC1:CPP添加量为0.05 g/L的持钙能力测试中氢氧化钠消耗量;CHC2:CPP添加量为0.1 g/L的持钙能力测试中氢氧化钠消耗量;CHC3:CPP添加量为0.2 g/L的持钙能力测试中氢氧化钠消耗量;Mw1:分子量大于10000 Da的组分含量;Mw2:分子量5000~10000 Da的组分含量;Mw3:分子量1000~5000 Da的组分含量;Mw4:分子量小于1000 Da的组分含量;Content:CPP含量。
Figure 6. Principal component analysis loadings for 7 CPP samples
表 1 乙醇钡沉淀法测定的样品中CPP含量
Table 1 CPP content in different samples determined by barium ethanol precipitation method
表 2 CPP中N、P含量及比值
Table 2 N and P content and ratio in CPP
物料编号 N含量(%) P含量(%) N/P 1 11.70±0.32b 1.57±0.15a 16.50 2 12.90±0.21a 0.74±0.03c 38.80 3 11.90±0.33b 0.96±0.11b 27.40 4 11.80±0.47b 0.81±0.04bc 32.20 5 12.20±0.18b 0.74±0.13b 36.50 6 13.30±0.28a 0.72±0.19b 46.80 7 9.01±0.46c 0.71±0.22b 12.70 表 3 CPP中氨基酸组成及含量(mg/g)
Table 3 Composition and content of amino acid in CPP(mg/g)
氨基酸 1 2 3 4 5 6 7 Asp 4.35±0.03d 8.62±0.12a 4.48±0.21cd 4.84±0.11bc 5.27±0.33b 4.83±0.09bc 5.24±0.14b Glu 77.80±2.13b 136.00±5.87a 60.20±5.03c 57.5±3.73c 70.70±2.18b 60.50±2.44c 15.40±1.51d Ser 9.35±1.96b 14.50±1.07a 6.93±0.83b 7.25±1.01b 8.69±0.53b 7.63±0.72b 3.98±0.50c Gly 9.01±2.69a 8.30±1.53a 3.84±0.74b 4.21±1.82b 5.26±1.43b 4.49±0.93b 1.40±0.34c His 9.21±0.85c 31.50±4.75a 15.50±3.99b 15.0±4.28b 17.20±3.86b 18.00±4.04b 1.61±0.41d Arg 10.50±0.78b 14.40±1.21a 6.65±0.60c 7.25±0.73c 9.26±0.65b 7.84±0.33c 2.41±0.53d Thr 28.60±3.31c 71.30±8.50a 31.60±4.69b 33.6±4.28bc 37.60±5.75b 38.50±2.07b 2.95±0.42d Ala 8.61±2.15b 14.00±3.77a 6.70±1.09c 7.03±1.00c 8.43±2.23b 7.67±0.80c 2.21±0.13d Pro 168.00±9.98c 369.00±21.60a 286.00±17.50b 257.00±20.00b 280.00±16.20b 302.00±35.90b 6.76±1.96d Tyr 17.30±4.03b 30.20±6.22a 12.00±2.77b 13.7±1.09b 17.40±2.43b 15.00±4.11b 3.86±1.52c Val 19.70±5.51b 36.30±8.24a 17.70±3.90b 17.60±4.14b 20.60±2.99b 19.40±2.73b 4.22±1.86c Met 7.72±0.99b 14.40±5.87a 7.23±3.71b 7.03±2.02b 8.15±1.76b 7.86±2.75b 1.88±0.63c Cys 1.77±0.01c 5.30±1.77a 2.95±0.40b 2.83±0.58b 2.25±0.66bc 2.76±0.37b 0.19±0.00d Ile 20.70±5.57b 41.10±7.14a 20.80±3.86b 20.30±6.07 23.00±3.99b 22.60±5.50b 3.31±1.00c Leu 15.20±1.71c 63.10±8.22a 31.80±6.93b 30.80±7.04b 34.60±3.07b 34.30±4.73b 6.48±0.72d Phe 20.00±3.86b 42.10±5.19a 22.00±4.29b 20.60±3.33b 22.90±1.88b 23.40±2.00b 3.40±0.75c Lys 9.10±2.23a 0.85±0.14c 0.62±0.08c 0.58±0.13c 9.92±1.44a 0.58±0.00c 5.13±1.11b 总量 438.00±41.00c 901.00±92.20a 537.00±71.40b 507.00±49.50bc 581.00±62.30b 578.00±66.90b 70.50±21.80d 注:同行不同小写字母表示差异显著,P<0.05。 表 4 CPP中分子量分布(%)
Table 4 Molecular weight distribution in CPP(%)
物料编号 >10000 Da 5000~10000 Da 1000~5000 Da <1000 Da 1 2.70±0.02d 6.82±0.39d 55.40±0.14a 35.10±0.52b 2 10.80±0.23b 16.20±0.22a 42.40±0.28b 30.70±0.30c 3 0.15±0.00f 0.37±0.01f 12.10±0.21c 87.40±0.21a 4 1.60±0.02e 0.85±0.01e 14.80±0.32c 82.70±0.33a 5 6.89±0.15c 12.60±0.27b 44.50±0.03b 36.00±0.45b 6 7.12±0.00c 12.30±0.00b 43.80±0.40b 36.70±0.40b 7 66.80±0.17a 10.20±0.11c 9.60±0.25d 13.40±0.31d 表 5 CPP样品特性与持钙能力的相关性分析
Table 5 Correlation analysis of CPP sample characteristics and calcium-holding capacity
指标 丙氨酸 脯氨酸 酪氨酸 缬氨酸 甲硫氨酸 异亮氨酸 苯丙氨酸 赖氨酸 分子量
(>10 kDa)分子量
(0.5~10 kDa)分子量
(0.1~0.5 kDa)分子量
(<0.1 kDa)CPP含量 持钙能力(添加量0.05 g/L) 0.720 0.686 0.669 0.723 0.719 0.746 0.738 −0.136 −0.985** 0.010 0.517 0.494 0.746 持钙能力(添加量0.1 g/L) 0.747 0.704 0.7 0.748 0.743 0.768* 0.759* −0.14 −0.975** 0.025 0.543 0.461 0.733 持钙能力(添加量0.2 g/L) 0.743 0.703 0.694 0.744 0.74 0.766* 0.758* −0.159 −0.975** 0.017 0.538 0.467 0.743 注:*表示显著,P<0.05;**表示极显著,P<0.01。 -
[1] Park Y W, Nam M S. Bioactive peptides in milk and dairy products: A review[J]. Korean Journal for Food Science of Animal Resources,2015,35(6):831. doi: 10.5851/kosfa.2015.35.6.831
[2] 焦宇知. 酪蛋白磷酸肽新生产工艺及其功能性质研究[D]. 无锡: 江南大学, 2004. Jiao Yuzhi. Studies on novel production technologies for CPP and its functional properties[D]. Wuxi: Jiangnan University, 2004.
[3] 冯凤琴, 王璋, 许时婴. 生物活性物质酪蛋白磷酸肽的功能和应用[J]. 食品与发酵工业,1999(5):73‒76. [Feng Fengqin, Wang Zhang, Xu Shiyin. The function and application of biologically active substance casein phosphopeptide[J]. Food and Fermentation Industries,1999(5):73‒76. [4] Reeves R E, Latour N G. Calcium phosphate sequestering phosphopeptide from casein[J]. Science,1958,128(3322):472.
[5] Tsuchita H, Goto T, Yonehara Y, et al. Calcium and phosphorus availability from casein phosphopeptides in male growing rats[J]. Nutrition Research,1995,15(11):1657‒1667.
[6] Cruz-Huetra E, Garcia-Nebot M J, Miralles B, et al. Caseinophosphopeptides released after tryptic hydrolysis versus simulated gastrointestinal digestion of a casein-derived by-product[J]. Food Chemistry,2015,168:648‒655.
[7] Meng Q, Diao Q, Zhang Y, et al. Harm of calcium deficiency to preschool children and its supplemental methods[J]. Journal of Anshan Normal University,2013:2.
[8] Aslam M N, Varani J. The western-style diet, calcium deficiency and chronic disease[J]. Journal of Nutrition and Food Science,2016,6(496):2.
[9] Zhang W, Stoecklin E, Eggersdorfer M. A glimpse of vitamin D status in mainland China[J]. Nutrition,2013,29(7-8):953−957. doi: 10.1016/j.nut.2013.01.010
[10] Gonçalves F M C, Delbem A C B, Gomes L F, et al. Effect of fluoride, casein phosphopeptide-amorphous calcium phosphate and sodium trimetaphosphate combination treatment on the remineralization of caries lesions: An in vitro study[J]. Archives of Oral Biology,2021,122:105001. doi: 10.1016/j.archoralbio.2020.105001
[11] Philip N, Walsh L. The potential ecological effects of casein phosphopeptide-amorphous calcium phosphate in dental caries prevention[J]. Australian Dental Journal,2019,64(1):66−71. doi: 10.1111/adj.12661
[12] Liu G, Sun S, Guo B, et al. Bioactive peptide isolated from casein phosphopeptides promotes calcium uptake in vitro and in vivo[J]. Food & Function,2018,9(4):2251−2260.
[13] 高银, 宋振南, 方文兵. 酪蛋白磷酸肽(CPP)的研究进展[J]. 安徽农学通报,2007,13(16):47‒48. [Gao Yin, Song Zhennan, Fang Wenbing. Research progress of casein phosphopeptide(CPP)[J]. Anhui Agriculture Science Bulletin,2007,13(16):47‒48. [14] 李如兰, 王立克, 戴四发. 酪蛋白磷酸肽功能研究进展[J]. 家禽科学,2012(2):43−45. [Li Rulan, Wang Like, Dai Sifa. Research progress of function of casein phosphopeptide[J]. Poultry Science,2012(2):43−45. doi: 10.3969/j.issn.1673-1085.2012.02.017 [15] 徐曼. 酪蛋白磷酸肽的制备及其持钙能力的研究[D]. 武汉: 武汉轻工业学院, 2011. Xu Man. Preparation of casein phosphopeptides and studies on its calcium-holding ability[D]. Wuhan: Wuhan Institute of Light Industry, 2011.
[16] 李华, 郑杭娣, 陶妃妃. 不同检测方法测定婴幼儿配方奶粉中CPPs含量的比较研究[J]. 现代食品,2019(12):154−157. [Li Hua, Zheng Hangti, Tao Feifei. A comparative study on determination of CPPs in infant formula by different detection methods[J]. Modern Food,2019(12):154−157. [17] 中华人民共和国卫生部. GB/T 5009.5-2003 食品中蛋白质的测定[S]. 北京: 中国标准出版社, 2003. Ministry of Health of the PRC. GB/T 5009.5-2003 determination of protein in foods[S]. Beijing: China Standards Press, 2003.
[18] 苏婷婷. 低抗原性酪蛋白磷酸肽的制备及其功能的研究[D]. 呼和浩特: 内蒙古农业大学, 2014. Su Tingting. Stuides on production technologies for low antigenicity CPP and its functional properties[D]. Hohhot: Inner Mongolia Agriculture University, 2014.
[19] Yu M, Zeng M, Qin F, et al. Physicochemical and functional properties of protein extracts from Torreya grandis seeds[J]. Food Chemistry,2017,227:453−460. doi: 10.1016/j.foodchem.2017.01.114
[20] 田彦梅, 张园, 叶青, 等. 益生菌发酵羊乳中酪蛋白磷酸肽的持钙能力和结合铁能力的研究[J]. 食品与发酵科技,2019,55(4):18−22. [Tian Yanmei, Zhang Yuan, Ye Qing, et al. The calcium holding and iron binding capacity of casein phosphopeptides in fermented goat milk[J]. Food and Fermentation Sciences & Technology,2019,55(4):18−22. [21] 解冠华. 酶水解法制备水牛乳酪蛋白磷酸肽[D]. 南昌: 南昌大学, 2007. Xie Guanhua. Preparation of casein phosphopeptides derived from enzymatic hydrolysis of buffalo casein[D]. Nanchang: Nanchang university, 2007.
[22] 王青华. 瑞士乳杆菌乳制品中酪蛋白磷酸肽的研究[D]. 天津: 天津科技大学, 2007. Wang Qinghua. Investigation on casein phosphopeptides in Lactobacillus helveticus dairy products[D]. Tianjin: Tianjin University of Science and Technology, 2007.
[23] 郭宝颜, 刘果, 梁曹雯, 等. 两种酪蛋白磷酸肽混合物的钙结合能力及物化性质比较[J]. 现代食品科技,2020,36(9):96−100, 125. [Guo Baoyan, Liu Guo, Liang Caowen, et al. Calcium-binding ability and physicochemical properties of two casein phosphopeptide products[J]. Modern Food Science and Technology,2020,36(9):96−100, 125. [24] 穆闯录. 不同泌乳阶段牛羊乳及母乳中蛋白质和总氨基酸分析及评价[D]. 杨凌: 西北农林科技大学, 2017. Mu Chuanlu. Comparative analysis and evaluation of protein and total amino acids in different stages of milk goat and breast milk[D]. Yangling: Northwest Agriculture and Forestry University, 2017.
[25] 刑琛. 牛乳酪蛋白深度水解配方食品研究[D]. 武汉: 武汉轻工大学, 2019. Xing Chen. Study on deeply hydrolyzed formula food of cow cheese protein[D]. Wuhan: Wuhan University of Light Industry, 2019.
[26] 刘锋. 内蒙古不同地区牛乳中常规营养成分及氨基酸的比较研究[D]. 呼和浩特: 内蒙古农业大学, 2009. Liu Feng. The study of milk nutrient component and amino acid of dairy cows in the different areas of the Inner Mongolia[D]. Hohhot: Inner Mongolia Agriculture University, 2009.
[27] 丁琬莹. 酪蛋白磷酸肽的制备及其性质研究[D]. 哈尔滨: 哈尔滨商业大学, 2014. Ding Wanying. Study on the preparation and properties of casein phosphopeptide[D]. Harbin: Harbin University of Commerce, 2014.
[28] 张梦潇, 周文华, 莫华, 等. 不同品种紫薯粉鲜湿面条的品质特性及主成分分析[J]. 食品工业科技,2020,41(1):79−85. [Zhang Mengxiao, Zhou Wenhua, Mo Hua, et al. Quality characteristics and principal component analysis of fresh noodles with purple sweet potato flour of different varieties[J]. Science and Technology of Food Industry,2020,41(1):79−85. [29] Granato D, Santos J S, Escher G B, et al. Use of principal component analysis(PCA) and hierarchical cluster analysis(HCA) for multivariate association between bioactive compounds and functional properties in foods: A critical perspective[J]. Trends in Food Science & Technology,2018,72:83−90.
[30] Pérez-Rodríguez M, Dirchwolf P M, Rodríguez-Negrín Z, et al. Assessing mineral profiles for rice flour fraud detection by principal component analysis based data fusion[J]. Food Chemistry,2021,339:128125. doi: 10.1016/j.foodchem.2020.128125







 下载:
下载:




 下载:
下载:
