Research Progress of Polysaccharide - Based Hydrogel Carriers and Their Drying Method
-
摘要: 多糖基水凝胶可以用来保护、包封、运载药物或营养物质,提高药物或营养物质的稳定性。目前,已开发以壳聚糖、海藻酸盐、纤维素及其衍生物、果胶、淀粉等为原料的多糖基水凝胶,并取得了广泛应用。然而水凝胶珠自身水分含量高,面临难以贮存和运输等问题。近年来,为了提高水凝胶产品的稳定性、延长贮存时间、并减少运输成本,多糖基水凝胶的干燥技术逐渐成为研究热点。本文综述了不同多糖基水凝胶包封药物或营养物质的应用,并总结了不同干燥方式在多糖基水凝胶加工中的应用,为多糖基水凝胶的干燥技术应用提供理论支撑。Abstract: Polysaccharide based hydrogels can be used to protect, encapsulate and transport drugs or nutrients, and thus improve the stability of drugs or nutrients. At present, hydrogels had been developed based on chitosan, alginate, cellulose and its derivatives, pectin, starch and so on, and they had been widely used. However, it was difficult to store and transport the hydrogels due to its high moisture content. Recently, in order to improve the stability, extend the storage time and reduce the transportation cost of hydrogels, the drying technology of polysaccharide-based hydrogels had become a hot research topic. The applications of polysaccharide-based hydrogels encapsulating drugs or nutrients were summarized. The effect of drying processing on polysaccharide-based hydrogels application was concluded. This paper provides theoretical support for the drying technology application of polysaccharide-based hydrogels.
-
Keywords:
- carriers /
- polysaccharide /
- hydrogels /
- drying methods /
- applications
-
水凝胶是指能够吸收大量水并适当地溶胀和收缩以促进包载物释放的亲水性聚合物网络[1]。水凝胶的理化特性取决于制备水凝胶聚合物的种类、浓度、交联水平、温度、pH和盐浓度等因素[2]。水凝胶作为运载体系包埋营养物质或者药物具有诸多优势,如安全性高、可再生、生物相容性高、生物可降解、成本低等[3]。
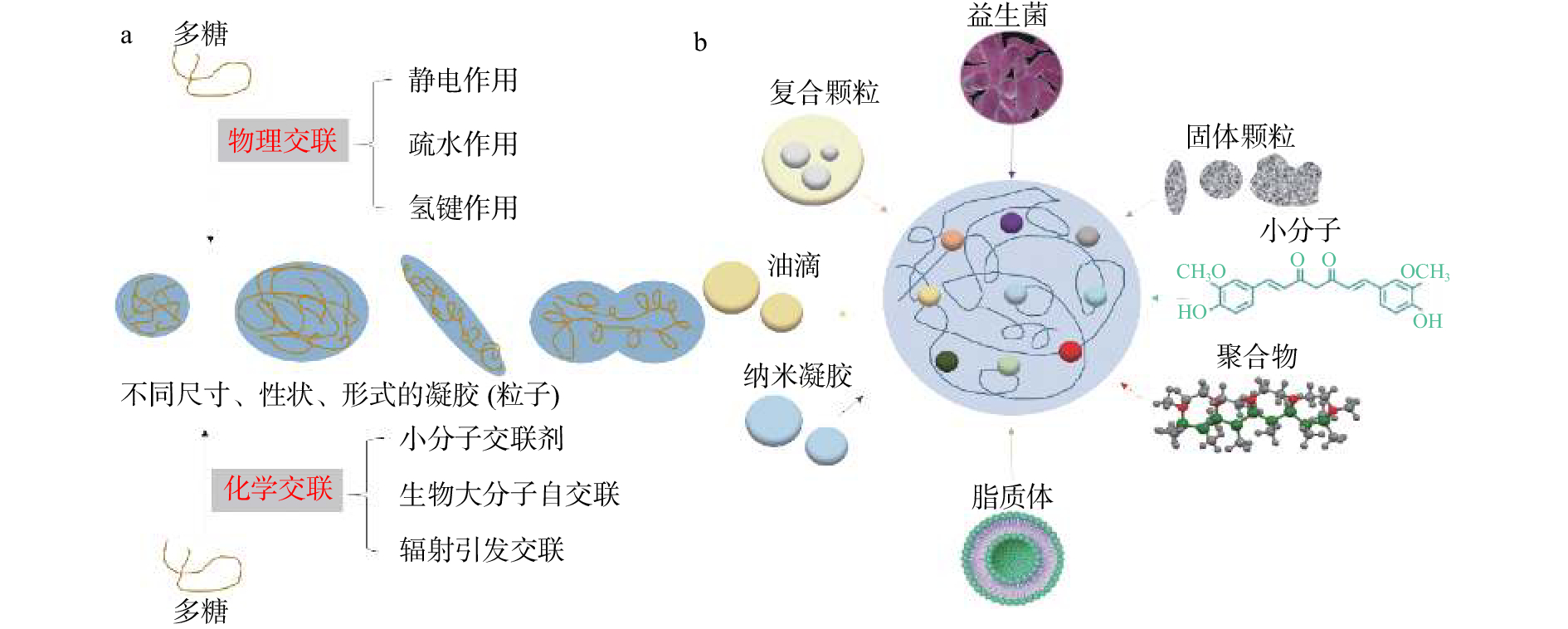
水凝胶按照来源可分为天然来源水凝胶和合成来源水凝胶。天然来源水凝胶可由多种不同类型的多糖、蛋白质、无机材料组成。其中天然多糖,如壳聚糖、海藻酸盐、纤维素及其衍生物等,相比于其他水凝胶载体材料(如蛋白质),具有粘膜粘附、抗微生物和抗炎等特性,且自身具有良好的生物活性[4]。多糖基水凝胶可通过适当的释放机制,如扩散、膨胀、化学因素或基于某些环境刺激的控制,使生物活性物质的局部浓度保持较长时间,达到药物或营养物质靶向控释的效果[4]。因此,多糖基水凝胶作为包封药物或营养物质的载体具有天然优势。多糖基水凝胶的制备及包封不同功能成分的方法,如图1所示[5]。图1a为制备多糖基水凝胶的方法,物理交联的方法包括静电作用、疏水作用、氢键作用,化学交联的方法包括小分子交联剂、生物大分子自交联、辐射引发交联等工艺制备水凝胶。图1b概括了水凝胶可以包封的物质种类,例如益生菌、颗粒、脂质滴、纳米凝胶等。
水凝胶存在水分含量高、难以贮存和运输等问题。为了提高产品的稳定性,延长贮存时间,减少运输成本,需要对水凝胶进行干燥。干燥可通过传热和传质从产品中去除水分,降低水分活度,从而延长产品的货架期,并减轻产品重量和缩小运输空间。目前用于水凝胶的干燥方法有真空冷冻干燥、超临界萃取干燥、真空干燥、热风干燥、流化床干燥等。干燥方法的选择取决于水凝胶特性、产品应用、经济性和生产效率等要求。采用合适的干燥方法对改善水凝胶品质和提高包封营养物质或药物保留率的效果具有重要意义[6-7]。目前,尚未有文献系统报道多糖基水凝胶种类及其干燥方式。
本文综述了近年来多糖基水凝胶在运载体系方面的应用以及不同干燥方式对其产生的影响,旨在为不同种类多糖基水凝胶选择合适的干燥方法提供理论依据。
1. 基于不同多糖的水凝胶载体
1.1 壳聚糖
壳聚糖是一种线性多糖,由随机分布的β-(1-4)连接的N-乙酰基-D-氨基葡萄糖残基和D-氨基葡萄糖残基组成。壳聚糖中氨基基团的酸度系数(pKa)约为6.5,这导致其在酸性水介质中质子化并使聚合物溶剂化[8]。当pH低于pKa时,壳聚糖能形成一层厚厚的膨胀层,在水凝胶释放内容物时起到缓释的作用[9]。壳聚糖是唯一的天然阳离子多糖,还具有无毒副作用、生物相容性好、生物降解性强、免疫原性低等优点[10-11]。由于其良好的理化性质和优良的安全性,壳聚糖被广泛应用于药物及营养物质的水凝胶载体中。
FENG等[12]利用壳聚糖和羧甲基壳聚糖之间的静电相互作用制备了载有盐酸阿霉素的纳米凝胶,由于载体的粘膜粘着性而提高盐酸阿霉素对大肠癌的治疗效率。OH等[13]制备了一种新型的pH响应壳聚糖纳米凝胶。由于3-二乙基氨基丙基的质子化作用,装载阿霉素的纳米凝胶在pH为6.8时比在正常pH为7.4时显示出更强的阿霉素释放效果。ZHENG等[14]以甲基丙烯酸甲酯和壳聚糖为单体,采用硫酸铵为引发剂,以氟尿嘧啶作为模板,通过自由基聚合制备接枝共聚凝胶,并在体外模拟结肠液实验药物的释放性能,结果发现其具有良好的结肠特异性药物传递行为。壳聚糖基水凝胶具有良好的生物相容性并且无毒可降解,具有很好的包载药物的能力。通过向壳聚糖水凝胶载体中引入一些环境敏感性基团或单元,可以使其具有环境敏感性,能够对温度、pH等刺激因子产生响应,从而有望提高药物释放的靶向性和可控性。
1.2 海藻酸盐
海藻酸盐是由β-D-甘露糖醛酸和α-L-古洛糖醛酸单元组成的阴离子多糖[15]。尽管海藻酸盐水凝胶生物降解缓慢,细胞粘附性弱、且力学性能较差,但海藻酸盐具有沿主链分布的多官能团,例如多羟基和羧基,可进行化学修饰优化其性质,例如酯化、硫酸化、氧化、酰胺化或接枝等[16-17]。
为了延长药物疗效并减少给药次数,YOON等[18]设计了一种负载生长激素的海藻酸盐纳米凝胶,研究结果显示,纳米凝胶中生长激素负载率为100%;体内药代动力学结果表明,在一次性注射人生长激素纳米凝胶后,两周内血液中的生长激素水平基本维持稳定;此外,海藻酸盐纳米凝胶可作为一种新型的抗原开发系统用于疫苗开发。XIANG等[19]将海藻酸钠和富血小板血浆共混,制备了一种新型的复合水凝胶,与单纯海藻酸钠基水凝胶相比,该复合水凝胶不仅在压缩机械强度方面有所提高,且体外细胞实验也表现出更好的相容性。海藻酸钠基水凝胶负载其它单体以改善水凝胶的机械性能可灵活运用于多种组织结构的缺损修复,海藻酸钠较为温和的成胶条件也保证其负载的敏感性药物、细胞或蛋白质等物质的活性。
1.3 纤维素及其衍生物
纤维素是地球上最丰富的有机聚合物,是大多数植物初级细胞壁的主要结构成分。纤维素是由β-1,4-糖苷连接的D-葡萄糖单元(脱水葡萄糖单元)组成的线性多糖,但由于其本身结构紧密,分子间存在氢键,不溶于大多数溶剂,导致无法很好地被利用。为此,通常需对其改性再制备水凝胶拓展应用范围。
SUBHAM等[20]制备了羧甲基纤维素钠/聚乙烯醇水凝胶微球,该微球的互穿聚合物网络结构使其具有很好地释放特性,可用于药物的口服控释。SUN等[21]制备了一种木质素和聚丙烯酸交联的多孔复合水凝胶,实现了杀虫剂的控制释放。多孔复合水凝胶与单纯聚丙烯酸水凝胶相比,比表面积更大,吸附能力更强,释放速度更缓慢,可以很好地实现农药的控制释放。以纤维素为原料直接合成水凝胶的难点是如何让纤维素溶解,以改性后纤维素为原料制备水凝胶,通过不同的条件控制可以合成出对环境条件敏感的纤维素基水凝胶,实现物质的控释。
1.4 果胶
果胶是一种由α-1,4-糖苷键连接D-半乳糖醛酸残基及多种中性糖组成天然复合杂多糖,属于无毒、生物可降解的聚合物。在一定的条件下,果胶可形成水不溶性网状结构凝胶,并作为固定生物活性物质的载体[22]。低甲氧基果胶可通过离子凝胶法和乳化技术与二价钙离子结合形成刚性凝胶珠并应用于包埋和微胶囊技术的研究中[23]。由于果胶的高度水溶性,当果胶被用作载体时极易发生溶胀、快速水合,导致包埋成分的提前释放,有时为了改善果胶的包埋性能,也常常在应用时会先对果胶进行化学、酶法和物理改性[24]。
通过离子凝胶法制备的果胶凝胶珠作为缓释药物输送系统,该系统可在温和条件下进行载药[25]。用乙酰化剂修饰的果胶制备水凝胶可以维持布洛芬释放10~12 h[26]。SOUZA等[27]分别制备了粒径在约为650~680 μm的低酯果胶酸钙微球和涂有壳聚糖(涂层厚度为5~15 μm)的低酯果胶酸钙凝胶球去包埋芒果苷,对凝胶珠进行乙酰化后去研究芒果苷在模拟胃肠液中的释放规律,结果发现,乙酰化程度高的果胶/壳聚糖凝胶珠对芒果苷的缓释更好,其能避免芒果苷在胃中的提前释放,这一研究也显示了果胶作为功能性成分包埋载体的潜在应用。
1.5 淀粉
淀粉是一种高分子碳水化合物,是由单一类型糖单元按一定排列规则组成的一种多糖高分子聚合物,其基本构成单元为α-D-吡喃葡萄糖[28],淀粉因其来源广、成本低、生物相容性好等优势,被广泛应用于食品和生物医药领域,运载食品活性因子或药物分子至靶向部位,提高食品活性因子稳定性或药物输送效率[29]。天然淀粉由于缺乏可电离基团,在水中溶解度小,吸附率较低,限制其作为优质载体的制备材料。
MENG等[30]用三偏磷酸钠交联改性淀粉制备了改性淀粉基水凝胶,制备的水凝胶具有良好的热稳定性和pH敏感性,姜黄素的包封率为80%。因此,淀粉基水凝胶是有潜力的物质传递系统。ZHAO等[31]利用交联后的氧化淀粉制作一系列具有不同电荷密度和交联密度的微凝胶,并利用这种可生物降解的微凝胶系统控制溶菌酶的摄取和释放。利用对淀粉改性的技术手段可以改进淀粉的理化特性,扩展淀粉基水凝胶应用范围。
1.6 葡聚糖
葡聚糖是一种可降解细菌多糖,来源丰富,作为一种生物材料具有良好的生物相容性,被广泛应用于药物辅料和生物分离中,其长链上的羟基极易进行修饰得到具有反应活性的葡聚糖衍生物,可通过不同方式进行交联形成水凝胶网络[32]。
ZHANG等[33]通过葡聚糖、牛血清白蛋白和紫杉醇制备出一种新型复合纳米凝胶,确定了最佳的载药量和包封效率,研究结果发现葡聚糖-牛血清白蛋白-紫杉醇纳米凝胶在体内具有良好的肿瘤靶向吸收效果、可控的药物释放和抗肿瘤能力。张慧等[34]以甲基丙烯酸缩水甘油酯修饰葡聚糖和丙烯酸为反应单体,聚合制备了具有pH敏感性的纳米凝胶,以红霉素为药物模型研究了其缓释作用:包裹率和载药率分别为90.7% 和1.06%;在无酶人工胃液中2 h纳米凝胶的药物累积释放率为7.0%,之后在无酶人工肠液中4 h内释放增加到37.0%,因此该凝胶可作为潜在的结肠靶向给药载体。
除了对小分子药物的负载缓释外,葡聚糖水凝胶还可缓释大分子药物。CHEN等[35]构建了一种新型的含甲基丙烯酰基葡聚糖与明胶的复合纳米粒子体系。该纳米粒子具有单分散尺寸分布,不仅具有良好的溶胀能力和降解性能,且无细胞毒性; 纳米粒子对骨形态发生蛋白的释放能持续12 d以上,且释放率超过90%。综合表明,此纳米粒子已具备作为生长因子传递载体的基本条件。
1.7 透明质酸
透明质酸是由D-葡萄糖醛酸及N-乙酰葡糖胺单元组成的多糖[36]。可以对透明质酸的多功能基团,如葡萄糖醛酸的羧酸、伯羟基和仲羟基以及N-乙酰基进行化学修饰,改变透明质酸的特性,包括其疏水性和生物活性。
WANG等[37]开发了透明质酸(HA)修饰的聚乙烯亚胺-聚(d, L-丙交酯-共-乙交酯)(PEI-PLGA)纳米颗粒系统用于靶向递送多柔比星(DOX)和miR-542-3p来治疗三阴性乳腺癌(TNBC)。该纳米颗粒可以有效防止miR-542-3p在血清中降解。HA/PEI-PLGA纳米颗粒具有在组合TNBC疗法中共同递送化学药物和肿瘤抑制性miRNA的潜力,可提高了MDA-MB-231细胞的药物摄取量。LIANG等[38]报道基于透明质酸-表没食子儿茶素没食子酸偶联物、线性聚乙烯亚胺和颗粒酶B开发的一种新型纳米凝胶,用于细胞内靶向递送颗粒酶B到癌细胞中。由于透明质酸可以与CD44、LYVE-1、RHAMM和HARE等受体以非特异性方式结合,因此透明质酸可以作为向细胞内递送抗癌药物的载体[39-40]。
1.8 其他多糖
瓜尔胶由β-(1-4)连接的D-甘露糖残基的线性主链和D-半乳糖侧链通过α-(1→4)-糖苷键连接至其他甘露糖单元组成的大分子多糖[41]。瓜尔胶在水合作用时可形成高粘性凝胶,能降低药物释放速率。包封物从瓜尔胶基质释放主要是通过穿过凝胶层的扩散或基质的侵蚀来控制的[42]。大量研究[43-45]报道使用瓜尔胶作为双氯芬酸钠透皮给药载体,制备瓜尔胶化学修饰的多壁碳纳米管杂化水凝胶和瓜尔胶纳米硅水凝胶缓释双氯芬酸钠,两种水凝胶均表明,由于瓜尔胶的高粘性,药物表现出缓慢和稳定的释放。
食用树胶是由α-1-3-连接的D-吡喃葡萄糖基和β-1-3-连接的D-吡喃葡萄糖基组成的一种水溶性细菌多糖[46]。QI等[46-48]研究了各种以食用树胶为基础的包载胰岛素的水凝胶。通过食用树胶和2-丙烯酰胺基-2-甲基-1-丙烷磺酸[47]或半包含索拉胶聚合物网络水凝胶并入了聚丙烯酰胺-共丙烯酸网络中。胰岛素的体外释放表明释放介质的pH尤其关键,在体外模拟胃部液24 h内释放的胰岛素量约为26.1%(w/w),而胰岛素在体外模拟肠道液中在6 h内释放的百分比大于50%(w/w),胰岛素的释放曲线可以通过复合水凝胶中的食用树胶含量控制,口服给药载有胰岛素的水凝胶对糖尿病大鼠的诱导作用与口服的胰岛素相比,血糖水平降低,且在药理学上的可利用性提高了10倍以上[46]。表1概括了不同多糖在水凝胶载体应用中的优缺点。
表 1 不同多糖在水凝胶载体应用中的优缺点Table 1. Advantages and disadvantages of different polysaccharides in the application of hydrogel carriers多糖 应用 优点 缺点 文献 壳聚糖 自组装纳米粒,核酸载体 无毒副作用、生物相容性好、生物降解性强和免疫原性低 几乎不溶于水和其他常见的有机溶剂 [49] 海藻酸盐 药物控释作用 生物相容性、低毒性和来源广 生物降解缓慢,细胞粘附性弱、
且力学性能较差[50] 纤维素 药物或基因载体 地球上最丰富的有机聚合物 不溶于大多数溶剂 [51] 果胶 结肠靶
向药物载体天然、无毒和来源广 高水溶性 [24] 淀粉 药物载体 来源广、成本低、生物相容性好 水中溶解度小,吸附率较低 [51] 葡聚糖 纳米载体 可降解细菌多糖,来源丰富 制备水凝胶条件较复杂 [32] 透明质酸 肿瘤靶向药物载体 可以与CD44、LYVE-1、RHAMM和HARE等受体以非特异性方式结合 疏水性 [52] 2. 不同干燥方法在多糖基水凝胶中的应用
干燥是食品加工不可缺少的技术之一,也是最耗能的操作单元之一[53]。干燥的目的是通过去除产品中的水分,以降低水分活度,从而抑制微生物生长,防止产品腐败变质[54-55]。干燥水凝胶提供了诸多益处,包括提高贮存稳定性,降低包装要求,减轻运输重量等。干燥水凝胶的品质,如孔隙率、机械强度、表面质地和尺寸等受干燥方法和工艺参数等条件影响[56]。表2为不同干燥方法在多糖基水凝胶中的应用与优缺点。
表 2 不同干燥方法在多糖基水凝胶中应用的优缺点Table 2. Advantages and disadvantages of different drying methods in polysaccharide based hydrogels干燥方法 优点 缺点 适用性 应用实例 真空冷冻干燥 低温,无氧的干燥环境 成本高、时间长 热敏性和易氧化的物质、可制备疏松多孔的水凝胶 RISBUD等[58]发现真空冷冻干燥水凝胶的释药性能优于热风干燥水凝胶,这可能与真空冷冻干燥后水凝胶的多孔性有关 超临界二氧化碳萃取干燥 低温,无氧的干燥环境 成本高、产量低 热敏性和易氧化的物质、可制备纳米多孔的水凝胶 BROWN等[64]发现超临界条件下干燥后水凝胶的结构保持良好,优于热风干燥。与真空冷冻干燥相比,超临界二氧化碳萃取干燥制得的产品结构更致密,具有更好的质构特性 流化床干燥 传热高、时间短 对被干燥物料颗粒度有一定要求 散粒状水凝胶,保持水凝胶形貌 ALBADRAN等[69]发现与真空冷冻干燥法相比,流化床干燥能有效缩短干燥时间,并提高益生菌存活率 真空干燥 无氧的干燥环境 热效率低、时间长 易氧化的物质 SAMPAIO等[71]发现真空干燥能有效提高水凝胶珠中番茄红素的稳定性,延长其贮存时间 热风干燥 处理量大 时间长,样品受热不均 非热敏性和非易氧化的物质 STOJA等[75]发现热风干燥水凝胶比超临界二氧化碳萃取干燥水凝胶有更高的百里酚负载能力 2.1 真空冷冻干燥
真空冷冻干燥是通过冷冻产品的升华来除去水分的过程[57]。真空冷冻干燥在低温和真空条件下完成干燥过程,可以有效减少水凝胶中热敏性和易氧化成分的降解,从而维持较好的品质。近年来,真空冷冻干燥在生产高品质和高价值产品方面具有广泛的应用研究。
RISBUD等[58]发现热风干燥和真空冷冻干燥后的壳聚糖交联水凝胶存在显著差异,在pH为1.0的条件下,真空冷冻干燥水凝胶在3 h内释放约73%的阿莫西林,热风干燥水凝胶释放33%,真空冷冻干燥水凝胶的释药性能优于热风干燥水凝胶,这可能与真空冷冻干燥后水凝胶的多孔性有关,真空冷冻干燥水凝胶孔径为(39.20±2.66)μm,因此,真空冷冻干燥可以作为在酸性环境中递送抗生素水凝胶的有效干燥方式。
然而真空冷冻干燥设备昂贵、能耗高、且干燥时间长,这极大地限制了真空冷冻干燥在实际生产中的应用[59-60]。因此,真空冷冻干燥主要用于包载高价值和热敏性药物的水凝胶干燥。另外,在没有赋形剂(如多糖)的情况下,药物在真空冷冻干燥中,由于冷冻条件不适,导致冰晶和冰水界面的形成、离子强度的变化、pH的变化等,可能造成物质降解、聚集、沉淀等问题[61-62]。
2.2 超临界二氧化碳萃取干燥
超临界二氧化碳萃取干燥的实质是萃取过程,在超临界二氧化碳萃取干燥过程中,水分是溶质,超临界二氧化碳是溶剂,超临界二氧化碳可以进入物料中,将水分携带出来,从而实现物料的干燥。超临界条件下二氧化碳的气液界面消失,不存在表面张力,因此水凝胶不存在因表面张力作用而导致的微观结构的改变;干燥过程中温度较低,且在有二氧化碳气体和黑暗环境下进行,因此超临界二氧化碳干燥对水凝胶中的营养成分具有很好的保护作用。迄今为止,超临界二氧化碳萃取干燥被广泛应用于生产无机气凝胶和有机气凝胶[63]。
BROWN等[64]研究超临界二氧化碳萃取干燥、空气干燥、真空冷冻干燥用于去除琼脂凝胶中的水分,结果发现超临界条件下干燥后水凝胶的结构保持良好,优于热风干燥。与真空冷冻干燥相比,超临界二氧化碳萃取干燥制得的产品结构更致密,具有更好的质构特性。CASSANELLI等[65]研究真空冷冻干燥、热风干燥和超临界二氧化碳萃取干燥结冷胶水凝胶,结果发现真空冷冻干燥水凝胶具有高度多孔结构;而热风干燥的水凝胶完全塌陷,形成的水凝胶缓慢并部分重新吸收水,干燥后样品的环境扫描电子显微镜图(图2);干燥后样品的收缩程度决定了样品的密度。真空冷冻干燥样品的密度最小,多孔性。热风干燥样品的密度最大,因为样品在干燥过程中坍塌。超临界二氧化碳干燥,产品收缩,但不塌陷,导致吸水速度比真空冷冻干燥水凝胶慢,但比热风干燥水凝胶快;真空冷冻干燥、热风干燥和超临界二氧化碳萃取干燥收缩率分别为(26.20%±1.69%)、(82.55%±0.12%)、(54.65%±1.00%)。超临界二氧化碳萃取干燥后的水凝胶具有高比表面积、大孔隙率,但产品松脆易碎、吸湿性强,同时设备造价高、能耗高、产量小。
2.3 流化床干燥
流化床干燥过程为物料被置于孔板上,并由其下部输送气体,引起物料颗粒在气体分布板上运动,在气流中呈悬浮状态,利用热能将湿物料中的水分气化除去,从而获得干物料的操作过程[66]。流化床干燥是颗粒状物料最常用的干燥方法[67]。流化床干燥过程中,气体与湿颗粒接触好、气体与颗粒间传热高、干燥速度快、产品质量优于传统热风对流干燥。
COOK等[68]对比分析了多种干燥方式(热风干燥、真空干燥、真空冷冻干燥、流化床干燥)对海藻酸钠-壳聚糖包封益生菌水凝胶珠理化特性和益生菌生存活力的影响;结果发现,真空冷冻干燥后产生大而脆的颗粒,而流化床干燥后产生更小、更硬的颗粒,且流化床干燥时间更短,见图3;选用流化床干燥后的水凝胶珠进行后续实验,发现益生菌在干水凝胶比在湿水凝胶中存活率更高。ALBADRAN等[69]研究负载益生菌的海藻酸钠-壳聚糖水凝胶经过真空冷冻干燥和流化床干燥后,在不同水分活度和温度下的稳定性,流化床干燥后水凝胶的益生菌存活率为(9.7±0.05)lg CFU/mL,真空冷冻干燥后为(9.3±0.05)lg CFU/mL,流化床比真空冷冻干燥得到的微粒的益生菌存活率高;因此,与真空冷冻干燥法相比,流化床干燥能有效缩短干燥时间,并提高益生菌存活率。
2.4 真空干燥
真空干燥法是利用低压下物料中的水分在较低的温度下沸腾而蒸发,使物料脱水干燥的一种加工方法[70]。真空干燥用于颜色、外观、营养和维生素含量变化敏感的原料中。近年来,该干燥方法因其独特的干燥性能而被广泛应用于含有高生物活性成分的原料中。
SAMPAIO等[71]研究真空干燥对水凝胶珠稳定性的影响。结果发现,湿珠在7 ℃下,干珠在7、10、25、40 ℃温度下贮藏8周后,湿珠中番茄红素保留率远低于真空干燥的水凝胶珠,贮藏8周后,湿珠中番茄红素在的保留率为20%左右。干珠中番茄红素在的保留率为80%左右,说明真空干燥能有效提高水凝胶珠中番茄红素的稳定性,延长其贮存时间。
2.5 热风干燥
热风干燥过程以热空气为干燥介质,通过强制对流循环方式使干燥介质和待干燥物料直接接触,与样品进行湿热交换,使物料表面的水分气化,达到去除水分的目的[72]。然而热风干燥的干燥时间长,温度高,易引起氧化,产生不良气味,破坏产品的微观结构等。热风干燥虽具有缺点,但由于热风干燥操作简单、成本低,通常与其他干燥方法结合使用,如远红外干燥、微波干燥等。许多研究报道,热风干燥和远红外干燥结合相比于单独的热风或远红外干燥,由于协同作用,可以获得更高的干燥速度和更好的产品质量[73]。
SANTAGAPITA等[74]研究干燥方法(真空冷冻干燥、真空干燥、热风干燥)和热处理对水凝胶中的酶稳定性及释放动力学的影响。结果发现,热风干燥与真空干燥条件真空冷冻干燥更加温和,真空干燥和热风干燥的水凝胶珠比真空冷冻干燥的水凝胶珠表现出更高的焓驰豫,提高水凝胶负载酶的稳定性。真空干燥水凝胶珠的酶释放率高于真空冷冻干燥水凝胶珠。真空干燥和热风干燥的水凝胶珠比真空冷冻干燥的水凝胶珠尺寸更小,孔隙更大,粗糙度更高。STOJA等[75]研究淀粉应用于负载百里酚,并可以通过筛选淀粉来源和优化制备条件来提高百里酚的负载率,结果发现热风干燥水凝胶比超临界二氧化碳萃取干燥水凝胶有更高的百里酚负载能力,玉米淀粉水凝胶比木薯淀粉水凝胶有更高的百里酚负载能力。在100 ℃条件下制备的热风干燥玉米淀粉干凝胶具有最大的负载能力,且可作为百里酚的载体应用于生物医学制药、化妆品、活性包装或保健品等领域。
3. 结语
本文综述了壳聚糖、海藻酸钠、纤维素、果胶、淀粉、葡聚糖等常用多糖在水凝胶方面的应用。天然多糖因具有不同的功能基团和特性,在用于开发具有可控特性水凝胶载体方面具有相当的发展潜力。为提高多糖基水凝胶贮存稳定性,综述了多种用于多糖基水凝胶加工过程中的干燥方法,不同干燥方法由于其自身特性不同,适用范围也不同,真空冷冻干燥优点为低温,无氧的干燥环境,适用于热敏性和易氧化的物质、可制备疏松多孔的水凝胶,缺点为成本高、时间长;超临界二氧化碳萃取干燥优点为低温,无氧的干燥环境,适用于热敏性和易氧化的物质、可制备纳米多孔的水凝胶,缺点为成本高、产量低;流化床干燥优点为传热高、时间短,适用于散粒状水凝胶,可保持水凝胶形貌,缺点为对被干燥物料颗粒度有一定要求;真空干燥优点为无氧的干燥环境,适用于易氧化的物质,缺点为热效率低、时间长;热风干燥优点为处理量大,适用于非热敏性和非易氧化的物质,缺点为时间长,样品受热不均。不同干燥方式适用于不同应用场景下的多糖基水凝胶,根据多糖基水凝胶的具体用途,选择合适的干燥方法。在今后的工作中,可以研究干燥过程中多糖基水凝胶性质的变化规律,得出干燥方法和工艺参数等条件如何影响干燥水凝胶的性质,如孔隙率、机械强度、表面质地和尺寸等,为获得干燥水凝胶提供合适的工艺参数及一定的理论基础。
-
表 1 不同多糖在水凝胶载体应用中的优缺点
Table 1 Advantages and disadvantages of different polysaccharides in the application of hydrogel carriers
多糖 应用 优点 缺点 文献 壳聚糖 自组装纳米粒,核酸载体 无毒副作用、生物相容性好、生物降解性强和免疫原性低 几乎不溶于水和其他常见的有机溶剂 [49] 海藻酸盐 药物控释作用 生物相容性、低毒性和来源广 生物降解缓慢,细胞粘附性弱、
且力学性能较差[50] 纤维素 药物或基因载体 地球上最丰富的有机聚合物 不溶于大多数溶剂 [51] 果胶 结肠靶
向药物载体天然、无毒和来源广 高水溶性 [24] 淀粉 药物载体 来源广、成本低、生物相容性好 水中溶解度小,吸附率较低 [51] 葡聚糖 纳米载体 可降解细菌多糖,来源丰富 制备水凝胶条件较复杂 [32] 透明质酸 肿瘤靶向药物载体 可以与CD44、LYVE-1、RHAMM和HARE等受体以非特异性方式结合 疏水性 [52] 表 2 不同干燥方法在多糖基水凝胶中应用的优缺点
Table 2 Advantages and disadvantages of different drying methods in polysaccharide based hydrogels
干燥方法 优点 缺点 适用性 应用实例 真空冷冻干燥 低温,无氧的干燥环境 成本高、时间长 热敏性和易氧化的物质、可制备疏松多孔的水凝胶 RISBUD等[58]发现真空冷冻干燥水凝胶的释药性能优于热风干燥水凝胶,这可能与真空冷冻干燥后水凝胶的多孔性有关 超临界二氧化碳萃取干燥 低温,无氧的干燥环境 成本高、产量低 热敏性和易氧化的物质、可制备纳米多孔的水凝胶 BROWN等[64]发现超临界条件下干燥后水凝胶的结构保持良好,优于热风干燥。与真空冷冻干燥相比,超临界二氧化碳萃取干燥制得的产品结构更致密,具有更好的质构特性 流化床干燥 传热高、时间短 对被干燥物料颗粒度有一定要求 散粒状水凝胶,保持水凝胶形貌 ALBADRAN等[69]发现与真空冷冻干燥法相比,流化床干燥能有效缩短干燥时间,并提高益生菌存活率 真空干燥 无氧的干燥环境 热效率低、时间长 易氧化的物质 SAMPAIO等[71]发现真空干燥能有效提高水凝胶珠中番茄红素的稳定性,延长其贮存时间 热风干燥 处理量大 时间长,样品受热不均 非热敏性和非易氧化的物质 STOJA等[75]发现热风干燥水凝胶比超临界二氧化碳萃取干燥水凝胶有更高的百里酚负载能力 -
[1] HOARET R, KOHANE D S. Hydrogels in drug delivery: Progress and challenges[J]. Polymer,2008,49(8):1993−2007.
[2] AHMED, ENAS M. Hydrogel: Preparation, characterization, and applications: A review[J]. Journal of Advanced Research,2015,6(2):105−121.
[3] RAAK N, ROHM H, JAROS D. Cross-linking with microbial transglutaminase: Isopeptide bonds and polymer size as drivers for acid casein gel stiffness[J]. International Dairy Journal,2016:49−55.
[4] SALARA A R, JAFARI S M, TONG Q, et al. Drug nanodelivery systems based on natural polysaccharides against different diseases[J]. Advances in Colloid and Interface Science,2020:102251.
[5] CAO Y, MEZZENGA R. Design principles of food gels[J]. Nature Food,2020,1(2):106−118.
[6] DHEER D, ARORA D, JAGLAN S, et al. Polysaccharides based nanomaterials for targeted anti-cancer drug delivery[J]. Journal of Drug Targeting,2017,25(1):1−16.
[7] ZHANG L, PAN J, DONG S, et al. The application of polysaccharide-based nanogels in peptides/proteins and anticancer drugs delivery[J]. Journal of Drug Targeting,2017,25(8):673−684.
[8] SZYMAŃSKA E, KATARZYNA W. Stability of Chitosan—A challenge for pharmaceutical and biomedical applications[J]. Marine Drugs,2015,13(4):1819−1846.
[9] HUANBUTTA K, CHEEWATANAKORNKOOL K, TERADAK, et al. Impact of salt form and molecular weight of chitosan on swelling and drug release from chitosan matrix tablets[J]. Carbohydrate Polymers,2013,97(1):26−33.
[10] KIM I Y, SEO S J, MOON H S, et al. Chitosan and its derivatives for tissue engineering applications[J]. Biotechnology Advances,2008,26(1):1−21.
[11] LAYEK B, LIPP L, SINGH J. APC targeted micelle for enhanced intradermal delivery of hepatitis B DNA vaccine[J]. Journal of Controlled Release,2015,207:143−153.
[12] FENG C, LI J, KONG M, et al. Surface charge effect on mucoadhesion of chitosan based nanogels for local anti-colorectal cancer drug delivery[J]. Colloids and Surfaces B-Biointerfaces,2015,128:439−447.
[13] OH N M, OH K T, BAIK H J, et al. A self-organized 3-diethylaminopropyl-bearing glycol chitosan nanogel for tumor acidic pH targeting: In vitro evaluation[J]. Colloids and Surfaces B-Biointerfaces,2010,78(1):120−126.
[14] ZHENG X F, LIAN Q, YANG H, et al. Surface molecularly imprinted polymer of chitosan grafted poly(methyl methacrylate) for 5-fluorouracil and controlled release[J]. Scientific Reports,2016,6:21409.
[15] D'AYALA G G, MALINCONICO M, LAURIENZO P. Marine derived polysaccharides for biomedical applications: Chemical modification approaches[J]. Molecules,2008,13(9):2069−2106.
[16] LEONARD M, BOISSESON M R D, Hubert P, et al. Hydrophobically modified alginate hydrogels as protein carriers with specific controlled release properties[J]. Journal of Controlled Release,2004,98(3):395−405.
[17] FRÉDÉRIC V, CHRISTOPHE M, DURAND A, et al. Synthesis and rheological properties of hydrogels based on amphiphilic alginate-amide derivatives[J]. Carbohydrate Research,2009,344(2):223−228.
[18] YOON D Y, KIM J C. In vivo residence duration of human growth hormone loaded in nanogels comprising cinnamoyl alginate, cinnamoyl Pluronic F127 and cinnamoyl poly(ethylene glycol)[J]. International Journal of Pharmaceutics,2016,509(1−2):229−236.
[19] GAO X, GAO L, GROTH T, et al. Fabrication and properties of an injectable sodium alginate/PRP composite hydrogel as a potential cell carrier for cartilage repair[J]. Journal of Biomedical Materials Research Part A,2019(11):2076−2087.
[20] BANERJEE S, SIDDIQUI L, BHATTACHARYA S S, et al. Interpenetrating polymer network (IPN) hydrogel microspheres for oral controlled releaseapplication[J]. International Journal of Biological Macromolecules,2012,50(1):198−206.
[21] SUN Y, MA Y, FANG G, et al. Controlled pesticide release from porous composite hydrogels based on lignin and polyacrylic acid[J]. BioResources,2016,11(1):2361−2371.
[22] GAWKOWSKA D, CYBULSKA J, ZDUNEK A. Structure-related gelling of pectins and linking with other natural compounds: A review[J]. Polymers,2018,10(7):762.
[23] BRACCINI I, PEREZ S. Molecular basis of Ca2+-induced gelation in alginates and pectins: The egg-box model revisited[J]. Biomacromolecules,2001,2(4):1089−1096.
[24] KUPCHIK L A, KARTEL' N T, BOGDANOV E S, et al. Chemical modification of pectin to improve its sorption properties[J]. Russian Journal of Applied Chemistry,2006,79(3):457−460.
[25] DAFE A, ETEMADI H, DILMAGHANI A, et al. Investigation of pectin/starch hydrogel as a carrier for oral delivery of probiotic bacteria[J]. International Journal of Biological Macromolecules,2017,97:536−543.
[26] BHATIA M S. Chemical modification of pectins, characterization and evaluation for drug delivery[J]. Scientia Pharmaceutica,2008,76(4):775−784.
[27] SOUZA J R R D, CARVALHO J I X D, TREVISAN M T S, et al. Chitosancoatedpectin beads: Characterization and in vitro release ofmangiferin[J]. Food Hydrocolloids,2009,23(8):2278−2286.
[28] MASINA N, CHOONARA Y E, KUMARP, et al. A review of the chemical modification techniques of starch[J]. Carbohydrate Polymers,2017,57(12):2691.
[29] HALAL S, COLUSSI R, PINTO V Z, et al. Structure, morphology and functionality of acetylated and oxidised barleystarches[J]. Food Chemistry,2015,168:247−256.
[30] MENG R, WU Z, XIE H, et al. Preparation, characterization, and encapsulation capability of the hydrogel cross-linked by esterified tapioca starch[J]. International Journal of Biological Macromolecules,2020,155:1−5.
[31] ZHAO L, CHEN Y, LI W, et al. Controlled uptake and releaseof lysozyme from glycerol diglycidyl ether cross-linked oxidizedstarch microgel[J]. Carbohydrate Polymers,2015,121:276−283.
[32] NAGAHAMA K, SANO Y, KUMANO T. Anticancer drug-based multifunctional nanogels through self-assembly of dextran-curcumin conjugates toward cancer theranostics[J]. Bioorganic & Medicinal Chemistry Letters,2015,25(12):2519−2522.
[33] ZHANG X, ZHANG R, HUANG J, et al. Albumin enhances PTX delivery ability of dextran NPs and therapeutic efficacy of PTX for colorectal cancer[J]. Journal of Materials Chemistry B,2019,7(22):3537−3545.
[34] 张慧, 吴红, 范黎, 等. 酸敏性葡聚糖纳米凝胶的制备与释药性质考察[J]. 医药导报,2008,27(8):967−970. [ZHANG H, WU H, FAN L, et al. Preparation and drug release characteristics of the pH-sensitive dextran hydrogel nanoparticles[J]. Herald of Medicine,2008,27(8):967−970. [35] CHEN F, MA Z, DONG G, et al. Composite glycidyl methacrylated dextran ( Dex-GMA) /gelatin nanoparticles for localized propein delivery[J]. Acta Pharmacologica Sinica,2009,30(4):485−493.
[36] PRESTWICH G D. Hyaluronic acid-based clinical biomaterials derived for cell and molecule delivery in regenerative medicine[J]. Journal of Controlled Release,2011,155(2):193−199.
[37] WANG S, ZHANG J, WANG Y, et al. Hyaluronic acid-coated PEI-PLGA nanoparticles mediated co-delivery of doxorubicin and miR-542-3p for triple negative breast cancer therapy[J]. Nanomedicine:Nanotechnology, Biology and Medicine,2016,12(2):411−420.
[38] LIANG K, NG S, LEE F, et al. Targeted intracellular protein delivery based on hyaluronic acid-green tea catechin nanogels[J]. Acta Biomaterialia,2016,33:142−152.
[39] WEI X, SENANAYAKE T H, WARREN G, et al. Hyaluronic acid-based nanogel-drug conjugates with enhanced anticancer activity designed for the targeting of CD44-positive and drug-resistant tumors[J]. Bioconjugate Chemistry,2013,24(4):658−668.
[40] YAO H, ZHANG Y, SUN L, et al. The effect of hyaluronic acid functionalized carbon nanotubes loaded with salinomycin on gastric cancer stem cells[J]. Biomaterials,2014,35(33):9208−9223.
[41] BAINES D, SEAL R. Natural food additives, ingredients and flavourings[M]. Cambridge: Woodhead, 2012: 175−196.
[42] GEORGE A, SHAH P A, SHRIVASTAV P S. Guar gum: Versatile natural polymer for drug delivery applications[J]. European Polymer Journal,2019,112:722−735.
[43] GIRI A, BHOWMICK M, PAL S, et al. Polymer hydrogel from carboxymethyl guar gum and carbon nanotube for sustained trans-dermal release of diclofenac sodium[J]. International Journal of Biological Macromolecules,2011,49(5):885−893.
[44] GIRI A, BHUNIA T, MISHRA S R, et al. Acrylic acid grafted guargum-nanosilica membranes for transdermal diclofenac delivery[J]. Carbohydrate Polymers,2013,91(2):492−501.
[45] GIRI A, BHUNIA T, PAL A, et al. In-situ synthesis of polyacrylate grafted carboxymethyl guargum-carbon nanotube membranes for potential application in controlled drug delivery[J]. European Polymer Journal,2016,74:13−25.
[46] QI X, YUAN Y, ZHANG J, et al. Oral administration of Salecan-Based hydrogels for controlled insulin delivery[J]. Journal of Agricultural and Food Chemistry,2018,66(40):10479−10489.
[47] QI X, WEI W, LI J, et al. Salecan-based pH-sensitive hydrogels for insulin delivery[J]. Molecular Pharmaceutics,2017,14(2):431−440.
[48] QI X, WEI W, WEI D, et al. Salecan polysaccharide-based hydrogels and their applications: A review[J]. Journal of Materials Chemistry B,2019,7(16):2577−2587.
[49] KUMAR D R, KUMAR P S, GANDHI M R, et al. Delivery of chitosan/dsRNA nanoparticles for silencing of wing development vestigial (vg) gene in Aedes aegypti mosquitoes[J]. International Journal of Biological Macromolecules,2016,86:89−95.
[50] BLANDON L M, ISLAN G A, CASTRO G R, et al. Kefiran-alginate gel microspheres for oral delivery of ciprofloxacin[J]. Colloids Surfrace B:Biointerfaces,2016,145:706−715.
[51] LU D, XIAO C, XU S J. Starch-based completely biodegradable polymer materials[J]. Express Polymer Letters,2009,3(6):366−375.
[52] JIA X, HAN Y, PEI M, et al. Multi-functionalized hyaluronic acid nanogels crosslinked with carbon dots as dual receptor-mediated targeting tumor theranostics[J]. Carbohydrate Polymers,2016,152:391−397.
[53] SAGAR V R, KUMAR S P. Recent advances in drying and dehydration of fruits and vegetables: A review[J]. Journal of Food Science and Technology-Mysore,2010,47(1):15−26.
[54] AKPINAR E K. Mathematical modelling of thin layer drying process under open sun of some aromatic plants[J]. Journal of Food Engineering,2006,77(4):864−870.
[55] HASHIM N, DANIELO, RAHAMAN E. A preliminary study: Kinetic model of drying process of pumpkins (Cucurbita moschata) in a convective hot air dryer[C]// Chin N L, Man H C, Talib R A, editor, 2nd International Conference on Agricultural and Food Engineering, Kuala Lumpur, Malaysia 2014: 345−352.
[56] HEGEDUS A, KLÁRAPH. Comparison of the effects of different drying techniques on properties of granules and tablets made on a production scale[J]. International Journal of Pharmaceutics,2007,330(1-2):99−104.
[57] TANGX, PIKAL M J. Design of freeze-drying processes for pharmaceuticals: Practical advice[J]. Pharmaceutical Research,2004,21(2):191−200.
[58] RISBUD M V, HARDIKAR A A, BHAT S V, et al. pH-sensitive freeze-dried chitosan-polyvinyl pyrrolidone hydrogels as controlled release system for antibiotic delivery[J]. Journal of Controlled Release,2000,68(1):23−30.
[59] GAN K H, BRUTTINI R, CROSSER O K, et al. Freeze-drying of pharmaceuticals in vials on trays: Effects of drying chamber wall temperature and tray side on lyophilization performance[J]. International Journal of Heat and Mass Transfer,2005,48(9):1675−1687.
[60] RATTI C. Hot air and freeze-drying of high-value foods: A review[J]. Journal of Food Engineering,2001,49(4):311−319.
[61] WANG W. Lyophilization and development of solid protein pharmaceuticals[J]. International Journal of Pharmaceutics,2000,203(1):1−60.
[62] TABORSKY G. Protein alterations at low temperatures: An overview[M]. Proteins at Low Temperatures: American Chemical Society, 1979: 1−26.
[63] ESTELLA J, ECHEVERRIAJ C, LAGUNA M, et al. Effects of aging and drying conditions on the structural and textural properties of silica gels[J]. Microporous and Mesoporous Materials,2007,102(1-3):274−282.
[64] BROWN Z K, FRYER P J, NORTON I T, et al. Drying of agar gels using supercritical carbon dioxide[J]. The Journal of Supercritical Fluids,2010,54(1):89−95.
[65] CASSANELLIM, PROSAPIO V, NORTON I, et al. Role of the drying technique on the low-Acyl gellan gum gel structure: Molecular and macroscopic investigations[J]. Springer Open Choice,2019,12(2):313−324.
[66] WANG Z, CHEN G. Heat and mass transfer in batch fluidized-bed drying of porous particles[J]. Chemical Engineering Science,2000,55(10):1857−1869.
[67] SRINIVASAKANNAN C, SHOAIBI A A, BALASUBRAMANIAN N. Continuous fluidized bed drying with and without internals: Kinetic model[J]. Chemical and Biochemical Engineering Quarterly,2012,26(2):97−104.
[68] COOK M T, TZORTZIS G, Charalampopoulos D, et al. Production and evaluation of dry alginate-chitosan microcapsules as an enteric delivery vehicle for probiotic bacteria[J]. Biomacromolecules,2011,12(7):2834−40.
[69] ALBADRAN H A, CHATZIFRAGKOU A, KHUTORYANSKIY V V, et al. Stability of probiotic Lactobacillus plantarum in dry microcapsules under accelerated storage conditions[J]. Food Research International,2015,74(Aug.):208−216.
[70] BROECKX G, VANDENHEUVEL D, CLAES I J J, et al. Drying techniques of probiotic bacteria as an important step towards the development of novel pharmabiotics[J]. International Journal of Pharmaceutics,2016,505(1-2):303−318.
[71] SAMPAIO G L A, PACHECO S, RIBEIRO A P O, et al. Encapsulation of a lycopene-rich watermelon concentrate in alginate and pectin beads: Characterization and stability[J]. Lwt-Food Science and Technology,2019:116.
[72] AN K, ZHAO D, WANG Z, et al. Comparison of different drying methods on Chinese ginger (Zingiber officinale Roscoe): Changes in volatiles, chemical profile, antioxidant properties, and microstructure[J]. Food Chemistry,2016,197:1292−1300.
[73] LUIS P, KONG A, ANTONIO V, ANTONIO V, et al. Combined infrared-convective drying of murta (Ugni molinae Turcz) berries: Kinetic modeling and quality assessment[J]. Drying Technology,2013,31(3):329−338.
[74] SANTAGAPITA P R, MAZZOBRE M F, BUERA M P. Formulation and drying of alginate beads for controlled release and stabilization of invertase[J]. Biomacromolecules,2011,12(9):3147−55.
[75] STOJA M, IVONA J C, JASNA I, et al. Effect of starch xero- and aerogels preparation on the supercritical CO2 impregnation of thymol[J]. Starch - Stä rke,2015,67(1-2):174−182.





 下载:
下载:


 下载:
下载:
